 |
 |
| J Korean Ophthalmol Soc > Volume 64(12); 2023 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļ╣äņåīņäĖĒżĒÅÉņĢö ĒÖśņ×ÉņŚÉņä£ ļ®┤ņŚŁņÜöļ▓Ģ(ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö)ņØä ņé¼ņÜ®ĒĢ£ Ēøä ļ░£ņāØĒĢ£ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻ░Ć-ĒĢśļØ╝ļŗż ņ£Āņé¼ ņ”ØĒøäĻĄ░ 1ņśłļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņ”ØļĪĆņÜöņĢĮ
64ņäĖ ņŚ¼ņ×ÉĻ░Ć ņ¢æņĢłņØś ņŗ£ļĀźņĀĆĒĢśļź╝ ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ĒÖśņ×ÉļŖö ļ╣äņåīņäĖĒżĒÅÉņĢöņ£╝ļĪ£ ĒśĖĒØĪĻĖ░ļé┤Ļ│╝ņŚÉņä£ ļ®┤ņŚŁĒĢŁņĢöņĀ£(ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö)ļź╝ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ņŚłļŗż. ņĢłņĀĆĻ▓Ćņé¼ņÖĆ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņ¢æņĢłņŚÉ ļŗżļ░£ņä▒ ļ¦Øļ¦ēļé┤ņĢĪ ļ░Å ļ¦Øļ¦ēĒĢśņĢĪņØ┤ ļéśĒāĆļé¼ļŗż. ņ¢æņĢł ļ¬©ļæÉ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æ ņ¦äļŗ© ĒĢśņŚÉ ĒśĢĻ┤æņĢłņĀĆĒśłĻ┤ĆņĪ░ņśüņłĀ ļ░Å ņØĖļÅäņŗ£ņĢäļŗīĻĘĖļ”░ĒśłĻ┤ĆņĪ░ņśüņłĀ Ēøä 2ņŻ╝Ļ░ä Ļ▓ĮĻĄ¼ņÜ® ĒöäļĀłļō£ļŗłņåöļĪĀ 40 mg/dayļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż. 2ņŻ╝ Ēøä ņÖĖļל ļé┤ņøÉ ņŗ£ ņ”ØņāüņØ┤ ĒśĖņĀäļÉśņŚłĻ│Ā ņĢłņĀĆĻ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ļŗżļ░£ņä▒ ļ¦Øļ¦ēļé┤ņĢĪ ļ░Å ļ¦Øļ¦ēĒĢśņĢĪņØś Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż. ņØ┤Ēøä Ļ▓ĮĻĄ¼ņÜ® ĒöäļĀłļō£ļŗłņåöļĪĀņØä 20 mg/day 2ņŻ╝ļĪ£ ņżäņśĆļŗż. 2ņŻ╝ Ēøä ņÖĖļל ļé┤ņøÉ ņŗ£ ņ”ØņāüņØ┤ ĒśĖņĀäļÉśņŚłĻ│Ā ņĢłņĀĆĻ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ļŗżļ░£ņä▒ ļ¦Øļ¦ēļé┤ņĢĪĻ│╝ ļ¦Øļ¦ēĒĢśņĢĪņØ┤ ņåīņŗżļÉśņŚłņ£╝ļ®░ ņÜ░ņĢł ĒÖ®ļ░ś ļČĆĻĘ╝ņŚÉ ņåīļ¤ēņØś ļ¦Øļ¦ēĒĢśņĢĪļ¦ī ļé©ņĢä ņ׳ņŚłļŗż.
ABSTRACT
Purpose
To report a case of Vogt-Koyanagi-Harada-like syndrome that occurred during immunotherapy (pembrolizumab) in a patient with non-small-cell lung cancer (NSCLC).
Case summary
A 64-year-old female visited our clinic complaining of decreased visual acuity in both eyes. The patient had NSCLC and had been prescribed immunotherapy (pembrolizumab) by the Department of Pulmonology. Fundus examination and optical coherence tomography revealed multiple intraretinal cysts and subretinal fluid in both eyes. After evaluation using fluorescein and indocyanine green angiography, Vogt-Koyanagi-Harada (VKH) disease was diagnosed in both eyes and oral prednisolone 40 mg/day was prescribed for 2 weeks. At an outpatient visit at that time, the symptoms had improved, and fundus examination and optical coherence tomography revealed decreases in the number of intraretinal cysts and the subretinal fluid level. Oral prednisolone was reduced to 20 mg/day for 2 weeks. At an outpatient visit at that time, the symptoms had further improved; no cysts or subretinal fluid were apparent on fundus examination or optical coherence tomography, and only a small amount of subretinal fluid was present near the macula of the right eye.
ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö(pembrolizumab)ņØĆ ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£(immune checkpoint inhibitors)ņØś ĒĢ£ ņóģļźśļĪ£ ņ¦äĒ¢ēļÉ£ ļ╣äņåīņäĖĒżĒÅÉņĢö ļ░Å ĒØæņāēņóģņŚÉņä£ ĒĢŁņóģņ¢æ ĒÖ£ņä▒ņØä Ļ░¢ļŖö ļŗ©Ēü┤ļĪĀņä▒ IgG ĒĢŁņ▓┤ņØ┤ļŗż. ļŗ©Ēü┤ļĪĀņä▒ ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░G (immunoglobuin G, IgG) ĒĢŁņ▓┤ļŖö TņäĖĒżļź╝ ĒÖ£ņä▒ĒÖöĒĢśĻ│Ā ĒĢŁņóģņ¢æ ļ®┤ņŚŁļ░śņØæņØä Ļ░ĢĒÖöĒĢśļŖö ņäĖĒżļÅģņä▒ TņäĖĒżņØś programmed death-1 (PD-1) ņłśņÜ®ņ▓┤ļź╝ ņ░©ļŗ©ĒĢ£ļŗż.1,2 ĒĢśņ¦Ćļ¦ī ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£ņØś ļČĆņ×æņÜ®ņ£╝ļĪ£ ļ®┤ņŚŁ Ļ┤ĆļĀ© ņØ┤ņāüļ░śņØæņØ┤ ņĀäņŗĀ ņ¢┤ļööņŚÉļéś ļéśĒāĆļéĀ ņłś ņ׳ļŖöļŹ░ ņØ┤ļŖö ņ×ÉĻ░Ćļ®┤ņŚŁņ▓┤Ļ│ä ĒÖ£ņä▒ĒÖöņÖĆ Ļ┤ĆļĀ©ļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ņŚ╝ņ”Ø ļ░śņØæņ£╝ļĪ£ņä£ ĒÖśņ×ÉņØś 70-80%ņŚÉņä£ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ļŗż.3
ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æ(Vogt-Koyanagi-Harada disease)ņØĆ ļłłļ┐Éļ¦ī ņĢäļŗłļØ╝ ĻĘĆ, ņżæņČöņŗĀĻ▓ĮĻ│ä, Ēö╝ļČĆ ļ®£ļØ╝ļŗīņäĖĒżņØś ņØ┤ņāüņ£╝ļĪ£ ļæÉĒåĄ, ņŗ£ļĀź ļ░Å ņ▓ŁļĀźņāüņŗż, ļ░▒ļ░śņ”Ø, ņåīņĢäļ¦łļ╣äņÖĆ Ļ░ÖņØĆ ņ”ØņāüņØä ļÅÖļ░śĒĢĀ ņłś ņ׳ļŖö ņ¢æņĖĪņä▒ ņ×ÉĻ░Ćļ®┤ņŚŁ ļ»Ėļ¦īņä▒ ņ£ĪņĢäņóģņä▒ ĒżļÅäļ¦ēņŚ╝ņØ┤ļŗż.4 ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£ ņé¼ņÜ®Ļ│╝ ņŚ░Ļ┤ĆļÉ£ ĒżļÅäļ¦ēņŚ╝ņØś ļ░£ņāØļźĀņØĆ 0.3%ņŚÉņä£ 6% ņé¼ņØ┤ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░,5 ņØ┤ ņżæ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æ ņ”ØļĪĆļŖö ļō£ļ¼╝Ļ▓ī ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż. 2015ļģä ņØ┤ĒĢäļ”¼ļ¼┤ļ¦Ö(ipilimumab) ļ®┤ņŚŁņÜöļ▓ĢņØä ļ░øņØĆ ĒØæņāēņóģ ĒÖśņ×ÉņŚÉņä£ ņĢĮļ¼╝ ņ£Āļ░£ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æ ņé¼ļĪĆĻ░Ć ņ▓śņØī ļ│┤Ļ│ĀļÉśņŚłĻ│Ā,6 ņĄ£ĻĘ╝ņŚÉļŖö ļŗłļ│╝ļŻ©ļ¦Ö(nivolumab) ļ░Å ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ļśÉļŖö ļ│æĒĢ®ņÜöļ▓Ģ ņ╣śļŻī Ēøä ņ£Āļ░£ļÉ£ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗż ņ£Āņé¼ņ”ØĒøäĻĄ░ ņé¼ļĪĆļōżņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż.7,8 ņÖĖĻĄŁņŚÉļŖö ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ņé¼ņÜ® ņ┤łĻĖ░ņŚÉ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØ┤ ļ░£ņāØĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ņ£╝ļéś, ĻĄŁļé┤ņŚÉņä£ļŖö ņĢäņ¦ü ļ│┤Ļ│Ā ņé¼ļĪĆĻ░Ć ņŚåļŗż.8 ņØ┤ņŚÉ, ņĀĆņ×ÉļŖö ļ╣äņåīņäĖĒżĒÅÉņĢö ĒÖśņ×ÉņŚÉņä£ ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ņé¼ņÜ® ņżæĻĖ░ņŚÉ ņ£Āļ░£ļÉ£ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗż ņ£Āņé¼ ņ”ØĒøäĻĄ░ 1ņśłļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
2022ļģä 3ņøöņŚÉ 3ņØ╝ ņĀäļČĆĒä░ ņŗ£ņ×æļÉ£ ņ¢æņĢłņØś ņŗ£ļĀźņĀĆĒĢśļź╝ ņŻ╝ņåīļĪ£ 64ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉĻ░Ć ļé┤ņøÉĒĢśņśĆļŗż. ĒÖśņ×ÉļŖö 2020ļģä 12ņøöļČĆĒä░ ĒśĖĒØĪĻĖ░ļé┤Ļ│╝ ļ░Å ņŗĀĻ▓ĮņÖĖĻ│╝ņŚÉņä£ ļŗżļ░£ņä▒ ļćīņĀäņØ┤ļź╝ ļÅÖļ░śĒĢ£ ļ╣äņåīņäĖĒżĒÅÉņĢö(ņäĀņĢöņóģ, cT1bN3M1c, stage IVB)ļĪ£ ņ╣śļŻīļź╝ ļ░øĻ│Ā ņ׳ņŚłļŗż. ĒśĖĒØĪĻĖ░ļé┤Ļ│╝ņŚÉņä£ļŖö 2021ļģä 1ņøöļČĆĒä░ ĒÄśļ®öĒŖĖļĀēņŗ£ļō£(pemetrexid), ņŗ£ņŖżĒöīļØ╝Ēŗ┤(cisplatin) ļ│æĒĢ®ņÜöļ▓Ģ 4ņŻ╝ĻĖ░, 2021ļģä 4ņøöļČĆĒä░ ĒÄśļ®öĒŖĖļĀēņŗ£ļō£ ņ£Āņ¦ĆņÜöļ▓Ģ 6ņŻ╝ĻĖ░, 2021ļģä 8ņøöļČĆĒä░ ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ļŗ©ņØ╝ņÜöļ▓Ģ 8ņŻ╝ĻĖ░ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņŗĀĻ▓ĮņÖĖĻ│╝ņŚÉņä£ļŖö ļćīņĀäņØ┤ļĪ£ Ļ░Éļ¦łļéśņØ┤Ēöä ņ╣śļŻīļź╝ ļ░øņĢśļŗż. ĒÖśņ×ÉļŖö ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ļŗ©ņØ╝ņÜöļ▓Ģ 8ņŻ╝ĻĖ░ ņ╣śļŻī Ēøä ņ¢æņĢł ņŗ£ļĀźņĀĆĒĢś ļ░Å ļæÉĒåĄņØä ĒśĖņåīĒĢśņśĆļŗż. ņĢłĻ│╝ņĀü ņłśņłĀļĀźņØĆ ņŚåņŚłĻ│Ā, Ļ│ĀĒśłņĢĢ ņØ┤ņÖĖņØś ĒŖ╣ņØ┤ ņĀäņŗĀ ņ¦łĒÖśņØĆ ņŚåņŚłļŗż. ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņÜ░ņĢł 0.2, ņóīņĢł 0.7ņØ┤ņŚłļŗż. ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼ņāü ņ¢æņĢłņŚÉ Ļ▓░ļ¦ēņČ®ĒśłņØ┤ ņ׳ņŚłļŗż. ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņ¢æņĢł ņé╝ņČ£ņä▒ ļ¦Øļ¦ēļ░Ģļ”¼Ļ░Ć ĒÖĢņØĖļÉśņŚłļŗż(Fig. 1). ĒśĢĻ┤æņĢłņĀĆ ĒśłĻ┤ĆņĪ░ņśüņłĀņāü ņ¢æņĢł ļŗżņżæ Ļ│╝ĒśĢĻ┤æ ļłäņČ£, ņØĖļÅäņŗ£ņĢäļŗīĻĘĖļ”░ ĒśłĻ┤ĆņĪ░ņśüņłĀņŚÉņä£ ņ¢æņĢł ņĀĆĒśĢĻ┤æ ļ░śņĀÉņØä ļ│┤ņśĆļŗż(Fig. 2). ņ¢æņĢł ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗż ņ£Āņé¼ ņ”ØĒøäĻĄ░ ņ¦äļŗ©ņØä ļ░øĻ│Ā ĒśĖĒØĪĻĖ░ļé┤Ļ│╝ļĪ£ ņØśļó░ĒĢśņŚ¼ Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ ļ│ĄņÜ® Ļ░ĆļŖźĒĢ©ņØä ĒÖĢņØĖĒĢ£ Ēøä 2ņŻ╝ ļÅÖņĢł Ļ▓ĮĻĄ¼ ĒöäļĀłļō£ļŗłņåöļĪĀ(prednisolone) 40 mg/dayļĪ£ ļ│ĄņÜ® ņŗ£ņ×æĒĢśņśĆļŗż. Ļ▓ĮĻĄ¼ ĒöäļĀłļō£ļŗłņåöļĪĀņØä ļ│ĄņÜ®ĒĢ£ ņ¦Ć 2ņŻ╝ ĒøäņŚÉ ĒÖśņ×ÉņØś ņŗ£ļĀźņØ┤ ĒśĖņĀäļÉśņŚłļŗż. ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņÜ░ņĢł 0.5ņÖĆ ņóīņĢł 0.7ņØ┤ņŚłļŗż. ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼ņŚÉņä£ ņ¢æņĢł Ļ▓░ļ¦ēņČ®ĒśłņØĆ ņŚåņŚłĻ│Ā ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņāü ņ¢æņĢł ļ¦Øļ¦ēĒĢśņĢĪņØ┤ Ļ░ÉņåīļÉ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņØ┤Ēøä Ļ▓ĮĻĄ¼ ĒöäļĀłļō£ļŗłņåöļĪĀ 20 mg/dayļĪ£ Ļ░Éļ¤ēĒĢśņŚ¼ 2ņŻ╝ ļÅÖņĢł ļ│ĄņÜ® ņ£Āņ¦ĆĒĢśņśĆļŗż.
2ņŻ╝ Ēøä ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņ¢æņĢł ļ¦Øļ¦ēĒĢśņĢĪņØĆ ļŹö Ļ░ÉņåīĒĢśņśĆĻ│Ā, ĒŖ╣Ē׳ ņóīņĢłņŚÉņä£ļŖö ļ¦Øļ¦ēĒĢśņĢĪņØ┤ ļ¬©ļæÉ ņåīņŗżļÉśņŚłļŗż. Ļ▓ĮĻĄ¼ ĒöäļĀłļō£ļŗłņåöļĪĀ 10 mg/dayļĪ£ 2ņŻ╝ ļÅÖņĢł Ļ░Éļ¤ēĒĢśņśĆĻ│Ā ņØ┤Ēøä 5 mg/dayļĪ£ Ļ░Éļ¤ēĒĢśņŚ¼ 2ņŻ╝ ļÅÖņĢł ņ£Āņ¦ĆĒĢśņśĆļŗż.
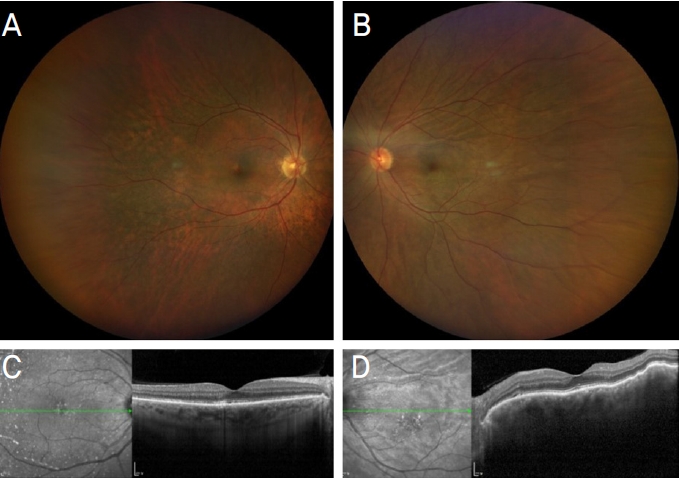
4ņŻ╝ Ēøä ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņÜ░ņĢłņØś ļ¦Øļ¦ēĒĢśņĢĪņØ┤ ņÖäņĀäĒ׳ ņåīņŗżļÉśņŚłĻ│Ā ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņÜ░ņĢł 0.6Ļ│╝ ņóīņĢł 0.7ņØ┤ ļÉśņ¢┤ Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ļź╝ ņżæļŗ©ĒĢśņśĆļŗż(Fig. 3). 2022ļģä 12ņøö ņÖĖļל ļ░®ļ¼Ė ņŗ£ ĒÖśņ×É ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņÜ░ņĢł 1.0, ņóīņĢł 0.9, ņ¢æņĢł ļ¦Øļ¦ē ĒĢśņĢĪ ļ¬©ļæÉ ņåīņŗżļÉ£ ņāüĒā£ļĪ£ ņ£Āņ¦ĆļÉśņŚłļŗż.
PD-1ņØĆ TņäĖĒż ļśÉļŖö BņäĖĒżĒæ£ļ®┤ņŚÉ ļČÖņ¢┤ ņ׳ļŖö ņłśņÜ®ņ▓┤ļĪ£ ņĢöņäĖĒżĒæ£ļ®┤ņŚÉ ļ░£ĒśäļÉśļŖö ļ”¼Ļ░äļō£ņØĖ PD-L1Ļ│╝ ņāüĒśĖņ×æņÜ®ņØä ĒĢ£ļŗż. PD-1Ļ│╝ PD-L1ņØ┤ Ļ▓░ĒĢ®ĒĢśļ®┤ TņäĖĒżļŖö ņĢöņäĖĒżļź╝ ņØĖņŗØĒĢśņ¦Ć ļ¬╗ĒĢśņŚ¼ Ļ│ĄĻ▓®ĒĢśņ¦Ć ļ¬╗ĒĢśĻ▓ī ļÉ£ļŗż. ļŗłļ│╝ļŻ©ļ¦ÖĻ│╝ ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦ÖņØĆ ļīĆĒæ£ņĀüņØĖ PD-1 ņ░©ļŗ© ĒĢŁņ▓┤ļĪ£ņä£ PD-1ņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ PD-L1Ļ│╝ņØś ņāüĒśĖņ×æņÜ®ņØä ņ░©ļŗ©ĒĢ┤ ĒÖ£ņä▒ĒÖöļÉ£ TņäĖĒżĻ░Ć ņĢöņäĖĒżļź╝ Ļ│ĄĻ▓®ĒĢĀ ņłś ņ׳Ļ▓ī ĒĢśļ®░ ĒØæņāēņóģ, ĒśĖņ¦ĆĒé© ļ”╝Ēöäņóģ, Ļ░äņäĖĒżņĢö, ļæÉĻ▓ĮļČĆņĢö, ĒÅÉņĢö ļō▒ ļŗżņ¢æĒĢ£ ņĢģņä▒ ņóģņ¢æņŚÉņä£ ņé¼ņÜ®ņØ┤ FDAņŚÉņä£ ņŖ╣ņØĖļÉśņŚłļŗż.1,7,9
ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦ÖņØä ļ╣äļĪ»ĒĢ£ ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£ņŚÉņä£ ņĢłĻ│╝ņĀü ļ®┤ņŚŁ Ļ┤ĆļĀ© ļČĆņ×æņÜ®ņØĆ ļō£ļ¼╝ļ®░ ĒÖśņ×ÉņØś 1% ļ»Ėļ¦īņŚÉņä£ ļ░£ņāØĒĢ£ļŗż. ļČĆņ×æņÜ® ņżæ ĒżļÅäļ¦ēņŚ╝ņØ┤ Ļ░Ćņן ĒØöĒĢśĻ▓ī ļ░£ņāØĒĢśļ®░ ņØ┤ņÖĖņŚÉļÅä ņĢłĻĄ¼ ņŚ╝ņ”Øļ░śņØæņ£╝ļĪ£ ņŻ╝ļ│ĆļČĆ ĻČżņ¢æ Ļ░üļ¦ēņŚ╝, ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗż ņ”ØĒøäĻĄ░ ļō▒ņØ┤ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā, ņĢłņÖĆ ņŚ╝ņ”Øļ░śņØæņ£╝ļĪ£ļŖö ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ, ņĢłņÖĆĻĘ╝ņŚ╝, Ēå©ļĪ£ņé¼-ĒŚīĒŖĖ ņ”ØĒøäĻĄ░ ļō▒ņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░öĻ░Ć ņ׳ļŗż.10
ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£ņŚÉ ņØśĒĢ£ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØś ĻĖ░ņĀäņØĆ ļČłļ¬ģĒÖĢĒĢśņ¦Ćļ¦ī ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£ņŚÉ ņØśĒĢ┤ ĒÖ£ņä▒ĒÖöļÉ£ TņäĖĒżĻ░Ć ļ®£ļØ╝ļŗī ņäĖĒżļź╝ Ļ│ĄĻ▓®ĒĢśĻ▓ī ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż.11 ļ®┤ņŚŁ Ļ┤ĆļĀ© ļČĆņ×æņÜ®ņØĖ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØĆ ņĢģņä▒ ĒØæņāēņóģņŚÉņä£ ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£ ņØ╝ņóģņØĖ ņØ┤ĒĢäļ”¼ļ¼┤ļ¦ÖņØä ņé¼ņÜ®ĒĢśļŖö ĒÖśņ×ÉņŚÉņä£ ņ▓śņØī ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░12 ņĄ£ĻĘ╝ņŚÉļŖö ļŗłļ│╝ļŻ©ļ¦ÖĻ│╝ ļō£ļ¼╝Ļ▓ī ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ņé¼ņÜ® ĒøäņŚÉ ļ░£ņāØĒĢ£ ņ”ØļĪĆļōżņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż.4,7,8
ņĄ£ĻĘ╝ņŚÉ ņØ╝ļ│ĖņŚÉņä£ ļ│┤Ļ│ĀļÉ£ ļ╣äņåīņäĖĒżņĢö ĒÖśņ×ÉņØś ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æ ņ”ØļĪĆļŖö ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ņÜöļ▓ĢņØä 3ņŻ╝ĻĖ░ ļÅÖņĢł ņé¼ņÜ® Ēøä ļ░£ļ│æĒĢśņśĆņ£╝ļ®░ ņ┤łĻĖ░ ņ”ØņāüņØĆ ņĢłĻĄ¼ĒåĄņ”ØĻ│╝ ņ▓ŁļĀź Ļ░ÉņåīņśĆļŗż.8 ļŗżļźĖ ņ”ØļĪĆņŚÉņä£ļŖö ļ╣äņåīņäĖĒżĒÅÉņĢöņŚÉ ļīĆĒĢ£ ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ņÜöļ▓Ģ 4Ļ░£ņøö ĒøäņŚÉ ņ¦äļŗ©ļÉśņŚłņ£╝ļ®░ ņ┤łĻĖ░ ņ”ØņāüņØĆ ļæÉĒåĄņŚÉ ņØ┤ņ¢┤ ņŗ£ļĀźņĀĆĒĢś ļ░Å ņ▓ŁļĀź Ļ░ÉņåīĻ░Ć ļÆżļö░ļ×Éļŗż.13 ĒĢśņ¦Ćļ¦ī ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ļ░£ņāØ ņŗ£ņĀÉņØ┤ ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ņ╣śļŻī 8Ļ░£ņøö ĒøäņØĖ 8ņŻ╝ĻĖ░ ņØ┤ĒøäļĪ£ ņØ┤ņĀä ļ│┤Ļ│Āļ│┤ļŗż ļŖ”ņŚłņ£╝ļ®░ ļæÉĒåĄņØä ļÅÖļ░śĒĢ£ ņŗ£ļĀźņĀĆĒĢśļź╝ ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢśņśĆļŗżļŖö ņĀÉņŚÉņä£ ņ░©ņØ┤Ļ░Ć ņ׳ļŗż. ļśÉĒĢ£ ņ╣śļŻīņŚÉņä£ņØś ņ░©ņØ┤ņĀÉņØĆ ļīĆļČĆļČäņØś ļŗłļ│╝ļŻ©ļ¦Ö ļ░Å ĒÄ©ļĖīļĪ£ļ”¼ņŻ╝ļ¦Ö ņ£Āļ░£ ļ│┤Ļ│ĀĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æ ĒÖśņ×ÉņŚÉņä£ ņ┤łĻĖ░ ņ╣śļŻīļĪ£ Ļ│ĀņÜ®ļ¤ēņØś ņĀĢļ¦ź ļé┤ ņŖżĒģīļĪ£ņØ┤ļō£(150-1,000 mg/day) ņé¼ņÜ® Ēøä Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ļĪ£ ņÖäņĀäĻ┤ĆĒĢ┤ļź╝ ļ│┤ņśĆņ£╝ļéś,6,7,12 ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö Ļ▓ĮĻĄ¼ ĒöäļĀłļō£ļŗłņåöļĪĀ 40 mg/day ņÜ®ļ¤ēņ£╝ļĪ£ ņ┤łĻĖ░ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņŚ¼ ņ¦łļ│æņØś ņÖäņĀäĒĢ£ ĒÜīļ│ĄņØä ļ│┤ņśĆļŗż.
ļ│┤Ļ│ĀĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØĆ ņØ╝ļ░śņĀüņ£╝ļĪ£ 30ļīĆņÖĆ 40ļīĆņØś ņĀŖņØĆ ņé¼ļ×īļōżņŚÉĻ▓ī ļ░£ņāØĒĢśņ¦Ćļ¦ī14 ļ│Ė ņ”ØļĪĆļź╝ ĒżĒĢ©ĒĢ£ ļ®┤ņŚŁĻ┤Ćļ¼Ėņ¢ĄņĀ£ņĀ£ ņé¼ņÜ®Ļ│╝ ņŚ░Ļ┤ĆļÉ£ ņé¼ļĪĆņŚÉņä£ļŖö ļīĆļČĆļČä 60ļīĆ ņØ┤ņāüņØś Ļ│ĀļĀ╣ ĒÖśņ×ÉļōżņŚÉņä£ ļ░£ņāØĒĢ£ļŗż. ļśÉĒĢ£ ļ│┤Ēü¼ĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØś ņØ╝ņ░© ņ╣śļŻīļĪ£ ņØ╝ļ░śņĀüņ£╝ļĪ£ Ļ│ĀņÜ®ļ¤ēņØś ņŖżĒģīļĪ£ņØ┤ļō£ ņ╣śļŻīĻ░Ć ĻČīņןļÉśņ¦Ćļ¦ī Ļ│ĀļĀ╣ņØ┤ļéś ĻĖ░ņĀĆ ņ¦łĒÖśņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ļŖö ļŗ╣ļć©ļéś Ļ░ÉņŚ╝Ļ│╝ Ļ░ÖņØĆ ļČĆņ×æņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ Ļ│ĀņÜ®ļ¤ē ņŖżĒģīļĪ£ņØ┤ļō£ņØś ņé¼ņÜ®ņØ┤ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ļö░ļØ╝ņä£ ļ│Ė ņ”ØļĪĆļŖö ļ®┤ņŚŁĒĢŁņĢöņ╣śļŻīņĀ£ļĪ£ ņ£Āļ░£ļÉ£ ļ│┤Ļ│ĀĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņŚÉņä£ņØś ņĪ░ĻĖ░ ņ¦äļŗ© Ēøä Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ ņ╣śļŻīļ¦īņ£╝ļĪ£ ņ×¼ļ░£ ņŚåņØ┤ ĒĢ┤ļČĆĒĢÖņĀü ļ░Å ĻĖ░ļŖźņĀü ņśłĒøäĻ░Ć ņ¢æĒśĖĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņżĆ ņ”ØļĪĆļØ╝Ļ│Ā ĒĢĀ ņłś ņ׳ļŗż.
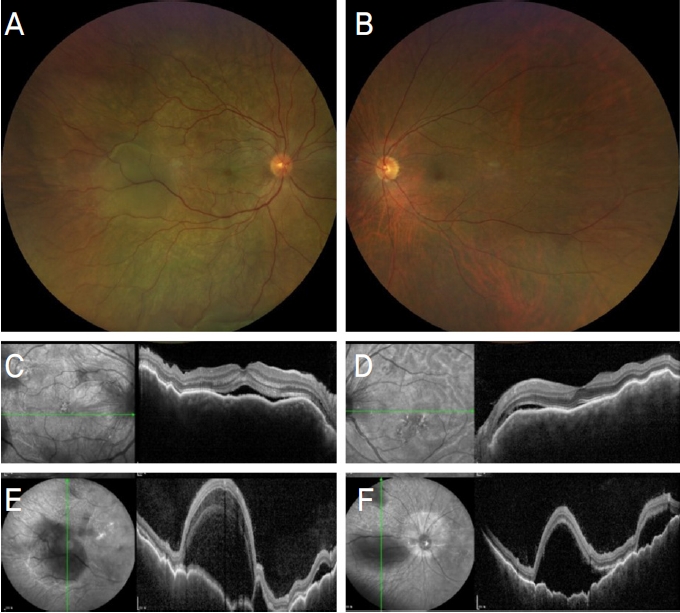
Figure┬Ā1.
Fundus photographs, optical coherence tomography images in both eyes. Fundus photographs (A, B) and optical coherence tomographic image (C, D) shows exudative retinal detachment in both eyes. Optical coherence tomographic im - ages of peripheral subretinal fluids in both eyes (E, F).
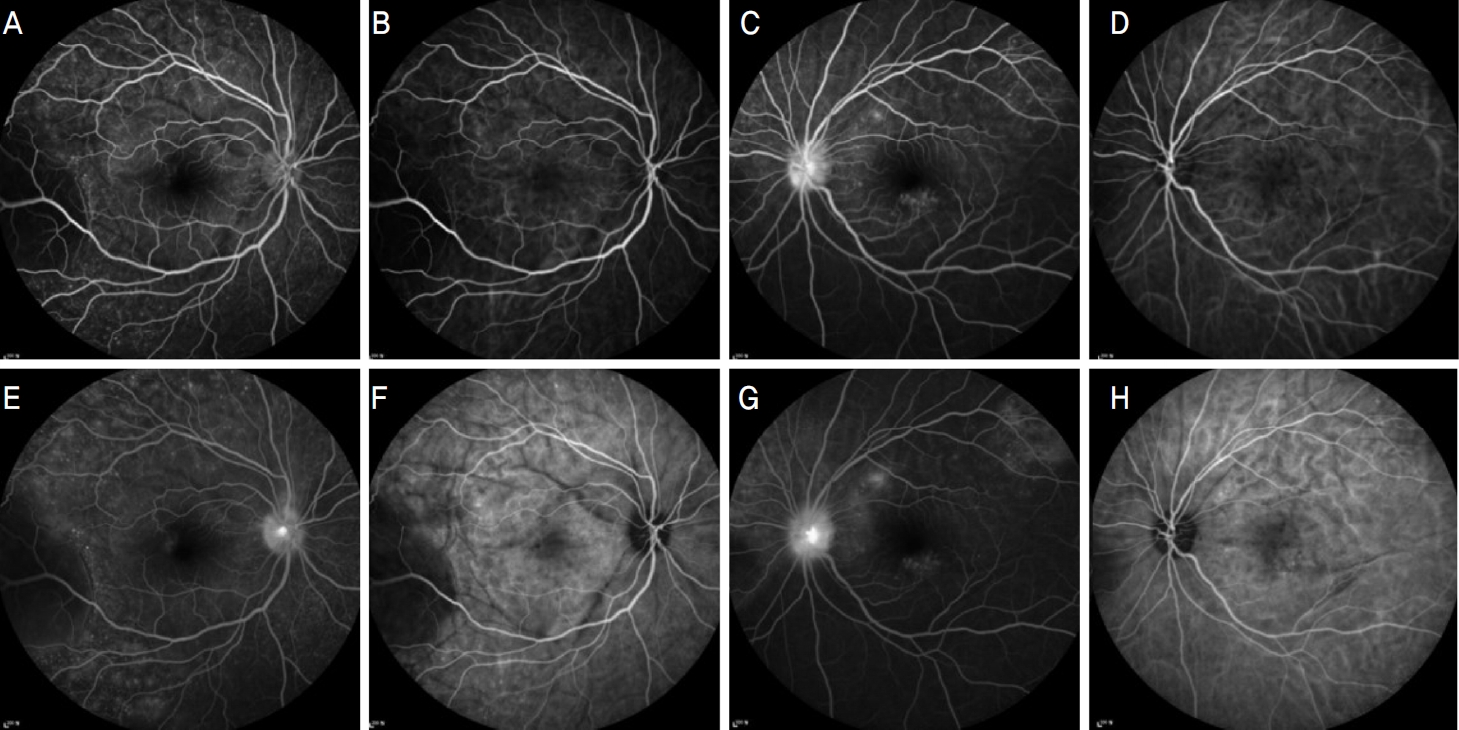
Figure┬Ā2.
Fluorescein angiographic images at early phase do not have hyperfluorescene leakages (A, C) and peripheral multiple hyperfluorescene leakages at late phase (E, G). Indocyanine green angiographic images at early phase shows hypofluorescent dark dots (B, D) and it continue well into late angiography phase (F, H).
REFERENCES
1) Gangadhar TC, Salama AK. Clinical applications of PD-1-based therapy: a focus on pembrolizumab (MK-3475) in the management of melanoma and other tumor types. Onco Targets Ther 2015;8:929-37.


2) Reck M, Rodr├Łguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive nonsmall-cell lung cancer. N Engl J Med 2016;375:1823-33.


3) Ushio R, Yamamoto M, Miyasaka A, et al. Nivolumab-induced Vogt-Koyanagi-Harada-like syndrome and adrenocortical insufficiency with long-term survival in a patient with non-small-cell lung cancer. Intern Med 2021;60:3593-8.



4) Bricout M, Petre A, Amini-Adle M, et al. Vogt-Koyanagi-Harada-like syndrome complicating pembrolizumab treatment for metastatic melanoma. J Immunother 2017;40:77-82.


5) Abdel-Rahman O, Oweira H, Petrausch U, et al. Immune-related ocular toxicities in solid tumor patients treated with immune checkpoint inhibitors: a systematic review. Expert Rev Anticancer Ther 2017;17:387-94.


6) Crosson JN, Laird PW, Debiec M, et al. Vogt-Koyanagi-Harada-like syndrome after CTLA-4 inhibition with ipilimumab for metastatic melanoma. J Immunother 2015;38:80-4.



7) Kikuchi R, Kawagoe T, Hotta K. Vogt-Koyanagi-Harada disease-like uveitis following nivolumab administration treated with steroid pulse therapy: a case report. BMC Ophthalmol 2020;20:252.




8) Tamura T, Akimoto E, Matsumoto C, et al. Vogt-Koyanagi-Harada syndrome induced by pembrolizumab in a patient with non-small cell lung cancer. J Thorac Oncol 2018;13:1606-7.


9) Telfah M, Whittaker TJ, C Doolittle G. Vision loss with pembrolizumab treatment: a report of two cases. J Oncol Pharm Pract 2019;25:1540-6.



10) Antoun J, Titah C, Cochereau I. Ocular and orbital side-effects of checkpoint inhibitors: a review article. Curr Opin Oncol 2016;28:288-94.


11) Dalvin LA, Shields CL, Orloff M, et al. Checkpoint inhibitor immune therapy: systemic indications and ophthalmic side effects. Retina 2018;38:1063-78.

12) Wong RK, Lee JK, Huang JJ. Bilateral drug (ipilimumab)-induced vitritis, choroiditis, and serous retinal detachments suggestive of Vogt-Koyanagi-Harada syndrome. Retin Cases Brief Rep 2012;6:423-6.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 675 View
- 54 Download
- Related articles
-
One-and-a-half Syndrome Associated with Multiple Sclerosis in a 14-year-old Girl2021 August;62(8)
A Case of Extensive Epibulbar Choristoma Associated with Microphthalmos.2017 January;58(1)
Parry-Romberg Syndrome Associated with Hypothyroidism.2017 July;58(7)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



