콘택트렌즈 관련 세균각막염에서 배양 양성 여부에 따른 비교 분석: 25년 후향적 연구
Comparative Analysis of Contact Lens-related Bacterial Keratitis According to Culture Positivity: A 25-year Retrospective Study
Article information
Abstract
목적
미생물학적으로 확인된 콘택트렌즈 관련 세균각막염(culture positive, CP)의 균주 분포와 임상 특징을 조사하고 배양음성군(culture negative, CN)과 비교하였다.
대상과 방법
1998-2022년 사이 콘택트렌즈 관련 세균각막염으로 입원치료한 142안을 후향적 분석하였으며, CP 79안(100균주)과 CN 63안이 포함되었다. CP군의 균주 분포 및 CP군과 CN군 사이에 역학, 선행인자, 임상 양상, 치료 결과를 비교하였다. 불량한 치료 결과는 최종 최대교정시력 0.5 이하, 치료 후 시력감소, 또는 수술적 치료 시행으로 정의하였다. 불량한 치료 결과에 이르는 위험인자는 two-proportional Z-test를 통해 분석하였다.
결과
CP군에서 그람음성균이 85%였으며, Pseudomonas (27%)와 Serratia spp. (26%)가 흔하였다. CP군과 CN군 사이에 평균 나이(27.0 vs. 33.8세, p=0.009)와 치료콘택트렌즈 사용(13.9 vs. 28.6%, p=0.031)이 차이를 보였다. 두 군 사이에 증상 기간, 이전 점안 항생제 사용, 수면 시 렌즈 착용, 상피결손 크기, 전방축농 및 불량한 치료 결과는 차이가 없었다. 전체군에서 불량한 치료 결과의 위험인자는 심부기질침윤(Z=2.88), 상피재생 기간 ≥7일(Z=2.30), 초진 시력 <0.1 (Z=2.20), 렌즈 교체주기 초과 사용(Z=2.10) 그리고 상피결손 ≥5 mm2 (Z=2.05)였다.
결론
CP군과 CN군 사이에 임상 양상과 치료 결과의 유의한 차이는 없었다. 전체군에서 불량한 초진 소견과 렌즈 교체주기 초과 사용이 불량한 치료 결과와 관계 있었다.
Trans Abstract
Purpose
This study investigated the microbiological profile and clinical characteristics of culture positive (CP) contact lens-related bacterial keratitis (CLBK) and compared them to culture negative (CN) cases.
Methods
We retrospectively analyzed 142 CLBK patients hospitalized between January 1998 and December 2022. The CP and CN groups consisted of 79 eyes (100 isolates) and 63 eyes, respectively. We investigated the microbiological profile in the CP group and compared the epidemiology, predisposing factors, clinical characteristics, and treatment outcomes between the CP and CN groups. Poor treatment outcomes were defined as a final best-corrected visual acuity (BCVA) ≤ 0.5, worsened BCVA after treatment, or the need for surgical intervention. We evaluated the risk factors for poor treatment outcomes in the entire cohort through two-proportional Z-test analysis.
Results
In CP group, gram-negative bacteria accounted for 85%, and common isolates were Pseudomonas (27%) and Serratia (26%) species. There were significant differences in mean age (27.0 years vs. 33.8 years, p = 0.009) and a history of therapeutic bandage contact lens wear (13.9% vs. 28.6%, p = 0.031) between the CP and CN groups. However, there were no significant differences in symptom duration, prior use of topical antibiotics, sleeping with wearing CL, epithelial defect size, hypopyon, and poor treatment outcomes. Significant risk factors for poor treatment outcomes in the entire group included deep infiltration (Z = 2.88), epithelial healing time ≥ 7 days (Z = 2.30), initial BCVA < 0.1 (Z = 2.20), over date use of contact lens (Z = 2.10), and epithelial defect size ≥ 5 mm2 (Z = 2.05).
Conclusions
There were no significant differences in clinical characteristics and treatment outcomes between the CP and CN groups. Poor initial clinical findings and over date use of contact lens were associated with poor treatment outcomes in both groups.
콘택트렌즈(contact lens, CL)의 착용은 감염각막염의 위험인자로 널리 알려져 있으며, 전체 각막염의 유발 요인 중에서 외상(16.8%)과 함께 많은 비율(14.0%)로 보고되고 있다.1 국내 콘택트렌즈 관련 합병증 빈도에 대해 Kim et al2은 대상 환자 499명 중 각막미란이 26.3%로 가장 많았고, 감염 각막궤양을 9.4%로 보고한 바 있다. 감염각막염의 역학적 측면에서 일반적인 세균각막염의 평균 나이는 53.9세로 보고됨에 비해,3 그중 콘택트렌즈와 관련된 경우는 28.8-29.8세로 낮게 보고되는 경향이다.4 이러한 콘택트렌즈 관련 감염 각막염의 역학적 특수성은 젊은 나이에서 각막염의 성공적인 치료 후에도 각막혼탁으로 인한 시력저하가 장기적으로 지속된다는 점에서 임상적으로 중요하게 다루어질 필요가 있다. 또한 콘택트렌즈 감염각막염에서 세균이 차지하는 비율은 88.9-93.6%로 보고되며, 진균(2-30.7%)이나 아메바(2.8-7.7%)에 비해 높은 비율을 차지한다.5-7
콘택트렌즈 관련 세균각막염(CL related bacterial keratitis, CLBK)의 위험인자로는 많은 연구들에서 장시간 착용, 수면 시 콘택트렌즈의 착용, 연속착용콘택트렌즈의 사용, 콘택트렌즈의 부적절한 세척, 콘택트렌즈의 보관 불량, 콘택트렌즈 케이스의 불량한 세척 등이 보고되었다.8-10 콘택트렌즈 착용과 세균각막염 발병의 관련성을 설명하는 기전으로는 콘택트렌즈에 의한 각막의 저산소증, 각막상피의 손상으로 인한 병원균에 대한 각막의 저항력 약화, 콘택트렌즈 아래의 눈물순환 장애로 눈물에 의한 병원균 세척 작용의 저하 등이 제시된 바 있다.11
배양 양성률 측면에서는 일반적인 세균각막염의 37-42%에 비해 콘택트렌즈 관련 세균각막염에서 44-54%로 다소 높게 보고되는 경향을 보인다.6,12,13 따라서 세균각막염에서 배양 양성 여부에 따른 임상 분석의 필요성이 대두되며, 일반적인 세균각막염의 경우 배양 양성 여부에 따른 임상 분석 및 치료 결과가 여러 국가와 지역에서 보고된 바 있다.14-16 하지만 콘택트렌즈 관련 세균각막염에 한정하여 배양 양성 여부에 따른 임상적 차이를 조사한 연구는 부족한 실정이다. 이에 본 연구에서는 25년간의 장기간의 데이터를 이용하여 미생물학적으로 확인된 콘택트렌즈 관련 세균각막염 환자를 대상으로 균주 분포, 역학, 임상 양상, 치료 결과를 분석하고, 이를 미생물학적으로 확인되지 않은 군과 비교하여 그 특징을 알아보고자 하였다.
대상과 방법
연구 대상 선정
1998년 1월부터 2022년 12월까지 25년간 영남대학교병원 안과에서 콘택트렌즈 관련 감염각막염으로 입원치료한 환자 중, 임상적으로 세균각막염으로 확인되고 항미생물제제 중 항생제만으로 치료를 시행한 경우를 대상으로 의무 기록을 통한 후향적 분석을 시행하였다. 감염각막염의 진단은 한 명의 각막전공 전문의에 의해 각막기질침윤, 상피결손, 전방염증 정도를 평가하여 이루어졌으며, 입원치료의 결정은 증상 기간, 환자의 지역적 연고와 약제 사용 이해도 등을 종합적으로 감안하여 이루어졌다.17 콘택트렌즈 관련 감염각막염으로 진단받았으나 입원치료하지 않은 경우, 배양검사에서 진균 또는 아메바가 검출된 경우, 또는 항바이러스제, 항진균제, 항아메바제제를 사용하여 치료한 경우는 연구 대상에서 제외하였다. 본 연구는 헬싱키선언(Declaration of Helsinki)을 준수하였으며 영남대학교병원 임상연구윤리위원회(Institutional Review Board, IRB)의 승인을 얻었다(승인 번호: YUMC 2022-11-021).
연구 그룹 분류 및 미생물학적 분석
전체군을 배양 결과에 따라 미생물학적으로 확인된 군(culture positive group, CP)과 배양 음성군(culture negative group, CN)으로 나누었다. 각막, 결막, 콘택트렌즈, 콘택트렌즈 보관액, 콘택트렌즈 용기 검체 배양 중 한 군데 이상에서 배양 양성 결과를 얻은 경우를 CP군으로 정의하였다.
미생물학적 분석으로 CP군에서 검출된 균주의 종류를 조사하여 정리하였다. CP군의 균주 분포의 변화 추이 분석을 위해 전반기(1998-2005년), 중반기(2006-2013년), 후반기(2014-2021년)로 나누었다.
역학적 인자 및 선행인자
역학적 인자로 환자의 성별, 나이, 증상 기간(증상 발생 후 본원 내원까지의 기간), 각막염 발생 계절 등을 조사하여 CP군과 CN군 사이에 비교 분석하였다. 나이는 0-19세, 20-39세, 40세 이상으로 구분하였다. 발생 계절은 증상이 처음 발생한 시점의 날짜를 기준으로 하여 봄(3-5월), 여름(6-8월), 가을(9-11월), 겨울(12-2월)로 분류하였다.
선행인자로는 각막외상 유무, 이전 안구표면질환 유무, 안과 수술력, 기존에 가지고 있었던 전신 질환, 내원 전 점안 항생제 또는 스테로이드제 사용 유무 등에 대해 조사하였다.
콘택트렌즈 사용 패턴 조사
콘택트렌즈 관련 세균각막염 환자가 각막염 발병 당시 사용 중이었던 콘택트렌즈의 종류를 조사하였다. 소프트콘택트렌즈(soft CL)는 매일착용콘택트렌즈(daily wear soft CL), 연속착용콘택트렌즈(extended wear soft CL), 미용콘택트렌즈(cosmetic color lens)로 분류하였으며, 이외에 치료콘택트렌즈(therapeutic bandage CL, BCL), 가스투과경성콘택트렌즈(rigid gas permeable CL), 각막굴절교정렌즈(orthokeratology CL)로 구분하였다. 소프트콘택트렌즈를 착용하였으나 사용 목적이 확인되지 않은 경우에는 기타 소프트콘택트렌즈(unidentified soft CL)로 분류하였다.
환자의 콘택트렌즈 사용 패턴과 관련하여 전체 렌즈 착용 기간, 하루 중 렌즈 착용 시간 및 콘택트렌즈의 부적절한 사용에 대해 조사하였다. 구체적으로 콘택트렌즈의 부적절한 사용은 물 노출(water exposure under wearing CL), 수면 시 콘택트렌즈의 착용(sleeping with wearing CL), 및 콘택트렌즈 교체주기 초과 사용(over date use)으로 구분하여 조사하였다. 콘택트렌즈 교체주기 초과 사용은 콘택트렌즈 제조사에서 권장하는 렌즈의 적정 교체주기 또는 유통기한을 넘겨 사용한 렌즈의 사용으로 정의하였으며, 물 노출은 콘택트렌즈 착용 중 안구에 물이 들어간 경우로 정의하였다.
초진 임상 양상
임상적 특징으로 초진 시 각막 병변의 위치와 크기, 전방 축농 유무, 각막내피반 유무 및 초진 최대교정시력에 대해 조사하였다. 각막 병변의 위치는 중심에서 반경 1/2 이내를 중심부, 그 바깥쪽을 주변부로 정의하여 분류하였다. 각막 병변의 크기는 각막상피결손의 크기로 나타내었다. 상피결손 면적은 세극등현미경의 10배 배율로 촬영한 사진(Canon camera, Tokyo, Japan)에 ImageJ (ver 1.53k, Wayne Rasband National Institutes of Health, Kensington, MD, USA) 프로그램을 사용하여 측정한 상피결손의 면적으로 정의하였으며, 두 명의 검사자가 측정한 값을 평균하여 상피결손의 면적으로 결정하였다.18
세균의 배양 및 동정
콘택트렌즈 관련 세균각막염 환자에서 원인 세균을 동정하기 위해 병변 기저면이나 가장자리에서 조직을 긁어내어 검체를 채취하고 도말검사와 배양검사를 시행하였다. 도말 검사를 위해 0.5% proparacaine hydrochloride (Alcaine®, Alcon, Fort Worth, TX, USA)로 각막을 점안마취한 뒤, 소독된 면봉으로 분비물을 제거한 후 No. 15 Bard-Parker knife (Bard-Parker Co., Danbury, CT, USA)로 2장의 슬라이드 도말표본을 만들어 그람염색(gram stain) 및 KOH 도말 검사(potassium hydroxide smear)를 실시하였다. 각막찰과 배양검사와 동시에 결막에서 원인 세균을 동정하기 위해 멸균 면봉을 사용하여 검체를 채취하였다. 추가로 초진 시에 환자가 사용하던 콘택트렌즈나 사용하던 콘택트렌즈 케이스를 확보한 경우 함께 배양검사를 시행하였다.19 배양검사를 위해 기본 배지인 blood agar, chocolate agar, MacConkey agar medium에 접종하여 48시간 동안 배양검사를 시행하였다. 혐기성 세균이 의심되는 경우에는 추가로 phenylethyl alcohol blood 배지와 Brucellar agar 배지에 검체를 접종한 후 바로 혐기성 균배양 Jar에서 배양하였다. 배양된 세균의 동정은 그람염색과 미생물자동분석기(VITEK system, BioMerieux-Co., Lyon, France)를 이용하였다.20
약물요법
초진 시 각막찰과에 의한 미생물검사를 실시한 후 결과가 나오기 전 경험적 전신 항생제 치료로서 2세대 또는 3세대 cephalosporin과 aminoglycoside를 투여하였다. 경험적 점안 항생제 치료로는 2% tobramycin (Tobra®, Daewoong, Sungnam, Korea)과 cephalosporin계 항생제(5% cefamandole nafate, Cefamandole nafate®, Dongkwang, Pyeongtaek, Korea, 1998-2010; 5% ceftazidime, 2011-2021)를 사용하였으며, 상용화된 fluoroquinolone 항생제 안약(0.5% levofloxacin, Cravit®, Santen, Osaka, Japan, 1998-2005; 0.5% moxifloxacin, Vigamox®, Alcon, 2005-2022)을 병합하여 30분에서 1시간 간격으로 점안하였다. 임상 소견 호전 시 균의 감수성 결과에 관계없이 계속 사용하면서 용량을 줄여 나갔으며, 악화되는 양상을 보이면 항생제 감수성 결과를 반영하여 48-72시간 뒤에 항생제를 바꾸어 사용하는 원칙을 적용하고자 하였다.
치료 결과 분석
치료 결과는 상피재생 완료기간, 최종 최대교정시력(final best-corrected visual acuity, final BCVA), 치료 후 시력 감소 유무, 수술적 치료 여부를 조사하여 CP군과 CN군 사이에 비교 분석하였다. 상피재생 완료기간은 초진 이후 상피가 완전히 회복되었을 때까지의 기간으로 정의하였다.
최종 최대교정시력은 치료 시작 시점으로부터 3개월 후 각막염의 기질침윤이 소실되고 상피재생이 완료되었을 시 Snellen 시력으로 측정한 것을 기준으로 하였으며, 시력의 평균값을 구할 때에는 통계학적 분석을 위하여 logarithm of the minimum angle of resolution (logMAR)으로 변환하였다.
치료 중 병변이 악화되는 경우에는 각막전공 전문의의 의학적 판단에 따라 양막이식술 등의 수술적 치료가 시행되었다. 불량한 치료 결과(poor treatment outcome)는 치료 후 최종 교정시력이 0.5 이하이거나 최종시력의 감소 또는 수술적 치료가 동반된 경우로 정의하였다.
통계학적 분석
자료의 분석은 IBM SPSS ver. 27.0 for Windows (IBM Corp., Armonk, NY, USA)를 사용하였다. 통계 기법은 범주형 자료는 chi-square test와 Fisher’s exact test를 사용하였으며, 연속형 자료는 평균값 비교를 위해 independent t-test를 이용하였다. 통계학적 유의수준은 p값이 0.05 미만인 경우로 하였다. 전체 25년간의 기간 동안 콘택트렌즈 착용 비율에 대한 추세 분석을 위해 Microsoft Excel (Microsoft Corporation, Redmond, WA, USA)에 내장된 선형 회귀모델 추세선 통계식을 사용하였으며, 기울기 및 결정계수(coefficient of determination, R2)를 평가하였다.
불량한 치료 결과를 초래하는 위험인자를 조사하기 위해 전체군 및 CP군 각각에서 two-proportion Z-test를 통해 각 독립변수의 유무가 불량한 치료 결과를 일으키는 비율의 차이를 Z-점수로 평가하였다. Z-점수는 각 독립변수에 대한 정규 모집단의 평균값에서 얼마나 멀리 떨어져 있는가를 표준편차의 배수로 나타낸 것으로, 각 지정된 독립변수의 조건을 만족할 때를 Z-점수의 양의 방향으로 설정하였다.21 Z-점수의 95%, 99%, 99.9%의 신뢰구간에 해당하는 값은 각각 ± 1.96, ± 2.58, ± 3.29로 정의되었다.
결 과
전체 25년의 기간 동안 본원에서 세균각막염으로 입원 치료하여 항생제만으로 치료를 시행한 경우는 860안이 확인되었다. 이 중 콘택트렌즈 관련 감염각막염은 142안으로 16.5%를 차지하였다. 시기에 따른 콘택트렌즈 관련 세균각막염의 비율은 1998-2002년 12.6%에서 2013-2017년 21.2%로 유의한 증가를 보였으며(p=0.043), 2018-2022년에는 15.1%로 약간 감소하여 전체 25년 동안의 경향은 약한 증가 추세를 보였다(slope of linear regression=0.919, R2=0.209) (Fig. 1). 본 연구 대상에 포함된 142안 중 CP군이 79안, CN군이 63안으로 배양 양성률은 55.6%로 확인되었다.
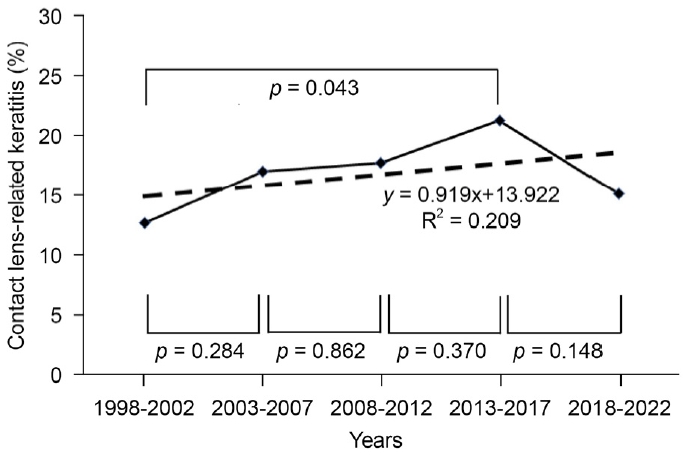
Prevalence of contact lens-related bacterial keratitis among total bacterial keratitis from 1998 to 2022. The p-value was calculated using chi-square test to compare the distribution of the contact lens-related bacterial keratitis between 2 periods. The slope, intercept, and R2 (coefficient of determination) of the linear regression model equation (dotted line) are presented.
미생물학적 특성
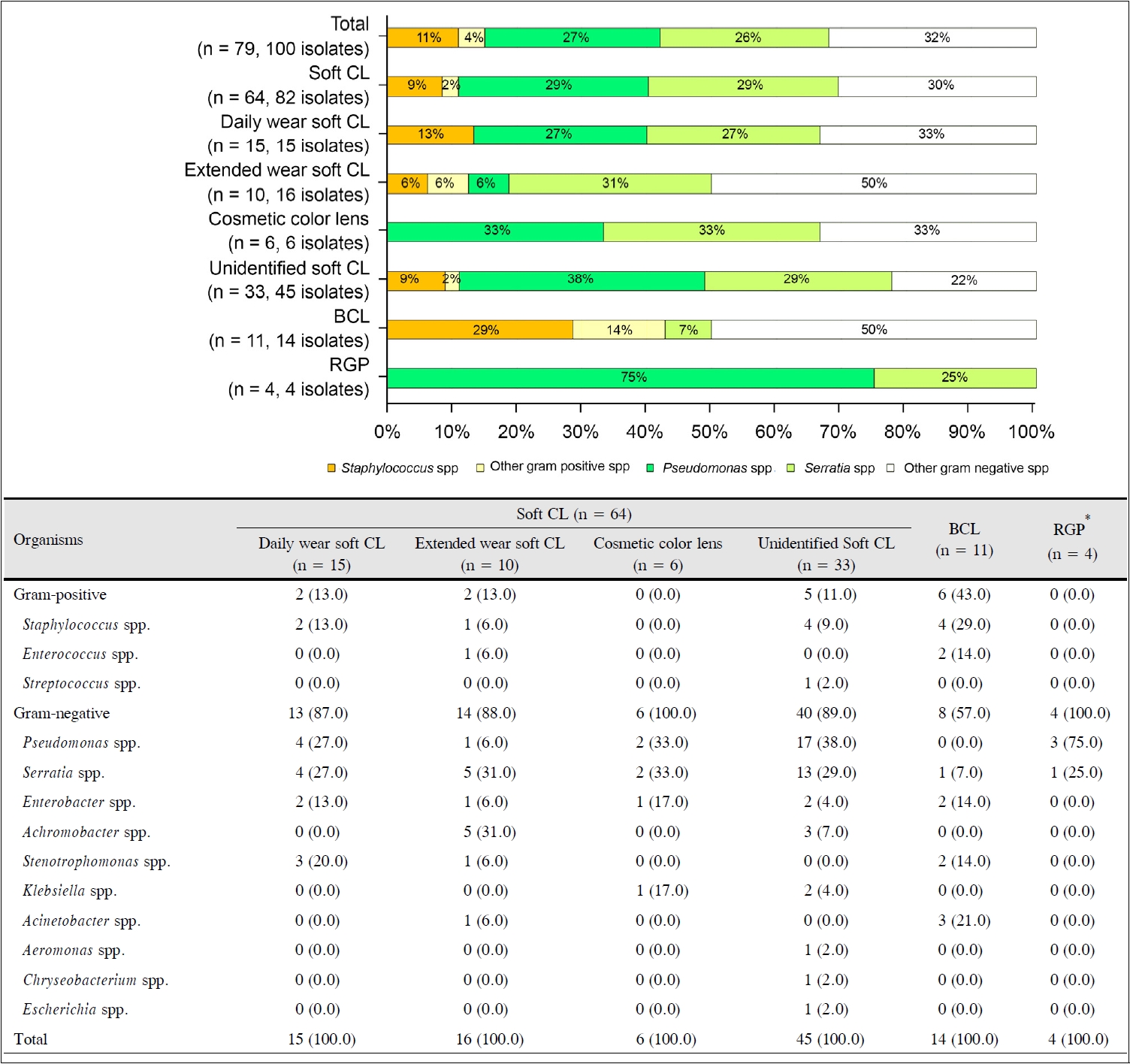
CP군 79안에서 100균주가 확인되었으며, 전체 균주 중 그람음성균의 비율은 85.0%였다. 가장 흔하였던 균주는 Pseudomonas spp. (n=27, 27.0%)였으며, 그 다음으로 Serratia spp. (n=26, 26.0%), Staphylococcus spp. (n=11, 11.0%) 순이었다. 총 79안 중 16안(20.3%)에서 두 균주 이상의 복합 감염이 확인되었다(Fig. 2).
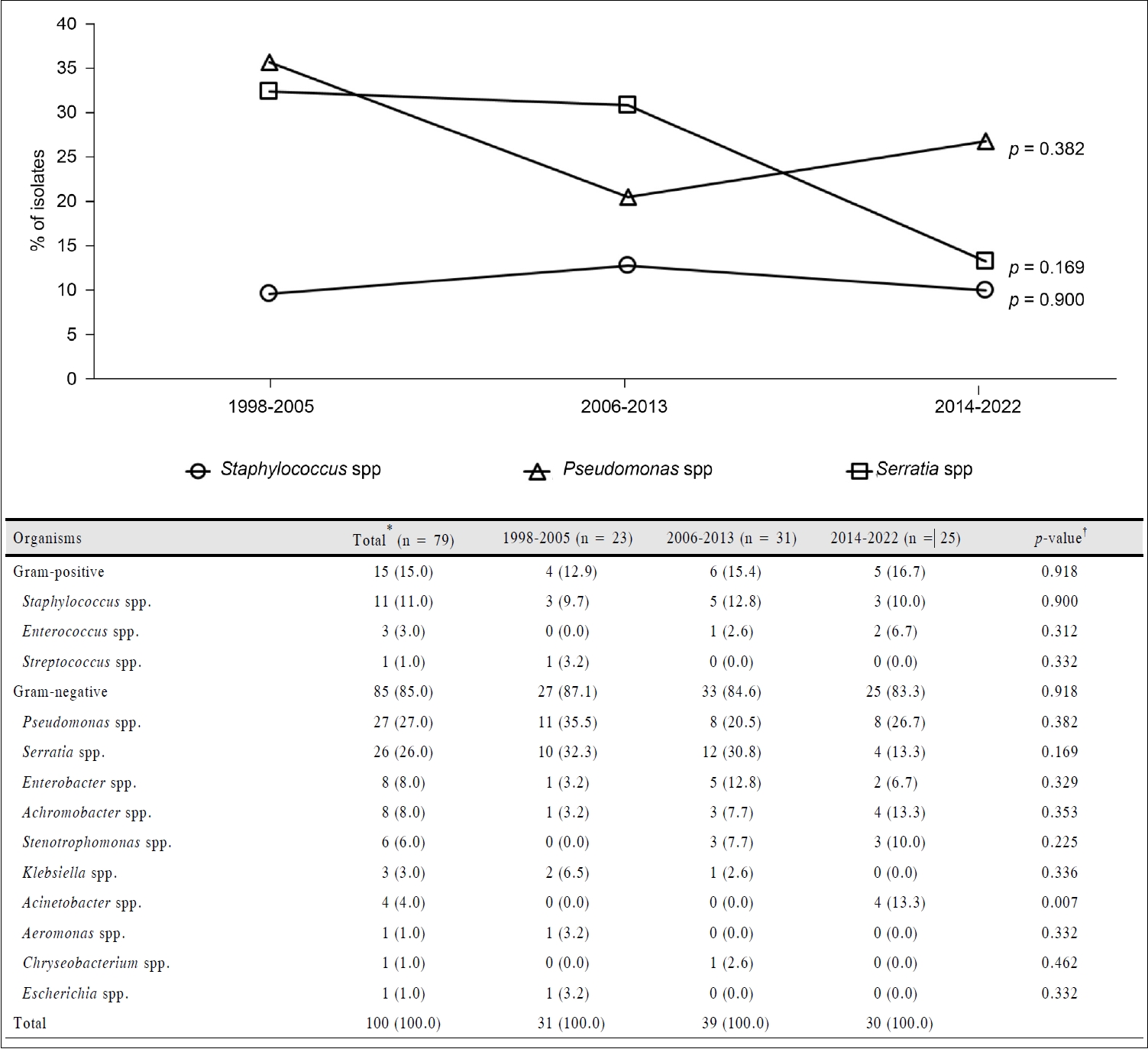
Microbiological profiles and shifting trend in culture positive CLBK isolates during 1998-2022. Values indicate the number of isolates (%). CLBK = contact lens related bacterial keratitis. *Sixteen eyes were polymicrobial infection: 2 strains isolation (12 cases), 3 strains isolation (3 cases), 4 strains isolation (1 case); †p-value was calculated by analysis of variance test.
시기별 분석에서 Pseudomonas spp.의 비율은 중반기(20.5%)에 감소하였다가 다시 후반기(26.7%)에 증가하였으나 시기에 따른 유의한 차이를 보이지 않았으며(p=0.382), Serratia spp.는 전반기(32.3%) 이후 지속적으로 비율이 감소하였으나 시기에 따른 유의한 차이를 보이지는 않았다(p=0.169). Staphylococcus spp.는 연구 기간 동안 9-13%가량을 차지하였으며 시기에 따른 유의한 차이를 보이지 않았다(p=0.900) (Fig. 2).
콘택트렌즈 종류에 따른 미생물 분포
CP군에서 사용한 콘택트렌즈 종류에 따라 그람양성균 및 그람음성균 분포를 살펴보았으며, 매일착용콘택트렌즈 15안에서 그람양성균 13%, 그람음성균 87%로 전체 CP군에서의 결과와 비슷한 결과를 보였다. 연속착용콘택트렌즈 16안에서도 그람양성균 13%, 그람음성균 88%로 전체 CP군에서의 결과와 비슷한 결과를 보였다. 미용콘택트렌즈 6안에서는 모두 그람음성균이 배양되었으며, Pseudomonas spp.와 Serratia spp. 각 2안(33%)으로 가장 많은 비율을 차지하였다. 치료콘택트렌즈 14안에서는 Staphylococcus spp. (4안, 29%)가 가장 흔하였다. 그람양성균의 비율은 치료콘택트렌즈에서 43%였으며, 나머지 렌즈들에서의 10%에 비해 유의하게 높았다(BCL vs. non-BCL, p=0.006, Fisher’s exact test). 가스투과경성콘택트렌즈 또는 각막굴절교정렌즈를 착용한 4안에서는 모두 그람음성균이 확인되었다(Pseudomonas spp. 3안, Serratia spp. 1안) (Fig. 3).
역학적 특성
전체군의 평균 나이는 30.1세였으며, CP군(27.0세)보다 CN군(33.8세)에서 더 많았다(p=0.009). 여성의 비율은 CP군에서 68.4%, CN군에서 68.3%로 유의한 차이를 보이지 않았다(p=1.000). 계절 분포에서 여름에 각막염이 발병한 비율은 두 군 간에 유의한 차이가 없었다. 증상 기간이 3일 이상인 경우는 CP군에서 48.1%, CN군에서 58.7%로 유의한 차이를 보이지 않았다(p=0.238). 입원 기간은 CP군과 CN군 사이에 유의한 차이를 보이지 않았다(Table 1).
선행인자 및 콘택트렌즈 사용 패턴 조사
CP군과 CN군 사이에 이전 안구표면질환(12.7% vs. 17.5%, p=0.480), 안과 수술력(5.1% vs. 4.8%, p=1.000), 이전 점안 항생제 사용(39.2% vs. 52.4%, p=0.130), 이전 점안 스테로이드제 사용(2.5% vs. 4.8%, p=0.655), 당뇨(3.8% vs. 6.3%, p=0.700) 그리고 고혈압(3.8% vs. 9.5%, p=0.185)의 유의한 차이는 보이지 않았다(Table 1).
콘택트렌즈 사용 패턴에, 수면 시 콘택트렌즈의 착용 비율은 CP군에서 36.7%로 CN군의 23.8%에 비해 높았지만 통계적으로 유의한 차이는 보이지 않았다(p=0.105). 물 노출 비율은 CP군에서 20.3%로 CN군의 42.9%에 비해 유의하게 더 낮았다(p=0.006). 하루 중 12시간 이상 콘택트렌즈 사용(54.4% vs. 50.8%, p=0.736)과 콘택트렌즈 교체주기 초과 사용(12.7% vs 6.3%, p=0.264)은 CP군과 CN군 사이에 유의한 차이를 보이지 않았다(Table 1).
콘택트렌즈 유형에 따른 분석에서 소프트렌즈가 차지하는 비율은 CP군에서 CN군보다 다소 높았다(81.0% vs. 66.7%, p=0.051). BCL의 경우 CP군보다 CN군에서 유의하게 더 높은 비율을 보였으며(13.9% vs. 28.6%, p=0.031), BCL 29안에서 CP군은 11안으로 37.9%의 배양 양성률을 보였다. BCL 사용의 가장 많은 원인으로 51.7%가 각막미란이었고, 그 다음으로 각막염 17.2%, 반복각막진무름 10.3% 등이었다. 매일착용콘택트렌즈(p=0.458), 연속착용콘택트렌즈(p=0.210), 미용콘택트렌즈(p=0.197) 그리고 가스투과경성 콘택트렌즈(p=1.000)의 사용 비율은 CP군과 CN군 사이에 유의한 차이를 보이지 않았다(Table 1).
초진 임상 양상 및 치료 결과
임상 소견에서 CP군과 CN군 사이에 중심부 각막 병변(68.4% vs. 66.7%, p=0.858), 상피결손 크기(6.9 ± 12.6 mm2 vs. 5.0 ± 9.4 mm2, p=0.319), 심부기질침윤(3.8% vs 7.9%, p=0.466), 각막내피반(2.6% vs 3.3%, p=1.000) 그리고 상피 재생 완료기간(8.5 ± 9.0 days vs. 7.6 ± 5.6 days, p=0.468)의 유의한 차이는 보이지 않았다. 전방축농의 비율은 CP군에서 12.7%으로 CN군의 3.2%에 비해 높았으나 통계적으로 유의한 차이는 보이지 않았다(p=0.066) (Table 2).
초진 시력의 경우 CP군과 CN군 사이에 통계적으로 유의한 차이는 없었으며(0.85 ± 0.80 logMAR vs. 0.93 ± 0.73 logMAR, p=0.583), 최종 시력(0.18 ± 0.47 logMAR vs. 0.15 ± 0.30 logMAR, p=0.666) 또한 CP군과 CN군 사이에 유의한 차이를 보이지 않았다. 경험적 항생제 치료 중 배양검사에서 메티실린 내성 그람양성균 4예, ceftazidime 내성 녹농균 2예가 확인되었으나, 모두 본원의 경험적 항생제 치료 요법에 호전되어 약제 변경이 필요하지 않았다. 또한, 항생제 내성 유무와 관계없이 불충분한 치료 반응으로 점안 항생제를 교체하여 사용한 경우도 확인되지 않았다. 불량한 치료 결과는 CP군에서 16.4%, CN군에서 17.5%로 확인되어 두 군 사이에 유의한 차이를 보이지 않았다(p=1.000) (Table 2).
불량한 치료 결과에 이르는 위험인자 분석
전체군에서 two-proportion Z-test를 시행한 결과 심부기질침윤(Z=2.88), 상피재생 완료기간 7일 이상(Z=2.30), 초진 시력 0.1 미만(Z=2.20), 콘택트렌즈 교체주기 초과 사용(Z=2.10), 상피결손 크기 5 mm2 이상(Z=2.05)이 불량한 치료 결과의 유의한 위험인자로 나타났다(Table 3).
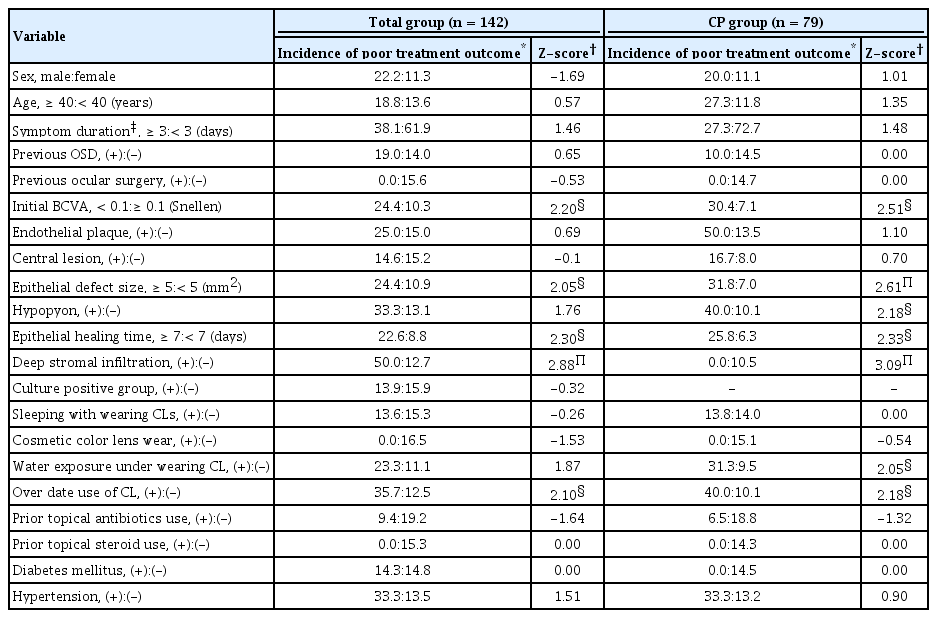
Analysis of potential risk factors for poor treatment outcomes in each total and CP group with CLBK using a two-proportion Z-test
CP군에서 two-proportion Z-test를 시행한 결과, 심부기질 침윤(Z=3.09), 상피결손 크기 5 mm2 이상(Z=2.61), 초진 시력 0.1 미만(Z=2.51), 상피재생 완료기간 7일 이상(Z=2.33), 전방축농(Z=2.18), 콘택트렌즈 교체주기 초과 사용(Z=2.18) 그리고 물 노출(Z=2.05)이 불량한 치료 결과의 유의한 위험인자로 나타났다(Table 3).
배양 양성군에서 BCL 여부에 따른 임상 분석
CP군(79안)에서 BCL 착용군(BCL, 11안)과 BCL 이외 착용군(non-BCL, 68안)으로 나누어 세부 분석을 시행하였다. 나이 30세 이상인 경우는 BCL군에서 72.7%로 non-BCL군의 17.6%에 비해 유의하게 높았으며(p<0.001), 이전 안구표면질환(54.5% vs 5.9%, p<0.001), 안과 수술력(27.3% vs. 1.5%, p=0.008), 안외상(27.3% vs. 0.0%, p=0.002) 또한 BCL군에서 non-BCL군에 비해 유의하게 높은 비율을 보였다. 두 군 사이에 증상 기간 7일 이상인 경우, 상피결손 크기 5 mm2 이상, 초진 시력 0.1 미만인 경우, 최종시력 0.5 미만인 경우, 상피재생 완료기간 그리고 불량한 치료 결과는 통계적으로 유의한 차이를 보이지 않았다(Fig. 4).
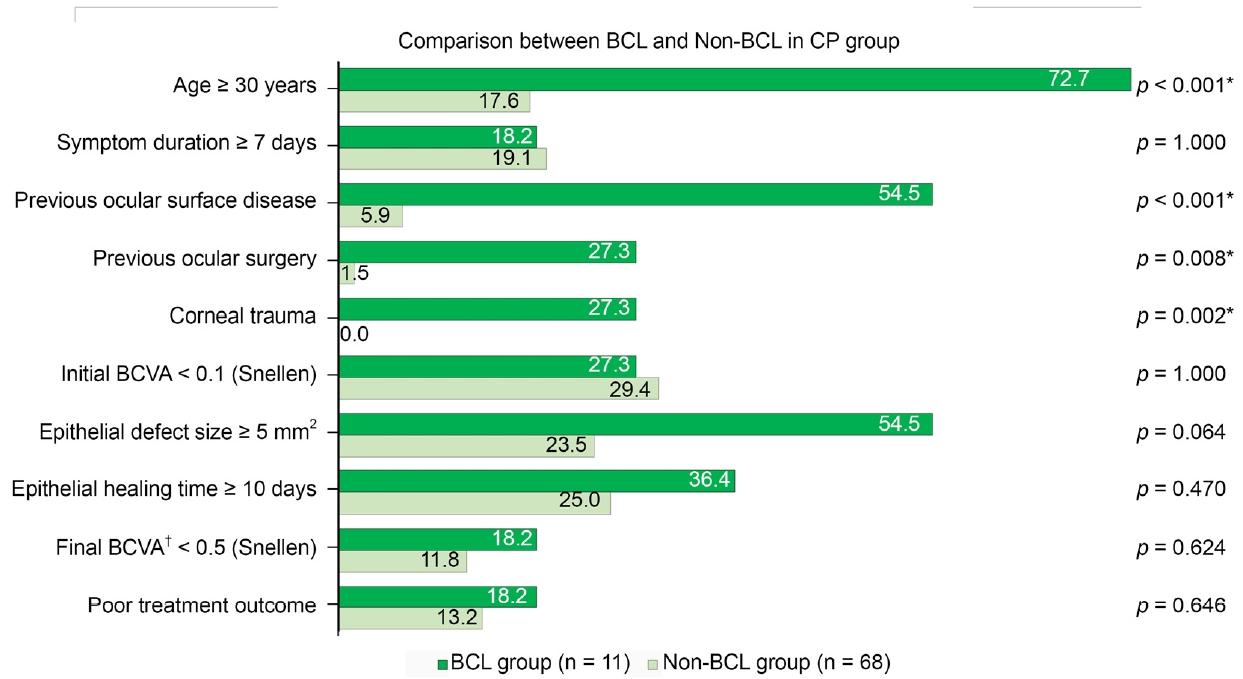
Comparison between the therapeutic bandage contact lens wearers and the others in CP group. Values indicate percentage (%). The p-value was calculated using Fisher’s exact test. BCL = therapeutic bandage contact lens; CP = culture positive; BCVA = best-corrected visual acuity. *A p-value less than 0.05; †one case of BCL and 12 cases of non-BCL were excluded due to insufficient data.
고 찰
세균각막염 중 콘택트렌즈와 관련된 비율은 본 연구에서 16.5%였다. 이와 비슷하게 국내의 전체 감염각막염 연구들에서 콘택트렌즈와 관련된 비율은 You et al22의 16.0%, 서부 경남 지역 Park et al23의 18.4%, 광주 전남 지역 Noh et al24의 11.9% 등으로 보고되어 본 연구 결과와 비슷하였다. 한편 2000년 이전에 시행된 다병원연구에서는 콘택트렌즈 관련 비율을 33.6-42.0%로 보고하여 본 연구에 비해 높았다.12,25 이러한 차이는 해당 연구들에서 수도권 지역 병원의 비율이 높아 외상 등의 원인보다 콘택트렌즈가 상대적으로 많은 비중을 차지하였기 때문으로 생각된다. 또한 본 연구에서 25년의 기간 동안 세균각막염 중 콘택트렌즈가 관련된 비율은 전체적으로 약한 증가 추세를 보였다. 하지만 이러한 역학적 특징은 연구 기관의 지역적 및 의료전달체계 특성이 반영되어 나타나는 결과이므로 단일기관 연구의 결과를 일반화하기에는 다소 무리가 있으며 향후 다기관 연구에서 확인되어야 할 것이다.
CLBK에서 배양 양성률은 본 연구에서 55.6%였으며, 전체 세균각막염의 배양 양성률 37-42%에 비해 다소 높은 경향이었다.6,12,13 이는 타 연구들에서도 비슷하였는데, 콘택트렌즈 감염각막염의 배양 양성률은 국내의 Tchah et al12 (54.0%), 터키의 Karaca et al5 (64.5%), 브라질의 Agi et al13 (52.9%) 등의 보고에서처럼 비교적 높은 경향을 보이고 있었다. 이는 콘택트렌즈 착용이 가지는 특성과 연관되는 것으로 생각된다. 구체적으로 콘택트렌즈 착용 시 각막과 콘택트렌즈 사이의 밀폐된 공간에서 세균이 생물막(biofilm)을 형성하여 고농도의 항생제를 견딜 수 있는 환경이 조성되며, 눈물의 세척 작용의 영향을 적게 받는다는 것이 제시된 바 있다.26-28 또한 생물막은 그람양성균 및 그람음성균 모두에서 생성될 수 있는데,29 이는 세균의 부착과 증식에 좋은 환경으로 작용하여 세척이나 소독 시에도 균이 제거되는 것을 방해하고, 항체나 대식세포 등 생체면역방어 기전에 저항성을 보이는 기전으로 작용할 수 있다.30 임상적으로 감염각막염으로 여겨지는 경우에는 배양검사를 통해 미생물을 확인하는 노력이 중요하다. 한편 그럼에도 불구하고 배양검사 결과에서 균주가 검출되지 않는 경우를 볼 수 있는데, 이는 검체 획득 과정 및 배지 접종 측면에서 검체 양이 충분하지 않은 것이 원인으로 제시되었다.31 이외에도 이전 항생제 사용이 있었거나, 이전 항생제 사용 기간이 긴 경우가 언급되었으며 이는 균의 증식 지연으로 인한 결과라고 하였다.32,33 배양 결과를 얻지 못한 경우 임상 경과에 따라 반복적인 미생물검사를 시행하여 원인 균주를 확인하는 노력이 필요할 것이다.
그람음성균 비율은 본 연구에서 85%로 우세하였으며 흔한 균주는 Pseudomonas spp. (27%)와 Serratia spp. (26%)였다. 그람음성균 비율을 타 국내 다기관 연구와 비교하였을 때 Tchah et al12은 90.6%로, You et al22은 복합감염을 제외한 후 그람음성균 비율을 75%로 보고하여 본 연구와 유사하였다. 국외의 경우에도 영국의 Ting et al34은 CLBK에서 그람음성균이 66.7%였고 그중 Pseudomonas spp.가 51.1%로 가장 많았다고 하여 본 연구와 비슷하였다. Pseudomonas spp.의 콘택트렌즈 부착에 대한 실험 연구에서 Pseudomonas spp.의 편모(flagellum)와 섬모(pilus)는 콘택트렌즈 표면과의 부착을 매개하는 주요 구조물임이 밝혀진 바 있으며,35 녹농균의 이러한 특징은 각막염 및 각막궤양의 발생과 연관됨이 보고되었다.36 또한 Serratia spp.의 경우 Mayo et al37에 의하면 chlorhexidine과 benzalkonium chloride가 포함된 렌즈소독액에서 생존할 수 있다고 하였으며, 콘택트렌즈에 biofilm을 형성한 Serratia spp.는 백혈구의 식균 작용에 내성을 갖는다고 보고한 바 있다. 이러한 결과들은 CLBK에서 그람음성균이 우세한 경향을 보이는 근거가 될 수 있다.
한편 BCL의 경우 다른 콘택트렌즈와는 다른 균주 분포를 보였다. 대표적으로 그람양성균 비율은 BCL에서 43%로 다른 콘택트렌즈(10.5%)에 비해 높았다(p=0.006). 이는 굴절교정용 렌즈와 달리 BCL은 안구표면질환에서 각막 보호 및 상피재생 촉진을 목적으로 사용된다는 점과 관계될 수 있다. BCL 착용 후 각막상피결손 부위에 이미 존재하던 정상세균총(normal flora) 또는 병원균의 증식으로 인한 감염 악화가 발병 원인이 될 수 있는데, 안검 정상세균총의 균주 분포에 대해 Ratnumnoi et al38은 coagulase-negative staphylococcus (58.3%), Streptococcus spp. (2.5%)가 흔하였다고 하였고, Graham et al39은 정상안의 결막배양에서 S. epidermidis (75.5%)가 흔하게 동정되었다고 하는 등 높은 그람양성균 비율을 보고하였다. 이는 BCL군에서 안구 정상세균총이 약화된 안구표면에 침투하여 병원균으로 작용하였을 가능성을 시사한다.
역학적 측면에서 성별과 증상 기간은 CP군과 CN군 사이에 유의한 차이가 없었으며, 평균 나이는 CP군에서 27.0세로 CN군의 33.8세에 비해 유의하게 낮았다. 증상 기간은 본 연구에서 CP군 6.7일, CN군 7.2일로 나타났는데, 이전 국내 감염각막염 연구에서도 증상 기간을 평균 6.9-8.6일로 보고하여 본 연구와 유사하였다. 또한 국내 연구에서 배양 양성군과 배양 음성군 사이에 증상 기간의 유의한 차이가 없다고 보고한 바 있다.40 한편 외국의 연구를 살펴보면, 터키와 미국의 연구에서는 배양 양성군에서 증상 기간이 더 길다고 보고하였으나,16,41 인도 Bhadange et al42의 연구에서는 배양 음성군에서 증상 기간이 27.6일로 배양 양성군의 14.4일보다 더 길다고 보고하였다. 국가에 따른 증상 기간의 다양한 차이는 국가별 의료 환경의 차이 또는 의료기관 접근성과도 연관이 있을 것으로 생각된다. 이를 뒷받침하는 자료로서 경제협력개발기구(Organisation for Economic Co-operation and Development, OECD)가 제공하는 OECD Health Statistics 2021 통계(https://stats.oecd.org/)에 의하면 연간 환자 1인당 외래방문 횟수(2021년)를 OECD 평균 6.0회, 터키 8회 그리고 한국 15.7회로 보고한 바 있어, 한국에서의 의료 접근성이 타 국가들에 비해 상대적으로 높았다는 것을 시사하였다.
선행인자 중 이전 안과 질환 과거력 및 전신 질환 비율은 CP군과 CN군 사이에 차이가 없었다. 그중 내원 전 점안 항생제 노출 비율은 두 군 간 유의한 차이는 없었으나 CP군(39.2%)에 비해 CN군(52.4%)에서 약간 높은 경향을 보였다(p=0.130). 배양검사 전 점안 항생제 사용 여부가 세균각막염의 배양 양성률에 미치는 영향에 대해서는 여러 연구들에서 보고된 바 있다. 네덜란드의 van der Meulen et al32의 연구에 따르면 감염각막염에서 배양검사 전 점안 항생제 사용군에서 배양 양성률이 41.3%, 사용하지 않은 군은 68.7%로 유의한 차이를 보였으며, 배양검사 전 점안 항생제 사용이 균의 증식 지연과 연관 있는 것으로 추측하였다. 이와 비슷하게 연속착용콘택트렌즈 착용자를 대상으로 시행한 호주의 Ozkan et al43의 전향적 연구에서는 0.3% tobramycin을 점안한 군에서 안구 검체의 미생물 수가 항생제를 사용하지 않은 군보다 유의하게 적었다고 하였다(p=0.01). 또한 터키의 Yarimada et al16은 내원 전 점안 항생제 노출 비율이 배양 양성군(36.7%)보다 배양 음성군(45.9%)에서 상대적으로 더 높았다고 하였다. 반면 Sharma et al33은 배양검사 전 점안 항생제 사용 여부보다는 점안 항생제 사용 기간이 길고 증상의 지속 기간이 길수록 배양검사에서 균 검출 가능성이 낮아지는 것으로 설명하였다.
부적절한 콘택트렌즈 사용으로서, 첫째로 콘택트렌즈를 하루 12시간 이상 착용하는 경우가 CP군(54.4%) 및 CN군(50.8%) 모두에서 가장 많았다. 이와 관련된 연구로 홍콩의 Boost et al44은 매일착용콘택트렌즈를 하루 사용 후 콘택트렌즈 보관액(blister pack saline)에 1일간 보관한 뒤의 미생물 배양 비율을 조사한 바 있다. 한 환자당 1달간 5쌍의 검체를 얻어 조사한 결과 95%의 환자에서 적어도 한 검체 이상에서 균이 배양되었다고 보고하였다. 이 결과에 대해 Boost et al44은 콘택트렌즈를 다룰 때의 손 위생 불량과 콘택트렌즈 보관액의 재사용이 감염의 원인일 것이라고 언급하였다. 두 번째로, 수면 시 콘택트렌즈의 착용 비율은 CP군에서 상대적으로 높은 경향이었으며 유의한 차이는 보이지 않았다(36.7% vs. 23.8%, p=0.105). 국내의 Tchah et al12의 연구에서는 수면 시 렌즈 착용과 관련된 경우가 17.1%로 본 연구의 31.0%에 비해 다소 낮았다. 각막염 발병 위험 측면에서는 호주의 Stapleton et al9은 수면 시 콘택트렌즈의 착용이 콘택트렌즈 관련 각막염의 발생 위험을 6-8배 높인다고 보고한 바 있다. 세 번째로, 물 노출과 관련한 이전 보고로 영국의 Stellwagen et al45은 콘택트렌즈를 착용한 채로 샤워한 케이스에서 각막염의 위험도가 높았다고 보고한 바 있다(odds ratio, 3.1; 95% confidence interval, 1.2-8.5; p=0.03). 또한 싱가포르의 Lim et al8의 연구에서는 샤워 중 콘택트렌즈 착용(p=0.008)과 불량한 손 위생(p=0.002)을 콘택트렌즈 관련 감염각막염의 유의한 위험인자로 보고하였다. 이와 같이 콘택트렌즈 착용 중 물에 노출되는 것은 각막염 발병 위험인자로 작용할 것으로 생각되지만 물 노출과 배양 양성률과의 관계에 대해서는 아직 알려진 바가 드물며, 본 연구에서는 CP군보다 CN군에서 물 노출 비율이 높게 나타나는 결과를 보이기도 하였다(20.3% vs. 42.9%, p=0.006). 물 노출과 배양 양성의 관계에 대해서는 향후 추가적인 연구가 필요한 부분이다. 마지막으로, 콘택트렌즈 교체주기 초과 사용은 CP군에서 CN군에 비해 높은 경향이었다(12.7% vs. 6.3%, p=0.264). 렌즈 교체주기 초과에 관련한 국내의 이전 보고에 의하면, 연속착용콘택트렌즈 착용 시 교체주기를 초과하여 장기 착용하는 경우가 30%였다고 보고하였고 이 가운데 3%는 25개월 이상 착용하였다고 하여 본 연구에 비해 높았다.46 수면 시 콘택트렌즈 착용 및 렌즈 교체주기 초과 사용은 장시간 렌즈 착용과 관련되어 상대적으로 세균 증식 촉진 기회가 증가할 것으로 생각된다. 이러한 특징들은 배양 양성률과도 일부 연관될 것으로 추측되지만 본 연구 결과만으로는 확인할 수 없었다.
사용된 콘택트렌즈 종류 중 소프트렌즈가 CP군(81.0%)과 CN군(66.7%) 모두에서 가장 높은 비율을 차지하였다. 이와 비슷하게 국내의 Tchah et al12은 콘택트렌즈 연관 감염각막염 다병원연구에서 소프트렌즈 비율을 96.8%로 보고한 바 있으며, Kim et al2은 콘택트렌즈 합병증으로 내원한 환자의 46.6%가 소프트렌즈 착용자였다고 하였다. 미용 콘택트렌즈 사용은 본 연구에서 10.6%로 나타났으며 CP군(7.6%)과 CN군(14.3%) 사이에 차이가 없었다. 여러 콘택트렌즈 관련 질환에서 미용콘택트렌즈의 비율은 12.5-42.4%로 보고되고 있다.2,47 Bourcier and Sauer48는 미용콘택트렌즈가 다른 굴절교정용 렌즈에 비해 감염각막염 위험이 16.5배 높다고 하였는데, 그 이유로 미용콘택트렌즈가 가지는 낮은 산소투과율과 렌즈 표면 거칠기로 세균 증식을 용이하게 하기 때문이라고 하였다.49 연속착용콘택트렌즈 착용 비율은 CP군에서 12.7%로 CN군의 6.3%에 비해 다소 높았지만 통계적으로 유의한 차이는 없었다(p=0.210). 연속착용 콘택트렌즈는 동일 렌즈를 장기간 사용하게 되므로 렌즈의 주기적인 교체나 세척이 제대로 이루어지지 않는다면 감염의 위험이 커질 수 있다. 미용콘택트렌즈 착용과 연속착용 렌즈 착용은 감염 발병의 위험인자로 생각되지만 배양 양성과의 유의한 관계는 본 연구에서 확인할 수 없었다.
BCL의 경우 배양 양성률이 37.9%로 전체 CLBK에서의 55.6%에 비해 낮았다. 이에 대한 이유로 동반된 안구표면 질환의 치료를 위한 BCL 착용과 함께 내원 전부터 점안 항생제가 사용되었기 때문으로 생각되었으나, BCL 사용 여부에 따른 이전 점안 항생제 사용 비율의 유의한 차이는 확인되지 않았다(BCL 36.4% vs. non-BCL 39.7%, p=1.000). 이외에 점안 항생제 사용 기간이 길수록 배양 양성률의 저하와 연관될 수 있다는 보고가 있으나,33 본 연구의 후향적 연구 특성상 정확한 사용 기간까지는 확인할 수 없었다.
임상 양상 측면에서 보았을 때, CP군과 CN군 사이에 유의한 차이를 보이는 인자는 없었다. 그중 전방염증의 정도는 시력 예후를 결정하는 중요한 위험 요소로 알려져 있어,14 전방축농의 여부는 감염각막염에서 중증도의 지표가 될 수 있다. 본 연구에서 전방축농은 CP군(12.7%)에서 CN군(3.2%)에 비해 상대적으로 더 높은 비율을 보였지만 통계적 유의성까지는 보이지 않았다(p=0.066). 전체 세균각막염에 대해 국내의 Kim et al15은 전방축농 비율이 배양 양성군(15%)과 배양 음성군(14%) 사이에 유의한 차이가 없었다고 하여 본 연구와 유사하였다(p=0.80). 한편 전체 감염각막염을 대상으로 Noh et al24은 전방축농이 배양 양성군(34.4%)에서 배양 음성군(12.8%)보다 많았다고 하였으며(p=0.001), 미국의 Stein et al17 또한 콘택트렌즈 감염각막염에서 배양 양성군이 배양 음성군에 비해 전방염증의 비율이 더 높았다고 하였고(80% vs. 30%), 영국의 Ting et al34은 전체 세균각막염의 배양 양성군에서 전방축농이 더 많았다고 보고하였다. 일반적으로 배양 양성군은 배양 음성군에 비해 미생물 균주의 증식과 군집 형성이 상대적으로 더 활성화되어 있을 것으로 기대되며, 이로 인해 전방축농 발생 또한 상대적으로 많을 것으로 생각된다. 초진 시력은 본 연구의 CP군(0.85 logMAR)과 CN군(0.93 logMAR) 사이에 차이가 없었다. 국내의 Noh et al24은 감염각막염에 서 초진 최대 교정시력이 배양 양성군에서 배양 음성군보다 유의하게 나빴다고 보고하여 차이를 보였지만, 터키에서 시행한 Yarimada et al16의 세균각막염 연구에서는 배양 여부에 따른 초진 시력 차이가 없었다고 하여 본 연구와 유사한 결과를 보였다.
치료 결과에서 CP군과 CN군 사이에 유의한 차이를 보이는 인자는 없었다. 상피재생 완료기간은 본 연구에서 CP군(8.5일)과 CN군(7.6일) 사이에 차이가 없었다. 비슷하게 Noh et al24은 전체 각막염에서 배양 양성군과 배양 음성군 사이에 상피재생 완료기간의 유의한 차이가 없다고 하였으며(11.5 vs. 10.0일, p=0.791), 전체 세균각막염을 대상으로 한 Kim et al15의 연구에서도 배양 양성 여부에 따른 상피 재생 완료기간의 유의한 차이는 없었다고 하여 본 연구와 유사하였다. 불량한 치료 결과의 비율은 본 연구에서 CP군(16.4%)과 CN군(17.5%) 사이에 통계적으로 유의한 차이를 보이지 않았으며, 이와 비슷하게 이전 국내의 연구들에서도 배양 여부는 불량한 치료 결과나 평균 치료 기간에 유의한 차이가 없다고 보고한 바 있다.15,40 이외에 인도, 터키, 영국 등 국외의 연구들에서도 배양 양성 여부에 따라 치료 실패 비율, 치료 전후 시력의 변화, 또는 수술적 치료 시행의 유의한 차이가 없었다고 하여 본 연구와 비슷한 경향을 보였다.16,34,42 이러한 결과에 대해 Kim et al15은 세균각막염에서 배양 양성 자체보다 환자 연령과 면역 상태, 안구표면의 방어 기전 및 그로 인한 초기 손상 정도가 치료 결과에 영향을 줄 것이라고 추측하였다.
불량한 치료 결과에 이르는 유의한 위험인자로는 전체군과 CP군에서 공통적으로 심부기질침윤, 상피결손 크기 5 mm2 이상, 상피재생 기간 7일 이상, 초진 시력 0.1 미만 그리고 콘택트렌즈 교체주기 초과 사용이었으며, CP군에서는 전방축농과 물 노출이 추가로 포함되었다. 호주의 Stapleton and Carnt50는 CLBK에서 불량한 치료 결과의 위험인자로서 적절한 치료의 지연, 콘택트렌즈 보관 케이스의 위생 관리, 연속착용콘택트렌즈 착용을 보고한 바 있다. 한편 전체 세균각막염에서 치료 결과에 영향을 미치는 인자는 여러 국내외 연구들에서 고령, 중심부 각막 병변, 상피결손 크기 5 mm2 이상, 안과 수술력, 전방축농, 이전 안구표면질환, 당뇨, 불량한 초진 시력, 낮은 교육수준, 심한 전방염증, 긴 증상 기간, 심부기질침윤 및 이전 점안 스테로이드제 사용 등이 보고되었다.14,15,22,34,51 이와 같이 전체 세균각막염과 CLBK에서 불량한 치료 결과에 영향을 미치는 인자는 공통적으로 초기 손상 정도와 관련된 인자가 언급되었다. 추가로 CLBK에서는 콘택트렌즈와 관련된 인자, 그중에서도 부적절한 렌즈 사용과 관련된 인자들이 포함된 것을 알 수 있었다. 이는 콘택트렌즈의 사용 시 적절한 관리의 중요성을 강조하는 결과로 생각되며, 부적절한 렌즈 사용은 합병증 발생 위험을 증가시킬 뿐만 아니라 치료 결과 불량에도 직접적으로 관여할 수 있다는 것을 시사한다.
본 연구의 결과를 토대로 할 때, 콘택트렌즈 관련 세균각 막염에서 배양 양성 그 자체가 반드시 불량한 임상 양상이나 치료 결과를 보이지는 않았음을 알 수 있었다. 이는 증례에 따라 다양한 초기 임상 양상을 보였으며, 증상 기간 및 이전 점안 항생제 사용 여부 등이 배양 결과 및 치료 결과에 종합적인 영향을 미친 결과로 생각된다. 실제 임상 상황에서는 배양 양성 여부 그 자체보다 부적절한 콘택트렌즈 사용이나 초기 손상 정도가 치료 결과에 더 중요한 요인인 것으로 생각되었다. 이는 콘택트렌즈 착용에 있어 올바른 사용 및 관리 교육이 중요함을 시사한다.
본 연구에는 몇 가지 제한점이 있다. 첫째, 후향적인 의무기록 분석 연구의 한계로서 콘택트렌즈 자체 또는 보존액에 대한 배양검사가 모든 증례에서 시행되지는 못하였다. 향후 전향적 코호트 연구를 실시하여 각막찰과 및 콘택트렌즈 자체 그리고 보존액에서의 균주 분포들을 따로 분석한다면 임상적으로 더욱 유용한 자료로 쓰일 수 있을 것이다. 둘째로, 감염각막염의 역학 및 임상 특징은 연구가 시행된 지역적 특성 등에 따라 차이를 보일 수 있어 본 연구 결과를 국내 전체로 일반화하기에 제한이 있다. 그럼에도 불구하고 본 연구는 25년간 장기간의 비교적 많은 수의 환자를 대상으로 하여 콘택트렌즈 관련 세균각막염의 배양 양성 여부에 따른 임상적 특징과 치료 결과를 분석하였다는 점에서 임상적 가치가 있을 것으로 생각된다. 이 연구가 콘택트렌즈 관련 세균각막염의 특징에 대해 참고할 수 있는 기초 자료가 될 수 있을 것으로 생각된다.
결론적으로 CLBK에서 CP군과 CN군 사이에 임상 양상 및 치료 결과의 유의한 차이는 없었다. CLBK에서 흔한 균주는 Pseudomonas spp. (27%)와 Serratia spp. (26%) 등 그람음성균 비율이 높았으나, BCL에서는 상대적으로 높은 그람양성균 비율을 보였다. 전체군에서 배양 양성 그 자체는 불량한 치료 결과에 이르는 유의한 위험인자가 아니었으며, 심부기질침윤, 상피재생 완료기간 7일 이상, 초진시력 0.1 미만, 콘택트렌즈 교체주기 초과 사용 그리고 상피 결손 5 mm2 이상이 유의한 위험인자였다. 본 연구 결과는 콘택트렌즈 착용자에게 올바른 콘택트렌즈 사용과 관리 방법 교육의 중요성을 강조하는 의미가 있다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
손성근 / Sunggeun Son
영남대학교 의과대학 안과학교실
Department of Ophthalmology, Yeungnam University College of Medicine