 |
 |
| J Korean Ophthalmol Soc > Volume 64(2); 2023 > Article |
|
국문초록
대상과 방법
2011년부터 2021년까지 미세절개유리체절제술로 특발 망막앞막 수술 후 급성 안내염이 발병한 증례들의 의무기록을 분석하였다. 안내염의 발생률, 배양 양성 비율 및 균주, 최종 시력에 대해 조사 후 불량한 시력 예후에 영향을 주는 인자들을 조사하였다.
결과
총 12,921안에서 미세절개유리체절제술 후 20안(0.15%)에서 급성 안내염이 발생하였다. 그중 3,180안의 특발 망막앞막 증례들에서 14안의 안내염이 발생하여 발생률과 발생률비는 각각 0.44% 및 7.1이었다(p<0.001, 95% confidence interval [CI]=2.6-22.7). 14안 모두 특발 망막앞막 수술 시 하나 이상의 공막창을 봉합하지 않았다. 안내염 진단 후 13안은 응급 유리체절제술 후 유리체내 항생제 주사를 시행하였고 1안은 유리체내 항생제 주사만으로 치료되었다. 배양 결과 4안(28.6%)에서 모두 표피포도구균이 배양되었고 3안은 메티실린 내성이었다. 최종 시력은 모든 증례들에서 첫 수술 전 시력보다 호전되지 않았고, 그 평균은 20/42에서 20/259로 감소하였다(p<0.001). 법적 실명에 해당하는 20/200 이하의 최종 시력은 6안(42.9%)으로 안내염의 황반 침범은 실명 위험이 높은 단일 소견이었다(p=0.020, odds ratio=35.0, 95% CI=1.7-703.0).
ABSTRACT
Purpose
To investigate the incidence and clinical course of acute endophthalmitis after idiopathic epiretinal membrane (iERM) surgery employing microincision vitrectomy (MIVS).
Methods
We retrospectively reviewed the medical records of eyes with acute endophthalmitis developing after iERM surgery via 23- or 25-gauge MIVS from 2011 to 2021. The incidence, culture-positive rate (and responsible bacteria), final visual acuity (VA), and factors affecting poor visual outcomes were assessed.
Results
Acute endophthalmitis developed in 20 of the 12,921 eyes (0.15%) after MIVS. Of these, 14 of 3,180 eyes treated via iERM (0.44%, one per 227 procedures) developed endophthalmitis; the incidence ratio (iERM versus non-iERM) was 7.1 (p < 0.001, 95% confidence interval [CI] = 2.6-22.7). At least one sclerotomy remained unsutured in all eyes after iERM surgery. Thirteen eyes (92.9%) were given intravitreal antibiotic injections after emergency vitrectomy, and one eye was treated with intravitreal antibiotic injection alone. Staphylococcus epidermidis was cultured from four eyes (28.6%); three strains were methicillin-resistant. All final VAs were not better than the initial VAs; the average VA decreased from 20/42 to 20/259 (p < 0.001). Six eyes (42.9%) attained legal blindness status (final VA < 20/200); Macular invasion was a unique risk factor for such blindness (p = 0.020, odds ratio = 35.0, 95% CI = 1.7-703.0).
망막앞막은 40세 이상에서 약 3%의 유병률로 흔하게 발견되는 망막 질환이며 고령일수록 유병률도 증가한다.1 특발 망막앞막은 기저 질환 없이 망막표면에 증식막이 형성된 후 이들의 수축과 견인으로 인한 황반의 변형으로 변시증과 시력저하가 주증상으로 나타나는 질환이며,2 유리체절제술 및 막 벗김으로 황반의 견인을 해소하여 치료한다. 수술 후 더 나은 시력과 재발 방지를 위해 백내장수술 및 내경계막 벗김을 동시에 시행하기도 한다.3,4 2000년 이후 유리체절제기의 성능 향상과 더불어 눈 속 기구가 작고 견고해지면서 25게이지 무봉합 미세절개유리체절제술(microincision vitrectomy surgery)은 고식적인 20게이지 봉합 유리체절제술보다 수술 시간을 단축시키고 봉합사 주위 염증 및 안구 불편감도 완화시켰다.5 특발 망막앞막 수술도 무봉합 미세절개유리체절제술을 통해 술 후 결막충혈과 안구 통증이 이전의 봉합 유리체절제술보다 감소하였고 국소마취 후 짧은 시간 내 수술이 가능하여 매년 수술 횟수가 급격히 증가하고 있다.5,6
술 후 안내염은 결막 정상 세균총이나 오염균이 기구나 창상을 통해 유리체강 내부로 전파되어 안구 내 염증을 일으키는 질환이다.7 국가 단위 대규모 연구에서 백내장수술 후 안내염 발생률은 0.05%로 낮았다.8 봉합 유리체절제술 후 안내염도 백내장 술 후 안내염과 비슷한 0.06%로 보고되었다.9 반면 무봉합 미세절개유리체절제술 도입 후 안내염 발생률은 봉합 유리체절제술 및 백내장 술 후 안내염보다 높은 0.16-0.84%까지 도달할 수 있음이 보고되었다.10 다행히 소독 기술, 항생제, 수술 기구의 발달에 힘입어 미세절개유리체절제술 후 안내염의 발생률은 점차 낮아지고 있다.11
무봉합 미세절개유리체절제술로 망막앞막 수술 후 급성 안내염이 많이 발병하였던 소수의 보고가 있었다. 2008년 무봉합 미세절개유리체절제술 후 발병한 안내염 보고에서 망막앞막 수술 후 발생한 안내염이 다수를 차지하였다.10 10년 동안의 국가 데이터베이스 분석을 통한 황반 수술 후 급성 안내염에 관한 보고에서, 망막앞막 수술 후 급성 안내염은 전층 황반원공수술 후 안내염보다 두 배 이상 많이 발생하였다.12 특히 봉합 유리체절제술을 선호했던 2009년 이전의 망막앞막 수술 후 안내염 발생률보다 미세절개유리체절제술이 도입된 2010년 이후의 안내염 발생률이 높았다.12
특발 망막앞막 수술은 망막앞막과 내경계막을 가시화하기 위한 다양한 시약들을 사용하고, 기구의 유리체내 주입이 빈번하며,13 주변부 망막과 유리체 이상이 드물어 주변부 유리체를 보존하는 경향이 있다. 또한 열공망막박리 및 황반원공과 같이 유리체절제술이 필요한 다른 망막 질환들보다 상대적으로 수술 전 시력이 양호하여 급성 안내염으로 인한 시력상실은 환자에게 상실감을 안겨줄 수 있다. 그럼에도 불구하고 지금까지 국내에서 특발 망막앞막 수술 후 급성 안내염이 이환된 환자들의 발생률, 임상 경과 및 불량한 시력 예후에 관여하는 인자들에 대해 조사한 보고는 없었다. 이에 저자들은 미세절개유리체절제를 통한 특발 망막앞막 수술 후 발병한 급성 안내염 환자들을 조사하여 그 발생률과 임상 경과에 대해 보고하고자 한다.
2011년 1월부터 2021년 12월까지 본원 및 분원에서 특발 망막앞막을 진단받고 유리체절제술을 시행한 눈에서 6주 이내에 안내염이 발병한 환자들의 의무기록을 후향적으로 분석하였다. 23 혹은 25게이지 미세절개유리체절제술만 포함하였고 20게이지 봉합 유리체절제술을 시행하였거나 20게이지 공막창과 미세절개 공막창을 혼용한 수술의 경우는 제외하였다. 이차성 망막앞막으로 수술 후 급성 안내염이 발병한 경우도 제외하였다. 이전 녹내장수술 및 유리체절제술 병력이 있는 경우는 제외하였고 각막굴절교정술 및 백내장수술 병력은 제외하지 않았다. 본 연구는 본원(IRB No. 2206-012-116) 및 분원(IRB No. 05-2022-119)의 생명윤리위원회 승인 후 헬싱키선언을 준수하였다.
미세절개유리체절제술로 특발 망막앞막 수술 후 발생한 급성 안내염의 발생률을 조사하기 위해, 해당 기간 안내염 치료 목적을 제외하고 미세절개유리체절제술을 처음 경험한 증례들의 수를 기록하였다. 그중 특발 망막앞막으로 미세절개유리체절제술을 경험한 증례들 및 급성 안내염이 발병한 증례들의 수를 각각 기록하였다. 특발 망막앞막 이외의 질환으로 미세절개유리체절제술 후 발병한 급성 안내염의 발생률과 비교하기 위해 발생률비(incidence rate ratio)를 조사하였다.
특발 망막앞막 수술 후 급성 안내염이 합병된 증례들의 최종 시력에 영양을 주는 인자들을 조사하기 위해 특발 망막앞막 술 전 인자, 특발 망막앞막 수술 인자 및 안내염 관련 인자로 나누어 조사하였다. 특발 망막앞막 술 전 인자로 수술 시행 기관, 술자, 나이, 성별, 술 안, 기저 질환, 스테로이드 제제 복용 및 점안 유무, 평균 교정시력, 평균 중심황반두께, 평균 안압 및 바이스 고리(weiss ring) 유무에 따른 후유리체박리 상태를 조사하였다. 수술 인자로 공막창 크기, 백내장수술 병합 및 투명각막절개 봉합 유무, 내경계막 벗김 유무 및 크기, 유리체 및 내경계막 가시화를 위해 사용한 시약, 공막창 봉합 유무, 수술 소요 시간, 마취 종류 및 술 후 점안 항생제 안약의 종류와 점안 방법에 대해 조사하였다. 안내염 관련 인자로 CCLRU14 기준에 따른 결막 충혈을 포함한 안내염 증상, 의무기록 조사를 토대로 첫 수술 후 안내염 증상 발생 및 진단 시점까지 기간, 안내염 진단 시 교정시력 및 안압, Standardization of Uveitis Nomenclature (SUN) Working Group15에 따른 전방세포, 전방축농 및 Nussenblatt et al16의 연구에서 제안한 유리체혼탁의 단계를 조사하였다. 새벽, 오전, 오후처럼 시점이 모호하게 기록되어 있는 경우 새벽은 6시, 오전은 10시, 오후는 14시, 저녁은 18시, 밤은 22시 및 한밤중은 2시로 변환 후 계산하였다. 수술 기록 혹은 동영상을 참조한 안내염의 망막 및 황반 침범 유무, 망막출혈, 망막혈관염 및 망막박리의 유무를 조사하였다. 유리체 검체의 배양 양성 유무와 균주를 조사하였다. 유리체내 항생제 주사 횟수, 전신 항생제 사용 유무와 기간, 이차 수술 시행 유무를 조사하였다. 안내염 첫 치료를 시작한 시점과 안내염 증상 발생 시점 및 안내염 진단 시점과의 기간을 조사하였다. 첫 안내염 치료 후 3주, 3개월 및 최종 경과 관찰 시점까지 평균 교정시력 및 안압, 전방세포, 유리체혼탁 및 망막박리 유무를 조사하였다.
특발 망막앞막 수술의 시작과 종료 시 5% 포비돈 요오드 희석 용액으로 결막을 세척하였다. 구후 혹은 전신마취 후 평면부 공막창을 통한 표준 3-port 미세절개유리체절제기(The CONSTELLATION® Vision System, Alcon Laboratories Inc., Fort Worth, TX, USA)를 사용하였다. 후유리체 가시화가 필요한 경우 트리암시놀론을 주입하여 후유리체박리 여부를 확인하고, 후유리체박리가 일어나지 않은 경우 적도 부위까지 박리를 일으킨 후 중심부 유리체를 절제하였다. 망막앞막 벗김 후 술자의 판단에 따라 내경계막 벗김을 추가로 시행하였다. 내경계막 가시화가 불충분한 경우 0.025% brilliant blue G (BBG) 혹은 0.05% indocyanine green (ICG)으로 가시화하였다. 종료 시점에 공막창이 자기폐쇄(self-sealing)된 경우 봉합하지 않고 공막누르개로 공막창을 압박하여도 누출이 지속되는 공막창들은 흡수사로 봉합하였다.
이차 수술은 안내염 진단 시점에 각막혼탁, 전방염증 및 유리체혼탁으로 안저검사를 통해 황반의 해부학적 상태를 확인할 수 없었던 경우 시행하였다. 유리체절제침으로 유리체를 흡인하여 0.2 mL의 검체를 획득 후 소아 혈액배양병(BacT/Alert® PF, bioMérieux, Marcy l'Etoile, France)에 접종하였다. 잔여 주변부 유리체를 절제 후 0.1 g/mL vancomycin (Vancocin CP 500 mg, Penmix Inc., Seoul, Korea)을 500 mL 보강 평형염액(Balanced Salt Solution, Alcon Laboratories, Fort Worth, TX, USA)에 1 mL를 주입하여 유리체강을 세척하였다. 이후 1.0 mg vancomycin (Vancocin CP 500 mg, Penmix Inc.)과 2.25 mg ceftazidime (Tazime 1 g, Hanmi Pharm, Seoul, Korea)을 각각 유리체내 주사하였다. 첫 치료로 유리체내 항생제 주사를 시행한 경우 26게이지 바늘이 장착된 2 mL의 주사기로 0.2 mL의 유리체 검체를 획득 후 소아 혈액배양병에 접종한 뒤 1.0 mg vancomycin (Vancocin CP 500 mg, Penmix Inc.)과 2.25 mg ceftazidime (Tazime 1 g, Hanmi Pharm)을 각각 0.1mL의 용량으로 유리체내에 주사하였다.
발생률비 계산은 Exact Poisson 검정을 사용하였고 평균 시력의 비교는 Wilcoxon signed rank 검정을 사용하였다. 최종 시력이 20/200 이하로 저하된 경우를 법적 실명으로 정의하고,17 법적 실명에 따른 조사 인자들의 차이를 확인하기 위해 비모수 검정인 Fisher’s exact probability 혹은 Mann-Whitney U 검정을 시행하였다. 법적 실명에 영향을 미치는 인자들을 조사하기 위해 특발 망막앞막 술 전 인자, 수술 인자 및 안내염 관련 인자들을 독립변수로 하여 단변량 로지스틱 회귀분석(univariate logistic regression)을 시행하였다. 통계 분석은 MedCalc® version 20.113 (MedCalc Software Ltd., Ostend, Belgium)과 SPSS version 20.0 (IBM Corp., Armonk, NY, USA)을 사용하였고 p값이 0.05 미만인 경우 통계적으로 유의하다고 정의하였다.
11년간 총 12,921안이 미세절개유리체절제술을 처음 경험하였고 3,180안은 특발 망막앞막으로 수술하였다. 그중 술 후 급성 안내염은 20명이 발생하였고 14안은 특발 망막앞막 수술 후 발병한 안내염이었다. 미세절개유리체절제술 후 급성 안내염의 발생률은 0.15%였다. 특발 망막앞막으로 미세절개유리체절제술 후 급성 안내염의 발생률은 0.44%였고 특발 망막앞막 이외의 질환으로 수술 후 급성 안내염의 발생률은 0.06%로, 그 발생률비는 7.1이었다(p<0.001, 95% confidence interval [CI]=2.6-22.7).
관찰 기간 중 14안의 급성 안내염 증례들을 집도한 술자는 총 7명으로 안내염 발병 시점 이들의 집도 경험은 평균 6.6 ± 4.6년이었다. 특발 망막앞막 수술 후 안내염이 발생한 14안의 최종 경과 관찰 기간은 첫 수술 후 평균 2.4 ± 1.9년이었다. 안내염이 발생한 14안의 평균 나이는 67.8세로 그중 11안(78.6%)이 여성이었고, 또한 10안(71.4%)은 좌안으로, 여성과 좌안에서 더 많이 발생하였다. 고혈압과 당뇨 병력은 각각 6안 및 1안에 존재하였다. 모든 환자들은 만성신부전 병력 및 6개월 이내의 스테로이드 복용 및 점안 병력이 없었다. 수술 전 평균 교정시력은 0.32 logarithm of the minimum angle of resolution (logMAR), 평균 중심망막두께는 426.1 μm였고 평균 안압은 13.3 mmHg였다. 수술 전 후유리체박리는 11안(78.6%)에서 존재하였고 3안은 수술 중 후유리체를 박리하였다(Table 1).
특발 망막앞막 수술에서 13안(92.9%)은 구후마취 하에 수술하였고 10안(71.4%)에서 25게이지 삽입관(cannula)을 사용하였다. 백내장 병합수술은 7안에서 이루어졌고 그중 6안은 10-0 폴리프로필렌 봉합사로 투명각막절개창을 봉합하였다. 13안에서 내경계막을 벗겨 그 평균 크기는 3.1 시신경유두 지름이었다. 13안에서 유리체내 시약을 주입하였고 12안(85.7%)에서 트리암시놀론(TAMCETON, Hanall Biopharma, Seoul, Korea; MaQaid®, Wakamoto Pharmaceutical Co. Ltd., Tokyo, Japan), 5안(35.7%)에서 BBG, 다른 5안에서 ICG를 주입했다. 14안 중 어떠한 증례도 모든 공막창을 봉합하지 않았다. 9안(64.3%)은 모든 공막창들을 봉합하지 않았고 5안은 하나 혹은 두 개의 공막창만 봉합하였다. 평균 수술 소요 시간은 49.6 ± 16.0분이었다(Table 2). 수술 후 점안 항생제는 10안에서 4세대 퀴놀론(Moroxacin eye drops 0.5%, Hanmi Pharm., Seoul, Korea), 2안에서 3세대 퀴놀론(Levocle Eye drops 1.5%, Hanlim Pharm, Seoul, Korea), 2안에서 토브라마이신(Tobramycin Eye drops 0.3%, TORAMICIN®, Hanmi Pharm, Seoul, Korea)을 하루 4회 점안하였다.
특발 망막앞막 수술 후 첫날 안압은 13.4 (8-26) mmHg로 저안압은 없었다. 첫 수술 후, 안내염 증상이 발병하기까지 기간은 평균 1.9일이었고 진단 시점은 평균 3.6일이었다. 안내염 진단 시점의 교정시력은 8안(57.1%)이 안전수동으로 가장 많았고, 4안은 안전수지, 1안은 광각인지 및 1안은 20/200이었다. 안내염 진단 시점의 평균 교정시력은 2.10 logMAR로 수술 전과 비교하여 유의하게 낮았고(p<0.001), 평균 안압은 15.9 (8-5) mmHg였다. 안내염 증상으로 11안에서 비문증을 호소하였고 9안에서 안구 통증을 호소하였다. 결막충혈은 평균 2.7 ± 1.1, 전방세포는 평균 3.8 ± 0.8, 유리체혼탁은 평균 2.4 ± 1.1이었다. 13안에서 망막을 침범하여 망막출혈과 망막혈관염이 각각 11안 및 10안에서 관찰되었다. 안내염이 황반을 침범한 경우는 6안(42.9%)이며 2안은 열공망막박리가 동반되었다.
4안(26.7%)에서 표피포도구균(Staphylococcus epidermidis)이 검출되었고 3안은 methicillin에 저항성이 있었지만 vancomycin에는 모두 감수성이 있었다. 안내염 진단 후 평균 3.3시간 뒤 안내염 첫 치료가 시작되었다. 1안은 유리체내 항생제 주사 치료만으로 호전되었고 13안은 응급 유리체절제 및 유리체내 항생제 주사 치료를 하였다. 유리체내 항생제 주사는 평균 1.9 ± 1.3회 시행하였다. 총 10안에서 전신 항생제를 평균 9.0일간 사용하였다(Table 3). 그중 7안은 ceftazidime 2.0 g (Tazime 1g, Hanmi Pharm)과 vancomycin 1.0 g (Vancocin CP 500 mg, Penmix Inc.)을, 2안은 moxifloxacin 0.8 g (Avelox inj 400 mg, Bayer Korea, Seoul, Korea)을, 1안은 ceftriaxone 2.0 g만 매일 정주하였다.
안내염 치료 시작 후 평균 logMAR 교정시력은 3주 후 1.37 ± 0.80, 3개월 후 1.18 ± 0.90 및 최종 경과 관찰 시점에 1.11 ± 0.96으로 호전되어 각 시점들의 시력은 안내염 진단 시점보다 유의하게 호전되었다(all, p=0.005). 안내염 치료 후 전방세포와 유리체혼탁은 유의하게 감소하여 결국 소실되었지만(all, p<0.001), 열공망막박리는 반복된 수술에도 불구하고 유착되지 않았다(Table 4). 총 6안(42.9%)에서 최종 시력이 법적 실명에 도달하였다. 조사 인자들 중 법적 실명에 도달한 군이 유의하게 특발 망막앞막 수술 전 시력이 낮았고(p=0.031), 안내염의 황반 침범이 많았다(p=0.026). 법적 실명 유무를 종속변수 지정한 후 Table 1-3에 열거한 모든 인자들을 하나씩 단일 독립변수로 지정하여 단변량 로지스틱 회귀분석을 통해 법적 실명에 이르게 하는 위험 요인을 조사한 결과, 오직 황반 침범만이 위험 인자였다(p=0.020, odds ratio=35.0, 95% CI=1.7-703.0). 황반을 침범한 증례들의 최종 평균 logMAR 교정시력은 1.88 ± 0.95 (20/1529)로 침범하지 않은 증례들의 최종 평균 교정시력인 0.55 ± 0.43 (20/70)보다 낮았다(p=0.020). 특발 망막앞막 수술 후 안내염이 발병하고 황반을 침범하여 법적 실명에 도달한 증례와 황반을 침범하지 않아 시력이 보존된 증례를 도식화하였다(Fig. 1).
미세절개유리체절제술을 통한 특발 망막앞막 수술 후 급성 안내염의 발생률은 0.44%로 이는 227안의 특발 망막앞막 수술 후 한 명에서 안내염이 발병하는 높은 빈도이며 다른 망막질환의 미세절개유리체절제술 후 발생하는 급성 안내염의 발생률보다 약 7배 높았다. 조사 기간 전체 미세절개유리체절제술 후 급성 안내염의 발생률은 이전의 다른 연구와 비슷하였다.18 이번 연구에서 발병한 안내염의 다수는 특발 망막앞막 수술 후 발생한 안내염(14/20, 70%)이었다. 이는 1,307건의 25게이지 미세절개유리체절제술 후 발병한 11안의 급성 안내염 보고에서 8안이 망막앞막 수술 후 발생하여 약 70%를 차지한 보고와 유사하였다.10 프랑스에서 미세절개유리체절제술이 도입된 2010년부터 7년간의 망막앞막 수술 후 발생한 급성 안내염의 연간 최대 발생률은 0.39%로 본 연구의 특발 망막앞막 수술 후 급성 안내염의 발생률과 유사하였다.12
Scott et al10은 무봉합 유리체절제술 후 안내염이 발병할 수 있는 6가지 인자들을 소개하였다. 1) 공막창 누출로 인한 술 후 저안압 2) 눈 만짐으로 인한 공막창 벌어짐 3) 유리체감돈증후군 4) 고령과 면역저하자 5) 결막하 항생제 미주입 6) 트리암시놀론 등의 유리체내 주입 약물 사용이며, 이번 연구에서 마지막 인자를 제외하고 나머지 인자들은 특발 망막앞막 수술 후 안내염을 유발한 요인으로 고려할 수 없었는데 그 이유는 다음과 같다. 망막앞막 수술 후 첫 날 저안압은 없었고 수술 직후 하루 동안 거즈와 플라스틱 안대를 착용하여 고정한 점을 고려하면 환자 요인으로 안내염이 발생했을 가능성은 낮다. 술 중 유리체감돈은 없었고 안내염이 발병한 모든 환자들은 첫 수술 6개월 이내의 스테로이드 복용 및 점안력이 없었다. 평균 나이는 60대로 초기 고령군이었고 당뇨 환자는 단 1명으로 면역저하자는 없었다. 유리체절제 후 결막하 항생제 주입이 술 후 안내염의 발생을 낮춘다는 확실한 결론은 아직 없으며,19 첫 수술 중 오염원 노출이 의심되어 항생제 주입을 시도한 증례도 없었다. 예상보다 높은 안내염 발병에 기여할 수 있는 특발 망막앞막 수술 중 요소는 봉합하지 않은 공막창으로 결막 세균의 유입, 희석 과정에서 오염될 수 있는 시약들, 막을 벗기기 위한 기구의 잦은 조작, 고배율을 달성하기 위한 현미경의 추가적인 조작, 잔여 주변부 유리체 등을 고려할 수 있다.
유리체절제 시 약 5%의 빈도로 안구표면액에 세균이 존재하며 유리체강으로 진입하는 기구의 끝이 결막에 닿아 이 과정에서 기구가 결막 상재균에 오염된다고 하였다.20 따라서 유리체절제침과 눈속 기구가 삽입관을 통해 유리체 내 진입 전 결막 소독이 중요하고 이때 포비돈 요오드 희석 용액이 효과적이라고 하였다.20 안내염 증례들의 특발 망막앞막 수술 기록과 동영상 분석 결과 모든 눈에서 수술 시작 및 종료 시점 포비돈 요오드 용액으로 결막을 충분히 세척하였다. 하지만 막 벗김 기구의 눈 속 진입 직전이나 백내장수술 후 투관침 삽입 직전 결막 세척은 하지 않았다.
유리체절제술 후 남아있는 주변부 유리체는 결막 세균이 접종된 후 증식할 수 있는 발판이 될 수 있기 때문에, 주변부 유리체를 제거하면 25게이지 무봉합 유리체절제술 후 안내염의 빈도가 20게이지 봉합 유리체절제술처럼 낮아질 수 있다고 하였다.20 여타 유리체절제술 증례들에 비해 특발 망막앞막의 주변부 망막은 정상인 경우가 많아 주변부 유리체를 철저히 제거하지 않는 경향이 있다. 따라서 특발 망막앞막 수술 후 급성 안내염이 더 많이 발현할 수 있는한 원인으로 첫 수술 후 주변부의 잔여 유리체를 배제할 수 없다. 포비돈 요오드 희석 용액으로 결막을 소독해도 결막 배양에서 13-28%의 빈도로 세균이 배양된 보고는 결막 소독만으로 세균을 완벽하게 차단할 수 없음을 시사한다.21 포도구균과 크기가 비슷한 fluoresbrite carboxylate microspheres를 사용해 오염 정도를 정량적으로 평가한 결과, 25게이지 삽입관 뚜껑이 열릴 때 microspheres가 유입되어 삽입관 주위에 머무를 수 있음을 보여주었다.22 대표 증례들 모두 삽입관 주위의 심한 유리체혼탁과 망막염이 관찰되었던 점은(Fig. 1D, K) 무봉합 공막창과 그 주위의 잔존 유리체가 특발 망막앞막 수술 후 안내염이 시작되는 주요 장소일 수 있음을 시사한다. Hatano 23의 실험에서 단지 5개의 세균이 유리체로 유입되어도 안내염이 발생하였는데 이는 유리체가 무혈관 조직임과 동시에 체액성 면역(humoral immunity)에 특권이 있기 때문이라고 하였다. 그러므로 소독 후 결막 잔여 세균들의 유리체내 진입을 막기 위해 경사 절개를 통해 유리체로 진입하는 경로를 증가시켜 감염 확률을 낮추어야 한다.19,20
표피포도알균은 가장 흔하게 배양되는 결막 상재균으로,24 본 연구에서도 모두 표피포도알균이 동정되었다. 안내염에서 동정된 표피포도알균의 항생제 감수성 조사 결과 메티실린 및 3세대 세팔로스포린 내성 균주가 증가하고 있다.25 본 연구에서 다수의 증례들은 수술 후 점안 항생제로 4세대 퀴놀론을 사용하였으며 점안 항생제 종류는 법적 실명에 영향을 주는 인자가 아니었다. 배양된 모든 표피포도알균은 반코마이신에 내성이었고 모든 환자에서 안내염 진단 후 초기 경험적 유리체내 항생제로 반코마이신을 주사하였다. 다행히 안내염이 발병한 14안 모두 감염은 조절되어 전방세포와 유리체혼탁은 결국 소실되었다. 본 조사의 배양률은 26.7%로 낮았는데 31개의 병원이 참여한 다기관 후향 연구에서도 유리체절제술 후 안내염 배양률은 26.5%로 낮았고 안내염 초기에 투여한 경험적 전신 항생제가 배양률을 낮추는 한 원인이 될 수 있다고 하였다.26
14안의 급성 안내염 증례들에서 안내염 진단 후 첫 치료는 평균 3.3시간으로 신속하게 이루어졌다. 그럼에도 불구하고 약 40%의 환자들이 법적 실명에 도달하였고 안내염이 황반을 침범하면 실명 위험이 더 높았다. 이와 관련된 추정되는 기전은 세균이 무봉합 공막창 혹은 삽입관을 통해 진입하여 공막창 주위 잔여 유리체에서 증식한 후 세균과 그들이 분비하는 독소들이 평형염액으로 충전된 유리체 내에서 빠르게 확산하는 것이다. 대다수에서 시행한 내경계막 벗김으로 인하여 황반 앞의 장벽이 소실되어 세균과 독소로부터 더 쉽게 망막이 손상받을 수 있기 때문에 안내염의 황반 침범은 나쁜 시력 예후를 나타낼 수 있을 것으로 사료된다.27 특발 망막앞막 수술 전 및 수술 중 인자들에서 안내염 발병 후 법적 실명의 위험성을 높이는 인자는 없었다. 특히 대다수에서 안내염으로 내원한 시점에 유리체염과 전방염증으로 황반을 확인할 수 없었다. 본 증례들을 통해 미세절개유리체절제술을 통한 특발 망막앞막 수술 후 급성 안내염으로 내원하여 안저가 관찰되지 않으면, 안내염을 치료함과 동시에 황반 침범 유무를 확인하여 예후를 알 수 있기 때문에 이차 수술이 필요함을 환자에게 설명할 수 있다.
열공망막박리가 동반된 2안은 결국 법적 실명하였다. Endophthalmitis Vitrectomy Study (EVS)의 증례들 중 열공망막박리가 발생한 증례들은 강한 독성의 세균 감염, 광각 인지 이하의 시력 및 후낭절개 군에서 많았다.28 반면 본 조사의 2안은 안내염 진단 시 안전수동의 시력, 음성 배양 결과 및 후낭은 보존되어 있어 EVS 결과와 다소 차이가 있었다. 이러한 차이는 백내장 술 후 안내염 환자 기반의 EVS 연구와 유리체절제술을 기반으로 한 본 연구의 차이에서 기인할 것으로 추정된다.
본 연구는 안내염의 낮은 발생률을 감안할 때 대상 환자의 수가 적어 편향 오차가 존재할 수 있다. 후향적 연구의 한계로 안내염이 발병했던 원인과 감염 경로를 정확히 조사할 수 없었다. 본 연구는 단면 연구로 안내염이 발병한 환자들의 공막창 상태는 조사할 수 있었지만 모든 특발 망막앞막 수술 환자들의 공막창 누출과 봉합 유무에 대해 정확히 조사할 수 없었다. 따라서 특발 망막앞막 수술 후 모든 공막창을 봉합했던 증례들의 안내염 발생률과 다를 수 있어 후속 비교 연구가 필요하다. 공막창의 크기와 주입한 유리체내 시약에 따른 안내염 발생률에 차이가 있는지에 대한 후속 비교 연구도 필요하다. 또한 배양되지 않은 독성이 강한 세균에 의한 안내염으로 법적 실명에 이르렀을 가능성도 배제할 수 없다. 그럼에도 불구하고 본 연구는 무봉합 미세절개유리체절제술을 통한 특발 망막앞막 수술 후 발병하는 급성 안내염의 발생률과 임상 경과를 처음으로 보고했다는데 중요한 의의가 있다. 특히 표피포도알균 감염은 결막 상재균의 유입으로 인한 감염일 수 있기 때문에,24,25 모든 특발 망막앞막 수술 과정에서 오염을 유발하는 요소들을 차단하고 감염을 예방하기 위한 경각심이 필요하다.
결론적으로 미세절개유리체절제술을 통한 특발 망막앞막 수술 후 발병하는 급성 안내염은 약 40%에서 법적 실명할 수 있다. 안내염이 황반을 침범하면 신속한 이차 수술 및 유리체내 항생제 주사에도 불구하고 법적 실명에 도달할 위험이 있다. 따라서 특발 망막앞막 술자는 철저한 결막 소독, 무균적 시약 제조, 주의 깊은 기구 조작 등을 통해 안내염을 예방해야 한다. 수술 전 환자에게 안내염의 증상에 대해 충분히 설명 후 해당 증상들이 발생하면 신속히 병원을 방문해 진료 후 안내염이 황반을 침범하기 전 치료가 시작될 수 있도록 첫 수술 전 교육해야 한다.
Figure 1.
Representative cases of acute endophthalmitis after idiopathic epiretinal membrane surgery. Acute endophthalmitis leading to legal blindness after idiopathic epiretinal membrane surgery. (A) Fundus photograph before idiopathic epiretinal membrane (iERM) surgery in patient No. 13 (female, 64 years old). The initial corrected visual acuity (VA) was 20/50. (B) Acute endophthalmitis emerged 2 days after iERM surgery. Her VA decreased to hand motion. Hypopion, diffuse corneal edema, and conjunctival injection are revealed in the slit-lamp photography. (C) Macular invasion is evident with retinal vasculitis, multiple retinal hemorrhages, and focal retinitis. Methicillin-resistant Staphylococcus epidermidis was cultured on an automated microbial identification system. (D) Peripheral vitritis and retinitis are detected behind the superonasal sclerotomy, which is presumed to be the entrance route of the bacteria. (E-G) Macular atrophy and edema persisted until the final visit (398 days after the iERM surgery). The final VA was finger counting at 30cm with chronic inferior retinal detachment. The final VA corresponded to legal blindness. Acute endophthalmitis restored to the initial VA after iERM surgery. (H) Fundus photograph of patient No. 1 (female, 58 years old). The baseline corrected VA was 20/25, but the patient complained of severe metamorphopsia. (I) Acute endophthalmitis developed 2 days after iERM surgery with decreased VA of hand motion. (J) Multiple retinitis shows in the inferotemporal periphery, but the macula is intact. (K) Peripheral endophthalmitis begins behind the inferotemporal sclerotomy. No bacteria were identified on culture. (L) The final VA recovered to 20/25 (264 days after the first surgery), and (M, N) macular abnormalities are absent.
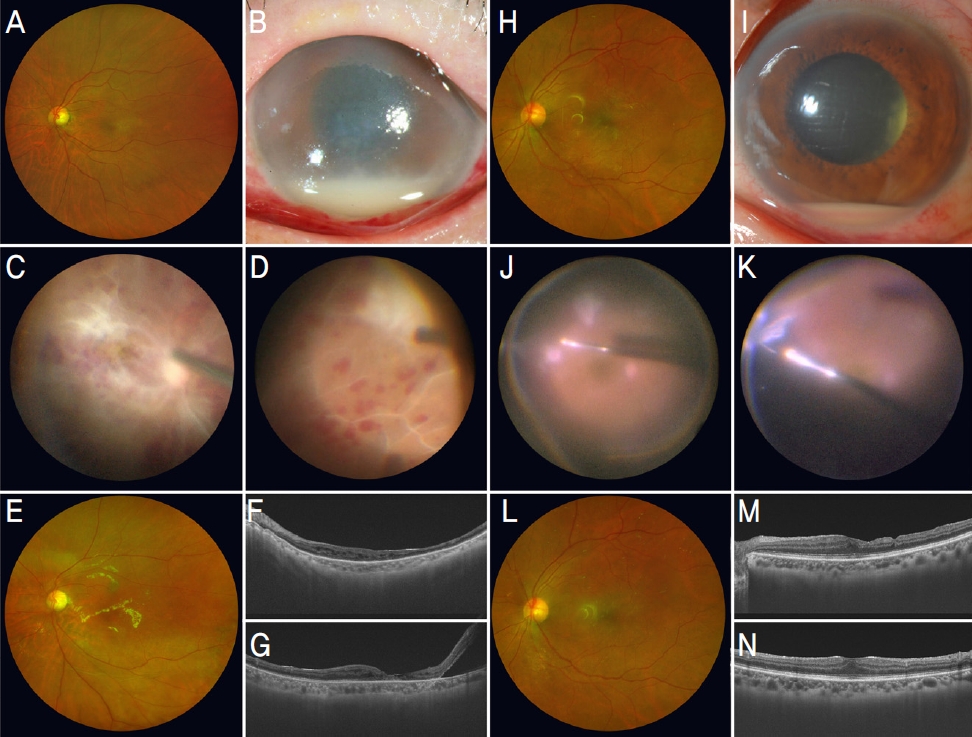
Table 1.
Baseline factors of eyes with acute endophthalmitis after idiopathic epiretinal membrane surgery
| Preoperative factor | Total (n = 14) | LB (n = 6) | Non-LB (n = 8) | p-value | |
|---|---|---|---|---|---|
| Main/branch hospital | 8 (57.1)/6 (42.9) | 4/2 | 4/4 | 0.627* | |
| Age (years) | 67.8 ± 7.7 | 69.7 ± 7.6 | 66.4 ± 8.0 | 0.585† | |
| Male/female | 3 (21.4)/11 (78.6) | 1/5 | 2/6 | 1.000* | |
| Right/left | 4 (28.6)/10 (71.4) | 0/6 | 4/4 | 0.085* | |
| Underlying diseases | 1.000* | ||||
| Hypertension | 6 (42.9) | 3 | 3 | ||
| Diabetes miletus | 1 (7.1) | 1 | 0 | ||
| Chronic kidney disease | 0 (0.0) | 0 | 0 | ||
| Preoperative use of systemic steroid | 0 (0.0) | 0 | 0 | 1.000* | |
| Preoperative use of topical steroid | 0 (0.0) | 0 | 0 | 1.000* | |
| Mean initial VA (logMAR) | 0.32 ± 0.22 | 0.47 ± 0.22 | 0.21 ± 0.13 | 0.031†,‡ | |
| Mean initial CMT (μm) | 426.1 ± 101.7 | 456.0 ± 138.5 | 403.8 ± 64.6 | 0.922† | |
| Mean initial IOP (mmHg) | 13.3 ± 3.2 | 11.8 ± 3.1 | 14.4 ± 3.0 | 0.149† | |
| Complete/partial PVD | 11 (78.6)/3 (21.4) | 5/1 | 6/2 | 1.000* | |
Table 2.
Intraoperative factors of eyes with acute endophthalmitis after idiopathic epiretinal membrane surgery
| Intraoperative factor | Total (n = 14) | LB (n = 6) | Non-LB (n = 8) | p-value | |
|---|---|---|---|---|---|
| Sizes of sclerotomies | 1.000* | ||||
| 23-gauge | 4 (28.6) | 2 | 2 | ||
| 25-gauge | 10 (71.4) | 4 | 6 | ||
| Combined phacoemulsification | 7 (50.0) | 2 | 5 | 0.592* | |
| Suture of clear corneal Incision | 6 (42.9) | 3 | 3 | 0.592* | |
| ILM peeling/ILM preservation | 13 (92.9)/1 (7.1) | 5/1 | 8/0 | 0.429* | |
| Size of ILM peeling (DD) | 3.1 ± 1.5 | 2.9 ± 1.5 | 3.3 ± 1.6 | 0.496† | |
| Vital dyes for epiretinal membrane or ILM visualization | |||||
| Triamcinolone | 12 (85.7) | 5 | 7 | 1.000* | |
| Indocyanine green 0.05% | 5 (35.7) | 1 | 4 | 0.301* | |
| Brilliant blue G 0.025% | 5 (35.7) | 2 | 3 | 1.000* | |
| Number of sutured sclerotomies | 0.301* | ||||
| None | 9 (64.3) | 5 | 4 | ||
| One or two | 5 (35.7) | 1 | 4 | ||
| All | 0 (0.0) | 0 | 0 | ||
| Operation time (minutes) | 49.6 ± 16.0 | 49.0 ± 17.9 | 50.0 ± 15.6 | 0.851† | |
| Local/general anesthesia | 13 (92.9)/1 (7.1) | 6/0 | 7/1 | 1.000* | |
Table 3.
Ocular findings, pathogens, and treatments at diagnosis of endophthalmitis
| Factor related to endophthalmitis | Total (n = 14) | LB (n = 6) | Non-LB (n = 8) | p-value | |
|---|---|---|---|---|---|
| Symptoms related to endophthalmitis | |||||
| Decreased vision | 14 (100.0) | 6 | 8 | 1.000* | |
| Ocular pain | 9 (64.3) | 4 | 5 | 1.000* | |
| Conjunctival injection (CCLRU14) | 2.7 ± 1.1 | 2.5 ± 1.3 | 2.9 ± 1.0 | 0.605† | |
| Floater | 11 (78.6) | 3 | 8 | 0.055* | |
| Period from iERM surgery to symptoms (days) | 1.9 ± 0.9 | 1.7 ± 0.5 | 2.1 ± 1.1 | 0.527† | |
| Period from iERM surgery to endophthalmitis diagnosis (days) | 3.6 ± 2.3 | 4.2 ± 2.3 | 3.1 ± 2.3 | 0.989† | |
| Mean presenting VA (logMAR) | 2.10 ± 0.43 | 2.22 ± 0.20 | 2.01 ± 0.54 | 0.469† | |
| Mean presenting IOP (mmHg) | 15.9 ± 5.2 | 17.0 ± 6.8 | 15.0 ± 3.8 | 0.464† | |
| AC cells (SUN Working Group15) | 3.8 ± 0.8 | 4.0 ± 0.0 | 3.6 ± 1.1 | 1.000† | |
| Hypopion (mm) | 0.9 ± 0.8 | 1.0 ± 0.9 | 0.8 ± 0.8 | 0.745† | |
| Vitritis (Nussenblatt16) | 2.4 ± 1.1 | 2.5 ± 1.4 | 2.4 ± 0.9 | 0.912† | |
| Fundus examination | |||||
| Retinal infiltration | 13 (92.9) | 6 | 7 | 1.000* | |
| Macular invasion | 6 (42.9) | 5 | 1 | 0.026*,‡ | |
| Retinal hemorrhages | 11 (78.6) | 5 | 6 | 1.000* | |
| Retinal vasculitis | 10 (71.4) | 6 | 4 | 0.085* | |
| Retinal detachment | 2 (14.3) | 2 | 0 | 0.165* | |
| Pathogen detected | 4 (28.6) | 2 | 2 | 1.000* | |
| MSSE | 1 (7.1) | 0 | 1 | 1.000* | |
| MRSE | 3 (21.4) | 2 | 1 | 0.538* | |
| Treatments of endophthalmitis | |||||
| Intravitreal antibiotics injection | 14 (100.0) | 6 | 8 | 1.000* | |
| Mean number of intravitreal antibiotics Injection | 1.9 ± 1.3 | 1.5 ± 0.8 | 2.1 ± 1.6 | 0.492† | |
| Systemic antibiotics treatments | 9 (64.3) | 4 | 5 | 1.000* | |
| Mean period of systemic antibiotics treatments (days) | 9.0 ± 4.7 | 7.6 ± 5.2 | 10.4 ± 6.5 | 0.444† | |
| Secondary vitrectomy | 13 (92.9) | 6 | 7 | 1.000* | |
| Period from iERM surgery to initiation of endophthalmitis treatments (days) | 3.7 ± 2.3 | 4.3 ± 2.3 | 3.3 ± 2.3 | 0.468† | |
| Period from symptom onset to initiation of endophthalmitis treatments (days) | 1.3 ± 1.6 | 2.1 ± 2.2 | 0.6 ± 0.4 | 0.081† | |
| Period from endophthalmitis diagnosis to initiation of endophthalmitis treatments (hours) | 3.3 ± 0.9 | 3.4 ± 1.2 | 3.1 ± 0.7 | 0.730† | |
Values are presented as number (%).
LB = legal blindness; iERM = idiopathic epiretinal membrane; VA = visual acuity; logMAR = logarithm of the minimum angle of resolution; IOP = intraocular pressure; AC = anterior chamber; MSSE = methicillin-sensitive Staphylococcus epidermidis; MRSE = methicillin-resistant Staphylococcus epidermidis.
Table 4.
Clinical outcomes of acute endophthalmitis after idiopathic epiretinal membrane surgery
| Postoperative factors | 3-week | 3-month | Final follow-up | |||
|---|---|---|---|---|---|---|
| Values | p-value | Values | p-value | Values | p-value | |
| Mean F/U VA (logMAR) | 1.37 ± 0.80 | 0.005*,‡ | 1.18 ± 0.90* | 0.005*,‡ | 1.11 ± 0.96 | 0.005*,‡ |
| Mean F/U IOP (mmHg) | 10.9 ± 4.2 | 0.005*,‡ | 11.1 ± 5.6* | 0.048*,‡ | 12.9 ± 4.3 | 0.159* |
| AC cells (SUN Working Group15) | 0.4 ± 0.5 | <0.001*,‡ | 0.1 ± 0.3* | <0.001*,‡ | 0.0 ± 0.0 | <0.001*,‡ |
| Vitritis (Nussenblatt16) | 0.3 ± 0.5 | <0.001*,‡ | 0.1 ± 0.3* | <0.001*,‡ | 0.0 ± 0.0* | <0.001*,‡ |
| Retinal detachment | 2 | 1.000† | 2 | 1.000† | 2 | 1.000† |
Values are presented as mean ± standard deviation or number.
F/U = follow-up; VA = visual acuity; logMAR = logarithm of the minimum angle of resolution; IOP = intraocular pcressure; AC = anterior chamber.
REFERENCES
1) Kim JM, Lee H, Shin JP, et al. Epiretinal membrane: prevalence and risk dactors from the korea national health and nutrition examination survey, 2008 through 2012. Korean J Ophthalmol 2017;31:514-23.




2) Mitchell P, Smith W, Chey T, et al. Prevalence and associations of epiretinal membranes. The blue mountains eye study, Australia. Ophthalmology 1997;104:1033-40.


3) Kauffmann Y, Ramel JC, Lefebvre A, et al. Preoperative Prognostic factors and predictive score in patients operated on for combined cataract and idiopathic epiretinal membrane. Am J Ophthalmol 2015;160:185-92.e5.


4) Lee JW, Kim IT. Outcomes of idiopathic macular epiretinal membrane removal with and without internal limiting membrane peeling: a comparative study. Jpn J Ophthalmol 2010;54:129-34.



5) Rizzo S, Genovesi-Ebert F, Murri S, et al. 25-gauge, sutureless vitrectomy and standard 20-gauge pars plana vitrectomy in idiopathic epiretinal membrane surgery: a comparative pilot study. Graefes Arch Clin Exp Ophthalmol 2006;244:472-9.



6) Kim JY, Rim TH, Kim SS. Trends of pars plana vitrectomy rates in south korea: a nationwide cohort study. Korean J Ophthalmol 2017;31:446-51.




7) Das T, Sharma S. Current management strategies of acute post-operative endophthalmitis. Semin Ophthalmol 2003;18:109-15.


8) Baudin F, Benzenine E, Mariet AS, et al. Epidemiology of acute endophthalmitis after intraocular procedures: a national database study. Ophthalmol Retina 2022;6:442-9.


9) Park JC, Ramasamy B, Shaw S, et al. A prospective and nationwide study investigating endophthalmitis following pars plana vitrectomy: incidence and risk factors. Br J Ophthalmol 2014;98:529-33.


10) Scott IU, Flynn HW Jr, Dev S, et al. Endophthalmitis after 25-gauge and 20-gauge pars plana vitrectomy: incidence and outcomes. Retina 2008;28:138-42.

11) Chen G, Tzekov R, Li W, et al. Incidence of endophthalmitis after vitrectomy: a systematic review and meta-analysis. Retina 2019;39:844-52.

12) Ben Ghezala I, Mariet AS, Benzenine E, et al. Incidence of acute postoperative endophthalmitis following macular surgery in France between 2006 and 2016. Acta Ophthalmol 2020;98:e333-8.



13) Lee JE, Byon IS, Park SW. Epiretinal Membrane. In: Lee JE, Byon IS, Park SW, eds. Internal Limiting Membrane Surgery. Singapore: Springer, 2021; chap 4.
14) Terry RL, Schnider CM, Holden BA, et al. CCLRU standards for success of daily and extended wear contact lenses. Optom Vis Sci 1993;70:234-43.


15) Jabs DA, Nussenblatt RB, Rosenbaum JT. Standardization of uveitis nomenclature for reporting clinical data. Results of the first international workshop. Am J Ophthalmol 2005;140:509-16.



16) Nussenblatt RB, Palestine AG, Chan CC, Roberge F. Standardization of vitreal inflammatory activity in intermediate and posterior uveitis. Ophthalmology 1985;92:467-71.


17) Vashist P, Senjam SS, Gupta V, et al. Definition of blindness under national programme for control of blindness: do we need to revise it? Indian J Ophthalmol 2017;65:92-6.



18) Scott IU, Flynn HW Jr, Acar N, et al. Incidence of endophthalmitis after 20-gauge vs 23-gauge vs 25-gauge pars plana vitrectomy. Graefes Arch Clin Exp Ophthalmol 2011;249:377-80.



19) Kaiser RS, Prenner J, Scott IU, et al. The Microsurgical safety task force: evolving guidelines for minimizing the risk of endophthalmitis associated with microincisional vitrectomy surgery. Retina 2010;30:692-9.


20) Shimada H, Nakashizuka H, Hattori T, et al. Incidence of endophthalmitis after 20- and 25-gauge vitrectomy causes and prevention. Ophthalmology 2008;115:2215-20.


21) Inoue Y, Usui M, Ohashi Y, et al. Preoperative disinfection of the conjunctival sac with antibiotics and iodine compounds: a prospective randomized multicenter study. Jpn J Ophthalmol 2008;52:151-61.



22) Machida Y, Nakashizuka H, Shoji J, Shimada H. Microincision vitrectomy surgery: experimental visualization and quantification of vitreous contamination. BMC Ophthalmol 2020;20:441.




23) Hatano H. Experimental Pseudomonas endophthalmitis in rabbits. Intracameral inoculation of two pseudomonal strains. Nippon Ganka Gakkai Zasshi 1982;86:839-45.

24) Chung JL, Seo KY, Yong DE, et al. Antibiotic susceptibility of conjunctival bacterial isolates from refractive surgery patients. Ophthalmology 2009;116:1067-74.


25) Gentile RC, Shukla S, Shah M, et al. Microbiological spectrum and antibiotic sensitivity in endophthalmitis: a 25-year review. Ophthalmology 2014;121:1634-42.


26) Sakamoto T, Terasaki H, Yamashita T, et al. Increased incidence of endophthalmitis after vitrectomy relative to face mask wearing during COVID-19 pandemic. Br J Ophthalmol 2022 bjophthalmol-2022-321357.doi:10.1136/bjophthalmol-2022-321357.

-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,203 View
- 55 Download
- Related articles
-
Surgical Outcomes of Idiopathic Epiretinal Membrane with Good Visual Acuity.2014 May;55(5)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



