|
 |
| J Korean Ophthalmol Soc > Volume 63(4); 2022 > Article |
|
국문초록
대상과 방법
녹내장 86안, 시야결손 전 녹내장 86안, 정상안 43안이 포함되었다. 총 맥락막 면적과 맥락막혈관지수를 브루크막 개방 중심에서 3.5 mm 거리에서 스펙트럼영역 빛간섭단층촬영(spectral domain optical coherence tomography) 영상의 이진화 기법을 이용하여 측정하였다. 맥락막혈관지수는 맥락막조직에서 맥락막혈관이 차지하는 면적의 비율로 도출하였다. 맥락막혈관지수와 전사상판조직의 두께 사이의 관련성을 분석하였다.
결과
맥락막혈관지수는 녹내장군(61.67% ± 4.11%)에서 가장 낮았고 시야결손 전 녹내장군(63.36% ± 3.54%), 정상안군(64.84% ± 3.13%) (p<0.001) 순으로 높았다. 녹내장(102.05 ± 44.01 μm)은 시야결손 전 녹내장군(106.16 ± 38.03 μm) 및 정상안(154.98 ± 79.46 μm)에 비해 전사상판조직의 두께가 유의하게 얇았다(p<0.001). 다변수 회귀분석에서 맥락막혈관지수는 정상안과 녹내장안을 포함한 모든 군에서 전사상판조직의 두께 및 총 맥락막 면적과 연관성을 보였다(p<0.05).
ABSTRACT
Purpose
To assess the association between the choroidal vascularity index (CVI) and prelaminar tissue thickness (PTT) in healthy and glaucomatous eyes.
Methods
The study included 86 eyes with perimetric glaucoma (PG), 86 with pre‐perimetric glaucoma (PPG), and 43 age-matched healthy eyes. Total choroidal area (TCA) and CVI were measured by image binarization of spectral‐domain optical coherence tomography (SD‐OCT) 3.5 mm from the center of Bruch’s membrane opening. The CVI was the percentage of choroidal vasculature to choroidal tissue. The association between CVI and PTT measured on a center‐horizontal scan of enhanced depth imaging SD‐OCT was assessed.
Results
The CVI was lowest in PG (61.67% ± 4.11%), followed by PPG (63.36% ± 3.54%), and healthy (64.84% ± 3.13%) eyes (p < 0.001). PG (102.05 ± 44.01 μm) had a significantly thinner PTT than PPG (106.16 ± 38.03 μm) and the healthy (154.98 ± 79.46 μm) eyes (p < 0.001). In a multivariate regression analysis, CVI was associated with PTT and TCA in all subjects, including healthy and glaucomatous eyes (p < 0.05).
녹내장은 다인자성 질환이지만[1,2] 안압으로 인한 시신경 유두의 기계적인 스트레스뿐만 아니라 시신경유두의 허혈도 녹내장의 발병에 기여하는 것으로 알려져 있다[3,4]. 특히, 유두주위 맥락막혈관계는 녹내장성 시신경병증의 추정 부위로 알려진 전사상판조직(prelamina), 사상판(lamina) 및 후사상판(retrolamina) 조직을 포함하는 시신경유두의 혈액 공급을 담당하고 있어 녹내장성 손상과의 관련성이 대두되고 있다[5-11]. 한편 시신경유두의 앞쪽에 위치한 전사상판조직의 두께와 위치는 빛간섭단층촬영(optical coherence tomography, OCT) 영상에 의해 평가가 용이한 지표이다[7,12-14]. 이는 전사상판조직이 시신경의 표면에 위치하므로 음영 또는 빛의 투과 감소의 가능성이 적기 때문이다[15]. 한편 기존 연구들은 맥락막혈관을 직접 측정하기보다는 맥락막의 두께를 맥락막 순환을 시사하는 지표로 이용하였다는 점에서 한계가 있었다[5,7,16].
최근 빛간섭단층촬영영상의 이진화 기법을 통하여 도출된 맥락막혈관지수(choroidal vascularity index, CVI)가 녹내장 및 다양한 망막질환에서 맥락막의 혈관 상태를 정량화하는 수단으로 사용되고 있다[8,17-20]. 특히, 맥락막혈관지수는 빛간섭단층촬영혈관조영술로 측정한 시신경유두주위 위축 내부의 심부혈관 소실 여부와 유의한 연관성을 가지는 것으로 보고되었다[17].
본 연구는 정상인과 시야결손 전 녹내장(pre‐perimetric glaucoma, PPG) 및 녹내장(perimetric glaucoma, PG) 환자에서 맥락막혈관지수와 전사상판조직의 두께(prelaminar tissue thickness, PTT) 사이의 상관관계가 있는지를 분석하고자 하였다.
2017년 1월부터 2018년 12월 사이에 해운대백병원 녹내장 클리닉을 방문한 건강한 대상자, 시야결손 전 녹내장 및 녹내장 환자들을 모집하였다. 모든 참가자로부터 사전 동의를 얻었고 연구 프로토콜은 해운대백병원 의학연구윤리심의위원회의 승인을 받았다(임상시험윤리위원회 승인 번호: 2020‐06‐013). 모든 참가자들은 최대교정시력 측정과 세극등현미경검사, 골드만압평안압계, 전방각경검사, 안축장측정검사(IOL Master; Carl Zeiss Meditec, Dublin, CA, USA), 각막중심두께(Pentacam Scheimpflug Imaging System; Oculus Optikgeräte GmbH, Wetzlar, Germany), 망막신경섬유층 및 시신경유두촬영(TRC‐NW8; Topcon, Tokyo, Japan), 시야검사(Humphrey Field Analyzer; 24‐2 Swedish interactive threshold algorithm; Carl Zeiss Meditec) 및 spectral‐domain ‐OCT (Spectralis; Heidelberg Engineering GmbH, Heidelberg, Germany)검사를 시행하였다.
모든 환자들은 21세 이상이며, 전방각경검사에서 개방각 소견을 보이고, 최대교정시력이 20/40 이상이었다. 정상안은 정기적인 안과검진(백내장, 안구건조증)을 위해 해운대 백병원 외래를 방문하였고, 안압이 21 mmHg 미만이면서 안압 상승의 과거력이 없고, 시신경유두와 망막신경섬유층 촬영에서 녹내장성 변화가 보이지 않으며 시야검사에서 정상으로 판정된 경우로 정의하였다. 시야전단계 녹내장군(PPG)과 녹내장군(PG) 모두 안저촬영 평가에 기초하여 녹내장성 시신경손상(시신경태 얇음, 패임, 혹은 전반적인 시신경테의 소실)이 있었다. 시야전단계 녹내장군(PPG)은 정상적인 시야검사 결과를 보였고 녹내장군(PG)은 pattern standard deviation이 정상의 95% 범위를 벗어나거나, glaucoma hemifield test가 outside normal limit이거나, pattern deviation plot에서 가장자리를 제외한 부위에서의 역치가 정상의 5% 미만으로 나타난 인접한 3개 이상 점과 그중 한 개 이상은 1% 미만이었다. 세 그룹은 개별 짝짓기 방법을 이용하여 연령에 대해서 짝짓기를 시행하였으며, 두 눈 모두 임상시험 대상군의 기준에 부합하는 경우 한 눈만 무작위로 선택하였다.
연구 결과에 영향을 미칠 수 있는 전신질환 안구 내 질환 또는 안과수술의 병력이 있는 피험자는 제외하였다. 전신성 고혈압 당뇨병이 있는 환자의 경우 당뇨병성 또는 고혈압성 망막병증이 동반되어 있는 경우는 제외하였다.
Spectralis OCT2 Glaucoma Module Premium Edition (GMPE) software (version 1.9.17.0; Heidelberg Engineering GmbH)는 중심와에서 브루크막 개방(Bruch’s membrane opening, BMO) 중심을 연결하는 축을 중심으로 하여 정렬된 24개의 B scan 및 시신경 방사형 원 스캔 패턴(optic nerve head [ONH] radial circle)을 제공한다. 이들을 이용하여 3.5 mm 너비의 circle scan에서 측정한 망막신경섬유층두께(retinal nerve fiber layer thickness), 브루크막개방의 면적 (BMO area), 중심와‐브루크막개방각 각도(fovea‐BMO angle), 총 맥락막 면적(total choroidal area, TCA) 및 맥락막혈관지수(CVI)를 측정하였다[17,21].
총 맥락막 면적(TCA) 및 맥락막혈관지수(CVI)는 Image J version 1.47 (National Institute of Health, Bethesda, MD, USA)를 이용하여 시행한 OCT 영상의 이진화로 도출하였다[17,20,22-25]. 이진화된 이미지를 다시 RGB (red, green, blue)이미지로 변환하여 색상 임계값 도구가 어두운 픽셀을 선택할 수 있도록 하였다[17,22]. 망막색소상피와 맥락막공막 접합부 사이의 맥락막 영역의 넓이를 맥락막 면적으로 정하였고 어두운 픽셀을 보이는 맥락막혈관 영역 넓이의 총 맥락막 면적에 대한 비율을 맥락막혈관지수로 정하였다 (Fig. 1E, J, O) [17].
전사상판조직의 두께(PTT), 사상판 깊이(lamina cribrosa depth, LCD) 및 전사상판 앞 깊이(anterior prelaminar depth, APLD)는 두 명의 관찰자에 의해 측정한 결과값의 평균치로 도출하였다. 중심와‐브루크막개방각 축에 가장 가까운 B 스캔에서 브루크막개방을 연결하는 기준선에서 측정하였다. 기준선의 중심부, 비측 및 이측 100 μm 지점의 총 세 지점에서 측정한 값의 평균치를 도출하였다(Fig. 1C, D, H, I, M, N). 사상판 깊이는 기준선에서 사상판 앞쪽경계면까지의 수직 거리로, 전사상판 앞 깊이는 기준선에서 전사상판조직의 앞쪽면까지의 수직거리로 측정하였다. 전사상판 조직의 두께는 전사상판 앞 깊이와 사상판 깊이의 차이로 도출하였다(Fig. 1C, D, H, I, M, N).
세 그룹을 비교하기 위하여 연속변수에 대해서는 일원분산분석(one‐way analysis of variance)을 시행하였고, 비연속변수에 대해서는 카이제곱검정을 이용하였다. 일원분산분석의 사후검정은 Tukey’s correction으로 시행하였다. 맥락막혈관지수와 전사상판조직의 두께 간의 관계를 확인하기 위해 단변수 및 다변수 회귀분석을 시행하였다. Bland‐ Altman plot을 이용하여 전사상판조직의 두께, 전사상판 앞 깊이 및 사상판 깊이 측정에 대한 연구자 간의 일관성(inter ‐observer agreement)을 평가하였다.
본 연구는 43안의 정상안(healthy), 86안의 시야전단계 녹내장안(PPG), 86안의 녹내장안(PG)을 포함하였다. 녹내장안은 초기(mean deviation [MD] >‐6.0 dB) 67안, 중기 (‐12.0 dB≤ MD ≤‐6.0 dB) 14안, 후기(MD <‐12.0 dB) 5안의 분포를 보였다. 전사상판조직의 두께(Bland‐Altman 95% limits of agreement [LoA], ‐6.0 to 4.9 μm), 전사상판 앞 깊이(Bland‐Altman 95% LoA, ‐6.2 to 8.0 μm), 사상판 깊이(Bland‐Altman 95% LoA, ‐5.0 to 5.7 μm) 모두 좋은 관찰자 간 일치도를 보였다(Fig. 2).
Table 1은 세 그룹의 기본적인 특성들을 보여주는데, 기저안압, 시야검사상 MD와 pattern deviation (PSD), 평균 망막신경섬유층두께 및 부르크막개방 면적에서 유의한 차이를 보였다(p<0.05). 사후검정(post‐hoc testing)에서 평균 망막신경섬유층두께는 녹내장군(PG; 77.6 ± 13.4 μm)에서 가장 얇았으며 시야전단계 녹내장군(PPG; 89.0 ± 10.3 μm) 및 정상안군(healthy; 101.4 ± 9.9 μm) 순으로 두꺼워졌다 (p<0.001) (Table 1, Fig. 1A, F, K). 녹내장군의 시야검사상 MD (‐4.7 ± 3.6 dB) 및 PSD (5.7 ± 3.6 dB)는 시야전단계 녹내장군(시야의 MD: ‐1.1 ± 1.8 dB, 시야의 PSD: 1.9 ± 1.1 dB) 및 정상군(시야의 MD: ‐0.6 ± 1.6 dB, 시야의 PSD: 1.8 ± 0.6 dB)과 의미 있는 차이를 보였다(Table 1, Fig. 1B, G, L). 녹내장군의 기저안압(16.4 ± 4.2 mmHg)은 시야전단계 녹내장군(15.8 ± 4.3 mmHg) 및 정상군(14.2 ± 2.3 mmHg)보다 유의하게 높았다. 브루크막개방의 면적은 시야전단계 녹내장군(2.4 ± 0.6 mm2) 또는 녹내장군(2.4 ± 0.5 mm2)보다 정상군(22.2 ± 0.4 mm2)에서 유의하게 작았다. 나이, 안축장, 각막두께 또는 중심와‐브루크막개방각 각도는 세 군 간에 차이가 없었다(p>0.05).
세 그룹은 총 맥락막 면적(TCA), 맥락막혈관지수(CVI), 전사상판조직의 두께(PTT), 전사상판 앞 깊이(APLD) 및 사상판 깊이(LCD) (p<0.05) 모두 유의한 차이를 보였다 (Table 2, Fig. 1C‐E, H‐J, M‐O). 사후검정(post‐hoc testing)에서 정상안은 시야전단계 녹내장군(전사상판조직의 두께:106.16 ± 38.03 μm, 전사상판 앞 깊이: 358.39 ± 142.45 μm, 사상판 깊이: 464.55 ± 136.54 μm)과 녹내장군(전사상판조직의 두께: 102.05 ± 44.01 μm, 전사상판 앞 깊이: 379.16 ± 162.78 μm, 사상판 깊이: 482.95 ± 147.27 μm)에 비해 전사상판조직의 두께(154.98 ± 79.46 μm)가 유의하게 두꺼웠고 전사상판 앞 깊이(279.05 ± 118.24 μm) 및 사상판 깊이(395.65 ± 91.17 μm)가 유의하게 얕았다(Table 2, Fig. 1C, D, H, I, M, N). 맥락막혈관지수는 정상안(64.84% ± 3.13%)에서 가장 높았고 시야전단계 녹내장군(63.36% ± 3.54%) 및 녹내장군(61.67% ± 4.11%) 순으로 낮아졌다 (Table 2, Fig. 1E, J, O). 총 맥락막 면적은 시야전단계 녹내장군(4.76 ± 2.01 mm2) 또는 정상안(4.66 ± 1.26 mm2)보다 녹내장군(3.82 ± 1.18 mm2)에서 유의하게 작았다(Fig. 1E, J, O).
정상안, 시야전단계 녹내장안 및 녹내장안을 포함한 모든 참가군에서의 임상적 및 해부학적 변수와 맥락막혈관지 수에 대한 다른 측정인자들 간의 상관관계를 나타내는 단변량 및 다변량 회귀 결과를 정리하였다(Table 3). 단변량 회귀분석에서 맥락막혈관지수는 시야검사상 MD (ß=0.141; p=0.038), 망막신경섬유층두께(ß=0.213; p=0.001), 총 맥락막 면적(ß=0.499, p<0.001), 전사상판조직의 두께(ß=0.222, p=0.001) 및 사상판 깊이(ß=0.183, p=0.007)와 유의한 양의 상관관계를 가졌으며 브루크막개방의 면적(ß=‐0.180, p=0.008)과는 음의 상관관계를 보였다(Table 3). 연령(p=0.094)과 성별(p=0.058)은 맥락막혈관지수와 경계적 유의성을 가졌다(Table 3). 다변량 회귀분석 시 시야의 MD와 평균 망막신경섬유층두께는 variance inflation factor가 높기 때문에 다중공선성(multicollinearity)을 피하기 위해 분리되어 포함되었다. 두 가지 분석 모두에서 맥락막혈관지수는 총 맥락막면적(시야의 MD: ß=0.448, p<0.001; 평균 망막신경섬유층 두께: ß=0.435, p<0.001) 및 전사상판조직의 두께(시야의 MD: ß=0.170, p=0.006; 평균 망막신경섬유층두께: ß=0.131, p=0.041)와 유의한 양의 상관관계를 보였다(Table 3).
한편, 정상안을 제외한 시야전단계 녹내장군 및 녹내장 군에서는 단변량 및 다변량 회귀분석 모두에서 맥락막혈관지수가 전사상판조직의 두께, 전사상판 앞 깊이 및 사상판 깊이를 포함한 모든 시신경유두 변수와 유의한 상관관계를 보이지 않았다(p>0.05) (Table 4).
정상안, 시야전단계 녹내장안 및 녹내장안을 포함한 모든 참가군에서의 전사상판조직의 두께와 다른 측정인자들 간의 상관관계를 나타내는 단변량 및 다변량 회귀 결과를 정리하였다(Table 5). 단변량 회귀분석에서 전사상판조직의 두께는 망막신경섬유층두께(ß=1.302, p<0.001), 맥락막혈관지수(ß=3.162, p=0.001)와 유의한 양의 상관관계를 가졌으며 기저안압(ß=‐2.112, p=0.025), 브루크막개방의 면적(ß=‐19.26, p=0.006) 및 전사상판조직 앞 깊이(ß=‐0.164, p<0.001)와는 음의 상관관계를 보였다. 다변량 회귀분석에서 전사상판조직의 두께는 망막신경섬유층 두께(ß=0.816, p<0.001), 맥락막혈관지수(ß=2.876, p=0.001)와 유의한 양의 상관관계를 가졌으며 전사상판조직 앞 깊이(ß=‐0.145, p<0.001)와는 음의 상관관계를 보였다.
유두주위 맥락막혈관계는 시신경유두를 공급하는 맥락막 세동맥의 구심 분지에 인접하여 위치하며 두 혈관은 공통 관류원(짧은뒤섬모체동맥)을 공유한다[5-10]. 이러한 해부학적 특징은 유두주위 맥락막혈류와 전사상판조직 및 사상판을 포함하는 심부 시신경으로의 혈액 공급을 담당하고 있어 녹내장성 시신경병증의 발병 기전에 역할을 할 수 있을 것으로 생각된다. Lee et al. [6]이 최근 인도시아닌 녹색 혈관조영술을 이용한 연구에서 유두주위 맥락막혈류가 전사 상판조직 관류에 기여한다고 보고하였다. 그러나 맥락막혈류를 정량화할 수 있는 비침습적인 방법이 여의치 않았으므로 맥락막혈류와 시신경구조 간의 상관관계에 대한 연구는 부족한 상황이었다. 본 연구에서는 정상안과 녹내장안을 포함한 모든 참가군에서 빛간섭단층촬영을 이용한 영상 양극화로 도출한 맥락막혈류가 전사상판조직의 두께와 유의한 양의 상관관계를 가진다는 것을 확인할 수 있었다는 점에서 맥락막과 전사상판조직 혈류 순환 사이에 유의한 상관관계를 가진다는 가설을 지지한다[6]. 또한 정상안보다 녹내장안에서 더 낮은 맥락막혈관인자와 더 얇은 전사상판 조직의 두께를 보여준다는 점에서 녹내장안에서 감소된 맥락막의 혈관성 및 두께를 보여주는 이전 연구의 결과와 부합한다[5,12,18,26,27]. 한편, 유두주위 맥락막 순환장애가 전사상 판조직의 관류장애 및 녹내장 병인의 원인인자로 작용할지는 명확하지 않다. 녹내장 및 시야전단계 녹내장군에서는 맥락막혈관지수가 전사상판조직의 두께, 전사상판조직 앞깊이 및 사상판 깊이를 포함한 모든 시신경유두 변수와 유의한 상관관계를 보이지 않았다는 점에서 맥락막두께가 녹내장의 중증도와 관련성이 없다는 기존의 연구들과 부합한다[5,26,28-30]. 또한, 맥락막은 안구내 요소일 뿐 아니라 전신적인 요소를 반영하는 동적인 요소라는 점에서 본 연구 결과로 녹내장과의 병인과의 관련성을 확인하기 어렵다[20]. 그러나 전체 개체들을 대상으로 한 다중회귀분석에서 망막신경 섬유층 두께는 맥락막혈관지수와 경계성의 상관관계를 보였지만(p=0.060) (Table 3), 전사상판조직의 두께를 제외한 모델에서는 망막신경섬유층두께와 맥락막혈관지수는 유의한 관련성을 가졌다(ß=0.186, p=0.007). 이러한 결과는 망막신경섬유층두께와 전사상판조직의 두께 사이의 다중공선성으로 인해 망막신경섬유층두께의 통계적 유의성이 상쇄되었을 수 있다. 향후 맥락막 순환장애와 전사상판조직 순환 및 녹내장 병인 간의 인과적 관련성에 대한 전향적 종단 연구가 요망된다.
한편 맥락막혈관계가 녹내장성 시신경손상의 중증도에 영향을 미치는지에 대해서는 의문이다. 이전의 연구들에서 맥락막두께와 녹내장 중증도 사이에 유의미한 관계가 없음을 보였다[5,26,28-30]. 이와 유사하게 본 연구에서도 맥락막혈 관지수는 녹내장안에서 전사상판조직의 두께를 포함하는 시신경의 해부학적 구조와 유의한 관련성을 보이지 않았다.
본 연구에서 맥락막혈관지수는 맥락막의 넓이와 강한 연관성을 보였으며 이는 기존의 연구 결과들과 부합한다[8,17]. 이는 맥락막두께가 맥락막혈관지수를 어느 정도 반영하는 지표로 생각할 수 있다는 것을 시사한다. 흥미롭게도, 정상안에 비하여 녹내장안에서 맥락막혈관지수가 유의하게 낮음에도 불구하고 맥락막 넓이는 두 군 간에 통계적으로 유의한 차이를 보이지 않았다. 또한 맥락막혈관지수와 달리 맥락막의 넓이는 전사상판조직과 유의한 관련성을 보이지 않았다(Table 5). 이는 녹내장안의 맥락막혈관성의 소실이 맥락막 얇아짐의 부수 현상이라기보다 일차적인 현상임을 시사한다.
본 연구는 몇 가지 제한점이 존재한다. 첫째, 단면 연구의 특성상 맥락막혈관성이 녹내장의 진행에 어떤 역할을 할지에 대해서는 향후 종단적 연구가 필요할 것으로 생각된다. 둘째, 전사상판조직의 두께 등 시신경 관련변수들은 중심와‐브루크막개방각 축을 포함하는 시신경의 중심부에 서만 측정되었다. 그러나 전사상판조직의 두께, 사상판 깊이 및 전사상판조직 앞 깊이 수치 모두 관찰자 간 일치도가 양호하였으며 사상판의 후방 휘어짐이 중앙 영역에서 두드 러지므로 이 영역에서 측정하는 것이 바람직할 것으로 생각된다[12]. 더욱이 시신경의 주변 영역에서의 측정은 신경망막 테두리와 큰 혈관에 음영으로 인하여 어려움이 있을 것으로 생각된다[31]. 마지막으로, 맥락막혈관성을 얻기 위한 현재의 영상의 이진화 기법은 안축장 등에 의한 안구 확대를 고려하지 않았으며 큰 표층 망막혈관에 의한 음영을 제거하지 못했다는 제한점이 있다. 그러나 세 그룹은 연령, 각막 두께, 안축장에서 유의한 차이를 보이지 않았으며[8,32], 맥락막혈관성은 안축장과 관련이 없었다. 향후 이러한 제한점을 해결하기 위하여 맥락막혈관성 측정 기법의 기술적 개선이 요망된다.
결론적으로 녹내장안은 정상안에 비해 맥락막혈관지수 및 전사상판조직의 두께가 유의하게 낮았으며, 두 변수는 정상안과 녹내장안을 포함한 모든 참가군에서 양의 상관관계가 있었다. 이 결과는 유두주위 맥락막 순환이 전사상판 조직의 혈류 순환과 관련성을 가짐을 시사한다. 향후 맥락 막의 혈관성과 녹내장 발병 및 진행 간의 인과관계에 대한 추가적인 연구가 필요할 것으로 생각된다.
Figure 1.
Representative cases showing differing choroidal vascularity index (CVI), prelaminar tissue thickness (PTT) among perimetric glaucoma (PG), pre-perimetric glaucoma (PPG), and healthy subjects. In the spectral‐domain optical coherence tomography (SD‐OCT) B scans, reference lines (white horizontal lines) connecting the Bruch’s membrane termination and three vertical lines from the reference line are marked. The anterior prelaminar depth (APLD), lamina cribrosa depth (LCD), and PTT are marked as green, yellow, and red lines, respectively (C, D, H, I, M, N). CVI was derived as a proportion of the choroidal vasculature (yellow outlines) against the total choroidal area (TCA) by image binarization of the 3.5 mm‐sized radial circle on the SD‐OCT scan (E, J, O). (A‐E) Left eye of 66‐year‐old healthy subject with normal‐looking retinal nerve fiber layer (RNFL) (A) and visual field (VF) result (mean deviation [MD] = +0.36 dB) (B) had PTT (323.5 μm), LCD (494.5 μm), APLD (204.7 μm) (C, D), TCA (4.82 mm2), and CVI (69.06%) (E). (F‐J) Right eye of 64‐year‐old PPG patient with RNFL defect in inferotemporal area (F) and normal VF result (MD = +0.38 dB) (G) had thinner PTT (157.5 μm), larger APLD (290.0 μm) (H, I), lower TCA (3.34 mm), and lower CVI (59.3%) (J) than a control eye (C‐E). (K‐O) Left eye of 65‐year‐old PG patient with RNFL defect in TI area (K) and VF damage in superotemporal area (MD = ‐4.49 dB) (L) had thinner PTT (50.83 μm), larger APLD (299.83 μm) (M, N), lower TCA (2.21 mm), and lower CVI (54.2%) (O) than a PPG subject (H‐J).
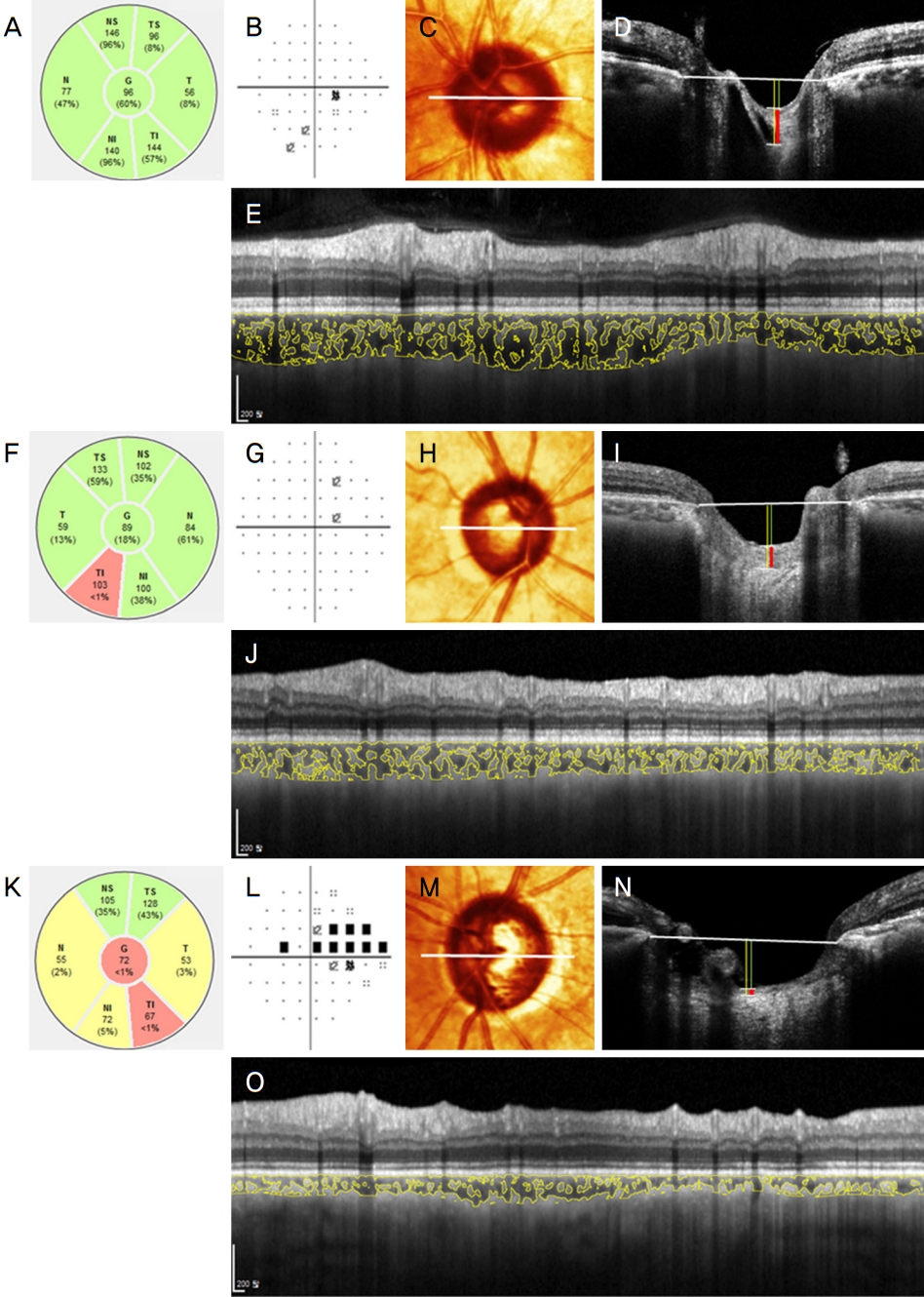
Figure 2.
Bland‐Altman plots showing the relationship between mean and difference of the optic disc parameters of the two observers. There was good inter-observer agreement for the prelaminar tissue thickness (PTT) (A), anterior prelaminar depth (APLD) (B), and lamina cribrosa depth (LCD) (C). The solid lines show the mean difference, and the dashed lines represent the 95% limit of agreement (LOA).
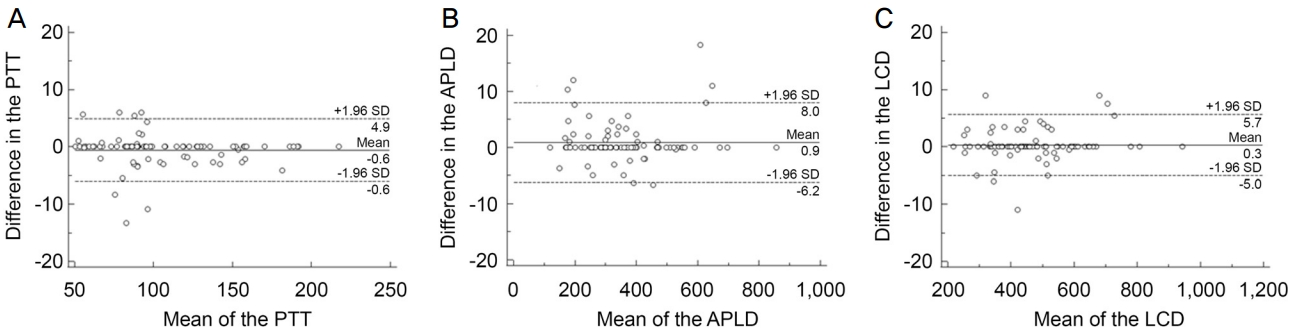
Table 1.
Comparison of the baseline parameters of healthy subjects, PPG, and PG patients
| Variable | Healthy group (n = 43) | PPG group (n = 86) | PG group (n = 86) | p‐value | Post hoc test |
|---|---|---|---|---|---|
| Age (years) | 52.2 ± 13.6 | 52.8 ± 14.4 | 52.8 ± 13.3 | 0.974* | |
| Gender, male/female | 17/26 | 40/46 | 30/56 | 0.296† | |
| Axial length (mm) | 24.3 ± 1.7 | 24.3 ± 1.3 | 24.4 ± 1.4 | 0.931* | |
| Central corneal thickness (μm) | 541.3 ± 34.4 | 545.3 ± 32.1 | 534.6 ± 34.6 | 0.113* | |
| Untreated IOP (mmHg) | 14.2 ± 2.3 | 15.8 ± 4.3 | 16.4 ± 4.2 | 0.014* | A < B = C |
| IOP at the time of the testing (mmHg) | 13.4 ± 2.4 | 13.2 ± 2.8 | 12.6 ± 2.5 | 0.111* | |
| Visual field MD (dB) | ‐0.6 ± 1.6 | ‐1.1 ± 1.8 | ‐4.7 ± 3.6 | <0.001* | C < B = A |
| Visual field PSD (dB) | 1.8 ± 0.6 | 1.9 ± 1.1 | 5.7 ± 3.6 | <0.001* | C < B = A |
| Average RNFL thickness (μm) | 101.4 ± 9.9 | 89.0 ± 10.3 | 77.6 ± 13.4 | <0.001* | C < B < A |
| BMO area (mm2) | 2.2 ± 0.4 | 2.4 ± 0.6 | 2.4 ± 0.5 | 0.032* | A < B = C |
| Fovea‐BMO angle (°) | ‐6.0 ± 3.9 | ‐6.8 ± 3.3 | ‐7.6 ± 3.7 | 0.056* |
Table 2.
Comparison of the choroidal vascularity and lamina cribrosa parameters of healthy subjects, PPG, and PG patients
| Variable | Healthy group (n = 43) | PPG group (n = 86) | PG group (n = 86) | p‐value | Post hoc test |
|---|---|---|---|---|---|
| PTT (μm) | 154.98 ± 79.46 | 106.16 ± 38.03 | 102.05 ± 44.01 | <0.001* | C = B < A |
| APLD (μm) | 279.05 ± 118.24 | 358.39 ± 142.45 | 379.16 ± 162.78 | 0.001* | A < B = C |
| LCD (μm) | 395.65 ± 91.17 | 464.55 ± 136.54 | 482.95 ± 147.27 | 0.002* | A < B = C |
| CVI (%) | 64.84 ± 3.13 | 63.36 ± 3.54 | 61.67 ± 4.11 | <0.001* | C < B < A |
| TCA (mm2) | 4.66 ± 1.26 | 4.76 ± 2.01 | 3.82 ± 1.18 | <0.001* | C < A = B |
Table 3.
Regression analysis testing factors associated with the choroidal vascularity index in healthy subjects, pre‐perimetric glaucoma and perimetric glaucoma patients (n = 215)
Table 4.
Regression analysis testing factors associated with the choroidal vascularity index in pre‐perimetric glaucoma and perimetric glaucoma patients (n = 172)
Table 5.
Regression analysis testing factors associated with the prelaminar tissue thickness in healthy subjects, pre.perimetric glaucoma, and perimetric glaucoma patients (n = 215)
| Variable |
Univariable analysis |
Multivariable analysis |
||
|---|---|---|---|---|
| ß (95% CI) | p‐value | ß (95% CI) | p‐value | |
| Age, per 1 year older | ‐0.421 | 0.122 | ||
| Gender, male | 0.004 | 0.958 | ||
| Central corneal thickness, per 1 μm thicker | ‐0.021 | 0.846 | ||
| Axial length, per 1 mm longer | 2.100 | 0.426 | ||
| Untreated IOP, per 1 mmHg higher | ‐2.112* | 0.025* | ‐0.529 | 0.517 |
| IOP at scan time, per 1 mmHg higher | 0.139 | 0.922 | ||
| Visual field MD, per 1 dB better | 1.525 | 0.181 | ||
| Average RNFL thickness, per 1 μm thicker | 1.302* | <0.001* | 0.816* | <0.001* |
| BMO area, per 1 mm2 larger | ‐19.26* | 0.006* | ‐11.71 | 0.057 |
| CVI, per 1% larger | 3.162* | 0.001* | 2.876* | 0.001* |
| TCA, per 1 mm2 larger | 2.802 | 0.222 | ||
| APLD, per 1 μm larger | ‐0.164* | <0.001* | ‐0.145* | <0.001* |
| LCD, per 1 μm larger | ‐0.107 | 0.117 | ||
REFERENCES
1) Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311:1901-11.



2) Fechtner RD, Weinreb RN. Mechanisms of optic nerve damage in primary open angle glaucoma. Surv Ophthalmol 1994;39:23-42.


4) Weinreb RN, Harris A. Ocular Blood Flow in Glaucoma. Amsterdam: Kugler Publications, 2009.
5) Lee KM, Lee EJ, Kim TW. Juxtapapillary choroid is thinner in normal‐ tension glaucoma than in healthy eyes. Acta Ophthalmol 2016;94:e697-708.


6) Lee KM, Kim JM, Lee EJ, Kim TW. Anterior optic nerve head perfusion is dependent on adjacent parapapillary choroidal perfusion. Sci Rep 2019;9:10999.



7) Park JH, Yoo C, Jung JH, et al. The association between prelaminar tissue thickness and peripapillary choroidal thickness in untreated normal‐tension glaucoma patients. Medicine (Baltimore) 2019;98:e14044.



8) Suh MH, Park JW, Khandelwal N, Agrawal R. Peripapillary choroidal vascularity index and microstructure of parapapillary atrophy. Invest Ophthalmol Vis Sci 2019;60:3768-75.


9) Lieberman MF, Maumenee AE, Green WR. Histologic studies of the vasculature of the anterior optic nerve. Am J Ophthalmol 1976;82:405-23.


10) Onda E, Cioffi GA, Bacon DR, Van Buskirk EM. Microvasculature of the human optic nerve. Am J Ophthalmol 1995;120:92-102.


11) Anderson DR, Braverman S. Reevaluation of the optic disk vasculature. Am J Ophthalmol 1976;82:165-74.


12) Kim DW, Jeoung JW, Kim YW, et al. Prelamina and lamina cribrosa in glaucoma patients with unilateral visual field loss. Invest Ophthalmol Vis Sci 2016;57:1662-70.


13) Jung YH, Park HY, Jung KI, Park CK. Comparison of prelaminar thickness between primary open angle glaucoma and normal tension glaucoma patients. PLoS One 2015;10:e0120634.



14) Yang H, Downs JC, Girkin C, et al. 3‐D histomorphometry of the normal and early glaucomatous monkey optic nerve head: lamina cribrosa and peripapillary scleral position and thickness. Invest Ophthalmol Vis Sci 2007;48:4597-607.


15) Lucy KA, Wang B, Schuman JS, et al. Thick prelaminar tissue decreases lamina cribrosa visibility. Invest Ophthalmol Vis Sci 2017;58:1751-7.



16) Sullivan‐Mee M, Patel NB, Pensyl D, Qualls C. Relationship between juxtapapillary choroidal volume and beta‐zone parapapillary atrophy in eyes with and without primary open‐angle glaucoma. Am J Ophthalmol 2015;160:637-47.e1.



17) Park JW, Suh MH, Agrawal R, Khandelwal N. Peripapillary choroidal vascularity index in glaucoma‐a comparison between spectral‐ domain OCT and OCT angiography. Invest Ophthalmol Vis Sci 2018;59:3694-701.


18) Park Y, Cho KJ. Choroidal vascular index in patients with open angle glaucoma and preperimetric glaucoma. PLoS One 2019;14:e0213336.



19) Agrawal R, Chhablani J, Tan KA, et al. Choroidal vascularity index in central serous chorioretinopathy. Retina 2016;36:1646-51.


20) Agrawal R, Ding J, Sen P, et al. Exploring choroidal angioarchitecture in health and disease using choroidal vascularity index. Prog Retin Eye Res 2020;77:100829.


21) Suh MH, Zangwill LM, Manalastas PI, et al. Deep retinal layer microvasculature dropout detected by the optical coherence tomography angiography in glaucoma. Ophthalmology 2016;123:2509-18.


22) Agrawal R, Gupta P, Tan KA, et al. Choroidal vascularity index as a measure of vascular status of the choroid: measurements in healthy eyes from a population‐based study. Sci Rep 2016;6:21090.



23) Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25 years of image analysis. Nat Methods 2012;9:671-5.



24) Sonoda S, Sakamoto T, Yamashita T, et al. Choroidal structure in normal eyes and after photodynamic therapy determined by binarization of optical coherence tomographic images. Invest Ophthalmol Vis Sci 2014;55:3893-9.


25) Sonoda S, Sakamoto T, Yamashita T, et al. Luminal and stromal areas of choroid determined by binarization method of optical coherence tomographic images. Am J Ophthalmol 2015;159:1123-31.e1.


26) Park HY, Lee NY, Shin HY, Park CK. Analysis of macular and peripapillary choroidal thickness in glaucoma patients by enhanced depth imaging optical coherence tomography. J Glaucoma 2014;23:225-31.


27) Roberts KF, Artes PH, O’Leary N, et al. Peripapillary choroidal thickness in healthy controls and patients with focal, diffuse, and sclerotic glaucomatous optic disc damage. Arch Ophthalmol 2012;130:980-6.


28) Zhang C, Tatham AJ, Medeiros FA, et al. Assessment of choroidal thickness in healthy and glaucomatous eyes using swept source optical coherence tomography. PLoS One 2014;9:e109683.



29) Maul EA, Friedman DS, Chang DS, et al. Choroidal thickness measured by spectral domain optical coherence tomography: factors affecting thickness in glaucoma patients. Ophthalmology 2011;188:1571-9.
30) Song YJ, Kim YK, Jeoung JW, Park KH. Assessment of open‐angle glaucoma peripapillary and macular choroidal thickness using swept‐source optical coherence tomography (SS‐OCT). PLoS One 2016;11:e0157333.



-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,985 View
- 49 Download
- Related articles
-
Correlation Between Nocturnal Dip and Progression of Glaucoma.2010 November;51(11)
Correlation Between Central Corneal Thickness and Glaucomatous Damage.2012 July;53(7)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print