유리체강 내 애플리버셉트 주사 후 발생된 비동맥염 앞허혈시신경병증 1예
A Case of Nonarteritic Anterior Ischemic Optic Neuropathy after Intravitreal Aflibercept Injection
Article information
Abstract
목적
유리체강 내 애플리버셉트 주사 이후 발생한 비동맥염 앞허혈시신경병증 1예를 보고하고자 한다.
증례요약
고혈압 및 고지혈증의 기저 질환이 있는 71세 여자 환자가 우안의 습성 황반변성으로 진단받고 유리체강 내 애플리버셉트 주사를 한 달 단위로 2회 시행하였다. 2회차 주사 이후 시력은 회복되었으나 시신경 하측 유두테 경계가 불명확해진 동시에 해당 부위의 망막신경섬유층 부종이 관찰되었다. 주사의 부하량 스케줄에 따라 4주 뒤 추가 주사(3회차 주사)를 하였고, 시행 2주 후 환자는 급격한 시력저하를 호소하며 내원하였다. 검사상 전반적인 시신경유두테의 경계가 불명확해짐과 망막신경섬유층의 심한 부종이 확인되었다. 임상적으로 비동맥염 앞허혈시신경병증으로 진단하였다. 두 달 뒤 시신경부종은 가라앉았으나 시력은 회복되지 않았으며, 시신경 창백 및 망막신경섬유층의 광범위한 위축 소견이 관찰되었다. 추후 6개월간 시력은 회복되지 않았다.
결론
본 증례를 통해, 유리체 내 항혈관내피성장인자 주사 치료 시 비동맥염 앞허혈성시신경병증이 발생할 수 있음을 확인하였고, 작은 시신경유두 및 전신 질환의 위험 요소가 있는 경우 특히 주의가 요구된다. 아울러, 주사 직후 안압 상승 여부에 대한 확인 및 관리가 필요하며, 검진 시에도 황반부 이외에도 시신경유두를 포함한 포괄적인 모니터링이 필요하다고 볼 수 있다.
Trans Abstract
Purpose
To report a case of nonarteritic anterior ischemic optic neuropathy (NAION) development after intravitreal injection of aflibercept.
Case summary
A 71-year-old female presented with decreased visual acuity and was diagnosed with wet macular degeneration in the right eye. She received two intravitreal aflibercept injections. After 1 month, the best-corrected visual acuity (BCVA) had improved. However, the inferior rim of the optic disc was blurred and an inferior retinal nerve fiber layer (RNFL) swelling was observed. The patient received one more intravitreal aflibercept injection (a loading dose). After 2 weeks, the patient presented with sudden vision loss and the BCVA was finger-counting at 50 cm. Fundus examination revealed that the total optic disc rim was blurred and optical coherence tomography demonstrated diffuse RNFL swelling. The patient was diagnosed with NAION. After 2 months, the optic disc appeared pale but without blurring of the rim, and diffuse thinning of the RNFL was observed. Her BCVA had not improved up to 6 months of follow-up.
Conclusions
Although NAION after intravitreal injection is uncommon, physicians should not only examine the macula but also comprehensively assess the intraocular pressure, the RNFL profile, and the optic disc head, especially in patients with NAION risk factors.
황반변성은 고연령층에서 황반부에 드루젠이 형성되면서 다양한 형태의 변성이 오는 질환으로, 맥락막 신생혈관의 발생 유무에 따라 건성과 습성으로 분류한다. 맥락막 신생혈관의 발생에 혈관내피성장인자(vascular endothelial growth factor, VEGF)가 관련되어 있다는 것이 밝혀지면서 유리체강 내 항혈관내피성장인자(anti-VEGF) 주사 치료가 습성 황반변성 치료의 표준 지침으로 자리잡고 있다. 항혈관내피성장인자항체(anti-vascular endothelial growth factor antibody, anti-VEGF antibody) 중의 하나인 애플리버셉트(aflibercept; EYLEA®, Regeneron, Tarrytown, NY, USA)는 2011년 11월 미국 Food and Drug Administration에서 승인된 이후 습성 나이관련황반변성, 망막정맥폐쇄 및 당뇨황반부종 등의 다양한 망막 질환에서 널리 상용되고 있다[1].
Anti-VEGF의 유리체강 내 주사는 비교적 안전하게 시행될 수 있는 치료법이지만 드물게 안구 혹은 전신에 부작용이 발생할 수 있다. 이러한 합병증으로는 결막 출혈, 안구 통증, 안구 내 부유물, 안압 상승의 비교적 회복 가능한 소견부터, 망막열공, 망막 및 맥락막 혈관 폐쇄, 유리체출혈, 안내염 등 치명적인 후유증을 야기하는 질환까지 다양하게 존재한다[2,3]. 그중 드물기는 하나 anti-VEGF 유리체강 내 주사 후 비동맥염 앞허혈성시신경병증(nonarteritic anterior ischemic optic neuropathy, NAION)이 발생한 경우도 보고되고 있다[4,5].
NAION은 무통성의 갑작스러운 시력저하, 시야결손을 특징으로 하는 질환으로, 색각이상, 유두부종, 구심성동공 운동장애 등이 동반될 수 있다. 허혈성시신경병증은 50세 이상에서 가장 흔한 시신경병증으로, 50세에서 NAION의 10만 명당 유병률은 10.2명으로 흔한 질환이다[6]. NAION의 시력저하의 정도는 다양하며 Hayreh and Zimmerman [7]은 실제 NAION 환자의 약 21% 정도에서 시력이 0.1 이하로 떨어진다고 하였고, 시력 0.3 이상인 환자에서 약 9%, 0.3 미만인 환자의 18% 정도에서 2년 내 시력의 악화가 진행된다고 하였다[7]. 하지만 현재 NAION의 치료제로 명확하게 입증된 것은 없다. Steroid 치료는 시신경유두부종의 빠른 해소에 도움을 주나, 최종적으로 교정시력, 시야장애 등에 있어서는 치료하지 않은 군과 유의한 차이를 갖진 않는다고 하였다[8]. 이와 같은 빈도 및 시각적 예후를 고려할 때, NAION의 발생은 임상적으로 중요하며 무엇보다 예방적 관리가 필요한 질환이라고 할 수 있다.
저자들은 유리체강 내 애플리버셉트 주사 후 발생된 NAION 1예를 경험하였기에 이를 보고하고자 한다.
증례보고
기저 질환으로 고혈압 및 고지혈증이 있는 71세 여자 환자가 우안의 시력저하로 내원하였다. 최대교정시력은 우안 0.6, 좌안 1.0이었고 안압은 우안 15 mmHg, 좌안 14 mmHg 였다. 세극등현미경검사상 경도의 백내장 소견 이외에는 특이 소견이 발견되지 않았다. 안저검사상 황반부의 경도의 융기 소견이 보였고, 시신경유두직경에 대한 유두연-황반오목거리의 비(disc-to-fovea distance to disc-diameter ratio)는 약 3.0으로 시신경유두가 다소 작은 크기를 보였다[9]. 빛간섭단층촬영(optical coherence tomography, OCT) 상에서 황반부의 망막하액의 축적과 망막색소상피층의 변성이 보였으며, 형광안저조형술을 통해 우안 습성 황반변성으로 진단되었다(Fig. 1).

Initial fundus photography, optical coherence tomography (OCT), and fluorescein angiography (FA). (A) Fundus photography shows two disc diameter sized macular elevation (green arrows) and retinal pigment epithelium changes. (B) Baseline OCT shows subretinal fluid and retinal pigment epithelium degenerative changes. (C) FA shows leakage on perifovea. (D) Disc OCT shows peripapillary retinal nerve fiber layer thickness of within normal limit.
치료로 우안 유리체강 내 애플리버셉트(EYLEA®, 2 mg/0.05 mL) 주사를 한 달 단위로 2회 시행하였다. 1차 주사 이후 망막하액 및 장액망막박리 소견은 대부분 해소되었고 우안 시력도 0.9로 측정되었다(Fig. 2A). 한편 2차 주사 후, 황반부 소견과 달리, 시신경 하측 유두테의 경계가 blurring되는 소견이 관찰되었고, OCT상 해당 부위의 망막신경섬유층 두께가 증가하는 소견이 관찰되었다(Fig. 2B, C). 저자들은 시력 상승 및 망막하액의 감소 소견을 근거로 애플리버셉트 치료가 반응이 있는 것으로 판단하여, 시신경부종 소견에도 불구하고 부하량(loading dose)을 위해 애플리버셉트를 4주 후 추가 주사(3회차 주사)하였다.

Optical coherence tomography (OCT) and fundus photographys in the right eye performed 1 month after the second aflibercept injection. (A) OCT showed absorption of subretinal fluid. However, (B) swelling of the inferior margin of optic nerve head (green arrows) and (C) corresponding increase of retinal nerve fiber layer thickness were observed.
하지만 3차 주사 시행 2주 뒤, 환자는 우안의 급격한 시력저하를 주소로 내원하였다. 우안 시력은 안전수지로 저하되었고 상대구심동공장애가 확인되었다. 안저검사상 시신경유두의 상측부에 광범위한 부종 소견이 보였으며, OCT상 황반부는 평탄하였으나 시신경유두 주변 망막신경섬유층이 두께가 심하게 증가하였다. 시야검사에서는 광범위한 시야 협착 소견이 확인되었다(Fig. 3).

The ophthalmic examinations about 2 weeks after the third aflibercept injection. (A) Superior optic disc margin swelling on fundus photography was observed. (B) Severely constricted visual field was observed on Humphrey visual field exam. (C) Optical coherence tomography showed an increase of the superior retinal nerve fiber layer thickness and B-scan showed swelling of the optic nerve head tissue
임상적으로 NAION으로 진단하여 ginkgo biloba 80 mg을 처방하였다. 아울러 초진 시보다 상승된 안압(2회차 주사 후 18 mmHg, 3회차 주사 후 20 mmHg)이 관찰되어, 안압하강제(dorzolamide-timolol; Cosopt ® , Santen Pharmaceutical Co., Ltd., Osaka, Japan) 사용을 시작하였다. 진단 한 달 뒤 황반부 망막하액은 관찰되지 않았으며, 두 달 뒤 시신경부종은 가라앉았고 안압은 15 mmHg였으나, 시력은 회복되지 않았다. OCT상 황반부 신경절세포-내망상층(ganglion cell-inner plexiform layer, GC-IPL) 두께는 진단 한 달 뒤 시점부터 점진적으로 감소하였다. 3개월째 시신경 창백 소견이 보였으며, 황반부 신경절세포-내망상층 및 망막신경 섬유층의 광범위한 위축 소견이 관찰되었다(Fig. 4A). 추후 6개월간 경과 관찰하였으나 시력은 안전수지로 회복되지 않았다(Fig. 4B).
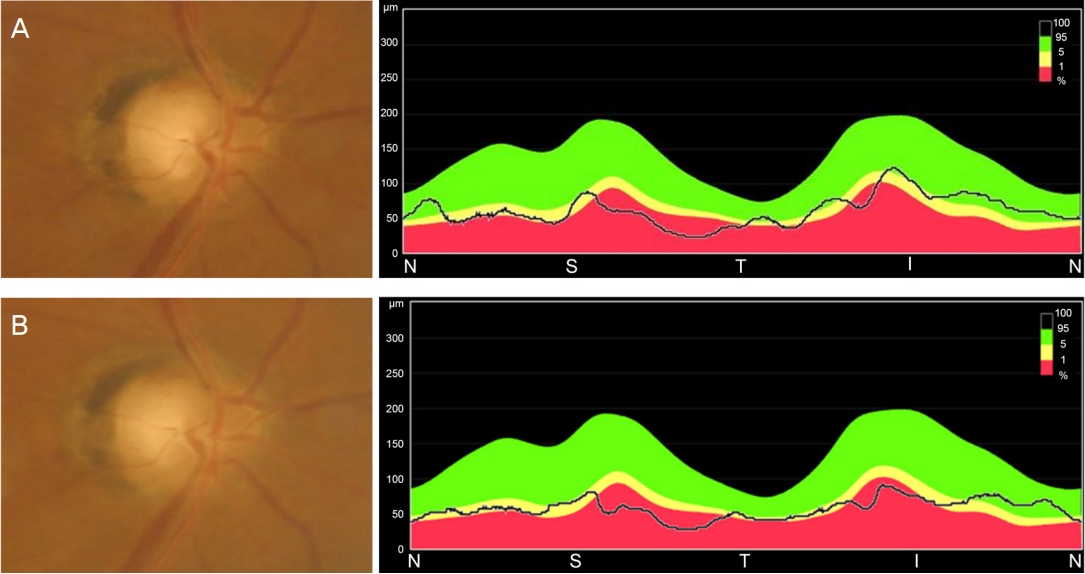
Fundus photography and optical coherence tomography in the right eye performed at (A) 3 months and (B) 6 months after the diagnosis Nonarteritic anterior ischemic optic neuropathy. (A) Optic disc margin was restored but retinal nerve fiber layer (RNFL) thickness decreased. (B) Optic pallor and corresponding diffuse RNFL thinning were observed.
고 찰
본 증례는 고혈압과 고지혈증이 있는 고령 여성에서 우안 습성 황반변성으로 유리체강 내 애플리버셉트 주사를 3회 받은 뒤, 발생된 NAION 증례이다. 환자는 초기 전형적인 시신경 및 망막신경섬유층의 부종을 보인 뒤 점진적인 시신경 창백과 신경섬유 위축의 경과를 보였고, 6개월간의 추적 관찰 기간 동안 시력이 개선되지 않았다. 본 증례는 유리체강 내 항체 주사 후 발생된 NAION에 대한 국내 보고가 아직 많지 않은 점에 의의가 있다.
시신경유두부의 혈류는 후모양체 동맥(posterior ciliary artery)의 관류압(perfusion pressure)과 저항에 의해 유지되는데 이의 균형이 깨져 생기는 허혈성 변화가 앞허혈시신경병증의 병인으로 생각된다[10]. 그중 관류압은 평균 혈압에서 안압을 감한 것으로 정의되며 평균 혈압이 임계치 이상으로 떨어지거나 안압이 상승하면 관류압이 하강하고 결과적으로 시신경유두부의 혈류가 감소하여 허혈성 변화에 빠진다[11]. 이 관류압을 병적으로 변화시키는 요인으로 전신 혈관 질환인 고혈압, 당뇨, 고지혈증, 심혈관 질환, 거대세포동맥염, 수면무호흡증 등과 안구 자체 요인으로 안압 상승, 작은 시신경유두부, 시신경유두드루젠 등이 앞허혈시신경병증의 위험 인자로 알려져 있다[12,13]. 아울러, 본 연구와 같이 유리체강 내 주사와 같은 안 내 술기 및 수술 또한 안압을 상승시키면서 시신경유두의 관류압을 감소시킬 수 있다. 또한 시술 과정에서 오는 스트레스 등도 원인 요소가 될 수 있다[14].
본 증례의 환자는 비교적 작은 크기의 시신경유두를 가지고 있었는데(disc-to-fovea distance to disc-diameter ratio ≒ 3.0), 이는 NAION의 위험 요소로 알려져 있으며 고혈압 및 고지혈증의 기왕력도 혈류장애의 위험 인자가 될 수 있다. 아울러, 연속된 유리체강 내 주사 과정에서 안압 상승이 유발될 수 있고, 이는 시신경유두부의 관류압 감소를 야기할 수 있다. 또한 주사 후 발생된 안구 내 염증 및 혈관염과 연관된 허혈성 장애 등도 그 발생 기전으로 추측해 볼 수 있다.
최근 습성 황반변성의 치료로 항혈관내피성장인자항체인 베바시주맙, 라니비주맙, 애플리버셉트가 널리 사용되고 있다. 세 가지 약제는 서로 구조적 차이를 가지고 있다. 베바시주맙은 재조합 인체화 단일클론 immunoglobulin 항체이며, 라니비주맙은 인체화 단일클론 항체의 Fab 분절이다. 이후 개발된 애플리버셉트는 혈관내피성장인자 수용체로 immunoglobulin G-1의 불변 부위에 VEGF 수용체-1, VEGF 수용체-2의 도메인이 포함되도록 제조되었다[15]. 애플리버셉트는 VEGF-A뿐만 아니라 VEGF-B, placental growth factor에도 결합하므로, 혈관내피성장인자에 보다 강한 친화력을 가지고 있으며, 그 효과가 더 오래 지속된다고 보고되었다. 애플리버셉트의 강한 친화력은 정상적인 혈류학적 상태에 보다 큰 작용을 할 수 있으며, 본 증례와 같이 반복적인 주사 과정에서 안구 내 혈류에 더욱 오랫동안 남아 있게 되어 앞허혈시신경병증 발생의 위험을 높였을 것으로 추측된다.
항혈관내피성장인자항체 유리체강 내 주사 후 발생할 수 있는 합병증들은 결막 출혈, 안구 통증, 안구 내 부유물, 망막열공, 망막 및 맥락막 혈관 폐쇄, 유리체출혈, 안내염 등이 잘 알려져 있으며 드물게 NAION이 보고되고 있다[2-5]. NAION의 병태생리학적 기전에 대해서는 아직 논란이 있으나 시신경으로 공급되는 혈류순환의 장애를 그 원인으로 추측하고 있다. 그 외에 혈관의 연축, 혈류의 자동순환시스템의 이상이 연관된 기전으로 여겨진다. 이와 같은 혈류의 공급 부족은 시신경의 부종과 주변부 출혈을 야기할 수 있다[10,11].
Hosseini and Razeghinejad [5]는 습성 황반변성이 있는 72세여성에서 두 차례 유리체강 내 아바스틴 주사 이후 발생한 NAION에 대해 보고한 바 있다. 환자는 두 번째 아바스틴 주사 시행 1주 후 급격한 시력저하를 호소하였고, 최대교정시력은 광각유, 상대구심동공운동장애 양성 소견과 함께 시신경유두부종이 관찰되었다. NAION 진단 후 경과 관찰하였으나 환자의 시력은 개선되지 않았다. 해당 증례는 본 증례와 비교할 때, 고혈압과 고지질혈증의 기저 질환 그리고 환자가 작은 시신경유두를 갖고 있었다는 공통점이 있었다. 또한 반복된 유리체강 내 주사 시행 이후 시신경유두 부종을 동반한 급격한 시력저하가 발생하였고, 시력 예후가 좋지 않았다는 점 역시 비슷하다. Ganssauge et al [4]은 기저 질환이 없는 51세 남성에서 맥락막 신생혈관 치료를 위한 아바스틴 주사 후 발생한 NAION 증례에 대해 보고하였다. 환자는 주사 치료 시행 2주 후 시신경유두부종을 동반한 시야장애를 호소하였다. 12개월째 0.1까지 시력이 저하되었다가 서서히 회복되어 18개월째 우안 최대교정시력은 0.3으로 조금 회복되었다. 상기 증례는 기저 질환이 없는 남성에서 1회의 주사 치료 후에 NAION이 발생된 점 그리고 최종시력 예후도 비교적 불량하지 않은 점이 본 증례와 차이를 보였다.
본 증례에서 주사 전 황반부 신경절세포-내망상층(GC-IPL) 두께는 NAION 발생 직후 유두 주변의 망막신경섬유층의 부종에도 불구하고 기저값과 뚜렷한 차이를 보이지 않았다. 하지만 망막신경섬유층의 부종이 완전히 회복되기 전인 진단 후 한 달 시점에서, 황반부 신경절세포-내망상층 두께 감소가 선행하여 시작되었다. 이 점은 황반부 신경절세포-내망상층 두께 측정이 NAION에서 초기 구조적 손실의 biomarker가 될 수 있음을 시사한다. 추후 이에 대한 보완적 연구가 필요하다.
특히, 본 증례의 경우 두 번째 안구 내 항체 주사 후 시신경 하측 부위의 부종이 발생하였던 점을 저자들이 인지하고도, 시력 호전 및 망막하액의 감소 소견만을 근거로 추가적인 애플리버셉트 주사를 시행한 점이 임상적 아쉬움으로 남는다. 아울러, 시신경 이상 소견에도 불구하고 시야 및 색각검사를 2회차 주사 직후에 시행하지 못하였고, 산동검사 관계로 동공 반응을 확인하지 못한 점은 조기 진단을 놓친 원인으로 판단된다. 특히, 세 번째 유리체강 내 주사 후 시신경 상측 부위에 새롭게 부종이 생기면서 기존의 하측 부위의 부종은 줄어든 양상이었는데, 이는 추가적인 NAION이 병합된 것으로 사료된다. 이와 같이, 반복적인 주사 과정에서 발생된 시신경유두부종을 고려할 때, 세 번째 유리 체강 내 주사는 보류했어야 함이 더 바람직해 보인다. 추후 유사한 사례에서는 주사 치료의 스케줄(treat and extend regimen)을 무조건 따르기보다는 시신경 상태 등을 면밀히 확인하면서 추가 주사 여부를 결정하는 유연함이 필요해 보인다. 본 증례를 통해, 기저 질환 및 작은 시신경유두의 위험 인자를 가진 환자에서 반복적인 유리체강 내 주사 치료를 받는 경우, 황반부 평가 이외에도 시신경유두 및 망막 신경섬유층의 상태도 종합적으로 확인하는 자세가 요구된다고 볼 수 있다.
본 증례 환자는 임상적으로 NAION으로 판단하였으나, 시신경염의 가능성도 완전히 배제할 수 없다. 시신경부종후 시행한 시야검사에서 전형적인 패턴이 아닌 전반적인 감소 양상이 관찰되었다. 이는 동반된 황반변성으로 인해 중심시력이 매우 낮은 편이었고 그로 인해 시야 결과에 영향을 주었을 것으로 판단된다. 하지만 이런 비전형적인 시야 양상은 임상적으로 시신경부종을 동반하는 특발성 시신경염이나 당뇨시신경병증 등을 배제할 필요가 있다. 하지만 본 증례의 경우 관련 전신검사나 magnetic resonance imaging 촬영 등의 추가검사를 수행하지 못하였고 이 점은 질환의 최종 진단에 있어 제한점이 될 수 있다. 본 증례에서 NAION 진단 시 안구 관류압을 향상시키기 위해 안압하강제를 사용하였다. 하지만 안압이 20 mmHg 정도로 경계성 상승을 보였기에 안압하강제 치료의 효용성에 논란의 소지가 있어 보인다. 또한 혈압을 함께 측정하지 못한 점도 안구 관류압의 역할을 정확히 평가하는 데 제한점이 될 수 있다.
저자들은 습성 황반변성 환자에서 유리체강 내 애플리버셉트 주사 후 발생한 NAION 증례를 경험하였다. 본 증례만을 통해 비동맥염 앞허혈시신경병증의 발병과 애플리버셉트 주사 치료와의 인과관계를 명확히 규정할 수는 없으나, 기존 유사 증례 및 그 발생 기전을 고려해 볼 때 상관관계를 배제할 수는 없다. 반복적인 유리체강 내 주사를 시행하는 경우 작은 시신경유두를 가지고 있거나 고혈압, 고지혈증 같은 기왕력을 갖고 있는 환자에서는 NAION 발생에 대한 주의가 요구된다. 또한 시술 후 안압 상승을 방지하는 조치와 급격한 시력저하에 대한 증상 교육이 필요하다. 아울러 경과 관찰 과정에서 황반부뿐만 아니라 시신경유두 및 망막신경섬유층을 포함한 포괄적인 모니터링을 시행해야 할 것이다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
주성준 / Sungjun Joo
한림대학교 의과대학 한림대학교성심병원 안과학교실
Department of Ophthalmology, Hallym University Sacred Heart Hospital, Hallym University College of Medicine
