안구 이식편대숙주병 환자들에서 발생한 감염각막염의 임상 양상
Clinical Manifestation of Infectious Keratitis in Ocular Graft Versus Host Disease
Article information
Abstract
목적
안구 이식편대숙주병 환자들에서 발생한 감염각막염의 임상 양상과 위험인자를 알아보고자 한다.
대상과 방법
2015년 1월부터 2020년 12월까지 안구 이식편대숙주병으로 진단받은 후 감염각막염이 발생한 환자 11명과 감염각막염이 발생하지 않은 36명의 의무기록을 후향적으로 조사하였다. 두 군의 성별, 연령, 기저 질환, 전신 이식편대숙주병에 의한 타 장기의 침범 여부, 사용된 전신 면역억제제, 안구 이식편대숙주병의 이환기간 등의 전신 지표와 감염 전 이식편대숙주병의 임상 양상 및 중증도, 감염 발생 후 각막상피결손의 크기 및 각막침윤 깊이, 전방축농 여부, 미생물배양검사결과 등의 임상지표를 조사하였다. 감염 발생군과 미발생군의 전신 이식편대숙주병 상태를 포함한 전신지표 및 안구지표들을 카이제곱검정을 통해서 비교하였고, 감염 발생과 관련 있는 위험인자들에 대해 이용하여 각각 회귀분석을 시행하였다.
결과
안구 이식편대숙주병으로 인한 각막지표 중 각막 필라멘트, 각막 신생혈관, 각막상피결손이 감염 발생군에서 유의미하게 많았으며(p<0.05), 이식편대숙주병의 중증도는 감염 발생군에서 유의하게 높았다(p<0.001). 감염 발생은 감염 전 각막 필라멘트, 각막 신생혈관, 각막상피결손의 존재와 유의한 관계가 있었고(p<0.05), 다변량 회귀분석에서 감염 발생의 위험인자는 각막상피결손의 존재(p=0.029)였다.
결론
안구 이식편대숙주병에서 감염 발생 전 각막상피결손, 각막 신생혈관, 각막 필라멘트의 존재가 감염 발생과 관련이 있으며, 이 중 각막상피결손의 존재가 안구 이식편대숙주병에서 감염각막염 발생의 위험인자였다.
Trans Abstract
Purpose
We evaluated the clinical manifestations of, and risk factors for, infectious keratitis in patients with ocular graft-versus-host disease (GVHD).
Methods
A total of 11 patients who developed infectious keratitis after a diagnosis of ocular GVHD between January 2015 and December 2020, and 36 who did not (the control group), were included in this retrospective study. We recorded sex, age, any underlying disease, any other organ affected by systemic GVHD, systemic immunosuppressant use, follow-up duration, clinical manifestations, the severity of ocular GVHD prior to infection, the size of the epithelial defect, the depth of infiltration, hypopyon status, and the results of microbiological tests. Systemic and ocular indices (including systemic GVHD status) were compared using the chi-squared test. Risk factors for infection were identified.
Results
Of the corneal indices, the presence of corneal filaments, the extent of corneal neovascularization, and the number of corneal epithelial defects were significantly higher in the infected group (p = 0.023, p = 0.004, and p = 0.001, respectively). GVHD severity was also significantly higher in that group (p < 0.001). The presence of corneal filaments, corneal neovascularization, and corneal epithelial defects prior to infection correlated significantly with the risk of infection (p = 0.046, p = 0.010, and p = 0.003, respectively). Multivariate analysis identified corneal epithelial defects as a significant risk factor for infection (p = 0.029).
Conclusions
In patients with ocular GVHD, corneal epithelial defects, corneal neovascularization, and corneal filaments prior to infection were associated with the development of infection. In particular, corneal epithelial defects before infection was a significant risk factor for infection.
동종 조혈모세포 이식은 백혈병 등의 다양한 혈액 질환을 치료하기 위한 중요한 과정이지만, 공여자의 T 임파구로 인한 심각한 합병증인 이식편대숙주병(graft-versus-host disease, GVHD)이 발생할 수 있다. 이식편대숙주병은 조혈모 세포 이식 후 100일 이내에 발생하는 경우를 급성, 그 이후에 발생하는 경우를 만성으로 분류할 수 있다[1]. 안구를 침범하는 이식편대숙주병 역시 모든 시기에 발생할 수 있으나, 만성기에서 더 호발하며 이식편대숙주병 환자의 40-90%에서 발병하는 것으로 알려져 있다[2]. 안구를 침범하는 이식편대 숙주병은 일반적으로 각막, 결막, 안검, 눈물샘과 마이봄샘을 포함한 안구 표면을 구성하는 조직을 주로 침범한다[3-12]. 급성기에서는 공여자의 T세포와 수여자의 조직적합항원의 상호작용으로 눈 증상이 일어나며, 만성기에서는 결막과 눈물샘의 파괴와 섬유화로 인한 안구 표면의 건조증으로 인해 안 증상이 발생하는 것을 그 병태생리로 한다[10,13,14]. 따라서, 만성 안구 이식편대숙주병은 건성 각결막염, 심한 점상각막염이 주된 임상 양상으로 나타나게 된다[3,15].
만성 안구 이식편대숙주병은 종종 각막 신생혈관, 각막궤양 및 천공과 같은 심각한 합병증을 일으켜 불량한 시력 예후와도 연관될 수 있다고 알려져 있다[16-19]. 국외에서는 몇몇의 연구에서 만성 안구 이식편대숙주병에서 발생한 각막궤양에 대해서 증례보고한 바 있으나 발생 위험인자와 임상 양상에 대해 전층적으로 분석한 경우는 낮은 유병률 및 전신 질환으로 인한 높은 사망률에 의해 드물게 보고되었으며 국내 연구는 없는 실정이다[16,19,20]. 따라서 본 연구에서는 국내에서 안구 이식편대숙주병으로 진단받은 환자들을 대상으로 발생한 감염각막염의 임상 양상과 위험인자에 대해 분석하고자 하였다.
대상과 방법
2015년 1월부터 2020년 12월까지 안구 이식편대숙주병으로 진단받은 총 47명의 의무기록을 후향적으로 조사하였다. 안구 이식편대숙주병으로 진단받은 환자군 중 배양검사에서 원인균이 동정되었거나, 도말검사 상 양성인 환자, 임상 양상에서 감염각막염이 강하게 의심되어 이에 상응하는 치료를 시행받은 자의 경우를 감염 발생군으로, 그 외의 경우 감염 미발생군으로 정의하였다. 이 중 경과 관찰 기간이 1년 미만이거나 추적 관찰이 안되어 치료 결과를 알 수 없는 경우, 안구 이식편대숙주병을 제외한 다른 각막 질환이 있는 경우는 분석에서 제외하였다. 모든 연구 과정은 헬싱키선언을 준수하였으며 생명의학 연구윤리심의위원회의 승인에 따라 진행되었다(승인 번호: 2022-016).
환자 정보 수집
성별, 나이, 전신 기저 질환의 병력, 안질환의 병력, 이식 전 원발 혈액 질환, 동종 조혈모세포 이식 방법(골수이식 또는 말초혈액 조혈모세포 이식), 이식 전처치의 종류(고용량 항암요법 또는 전신 방사선 치료), 전신 이식편대숙주병에 의한 타 장기의 이환 여부, 사용한 전신 면역억제제의 종류 및 안구 이식편대숙주병의 이환 기간에 대해서 조사하였다. 모든 환자들은 이식 직후 장기 이식편대숙주병 발생 예방을 위해 전신 면역억제제를 사용하였으며, 혈액내과 전문의에 의해 안구 외 다른 장기의 이식편대숙주병 상태에 따라 용량을 유지하거나 조정하였다. 한편, 감염 발생군에 대해서는 안구 이식편대숙주병 발병일로부터 감염각막염 이환까지의 기간을 조사하였다.
임상검사법
안구 이식편대숙주병의 정도를 평가하기 위해 기본적인 안구 표면 지표들을 조사하였는데, 크게 눈꺼풀, 눈물, 각막 및 결막에 대한 지표들을 분석하였다. 먼저 눈꺼풀의 비정상 정도는 마이봄샘기능부전 및 두줄속눈썹의 유무를 통해 평가하였고, 마이봄샘기능부전은 Arita et al [21]의 분류에 따라, 마이봄샘의 소실이 없는 0단계를 제외한 1, 2, 3단계의 경우를 마이봄샘기능부전이 있는 경우로 정의하였다. 눈물 분비 정도는 쉬르머I검사를 이용하여 기록하였고, 점안마취제를 사용하지 않고 쉬르머검사지(Eagle Vision, Memphis, TN, USA)의 한쪽 끝을 접은 후 하안검을 잡아당겨서 하안검 외측 1/3 부분에 검사지의 접은 부분이 결막낭 내로 들어가게 한 후 5분 후에 제거하여 쉬르머검사지의 젖은 부분의 길이를 mm 단위로 측정하였다. 안구 표면 질환지수는 안구 증상 관련 항목 3가지, 시기능 관련 항목 6가지 및 환경 자극 관련 항목 3가지에 대하여 각 항목당 0점에서 4점으로 하여 합산한 점수를 답변한 질문 수로 나누어 계산하였다[22]. 결막침범 정도는 결막충혈과 결막반흔의 유무를 통해 평가하였다. 각막침범은 각막상피병증의 정도와 필라멘트, 각막상피결손, 각막 신생혈관의 유무를 통해 평가하였고, 임상 경과에 따라 달라질 수 있기에 적절한 비교를 위해서 감염 미발생군은 가장 증상이 심했을 때의 안구 상태를 기준으로 하였고, 감염 발생군에서는 감염 발생 전 3개월 이내 가장 심했을 때를 기준으로 분류하였다. 각막상피병증은 Oxford Scheme 6-point scale을 사용하여 4-5점의 경우를 심한 경우, 0-3점의 경우를 심하지 않은 경우로 분류하였다[23].
안구 이식편대숙주병의 진단 및 정도 평가
안구 이식편대숙주병은 이식 후 100일 이후에 건성 각결막염이 동반된 환자에 대해 National Institute of Health (NIH) 및 International Chronic oGVHD Consensus group diagnostic criteria (ICCGVHD)를 통해 안과 전문의가 직접 평가하였으며, ICCGVHD의 진단기준 중 Definite ocular GVHD의 경우를 안구 이식편대숙주병으로 진단하였다[24,25]. NIH 중증도 점수는 증상으로 인한 일상생활 수행 능력의 제한 정도를 평가하여 분류하였으며, 증상으로 인한 일상 생활 수행 능력에 제한이 없는 경우 0점, 증상으로 인한 안약 점안 횟수가 3회 미만인 경우는 1점, 3회 이상이나 시력 감소는 없는 경우 2점, 3회 이상이면서 시력감소가 동반되어 일상생활 수행에 심각한 어려움이 있는 경우 3점으로 하였다. ICCGVHD 중증도 점수는 쉬르머검사, 각막형광염색검사, 안구 표면 질환지수 그리고 결막충혈의 4가지 인자의 합산점수로 계산하였다. 쉬르머검사 값은 15 mm보다 큰 경우를 0, 11점부터 15점인 경우를 1, 6점부터 10점인 경우를 2, 5점 이하를 3으로 하였고, 각막형광염색지수는 0점인 경우를 0, 2점보다 작은 경우를 1, 2점부터 3점인 경우를 2, 4점 이상인 경우를 3으로 하였다. 안구 표면 질환지수는 13점보다 작은 경우를 0, 13점부터 22점의 경우 1, 23점부터 32점의 경우 2, 33점 이상인 경우를 3으로 하였고, 결막 충혈은 충혈이 없는 경우 0, 경도의 충혈의 경우 1, 중등도의 충혈의 경우를 2로 하였다.
안구 이식편대숙주병의 발병 후 관리
모든 환자는 발병 후 인공눈물(0.1% Hyalu mini, sodium hyaluronate; Han-mi Pharm Co., Seoul, Korea), 스테로이드 점안액(Ocumetholone®; Samil, Seoul, Korea) 및 사이클로스포린 점안액(싸이포린엔점안액 0.05%; Taejoon, Seoul, Korea)으로 치료하였다. 스테로이드 점안액 및 사이클로스포린 점안액을 3개월 이상 사용해도 건성안 증상과 징후가 호전되지 않은 환자들의 경우 자가혈청 국소 점안액을 추가로 하루에 4회 점안하였다. 질병의 경과에서 각막상피결손이 발생한 경우에는 기존 치료를 지속하며, 스테로이드 점안액은 중지하였으며, Moxifloxacin 점안액(Vigamox®; Alcon Laboratories, Inc., Fort Worth, TX, USA)을 하루 4회 추가하였다. 상피결손이 회복된 후에는 다시 스테로이드 사용을 재개하였고, 점안 치료에도 불구하고 각막상피결손이 지속되거나 악화되는 경우 임상 양상을 고려하여 필요한 경우 양막이식술을 시행하였다.
감염 발생 시 안구검사법 및 미생물학적 평가
감염 발생군에서 감염 발생 전과 치료 후의 시력, 세극등현미경검사 상에서 각막상피결손의 크기 및 깊이, 전방축농의 유무, 배양검사 상 균 동정 결과를 조사하였으며 도말검사 및 배양검사는 감염각막염이 의심되는 모든 환자들에서 경험적 항생제를 투여하기 전에 시행하였다. 각막염 이환 전의 시력은 각막염 이환 전 가장 최근의 최대교정시력으로 하였고, 각막염 관해 후의 시력은 각막염이 관해되고 나서 1개월 후의 최대교정시력을 기준으로 하였다. 각막 병변의 크기는 각막상피결손의 크기로 나타내었으며 Mukerji et al [26]이 보고한 세극등현미경의 측정자를 이용한 측정 방식에 따라 병변의 가장 긴 직경과 그에 수직인 직경을 곱한 직사각형의 면적으로 계산하였다. 도말검사 및 배양검사는 0.5% proparacaine hydrochloride (Paracaine oph soln 0.5%; Hanmi Pharm, Seoul, Korea)로 각막을 점안마취한 뒤 No. 15 Bard-Parker knife (Bard-Parker Co., Danbury, CT, USA)를 이용하여 궤양 병변의 가장자리와 기저 부위를 긁어서 유리 슬라이드에 도말 표본을 만들었다. 검체의 도말 후 그람 염색 및 KOH 염색이 시행되었다. 또한 배양검사를 위해 감염 부위에서 병변이 진행하는 가장자리 부위를 획득하여, 검체를 묻힌 면봉을 이송배지에 넣어 미생물검사실로 보내고 도착 즉시 Blood agar와 MacConkey agar medium, Sabouraud agar에 접종하였고 배양을 시행하였다. 배양된 세균의 동정은 미생물자동분석기(VITEK [2] System; BioMerieux-Co, Lyon, France)를 이용하여 이루어졌다.
감염각막염 치료 과정 및 평가
배양검사 후 광범위한 강화 항생제 치료로 50 mg/mL fortified cefazolin (Cefazoline sodium; Chongkundang, Seoul, Korea)과 14 mg/mL tobramycin (Tobramycin sulfate; Huons, Seongnam, Korea)를 병합하여 투여하였으며 도말검사에서 KOH 양성이거나 임상적으로 진균 감염이 의심되는 경우 1% voriconazole (Vfend®; Pfizer, Sandwich, UK)로 치료를 시작하였다. 배양검사 및 항생제 감수성검사 결과, 치료에 대한 반응 정도를 평가하여 항생제의 종류 및 용법을 변경하였다. 임상 소견 호전 시 기존 항생제 사용을 유지하며 용량을 줄여 나갔고, 악화 양상이면 균의 감수성 결과를 반영하여 항생제를 변경하였다. 치료 성공은 각막상피의 완전한 회복 및 각막침윤의 관해로 정의하였고, 각막침윤의 크기가 더 커지거나 궤양의 진행으로 합병증이 발생하여 수술적 처치(각막 글루잉, 각막절편이식술, 전층각막이식술, 안구내용물제거술)를 필요로 하는 경우는 치료 실패로 정의하였다.
통계학적 분석
통계학적 분석은 SPSS software ver. 21.0 (IBM Copr., Chicago, IL, USA)를 이용하여 시행되었다. 감염 발생군과 감염 미발생군으로 나누어 각 군 간의 비교를 위해 감염 발생의 위험인자로 추정되는 연속변수에 관하여 Mann-Whitney U test, 비연속변수에 관하여 chi-square test를 시행하였고, p값이 0.05 미만인 경우를 유의한 것으로 정의하였다. 또한 단변량 로지스틱 회귀분석에서 p값이 0.05 미만인 이하인 변수를 이용하여 다변량 로지스틱 회귀분석을 실시하였고 p값이 0.05 미만인 경우를 의의가 있는 결과로 하였다.
결 과
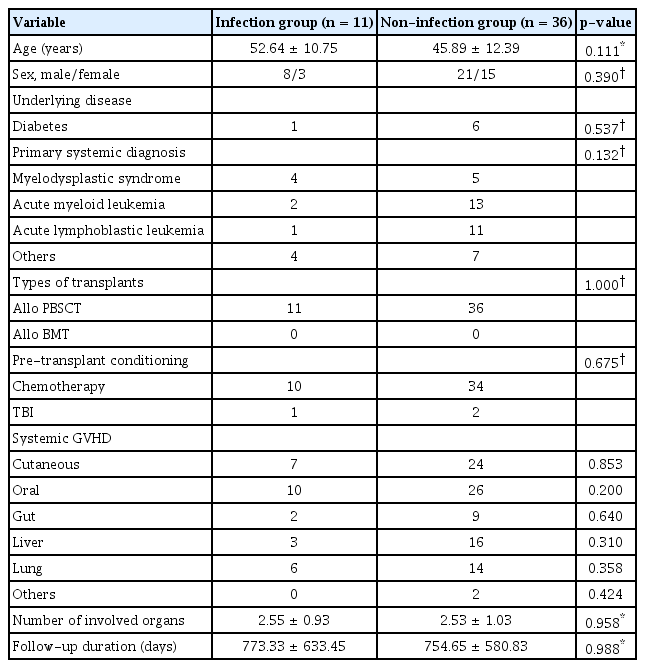
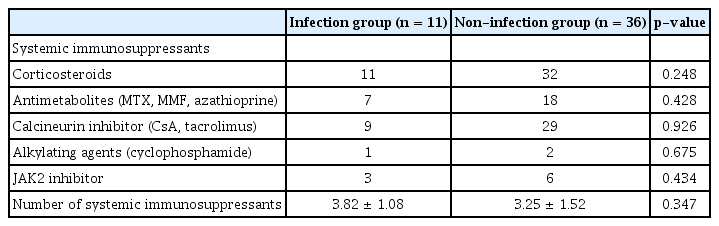
안구 이식편대숙주병 환자들의 역학적 정보에 대해 Table 1, 2에 요약하였다. 2015년 1월부터 2020년 12월까지 본원에서 안구 이식편대숙주병으로 경과 관찰했던 환자는 총 47명이었으며, 이 중 감염각막염이 발생한 환자는 총 11명(23.4%)이었다. 감염 발생군의 평균 나이는 52.64 ± 10.75세, 대조군은 45.89 ± 12.39세였으며 각각 남성이 8명(72.7%), 21명(58.3%)을 차지하였다. 조혈모세포 이식 전 원발 혈액 질환은 감염 발생군에서 골수 이형성 증후군 4명(36.3%), 급성 골수성 백혈병 2명(18.1%), 급성 림프구성 백혈병 1명(9.1%), 기타 4명(36.3%)이었으며, 감염 미발생군에서 골수 이형성 증후군 5명(13.8%), 급성 골수성 백혈병 13명(36.1%), 급성 림프구성 백혈병 11명(30.5%), 기타 7명(19.4%)이었다. 이와 관련한 감염 발생군 및 감염 미발생군 사이의 유의한 차이는 보이지 않았다. 한편, 동종 조혈모세포 이식은 두 군 모두에서 말초혈액 조혈모세포 이식을 통해 시행되었으며 이식 전처치 또한 두 군 간 유의한 차이는 관찰되지 않았다. 전신 이식편대숙주병에 의해 침범된 장기들의 경우 피부, 구강점막, 위장관, 간, 폐 등이 있었고, 전신면역억제제의 경우 스테로이드, 항대사제(methotrexate, mycophenolic acid, azathioprine), 칼시뉴린 억제제(cyclosporine, tacrolimus), 알킬화제(cyclophosphamide), JAK2 억제제가 치료에 사용되었으며 모두 두 군 간 유의한 차이는 없었다. 안구 이식편대숙주병의 전체 이환 기간은 감염 발생군에서 773.33 ± 633.45일, 미발생군에서 754.65 ± 580.83일로 두 군 간 유의한 차이는 없었다.
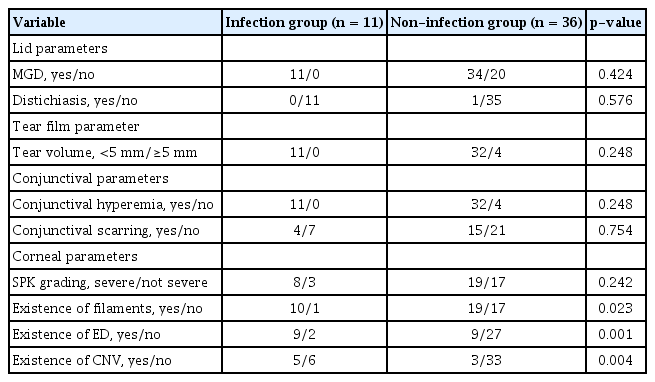
Table 3은 감염 발생군과 감염 미발생군의 안구 이식편대숙주병으로 인한 안구 표면 지표를 나타내었다. 안검의 마이봄샘기능부전과 두줄속눈썹의 유무, 쉬르머검사, 결막의 충혈 및 반흔은 두 군 간의 유의한 차이를 보이지 않았다. 각막의 경우, 각막상피병증의 정도에서는 차이를 보이지 않았으나, 각막 필라멘트, 각막 신생혈관, 각막상피결손의 발생은 감염 발생군에서 유의하게 더 많았다(p=0.023, p=0.004, p=0.001). 한편, 각막상피결손이 발생했던 모든 환자들은 발생 후 2주 이상 각막상피결손이 지속되었다.
안구 이식편대숙주병으로 인한 중증도는 NIH consensus criteria, ICCGVHD 두 가지를 통해 평가하였다(Fig. 1). NIH consensus criteria에 의한 중증도 점수는 감염 발생군에서 3.00 ± 0.00점, 대조군에서 2.73 ± 0.45점으로 감염 발생군에서 의미 있게 높은 결과를 보였다(p=0.001). ICCGVHD의 경우에도 감염 발생군에서 10.36 ± 0.50점, 대조군 9.25 ± 1.65점으로 감염 발생군에서 더 높은 결과를 보였다(p=0.001).
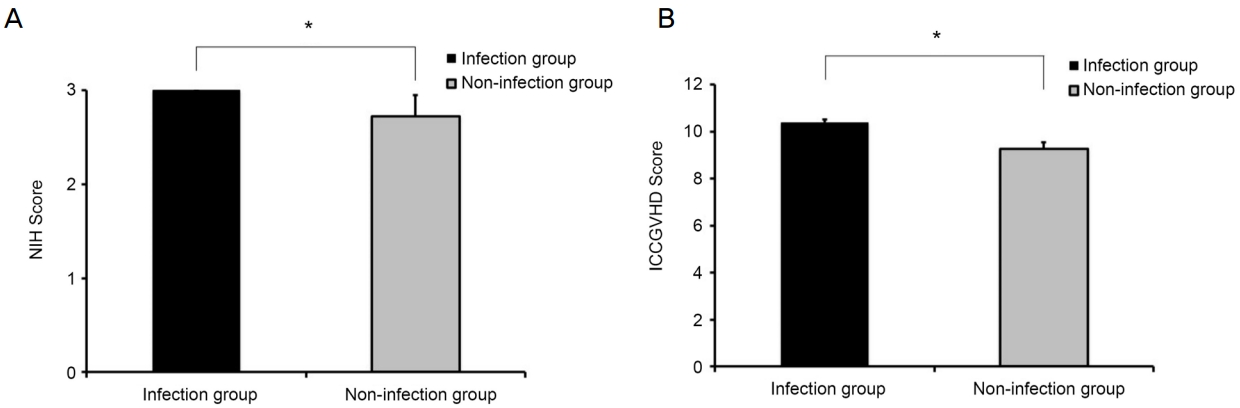
Baseline ocular GVHD grade was scored by NIH consensus criteria (A) and ICCGVHD criteria (B). There was significant score difference between two groups (p* < 0.05). Ocular GVHD grading score by both criteria showed more severe ocular GVHD in the infection group than the non-infection group. NIH = National Institute of Health; ICCGVHD = International Chronic ocular GVHD Consensus group diagnostic criteria; GVHD = graft-versus-host disease.
이식편대숙주병에 의한 안 증상 발생 후 감염 발생까지의 기간은 평균 7.82 ± 6.91개월이었으며, 그중 1년 이내 발생한 환자는 5명, 1년 이후 발생은 6명이었다. 감염 발생 전과 치료 후의 시력은 각각 0.39 ± 0.89, 1.81 ± 1.07으로 유의미하게 감소되었으며 감염각막염이 발생한 11명의 환자들 중 치료 성공은 9명(82%)이었고, 치료 실패(18%)는 2명이었다. 치료 실패 환자들 중 1안에서 각막 글루잉을 시행하였으며, 1안에서 전층각막이식술을 시행하였다. 각막 침윤의 평균 크기는 2.50 ± 1.43 mm2였으며, 깊은 각막침윤을 보이는 환자가 3명, 전방축농 소견을 보인 환자가 2명이었다. 도말검사 상 KOH 양성 소견을 보인 환자는 없었으나, 배양검사에서는 5명(45.4%)의 환자에서 균주가 동정되었으며 Staphylococcus caprae, Enterococcus faecalis, Pseudomonas aeruginosa, Candida tropicalis, Penicillium species가 각각 1안이었다(Table 4).
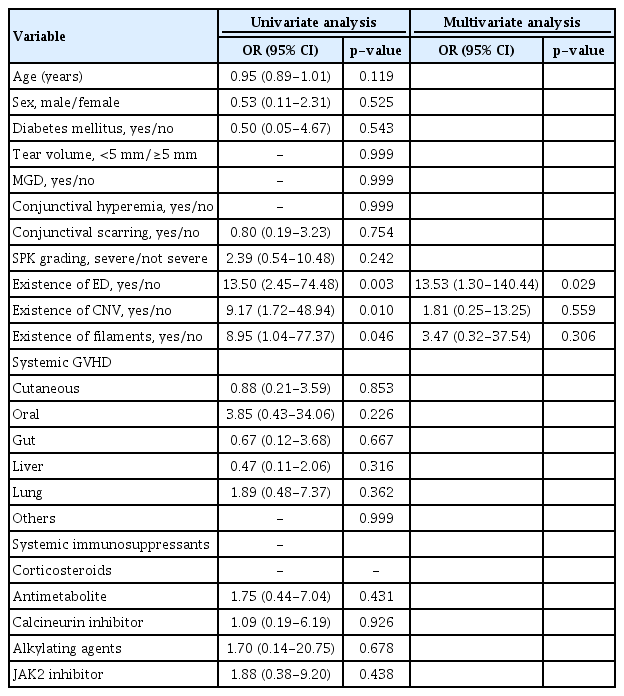
한편, 감염 발생에 대해 전신 및 안구지표들을 통한 단변량 분석을 시행하였을 때, 감염 발생 전 각막상피결손의 존재, 각막 신생혈관의 유무, 각막 필라멘트의 사용이 감염 발생과 관련이 있었고(p=0.003, p=0.010, p=0.046), 이 3가지 인자로 다변량 회귀분석을 시행한 결과 감염 발생 전 각막상피결손의 존재(p=0.029)만이 감염 발생과 유의한 연관이 있었다(Table 5).
고 찰
감염각막염은 만성 이식편대숙주질환 환자에서 드물게 발생하는 안과적 합병증이지만, 강력한 약물 치료에도 불구하고 안내염, 각막 융해 및 얇아짐, 데스메막류, 각막천공 등 수술적 처치를 필요로 하는 경우가 많으며 불량한 시력 예후를 보인다. Sinha et al [27]은 만성 안구 이식편대숙주병 환자의 6.2%에서 각막궤양을 비롯한 심각한 각막 합병증이 발생한다고 보고하였고, Balaram et al [28]은 13%에서 각막궤양이 발생하였다고 보고한 바 있다.
안구 이식편대숙주병 환자에서 감염각막염이 발생하는 기전은 현재 명확히 알려진 바는 없다. 이전 연구 결과들에 의하면 만성 이식편대 숙주병에서 발생한 심한 건성안으로 인한 안구 표면의 변화는 이차적인 각막상피병증, 각막궤양 및 각막천공을 발생시킬 수 있다고 하였는데[12,28,29], 이는 건성안으로 인한 각막 얇아짐과 각막미란과 관련이 있다고 하였다[30]. 또한, 건성안에서의 만성 염증 반응은 각막상피의 파괴를 일으켜 미생물의 침입을 허용하게 된다고 알려져 있다[31].
본 연구에서는 안구 이식편대숙주병 환자에서 발생한 감염각막염과 관련한 다양한 인자를 조사하였다. 그 결과 감염 전 발생한 각막상피결손의 존재, 필라멘트의 유무, 각막 신생혈관의 유무가 감염 발생과 관련이 있음을 발견하였으며, 그중에서도 각막상피결손의 존재가 다변량 로지스틱 회귀분석에서 감염각막염 발생과 유의한 상관관계를 보이는 것으로 나타났다(p=0.029). 안구 이식편대숙주병 환자에서 각막, 결막을 포함한 안구 표면 지표들은 안구 표면의 염증으로 인해 정상인에 비해 악화되어 있다고 알려져 있으며[32], Giannaccare et al [33]에 따르면 중심각막두께 및 각막 저항요인도 감소한다고 하였다. 이러한 안구 표면의 전반적인 구조적 변화와 더불어 염증유발 면역세포와 사이토카인의 존재는 각막 손상 회복을 저해하여 각막상피결손을 지속시키며, 각막상피결손의 지속은 각막상피세포 간의 치밀결합의 붕괴와 미생물 침입에 대한 장벽효과의 소실로 이어져 각막궤양과 같은 심각한 합병증을 일으키게 된다[34-38]. 각막상피결손의 지속이 안구 이식편대숙주병의 8.1%에서 발생했다고 보고하였던 Sinha et al [27]의 연구는 안구 이식편대숙주병 환자에서 안구 표면장벽의 붕괴를 보여주었다고 하겠다. 한편, 본 연구에서 전신 이식편대숙주병 상태와 전신 면역억제제 사용은 감염 발생과 유의한 관계를 보이지 않았는데, 전신 이식편대숙주병의 중증도 및 전신 면역억제제의 사용과 감염 발생의 상관관계에 대하여는 추후 대규모 연구를 통한 검증이 필요할 것으로 보인다.
본 연구에서 임상적으로 감염각막염이 의심된 환자는 11명이었고, 배양검사 상 양성인 환자는 5명이었다. 이러한 결과는 Sinha et al [39]이 보고한 대규모 연구와 어느 정도 일치하는 경향을 보이는데, 그들에 따르면 15명의 안구이식편대숙주병에 동반된 각막궤양 환자들 중 9명이 배양검사 상음성, 4명은 배양검사 상 양성이라고 하였다. 한편, 안구이식편대숙주병 환자의 천공된 각막표본에서 T세포, 단핵구, 세포사멸된 각막세포 및 과발현된 기질금속단백질분해효소 등이 검출되었다는 이전 보고가 있는데, 이를 본 연구의 결과와 종합한다면 안구 이식편대숙주병에 동반된 감염각막염의 발생은 심한 안구 표면 염증에 병발된 기회 감염의 가능성을 생각해 볼 수 있겠다.
안구 이식편대숙주병에서 발생한 감염각막염 균주에 대한 기존의 보고된 연구는 없는 것으로 알려져 있으나, Stevenson et al [20]에 의하면 안구 이식편대숙주병에서 발생한 4예의 감염각막염 사례들 중 두 예에서 황색 포도상구균 및 폐렴구균이 동정되었다고 하였다. 본 연구에서는 포도상구균, 장알균, 녹농균, 칸디다, 푸른곰팡이균이 각각 1예에서 검출되어 상대적으로 다양한 균주가 검출되었지만 일반적으로 안구 표면 질환에서 발생한 감염각막염의 경우 대부분 그람양성균이 원인균이라는 점[40]과 진균 배양검사의 양성률은 34.5-51.4% 정도로 세균의 배양검사 양성률보다 상대적으로 낮은 것을 고려한다면[41-44], 안구 이식편대 숙주병에서의 감염각막염 균주에 대해서는 추가적인 연구들이 필요할 것으로 생각된다.
본 연구의 안구 이식편대숙주병 환자들 중 각막상피결손이 발생했던 환자들은 모두 지속 각막상피결손 환자들이었다. Sinha et al [27]의 보고에 의하면, 안구 이식편대숙주병에서 각막상피결손의 지속은 높은 NIH 중등도 점수, 당뇨, 윤부세포결핍증, 각막 필라멘트의 존재 및 결막하 섬유화의 존재와 유의한 관련이 있다고 하였다. 본 연구에서 각막상피결손의 발생과 관련이 있는 인자들을 회귀분석을 시행한 결과 전신인자는 유의한 관련성을 나타내지 않았고, 나이, 각막상피병증의 정도, 각막 필라멘트의 유무, 각막 신생혈관의 유무가 관련이 있었으며 다변량 회귀분석에서는 각막 신생혈관만이 유의한 관계가 있었다(p=0.038). 각막 윤부에 존재하는 줄기세포는 각막의 상피재생에 필수적인 역할을 하는데, 각막 신생혈관의 경우 윤부세포결핍증을 반영하는 임상인자로 이 상태에서는 정상적인 각막상피재생의 과정이 일어나지 못하여 각막상피결손이 지속된다. 이전 연구 결과와 마찬가지로, 안구 이식편대숙주병 환자에서 각막 신생혈관이 동반되어 있다면 각막상피결손의 지속 가능성을 시사하기 때문에 감염 발생에 대한 주의가 필요하다.
본 연구에서는 스테로이드 점안약, 면역억제제 등의 각막 감염 발생 전 사용한 약에 대한 정보를 제시하지 않았다. 안구 이식편대숙주병 환자에서 흔히 사용되는 치료제인 스테로이드는 안구 표면의 염증을 억제하나, 각막상피세포 및 신경세포의 재생 역시 억제한다고 알려져 있으며[45,46], 각막두께 감소와 각막궤양, 천공과 같은 부작용을 발생시킬 수 있다고 보고된 바 있다[47]. 본 연구에서는 중등도 이상의 안구 표면의 염증이 있는 환자에서는 모두 점안 스테로이드제 및 자가혈청을 사용하였기에 오히려 감염 발생에 대한 혼란변수로서 가능성이 있었다. 점안 스테로이드제 등의 안약 사용은 감염 발생의 위험인자보다는 질병 중증도를 반영한다고 하겠으며, Sinha et al [27]의 안구 이식편대숙주병 환자에서 스테로이드 사용과 지속 상피결손의 발생은 유의한 관계가 없었다는 것과 Sugar et al [48]와 Yülek et al [49]이 점안 스테로이드 사용과 각막상피의 회복은 유의한 상관관계를 보이지 않았다는 보고가 이를 뒷받침하겠다.
본 연구의 제한점으로는 첫 번째, 전체 환자군의 표본수가 충분하지 않았다는 점이다. 안구 이식편대숙주병 환자에서 감염각막염의 발생률이 낮아 지난 5년간의 본원 기록상 11명의 증례만 기록되었다. 따라서 바이어스의 영향이 있을 수 있으므로 다변량 분석의 해석에 주의를 요하며, 향후 충분한 표본수를 대상으로 하여 본 연구의 결과를 확인하는 것이 필요하겠다. 두 번째로, 경과 관찰 기간 중 원인이 되는 전신 질환 조절 정도가 각 환자에서 동일하지 않아 안구 이식편대숙주병 경과에 혼란변수로 작용했을 가능성도 배제할 수 없겠다. 마지막으로, 일반적으로 지속성 각막상피결손은 신경영양성각막염, 당뇨각막병증, 윤부세포결핍, 노출각막염과 관련이 있다고 알려져 있으며[50], Tarnawska and Wylegała [51]는 각막지각 능력의 감소가 만성 안구이식편대숙주병 환자들에서 관찰되었다고 보고한 바 있다. 이러한 감소된 각막지각 능력은 안구 이식편대숙주병 환자에서 안구 표면장벽의 붕괴와 함께 각막상피결손의 지속 및 감염 발생에 기여했을 수 있으나, 본 연구에서 각막지각 능력의 평가는 시행되지 않았기에 추후 이 부분에 대한 고찰이 필요할 것으로 사료된다.
본 연구를 통해 안구 이식편대숙주병에서 발생한 감염각막염 환자들 대상으로 전신적 요소와 임상적 요소를 감염 미발생군과 비교 분석하였고, 감염각막염 발생 위험인자를 찾아보고자 한 것에 의의가 있다고 할 수 있다. 감염각막염이 발생한 군에서 감염 전 각막상피결손, 각막 신생혈관, 각막 필라멘트가 발생한 비율이 높았고, 이 중 다변량 분석 결과 각막상피결손의 존재가 감염각막염의 발생 위험인자였다. 또한, 이는 안구 이식편대숙주병 환자에서 각막상피결손이 지속될 때 감염 발생 가능성에 대한 면밀한 관찰이 필요하다는 것을 시사하며 좀 더 짧은 간격의 경과 관찰 주기를 고려해야 하겠다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
진형남 / Hyung Nam Jin
전남대학교 의과대학 안과학교실
Department of Ophthalmology, Chonnam National University Medical School