연령관련황반변성 및 맥락막비후 신생혈관증 환자의 방수 사이토카인 농도와 맥락막두께의 상관분석
Aqueous Humor Cytokine Levels and Choroidal Thicknesses of Patients with Age‐related Macular Degeneration and Pachychoroid Neovasculopathy
Article information
Abstract
목적
삼출성 연령관련황반변성 및 맥락막비후 신생혈관증 환자에서 항혈관내피세포성장인자 주사 치료 전후 황반하 맥락막두께와 방수 내 사이토카인 농도 변화의 상관성을 알아보고자 한다.
대상과 방법
삼출성 연령관련황반변성 환자 11명 11안, 맥락막비후 신생혈관증 환자 9명 9안을 대상으로 항혈관내피세포성장인자 주사 시행 후 황반하 맥락막두께 변화를 분석하였다. 초기 및 4주째 방수를 채취하여 vascular endothelial growth factor (VEGF), soluble VEGF receptor‐2 (sVEGFR‐2), platelet‐derived growth factor (PDGF)‐AA, monocyte chemo‐attractant protein 1 (MCP‐1), interleukin (IL)‐6, IL‐8의 농도 변화를 살펴보고, 두 군 간에 방수 내 사이토카인 농도에 차이가 있는지 살펴보았다.
결과
주사 치료 후 VEGF 및 PDGF‐AA의 농도는 유의하게 감소하였으며, sVEGFR‐2의 농도는 증가하였다. 주사 치료 전후 sVEGFR‐2 농도의 변화량은 맥락막두께 및 두께 변화량과 연관성을 보였는데, 맥락막이 상대적으로 얇고, 두께 변화가 작은 삼출성 연령관련황반변성 환자군에서 sVEGFR‐2 농도의 변화량이 컸다. 사이토카인 농도 간 상관관계 분석 결과 삼출성 연령관련황반변성 환자군에서는 MCP‐1, IL‐6 및 IL‐8 사이에 유의한 상관관계를 보였으나, 맥락막비후 신생혈관증 환자군에서는 sVEGFR‐2와 MCP‐1, MCP‐1과 PDGF‐AA 간에 유의한 상관관계를 보였다.
결론
맥락막이 상대적으로 얇은 삼출성 연령관련황반변성 환자군에서 주사 치료 후 sVEGFR‐2 농도의 상승폭이 컸으며, MCP‐1, IL‐6, IL‐8 등 염증성 사이토카인 수치 사이의 상관관계가 높게 나타났다. 이러한 결과는 두 질환군 간에 혈관신생인자나 염증성 사이토카인이 질병의 병태생리에 작용하는 방식에 차이가 있을 수 있음을 시사한다.
Trans Abstract
Purpose
We sought correlations between the subfoveal choroidal thickness (SCT) and changes in the levels of aqueous humor cytokines before and after anti‐vascular endothelial growth factor (anti‐VEGF) treatment of patients with neovascular age‐related macular degeneration (nAMD) and pachychoroid neovasculopathy.
Methods
We measured changes in the SCT and levels of aqueous humor cytokines (VEGF, soluble VEGF receptor‐2 [sVEGFR‐ 2], platelet‐derived growth factor [PDGF]‐AA, monocyte chemoattractant protein 1 [MCP‐1], interleukin [IL]‐6, and IL‐8) after anti‐ VEGF treatment of 11 eyes of 11 nAMD patients and nine eyes of nine pachychoroid neovasculopathy patients. The aqueous humor cytokine levels were compared between the two groups.
Results
After anti‐VEGF treatment, the aqueous levels of VEGF and PDGF‐AA decreased significantly, whereas that of sVEGFR‐2 increased. The amount of change in sVEGFR‐2 concentration before and after anti‐VEGF treatment correlated with the SCT and its change after treatment. nAMD patients with relatively thin SCTs and smaller SCT changes after anti‐VEGF treatment showed greater increases in sVEGFR‐2 levels following treatment. We found significant correlations among the MCP‐1, IL‐6, and IL‐8 levels in the nAMD group, and between the sVEGFR‐2 and MCP‐1, and MCP‐1 and PDGF‐AA, levels in the pachychoroid neovasculopathy group.
Conclusions
Patients with nAMD exhibited significant increases in aqueous sVEGFR‐2 levels following anti‐VEGF treatment and significant correlations among the levels of the inflammatory cytokines MCP‐1, IL‐6, and IL‐8, suggesting that angiogenic factors and inflammatory cytokines may affect the pathophysiologies of the two diseases differently.
연령관련황반변성은 드루젠을 포함하는 침착물이 망막색소상피세포 아래 축적되어 황반부변성을 유발하며, 진행할 경우 맥락막신생혈관을 동반하는 질환으로, 고령층의 주요한 실명 원인 중 하나이다[1,2]. 최근에는 빛간섭단층촬영 및 빛간섭단층혈관조영술의 발달로 질환의 진단 및 병태생리에 대한 이해가 높아지고 있다.
특히, Margolis and Spaide [3]에 의해 소개된 빛간섭단층촬영의 enhanced depth imaging 방법으로 망막뿐 아니라 맥락막에 대한 관찰이 효과적으로 이루어졌으며, 연령관련황반변성에서도 맥락막의 형태학적 특징에 대한 여러 연구들이 시행되었다[4-6]. 최근에는 두꺼운 맥락막과 망막색소상피세포의 변성 등 맥락막비후 색소상피병증(pachychoroid pigment epitheliopathy) 및 중심장액맥락망막병증과 병태생리학적 특성을 공유하는 것으로 생각되는 맥락막비후 신생혈관증(pachychoroid neovasculopathy)이라는 새로운 질환 개념이 등장하였다. 맥락막비후 신생혈관증은 두꺼워진 맥락막과 확장된 맥락막혈관 위에 제1형 맥락막신생혈관이 관찰되는 반면, 드루젠이나 기타 연령관련황반변성을 시사하는 소견은 드물다[7].
Miyake et al. [8]은 맥락막두께 및 임상 소견을 기반으로 전통적인 삼출성 연령관련황반변성과 맥락막비후 신생혈관증을 구분하고 임상양상을 비교하였다. 맥락막비후 신생혈관증 환자들은 전통적인 삼출성 연령관련황반변성 환자들에 비해 젊었으며, 일반적으로 알려진 위험 유전자를 통해 계산된 연령관련황반변성의 유전적 위험성이 낮은 것으로 알려졌다. 또한 안구 방수에서 측정한 혈관내피세포성장인자(vascular endothelial growth factor, VEGF) 농도가 일반적인 연령관련황반변성 환자들에 비해 맥락막비후 신생혈관증 환자에서 유의하게 낮았다[9]. 이러한 결과들은 두 질환의 병태생리에 차이가 있으며, VEGF가 혈관 신생에 관여하는 방식에 차이가 날 수 있음을 시사한다.
맥락막비후 신생혈관증 환자의 안구 방수에서 측정한 VEGF 및 염증성 사이토카인 수치에 관한 최근의 연구들을 살펴보면, 맥락막비후 신생혈관증 환자에서 VEGF 농도가 유의하게 낮았으며, 항혈관내피세포성장인자 주사 치료의 반응성과 VEGF 농도 사이에 관련성이 떨어졌다[10]. 맥락막비후 신생혈관증 환자에서는 대조군에 비해 VEGF는 증가되어 있지만, 보체 활성화 이후 생기는 부산물인 C3a 농도는 낮아, 일반적인 연령관련황반변성과는 달리 보체계의 활성화가 아닌 다른 기전에 의해 신생혈관이 생길 것으로 추측되었다[11]. 하지만 아직 맥락막비후 신생혈관증을 정의하는 맥락막두께를 포함하는 임상적인 기준은 정해지지 않았으며, 맥락막신생혈관을 동반한 환자들에서 맥락막두께에 따른 안구 내 VEGF 및 사이토카인 농도 그리고 항혈관내피세포성장인자 치료 전후 이들 VEGF 및 사이토카인 농도의 변화에 대한 연구는 부족하다. 이에 본 연구에서는 삼출성 연령관련황반변성 혹은 맥락막비후 신생혈관증으로 항혈관내피세포성장인자 주사 치료를 받는 환자들을 대상으로 주사 치료 전후 안구 방수 내 사이토카인 농도의 변화량과 맥락막두께 간의 상관관계를 살펴보고, 맥락막두께가 연령관련황반변성의 병태생리에 미치는 영향을 살펴보고자 한다.
대상과 방법
2017년 8월부터 2019년 5월까지 강동성심병원에서 새로 진단된 삼출성 연령관련황반변성 및 맥락막비후 신생혈관증 환자를 대상으로 전향적 연구를 진행하였다. 본 연구는 헬싱키선언(Declaration of Helsinki)을 준수하였으며, 강동성심병원 임상연구윤리심의위원회(Institutional Review Board, IRB)의 승인을 받고 진행하였다(IRB 승인 번호: 2017‐04‐001). 모든 환자에게 연구 시행 전 연구 목적 및 과정에 대해 설명 후 동의서를 받았다.
빛간섭단층촬영 및 형광안저혈관조영술상 신생혈관 및 삼출물이 관찰되어 삼출성 연령관련황반변성으로 진단되고 항혈관내피세포성장인자 주사 치료 예정인 자를 대상으로 하였다. 삼출성 연령관련황반변성 환자들 중 다음의 진단기준에 해당하는 경우에는 맥락막비후 신생혈관증으로 분류하였다: 1) 양안 모두 황반하 맥락막두께 ≥200 μm인 경우; 2) 드루젠이 관찰되지 않거나, 경성 드루젠(직경 ≤63 μm)만 일부 관찰됨(Age-Related Eye Disease Study category 1); 3) 맥락막비후 색소상피병증이나 중심장액맥락망막병증에서 보이는 망막색소상피 변성 소견을 보이거나 확장된 맥락막혈관 위에 제1형 맥락막신생혈관이 관찰되는 경우.
제외기준으로는 매체혼탁(각막혼탁, 백내장, 유리체혼탁 등)으로 맥락막을 분석할 수 있는 수준의 빛간섭단층촬영이 어려운 경우, 삼출성 연령관련황반변성 외 당뇨망막병증, 망막혈관폐쇄, 포도막염 등 기타 망막질환이 동반된 경우, 기존에 항혈관내피세포성장인자 유리체강 내 주입술을 받은 경우, 합병증 없이 진행된 백내장수술 외에 기타 안구 내 수술을 받은 환자의 경우로 하였다.
대상 환자들은 매 방문 시기마다 시력검사, 안압검사, 세극등현미경검사, 안저검사 등 기본 안과검진 및 안저촬영(Optos 200TX, Optos PLC, Dunfermline, UK), 빛간섭단층촬영(Spectralis OCT, Heidelberg Engineering, Heidelberg, Germany)검사를 시행하였다. 빛간섭단층촬영기기에 내장된 프로그램을 통해 중심 황반부 1 mm 영역의 평균 망막 두께를 측정하여 중심구역황반두께로 정의하였고, 황반 중심을 가로지르는 빛간섭단층촬영 수평 스캔 이미지에서 빛 간섭단층촬영기기에 내장된 프로그램의 측정 도구를 이용하여 망막색소상피/브루크막 복합체의 고반사 선과 맥락막/공막 경계까지 황반하 맥락막두께를 측정하였다. 두 명의 검사자가 독립적으로 측정하여 그 평균값을 분석에 이용하였다.
연구 대상으로 포함된 환자들은 애플리버셉트(Aflibercept, Eylea®, Regeneron Pharmaceuticals Inc., Tarrytown, NY, USA; Bayer, Basel, Switzerland) 2 mg/0.05 mL 혹은 라니비주맙(ranibizumab, Lucentis®, Genetech, South San Francisco, CA, USA) 0.5 mg/0.05 mL를 유리체강 내로 4주 간격으로 3회 주사하였다. 주사는 모든 환자의 서면 동의하에 시행하였다. 대상안을 0.5% 푸로파라카인염산염(Alcaine®, Alcon, Fort Worth, TX, USA)으로 점안 마취 및 5% 베타딘용액으로 안검 소독 후, 멸균소독된 개검기를 삽입하였다. 이후 각막과 결막낭 또한 5% 베타딘 용액을 점안하여 소독한 후, 안내주입술 직전에 30게이지 주사바늘이 부착된 1 mL 주사기로 주사바늘을 각막윤부에 홍채와 평행하게 진입하도록 하여 약 0.1 mL의 방수를 흡입하였다. 이후 항혈관내피세포성장인자 0.5 mg을 각막윤부에서 3‐3.5 mm 떨어진 섬모체 평면부에서 30게이지 주사바늘을 이용하여 주입하였다. 주사 직후 주사 부위를 면봉으로 압박하여 약물 및 유리체의 누출을 막고 지혈하였다.
첫 주사 치료와 4주 후 진행한 두 번째 주사 치료 시에 채취한 방수를 이용하여 안구 방수 내 사이토카인 농도 변화를 분석하였다. 방수 채취 후 바로 액체 질소를 이용하여 샘플을 얼렸으며, 이후 섭씨 영하 80°C 이하의 저온 냉동고에 보관하였다. 혈관 신생과 관련된 6종의 VEGF 및 사이토카인 (VEGF‐A, soluble vascular endothelial growth factor receptors 2 [sVEGFR‐2], monocyte chemo‐attractant protein 1 [MCP‐1], interleukin [IL]‐6, IL‐8, platelet‐derived growth factor AA [PDGF‐AA])을 다중 면역효소법(multiplexed sandwich enzyme‐linked immunosorbent assay)을 이용하여 제조사의 지침에 따라 분석하였다(Human Magnetic Luminex® assay, R&D Systems, Minneapolis, MN, USA). 채취한 방수 분석을 통해 주사 치료 전과 첫 주사 치료 후 4주째에 안구 방수 내 사이토카인의 농도 변화를 Wilcoxon signedrank test를 통해 비교하였으며, 사이토카인 농도 및 농도의 변화량 간에 상관분석을 피어슨 상관분석을 통해 시행하였다.
맥락막두께는 나이와 눈의 굴절률 등에 따라 변화하는 것으로 알려져 있다.3,12,13 맥락막두께에 따른 주사 전후 안구 방수의 사이토카인 농도 변화를 살펴보기 전 먼저 나이와 굴절률에 따른 맥락막두께의 변동성을 보정하였다. 맥락막두께를 종속변수로 두고, 나이와 굴절률을 독립변수로 입력하여 선형회귀분석을 시행하여 얻은 표준화 계수 값을 이용하여 맥락막두께를 다음 식을 통해 보정하였다.
Choroidal thickness adjusted=choroidal thickness measured+( age‐average age of all patients)×5.94‐(spherical equivalent‐ average spherical equivalent of all patients)×18.754
이렇게 보정한 맥락막두께 및 맥락막두께의 변화량과 각 사이토카인의 농도 및 농도의 변화량 간의 연관성을 살펴보았다(선형회귀분석). 전통적인 삼출성 연령관련황반변성 환자들과 맥락막비후 신생혈관증 환자들 간에 임상 특성 및 안구 방수 내 사이토카인 농도에 차이가 있는지 살펴보았다(Mann‐Whitney U test 및 chi‐square 혹은 Figher's exact test). 통계 분석을 위해서 SPSS 25.0버전(IBM Corp., Armonk, NY, USA)을 사용하였으며, p‐value가 0.05 미만인 경우를 통계학적으로 유의한 것으로 정의하였다.
결 과
본 연구에는 총 20명 20안이 최종적으로 연구에 포함되었다(삼출성 연령관련황반변성 11안, 맥락막비후 신생혈관증 9안). 맥락막비후 신생혈관증 환자들이 다소 젊은 경향을 보였으나 통계적으로 유의하지는 않았으며(삼출성 연령관련 황반변성 76.0 ± 7.4세 vs. 맥락막비후 신생혈관증 70.4 ± 8.5세, p=0.230), 맥락막비후 신생혈관증 환자들의 남성 환자 비율이 더 높았다(삼출성 연령관련황반변성 6/11 [55%] vs. 맥락막 비후 신생혈관증 9/9 [100%], p=0.038). 치료 전 및 치료 후 3개월 시점까지 양 군 간에 최대교정시력 및 중심구역황반 두께는 유의한 차이를 보이지 않았다. 황반하 맥락막두께는 맥락막비후 신생혈관증 환자군에서 치료 전후 모두 유의하게 두꺼웠다(Table 1, Fig. 1). 주사 치료와 관련하여 출혈, 감염 등 심각한 이상 반응은 없었다.
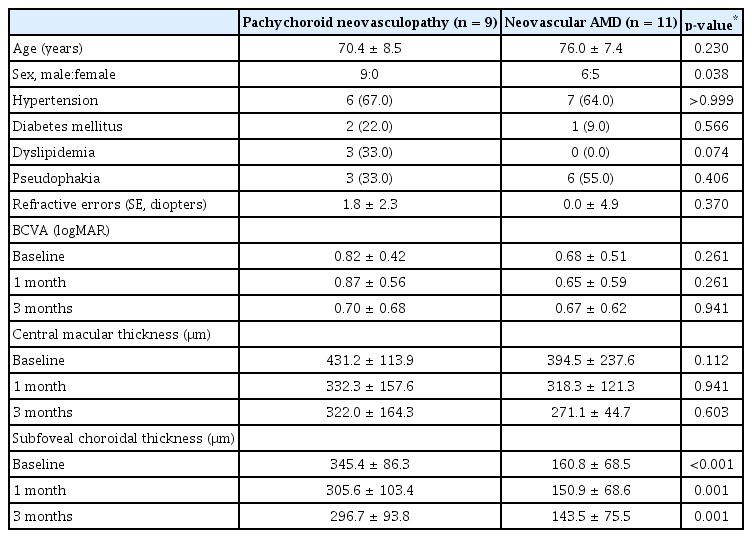
Comparison of clinical characteristics between pachychoroid neovasculopathy and neovascular AMD patients

Serial changes of visual acuity, central macular thickness, and subfoveal choroidal thickness following anti‐vascular endothelial growth factor treatment. There were no significant differences in best‐corrected visual acuity (A) and central macular thickness (B) between neovascular age‐related macular degeneration (nAMD) and pachychoroid neovasculopathy (PNV) groups. Subfoveal choroidal thickness was thicker throughout the follow‐up period in PNV group (C). logMAR = logarithm of minimal angle resolution. *p < 0.05, Wilcoxon signed‐rank test.
안구 방수 내 사이토카인 농도는 주사 치료 전과 첫 주사 치료 4주 후를 비교하였을 때 VEGF‐A 농도는 19.4 ± 26.1 pg/mL에서 4.7 ± 6.4 pg/mL (p=0.01)로, PDGF‐AA의 농도는 17.0 ± 5.3 pg/mL에서 14.4 ± 5.9 pg/mL (p=0.005)로 유의하게 감소하였고, sVEGFR‐2의 농도는 729.9 ± 290.5 pg/mL에서 983.5 ± 359.0 pg/mL (p<0.001)로 유의하게 증가하였다. 다른 3종의 사이토카인 농도는 주사 치료 전후 유의미한 변화를 보이지 않았다(Fig. 2). 양 군 간의 방수 내 사이토카인 농도를 비교해보면, sVEGFR‐2의 주사 치료 전후 변화량이 삼출성 연령관련황반변성 환자군에서 유의하게 컸다(맥락막비후 신생혈관증, 100.7 ± 144.3 pg/mL vs. 삼출성 연령관련황반변성, 378.6 ± 262.5 pg/mL, p=0.012). 양 군 모두 첫 주사 치료 후 4주째에 VEGF‐A 및 PDGF‐AA 농도가 감소하였으나, VEGF‐A는 맥락막비후 신생혈관증 환자군에서만, PDGF‐AA는 삼출성 연령관련황반변성 환자군에서만 통계적으로 유의한 변화가 관찰되었다. sVEGFR‐2는 양 군 모두에서 주사 치료 이후 유의한 증가가 관찰되었다(Table 2).
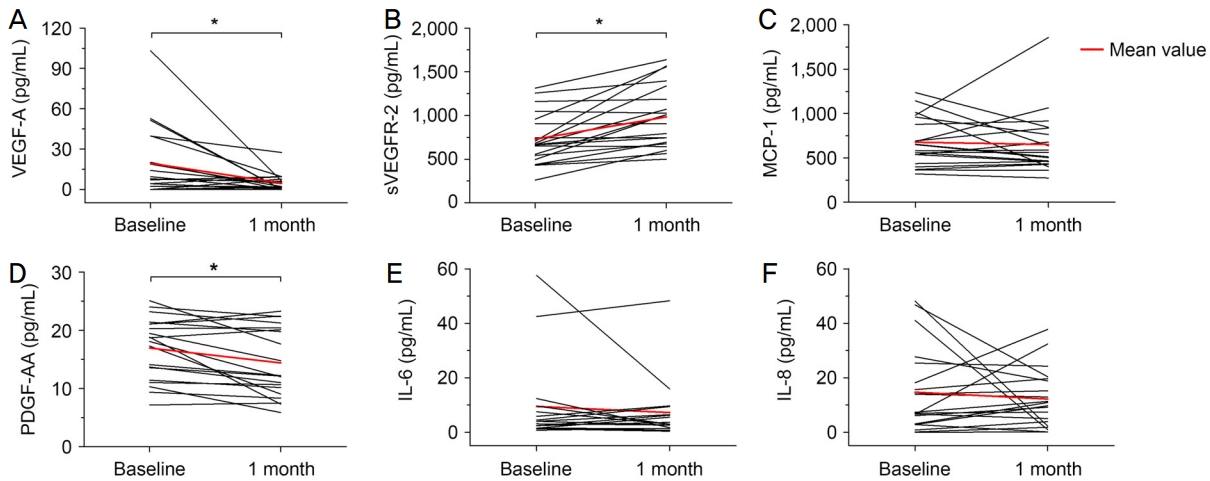
Changes in the level of aqueous cytokines after initial anti-vascular endothelial growth factor (VEGF) treatment. There was a significant decrease in the level of aqueous VEGF-A (A) and platelet-derived growth factor (PDGF)-AA (D) and a significant increase in the level of aqueous soluble vascular endothelial growth factor receptor (sVEGFR)-2 (B) after initial anti-VEGF treatment. There were no significant changes in the level of aqueous MCP-1 (C), IL-6 (E), and IL-8 (F). IL = interleukin; MCP = monocyte chemotactic protein. *p < 0.05, Wilcoxon signed‐rank test.
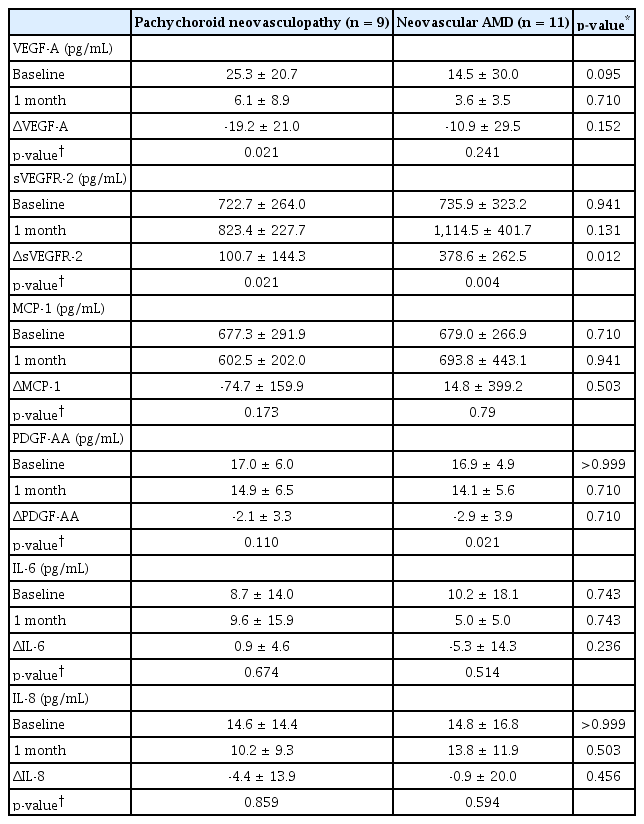
Comparison of aqueous cytokine levels between pachychoroid neovasculopathy and neovascular AMD patients
방수 내 사이토카인 농도 간 상관관계 분석 결과 삼출성 연령관련황반변성 환자군과 맥락막비후 신생혈관증 환자군 간에 다른 양상을 보였다. 삼출성 연령관련황반변성 환자군에서는 주사 치료 전 MCP‐1과 IL‐6 및 IL‐8, 그리고 IL‐6와 IL‐8에서 유의한 상관관계를 보였으며, 맥락막비후 신생혈관증 환자군에서는 sVEGFR‐2와 MCP‐1, MCP‐1과 PDGF‐AA 간에 유의한 상관관계를 보였다(Table 3). 주사 치료 전후 사이토카인 농도의 변화량 간의 상관관계 분석에서는 삼출성 연령관련황반변성 환자군에서는 ΔsVEGFR‐2와 ΔMCP‐1 및 ΔIL‐8, ΔMCP‐1과 ΔIL‐6 및 ΔIL‐8, ΔIL‐6과 ΔIL‐8 사이에 유의한 상관관계를 보였고, 맥락막비후 신생혈관증 환자군에서는 유의한 상관관계를 보이는 사이토카인 조합이 관찰되지 않았다(Table 4).

Correlation matrix for changes in the level of aqueous humor cytokines between baseline and 1 month following initial anti‐ VEGF treatment
방수 내 사이토카인 농도와 맥락막두께와의 연관성 분석에서는 주사 치료 전후 sVEGFR‐2 농도의 변화량이 초기 황반하 맥락막두께 및 주사 전후의 황반하 맥락막두께 변화량과 유의한 연관성을 보였다. 초기 황반하 맥락막두께가 상대적으로 얇은 환자에게서 sVEGFR‐2 농도의 변화량이 컸고(p=0.003, r2=0.314), 치료 전후 황반하 맥락막두께 변화가 크지 않은 군에서 sVEGFR‐2 농도의 변화량이 컸다 (p=0.003, r2=0.145). 다른 사이토카인과는 맥락막두께가 유의한 연관성을 보이지 않았다(Fig. 3).
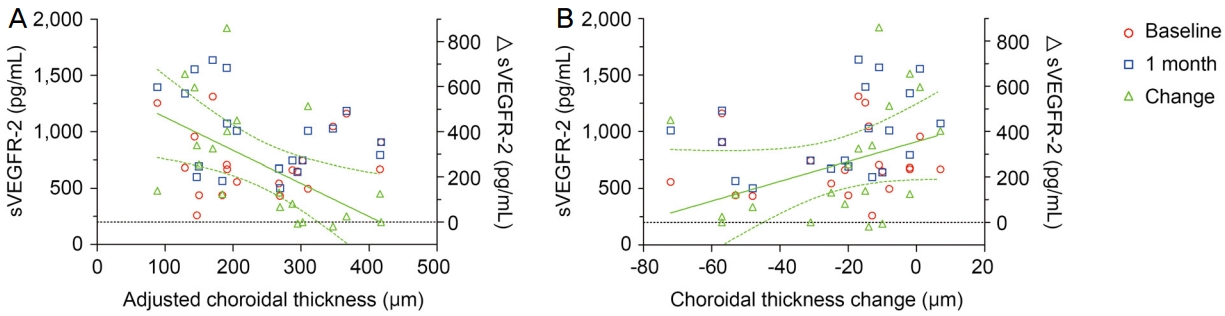
Correlation between subfoveal choroidal thickness and the level of sVGEFR‐2. (A) There was a significant negative correlation between the changes in the level of sVEGFR‐2 (ΔsVEGFR‐2) and adjusted subfoveal choroidal thickness (p = 0.003, r2 = 0.314). (B) There was a significant positive correlation between the changes in the level of sVEGFR‐2 (ΔsVEGFR‐2) and the changes in adjusted subfoveal choroidal thickness (p = 0.003, r2 = 0.145). These results suggest that a greater increase in the level of sVEGFR‐2 after anti‐VEGF treatment is observed in classic neovascular age‐related macular degeneration patients with relatively thin choroid and relatively lesser extent of choroidal thickness change after anti‐VEGF treatment. sVEGFR = soluble vascular endothelial growth factor receptor; VEGF = vascular endothelial growth factor.
고 찰
본 연구에서는 삼출성 연령관련황반변성 및 맥락막비후 신생혈관증 환자에서 항혈관내피세포성장인자 주사 치료 전후 안구 내 사이토카인 농도의 변화 양상이 맥락막두께에 따라 차이가 있는지 살펴보았다. 이번 연구에서 살펴본 사이토카인 중 VEGF‐A, sVEGFR‐2, PDGF‐AA가 주사 치료 전후 유의한 변화를 보였는데, 대부분 치료 후 농도가 낮아졌지만 sVEGFR‐2는 유의하게 증가하였다. 이 중 맥락막두께와 관련성을 보인 사이토카인은 sVEGFR‐2였는데, sVEGFR‐2의 치료 전후 변화량이 맥락막두께 및 맥락막두께의 변화량과 연관성을 보였다. 상대적으로 맥락막이 얇고 주사 치료 전후 맥락막두께의 변화량이 작은 전통적인 삼출성 연령관련황반변성 환자군에서 주사 치료 이후 sVEGFR‐2의 증가량이 크게 나타났다.
주요한 혈관신생인자인 VEGF는 두 가지 주요한 타이로신 키나제 수용체인 vascular endothelial growth factor receptor‐ 1 (VEGFR‐1) 및 vascular endothelial growth factor receptor‐2 (VEGFR‐2)를 통해 여러 생체 내 신호를 전달한다. 그중에서도 VEGFR‐2가 대부분 생물학적 작용에 관여하는 것으로 알려져 있으며[14], 대부분의 종양 조직의 혈관에서 VEGFR‐2의 발현이 증가되어 있음이 보고되고 있다[15,16]. sVEGFR‐2는 VEGFR‐2의 수용성 형태(soluble form)로 기존의 생체 내(in vivo) 및 시험관 내(in vitro) 연구들에서 혈중 VEGF 농도가 올라가면 sVEGFR‐2의 농도는 감소하는 것으로 알려져 있다. 이는 증가된 VEGF에 의해 세포 표면의 VEGF 수용체가 하향 조절되며, 이어서 수용성 형태인 sVEGFR‐2의 농도 역시 감소하는 것으로 생각된다[17]. 기존의 연구들에서 sVEGFR‐2에 비례하여 병적인 혈관신생이 줄어들었음이 보고되고 있으며[18,19], sVEGFR‐2는 중요한 림프관 성장의 내인성 저해제로 알려져 있다[20,21].
본 연구에서는 기존 보고와 달리 VEGF‐A 농도는 삼출성 연령관련황반변성 및 맥락막비후 신생혈관증의 양 군 간에 큰 차이가 없었다. 또한 예상과 달리 VEGF‐A 및 sVEGFR‐2 사이에 유의한 상관관계를 찾을 수 없었다. 가령, 삼출성 연령관련황반변성 환자군에서 초기 VEGF‐A 및 sVEGFR‐2 사이에 음의 상관관계를 보였으나 통계적으로 유의하지는 않았다(r=‐0.507, p=0.111). ΔVEGF‐A 및 ΔsVEGFR‐2 사이에서도 유의한 상관관계는 관찰되지 않았다. 이는 본 연구에 포함된 환자의 수가 많지 않아 유의한 통계적 차이를 보이지 못했을 가능성이 높으며, 각각의 연구에서 이용한 맥락막비후 신생혈관증의 진단기준이 동일하지 않았던 점에도 기인할 것이다. 또한 본 연구에서는 주사 치료 전과 치료 후 4주째의 방수 농도만 분석하였는데, 항혈관내피세포성장인자 주사 치료 이후 변화된 VEGF‐A 농도에 대응되는 sVEGFR‐2의 변화를 관찰하는 데 조금 더 짧거나 더 긴 다른 시점에서의 분석이 필요할 수도 있겠다.
기존 연구에서는 일반적인 삼출성 연령관련황반변성 환자에서는 MCP‐1과 IL‐6, IL‐8 사이에 유의한 상관관계를 보였지만 맥락막비후 신생혈관증에서는 이러한 상관관계를 보이지 않았으며, IL‐6, IL‐8, MCP‐1과 같은 염증성 사이토카인의 농도가 맥락막비후 신생혈관증 환자에서 전반적으로 낮다고 하였다[10]. 본 연구에서는 양 군 간에 sVEGFR‐2의 주사 치료 전후 변화량 외에 유의한 사이토카인 농도 차이는 관찰되지 않았지만, 각 사이토카인 농도 간의 상관관계 양상은 두 군 간에 차이를 보였다. 삼출성 연령관련황반변성 환자군에서는 기존 보고와 같이 MCP‐1과 IL‐6 및 IL‐8 사이에 유의한 양의 상관관계를 보였으나, 맥락막비후 신생혈관증 환자에서는 MCP‐1과 sVEGFR‐2 및 PDGF‐AA 사이에 유의한 양의 상관관계를 보였다. 특히 주사 치료 전후 사이토카인 농도의 변화량을 비교해 보았을 때 삼출성 연령관련황반변성 환자군에서는 ΔMCP‐1이 ΔIL‐6 및 ΔIL‐8과 유의한 양의 상관관계를 보였다. 반면, 맥락막비후 신생혈관증 환자군에서는 유의한 상관관계를 보이는 사이토카인 조합이 관찰되지 않았다. MCP‐1, IL‐6, IL‐8 등은 병적인 혈관신생과 관련된 것으로 잘 알려진 염증성 사이토카인으로[22,23], 이러한 수치들 사이에 높은 상관성을 보이는 것은 맥락막비후 신생혈관증보다 전통적인 삼출성 연령관련황반변성에서 혈관 신생 과정에서 염증성 반응이 더 중요하게 작용할 수 있음을 시사한다.
본 연구는 적은 환자 수와 짧은 경과 관찰 기간으로 인해 안구 방수 내 사이토카인 농도에 따른 임상양상의 차이를 충분히 살펴보는 데 제한점이 있었다. 안구 방수 분석도 치료 전 및 치료 후 4주째에만 분석을 시행하였는데, 조금 더 다양한 시점에서의 사이토카인 농도 변화를 분석해 볼 필요가 있다. 본 연구에서는 라니비주맙 치료군의 숫자가 적어 라니비주맙과 애플리버셉트 두 가지 항혈관내피세포성장인자 치료 약제 간의 비교를 할 수 없었다. 기존 보고에 의하면 라니비주맙 주사 치료 이후 안구 방수 내 sVEGFR‐2의 유의한 농도 변화는 없었으나[24], 애플리버셉트 주사 치료 이후에는 sVEGFR‐2의 농도가 증가하였다는 보고도 있다[25]. 향후 더 많은 환자들을 대상으로 주사 약제에 따른 안구 내 사이토카인 농도 변화 양상에 차이가 있는지, sVEGFR‐2 농도에 따른 항혈관내피세포성장인자 주사 치료의 효과 및 임상 경과에 차이가 있는지 비교해 보는 추가적인 연구가 필요하겠다.
맥락막비후 신생혈관증 환자군에 비해 삼출성 연령관련 황반변성 환자군에서 항혈관내피세포성장인자 주사 치료 전후 sVEGFR‐2의 상승폭이 컸으며, MCP‐1, IL‐6, IL‐8 등 염증성 사이토카인 수치 사이의 상관관계가 높게 나타났다. 이러한 결과는 두 질환군 간에 혈관신생인자나 염증성 사이토카인이 질병의 병태생리에 작용하는 방식에 차이가 있을 수 있음을 시사한다. 향후 맥락막혈관의 병태생리가 연령관련황반변성의 발달과 임상양상에 미치는 영향에 대한 추가적인 연구가 필요하겠다.
Acknowledgements
This study was supported by Korean Association of Retinal Degeneration and a grant no. 2017‐08 from the Kangdong Sacred Heart Hospital Fund.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
공정한 / Jeong Han Kong
한림대학교 의과대학 강동성심병원 안과학교실
Department of Ophthalmology, Kangdong Sacred Heart Hospital, Hallym University College of Medicine

