증식당뇨망막병증의 유리체절제술 후 신생혈관녹내장의 발생률과 위험인자
Neovascular Glaucoma after Diabetic Vitrectomy: Incidence and Risk Factors
Article information
Abstract
목적
증식당뇨망막병증의 유리체절제술 후 신생혈관녹내장의 발생률과 위험인자에 대해 알아보았다.
대상과 방법
2013년 3월부터 2019년 7월까지 증식당뇨망막병증으로 유리체절제술을 시행한 후 1년 이상 경과 관찰된 총 141명, 171안의 의무기록을 후향적으로 분석하였다. 유리제절제술시 술 전 전안부 신생혈관이 있는 경우에 베바시주맙을 전방과 유리체내에 동시 주입하였고, 술 전 전안부 신생혈관이 없으면 베바시주맙을 유리체내에만 단독 주입하였다. 환자들의 나이, 성별, 당뇨 유병 기간, 고혈압, 반대안 신생혈관녹내장, 술 전 견인망막박리, 범망막광응고 여부, 술 후 유리체출혈, 망막박리 여부를 분석하였다.
결과
총 141명, 171안이 연구에 포함되었고, 술 후 신생혈관녹내장의 발생은 10명(5.85%)이었다. 술 전 전방각이나 홍채에 신생혈관이 있던 환자 18명 중 5명(27.78%)에서 유리체절제술 후 신생혈관녹내장이 발생하였다. 위험인자 분석에서 술 전 전방각이나 홍채에 신생혈관이 있을수록(p=0.003, odds ratio [OR]=16.428), 당뇨 유병 기간이 짧을수록(p=0.033, OR=0.853), 술 전 범망막광응고가 안 되어 있을수록(p=0.035, OR=0.006) 신생혈관녹내장 발생이 증가하였다.
결론
증식당뇨망막병증의 유리체절제술 전에 술 전 전방각이나 홍채신생혈관이 있을 때, 당뇨 유병 기간이 짧은 경우, 술 전 범망막광응고가 안된 경우에는 유리체절제술 후 신생혈관녹내장 발생 가능성이 높아지므로 보다 면밀한 관찰이 필요하다.
Trans Abstract
Purpose
The prevalence and risk factors of neovascular glaucoma (NVG) after diabetic vitrectomy were evaluated.
Methods
This retrospective study included 171 eyes of 141 patients who underwent diabetic vitrectomy in-hospital between March 2013 and July 2019 and were followed for >12 months postoperatively. Regardless of the presence or absence of neovascularization in the anterior segment, all patients received injections of intravitreal bevacizumab during vitrectomy. Patients with preoperative neovascularization in iris (NVI) or angle (NVA) received both intracameral and intravitreal bevacizumab injections. Data were collected regarding baseline demographics, preoperative best-corrected visual acuity, intraocular pressure, hypertension, NVG in the fellow eye, panretinal photocoagulation history, iris and angle neovascularization, and postoperative findings (e.g., rebleeding and residual retinal detachment).
Results
In total, 141 patients and 171 eyes were included in the study, and the incidence of postoperative NVG was 5.85% (10 patients). Five patients (27.78%) with preoperative NVI or NVA developed postoperative NVG. Significant risk factors for postoperative NVG were preoperative NVA or NVI (odds ratio [OR] = 16.428, p = 0.003), shorter diabetic duration (OR = 0.853, p = 0.033), and the absence of preoperative panretinal photocoagulation (OR = 0.006, p = 0.035).
Conclusions
There is a high possibility of postoperative NVG in patients with preoperative NVI or NVA, a short duration of diabetes, and no preoperative panretinal photocoagulation. In such patients, close monitoring is required after diabetic vitrectomy.
유리체절제술은 지속되는 유리체출혈, 황반부를 포함하는 섬유혈관증식막, 견인망막박리 등 진행된 증식당뇨망막병증의 주된 치료 방법이다. 수술로 망막이 안정화되어 시력이 좋아져도 술 후 신생혈관녹내장(neovascular glaucoma, NVG)이 발생하여 시력을 잃는 경우가 드물지 않다[1]. 따라서 NVG에 대한 각종 위험인자를 알고, 유리체절제술 후 NVG 발생 가능성이 있는 환자들을 집중적으로 관리하는 것이 당뇨유리체절제술 예후에 중요하다.
NVG는 정상 안압에서 전방각신생혈관(neovascularization in angle, NVA)이나 홍채신생혈관(neovascularization in iris, NVI)이 생기는 녹내장 전 단계(rubeosis iridis, preglaucomatous NVG)에서 시작한다. 점차적으로 방수유출이 감소하여 안압이 상승하는 개방각녹내장 단계(open angle NVG)를 지나 섬유혈관막의 수축으로 폐쇄각녹내장 단계(close angle NVG)에 이르게 된다[2-4].
NVG 치료에 가장 중요한 것은 조기 발견이다. 안압이 정상인 녹내장 전 단계 NVG에서 충분히 범망막광응고를 하면 NVA나 NVI는 퇴행하고 개방각 상태를 유지할 수 있기 때문이다[2]. 최근 NVG의 안압하강치료에 항혈관내피성장인자(anti-vascular endothelial growth factor, anti-VEGF)의 사용이 널리 알려져 있다[5,6]. 당뇨유리체절제술 시 anti-VEGF의 사용이 NVG에 미치는 영향에 대해 연구되었으나[7], 이는 anti-VEGF의 유리체내 주입에 대한 연구였고, 전방내 주입에 대한 연구는 없었다.
본 연구에서는 증식당뇨망막병증의 유리체절제술 시 술 전 NVA나 NVI가 관찰되는 경우 유리절제술을 하면서 전방과 유리체 내에 anti-VEGF를 동시 주입하고, 그 외의 경우에는 유리체 내에만 anti-VEGF를 주입하여 NVG 발생률과 그 위험인자에 대해 분석하고자 하였다.
대상과 방법
본 연구는 2013년 3월 1부터 2019년 7월 31일까지 증식당뇨망막병증으로 유리체절제술을 받고 1년 이상 경과 관찰된 환자들을 대상으로 의무기록을 후향적으로 분석하였다. 헬싱키선언을 준수하여 메리놀병원 임상시험위원회로부터의 승인을 받았다(승인 번호: MMC/2018-273).
선정 기준으로 18세 이상, 증식당뇨망막병증으로 인해 3개월 이상 유리체출혈이 회복되지 않거나 황반부를 위협하는 견인망막박리, 섬유혈관증식막이 심하여 유리체절제술을 받은 환자로서 수술 전 비산동 전방각경검사를 시행한 경우를 대상으로 하였다. 제외 기준으로 증식당뇨망막병증과 백내장 이외의 다른 안내 질환이 있거나 이전 유리체절제술이나 스테로이드 주입술을 받은 경우, 수술 전 안압이 22 mmHg 이상이었거나 수술 중 후낭파열이 있는 경우로 정하였다.
백내장이 있거나 술 후 백내장 진행이 심해지리라 예상되는 경우는 수정체초음파유화술 후 후낭 내에 인공수정체를 삽입하였다. 이후 23 또는 25게이지 평면부유리체절제술을 시행하였다(Accurus@ or Constellation@; Alcon Laboratories, Inc., Fort Worth, TX, USA). 유리체는 기저부까지 최대한 제거하였다. 섬유혈관증식막을 제거하고, 망막신생혈관은 압박 지혈하거나 투열 치료하였다. 망막열공이 다수 발생했거나 유리체망막견인이 해제되지 않은 경우에는 C3F8가스나 실리콘기름을 주입하였다. 수술 중에 가능한 주변부까지 안내 레이저침을 이용해 범망막광응고를 시행하였다. 술 전 전안부 신생혈관이 있는 경우, 유리체절제술을 마치면서 베바시주맙(Avastin, Genetech Inc., San Francisco, CA, USA)을 전방에 1.25 mg (0.05 mL), 유리체내에 2.5 mg (0.1 mL)을 주입하였고, 전안부 신생혈관이 없으면 유리체 내에만 베바시주맙 2.5 mg (0.1 mL)을 주입하였다. 술 후 형광안저혈관조영검사를 시행하여 망막허혈 부위에 레이저광응고를 추가로 시행하였다. 수술 전 유리체내 베바시주맙 주입은 모든 환자에서 시행하지 않았다.
NVI는 고배율 세극등현미경에서 보이는 홍채 표면의 혈관으로 정의하였고, NVA는 비산동 상태에서 전방각경검사로 섬모체띠, 섬유주 등 전방각에서 보이는 혈관 조직으로 정의하였다. 전안부 신생혈관은 NVI 또는 NVA가 발견된 경우로 정하였다. NVG는 NVA나 NVI가 있으면서 안압이 연속적으로 22 mmHg 이상 상승한 경우로 정의하였다.
NVG 발생 위험인자를 알기 위해 나이, 성별, 술 전 시력, 안압, 고혈압, 당뇨 유병 기간, 반대 안 NVG 여부, 술 전 전안부 신생혈관, 견인망막박리, 술 전 범망막광응고 여부, 술 후 유리체출혈, 술 후 망막박리 발생 여부를 분석하였다.
통계는 SPSS statistics version 21.0 (IBM Corp., Armonk, NY, USA) 프로그램을 사용하였다. NVG 발생군과 발행하지 않은 군의 발생 빈도 비교에서 연속형 변수는 Mann-Whitney test, 범주형 변수는 Fisher's exact test를 사용하였다. 전안부 신생혈관이 있는 18명을 대상으로 NVA, NVI 존재에 따라 NVG 발생률의 차이를 비교하기 위해 Chi square test와 Fisher's exact test를 시행하였다. NVG 발생의 위험인자는 로지스틱 회귀분석을 이용하여 구하였다. 통계적 유의성은 p<0.05로 정의하였다.
결 과
총 141명, 171안으로 평균연령은 55.5 ± 11.11세(28-83세)였고 평균 경과 관찰 기간은 26.85 ± 14.99개월(12-64개월)이었다. 전체 환자 중에서 술 전 전안부 신생혈관이 있는 경우는 18안(10.53%)이었다. NVG 발생은 171안 중 10안(5.85%)으로 술 전 전안부 신생혈관이 있는 18안에서 5안(27.78%), 전안부 신생혈관이 없는 153안에서 5안(3.27%) 발생하였다(Fig. 1). 전안부 신생혈관 중에도 NVA만 있는 경우는 7.7%에서, NVI만 있는 경우에는 66.7%에서, NVA와 NVI가 동시에 있는 경우는 100%에서 NVG가 발생하였다(p=0.008) (Table 1). 모든 경우에서 2형 당뇨에 해당하였다. NVG가 발생한 평균 시기는 술 후 5.4 ± 2.99개월(3-12개월)이었다(Fig. 2). 빈도 분석에서 NVG가 발생한 군과 NVG가 발생하지 않은 군의 유의한 차이로서는 NVG 군에서 젊고(p=0.022), 당뇨 유병 기간이 짧고(p=0.007), 술 전 전안부 신생혈관이 관찰되었으며(p=0.001), 반대 안에 NVG가 있었으며(p=0.018), 술 전 범망막광응고가 되어있지 않았다(p=0.003). 고혈압, 술 전 안압, 술 후 유리체출혈이나 견인망막박리 발생 여부는 통계적으로 유의한 차이를 보이지 않았다(Table 1).

Flow chart of the research methods. PDR = proliferative diabetic retinopathy; IOP = intraocular pressure; PPV = pars plana vitrectomy; NVA = neovascularization of angle; NVI = neovascularization of iris; NVG = neovascular glaucoma.
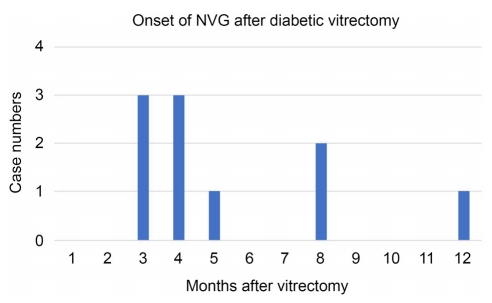
Onset of neovascular glaucoma (NVG) after diabetic vitrectomy. Three months after diabetic vitrectomy, neovascular glaucoma arose.
Table 2는 당뇨망막병증의 유리체절제술 후 NVG 발생의 위험인자를 알아보기 위해 로지스틱 회귀분석을 한 결과이다. 술 전 전안부 신생혈관(p=0.033, odds ratio [OR]=16.428)은 양의 상관관계를, 술 전 범망막광응고(p=0.006, OR=0.035)와 당뇨 유병 기간(p=0.033, OR=0.853)은 음의 상관관계를 보였다.
고 찰
전체 증식당뇨망막병증 환자의 21%에서 NVG가 나타난다[7]. 매체혼탁, 견인망막박리가 있는 진행된 증식당뇨망막병증에서 유리체절제술을 하지 않았을 때 NVG 발생률이 연구된 바는 없었다. 그러나 이런 경우 유리제절제술 없이는 레이저광응고술이 어려워 망막허혈 상태가 지속되고, NVG 발생 가능성은 시간이 지날수록 계속 증가할 것임을 이론적으로 알 수 있다.
1990년에 발표된 Diabetic Retinopathy Vitrectomy Study [8]에서는 증식당뇨망막병증의 유리체절제술 후 NVG 발생률이 13-27%였다. 최근에는 빠른 절단 속도를 가진 유리체절제기구와 광각 수술 현미경, 굽은 레이저침, 항혈관내피성장인자의 사용, 수술 기법의 발전 등 유리체 망막수술 환경이 발전되어, 무수정체안, 술 후 잔여 망막박리, 증식유리체망막병증 등의 합병증이 줄고, 주변부까지 눈 속 광응고술이 가능해졌다. 따라서 2010년 이후 유리체절제술이 시행된 연구들에 의하면 증식당뇨망막병증의 유리체절제술 후 NVG 발생률이 5.5-11.8%로 낮아졌다[9-12]. 본 연구에서는 술 후 12개월까지 NVG의 발생률은 5.85%였다. 비슷한 수술 환경과 항혈관내피성장인자를 사용한 타 연구보다 NVG 발생률이 비교적 적은 이유로 술 전 NVI나 NVA가 발견되었을 때 전방과 유리체 내에 베바시주맙을 동시 투여한 점을 들 수 있다.
최근 증식당뇨망막병증의 유리체절제술 후 신생혈관녹내장의 위험인자로 밝혀진 바는 남자, 젊은 나이, 술 전 높은 안압, 술 전 전방각신생혈관, 반대안 NVG, 높은 당화혈색소 수치, 심한 증식당뇨망막병증, 술 전 범망막광응고가 안되어 있을수록, 술 후 유리체출혈 발생, 짧은 당뇨 유병기간 등이다. 본 연구에서는 나이, 성별, 안압, 술 후 합병증 등은 관련이 없었고, 술 전 전안부 신생혈관, 짧은 당뇨 유병 기간, 술 전 범망막광응고가 시행되지 않은 것이 위험인자로 나왔다[9-12].
본 연구에서 171안 중 술 전 NVA만 있는 안이 13안, NVI만 있는 안은 3안, NVI와 NVA가 모두 있는 안은 2안이었다. Sanborn et al [13]의 연구에 의하면 세극등현미경검사는 홍채혈관조영검사보다 NVI를 36.6%에서 발견하지 못했다. 세극등현미경과 전방각경검사만으로 한 연구에서 Hayreh et al[14]은 모든 경우에서 NVI가 생긴 후 NVA가 나온다고 하였고, Browning et al [15]가 NVI 없이 NVA만 있는 경우가 12%였다고 보고한 연구에 비하면 NVI가 상당히 적은 수이다. 본 연구에서 NVA에 비해 NVI가 적은 이유는 세극등현미경과 전방각경검사만으로 홍채색이 진한 한국인의 NVI를 발견하기 어려워 위음성이 많았음이라 생각된다.
그럼에도 불구하고 술 전 전안부 신생혈관은 증식당뇨망막병증 유리체절제술 후 NVG를 일으키는 가장 강력한 위험인자로 나왔다. 이는 NVA의 섬유화로 인한 방수유출 제한과 NVA의 재발로 설명할 수 있다. 베바시주맙은 혈관내피성장인자를 감소시키나, 결합조직성장인자(connective tissue growth factor) 등 섬유화와 관련된 인자들은 상대적으로 증가시킨다[16]. 이는 증식당뇨망막병증에서 베바시주맙 주입 후 망막신생혈관 자리에 섬유조직이 남는 것과 섬유화의 진행으로 인한 견인망막박리의 발생을 설명할 수 있다.17 같은 원리로 술 전 NVA가 퇴화하면서 섬유주의 섬유화를 일으켜 방수유출에 제한을 줄 수 있을 것으로 생각된다. 또한 베바시주맙 주사 후 NVA는 퇴화되었지만, 수술시 시행한 범망막광응고술은 수주 지나서 효과가 있기에[18], 안내 허혈 인자가 심한 환자에서는 대부분 NVA가 재발한다[19]. Ha et al [19]의 연구에서 NVG 환자의 전방과 유리체내베바시주맙 동시 주사 시 NVA의 퇴화가 8주까지 유지되었고, 이후 모든 경우에서 NVA가 재발하였다. 본 연구에서는 술 전 전안부 신생혈관이 있던 환자 18명 중 5명(27.8%)에서 NVG가 발생하였고, 모두 술 후 3개월 이후에 발생하였다(Fig. 2). Ha et al [19]의 연구보다 NVA의 재발이 적은 것은 유리체절제술을 하면서 보다 광범위하게 범망막광응고술을 시행한 것과 유리체내 증식, 염증을 일으키는 물질들이 수술로 제거되었기 때문으로 생각된다.
수술 전 범망막광응고가 된 경우 NVG 발생이 적었다. 범망막광응고의 작용 기전이 완전히 밝혀지지는 않았으나, 망막의 산소 소비의 주를 이루는 광수용체-망막색소상피세포 복합체를 파괴하여 망막의 산소 소비를 줄이고, 맥락막에서 망막으로 산소 흡수를 도와 내망막층의 저산소증을 줄여 혈관내피성장인자의 분비를 줄이는 것으로 알려졌다[20]. 범망막광응고로 망막신생혈관뿐만 아니라 전방각신생혈관까지 퇴화시켜 NVG 발생을 줄일 수 있다. 유리체절제술 시 모든 경우에 범망막광응고를 시행하였기 때문에 술 후 범망막광응고가 되어 있는 외적 상태는 같아 보인다. 그러나, 범망막광응고는 수주 지나서 효과가 있기에[18], 이전에 범망막광응고를 받지 않았던 안은 이미 범망막광응고가 되어있던 안보다 술 후 수주 동안에는 혈관내피성장인자나 염증성 사이토카인이 높아 NVG로의 진행이 상대적으로 증가될 수 있다.
일반적으로 당뇨 유병 기간이 길수록 증식당뇨망막병증 진행이 많이 된다[21-23]. Lee et al [24]의 연구에서는 처음 증식당뇨망막병증을 진단받은 환자들을 대상으로 유병 기간이 길수록 NVG 발생 가능성이 높았다. 이 연구들과는 달리, 본 연구에서는 당뇨 유병 기간이 짧을수록 NVG 가능성이 높았다. 이는 본 연구가 유리체절제술이 필요한 진행된 증식당뇨망막병증 환자를 대상으로 한 것으로, 진행된 증식당뇨망막병증 환자가 진술하는 당뇨 유병 기간이 짧다면, 그만큼 혈당 조절이 안 된 기간이 길다는 것을 의미한다. Takayama et al [11]이 발표한 268명의 25게이지 증식당뇨망막병증 유리체절제술 후 NVG 발생 위험인자 연구에서도 당뇨 유병 기간이 짧을수록 유리체절제술 후 NVG 가능성이 높았었다.
본 연구의 한계로는 후향적 연구인 점, 적은 수의 환자를 대상으로 한 점, 당뇨 유병 기간이 환자 진술에 기반하여 정확하지 않은 점, 홍채혈관조영술을 하지 못해 NVI의 발견이 정확하지 않은 점이다. 그러나 진한 홍채 색을 가진 아시아인에게서 홍채혈관조영술을 자주 하기는 어렵고, 환자의 병력을 기반으로 당뇨 유병 기간을 예측해야만 하는 현 진료 환경을 고려하면 실질적으로 적용하는 데에 도움이 될 수 있다.
유리체절제술 후 망막이 안정되어 경과 관찰 간격을 늘리는 3개월 이후에 오히려 NVG의 발생이 자주 일어날 수 있음을 기억해야 한다. 수술 전 전안부 신생혈관이 있었던 경우, 수술 전 범망막광응고가 안되었던 경우, 진행된 증식당뇨망막병증 환자가 진술하는 당뇨 유병 기간이 짧은 경우 술 후 신생혈관녹내장이 발생 가능성이 높은 환자임을 기억하고, 비산동 전방각경검사를 반복해야 한다. 또한 치료 후 전안부 신생혈관이 없어지고, 개방각 상태이더라도 이미 섬유주가 손상 받았을 가능성을 고려하여 술 후 안압을 관찰한다면 유리체절제술 후 회복된 시력을 장기적으로 유지할 수 있을 것이다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
손현우 / Hyeon Woo Son
메리놀병원 안과
Department of Ophthalmology, Maryknoll Hospital


