베스트병으로 진단된 국내 환자의 특성과 임상경과
The Characteristics and the Clinical Courses of Best Disease in Korean Patients
Article information
Abstract
목적
베스트병으로 진단된 국내 환자들의 특징과 임상경과를 분석하고자 한다.
대상과 방법
베스트병을 진단 받은 후 12개월 이상 추적 관찰한 환자를 대상으로 의무기록을 분석하였다. 진단 당시 질병의 단계 및 최대교정시력을 확인하였으며, 추적 관찰 기간 동안 질병의 단계 진행 여부를 확인하였다. 진단 시 및 최종 추적 관찰 시의 최대교정시력을 서로 비교하였으며, 단계의 진행이 있었던 안과 없었던 안 사이에 시력 변화 정도를 추가로 비교하였다.
결과
전체 16명(32안)을 대상으로 연구를 시행하였으며, 평균 추적 관찰 기간은 52.1 ± 31.8개월이었다. 진단 시 베스트병 단계는 1단계 3안, 2단계 9안, 3단계 7안, 4단계 11안, 5단계 2안이었다. 추적 관찰 기간 동안 9안(28.1%)에서 단계의 진행이 관찰되었다. Logarithm of minimal angle of resolution (logMAR) 시력은 진단 시 평균 0.19 ± 0.19였으며, 최종 추적 관찰 시 평균 0.30 ± 0.27로 유의하게 악화되었다(p=0.004). 6안(18.8%)에서 logMAR 0.2 이상의 시력저하가 나타났다. 시력 악화 정도는 단계의 진행이 있었던 9안(0.25 ± 0.26)에서 단계 진행이 없었던 23안(0.05 ± 0.08)에 비해 더 큰 폭으로 나타났다(p=0.001).
결론
베스트병 환자의 진단 시 시력은 비교적 좋은 편이었으나 시간의 경과에 따라 일부 환자에서 질병의 단계 진행과 시력저하가 나타났다. 단계의 진행은 나쁜 시력예후와 연관된 것으로 나타났다.
Trans Abstract
Purpose
To evaluate the clinical characteristics and courses of Best disease in Korean patients.
Methods
We retrospectively reviewed the medical records of patients with Best disease followed-up for more than 12 months after diagnosis. The disease stage and best-corrected visual acuity (BCVA) at diagnosis, and stage progression during follow-up, were evaluated. The BCVA at diagnosis was compared to that at the final follow-up. The BCVA changes were compared between those evidencing stage progression and not.
Results
A total of 16 patients (32 eyes) were enrolled. The mean follow-up period was 52.1 ± 31.8 months. At diagnosis, three eyes had stage 1, nine stage 2, seven stage 3, 11 stage 4, and two stage 5 disease. During follow-up, stage progression was observed in nine eyes (28.1%). The mean logarithm of the minimal angle of resolution (logMAR) BCVA significantly worsened from 0.19 ± 0.19 at baseline to 0.30 ± 0.27 at the final follow-up (p = 0.004). In six eyes (18.8%), a deterioration of logMAR 0.2 or greater was noted. The extent of deterioration was greater in the nine eyes (0.25 ± 0.26) exhibiting stage progression than in the 24 eyes (0.05 ± 0.08) lacking such progression (p = 0.001).
Conclusions
The visual acuity of Best disease patients was relatively good at diagnosis. However, stage progression and visual deterioration were noted in some patients. Stage progression was associated with a poor visual prognosis.
베스트병은 베스트 노른자 모양 황반이영양증으로도 불리고 있으며, BEST1 유전자의 변이에 의해 발생하는 유전성 망막질환이다[1]. 주로 상염색체 우성 유전을 하며, 소아부터 성인까지 다양한 연령대에서 발병할 수 있다. 유병률은 연구에 따라 약간의 차이가 있는데 16,500명 중 1명에서 100,000명당 1.5명 정도로 상당히 낮은 것으로 알려져 있다[2,3].
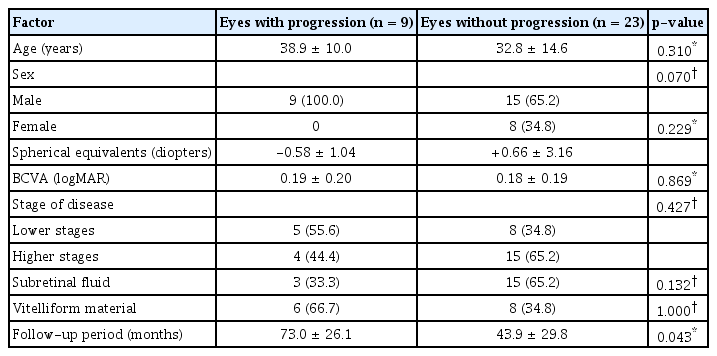
Gass [4]는 베스트병의 진행 단계를 황반의 형태에 따라 5단계로 분류하였다. 초기에는 황반부 망막색소상피에 약간의 변화가 나타나는 정도이나(1단계) 진행하면 노른자 모양(vitelliform) 병변이 나타나며(2단계), 이후 가성전방축농(pseudohypopyon) 단계(3단계)를 거쳐 풀어 익힌 노른자 모양(vitelloeruptive) 단계(4단계)로 진행하게 된다. 최종적으로 황반중심부의 위축 혹은 반흔이 나타나게 된다(5단계). 전기생리학적 검사에서 망막전위도(electroretinogram)는 정상이나 눈전위도(electrooculogram)에서 아덴비(Arden ratio)가 뚜렷하게 감소하는 결과가 나타난다.
과거 베스트병은 안저 소견을 바탕으로 진단하고 경과를 확인하였으나, 빛간섭단층촬영기기의 발달과 함께 현재는 빛간섭단층촬영이 눈 상태 확인에 중요한 검사 방법으로 이용되고 있다[5,6]. 국내 보고된 연구 결과의 경우 베스트병에서 나타나는 다양한 검사 소견을 분석한 연구를 비롯하여 여러 증례들이 보고되어 있다[6-10]. 그러나 현재까지 국내 보고는 소수의 환자를 대상으로 한 연구였으며, 경과 관찰 중 발생하는 시력 변화나 질병의 단계 변화에 대해서는 아직 충분히 알려져 있지 않다. 이에 본 연구에서는 베스트병으로 진단된 국내 환자들의 특징과 임상경과를 분석하고 이를 보고하고자 한다.
대상과 방법
본 후향적 연구는 단일 기관에서 헬싱키선언에 입각하여 시행되었으며, Institutional Review Board (IRB) 승인을 획득하였다(Kim’s Eye Hospital-IRB, 2020-05-008). 2011년 1월부터 2019년 12월까지 김안과병원 망막병원을 방문하여 베스트병을 진단 받은 후 12개월 이상 추적 관찰한 환자를 대상으로 의무기록을 분석하였다. 눈전위도검사(electrooculogram)상 아덴비 1.85 이하인 경우를 연구에 포함하였다.
진단 당시 현성굴절검사가 시행되었으며, 최대교정시력측정, 세극등검사, 안저검사, 안저촬영, 빛간섭단층촬영(optical coherence tomography), 눈전위도검사 및 망막전위도검사가 시행되었다. 추가적으로 당뇨, 고혈압 여부를 확인하였다. 시력은 decimal 시력표를 이용하여 측정한 후 분석을 위해 logarithm of minimal angle of resolution (logMAR) 값으로 변환하였다.
진단 당시 및 최종 추적 관찰 시의 안저촬영검사 결과를 바탕으로 Gass 분류법[4]에 따라 질병의 단계를 분류하였는데(Fig. 1), 빛간섭단층촬영 소견을 추가적으로 참고하였다. 빛간섭단층촬영 소견의 경우 망막하액, 망막하 노른자 모양 물질(vitelliform material), 반흔과 위축 등 베스트병의 각 단계에서 나타날 수 있는 소견들을[11, 12] 고려하였다. 질병의 단계는 아래와 같이 5가지 단계로 분류하였다: 1) 노른자 모양 병변이 아직 나타나지 않은 경우, 2) 노른자 모양 병변이 관찰되는 경우, 3) 가성전방축농이 관찰되는 경우, 4) 풀어 익힌 노른자 모양의 병변이 관찰되는 경우, 5) 위축성/반흔성 병변이 관찰되는 경우.
Fundus photographs showing various stages of Best disease. (A) Stage 1 (pre-vitelliform stage), (B) stage 2 (vitelliform stage), (C) stage 3 (pseudohypopyon stage), (D) stage 4 (vitelloeruptive stage), (E) stage 5 (atrophic/cicatrical stage).
추적 관찰 기간 동안 단계 진행 여부를 확인하였으며, 단계의 진행이 있었던 안과 없었던 안 사이에 최대교정시력 변화 정도를 서로 비교하였다. 진단 시 및 최종 추적 관찰 시의 최대교정시력을 서로 비교하였다. 추가적으로 진단시 및 최종 추적 관찰 시 빛간섭단층촬영 결과를 바탕으로 노른자 모양 물질(vitelliform material)과 망막하액 유무를 평가하였다. 상기 소견들과 단계의 진행 및 시력 변화와의 연관성을 확인하기 위해 최초 진단 당시 소견의 유무에 따라 각각 두 개의 군으로 구분하였으며, 양 군 사이에 시력 변화 정도 및 단계 진행의 빈도를 서로 비교하였다.
단계의 진행과 관련된 인자를 확인하기 위해 단계가 진행한 안과 그렇지 않은 안 사이에 나이, 성별, 구면렌즈대응치, 시력, 진단 당시 질병의 단계, 망막하액 여부, 노른자 모양 물질 여부, 추적 관찰 기간을 서로 비교하였다. 상기 비교에서 진단 당시 질병의 단계의 경우 stage 1, 2는 낮은 단계, stage 3, 4, 5의 경우 높은 단계로 2가지로 구분하였다.
통계 분석에는 SPSS 프로그램(SPSS ver. 12.0 for Windows; IBM Corp., Armonk, NY, USA)을 이용하였다. Wilcoxon signed ranks test를 이용하여 서로 다른 시점에 측정된 시력을 비교하였으며, 서로 다른 두 군 사이의 비교는 Mann-Whitney U test 혹은 Fisher’s exact test를 이용하였다. 0.05 미만의 p값을 통계적으로 유의한 값으로 정의하였다.
결 과
연구 기간 동안 총 21명의 환자가 베스트병으로 진단되었으며, 이 중 12개월 이상 추적 관찰된 16명(32안)을 대상으로 연구를 시행하였다(Table 1). 진단 시 환자의 평균 연령은 34.5 ± 13.8세였으며, 눈전위도검사를 통해 측정된 평균 아덴비는 1.4 ± 0.2였다. 평균 추적 관찰 기간은 52.1 ± 31.8개월이었다. 추적 관찰 기간 동안 1안에서 맥락막혈관신생이 발생하여 유리체강내 베바시주맙주입술을 시행받았으며, 나머지 31안의 경우 특별한 치료 없이 경과 관찰하였다.
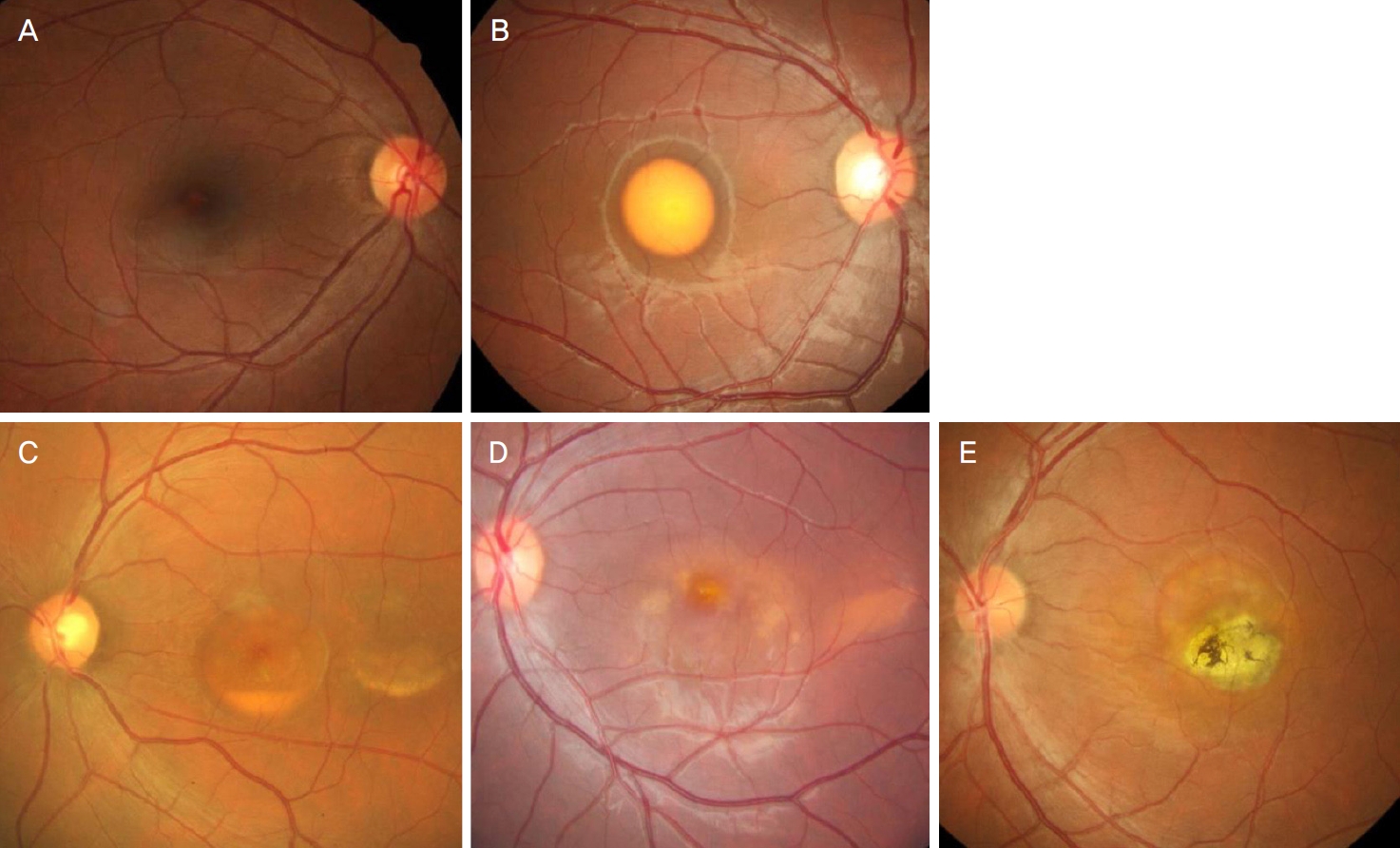
추적 관찰 기간 동안의 각 환자에서 나타난 베스트병의 단계 변화와 시력의 변화를 Table 2에 요약하였다. 진단 시 베스트병 단계는 1단계가 3안(9.4%), 2단계가 9안(28.1%), 3단계가 7안(21.9%), 4단계가 11안(34.4%), 5단계가 2안(6.3%)이었다. 추적 관찰 기간 동안 9안(28.1%)에서 단계의 진행이 관찰되었으며(Fig. 2), 나머지 23안의 경우 단계 진행이 없었다. 최종 추적 관찰 시에는 1단계가 3안(9.4%), 2단계가 5안(15.6%), 3단계가 7안(21.9%), 4단계가 8안(25.0%), 5단계가 9안(28.1%)이었다. 양안이 같은 단계를 보인 환자들은 진단 당시 9명(56.3%), 최종 추적 관찰 시 9명(56.3%)이었다. 진단 당시 양안이 같은 단계를 보인 9명 중 1명의 경우 양안에 서로 다른 단계의 진행이 나타나면서 최종 추적 관찰 시에는 양안이 다른 단계를 보이게 되었다.
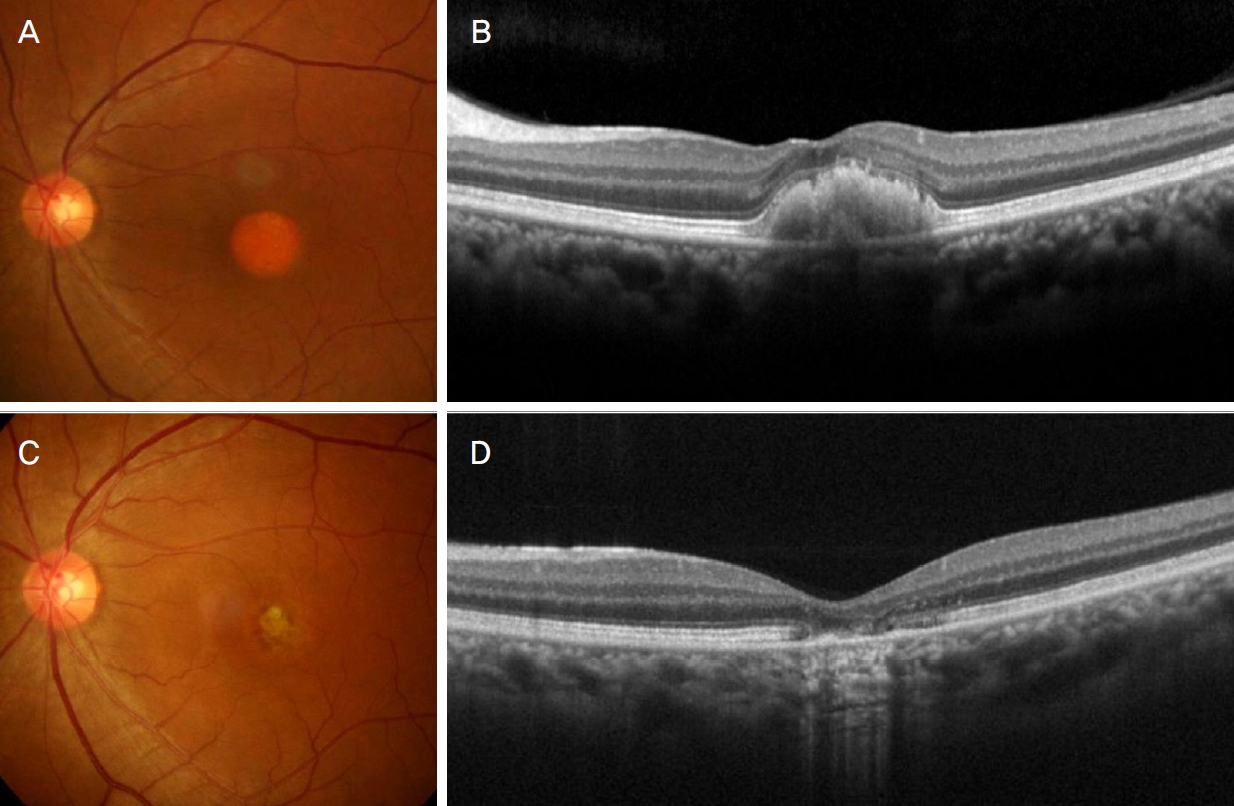
Representative case showing progression of the stage in Best disease. At diagnosis, vitelliform lesion was clearly shown on fundus photography (A). On optical coherence tomography (B), subretinal hyperreflective lesion was noted at the region of vitelliform lesion. Twenty-six months after diagnosis (C, D), the stage was progressed from vitelliform stage to atrophic/cicatrical stage.
LogMAR 시력은 진단 시 평균 0.19 ± 0.19였으며, 최종 추적 관찰 시 평균 0.30 ± 0.27로 유의하게 악화되었다(p=0.004). 진단 당시 8안(25.0%)에서 시력이 0.5 이하였으나, 최종 추적 관찰 시에는 17안(53.1%)에서 0.5 이하의 시력을 보였다. 추적 관찰 기간 동안 6안(18.8%)에서 logMAR 0.2 이상의 시력저하가 나타났다. 질병 단계의 진행이 있었던 9안의 경우 평균 시력은 진단 시 0.19 ± 0.20에서 최종 추적 관찰 시 0.45 ± 0.29로 변화하였으며, 단계 진행이 없었던 23안의 경우 진단 시 0.18 ± 0.19에서 최종 추적 관찰 시 0.23 ± 0.21로 변화하였다. 단계 진행이 있었던 경우 더 큰 폭의 시력저하가 나타났다(p=0.001).
빛간섭단층촬영을 통해 확인하였을 때, 진단 시 27안(84.4%)에서 노른자 모양 물질, 18안(56.3%)에서 망막하액이 관찰되었으며, 최종 추적 관찰 시에는 각각 19안(59.4%), 16안(50.0%)에서 관찰되었다. 추적 관찰 기간 동안의 시력저하 정도는 진단 당시 노른자 모양 물질이 관찰된 27안에서 평균 0.12 ± 0.18, 관찰되지 않은 5안에서 평균 0.01 ± 0.02였으며, 노른자 모양 물질이 관찰되지 않은 경우 더 낮은 값을 보였다(p=0.042). 단계 진행을 보인 안은 노른자 모양 물질이 관찰된 27안 중 8안(29.6%), 관찰되지 않은 4안 중 1안(25.0%)으로 양 군 사이에 그 빈도의 유의한 차이는 없었다(p=1.000). 추적 관찰 기간 동안의 시력저하 정도는 진단 당시 망막하액이 관찰된 18안에서 평균 0.10 ± 0.22, 관찰되지 않은 14안에서 평균 0.11 ± 0.09였으며, 양 군 사이에 유의한 차이는 없었다(p=0.193). 단계 진행을 보인 안은 망막하액이 관찰된 18안 중 3안(16.7%), 관찰되지 않은 14안 중 6안(42.9%)으로 양 군 사이에 그 빈도의 유의한 차이는 없었다(p=0.132).
단계의 진행과 연관된 인자 분석에서 단계 진행을 보인 안의 추적 관찰 기간(평균 73.0 ± 26.1개월)은 진행이 없었던 안(43.9 ± 29.8개월)에 비해 유의하게 더 길었다(Table 3, p=0.043). 다른 인자들의 경우 양 군 사이에 유의한 차이가 없었다.
고 찰
베스트병의 원인이 되는 BEST1 유전자는 Best1 단백질을 생성하는데, Best1은 망막색소상피에서 주로 발현된다[13]. 망막색소상피 내에서 Best1은 anion channel과 intracellular calcium signaling에 관여하는 것으로 추측되고 있다[14,15]. BEST1 유전자의 이상은 Best1 단백질의 이상을 유발하여 망막색소상피의 기능이상을 초래한다. 결과적으로 lipofuscin이 침착되면서 특징적인 노른자 모양 병변을 형성하게 되는데, 이러한 특징적 병변이 관찰되며 아덴비가 저하된 경우 베스트병을 진단할 수 있다. 형광안저혈관조영과 인도 사이아닌그린혈관조영술에서는 단계에 따라 다양한 소견이 나타날 수 있는데, 노른자 모양 단계의 경우 두 검사에서 모두 초기에 저형광, 후기에 과형광을 나타내는 것으로 알려져 있다[7]. 현재까지 베스트병의 치료를 위해 다양한 유전자 치료 혹은 세포 치료가 연구되고 있으나[16] 아직까지 효과가 있는 것으로 알려진 방법은 없다.
87명의 베스트병 환자를 대상으로 한 Xuan et al [1]의 연구에서 평균 연령은 약 37.5세였으며, 남성과 여성은 각각 59:28로 남성이 더 많았다. 평균 아덴비는 1.26이었으며, 평균 logMAR 최대교정시력은 0.42로 측정되었다[1]. 47명의 환자를 대상으로 한 Battaglia Parodi et al [11]의 연구에서는 남성과 여성이 각각 28:19로 남성이 더 많았으며, 평균 연령은 약 41세, 평균 logMAR 최대교정시력은 0.33이었다. Booij et al [17]의 연구에서는 남성이 29명, 여성이 25명이었으며, 환자의 평균 연령은 34세였다. 안전위도검사는 41명에서 시행되었는데, 1.3-1.85 사이의 아덴비를 보인 경우가 9명, 1.3 미만의 심한 아덴비 저하를 보인 경우가 32명이었다. 국내 환자를 대상으로 한 본 연구의 경우 이전 연구 결과들과 비슷하게 남성이 여성에 비해 더 많은 경향을 보였으며, 평균 연령과 아덴비 역시 기존의 연구들과 비슷한 값이었다.
베스트병은 시간의 경과와 질병 단계의 진행에 따라 시력 역시 점차 저하되는 것으로 알려져 있다. Battaglia Parodi et al [11]의 연구에서 1단계 환자의 평균 logMAR 시력은 0으로 매우 좋은 시력을 보였으나 2단계에서 0.24, 3단계에서 0.35, 4단계에서 0.37로 점차 저하되었으며, 5단계의 경우 0.86으로 시력이 심하게 저하된 소견이 나타났다. Booij et al [17]의 연구에서 추적 관찰이 시행된 40명의 결과를 분석하였을 때, 진단 당시 65%에서 더 좋은 눈의 시력이 0.5 이상이었으나 평균 15.3개월의 추적 관찰 후에는 10%만이 0.5 이상의 시력을 유지하였으며, 77%에서는 더 좋은 눈의 시력이 0.3 미만으로 측정되었다. Battaglia Parodi et al [11]은 베스트병 환자의 5년 임상경과에 대해 보고하였는데, 66%에서 시간의 경과에 따라 노른자 모양 병변이 점차 커지는 양상을 보였으며, 10%에서는 변화가 없었고, 24%에서는 크기가 감소하였다. 풀어 익힌 노른자 모양 단계로의 진행은 38%에서 나타났다. 62%의 환자에서는 진단 후 평균 약 3.15년에 망막하액의 발생하였다. LogMAR 시력은 진단 당시 평균 0.18에서 5년 추적 관찰 시 평균 0.29로 악화되었는데, 망막하액이 발생한 경우 시력이 뚜렷하게 저하되는 경향을 보였다[18]. 본 연구의 경우 단계의 진행 비율이 이전의 연구에 비해 낮은 경향을 보였으며, 최종 시력도 조금 더 나은 경향을 보였다. 본 연구는 평균 추적 관찰이 52.1개월로 길었으나 12개월 이상 추적 관찰한 환자를 대상으로 연구를 시행하였기에 일부 환자에서는 추적 관찰 기간이 상대적으로 짧았는데, 비교적 좋은 시력예후에는 이와 같은 인자가 영향을 미쳤을 것으로 추측된다.
빛간섭단층촬영 기기의 발달과 함께 베스트병에서 나타나는 망막외층의 미세구조 변화를 확인하는 많은 연구들이 시행되었으며, 질병의 단계 진행에 따른 미세구조의 손상이 확인되었다. Kim et al [6]은 베스트병의 진행 단계에 따른 빛간섭단층촬영 소견을 연구하였는데, 망막맥락막복합체(outer retina-choroid complex)가 두 층으로 나뉘거나 융기된 후 두꺼워지는 형태를 확인하였다. Battaglia Parodi et al [11]의 연구에서는 초기에는 외경계막의 손상은 나타나지 않았으나 타원체구역(ellipsoid zone)과 망막색소상피층의 손상을 확인할 수 있었다. 단계의 진행에 따라 손상이 더욱 뚜렷하게 나타나는 경향이 있었으며, 특히 5단계의 경우 대부분의 환자에서 타원체구역(86%) 혹은 망막색소상피층(71%)이 확인하기 어려울 정도로 심하게 손상되는 결과를 보였다. Qian et al [5]의 연구에서 역시 단계의 진행에 따라 점진적으로 망막색소상피층이 얇아지고, 망막외층이 분리되는 소견을 확인하였다. 본 연구에서는 추적 관찰 기간 동안 단계의 진행이 나타난 9안에서 그렇지 않은 23안에 비해 뚜렷하게 더 큰 폭의 시력저하가 나타났는데, 이는 단계 진행에 따라 망막미세구조 손상 역시 진행되는 기존의 연구 결과와 일맥상통하는 결과라 할 수 있을 것이다.
베스트병은 양안이 비슷한 단계로 진단되는 경우가 많으나 일부에서는 양안에 서로 다른 단계가 나타날 수 있는 것으로 알려져 있다[6,18]. 양안의 단계가 서로 다른 경우의 비율은 연구에 따라 차이가 있는데, Kim et al [6]의 국내 보고의 경우 그 비율은 33.3% (3명 중 1명)였으며, Qian et al [5]의 연구에서는 30.0% (20명 중 6명), Battaglia Parodi et al [11]의 연구에서는 9.1% (11명 중 1명)였다. 이와 같은 차이는 포함/제외 기준의 차이 등에 의해 영향을 받았을 것이다. 본 연구의 경우 43.7%%에서 진단 당시 양안이 다른 단계를 보였으며, 이는 기존의 보고들에 비해 비교적 높은 비율이었다.
단계의 진행과 연관된 인자 분석에서 추적 관찰 기간을 제외한 다른 인자들은 단계의 진행과 유의한 연관관계가 나타나지 않았다. Booij et al [17]의 연구에서는 BEST1 유전자 이상에 의한 질병에서 유전자 변이의 차이가 질병의 진행 속도와 연관되어 있다고 보고하였으나, 본 연구에서는 유전자검사를 따로 시행하지 않아 이와 같은 부분을 확인할 수 없었다.
본 연구의 제한점은 다음과 같다. 본 연구는 후향적 연구이다. 일부 분석에서 통계적으로 유의한 결과가 나타났으나 소수의 안을 대상으로 한 분석이라는 점을 고려하였을 때, 향후 보다 많은 안을 대상으로 한 연구를 통해 그 결과를 추가로 확인할 필요가 있을 것으로 생각된다. 또한 유전체 분석 없이 임상양상만으로 베스트병을 진단하였다. 따라서 성인 노른자 모양 황반이영양증(adult-onset vitelliform macular dystrophy)의 가능성을 완전히 배제할 수 없으며, 실제 베스트병 환자였음에도 불구하고 중심장액맥락망막병증 등으로 잘못 진단되어[19] 연구에 포함되지 못하였을 가능성 역시 배제할 수 없다. 평균 추적 관찰 기간의 경우 4년 이상으로 짧지 않은 기간이었으나 베스트병의 자연 경과를 평가하는 데 있어서는 충분하지 않은 기간일 수 있으며, 더 나아가 환자 사이에 추적 관찰 기간에 차이가 있었으며, 특히 단계가 진행한 경우 그렇지 않은 경우에 비해 추적 관찰 기간이 유의하게 더 길었다. 마지막으로 베스트병의 단계 평가에 있어서 정성적 평가가 시행되었는데, 이러한 부분에 있어서는 연구자에 따라 다른 결과가 나타날 수도 있을 것이다.
요약하면 본 연구에서는 국내 베스트병 환자의 특성과 임상경과를 분석하였다. 베스트병은 평균 약 34.5세에 진단되었으며, 남성이 여성에 비해 더 많았고, 진단 당시에는 비교적 좋은 시력을 보인 경우가 많았다. 평균 52.1개월간의 추적 관찰 과정 동안 28.1%에서 단계의 진행이 나타났으며, 18.8%에서 뚜렷한 시력저하가 나타났는데, 시력저하의 정도는 단계 진행을 보인 경우 더 큰 폭으로 나타났다. 향후 보다 장기간의 추적 관찰 연구가 필요할 것이다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
이지현 / Ji Hyun Lee
김안과병원
Kim’s Eye Hospital