갑상샘눈병증에서 갑상샘자극호르몬수용체 자가항체가 망막 및 맥락막혈관에 미치는 영향
Effects of Thyroid-stimulating Hormone Receptor Autoantibody on Retinal and Choroidal Vessels in Thyroid Eye Disease
Article information
Abstract
목적
갑상샘눈병증(thyroid eye disease, TED) 환자에서 빛간섭단층촬영혈관조영술(optical coherence tomography angiography, OCTA)을 이용하여 갑상샘자극호르몬수용체 자가항체(thyroid stimulating hormone receptor antibody, TSHR Ab)의 변화와 망막혈관 및 맥락막의 변화의 연관성을 알아보고자 하였다.
대상과 방법
TED로 진단받은 환자 중 TSHR Ab 이상(>1.5 IU/L)을 보인 환자군 23명(우안)을 대상으로 망막의 표층부 무혈관 부위 (superficial foveal avascular zone, sFAZ) 및 심층부 무혈관 부위(deep foveal avascular zone, dFAZ) 크기, 황반부중심의 지름 1 mm 중심와, 3 mm 중심와부근 영역의 표층모세혈관총밀도(superficial capillary plexus density, sCPD) 및 맥락막두께(choroidal thickness, CT)를 측정하였고 내원 1개월 이후 반복 시행하여 TSHR Ab 변화에 대한 상관관계를 분석하였다.
결과
sFAZ, dFAZ, 1 mm 중심와 sCPD에서 양의 경향성을 보였으나(p=0.465, p=0.759, p=0.224), 3 mm 중심와부근 sCPD와 CT에서는 음의 경향성을 보이며, 모든 변수에 통계적인 유의성은 없었다(p=0.421, p=0.487).
결론
TED 환자에서 1개월 간의 TSHR Ab의 변화량에 따라 망막혈류와 맥락막두께 변화량에는 영향이 없으나, 1 mm 중심와 sCPD에서는 강한 양의 경향성을 가진다.
Trans Abstract
Purpose
We describe the use of optical coherence tomography angiography (OCTA) to investigate the relationship between thyroid-stimulating hormone receptor autoantibody (TSHR Ab) levels and retinal vessel and choroid changes in patients with thyroid eye disease (TED).
Methods
We enrolled 23 TED patients with abnormal TSHR Ab levels (>1.5 IU/L; all right eyes). Sex, visual acuity, intraocular pressure and TSHR Ab level were recorded at baseline and after 1 month. We used OCTA to determine the size of the superficial and deep foveal avascular zones (sFAZ and dFAZ, respectively), as well as the 1-mm foveal and 3-mm parafoveal superficial capillary plexus density (sCPD) and choroidal thickness (CT), at baseline and after 1 month later.
Results
The mean age of the 23 patients was 43.30 ± 16.16 years and 18 were female (78%). The mean baseline TSHR Ab level was 11.47 ± 11.22 IU/L. The TSHR Ab level showed non-significant correlations with sFAZ and dFAZ size, and with the 1-mm foveal sCPD; the correlation coefficients were 0.173, 0.073, and 0.266, respectively (p = 0.465, p = 0.759, and p = 0.224, respectively). The 3-mm parafoveal sCPD and CT showed non-significant correlations with the TSHR Ab level; the correlation coefficients were -0.185 and -0.16 (p = 0.421, p = 0.487).
Conclusions
In TED patients, changes in TSHR Ab level over 1 month do not affect retinal blood flow or CT, but show a non-significant positive association with the 1-mm foveal sCPD.
갑상샘눈병증(thyroid eye disease)은 안와에 영향을 미치는 가장 흔한 자가면역 질환 중에 하나로, 갑상선기능항진증과 주로 연관되어 발생하지만 하시모토 갑상선염과 정상 갑상선 기능 상태일 때도 발생하는 것으로 알려져 있다[1]. 갑상샘눈병증은 안구 표면의 변화를 일으켜 광시증, 유루증, 이물감이 발생할 수 있고, 외안근의 섬유화에 의한 사시 및 복시가 발생할 수 있으며 또한 염증으로 인한 안와후부의 통증도 발생할 수 있다.
안와 후부 조직의 변화는 갑상샘자극호르몬수용체 자가항체(thyroid stimulating hormone receptor autoantibody, TSHR Ab)로 인하여 발생한다. TSHR Ab가 갑상샘자극호르몬수용체(thyroid stimulating hormone receptor, TSHR)의 leucine-rich domain A subunit에 붙게 되면 adenylate cyclase를 활성화시켜 cyclic adenosine monophosphate (cAMP)를 생성하게 되며 이는 갑상선을 성장시키거나 T3, T4를 생산하게 된다[2,3]. 정상 갑상선에서는 갑상선호르몬(T3, T4)이 negative feedback으로 뇌하수체에서 TSH의 생산을 억제하지만, 병적인 상태에서는 TSHR Ab의 지속적인 자극으로 인해 안와 섬유아세포가 자극되며 cAMP 생성과 PI3K/Akt 신호 과정을 통해 히알루론산 합성과 지방 생성이 증가하게 된다. 이로 인해 결국 외안근의 염증과 림프구가 침투하여 간질 사이 부종이 발생하며 갑상샘눈병증의 여러 증상이 나타나게 된다[4]. 이후 안와 섬유아세포가 과도하게 생산하는 glycosamicoglycans로 인해 부종이 더 심해지게 된다.
이러한 일련의 갑상샘눈병증의 임상양상의 과정에 따라 안구내 혈관에 영향을 줄 수 있는데, 이전 논문들에서도 중증도에 따른 갑상샘눈병증과 안구내 혈관의 관계를 규명하기 위한 노력들이 있었다. Kurioka et al [5]와 Li et al [6]은 컬러 도플러초음파를 이용하여 갑상샘눈병증이 있는 경우 중심망막동맥의 혈관 저항이 증가한다는 것을 밝혔고 망막동맥의 혈류 공급은 의미 있게 줄어든다고 하였다. 또한 Alimgil et al [7]은 안와 내의 압력 증가로 맥락막혈관 저항이 커지고 이어서 안구에 혈류 공급이 줄어든다고 밝혔다. 갑상샘눈병증도 TSHR Ab의 증가에 따라 염증에 의한 안구내 혈관 자체의 변화와 그에 따른 혈류에 변화가 있을 수 있고, 또는 염증에 의한 외안근 및 안와조직의 부종으로 기인한 안구내 혈류 변화와 그에 따른 혈관들의 변화가 있을 것으로 생각된다.
최근 빛간섭단층촬영혈관조영술(optical coherence tomography angiography, OCTA)이 개발되어 컬러 도플러초음파보다 더 정확하게 모세혈관 수준까지 관찰할 수 있게 되었다. OCTA를 이용한 연구로 망막 무혈관 부위(foveal avascular zone, FAZ) 변화는 시력에 영향을 준다고 알려져 있고, 특히 맥락막은 단위 무게당 가장 많은 혈관 흐름을 보이는 혈관 조직으로 망막외층과 망막색소상피에 혈류를 공급하는데 여러 망막, 맥락막 질환과의 연관성에 대해 많이 보고되었다[8-13]. 그중 맥락막두께(choroidal thickness, CT)는 노화나 병적인 상태에서 맥락막 혈액 순환과 관계가 있고, 얇아진 맥락막은 맥락막에 충분한 혈류가 공급되지 못하고 있음을 의미한다는 것이 밝혀졌다[14,15]. 이에 저자들은 갑상샘눈병증을 진단받은 환자에서 첫 내원시와 한 달 후의 TSHR Ab의 변화와 OCTA를 이용하여 망막혈관과 맥락막의 변화를 확인하고 그 연관성을 분석하여 혈청의 변화와 이에 따른 안구내 혈관에 미치는 영향을 알아보고자 하였다.
대상과 방법
2018년 9월부터 2019년 2월까지 본원에 내원한 환자들 중 갑상샘눈병증으로 진단받은 23명(우안) 환자들을 대상으로 하여 의무기록을 후향적으로 분석하였다. 본 연구는 모든 과정에서 헬싱키선언(Declaration of Helsinki)을 준수하였으며, 본원 임상시험심사위원회(Institutional Review Board, IRB)의 승인을 받았다(승인 번호: 2020-02-029).
갑상샘눈병증의 진단 기준은 내분비 내과에서 갑상선 기능 이상으로 치료 중인 환자가 눈꺼풀뒤당김, 눈꺼풀부종, 안구돌출 등 객관적인 증상이 있는 경우로 하였다[16]. 혈액검사를 통해 TSHR Ab titer가 1.5 IU/L 이상이면 본 연구에 포함되었다. 환자의 나이, 성별, 시력을 조사하였고, 망막 질환 및 망막 수술력이 있거나 갑상선 질환을 제외한 고혈압 등 전신 질환이 있는 경우는 제외하였다. Swept-source OCT (SS-OCT, DRI-OCT; Topcon, Tokyo, Japan)를 이용하여 OCTA를 검사하였고, 표층모세혈관총(superficial capillary plexus layer, SCP)와 심부모세혈관총(deep capillary plexus layer, DCP)는 정면 OCTA의 사진에서 소프트웨어에 내장된 도구를 이용하여 FAZ 크기를 측정하였다(Fig. 1A, B). CT는 한 명의 검사자가 OCT 소프트웨어에 내장된 수동 길이 측정 도구를 사용하여 황반중심부 망막색소상피에서 맥락막 큰 혈관의 바깥면까지 측정한 중심와와 그 이측, 비측 100 μm에 내린 세 수직선 길이의 평균치를 사용하였다(Fig. 1C). 이 방법은 중심와와 인접한 맥락막두께의 평균치를 사용한 논문[17,18]을 참조하였고, 본 연구에서는 망막중심부의 정확한 CT를 측정하기 위해 중심와와 그 이측, 비측 100 μm 범위로 정하였다. 1 mm 중심와와 3 mm 중심와 부근 sCPD는 황반을 기준으로 지름 1 mm 원 내부에서의 sCPD와 지름 3 mm 원 내부에서의 sCPD를 측정하여 비교하였다. 지름 3 mm 원 내부의 sCPD는 지름 1 mm부터 3 mm까지의 범위를 위쪽, 아래쪽, 귀쪽, 코쪽 4부분으로 나누어 각각의 sCPD를 측정한 뒤 모두 합한 값을 4로 나눈 것으로 정의하였다(Fig. 1D) [19]. 내원 1개월 후 같은 방법으로 SCP, DCP의 FAZ 크기와 CT, 중심와와 중심와부근 sCPD를 측정하였다(Fig. 1E-H). 통계는 IBM SPSS Statistics 25.0.0 (IBM Co., Armonk, NY, USA)을 이용하여 피어슨 상관관계 분석(Pearson’s correlation analysis)을 시행하였으며 p-value가 0.05 미만이면 통계학적으로 유의한 것으로 간주하였다.

An example of swept-source optical coherence tomography angiography image from the right eye of 19-year-old female with thyroid eye disease. Superficial and deep foveal avascular zone size, choroidal thickness (CT) and superficial capillary plexus density were measured, respectively using built-in software at the initial visit (A-D). The same measurements were done again one month after the initial visit (E-H). To measure CT, from the retinal pigment epithelium to the outer boundary of the choroidal large vessels at the macular center, the mean of the left and the right 100 μm and the three vertical lines in the middle were measured (C, G).
결 과
환자들의 평균 나이는 43.30 ± 16.16세였고, 여자가 전체 23명 환자 중 18명(78%)으로 더 많았다. 평균 최대교정시력(logMAR)은 0.08 ± 0.14였으며, 평균 안압은 14.91 ± 2.91 mmHg였다. 처음 내원 당시의 환자들의 평균 TSHR Ab는 11.47 ± 11.22 IU/L (정상은 1.5 IU/L 미만)였고, 평균 sFAZ는 289,319.95 ± 166,409.06 mm2, 평균 dFAZ는 312,646.04 ± 167,368.65 mm2로 측정되었다. 내원 당시의 평균 1 mm 중심와, 3 mm 중심와부근 sCPD는 각각 19.50 ± 4.99%, 54.62 ± 2.84%였고, 평균 CT는 189.22 ± 73.34 μm였다(Table 1). 이외에 각막과 망막의 특이 소견은 보이지 않았다.
1개월 뒤의 TSHR Ab의 검사를 시행한 환자의 평균은 9.75 ± 12.37 IU/L였으며, sFAZ는 255,471.75 ± 152,796.77 mm2였고 dFAZ는 297,799.70 ± 130,201.18 mm2였다. 1개월 뒤의 평균 1 mm 중심와, 3 mm 중심와부근 sCPD는 20.47 ± 5.82%, 54.11 ± 2.41%였으며, CT는 193.67 ± 64.77 μm였다. 1개월간 TSHR Ab의 변화량을 볼 수 있었던 21명 환자의 평균 변화량은 0.57 ± 3.72 IU/L였고, sFAZ, dFAZ의 변화량을 볼 수 있었던 20명 환자의 평균 변화량은 각각 26,288.00 ± 84,975.21 mm2, 11,685.15 ± 63,747.71 mm2로 측정되었다. 1 mm 중심와, 3 mm 중심와 부근 sCPD의 변화량을 볼 수 있었던 21명 환자의 평균 변화량은 -1.07 ± 3.82%, 0.31 ± 2.39%였으며, CT의 변화량을 볼 수 있었던 21명의 환자의 평균 변화량은 -2.76 ± 45.36 μm로 측정되었다. 1개월간의 TSHR Ab의 변화에 따른 망막, 맥락막 상태 변화는 sFAZ, dFAZ, 1 mm 중심와 sCPD에서 상관계수가 각각 0.173, 0.073, 0.266이었으며, 이 중 1 mm 중심와 sCPD에서는 약한 양의 경향성을 보이나, 통계적으로 유의미하지 않았다(p=0.465, p=0.759, p=0.224; Fig. 2A-C). 대조적으로 3 mm 중심와부근 sCPD와 CT에서는 상관계수가 -0.185, -0.16이었으나 다른 변수들과 마찬 가지로 경향성이나 통계적인 유의성은 보이지 않았다(p=0.421, p=0.487; Fig. 2D, E). 추가적으로 TSHR Ab의 수치가 1.5 IU/L 미만인 환자 8명을 대상으로 분석한 결과 sFAZ, dFAZ, 1 mm 중심와 sCPD, CT에서 상관계수가 각각 -0.326, -0.467, -0.048, -0.028로 음의 경향성을 보였으며(p=0.430, p=0.243, p=0.911, p=0.948), 3 mm 중심와부근 sCPD에서 상관계수가 0.120으로 양의 경향성을 보였고(p=0.778) 모든 값에서 통계적으로 유의미하지 않았다(Fig. 3).
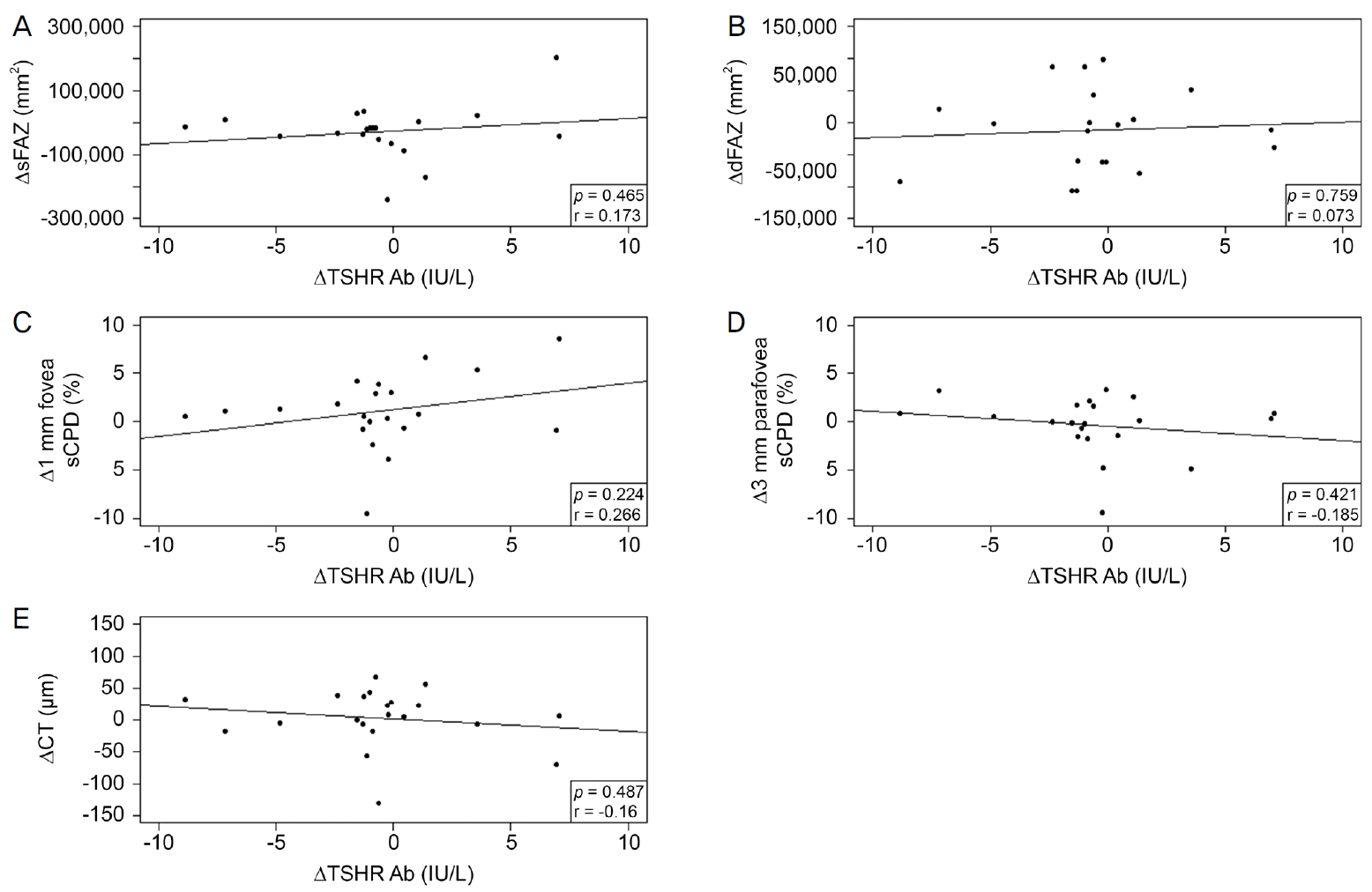
Scatter plots of thyroid stimulating hormone receptor antibody (TSHR Ab >1.5 IU/L) and its associations with superficial foveal avascular zone (sFAZ), deep foveal avascular zone (dFAZ), superficial capillary plexus density (sCPD), and choroidal thickness (CT). TSHR Ab was negatively associated with 3-mm parafovea sCPD (D). TSHR Ab had no tendency with other variables (A-C, E). p-value were calculated Pearson’s correlation analysis.
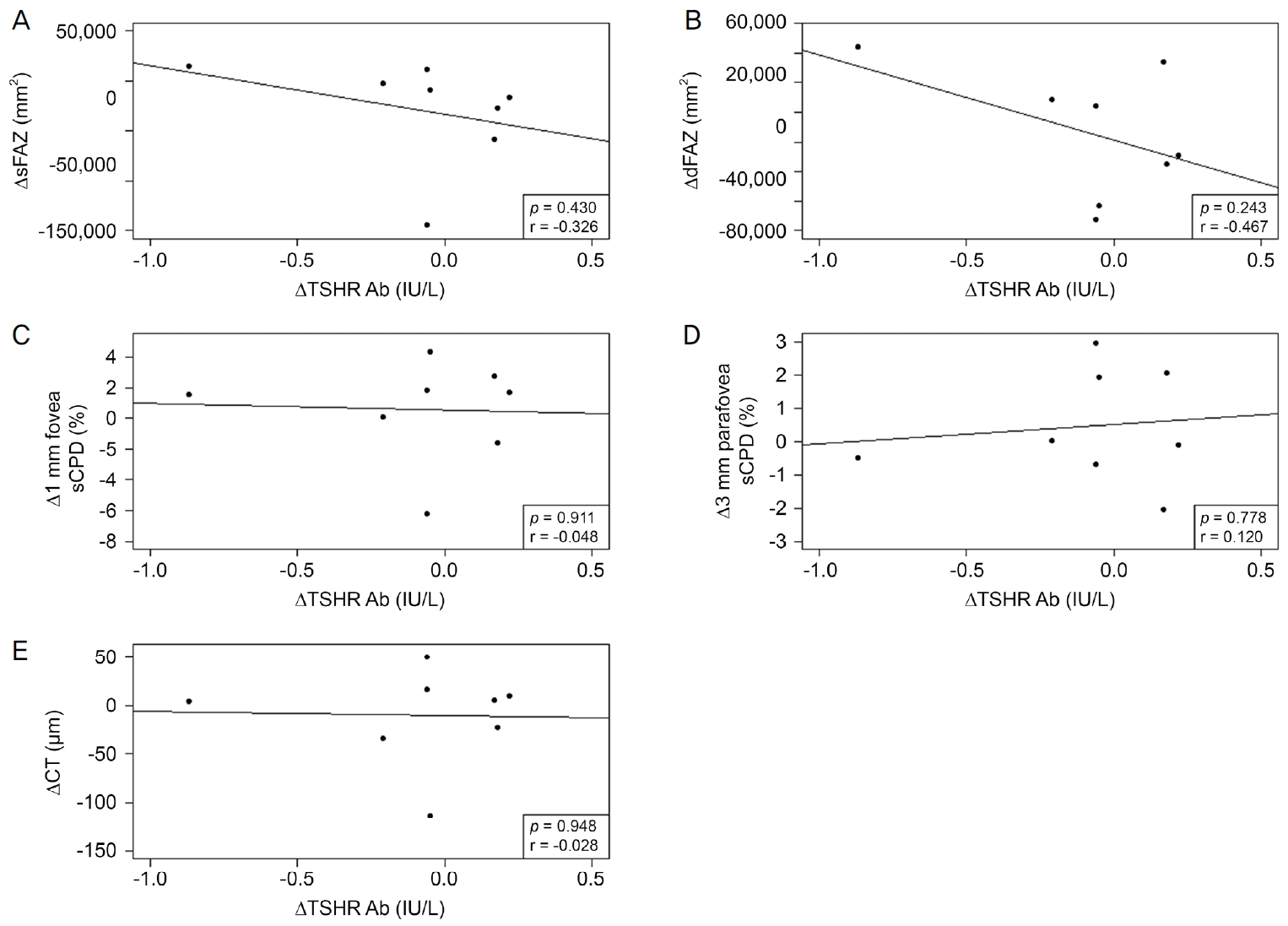
Scatter plots of thyroid stimulating hormone receptor antibody (TSHR Ab <1.5 IU/L) and its associations with superficial foveal avascular zone (sFAZ), deep foveal avascular zone (dFAZ), superficial capillary plexus density (sCPD), and choroidal thickness (CT). TSHR Ab was negatively associated with sFAZ and dFAZ but had no significance (A, B). TSHR Ab had no tendency with other variables (C-E). p-value were calculated Pearson’s correlation analysis.
고 찰
갑상샘눈병증으로 진단 받고 본 연구에 참가한 환자의 첫 내원시 TSHR Ab는 11.47 ± 11.22 IU/L였고, 1개월 뒤의 변화량의 평균은 0.57 ± 3.72 IU/L였다. 특정 환자의 우안을 기준으로 상관관계를 표시하여 각 변수의 양과 음의 상관관계를 확인할 수 있었다. TSHR Ab가 증가할수록 망막 중심와 1 mm 지름 안의 sCPD는 더 커지는 경향이 있었으나, 모든 변수의 통계적 유의성은 없었다.
TSHR Ab는 미세혈관계에 침착되어 있는 항체의 양을 반영하며, 이는 눈의 자가면역 과정을 촉발시킬 뿐 아니라 지속적으로 유지하는 역할을 하는 것으로 알려져 있다[20]. Kumar et al [4]은 TSHR Ab의 지속적인 자극으로 인해 안와 섬유아세포가 자극되며 이후 히알루론산 합성과 지방 생성이 증가하게 된 후 결국 외안근의 염증과 림프구가 침투하여 간질 사이 부종이 발생하며 갑상샘눈병증의 여러 증상이 나타나게 된다고 언급하였다. 이후 안와 섬유아세포가 과도하게 생산하는 글리코사미노글리칸으로 인해 부종이 더 심해지게 되는데, 특히 흡연과 셀레니움 부족, 고지혈증은 각각 지방생성 촉진, 산화 작용, 염증 작용을 촉진시켜 갑상샘눈병증의 임상양상의 진행과 연관이 있는 것으로 밝혀졌다[21-23].
여러 질환들에 의한 전신 염증 상태는 그 질환의 활성도에 따라 혈관이 풍부한 맥락막혈관 조직에 직간접적인 영향을 미친다고 알려져 있는데, 주로 혈관내피세포의 변화가 일어나거나 침윤성 세포와 면역복합체의 침착으로 혈관의 구조가 변형되고 혈액망막장벽의 파괴로 누출이 일어나며 신생혈관이 생기는 등 혈관 조직의 변화가 일어난다고 알려져 있다[24]. 갑상샘눈병증도 TSHR Ab의 증가에 따라 안구내 혈류 변화와 그에 따른 혈관들의 변화가 있을 것으로 생각된다.
갑상샘눈병증에 의한 혈관 자체의 변화에 대한 이전 논문들을 보면, 활동기의 갑상샘눈병증에선 강력한 혈관수축제인 endothelin-1의 영향으로 혈류가 감소되고, 망막혈관에 자가항체가 침착되어 유발되는 염증 작용으로 망막모세혈관이 파괴되어 밀도는 감소한다고 알려져 있다[25-27]. 본 연구에서는 1 mm 중심와 sCPD의 증가의 경향성을 볼 수 있었는데, 기존의 연구[27]는 한 시점에 정상인과 갑상샘눈병증 환자를 비교하여 연구된 반면, 본 연구는 갑상샘눈병증으로 진단 받은 사람만을 대상으로 처음 내원 시점과 1개월 후 내원 시점의 변화량을 보았다는 점에서 다르다. 대조적으로 활동기 갑상샘눈병증에서 망막모세혈관밀도가 증가한다는 Ye et al [28]의 보고도 있었다. 이 연구 역시 정상인과 갑상샘눈병증 환자를 비교한 논문으로 망막모세혈관밀도의 증가는 정맥울혈에 의한 혈류 지연에 대한 결과로 가정했다. 이는 본 연구의 1 mm sCPD의 증가 경향성과 일맥상통하는데, 위 두 논문 [27,28]의 차이점은 검사를 시행한 시기에 따른 갑상샘눈병증 환자의 중증도의 차이로 생각된다고 보고하였다. 본 연구에서 첫 내원시 임상양상에 따른 clinical activity score (CAS), NOSPECS classification, VISA inflammatory score를 이용하지 못한 것은 유의미하지 못한 결과에 대한 bias가 될 수 있다. 저자들은 추가로 본 연구에서 갑상샘눈병증로 진단된 환자 중 TSHR Ab의 수치가 1.5 IU/L 미만인 8명의 환자에 대하여 같은 검사를 하여 통계학적 분석을 한 결과, 첫 내원시와 1개월 뒤의 혈청 수치의 변화에 따른 OCTA 측정치 변화에 따르면 모든 변수에 통계적 유의성은 없었으나, sFAZ와 dFAZ가 음의 경향성을 보였다(Fig. 3A, B). 1 mm 중심와 sCPD, 3 mm 중심와부근 sCPD와 CT에서는 경향성을 보이지 않았다(Fig. 3C-E). 이는 TSHR Ab가 증가할수록 sFAZ, dFAZ 크기가 작아지는 경향성을 보인다는 것인데, 1.5 IU/L 이상만 포함했던 본 연구와 통계적으로 유의성이 없는 것은 같으나 경향성이 다른 결과가 도출되었다. 이 결과는 TSHR Ab의 중증도에 따라 혈관에 영향을 미치는 정도가 다르다고 생각할 수 있겠다. 따라서 향후 연구에서는 참여 인원을 늘려 갑상샘 눈병증 환자의 혈청 항체를 TSHR Ab 이외에 thyroid-stimulating autoantibodies도 함께 검사하고, 이에 더하여 항체의 중증도에 따라 군을 나누고, 추가적으로 주관적 증상(CAS score)에 따른 중증도도 함께 고려하여 적절한 대조군과 비교한다면 bias를 최소한으로 줄이고 혈청 항체와 망막, 맥락막혈관 관계를 정확히 파악할 수 있을 것으로 생각된다.
또한 맥락막두께 변화에 따른 혈류 변화에 대한 이전의 연구에서는 주로 염증에 의한 외안근 및 안와조직의 부종으로 기인한 안구내 혈류 변화를 서술하고 있다. Konuk et al [29]은 갑상샘눈병증에서 외안근 비대, 안와지방 비대로 발생하는 안후부 압력의 변화는 위눈정맥 흐름의 감소와 안와 전체의 정맥 유출을 감소시킨다고 밝혔다. Jorge et al [30]은 안와 환경의 물리적인 변화가 맥락막 모세혈관에 직접적인 영향을 미칠 수 있다고 제시했다. Gul et al [31]은 안와 조직, 안와정맥의 울혈이 결국 맥락막두께의 증가로 이어진다고 하였다. Gul et al [31]의 결과는 Özkan et al [32]이 활동기의 갑상샘눈병증에서 맥락막이 의미 있게 두꺼워진다고 보고한 결과와 같았다. 또 다른 참고 논문에서는 아시아인의 안와는 타 인종보다 안와벽이 두껍고 좁아 안와후부의 부종의 직접적인 영향으로 CT가 감소할 수 있다는 보고도 있었다[33,34]. 그러나 본 연구에서는 TSHR Ab의 변화에 따른 CT 변화에는 경향성이나 통계적 유의성은 보이지 않았다. 이는 먼저 환자 수가 적었고 또한 경과 기간이 1개월로 짧아 TSHR Ab의 변화량 자체도 적어 각 변수의 변화를 보는데 bias가 생겼을 수 있다. 추후 인원수를 늘려 중증도에 따른 군을 분류하고 경과 관찰 기간 Rundle’s curve에 따라 6-24개월로 늘려 그 변화를 함께 본다면 bias를 최소로 하여 연구할 수 있을 것이다.
저자들이 알기로 본 연구는 최초로 갑상샘눈병증 환자에서 시간에 따른 TSHR Ab와 망막, 맥락막 변화의 상관관계에 대해 다루었다. 이전의 많은 연구들은 진단된 시점에서 갑상샘눈병증과 망막과 맥락막의 미세혈관 변화를 정상인과 비교하였고, 갑상샘눈병증의 병태생리학적 해석에 따라 안와혈류, 안구 관류압의 변화와 망막, 맥락막의 변화 결과는 다양했다[29-32]. 본 연구는 시력 변화와 밀접한 관련이 있는 당뇨망막병증, 나이관련황반변성 등의 많은 질환에서 시행하였던 지표들을 이용하여 갑상샘눈병증에서도 TSHR Ab의 변화량과 정확한 OCTA 영상으로 얻은 망막과 맥락막 변화를 직접적으로 비교했다는 점에서 의의가 있다.
본 논문의 한계점은 후향적 연구 방법으로 의무기록을 살펴보았으며, 환자 모집 기간이 짧아 조사 대상 크기가 충분하지 못했고, TSHR Ab의 변화량 측정 기간이 1개월로 짧았으며, 증도에 따른 분류를 하지 못한 점이다. 또한 안와압력을 높이고 안와울혈을 일으킬 수 있는 다른 인자들(안구돌출, 외안근 부피)을 볼 수 있는 안와 전산화단층촬영 등의 고려 없이 TSHR Ab 수치 단독으로 OCTA와 비교한 것은 bias가 될 수 있다. 후속 연구에서는 위의 한계점을 보완하여 통계적으로 유의하게 밝혀질 관계성으로, 갑상샘 눈병증의 중증도 및 예후 예측 등을 혈청이 아닌 비침습적이고 비교적 넓은 연령대에도 쉽게 촬영이 가능한 OCTA를 이용해 할 수 있다는 점은 향후 연구의 가장 큰 강점이 될 것으로 기대된다. 결론적으로, 갑상샘눈병증 환자에서 OCTA 이미지를 이용해 망막, 맥락막 변화와 TSHR Ab 변화의 상관관계를 파악하였을 때, 1개월간 TSHR Ab 변화량에 따라 망막혈류와 맥락막두께 변화량에는 영향이 없었으나 1 mm sCPD 변화와는 양의 경향성을 보였다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
박지웅 / Ji Woong Park
계명대학교 의과대학 안과학교실
Department of Ophthalmology, Keimyung University College of Medicine

