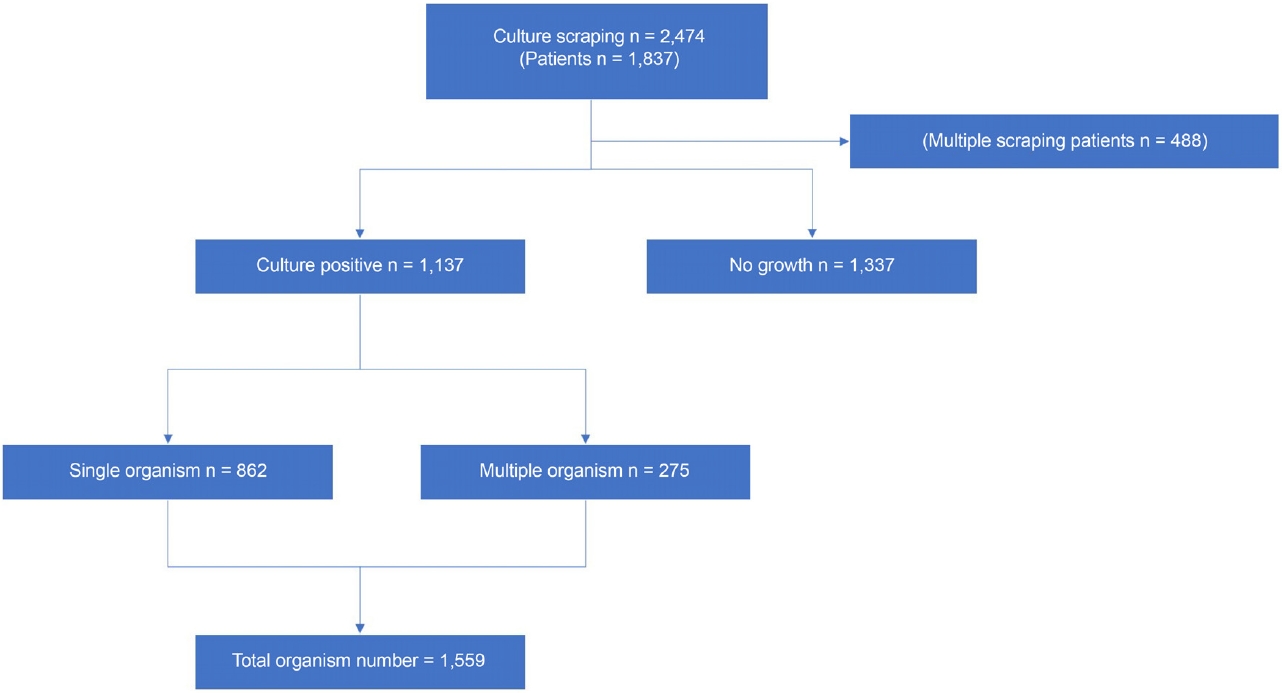
국내 미생물 각막염의 10년 추세
Ten-year Trends in Infectious Keratitis in South Korea
Article information
Abstract
목적
최근 10년간 미생물 각막염의 원인균과 항생제 감수성, 위험인자를 알아보고자 하였다.
대상과 방법
익명화 데이터시스템에서 추출한 2012년부터 2021년까지 7개 대학병원에서 미생물 배양검사를 시행한 미생물 각막염 환자의 데이터를 이용하여 원인균과 항생제 감수성을 분석하였다. 별개로 동일 기간, 한 기관의 의무기록을 후향적으로 분석하여 임상 양상 및 위험인자를 조사하였다.
결과
1,837명의 미생물 각막염 데이터가 추출되었고, 배양 양성률은 46.0% (1,137/2,474)이고 가장 흔한 원인균은 coagulase negative Staphylococcus (CoNS) (27.8%)였다. 퀴놀론계 항생제에 대한 내성률은 그람양성균과 그람음성균에서 시간에 따른 통계적 변화가 없었고, 그람음성균에서 세팔로스포린계 항생제에 대한 내성률의 증가가 관찰되었다. 288명의 후향적 의무기록 분석에서는 고연령군에서 초진 교정시력이 0.1 미만인 경우, 안과적 수술 과거력, 기존 안질환, 스테로이드 안약, 녹내장 안약 사용의 비율이 유의미하게 높았다. 다변량 분석에서 수술적 치료가 필요한 중증 각막염의 위험인자로는 증상 내원 기간(증상 발생 후 본원 내원까지의 기간)이 7일 이상인 경우와 기존 안질환이 있는 경우였다(p=0.048, 0.040).
결론
최근 10년간 미생물 각막염에서 CoNS가 가장 흔한 균이었고 그람음성균에서 세팔로스포린계 항생제에 대한 내성률이 증가하였다. 기존 안질환이 있는 경우 수술적 치료까지 필요할 수 있으므로 이들 환자에서 미생물 각막염은 더욱 주의를 기울여야겠다.
Trans Abstract
Purpose
This study investigated the causative microorganisms, antibiotic susceptibility, and risk factors of infectious keratitis over the past 10 years.
Methods
Data from patients with infectious keratitis who underwent microbial culture tests from 2012 to 2021, obtained from anonymized data systems, were analyzed. Microbial culture results and antibiotic susceptibility profiles were examined. A retrospective analysis of the medical records of patients with infectious keratitis during the same period was conducted to investigate the clinical characteristics and risk factors.
Results
Data from 1,837 cases of infectious keratitis were extracted from anonymized records. The culture positive rate among patients was 46.0% (1,137/2,474), with coagulase-negative Staphylococcus (CoNS) being the most common causative organism (27.8%). Increased resistance to cefazolin and cefotaxime was observed in gram-negative bacteria, while there were no significant temporal changes in quinolone resistance in gram-positive or negative bacteria. A retrospective medical record analysis of 288 cases revealed that older patients, as well as those with an initial corrected visual acuity < 0.1, a history of ocular surgery, pre-existing ocular conditions, prior steroid eye drops, or glaucoma eye drops, had significantly higher rates of culture positivity. Multivariate analysis identified risk factors for severe keratitis requiring surgical intervention as a symptom-to-presentation period of 7 days or longer (p = 0.048) and pre-existing ocular conditions (p = 0.040).
Conclusions
CoNS was the most common microorganism causing infectious keratitis over the past decade. There has been an increase in resistance to cephalosporin antibiotics among gram-negative bacteria. Patients with pre-existing ocular conditions may require surgical intervention, so infectious keratitis in these patients requires greater attention.
미생물 각막염은 안구감염의 일반적인 원인으로 알려져 있으며 각막천공, 안내염 및 각막혼탁 등으로 인해 영구적인 시력저하가 발생할 수 있는 질환이며 이에 적절한 치료가 필요하다.1-3 원인균과 항생제 감수성에 따른 적절한 항생제 선택은 치료에 중요하며, 각막찰과 배양검사가 시행되지만 임상적으로는 모든 경우에 배양검사를 할 수 없으며, 배양검사 결과가 나오기까지 시간이 걸리기 때문에 초기에 경험적인 항생제 치료가 중요하다.4
국내에서는 1995년부터 5년 동안 전국적인 규모의 연구가 이루어졌으며,5 지역별로도 여러 연구가 보고되어 있다.6-12 항균제 내성은 감염에서 항상 주요한 문제로 미생물 조성 및 항생제 내성 패턴에서 지속적인 변화가 보고되고 있으며,5-18 콘택트렌즈 사용자 및 면역 기능이 저하된 환자 수의 증가가 미생물 각막염의 양상에 영향을 미치고 있다.19-24 미생물 각막염의 원인은 지리와 기후에 따라 상당히 다르며, 같은 지역에서도 시기별로 변할 수 있기 때문에, 지역별 미생물 프로파일과 항생제 감수성 패턴을 분석하여 근거 있는 경험적 치료 요법을 선택하는 것이 중요하다.5-18
본 연구의 저자들은 2012년부터 2021년까지 7개 대학병원에서 미생물학적 검사로 진단받은 미생물 각막염 환자를 대상으로 최근 각막염을 일으키는 균들의 동향과 항생제 감수성을 분석하였으며, 추가적으로 가장 균 배양 시행 건수가 많았던 한 대학병원에서 미생물 각막염을 진단받은 환자의 의무기록을 후향적으로 검토하여 미생물 각막염의 발생 위험인자, 연령군에 따른 분석, 수술적 치료를 받게 되는 위험인자 분석을 시행하였다.
대상 및 방법
본 연구는 헬싱키선언(Declaration of Helsinki)을 준수하였으며, 연구윤리심의위원회(institutional Review Board, IRB)의 승인을 얻어 진행되었다(승인번호: KC22WISI0366 & KC22RISI0688).
가톨릭중앙의료원 산하 7개 병원(서울성모병원, 부천성모병원, 성빈센트병원, 여의도성모병원, 인천성모병원, 은평성모병원, 의정부성모병원)의 전자의무기록을 기반으로 구축된 기관 임상데이터웨어하우스(Clinical Data Warehouse, CDW)를 이용하였다.25 연구자는 활용하고자 하는 코호트 데이터를 기관의 데이터심의위원회의 심의와 생명윤리위원회의 승인을 거쳐 익명화 처리된 가공되지 않은 데이터를 제공받는다. 본 연구를 위해 다음과 같은 조건의 코호트 데이터가 추출되었다: 2012년 1월부터 2021년 12월의 기간, 7개 병원의 안과 방문, ICD 진단코드 H16의 모든 각막염, 미생물 배양검사. 배제 조건으로 누관수술, 유리체절제술, 각막이식수술와 동시에 시행된 배양검사된 경우로 설정하였다. 추출된 데이터는 자동으로 익명화 처리되어 의무기록을 통한 추가적인 확인이 불가능하다. 2012년부터 2016년까지를 전반기로, 2017년부터 2021년까지를 후반기로 나누어 여러 항생제의 감수성을 비교하여 미생물 각막염 원인균의 내성률 변화를 분석하였다.
CDW로부터 추출된 데이터의 특성상 개별 환자의 임상 양상, 위험인자 등 추가적인 분석에 이용할 수 없으므로 이와는 별도로 연구윤리심의위원회 승인하, 동일 기간 동안 균 배양검사 시행 건수가 가장 많았던 가톨릭대학교 서울성모병원에서 미생물 각막염으로 내원한 환자 중 원인균이 동정되었으며 2개월 이상 추적 관찰이 가능하였던 환자에 대해서 의무기록을 후향적으로 분석하였다. 연령에 따른 위험인자 분석을 위해 60세 미만의 저연령군과 60세 이상의 고연령군으로 나누어 전신 질환 유무, 증상 내원 기간(증상 발생 후 본원 내원까지의 기간), 외상력, 콘택트렌즈 사용 여부, 기존 안질환(수포각막병증, 실모양각막염, 단순포진각막염, 반복각막미란 등), 스테로이드 안약 사용 여부 등의 미생물 각막염 발생 위험인자를 분석하였고, 약제 불응으로 수술한 사례의 위험인자를 조사하였다. 수술을 받게 된 환자와 연관성을 보이는 위험인자를 검정하기 위해 단변량 로지스틱 회귀분석을 시행하였고 추가로 연관성을 보일 수 있는 위험 요인들에 대해 다변량 로지스틱 회귀분석을 시행하였다.
미생물 각막염의 원인균 동정을 위해 각막병변에서 표준화된 방법으로 검체를 채취하고 도말검사 및 배양검사를 실시하였다. 도말검사를 위해 0.5% 프로파라케인(Alcaine®, Alcon laboratory, Fort Worth, TX, USA)을 사용하여 각막에 점안마취를 시행한 후 멸균된 15번 블레이드로 검체를 채취하였다. 검체는 유리 슬라이드에 도말 표본을 만들고, 그람염색을 시행하여 그람양성과 음성을 판정하였다. 배양검사는 blood agar, chocolate agar, Sabouraud dextrose agar with chloramphenicol, brain heart infusion broth에 검체를 접종하여 시행하였다. 배양된 세균은 미생물 동정 이후 항생제 감수성검사가 진행되었다. 감수성 판정 결과는 “감수성(susceptible)”, “내성(resistant)”, “중간내성(intermediate)”으로 표시되었고, 이 중 중간내성은 내성으로 간주하여 내성 빈도를 계산하였다. 각막염의 배양과 동정은 연구 기간 동안 일관적으로 유지되었다.
통계 분석에서 범주형 자료는 chi-square test와 Fisher's exact test를 사용하여 분석하였으며, p-value<0.05를 통계적으로 유의미한 값으로 정의하였다. 통계 분석 프로그램으로는 IBM SPSS ver. 28.0 (IBM Corp., Armonk, NY, USA)을 사용하였다.
결 과
10년 동안 7개 대학병원에서 총 2,474건의 각막배양 시도가 있었고, 그중 1,137건(46.0%)의 배양에서 한 개 이상의 균이 자랐으며, 1,337건(54.0%)에서 균 배양이 되지 않았다. 균이 동정된 1,137건에서 275건에서 중복 감염되었으며 총 1,559예의 원인균이 동정되었다(Fig. 1). 배양검사에 참여한 환자는 총 1,837명이었으며 이 중 남자는 906명(49.3%), 여자는 931명(50.7%)이었다. 연령대별로 보면 60세에서 70세 사이의 환자가 전체의 20.7%로 가장 많았으며, 60세 이상의 고연령군은 전체의 44.1%를 차지하였다(Table 1).

Epidemiologic characteristics of microbiologically proven microbial keratitis using Clinical Data Warehouse data
원인균과 항생제 감수성
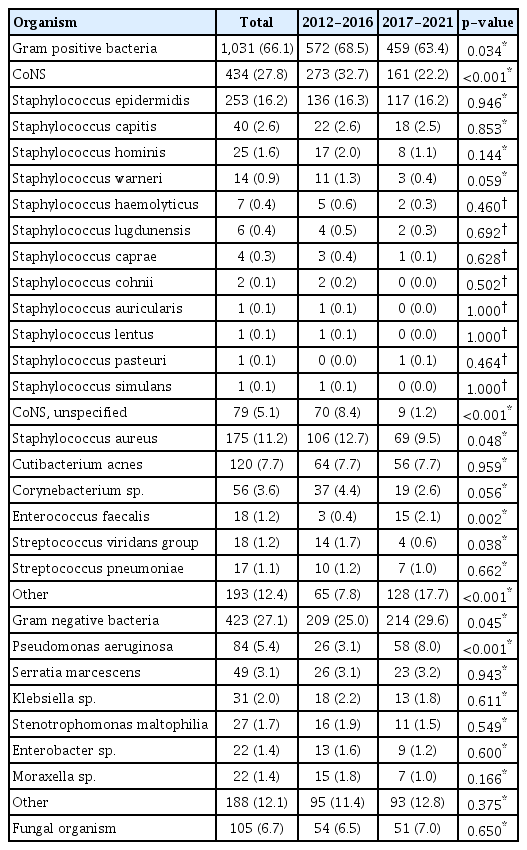
동정된 균 중 그람양성균은 1,031예(66.1%)로 나타났으며, 그중 가장 흔한 원인균은 coagulase negative Staphylococcus (CoNS)로 434예(27.8%)였고 이 중 Staphylococcus epidermidis가 253예(16.2%)로 가장 많은 비율을 차지하였다. 그람양성균에서 두 번째로 많이 검출된 균은 Staphylococcus aureus로 175예(11.2%)가 확인되었다. 그람음성균은 423예(27.1%)였으며, 이 중 가장 많이 검출된 원인균은 Pseudomonas aeruginosa로 84예(5.4%)였다. 전체 연구 기간을 통틀어서 전반기에 비해 후반기에는 그람양성균의 비율이 유의하게 감소(p=0.034), 그람음성균의 비율이 유의하게 증가하였고(p=0.045), 특히 그람양성균 중 CoNS와 Staphylococcus aureus의 검출 비율이 유의하게 줄어들었으며(p<0.001, 0.048), 그람음성균 중에서는 Pseudomonas aeruginosa의 검출 비율이 유의하게 증가하였다(p<0.001) (Fig. 2, Table 2).

Percentage of isolated microorganisms. Species with the contribution of less than 1% were grouped under 'Other’.
Comparison of isolated microorganisms between two time periods in patients with keratitis using Clinical Data Warehouse data
1,837명의 환자 중 488명의 환자에서는 다회 배양검사가 시행되었으며 동정된 균은 총 597예로 나타났다. 그람양성균은 368예(61.6%), 그람음성균은 188예(31.5%)로 그람음성균의 비율이 전체 환자군보다 상대적으로 높았다. 그람양성균에서 CoNS로 175예(29.3%), 다음으로 Staphylococcus aureus로 62예(10.4%)가 확인되었다. 그람음성균 중에서 Pseudomonas aeruginosa의 검출은 42예(7.0%)로 다회 배양검사한 환자에서 Pseudomonas aeruginosa의 동정 비율이 전체 환자의 비율(5.4%)보다 높은 것으로 나타났다.
그람양성균에서 vancomycin에 대해서 99.7%의 높은 감수성을 보였다. 70건의 적은 건수지만 ceftazidime에 대해서는 91.4%의 높은 감수성을 보였다. 그람양성균에서 퀴놀론계 항생제인 ciprofloxacin에 대한 항생제 내성률은 연구 기간 전반 5년 동안 31.5%에서 후반 5년에는 36.7%로 증가하였지만, 유의미한 증가는 보이지 않았다(p=0.137). Levofloxacin과 moxifloxacin에 대해서는 그람양성균은 각 21.7%, 23.2%의 내성률을 보였으며, 연구 기간 전반기와 후반기 간에 유의한 차이는 없었다(각각 p=0.117, 0.098). 그람음성균에서는 73건의 적은 건수지만 vancomycin에 대한 내성검사에서 내성이 확인되지 않았다. 그람음성균에서 세팔로스포린계 항생제인 cefazolin과 cefotaxime에 대해서는 연구 기간 후반기에 유의한 내성률 증가가 확인되었으며(각각 p<0.001, <0.001), ceftazidime에 대해서도 유의하게 내성률이 증가하였다(p=0.020). 하지만 Pseudomonas aeruginosa, Serratia marcescens 그리고 Klebsiella species에서 세팔로스포린계 항생제 내성률은 연구 기간 전반기와 후반기 간에 유의한 변화는 없었다(각각 p=0.501, p=0.170, p=0.981). Pseudomonas aeruginosa, Serratia marcescens 그리고 Klebsiella species를 제외한 Stenotrophomonas maltophilia를 포함한 그 외의 그람음성균에서 세팔로스포린계 항생제의 유의한 내성률 증가가 확인되었다(p<0.05). 그람음성균에서 퀴놀론계 항생제인 ciprofloxacin, levofloxacin, moxifloxacin에 대해서는 유의한 내성률 변화가 확인되지 않았다(각각 p=0.096, 0.608, 1.000). 그람음성균에서 amikacin과 tobramycin에 대해서는 연구 후반기에 내성률이 증가하였다(p=0.022, <0.001). Pseudomonas aeruginosa와 Serratia marcescens에서 amikacin에 대해서 유의한 내성률 변화가 확인되지 않았으며(각각 p=0.543, p=0.494), tobramycin에 대해서도 연구 기간 유의한 변화는 없었다(각각 p=0.400, p=0.464) (Table 3).
미생물 각막염 발생 위험인자
추가로 진행한 서울성모병원 연구에서 10년 동안 배양검사에서 원인균이 동정된 미생물 각막염으로 치료받은 환자 중 2개월 이상 추적 관찰이 가능하였던 환자는 288명(남자 53.8%, 여자 46.2%), 평균 연령은 55.0 ± 19.2세(6-93세)였다. 60세 미만인 저연령군은 150명(52.1%)이었으며, 60세 이상인 고연령군은 138명(47.9%)이었다. 저연령군에서는 고혈압을 전신 질환으로 가진 환자는 10명(6.7%)이었고, 고연령군에서는 47명(34.1%)으로 저연령군보다 유의하게 높은 비율을 보였다(p<0.001). 초기 내원 시 0.1 미만(logarithm of minimal angle of resolution [logMAR]>1.0)의 시력을 가진 비율이 저연령군에서 48.0%, 고연령군에서 76.1%였으며 유의하게 높았다(p<0.001). 증상 지속 기간이 7일 이상인 경우, 외상력은 두 군에서 유의한 차이를 보이지 않았다(각각 p=0.228, 0.229). 저연령군에 비해 고연령군은 안과 수술 과거력의 비율이 유의미하게 더 높았으며(p<0.001) 저연령군과 고연령군 모두 각막이식 과거력이 가장 많은 비율을 차지하였다(각각 13.3%, 27.5%, 총 20.1%). 고연령군에 비해 저연령군에서 콘택트렌즈 착용력은 유의미하게 더 높은 비율을 나타냈다(p<0.001). 고연령군은 저연령군에 비해 기존 안표면 질환 유무, 스테로이드 안약 사용, 녹내장 안약 사용의 비율이 유의미하게 더 높았다(각각 p=0.032, 0.002, 0.004) (Table 4). 저연령군에서 진균감염이 8예(4.3%), 고연령군에서 24예(12.2%)가 검출되어 고연령군에서 진균 감염이 유의하게 더 많이 검출되었으나(p=0.005), 다른 원인균에서는 연령 간에 유의한 차이가 없었다(p>0.05) (Table 5).

Demographics and clinical characteristics of microbiologically proven infectious keratitis in Seoul St. Mary’s Hospital
치료 결과
추가로 진행한 서울성모병원 연구에서 치료한 결과를 분석하였을 때, 환자의 치료 후 시력은 55.9%의 눈에서 향상되었고, 30.2%의 눈에서는 변화가 없었고 13.9%의 눈에서는 치료에도 불구하고 악화되었다. 저연령군에서는 시력이 62.7%에서 향상, 26.0%에서 변화가 없었고, 11.3%에서 악화되었으며 고연령군에서는 시력이 48.6%에서 향상, 34.8%에서 변화가 없었고, 16.7%에서 악화되었으며 두 군 간의 유의한 차이가 없었으나(p=0.053), 치료 후 교정시력이 0.1 미만인 경우는 저연령군에서 23.3%, 고연령군에서 62.3%로 고연령군에서 유의하게 더 많았다(p<0.001).
항생제 치료에 대한 반응이 충분하지 않거나 각막천공이 생기거나 임박한 61안(21.2%)에서 수술적인 치료(안구적출술, 각막이식, 양막이식, 결막피판술)가 시행되었다. 이 중 4안(6.6%)은 안구적출술을 받았고, 29안(47.5%)에서는 각막이식수술이 시행되었다. 안과 수술력이 있는 경우, 콘택트렌즈 착용력이 없음에도 각막염이 생긴 경우, 기존 안질환이 있는 경우 그리고 스테로이드 안약의 사용은 수술적 치료와 관련성이 유의한 것으로 나타났다(각각 p<0.001, 0.007, <0.001, 0.004) (Table 6).
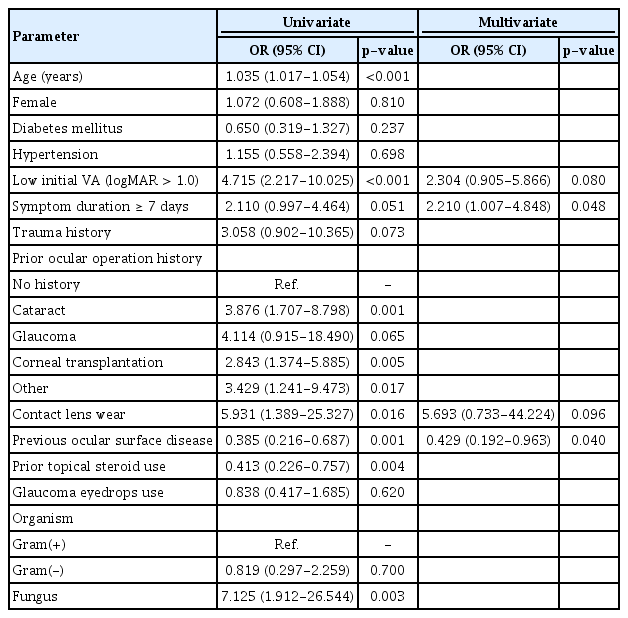
수술적 치료의 단변량 로지스틱 회귀분석 결과 나이가 많은 경우, 초기 내원 시 0.1 미만의 낮은 시력, 콘택트렌즈 착용력이 없는 경우, 기존 안질환이 있는 경우 그리고 스테로이드 안약의 사용은 모두 유의한 상관관계를 보였다(각각 p<0.001, <0.001, 0.001, 0.004). 수술을 받지 않은 환자에 비해 백내장수술을 받은 환자(odds ratio [OR], 3.876; 95% confidence interval [CI], 1.707-8.798; p=0.001)와 각막 이식을 받은 환자(OR, 2.843; 95% CI, 1.374-5.885; p=0.005)는 수술적 치료의 유의한 위험인자로 나타났다. 진균감염의 경우 그람양성균과 비교하였을 때 유의하게 수술적 치료가 요구되었다(OR, 7.125; 95% CI, 1.912-26.544; p=0.003). 단변량 로지스틱 회귀분석에서 p값이 0.1 미만이었던 독립 변수를 포함하여 다변량 로지스틱 회귀분석 결과, 증상 지속 기간이 7일 이상인 경우(OR, 2.210; 95% CI, 1.007-4.848; p=0.048)와 기존 안질환이 있는 경우(OR, 0.429; 95% CI, 0.192-0.963; p=0.040)가 수술적 치료를 받게 되는 유의한 예측 변수로 나타났다(Table 7).
고 찰
미생물 각막염의 정확한 진단과 치료를 위해 각막찰과 배양검사 그리고 생체 외 항생제 민감도 검사는 적절한 항생제 선택에 있어서 유용하고 필수적이다.4 지리적인 위치, 인구 통계, 시간의 흐름에 따라 원인 미생물과 항생제 내성의 변이가 있으므로, 지역별 미생물 동향 데이터를 수집하는 것이 중요하다. 5-18 본 연구에서는 최근 10년간 한국 대학병원에서 미생물 각막염의 원인 미생물 스펙트럼과 항생제 감수성 변화를 분석하였으며, 추가적으로 하나의 대학병원을 방문한 환자를 대상으로 미생물 각막염 발생 위험인자, 연령군에 따른 분석, 수술적 치료를 받은 환자의 위험인자를 분석하였다.
본 연구에서 각막배양검사의 배양 양성률은 46.0%로 나타났으며, 이는 Parmar et al14의 51.2%, Passos et al15의 53.5%보다 낮은 양성률을 보였다. Hahn et al5의 국내 1995년부터 2000년까지의 연구에서는 Pseudomonas aeruginosa가 33.4%로 가장 많은 미생물 각막염의 가장 흔한 원인균으로 보고하였다. 최근 국외의 여러 연구16-18,23,26-28에서 CoNS가 미생물 각막염의 가장 흔한 원인균으로 보고가 되었으며 국내 연구에서는 Kim et al7의 2000년부터 2007년까지 CoNS가 42.7%, Sun et al11의 2006년부터 2008년까지 CoNS가 32.4%, Mun et al29의 연구에서는 2007년부터 10년간 CoNS가 15.9%로 가장 많은 원인균으로 보고하였다. 본 연구에서도 CoNS가 가장 많이 동정된 균으로, 전체 미생물 각막염 환자 중 27.8%를 차지하며, 그람양성균에서는 42.1%를 차지한 결과로 2000년도 이후 국내에서 CoNS가 가장 흔한 원인균으로 보고된 다른 국내 연구 결과와 일치하였다. 반면, 일부 연구에서는 본 연구와 다르게 대만에서 CoNS 중 Staphylococcus epidermidis의 양성률이 2.9%로 낮게 보고되었고, Pseudomonas aeruginosa의 양성률은 46.7%로 높게 보고된 경우도 있다.30 이러한 세균학적 차이는 지역과 기후의 다양성을 반영한 결과로 생각된다.
Mun et al29의 연구에서 CoNS의 비율은 10년 동안 23.8%에서 10.8%로 비율이 줄었으나 유의한 차이는 없었다. 본 연구에서는 연구 기간 동안 그람양성균 비율의 유의한 감소가 있었으며 이 중 특히 CoNS의 검출 비율이 32.7%에서 22.2%로 유의한 감소를 보였다. 호주에서의 2016년도 연구,16 캐나다 토론토에서 2000년도부터 2010년도까지의 연구,17 영국에서 2008년부터 10년간의 연구,31 이스라엘 예루살렘에서 2002년도부터 13년까지의 연구28 등 여러 연구들과 마찬가지로 본 연구에서 연구 기간 전반기 25.0%에서 후반기 29.6%로 그람음성균의 비율이 유의하게 상승하였다. 특히, Pseudomonas aeruginosa의 비율이 3.1%에서 8.0%로 큰 폭으로 증가하였다.
각막염 치료에서 임상 양상이 호전되지 않거나 악화될 경우 추가적인 배양을 시행하게 되는데 다회 배양 환자에서 그람음성균 그중에서 특히 Pseudomonas aeruginosa의 동정 비율이 전체 환자군보다 상대적으로 더 높은 것으로 나타났으며 Pseudomonas aeruginosa 각막염의 경우 치료가 어렵고 임상 양상이 호전되지 않아 추가 배양을 하였을 것으로 보인다.32
퀴놀론계 항생제는 미생물 각막염의 1차 치료로 널리 사용되고 있으나 여러 연구에서 내성균의 증가 경향이 보고되었다.9,33-35 본 연구에서는 전체 퀴놀론계 항생제에 대한 내성률은 다른 국내 연구8,9,11와 비슷한 22.9% 내성률을 보였으나 내성균의 유의한 증가 경향을 보이지 않았다. 특히 ciprofloxacin에 대해서는 그람양성균에서 감수성이 연구 기간 전반기의 68.5%에서 후반기의 63.3%로 감소하였으나 통계적 유의성은 없었다는 점이 국내외 다른 연구 결과와 일치하였다.7,8,36 현재 임상에서는 퀴놀론계열 항생제에 대한 반응이 적은 세균성 각막염에서 주로 그람양성균에 효과적인 vancomycin과 그람음성균에 효과적인 ceftazidime 병용 안약으로 치료하고 있으며37 본 연구에서도 그람양성균에서 vancomycin에 높은 감수성, 그람음성균에 ceftazidime에 높은 감수성을 보였으나 ceftazidime의 감수성 감소가 관찰되어(92.3%에서 85.5%) 이러한 항생제를 사용할 때에는 경각심을 가지고 임상적으로 적절한 상황에서 충분한 약제 농도를 유지하는 것이 중요하다고 생각한다.
인구의 고령화 현상과 동반하여 고령 인구에서의 미생물 각막염 발생률도 증가하여 노인 환자와 젊은 환자 사이의 위험 요인, 임상 경과 및 예후의 차이점을 이해한다면 적절한 예방과 치료가 가능할 것이다.6,12,13 국내 연구에서 미생물 각막염 환자 중 60세 이상 고연령군이 차지하는 비율이 Hahn et al5은 33.8%, Lim and Lee8는 50.3%, Yoon et al12은 53.9%, Kim et al6은 58.7%, Kim et al7은 60.9%, 국외 연구에서는 Butler et al13은 45%, van der Meulen et al38은 49.4%로 보고하였다. 본 연구에서는 7개 대학병원 환자에서 고연령군의 비율이 44.1%를, 환자 수가 가장 많은 서울성모병원 환자 중에서는 47.9%를 차지하였다.
본 연구에서 고연령군은 저연령군에 비해 안과적 수술 과거력, 기존 안질환, 스테로이드 안약 사용, 녹내장 안약 사용의 비율이 더 높아 고령에서는 동반된 여러 안구 질환이 미생물 각막염 발생의 위험인자임을 확인할 수 있었다. 안구표면질환이 있는 경우는 눈물막의 장애로 눈물에 있는 리소자임이나 면역글로불린A 등에 의한 방어기전이 깨져 각막염의 발생률을 높이고39,40 나이가 많을수록 창상 치유 반응의 지연 및 면역력 저하로 감염에 취약하여41 고령자들은 특히 수술 과거력과 기존 안질환이 있는 경우 주기적인 관리를 통해 미생물 각막염을 예방하는 것이 중요한 것으로 사료된다. 본 연구에서 저연령군에서 콘택트렌즈 착용력의 비율이 더 높았으며 이는 최근 콘택트렌즈 사용 증가와 관련되어 미생물 각막염이 자주 발생하는 것으로 보이며 저연령층에서는 특히 렌즈 착용력과 관련된 주의사항 및 위생에 대한 정보 제공이 필요하다.6,12,42,43
계절별 미생물 각막염의 발생률은 계절별로 고르게 나타났으며 저연령군과 고연령군 사이의 계절별 발병률은 유의한 차이가 없었다. 여름에 호발하는 Sun et al11의 보고와 가을에 호발하는 Kim et al6의 보고와의 차이는 지리적 특성으로 인한 결과로 보인다.
미생물 각막염의 초진 시력이 0.1 미만인 경우는 Hahn et al5은 58.6%, Kim et al7의 66.4%로 보고하였고 Kim et al6에서 초진 시력이 0.1 미만인 저연령군이 50.1%, 고연령군이 75.0%인 반면, 치료 후 교정시력이 0.1 미만인 경우는 저연령군에서 26.2%, 고연령군에서 52.0%로 고연령군에서 시력 예후가 좋지 않았다. 본 연구에서도 유사하게 초진 시력이 0.1 미만인 경우는 61.5%, 그중 저연령군 48.0%, 고연령군 76.1%였으며 치료 후 최종 시력이 0.1 미만인 경우는 저연령군에서 23.3%, 고연령군에서 62.3%로 고연령군에서 시력 예후가 좋지 않았다.
Miedziak et al44은 미생물 각막염에서 치료 실패로 인해 전층각막이식술을 시행하게 되는 예후인자로 고령, 스테로이드 안약의 사용, 안과 수술 이력, 초진 시력이 나쁜 경우, 병변의 크기가 큰 경우(>16 mm2), 각막중심부에 위치한 경우를 보고하였다. Morlet et al43은 배양검사에서 균이 자라는 경우이면서 각막궤양의 크기가 큰 경우(>5 mm2), 60세 이상인 경우가 치료 실패로 수술적 치료의 위험인자로 보고하였다. 본 연구에서도 치료 실패로 수술적 치료를 시행하게 되는 위험인자들을 분석하였으며 단변량 로지스틱 회귀분석에서는 나이가 많은 경우, 초기 내원 시 낮은 시력, 콘택트렌즈 착용력이 없는 경우, 기존 안질환이 있는 경우, 스테로이드 안약의 사용, 백내장수술을 받은 경우, 각막이식을 받은 경우, 진균감염이 유의한 위험인자로 나타났다. 콘택트렌즈를 착용력이 없는 경우가 단변량 로지스틱 회귀분석에서 수술적 치료의 위험인자로 나타난 것으로 보아 콘택트렌즈 사용은 미생물 각막염을 자주 발생하게 되나 콘택트렌즈에 유발된 각막염의 경우 비교적 젊은 나이에 발생하여 치료 순응도가 좋아 빠른 치료를 하게 되며 약물에 잘 반응하여 예후가 좋았던 것으로 보인다.6,12,42,43
환자의 자각 증상이 감소하여 일차 의료기관의 방문이 지연되었거나 일차 의료기관에서 적절한 치료에도 불구하고 임상 양상이 악화되어 3차 의료기관으로 의뢰되어 늦게 내원하게 되는 경우 불량한 예후와 연관된 것으로 알려져 있으며45,46 본 연구에서 다변량 로지스틱 회귀분석 결과 증상 내원 기간이 7일 이상인 경우와 기존 안질환이 있는 경우에서 통계적으로 수술적 치료를 받게 되는 유의한 위험인자로 나타났다. 환자의 증상 발생 후 빠른 병원 내원과 의사의 정확한 진단 및 신속한 치료의 중요성을 시사하며 기존 안질환이 있는 경우 수술적 치료까지 필요할 수 있으므로 이들 환자에서 미생물 각막염은 더욱 주의를 기울여야 하며 환자의 개별적인 특성을 고려한 맞춤형 예방 및 치료 전략을 적용하는 것이 중요하다.
임상데이터웨어하우스에서 추출된 익명화된 데이터는 많은 양의 데이터를 용이하게 추출하여 분석할 수 있는 장점이 있으나 추출되는 데이터의 특성상 위험인자와 예후 등 필요한 추가적인 정보를 분석하기가 어렵다. 본 연구에서 익명화된 데이터로는 알기 어려운 미생물 각막염의 위험인자와 예후 등을 분석을 위해 추가적인 의무기록의 후향적 분석을 하였으나 하나의 대학병원에 내원한 환자에서만 위험인자와 예후를 분석하였기 때문에 지역별 차이로 인해 국내 미생물 각막염의 위험인자로 일반화하는 것은 어려울 것으로 생각된다. 앞으로 수치화하여 익명화 데이터로 추출할 수 있는 정보의 범위가 늘어나게 된다면 익명화 데이터의 활용도가 커지고 여러 분야에서 데이터 분석에 용이할 것으로 보인다. 본 연구의 다른 한계점으로는 중복 감염된 원인균도 분석에 포함되어 오염으로 인한 결과 왜곡의 가능성이 있으며 원인균이 확인된 환자만을 연구 대상으로 선정하여 원인균이 확인되지 않은 환자가 제외되었으므로 선택 편향이 발생할 수 있다. 또 대학병원에서 진단받은 환자만을 대상으로 하였기 때문에, 일부 환자는 내원 전 1차 의료기관에서 이미 항생제를 사용한 후 내원한 경우가 많아 배양검사 결과에 영향을 줄 수 있으며 실제 임상에서 사용된 항생제 안약의 농도는 체외검사에 사용되는 농도보다 훨씬 높을 수 있으므로, 체외검사 결과로 얻은 항생제 감수성 검사는 약물의 임상적 효과를 과소평가할 수있다. 한편 본 연구는 여러 대학병원에서 최근 10년간의 미생물 각막염의 변화 추세를 확인한 점에서 임상적인 가치가 있다고 생각되며, 향후 미생물 균주와 항생제 내성의 변화 추이 연구에 기초 자료로 쓰일 수 있을 것으로 생각된다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
박찬준 / Chanjoon Park
Department of Ophthalmology, College of Medicine, The Catholic University of Korea