각막내피손상 및 비손상 모델에서 각막내피세포와 각막기질의 상호작용
Interactions of Corneal Endothelial Cells with Stromal Cells during Corneal Endothelial Injury
Article information
Abstract
목적
화학적으로 유발된 각막내피손상의 치유와 세포 배양을 이용하여 각막내피세포와 기질세포의 상호작용을 조사하였다.
대상과 방법
25마리의 토끼를 NaOH에 각막내피가 손상된 군과 대조군 두 그룹으로 나누었다. 0.05 N NaOH 0.1 mL를 전방에 10분 동안 처리하여 각막내피손상을 유발한 후 1일, 1주, 2주 및 4주에 임상적으로 평가하였다. 각막내피세포와 각막기질세포를 배양하여 Transwell system에서 공배양과 그렇지 않을 때의 각막내피의 상처 치유 속도와 배양액 내의 사이토카인을 분석하였다.
결과
각막부종과 불투명도 점수는 대조군보다 NaOH에 손상된 모든 토끼에서 더 높았다. 1일째에 NaOH에 각막내피세포가 손상된 토끼에서 각막기질세포에는 영향을 거의 주지 않으면서 각막내피세포에 apoptosis가 관찰되었다. 손상 2주 후, 각막내피세포가 주변부에서 중심부로 이동하였다. 각막기질세포는 각막내피세포의 존재와 함께 데스메막에 평행하게 정렬되었다. 배양각막내피세포의 상처 치유는 각막기질세포와의 공배양에서 빨랐고 배양액 내로의 transforming factor-β1 및 interleukin-6 분비는 각막내피세포 또는 각막기질세포의 개별배양에서보다 공배양에서 더 낮았다.
결론
전방 내 NaOH 주입은 기질 조직에 최소한의 영향을 미치는 각막내피손상의 모델이 될 수 있을 것으로 보인다. 또한, 상처 치유 과정에서 각막내피세포와 각막기질세포 사이의 상호작용은 각막내피손상의 치유 과정에 필요한 사이토카인 생산과 관련이 있다.
Trans Abstract
Purpose
To investigate the interaction of corneal endothelial cells (CECs) with corneal stromal cells (CSCs) on the healing of chemically induced corneal endothelial injury.
Methods
Twenty-five rabbits were divided into two groups: rabbits exposed to NaOH and controls. Rabbits were clinically evaluated and sacrificed at 1 day, 1 week, 2 weeks, and 4 weeks after endothelial injury. Corneal endothelial cells and corneal stromal cells were cultured and the wound healing rate of the corneal endothelium and cytokines in the culture medium were analyzed with and without co-culture in the Transwell system.
Results
Corneal edema and opacity scores were higher in all rabbits exposed to NaOH than in controls. Corneal endothelial apoptosis with little effect on CSCs was observed in rabbits exposed to NaOH at day 1. Two weeks after injury, CECs migrated from the periphery. CSCs were aligned in parallel to Descemet's membrane, which exhibited the presence of CECs. Transforming factor-β1 and interleukin-6 secretion was lower in the co-culture system than in individual cultures of CECs or CSCs.
Conclusions
These results revealed intracameral NaOH injection is a model of corneal endothelial injury with minimal impact on the stroma. Communication between CECs and CSCs during wound healing may lead to the modulation of cytokine production, which is necessary for an enhanced healing process of corneal endothelial injury.
각막에는 각막상피세포, 각막기질세포, 각막내피세포 등 3가지 세포가 있다. 상피는 각막의 가장 바깥층이며 중요한 장벽 기능을 한다.1 각막기질세포는 중간엽 기원의 세포이자 각막기질의 주요 세포 성분이며2,3 이러한 세포들은 일반적으로 정지 상태이지만, 손상이나 염증에 반응하여 활성화되면 섬유아세포와 근섬유아세포로 전환될 수 있다.2,4 하지만 섬유아세포 및/또는 근섬유아세포에 의한 각막기질세포의 대체는 각막의 투명성을 변화시켜 각막혼탁을 일으킨다.4,5 각막의 뒤쪽 표면은 단층의 각막내피세포가 덮고 있으며, 전방의 방수와 맞닿아 있고 각막의 투명성을 유지하는 데 필수적인 역할을 한다.2,6 포유류의 각막내피는 각막 기질부에서 전방으로 수분을 이동시켜 각막 투명성을 유지한다.7 한편 사람 각막내피 재생 능력은 제한적이며 상처 치유는 인접한 세포의 이동 및 확장을 통해 이루어진다.8 이러한 과정은 표피성장인자(epidermal growth factor, EGF), 형질전환성장인자-베타1 (transforming factor-β1, TGF-β1), endothelin-1 및 interleukin-6 (IL-6)과 같은 사이토카인에 의해 매개된다.9-12 각막에 있는 세포들은 두 개의 무세포층, 즉 보우만층과 데스메막으로 분리되어 있다.9 사람 각막내피세포가 광범위한 손상을 입으면 각막기질 내의 수분을 전방 내로 퍼내지 못하여 각막부종이 생기고 각막이식을 요하는 물집각막병증을 일으키게 된다.9,13 이에 반해 토끼 각막내피세포는 현저한 증식력을 가지고 있다.14,15 토끼와 사람 각막내피세포 사이에 비타민과 셀레노화합물 대사와 NF-kappa B 신호 경로의 차이가 보고되었고, TGF-β, PITX2 및 케라토칸은 토끼 샘플에서 뚜렷하게 발현되었으며, 이는 토끼 각막내피세포에서의 활발한 증식과 관련이 있을 수 있다고 제시되었다.15
세포 표면의 다양한 부착분자(adhesion molecule)에 의해 매개되는 세포-세포 및 세포-매트릭스 상호작용은 상처 치유에 중요한 역할을 한다.16 각막내피세포는 데스메막에 의해 각막기질세포와 분리되지만, 기질-내피 상호작용은 각막내피손상을 치유하는 데 중요한 역할을 할 수 있다.17-19 반대로, 각막내피세포는 각막기질세포를 근섬유아세포로 전이시키는 것을 억제할지도 모른다.
각막내피와 기질세포의 상호작용이 있다고 제시된 바 있는데,17-19 발달 중인 토끼 각막의 Descemet's membrane (DM)에 있는 기공의 존재는 직접적인 내피-기질세포 상호작용을 시사하였고18 조류의 각막에서 일정한 간격으로 DM을 관통하고 간질과 내피세포를 연결하는 콜라겐 IV가 풍부한 기질의 존재도 보고되었고20 마우스 각막에서 내피-간질 통신을 나타내는 DM 구멍이 보고되어19 간질-각막내피 상호작용이 구조와 기능에 영향을 미칠 가능성이 제시되었다.17 또한, 상처 치유 과정에서는 여러 가지 사이토카인이 관여한다.21,22 IL-6 신호는 상처 치유 과정에서 각막 상처 치유 매개체로21 복구 환경으로의 전환을 담당한다.22 TGF-β는 염증, 혈관신생 자극, 섬유아세포 증식, 콜라겐 합성 및 새로운 세포외기질의 침착 및 리모델링과 같은 상처 치유의 여러 과정에 관여한다.23,24 TGF-β1은 각막내피세포의 성숙 시 세포장벽 기능을 촉진한다.25 이에, 본 연구에서는 토끼에서 화학적으로 각막내피손상을 일으켜 치유 과정을 평가하고 세포실험을 통해 각막기질세포-각막내피세포 상호작용의 역할을 조사하고자 하였다.
대상과 방법
모든 절차는 헬싱키선언의 원칙과 안과 및 시력 연구에서 동물 사용을 위한 ARVO 성명서에 따라 수행되었으며 한림대학교 의료원의 기관검토위원회/윤리위원회 및 동물실험윤리위원회(IACUC)에서 검토 및 승인되었다(IRB No. 2023-05-017, 000 2023-3-0517-2). 몸무게 약 1.8 kg의 뉴질랜드 흰 암컷 토끼가 사용되었으며 Nara-Biotech Animal Company (Seoul, Korea)에서 구입하였다. 토끼는 23°C와 60% 상대습도가 유지되는 일정한 조건에서 12시간의 낮-밤 주기(오전 8시-오후 8시; 오후 8시-오전 8시)에 노출되었다.
25마리의 토끼를 NaOH에 노출된 군과 대조군 두 그룹으로 나누었다. 마취는 근육 내 tiletamine, zolazepam (30 mg/kg; Zoletil 50, Virbac, Carros, France)과 xylazine hydrochloride (5 mg/kg) 혹은 알팍산(5 mg/kg)을 주입하여 이루어졌으며 국소마취는 proparacaine 안약(Alcaine, Alcon, Fort Worth, TX, USA)을 사용하였다. 모든 토끼의 오른쪽 눈을 실험에 사용하였고, 10% polyvinylpyrrolidone iodine (Besetine solution, Hyundai Pharm. Co. Ltd., Seoul, Korea)으로 소독한 후 0.05 N NaOH 0.1 mL를 전방에 10분 동안 처리하였다. 그 후, 전방을 balanced salt solution (BSS®, Alcon)으로 세척하였다. 토끼는 각막내피손상 후 1일, 1주, 2주 및 4주에 임상 양상을 평가하였다(n=5 for each group).
Assessment of corneal edema
각막투명도는 내피손상 후 1일, 1주, 2주, 4주에 평가하였다. 각막부종으로 인한 혼탁의 중증도는 이전에 Yoeruek et al26에 사용된 기준에 따라 평가하였으며 다음과 같다. grade 0, 투명한 각막; grade 1, 경미한 각막혼탁; grade 2, 홍채 세부 구조는 흐릿하지만 홍채와 렌즈 구분이 가능; grade 3, 홍채와 렌즈가 거의 보이지 않음; grade 4, 홍채와 렌즈를 식별할 수 없음. 혼탁 정도 값(n=5)은 수술 후 추적 기간에 평가되었다. 중앙각막두께(central corneal thickness, CCT)는 조직을 뗀 직후 캘리퍼로 측정되었다.
Vital staining
Alizarin red와 trypan blue로 vital staining을 시행하였다. 각막을 trypan blue로 염색하여 손상된 원형질막이 있는 세포를 나타내고 alizarin red로 염색하여 세포 경계를 확인하였다.27 각막내피표면을 90초 동안 0.9% NaCl 중 0.2% trypan blue로 염색하였다. 이어서, trypan blue를 0.9 % NaCl로 부드럽게 세척하고 0.9 % NaCl (pH 4.2) 중 0.2 % alizarin red로 90초 동안 염색하였다. 과량의 염료를 제거하기 위해 다시 한 번 0.9% NaCl로 세척 후, 각막을 2.5% glutaraldehyde에서 10분 동안 고정시켰다. 각막을 지지대에서 분리하고 공막 및 결막 조직을 다듬었다. 각막을 슬라이드에 놓고 0.9 % NaCl 방울이 있는 커버슬립을 덮은 뒤 각막을 평평하게 하기 위해 커버슬립을 슬라이드에 테이프로 붙였다. 내피는 CKX41 microscope (Olympus, Tokyo, Japan)에서 투과광으로 관찰하였으며 중앙 및 주변 영역의 사진을 획득하였다.
Immunofluorescence staining
적출된 안구는 매립 배지(Tissue-Tek OCT Compound, Sakura Finetek USA, Inc., Torrance, CA, USA)에서 즉시 취하였으며, 절편을 저온 유지 장치에서 10 μm 두께로 절단하고 tape system을 사용하여 잠재적인 compression artifact를 피하기 위해 유리 슬라이드로 옮기고 실온에서 15분 동안 건조시켰다. 절편의 중심은 동공과 시신경을 통해 판단하였다. 각막두께는 각 군의 5안에서 측정하였으며 1안에서 2-4개의 절편을 측정하였다. Collagen VIII alpha2 (COL8A2), alpha-smooth muscle actin (α-SMA), Na+-K+ ATPase 및 terminal deoxynucleotidyl transferase (TdT)-mediated dUTP nick end labeling (TUNEL)의 면역형광염색을 수행하였다. 샘플들은 3.7% formaldehyde solution에 20분 동안 고정되었다. 슬라이드를 0.5% Triton X-100으로 10분 동안 투과시키고 실온에서 1% bovine serum albumin으로 1시간 동안 처리하였다. 세척 후, 슬라이드를 goat anti-human COL8A2 antibody (Santa Cruz, Santa Cruz, CA, USA), rabbit anti-human α-SMA antibody (Abcam, Cambridge, MA, USA) 또는 mouse anti-human Na+-K+ ATPase (Santa Cruz)와 함께 4°C에서 밤새 배양한 후 PBS로 세척하였다. 세포를 암실에서 37°C로 1시간 동안 fluorescein isothiocy anateconjugated goat anti-rabbit 눈꺼풀뒤당김 교정술 immunoglobulin G antibody, rabbit anti-goat antibody, 또는 rabbit anti-mouse antibody (1:100)와 함께 배양한 다음 핵을 구분하기 위해 Hoechst dye (1:2,000; Molecular Probes, Eugene, OR, USA)를 사용하였다. 인산완충용액으로 세척한 후 슬라이드를 mounting media에 장착하였다. 음성 대조군 염색은 1차 항체의 생략하고 동시에 수행하였다.
Apoptosis 세포의 확인은 TUNEL 시스템 키트(Promega GmbH, Mannheim, Germany)를 사용하여 수행하였다. TUNEL 염색은 면역염색을 위해 위에서 설명한 대로 수행되었지만 proteinase-K (20 μg/mL, Promega GmbH)와 함께 37°C에서 추가로 10분 배양하고 TdT 반응 전에 추가 고정 단계를 수행하였다.
사람 각막내피세포와 기질세포의 배양
사람 각막내피세포와 각막기질세포는 전체층각막이식술 후 버려진 각막-공막 고리에서 얻었으며, 조직은 배양을 위해 처리될 때까지 4°C에서 Optisol™-GS (Bausch and Lomb Inc., Rochester, NY, USA)에 보관되었다. 세포배양은 이전에 기술된 바와 같이 시행하였다.28,29 사람각막내피세포는 사망 후 7일 이내에 획득하였으며 데스메막을 보존하였다. 사람 각막내피세포 및 데스메막 복합체를 0.02% ethylenediaminetetraacetic acid solution에서 1시간 동안 배양하고 열처리된 피펫으로 강하게 교반하여 세포 접합부를 파괴하고 3,000×g에서 5분 동안 원심분리하였다. Bovine fibronectin (10 mg/mL) 및 bocine type I collagen (35 mg/mL)을 함유하는 FNC coating mix (Athena Enzyme System, Baltimore, MD, USA)로 코팅된 배양 플레이트에 세포를 파종하였다. 그런 다음 세포를 8% fetal bovine serum (FBS; Cambrex Bio Science, Walkersville, MD, USA), 200 mg/L의 CaCl2, 0.08% chondroitin sulfate (both from Sigma Chemical Co., St Louis, MO, USA), 20 mg/mL ascorbic acid (Sigma Chemical Co.), 100 mg/mL pituitary extract (Invitrogen, Grand Island, NY, USA), 5 ng/mL EGF, 20 ng/mL nerve growth factor (both from Sigma Chemical Co.), 10 mg/mL gentamicin (Invitrogen), 100 IU/mL penicillin, 100 IU/mL streptomycin 및 2.5 mg/mL amphotericin (both from Cambrex Bio Science)이 첨가된 OptiMEM-I 배지에 5% CO2 습윤 하에서 배양하였으며 배지는 격일로 교체하였다. 각 계대 후 배양된 세포의 합류지점에서 성장 영역의 범위가 3배가 되도록 하였으며 passage 3의 세포를 실험에 사용하였다.
각막기질세포는 사망 후 7일 이내에 획득하였다. 데스메막과 상피는 집게와 안과용 칼을 사용하여 제거하였고 각막의 기질은 절편을 만들었다. 중간 기질 및 후방 기질을 배양 배지에 현탁시키고 24-well 플레이트에서 배양하였다. 각막기질을 4분의 1로 절편으로 만들어 37°C에서 Dulbecco's modified Eagle's medium (DMEM)에서 2 mg/mL collagenase (Roche, Basel, Switzerland)로 하루 동안 분해하였다. 분리된 세포를 DMEM으로 세척하고 10% FBS가 보충된 DMEM/F12에서 배양하였다.
사람 각막내피세포와 기질세포의 공배양
사람 각막내피세포와 각막기질세포는 Transwell system (Corning Inc., Lowell, MA, USA)에서 공동배양되었다. 사람 각막내피세포는 상부의 0.4 μm 필터 막에서 배양되었고 각막기질세포는 apical chamber 없이 Transwell의 각 well 바닥에 well당 100,000개 세포의 밀도로 배양하였다. 이어서 배양된 사람 각막내피세포를 각막기질세포 유무에 관계 없이 Transwell로 옮겼다. 배지를 serum-free DMEM으로 교체하고 세포를 48시간 동안 배양하였다. 상처 치유 분석을 위해 사람 각막내피세포 단층을 멸균된 10 μL 피펫 팁 (TipOne, USA Scientific, Ocala, FL, USA)으로 긁어 세포를 제거하여 두 개의 수직의 선형의 상처를 만들었다. SPOT 디지털 카메라가 장착된 도립 Zeiss 현미경으로 동일한 지점에서 상처 직후 및 24시간 후에 사진을 찍었다. 치유 정도는 원래 상처 부위와 남아있는 상처 부위의 차이 대 원래 상처 부위의 비율로 정의하였다. 공동배양 조절 배지의 단백질 함량은 bicinchoninic acid (BCA) protein assay (BioRad Laboratories, Hercules, CA, USA)를 사용하여 결정하였다. 모든 분취액은 사용할 때까지 -80°C에서 보관하였다.
Enzyme-linked immunosorbent assay (ELISA)
배지 내 TGF-β1 및 IL-6 농도는 double-sandwich ELISA로 측정하였다. 사람 각막내피세포 배양 배지, 각막기질세포 배양 배지 및 사람 각막내피세포 및 각막기질세포 공동 배양 배지 내 TGF-β1 및 IL-6 농도는 제조업체의 프로토콜에 따라 시판되는 human TGF-β1 및 IL-6 ELISA kit (R&D Systems, Minneapolis, MN, USA)를 사용하여 분석하였다. 각 ELISA의 민감도 한계는 ~7.8 pg/mL였다. 간략하게, anti-human TGF-β1 및 IL-6 항체를 96-well 플레이트의 각 well에 첨가하고 실온에서 밤새 incubation하였다. 다음 날 각 well을 세척 완충액으로 헹구었다. 그런 다음 모든 well을 1% bovine serum albumin을 포함하는 blocking buffer (pH 7.4)로 채우고 실온에서 1시간 동안 배양하였다. human TGF-β1 및 IL-6 또는 실험 샘플의 표준 희석액 100 uL를 적절한 polyclonal 항체로 코팅된 96-well 플레이트에 분배하였다. 플레이트를 밀봉하고 실온에서 2시간 동안 incubation하였다. 이어서, 플레이트를 4회 세척하고, horseradish peroxidase에 접합된 goat anti-human TGF-β1 및 IL-6 100 μL를 각 well에 첨가하고 실온에서 2시간 동안 배양하였다. 항체-항원 복합체를 100 µL의 3,30,5,50-tetramethylbenzidine으로 20분간 파란색으로 염색한 후 50 µL의 1 M H2SO4를 첨가하여 반응을 정지시켰다. 흡광도는 automatic plate reader를 사용하여 기준 파장 570 nm로 파장 450 nm에서 측정하였다. 사이토카인 농도는 BCA protein assay kit (Pierce Biotechnology, Rockford, IL, USA)로 측정한 총 단백질 농도를 기준으로 하였다.
Statistical analysis
통계는 Kruskal-Wallis test와 Mann-Whitney U test를 사용하여 실험적 차이의 통계적 유의성을 평가하였으며 p<0.05일 때 통계적으로 유의한 것으로 간주하였다.
결 과
각막부종 및 혼탁도 측정
0.05 N NaOH를 10분간 토끼 각막내피세포에 접촉하였을 때 각막부종이 발생하였고 감소 추세를 보였다(Fig. 1A). 0.5 N NaOH로 10분간 처리하였을 때에는 심한 각막부종과 혼탁이 지속하였고 14일째에 각막신생혈관이 발생하였다(Fig. 1B). 각막부종은 대조군에 비해 손상 후 1일에 유의하게 증가하였다(p=0.008) (Fig. 1A, C). 각막부종은 시간 경과에 따라 감소하였고 대조군과 비교하여 28일째 CCT에는 차이가 없었다(Fig. 1C). 각막혼탁도는 대조군에 비해 1일차에 증가하였고(p=0.008), 14일차와 28일차에는 1일차에 비해 감소하였다(p=0.008 and 0.008, respectively) (Fig. 1D). 그러나 각막혼탁도가 대조군에서 관찰된 수준으로 되돌아가지는 않았다(p=0.008).
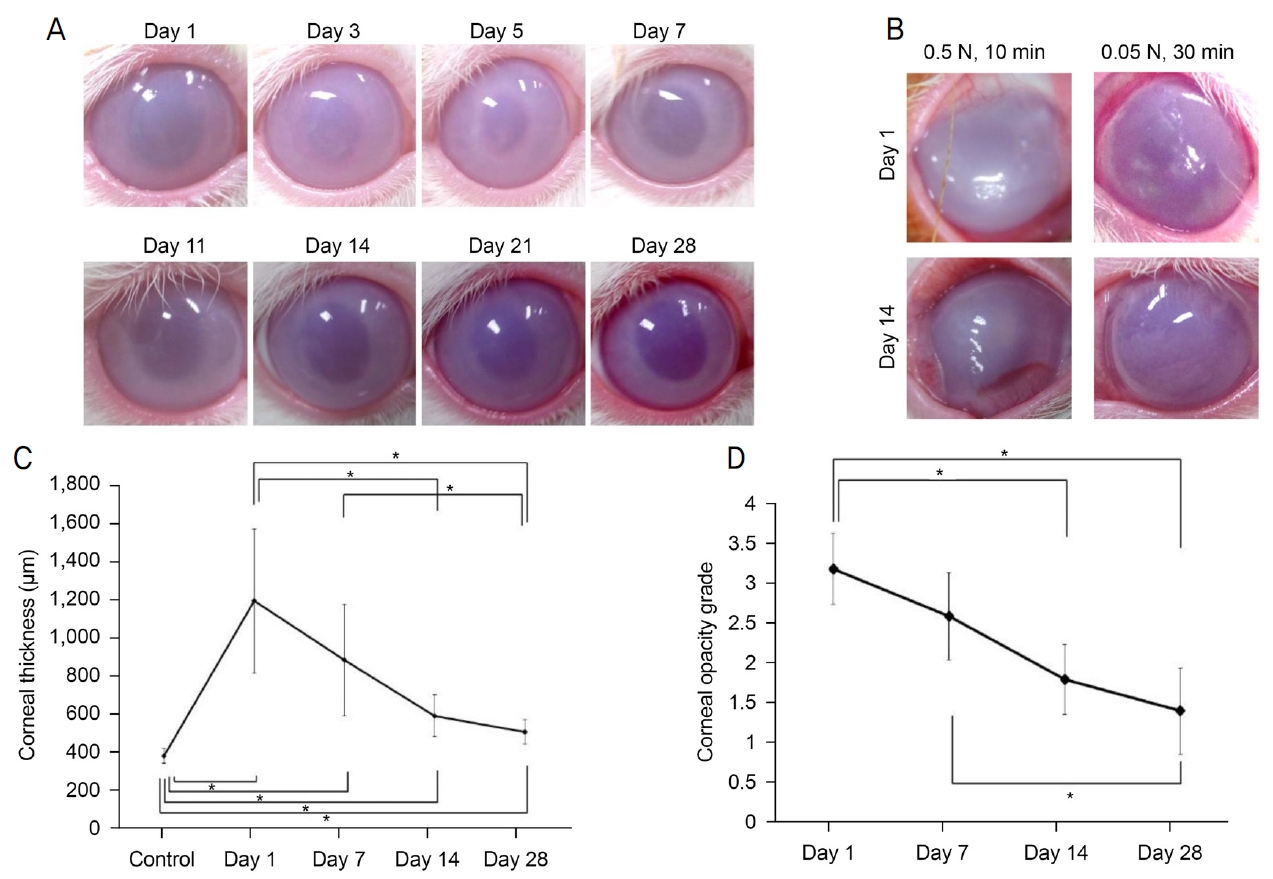
Corneal edema and opacity after chemical corneal endothelial injury in rabbits. (A) Changes in the cornea after chemical endothelial injury. (B) Corneas treated with high concentration or long duration of NaOH. (C) Corneal edema increased at day 1 and decreased until day 28 but did not achieve levels observed at baseline. (D) Corneal opacity decreased from day 1 until day 28. *Statistically significant by Mann-Whitney U test.
Alizarin S red와 trypan blue를 이용한 vital staining
각막내피세포는 vital staining으로 평가되었다. 중앙 및 주변 영역의 각막내피세포는 손상 후 1일차에 파괴되어 사라진 상태였다. 중심부는 살아 있는 세포가 없는 손상 상태로 남아 있었고, 주변부는 큰 세포가 나타나 먼 주변부에서 이동하여 7일 후에 손상에서 회복되었다. 세포가 주변에서 중심으로 이동하기 시작하여 주변부 세포의 integrity가 회복되기까지는 손상 후 14일이 걸렸다. 손상 후 28일까지 주변부 세포가 회복되었고 중앙 세포의 회복은 불완전하였지만 진행되었다(Fig. 2A). 손상 14일 후의 각막내피세포는 주변부 영역에서 세포의 크기가 작았고 다각형의(polygonal) 모양과 높은 밀도를 보인 반면 중심 영역에서는 더 크고 불규칙한 모양을 나타냈다(Fig. 2B).
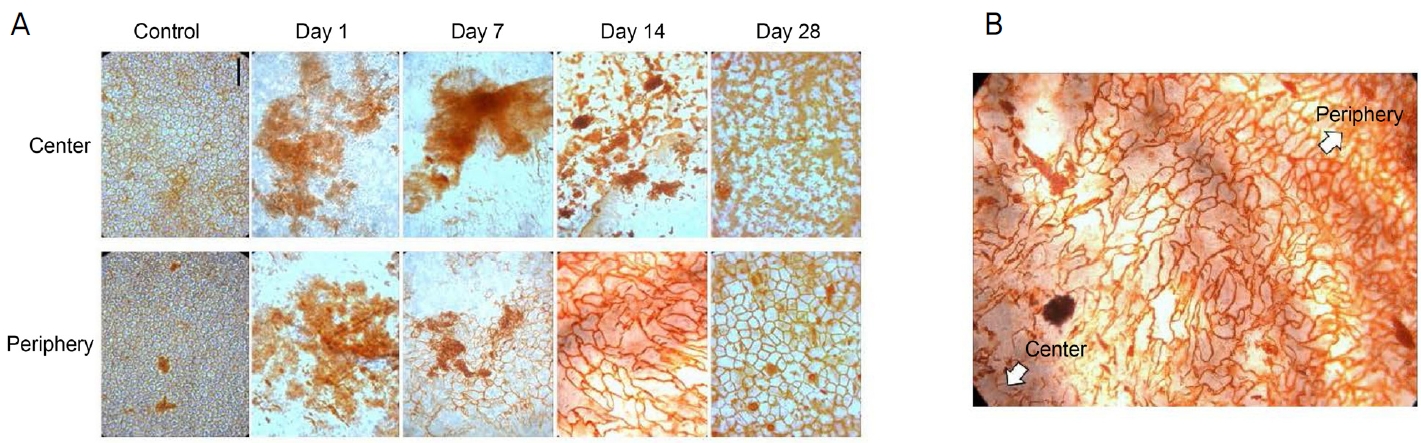
Vital staining of rabbit corneal endothelium with alizarin S red and trypan blue after injection of 0.1 mL of 0.05 N NaOH. (A) Corneal endothelial cells in both the central and peripheral areas were damaged at day 1. At day 7, central cells were damaged and peripheral cells migrated from the far periphery and recovered from damage. At day 14, peripheral cells recovered cell integrity and central cells migrated from the periphery and recovered. At day 28, peripheral cells recovered from the damage and recovery of central cells progressed from day 14. (B) Corneal endothelial cells were small and of polygonal shape and exhibited high density at the periphery and were larger and of irregular shape in the center at day 14. Scale bar = 100 μm.
헤마톡실린-에오진 염색과 TUNEL 염색
각막내피에 대한 알칼리성 손상은 손상 후 1일째에 각막내피세포의 박리 및 apoptosis를 초래하였다(red arrows in Fig. 3). 그 이후에는 각막내피에서 apoptosis 세포가 관찰되지 않았다. 한편 기질세포에서는 apoptosis 세포가 검출되지 않았다. 소수의 근섬유아세포가 손상 후 1일째에 α-SMA에 대한 면역형광염색에 의해 확인되었지만 α-SMA는 기질에서는 관찰되지 않았다(Fig. 3). 마찬가지로 데스메막에에서도 α-SMA를 발현하지 않았다.

Hematoxylin and eosin (H&E), terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) staining, and immunofluorescence with a α-smooth muscle actin (α-SMA). Alkaline injury to corneal endothelium led to the detachment and apoptosis of endothelial cells at day 1 after injury (red arrows). There were no apoptotic cells observed after this point. Immunofluorescence staining for α-SMA showed only a few myofibroblasts at day 1 and no cells stained with α-SMA were found in the stroma subsequently. The cells on the Descemet's membrane were not stained with α-SMA. Scale bar = 100 μm.
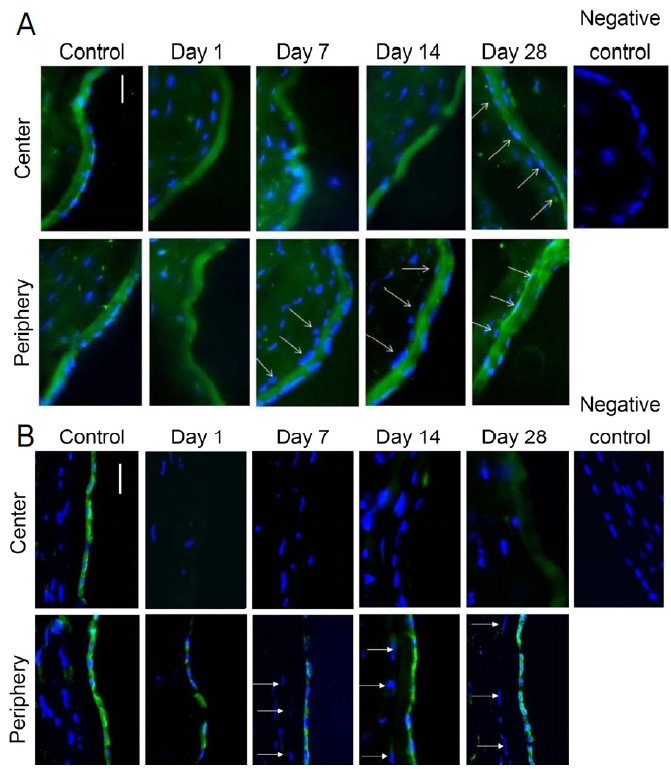
동결절편의 면역형광염색
데스메막은 COL8A2에 대한 항체로 염색하였다(Fig. 4). 손상 1일 후 데스메막의 내측면에서 세포가 관찰되지 않았다. 7일과 14일에 각막내피세포는 데스메막의 중심이 아닌 주변부에서 검출되었으며 28일째에 세포는 데스메막 전체에서 관찰되었다. Na+-K+ ATPase 염색은 데스메막에 있는 세포의 표현형을 조사하기 위해 수행되었다(Fig. 4). 손상 후 7일과 14일에 Na+-K+ ATPase를 발현하는 세포가 데스메막의 주변에서 관찰되었지만 중앙에서는 관찰되지 않았다. 28일째에 Na+-K+ ATPase를 발현하는 세포는 데스메막 전체에서 관찰되었다. 손상 후 1일째에 각막기질세포는 데스메막의 전면에서 검출되지 않았다. 손상 1일 후의 관찰과는 대조적으로, 데스메막의 전방 표면은 각막내피세포와 평행한 각막기질세포로 덮여 있었다(white arrows in Fig. 4).
Transwell system에서 각막내피세포와 각막기질세포 간의 사이토카인 분비 및 상호작용
Transwell system에서 각막내피세포와 각막기질세포 간의 상호작용을 조사하기 위해 사이토카인 분비를 평가하였다(Fig. 5A). TGF-β1은 각막기질세포 또는 각막내피세포의 개별배양보다 각막기질세포 및 각막내피세포의 공동배양에서 더 적게 분비되었다(p=0.008 for both) (Fig. 5B). IL-6 수치는 상부 공배양 chamber보다 하부에서 더 낮았다(p=0.008 for both) (Fig. 5C). 각막기질세포와 각막내피세포의 공배양은 각막기질세포 또는 각막내피세포의 개별배양보다 IL-6를 적게 분비하였다(p=0.001 for both).
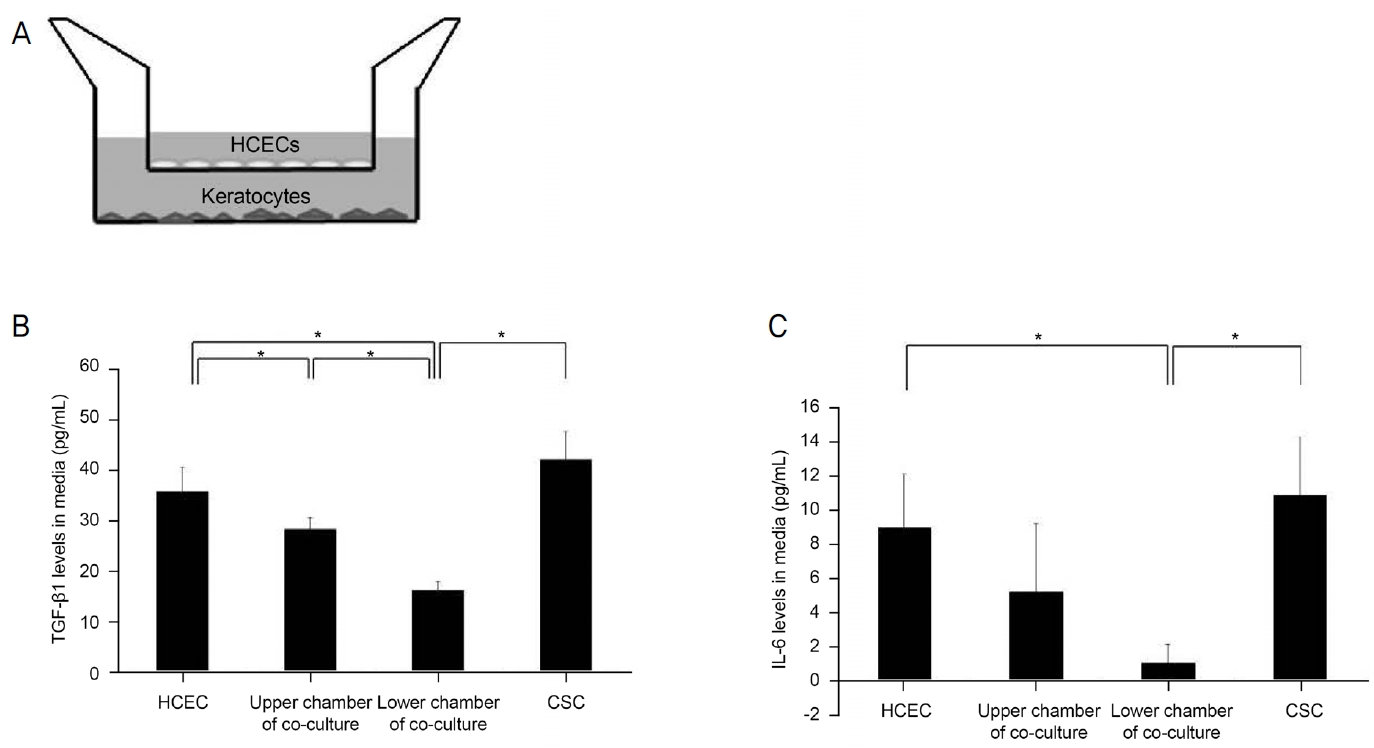
Transforming factor-β1 (TGF-β1) and interleukin-6 (IL-6) concentration in human corneal endothelial cell (HCEC) and corneal stromal cell (CSC) co-cultures or individual cultures. (A) HCEC at the insert membrane in upper chamber and CSC at the bottom in lower chamber. (B) TGF-β1 levels secreted by co-culture of CSCs and HCECs were lower than in individual cultures of CSCs or HCECs (p = 0.008 in both). IL-6 levels in the lower chamber of co-culture were lower than in the upper chamber (p = 0.008 in both). (C) IL-6 levels in co-cultures of CSCs and HCECs were lower than in individual cultures of CSCs or HCECs (p = 0.001 in both). *Statistically significant by Mann-Whitney U test.
상처 치유 분석
각막내피세포의 상처 회복률은 각막내피세포 단독배양에서보다 각막기질세포와 각막내피세포의 공동배양에서 더 높았다(p=0.016, Mann-Whitney U test) (Fig. 6A, B).
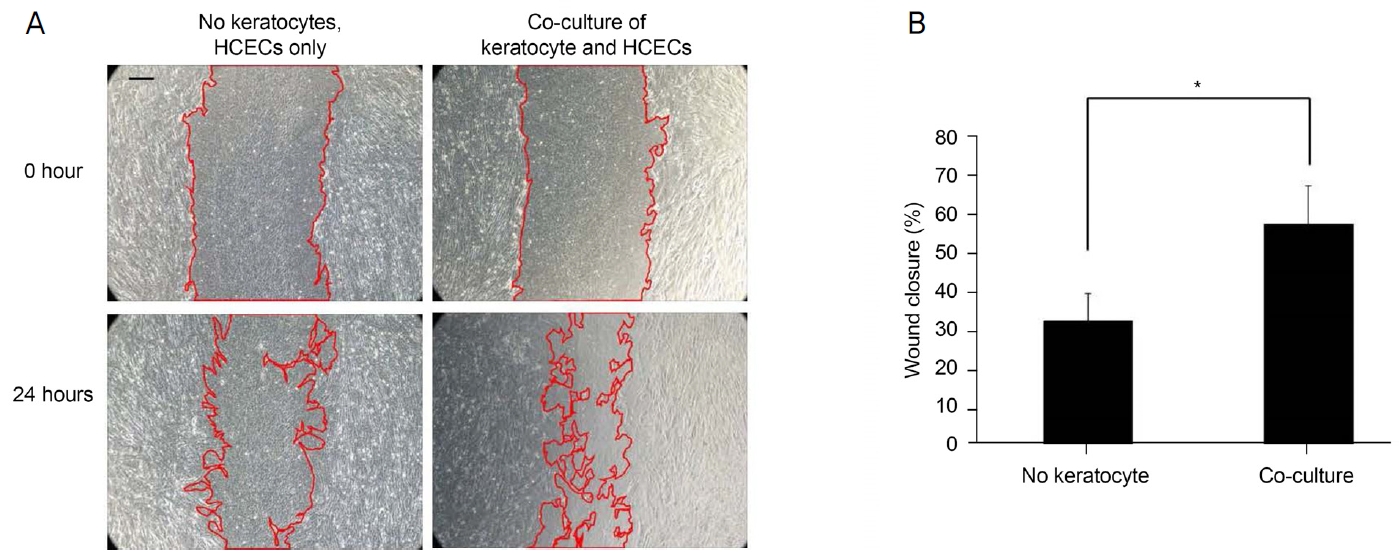
Wound healing assay. (A) Wound closure rate in co-cultures of human corneal endothelial cells (HCECs) and corneal stromal cells (CSCs) was faster than in cultures of HCECs without CSCs. (B) Wound closure rate of HCEC cultures was higher in the co-culture system than in cultures of HCECs without CSCs (p = 0.016). *Statistically significant by Mann-Whitney U test. Scale bar = 100 μm.
고 찰
각막은 3개의 세포층으로 구성되어 있다: 각막상피세포, 각막기질세포 및 각막내피세포는 2개의 무세포층인 보우만층과 데스메막으로 구분된다. 각막기질세포와 각막내피세포는 서로 접촉하고 있지만 이들 세포 간의 동적 상호작용은 조직 형성, 세포외기질 생성 및 상처 치유를 포함한 세포 기능 조절에 중요할 수 있다. 상처 치유에서 상피세포와 각막기질세포의 역할은 보고된 바 있다.30 그러나 각막기질세포와 각막내피세포 간의 상호작용은 아직 완전히 이해되지 않았다. 본 연구에서는 토끼 각막내피손상 실험과 배양세포를 이용한 비손상 실험을 수행하여 각막내피세포와 기질세포의 상호작용을 알아보고자 하였다.
본 연구에서는 화학적으로 토끼 각막내피를 손상시켜 생체 각막내피손상 모델을 만들었다. 기존에 여러 연구에서 각막내피손상 모델이 제시되었는데 이 연구에서 각막상피 쪽의 저온 손상은 토끼 각막에서 각막내피세포를 분리하는 데 사용되었다.31,32 그러나 이 기술은 각막내피박리뿐만 아니라 심각한 각막상피세포 손상 및 전층 기질 손상을 초래할 수 있다. 이에 본 연구에서는 전방에 0.05 N NaOH를 10분 동안 주입하여 토끼의 각막내피손상을 만들었다. 이 방법은 최소한의 상피 및 기질 손상으로 각막내피손상을 유도할 수 있었다. 손상 1일 후 조직학적 검사는 apoptosis 및 각막내피세포의 분리를 입증하였으며, 이는 각막기질세포에서는 관찰되지 않았다. α-SMA에 대한 면역형광염색은 근섬유모세포가 거의 없음을 보여주었다. 이러한 결과는 전방 내 저농도의 NaOH 주입이 기질세포와 조직을 보존하는 각막내피손상의 모델로 작용할 수 있음을 시사한다. 각막부종과 혼탁은 1일째 유의하게 증가한 후 28일째까지 서서히 감소하였으나 완전한 회복은 관찰되지 않았다. 본 연구에서는 중심각막두께를 조직을 떼자마자 측정하였으므로 살아있을 때의 각막두께와 비슷할 것으로 생각되었지만 향후 연구에서는 초음파 각막두께 측정기를 사용하는 것이 좋을 것으로 생각된다. 토끼에서 각막내피손상 후 각막내피의 변화를 평가하기 위해 alizarin S red와 trypan blue를 이용한 vital staining을 시행하였다. 1일째에는 각막 중앙과 주변부에 세포가 보이지 않았으나 7일째에는 각막내피세포가 주변부에서 이동하였다. 이는 각막내피세포가 주변부에서 증식하여 중앙부로 이동하였음을 시사하며, 주변부의 세포가 NaOH 노출에서 살아남을 수 있음을 시사한다. 따라서 주변의 세포는 각막내피손상에 대한 저장소 역할을 할 수 있으며 각막내피세포의 전구세포가 각막내피와 섬유주 사이의 주변에 존재할 수 있다는 연구와 일치한다.33 각막내피 주변부의 전구세포가 노출에 더 저항성이 있을 가능성도 있지만 전방 주변부는 매우 좁고 홍채와 가까우며 홍채에서 확산되는 혈청에 가까운 유속이 존재하여 전방 중앙부보다 보호되는 부분이라 생각된다.34,35 후방 윤부의 각막내피세포는 후방 윤부와 모양체 사이에 위치한 홍채에 의해 보호될 수 있으며, 방수에 존재하는 소량의 혈장 유래 단백질이 모양체 기질에서 홍채 뿌리로 확산되어 홍채 기질에 축적된 후 전방의 방수로 방출되어 홍채 뿌리로 전달된 단백질 중 일부는 즉시 섬유주유출 경로로 들어가기 때문이다.34 또한, 섬유주 근처의 각막내피세포는 화학 물질이 이 영역으로 씻겨 나갈 수 있기 때문에 보호될 수 있다.35 동결절편한 토끼의 각막을 COL8A2 및 Na+-K+ ATPase에 대해 면역형광염색을 수행하였는데 각막내피가 주변부에서 중심으로 회복됨을 관찰되었다. COL8A2에 대한 면역화학염색은 데스메막에 대한 세포 회복의 상대적 위치를 파악하기 위하여 수행되었다. COL8A2는 데스메막의 주요 구성 요소이며 COL8A2의 돌연변이는 각막내피세포의 세포외기질에 분자적 기능장애를 유발한다.36 Na+-K+ ATPase는 각막내피세포에서도 발현되는데 Na+-K+ ATPase 발현은 에너지를 사용하는 각막내피세포의 펌프작용과 관련이 있다.37 동결절편의 면역형광염색에서 각막기질세포는 회복된 각막내피세포에 나란히 위치하였는데 이는 각막내피세포와 각막기질세포 간의 상호작용이 각막내피손상의 상처 치유 동안 중요한 역할을 할 수 있음을 시사한다. 토끼의 각막내피세포는 사람과는 달라서 증식력이 좋고 단백질 발현이 사람과 달라서15 생체 각막내피손상으로 인해 보였던 각막내피와 각막기질세포 사이의 상호작용의 가능성을 체외에서 배양한 사람의 세포를 이용하여 조사해 볼 필요성이 있었다.
본 연구에서는 각막기질세포와 각막내피세포의 상호작용을 조사하기 위해서 Transwell system에서 각막내피세포와 각막기질세포를 배양하였다. 각막내피세포는 Transwell system의 상부의 삽입막에서, 각막기질세포는 하부 챔버에서 각각 배양되었다. 공배양 시스템에서 각막내피세포와 함께 배양된 각막기질세포에 의한 TGF-β1 및 IL-6 분비가 각막내피세포가 없는 각막기질세포에 의한 분비보다 낮았다. TGF-β1은 이 과정의 다음 단계 매개체를 유도하고 섬유모세포에 의한 세포외막의 합성 및 수축을 자극함으로써 상처 치유에 중요한 역할을 하는 사이토카인이다.38 TGF-β1은 matrix metalloprotease (MMP)-9, MMP-2, plasmin 및 thrombospondin 1을 비롯한 여러 자극 인자에 의해 활성화된다.39 MMP-9는 손상에 대한 반응으로 상처치유 과정 중에 발생하는 세포외기질의 리모델링에 기여하는 전염증성 사이토카인이다.40 정상적인 조건에서 각막내피세포는 각막기질세포에 의한 TGF-β1 및 IL-6 분비를 억제할 수 있다. 반대로, 각막내피손상은 각막기질세포에 의한 TGF-β1 및 IL-6 분비를 유도하여 상처 치유에 도움이 될 수 있다. 그러나 TGF-β1은 각막기질세포의 근섬유모세포로의 분화를 촉진하여 깊은 각막혼탁 및 시력상실을 초래할 수 있다. 상층부에서 배양된 각막내피세포에 스크래치를 내어 상처를 내었을 때 각막내피세포의 상처 치유율은 각막기질세포 없이 배양된 각막내피세포에서보다 각막기질세포와 각막내피세포의 공동배양에서 더 높았다. 배지에서 TGF-β1 분비는 공배양에서보다 개별적으로 배양된 각막내피세포에서 더 높았다. 각막기질세포에 의해 분비된 사이토카인은 각막내피세포에 의한 상처 치유를 촉진할 수 있으며, 이는 전염증성 환경과 TGF-β1이 우세한 환경 사이의 정밀한 균형에 따라 달라질 수 있다.40 향후 각막기질세포에서 분비된 TGF-β1 및 IL-6 분비가 각막내피세포 상처 치유에 도움이 될 수 있는지 보는 실험이 필요하다. 배양세포를 이용한 비손상 체외모델이라 하더라도 각막내피가 없을 경우 각막기질세포의 사이토카인 분비의 증가를 보여 생체 내 각막내피가 손상되어 없을 경우 각막기질세포의 반응을 체외에서 반영할 수 있을 것이라 생각하였다. 각막내피에 스크래치를 주는 방법은 상처 치유 효과를 보는 데 많이 사용하는 방법이다.41 본 연구에서는 배양세포 실험에서는 NaOH를 쓰지 않았고 각막내피에 스크래치를 하여 상처 치유를 보았으며 각막기질세포가 있을 때 상처 치유 속도가 빠른 경과를 보였으며 NaOH 노출 후에 각막기질세포가 영향을 받을 수 있을 것으로 생각된다. 그렇더라도 동물실험을 통해 NaOH 노출 후 각막기질세포가 영향이 적은 것을 보였다.
각막기질세포는 각막내피에 필수인자를 제공함으로써 각막의 대사 및 생리학적 항상성을 유지한다.2 손상 후에 각막기질세포와 각막내피세포의 상호작용은 각막내피 질환 또는 각막내피 상처 치유를 하며 각막내피세포와 각막기질세포는 데스메막으로 분리되어 있지만 두 세포 유형 간의 상호작용은 각막기능을 유지하는 데 중요한 역할을 할 수 있다. 결론적으로, 전방 내 저농도의 NaOH 주입은 기질 조직에 최소한의 영향을 미치는 각막내피손상을 일으키며 각막내피손상 및 비손상에서 각막내피세포와 각막기질세포 간의 상호작용은 각막내피의 상처 치유 과정을 향상시키는 데 중요한 역할을 할 것으로 생각된다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
김경욱 / Kyung Wook Kim
Department of Ophthalmology, Hallym University College of Medicine