당뇨망막병증 환자에서 설로덱시드 복용 후 황반하 맥락막두께의 종적인 장기 변화
Long-term Longitudinal Analysis of Subfoveal Choroidal Thickness Following Sulodexide Treatment in Diabetic Retinopathy Patients
Article information
Abstract
목적
당뇨망막병증 환자에서 설로덱시드(sulodexide) 복용 후 황반하 맥락막두께의 2년 장기 변화를 종단면적으로 알아보았다.
대상과 방법
당뇨망막병증 환자에서 설로덱시드 복용 후 2년 이상 경과 관찰한 38안을 대상으로 설로덱시드 복용 전, 복용 후 6개월, 12개월, 24개월의 중심망막두께, 황반하 맥락막두께, 맥락막혈관지수(choroidal vascularity index)를 각각 비교하고 전향적 코호트 방식으로 분석하였다.
결과
전체 환자군에서 설로덱시드 복용 전 황반하 맥락막두께는 216.00 ± 64.23 μm였다. 황반하 맥락막두께는 복용 후 6개월, 12개 월, 24개월에 각각 223.87 ± 62.18 μm, 225.53 ± 62.02 μm, 225.76 ± 63.62 μm로 유의한 증가가 있었다(p=0.0377, p=0.0159, p=0.0135). 설로덱시드 복용 전 중심망막두께는 318.14 ± 102.28 μm였다. 중심망막두께는 복용 후 6개월 313.08 ± 77.47 μm, 12개월 314.97 ± 88.32 μm, 24개월 320.03 ± 97.36 μm로 유의한 증가는 없었다(p=0.904, p=0.736, p=0.892).
결론
설로덱시드 복용 후 2년간 경과 관찰 결과 황반하 맥락막두께는 복용 이후 2년까지 유의하게 증가하였다. 이러한 맥락막두께의 증가는 중심황반두께와는 관련이 없었다.
Trans Abstract
Purpose
To evaluate the two-year longitudinal changes in subfoveal choroidal thickness (CT) following sulodexide treatment in patients with diabetic retinopathy.
Methods
Thirty-eight eyes from patients with diabetic retinopathy, followed for a minimum of two years after sulodexide administration, were included. Subfoveal CT, measured using optical coherence tomography, was analyzed prospectively. Variables including age, sex, duration of diabetes mellitus, HbA1c, blood pressure, sulodexide treatment duration, refractive error, axial length, central macular thickness (CMT), visual acuity, laser photocoagulation, and intravitreal anti-vascular endothelial growth factor injections were evaluated for potential effects on CT. CMT, subfoveal CT, and choroidal vascularity index were compared at baseline and at 6, 12, and 24 months after sulodexide.
Results
Of the 38 eyes, 10 belonged to males and 28 to females. The mean data were as follows: age, 67.18 ± 8.87 years; duration of diabetes, 18.11 ± 7.57 years; HbA1c, 8.76 ± 1.60 mmol/L; systolic blood pressure, 134.69 ± 14.68 mmHg; diastolic blood pressure, 73.72 ± 11.90 mmHg; duration of sulodexide, 25.79 ± 3.17 months; refractive error, 0.22 ± 2.19 diopters (D); and axial length, 23.32 ± 0.89 mm. During the observation period, 15 eyes underwent laser photocoagulation and 17 eyes received intravitreal anti-vascular endothelial growth factor injections. The mean subfoveal CT was 216.00 ± 64.23 μm before sulodexide administration and increased to 223.87 ± 62.18 μm, 225.53 ± 62.02 μm, and 225.76 ± 63.62 μm at 6, 12, and 24 months, respectively (p = 0.0377, p = 0.0159, p = 0.0135). The CMT was 318.14 ± 102.28 μm initially and changed to 313.08 ± 77.47 μm, 314.97 ± 88.32 μm, and 320.03 ± 97.36 μm at the aforementioned intervals, with no significant variation (p = 0.904, p = 0.736, p = 0.892).
Conclusions
Sulodexide administration led to a significant rise in subfoveal CT over a 2-year follow-up. This change in CT was not mirrored in the CMT.
당뇨망막병증은 전세계적으로 시력상실의 주요 원인이다. 전 세계적으로 2억 8,500만 명가량의 당뇨병 환자들이 있으며, 이들 중 1/3 이상이 당뇨망막병증의 증상을 가지고 있고, 당뇨망막병증 환자의 1/3 이상이 당뇨황반부종을 포함한 시력상실을 유발하는 당뇨망막병증의 합병증을 가지고 있다.1,2
당뇨망막병증이 시작되면, 초기 단계에서 고혈당증과 비정상적인 대사경로로 인해서 신경조직에 산화스트레스(oxidative stress)를 유발하고 신경 퇴행이 시작된다.3 이때 혈관내피세포의 손상, 미세동맥류의 발달, 점성 망막출혈 등이 나타나고 이것이 비증식성 당뇨망막병증의 특징이다.3 이외에도 여러가지 염증성 사이토카인과 혈장단백질이 유출되면서 경성 삼출물이 발생하고, 모세혈관이 수축 및 폐색되면서 모세혈관 비틀림과 망막 허혈을 유발한다.3 이로인한 망막 저산소증으로 망막신생혈관, 유리체출혈 및 망막앞출혈, 섬유화증식 및 견인 망막박리 등이 발생되어 심각한 시력 저하를 유발하고 이것이 증식성 당뇨망막병증의 특징이다.4
설로덱시드(sulodexide; Vessel Due F®, Aju Pharm, Seoul, Korea)는 당뇨망막병증에서 사용되고 있다.5-7 설로덱시드는 혈관벽의 구성 요소중 하나인 글리코사미노글리칸(glycoaminoglycans) 으로 heparan sulfate (80%)와 dermatan sulfate (20%)로 구성되어 있다.8,9 Weiss et al10과 Coccheri and Mannellol11의 연구에서 설로덱시드를 경구 복용하면 소화 기관에서 N-아세틸-D-글루코사민으로 분해되어 글리코사미노글리칸 합성에 이용 가능한 전구물질을 증가시켜 혈관벽을 보호한다고 한다.
당뇨병의 합병증으로 발생하는 말초동맥 질환, 심혈관계 질환, 신장 질환에서 설로덱시드의 혈관 보호에 대한 작용 기전과 효과에 대해서는 이전 연구에서 수차례 보고된 바 있다. Constantinescu et al12의 연구에 따르면 설로덱시드가 글리코사미노글리칸 합성을 증가시키고, 이는 심혈관계 질환에서 혈관벽의 글리코칼릭스를 회복시켜 준다고 한다. 즉, 설로덱시드 복용은 내피 및 혈관 투과성을 회복시키고, 백혈구의 부착력과 누출을 억제시켜 질병의 염증을 감소시키는 효과를 가진다.13 항염증이외에도 설로덱시드는 항전 작용이 있는 것으로 알려져 있다. Bignamini et al14의 연구에서는 설로덱시드가 헤파라나제의 억제제로서 작용하여 혈전 생성을 억제하는 것으로 알려져 있다. 이외에도 최종 당화 산물 관련 신호 전달의 감소, 혈관벽 경직의 진행 방지, 혈관내피성장인자 합성을 억제한다고 한다. 당뇨망막 병증 환자에서 설로덱시드의 망막혈관내피세포 보호 효과에 대한 연구도 여러 차례 진행되었으나,6,7,15 안구에서 혈관이 가장 풍부한 맥락막에 설로덱시드가 어떤 영향을 미치는가에 대한 국내외 연구는 현재까지 보고된 적이 없다.
당뇨망막병증에서 맥락막의 변화에 대해서는 여러 연구들이 진행되었다. Kim et al16의 연구에서는 비증식성 당뇨 망막병증에서 증식성 당뇨망막병증으로 질병이 진행하면서 맥락막의 두께는 유의하게 증가하며, 당뇨황반부종이 있는 경우에 맥락막두께가 가장 두껍다고 하였다. 그러나 Wang et al17의 연구에서는 이와 반대로 당뇨망막병증의 초기에는 맥락막두께가 증가하지만 질병이 진행함에 따라 맥락막두께는 오히려 감소하고, 당뇨황반부종과 맥락막두께는 유의한 관련성이 없다는 정반대의 결과를 발표하였다. Lee et al18과 Zhang et al19은 유리체강 내 항혈관내피성장인자(anti-vascular endothelial growth factor, VEGF) 주입술 혹은 범망막레이저광응고술 시행 이후 맥락막두께는 감소하였다고 하였다.
본 연구에서는 설로덱시드를 복용한 당뇨망막병증 환자의 황반하 맥락막두께와 맥락막혈관지수(choroidal vascularity index, CVI), 중심황반두께를 6개월, 12개월, 24개월에 걸쳐 측정하였다. 설로덱시드 복용이 당뇨망막병증 환자의 맥락막에 영향을 미쳤는지를 알아보고, 이러한 맥락막의 변화가 중심황반두께와는 관련성이 있는지를 살펴보았다.
대상과 방법
2018년 12월부터 2020년 8월까지 고신대학교 의과대학 복음병원에서 당뇨망막병증을 진단받고 최소 24개월 이상 경과 관찰이 가능하였던 환자 20명 38안을 대상으로 코호트 연구를 진행하였다. 본 연구는 헬싱키선언을 준수하였으며, 고신대학교 복음병원 의학연구윤리심의위원회(Institutional Review Board, IRB)의 승인 하에 진행되었다(승인번호:2018-08-004).
당뇨병으로 치료받고 있는 환자 중 안과에서 형광안저혈관조영에서 당뇨망막병증으로 진단받은 환자를 대상으로 하였다. 당뇨망막병증은 비증식성 당뇨망막병증, 증식성 당뇨망막병증을 모두 포함하였다. 다만 초진 당시부터 수술이 필요하였던 증식성 당뇨망막병증은 제외하였다. 이외에도 맥락막에 영향을 줄 수 있는 안내 질환으로 녹내장, 유전성 망막변성, 황반변성이 있는 환자는 제외하였다. 이 환자들 중 해당 기간 동안 설로덱시드를 24개월 이상 복용한 환자를 본 연구에 포함하였다. 연구에 포함된 환자들이 연구 기간 내에 맥락막에 영향을 줄 수 있는 유리체수술, 백내장수술, 유리체강 내 주사 혹은 레이저광응고술을 시행받은 경우에는 이 수술 혹은 시술들을 시행한 이후 3개월 간의 데이터를 제외하였다.
당뇨망막병증 환자를 설로덱시드 복용 전, 복용 후 6개월, 복용 후 12개월, 복용 후 24개월에 경과를 관찰하였다. 초진 시 최대교정시력, 세극등현미경검사, 안저검사, 형광안저혈관조영술, 빛간섭단층촬영, 혈압 측정, 자동굴절검사, A-scan 초음파를 시행하였다. 경과 관찰할 때는 최대교정시력, 세극등현미경검사, 안압측정, 안저검사, 빛간섭단층촬영을 시행하였다.
최대교정시력은 진용한시력표(J5, JV institute, Seoul, Korea)로 측정하였고, 통계 처리를 위해 logarithm of minimal angle of resolution (logMAR) 시력으로 변환하였다(변환식은 다음과 같다: logMAR시력=-log스넬렌시력). 세극등현미경 검사 및 안저검사는 BQ900 (Hagg-Streit, Köniz, Switzerland)을 이용하였다. 형광안저혈관조영은 HRA Spectralis (Heidelberg Engineering, Heidelberg, Germany)를 이용하여 시행하였다. 빛간섭단층촬영(optical coherence tomography, OCT)은 HRA Spectralis (Heidelberg Engineering, Heidelberg, Germany) OCT의 enhanced depth imaging 모드를 이용하여 검사하였다. 혈압검사는 BPA100 (Onbo Electronic, Shenzhen, China)을 이용하여 측정하였다. 자동굴절검사는 RK-F2 (Canon, Tokyo, Japan)를 이용하여 시행하였다. A-scan 초음파는 Compact Touch (Quantel Medical, Clermont-Ferrand, France)를 이용하였다.
맥락막두께 측정은 중심와를 관통하는 선형 수평 스캔을 이용하여 부루크막의 고반사선 외측에서 맥락막-공막 경계(chorioscleral interface)의 내측 고반사선까지 수직선을 그어 측정하였다(Fig. 1A).20 맥락막의 두께는 황반하, 비측으로 500 μm, 이측으로 500 μm 각각 떨어진 지점을 측정하여 그 평균을 사용하였다. 측정 방법은 내장된 캘리퍼를 이용하여 두 명의 측정자가 독립적으로 측정한 뒤 맥락막두께를 평균하여 측정치를 도출하였다. 중심황반두께 측정은 빛간섭단층촬영의 fast macular mode 검사에서 측정된 반경 500 μm의 중심황반두께를 사용하였다.
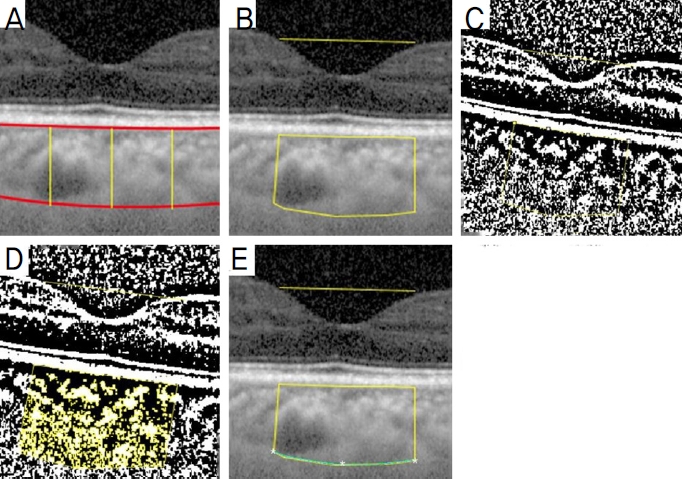
Examples of measured SFCT and CVI. (A) Draw a vetical line from the OHRL of the BM to the IHRL of the chorioscleral interface at subfoveal, 500 μm nasal, 500 μm temporal site. (B) Draw a line along the OHRL of the BM between the nasal and temporal site 750 μm away from subfovea, and draw a straight line from both end points perpendicular to the IHRL of the chorioscleral interface, and draw a line between the two endpoints along the IHRL of the chorioscleral interface. (C) Binarization was performed using Niblack mode, and the area of the choroid within this polygon was defined as TCA. (D) The binarized image was converted back to an RGB image so that the color thresholding tool could select dark pixels, the area showing dark pixels was defined as LA. (E) Draw a line along the IHRL of the chorioscleral interface between the nasal and temporal site 750 μm away from subfovea, and the curvature was measured at center and end point of that line (white asterisks). SFCT = subfoveal choroidal thickness; CVI = choroidal vascularity index; OHRL = outer hyperreflective line; BM = bruch’s membrane; IHRL = inner hyperreflective line; TCA = totcal choroial area; LA = luminal area.
맥락막혈관지수(CVI)는 Image J version 1.47 (National Institute of Health, Bethesda, MD, USA)를 이용하여 시행한 OCT 영상을 이진화로 변환하였다. 먼저 황반으로부터 비측과 이측으로 각 750 μm 지점까지 브루크막의 고반사선을 따라서 선을 긋는다. 양 끝점으로부터 수직으로 맥락막공막 경계부의 내측 고반사선까지 직선을 긋고, 양 끝점 사이로 맥락막공막 경계부의 내측 고반사선을 따라서 선을 긋는다(Fig. 1B). Niblack 모드를 통해 이진화를 시행하고 이 다각형 안에 들어간 맥락막 영역의 넓이를 총 맥락막 면적(total choroidal area, TCA)으로 정의하였다(Fig. 1C). 이 진화된 이미지를 다시 red, green, blue 이미지로 변환하여 색상 임계값 도구가 어두운 픽셀을 선택할 수 있도록 하였다(Fig. 1D). 어두운 픽셀을 보이는 영역의 넓이를 맥락막혈관 영역 넓이(luminal area, LA)로 정의하였다. 맥락막혈관 영역 넓이(LA)의 총 맥락막 면적(TCA)에 대한 비율을 맥락막혈관지수(CVI)로 다음과 같이 정의하였다(CVI=LA/TCA).21
맥락막곡률(choroidal curvature, CC)은 Image J version 1.47 (National Institute of Health)을 이용하였다. 곡면 또는 곡선 상의 임의의 위치에서 이 지점을 지나는 곡선과 같은 정도로 휘어지는 가상적인 원을 그렸을 경우, 이 가상적인 원의 중심을 곡률 중심으로 정의하고, 곡률 중심가지의 거리를 곡률 반지름으로 정의한다. 곡률은 기하학에서 공간 도형이 휜 정도를 나타내며, 곡률 반지름의 역으로 정의된다. 따라서 곡률이 더 커지면 공막과 맥락막의 경계선이 황반하에서는 더 아래쪽으로, 주변부에서는 더 위쪽으로 이동하게 될 것으로 생각된다. 분석에 사용한 OCT 영상을 Kappa-Curvature Analysis를 이용하여 곡률을 측정하였다. CVI를 측정할 때와 마찬가지로 황반으로부터 비측과 이측으로 각 750 μm 지점까지 맥락막 공막 경계부의 내측 고반 사선을 따라서 선을 긋고 황반하, 비측과 이측으로 각 750 μm 떨어진 지점에서의 곡률을 측정하였다(Fig. 1E).
맥락막두께에 따라 두꺼운 군과 얇은 군으로 나누어 설로덱시드 복용 후의 변화를 분석하였다. 두 군을 나누는 기준점은 설로덱시드 복용 전 황반하 맥락막두께의 평균인 216.34 μm를 기준으로 이보다 얇은 군과 두꺼운 군으로 나누었다. 이외에도 환자의 나이, 성별, 당뇨병 이환 기간, 당화혈색소수치, 수축기 및 이완기 혈압, 유리체강 내 주사와 레이저광응고술의 횟수를 조사하였다.
분석은 SPSS ver. 18.0 (SPSS Inc., Chicago, IL, USA)을 이용하여 Wilcoxon signed rank test, paired t-test, repeated measured analysis of variance로 비교하였고, p-value가 0.05 미만이면 통계적으로 의의가 있는 것으로 정의하였다. 그래프는 Prism v.7.04 (GraphPad, Boston, MA, USA)를 사용하여 작성하였다.
결 과
연구에 포함된 전체 20명(38안) 중 남자는 10안(26%), 여자는 28안(74%)이었으며 평균 나이는 67.18 ± 8.87세였다. 평균 당뇨병 이환 기간은 18.11 ± 7.57년이었으며 평균 당화혈색소 수치는 8.76 ± 1.60 mmol/L, 평균 수축기 혈압은 134.69 ± 14.68 mmHg, 이완기혈압은 73.72 ± 11.90 mmHg였다. 평균 설로덱시드 복용 기간은 25.79 ± 3.17개월이었다. 초진 시 평균 최대교정시력은 0.42 ± 0.44 logMAR였다. 평균 안축장 길이는 23.32 ± 0.89 mm였다. 관찰 기간 내 범망막 레이저광응고술을 시행한 경우는 15안(39%)이며 유리체강 내 anti-VEGF 주사를 시행한 경우는 17안(45%)이었다(Table 1).
전체 환자군에서 설로덱시드 복용 전 황반하 맥락막두께는 216.00 ± 64.23 μm였다. 황반하 맥락막두께는 복용 후 6개월 223.87 ± 62.18 μm, 12개월 225.53 ± 62.02 μm, 24개월 225.76 ± 63.62 μm로 유의하게 증가되었다(p=0.0377, p=0.0159, p=0.0135) (Fig. 2A). 설로덱시드 복용 전 중심황반두께는 318.14 ± 102.28 μm였다. 중심황반두께는 복용 후 6개월 313.08 ± 77.47 μm, 12개월 314.97 ± 88.32 μm, 24개월 320.03 ± 97.36 μm로 유의한 증가는 없었다(p=0.904, p=0.736, p=0.892) (Fig. 2B). 설로덱시드 복용 전 최대교정시력은 0.42 ± 0.44 logMAR였다. 최대교정시력은 복용 후 6개월 0.39 ± 0.44 logMAR, 12개월 0.41 ± 0.43 logMAR, 24개월 0.49 ± 0.51 logMAR로 유의한 변화는 없었다(p=0.372, p=0.720, p=0.194).

Changes over time after taking sulodexide. (A) Choroidal thickness was significantly increased at 6, 12 and 24 months on sulodexide. (B) But CMT showed no significant change over the same period. CT = choroidal thickness; CMT = central macular thickness. *p<0.05, p-value was calculated by repeated measured analysis of variance.
황반하 맥락막두께에 따라 얇은 군과 두꺼운 군으로 나누어 분석해 보았다. 설로덱시드 복용 전 황반하 맥락막두께가 전체 모집단의 평균인 216.34 μm 미만인 군은 22안, 황반하 맥락막두께가 216.34 μm 이상인 군은 16안이었다. 맥락막두께가 얇은 군은 설로덱시드 복용 전 173.79 ± 26.56 μm, 복용 후 6개월 184.39 ± 33.66 μm, 12개월 186.47 ± 32.69 μm, 24개월 188.88 ± 43.05 μm로 유의한 증가가 있었다(p=0.008, p=0.004, p=0.019) (Fig. 3A). 그러나 맥락막이 두꺼운 군은 설로덱시드 복용 전 275.42 ± 52.92 μm, 복용 후 6개월 278.17 ± 50.22 μm, 12개월 279.25 ± 54.16 μm, 24개월 276.48 ± 51.50 μm로 유의한 증가는 없었다(p=0.234, p=0.717, p=0.717) (Fig. 3B).
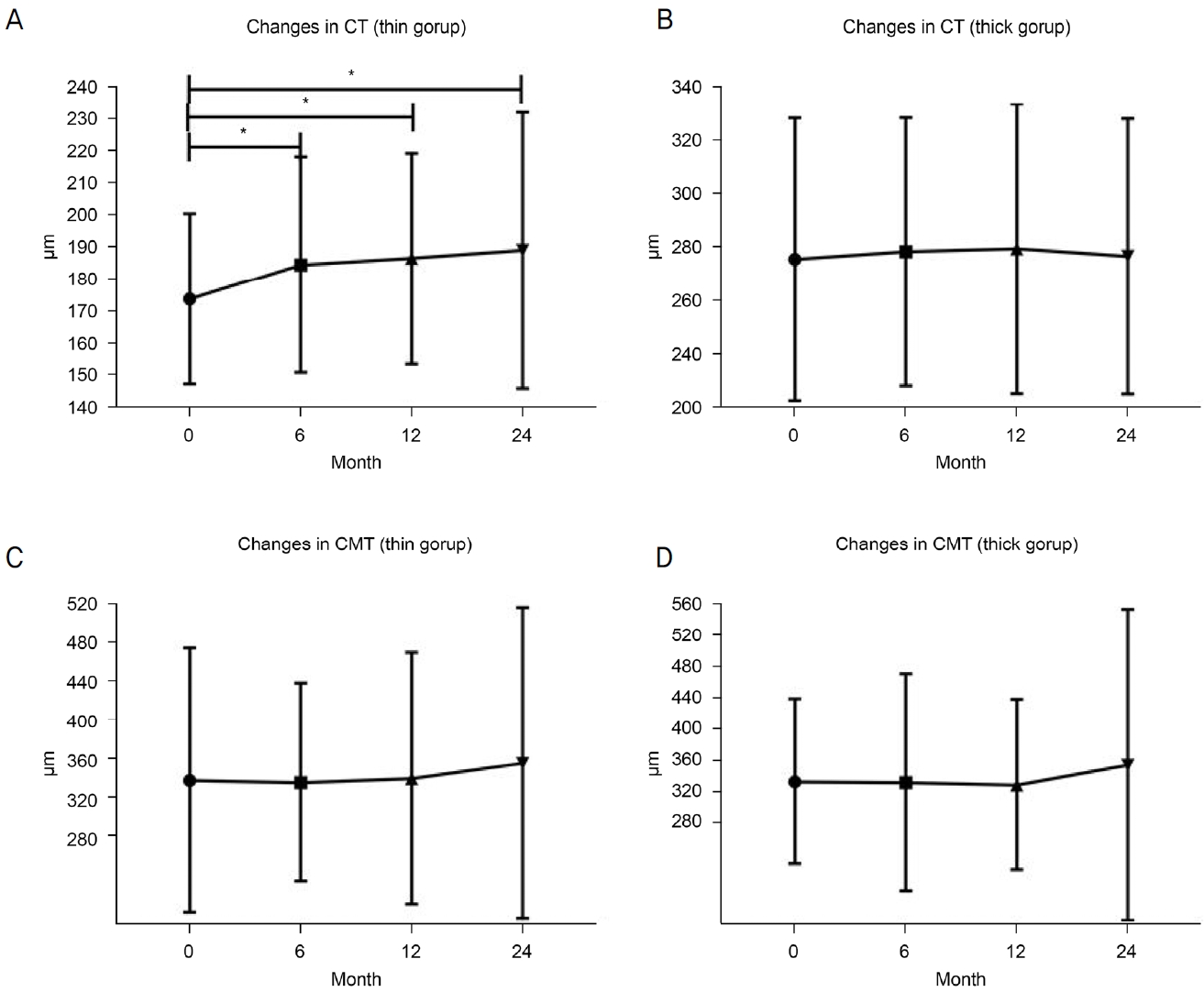
Changes over time after taking sulodexide in thin and thick groups. (A, B) A significant increase was observed in the group with thinner rather than thicker initial choroid. (C, D) There was no significant change in CMT over the same period in either the thin or thick groups. CT = choroidal thickness; CMT = central macular thickness. *p<0.05, p-value was calculated by W ilcoxon signed rank test.
초기 맥락막이 얇은 군과 두꺼운 군의 중심황반두께는 각각 복용 전 337.32 ± 136.26 μm, 331.44 ± 105.95 μm, 복용 후 6개월 337.32 ± 102.12 μm, 330.44 ± 139.11 μm, 12개월 339.18 ± 129.63 μm, 327.38 ± 109.55 μm, 24개월 355.14 ± 160.24 μm, 352.75 ± 199.09 μm로 두 군 모두에서 유의한 증가는 없었다(Fig. 3C, D).
맥락막혈관지수(CVI)는 설로덱시드 복용 전 0.6473 ± 0.0453, 복용 후 6개월 0.6518 ± 0.0507, 복용 후 12개월 0.6463 ± 0.0544, 복용 후 24개월 0.6476 ± 0.0662로 유의한 변화가 없었다(p=0.309, p=0.868, p=0.948) (Fig. 4A). 맥락막혈관넓이(LA)는 설로덱시드 복용 전 0.67 ± 0.23 mm2, 복용 후 6개월 0.66 ± 0.21 mm2, 복용 후 12개월 0.68 ± 0.23 mm2, 복용 후 24개월 0.64 ± 0.23 mm2로 유의한 변화가 없었다(p=0.335, p=0.607, p=0.073) (Fig. 4B). 총 맥락막 면적(TCA)은 설로덱시드 복용 전 1.05 ± 0.38 mm2, 복용 후 6개월 1.02 ± 0.34 mm2, 복용 후 12개월 1.07 ± 0.36 mm2로 유의한 변화는 없었으나(p=0.346, p=0.607) 복용 후 24개월 1.00 ± 0.36 mm2로 유의하게 감소하였다(p=0.049) (Fig. 4C).
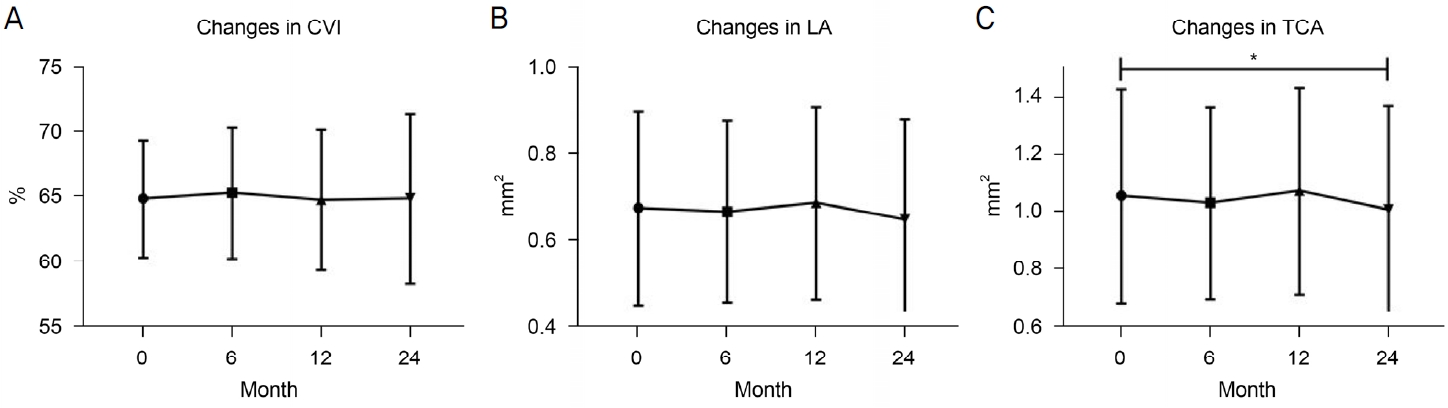
Changes over time after taking sulodexide. (A, B) CVI and LA showed no significant change at 6, 12 and 24 months on sulodexide. (C) TCA showed no significant change at 6 and 12 months on sulodexide but was decreased significantly at 24 months. CVI = choroidal vascularity index; LA = luminal area; TCA = total choroidal area. *p<0.05, p-value was calculated by repeated measured analysis of variance.
황반하 맥락막곡률(subfoveal CC)은 설로덱시드 복용 전 0.00465 ± 0.00499 μm-1, 복용 후 6개월 0.00506 ± 0.00440 μm-1, 복용 후 12개월 0.00527 ± 0.00397 μm-1, 복용 후 24개월 0.00725 ± 0.00624 μm-1로 유의한 증가가 있었다(p=0.01, p<0.001, p<0.001). 황반하로부터 비측으로 750 μm 떨어진 지점의 맥락막곡률(nasal CC)은 설로덱시드 복용 전 0.00403 ± 0.00368 μm-1, 복용 후 6개월 0.00430 ± 0.00347 μm-1로 유의한 변화는 없었으나(p=0.280) 복용 후 12개월 0.00474 ± 0.00396 μm-1, 복용 후 24개월 0.00505 ± 0.00486 μm-1로 유의하게 증가하였다(p=0.01, p=0.012). 황반하로부터 이측으로 750 μm 떨어진 지점의 맥락막곡률(temporal CC)은 설로덱시드 복용 전 0.00476 ± 0.00529 μm-1, 복용 후 6개월 0.00462 ± 0.00519 μm-1로 유의한 변화는 없었으나(p=0.479) 복용 후 12개월 0.00514 ± 0.00545 μm-1, 복용 후 24개월 0.00589 ± 0.00634 μm-1로 유의하게 증가하였다(p=0.019, p=0.001).
고 찰
본 연구에서 설로덱시드 복용 후 당뇨망막병증 환자의 맥락막두께를 2년간 관찰하였을 때, 복용 전과 비교하여 황반하 맥락막두께는 복용 후 6개월, 12개월, 24개월에 모두 유의한 증가를 보였다. 특별히 초기 맥락막이 두꺼운 군보다는 얇은 군에서 유의한 증가가 관찰되었다. 그러나 이러한 맥락막의 변화는 중심황반두께에는 영향을 주지 않았다.
당뇨망막병증 환자에서 맥락막의 두께 변화에 대해서는 다수의 연구에서 상반된 결과를 보고하고 있다. 관련된 논문들을 cross-section과 longitudinal한 연구 디자인으로 나누어 살펴보면 다음과 같다. Wang et al17, Querques et al22, Park et al23들은 다양한 단계의 당뇨망막병증 환자를 대상으로 cross-section 연구를 진행하였다. 당뇨망막병증이 없는 대조군보다 당뇨망막병증이 있는 눈에서, 비증식성 당뇨망막병증보다 증식성 당뇨망막병증이 있는 눈에서 맥락막두께가 더 얇다고 하였다. 즉, 당뇨망막병증이 진행되면서 맥락막두께는 더 얇아진다는 결론을 도출하였다. 그러나 동일한 cross-section 연구인 Gupta et al24과 Kim et al16 의 연구에서는 경도의 비증식성 당뇨망막병증에서 증식성 당뇨망막병증으로 진행하면서 맥락막두께가 두꺼워지는 경향이 있다고 보고하였다. 연구 디자인이 longitudinal한 경우를 살펴보면, Lee et al18은 당뇨망막병증 환자에게 anti-vegf injection, panretinal photocoagulation (PRP) 시행 1달 이후 시행 전과 비교하였을 때 맥락막두께가 감소하였다고 하였다. Sonoda et al25의 연구에서는 diabetic macular edema (DME)가 있는 당뇨망막병증 환자에게 intravitreal triamcinolone injection 시행 3개월 이후 시행 이전과 비교해서 맥락막두께가 유의하게 감소하였다고 하였다. Zhang et al19, Russel et al26의 longitudinal 연구들에서는 당뇨망막병증 환자에게 PRP를 시행하고 3달 후 맥락막두께가 시행 이전보다 유의하게 감소하였다고 하였다. Nourinia et al27의 연구에서는 diabetic macular edema (DME)가 있는 당뇨망막병증 환자에게서 anti vegf-injection을 4주 간격으로 3회 시행 이후 6개월간 longitudinal하게 맥락막두께를 측정하였는데 시행 이전과 비교하였을 때 3개월, 6개월 이후 맥락막두께는 유의하게 감소하였다고 하였다. 본 연구는 2년이라는 장기간 동안 추적 관찰을 시행한 longitudinal 연구라는 점에서 가장 유사한 Nourinia et al27의 연구에서는 시간이 지나면서 맥락막두께가 감소하였고 중심황반두께도 감소한다고 하였다. 그러나 본 연구에서는 설로덱시드 복용 이후 시간이 지나면서 맥락막두께가 증가하였다.
당뇨망막병증에서 맥락막의 두께가 감소하는 것은 망막색소상피와 망막외층의 저산소증과 관련성을 언급하고 있다.28,29 Gupta et al24의 연구에서 당뇨망막병증이 진행하면서 맥락막혈관넓이(LA)가 감소하면서 망막색소상피에 저산소증이 생기고, 맥락막혈관지수(CVI) 또한 감소한다는 결과를 발표하였다. Ghassemi et al30의 연구에서는 당뇨망막병증이 없는 눈에서 비증식성 당뇨망막병증으로 질병이 진행하면서 맥락막두께가 얇아지는 이유를 맥락막모세혈관의 가늘어짐뿐만 아니라 크고 작은 혈관의 폐색으로 인해 발생한 망막색소상피와 망막외층의 저산소증, 위축 때문으로 보았다.
본 연구에서는 설로덱시드를 복용한 후에 당뇨망막병증 환자의 맥락막두께가 2년째까지 유의하게 증가되는 것을 확인하였다. 이는 기존의 당뇨망막병증으로 인한 맥락막의 변화를 장기간 연구한 것과는 다른 결과이다. 이러한 결과는 설로덱시드 복용으로 인해 당뇨망막병증에서 장기간의 관찰에서 관찰되었던 맥락막두께 감소를 상쇄하였을 가능성이 있다. 특별히, 설로덱시드 복용 후 24개월까지 맥락막혈관지수(CVI)와 맥락막혈관넓이(LA)의 유의한 변화가 없이 맥락막두께가 두꺼워졌다. 이러한 점은 당뇨망막증에서 발생할 수 있는 망막색소상피와 망막외층에 발생할 수 있는 저산소증을 감소시킬 수 있는 가능성을 보여주고 있다. 설로덱시드 복용 24개월 후 총 맥락막 면적(TCA)의 유의한 감소가 있었으나, 맥락막혈관지수(CVI)는 유의한 변화가 없었던 것은 맥락막혈관넓이(LA)가 유의하지는 않지만 감소하는 경향이 있었기 때문으로 생각된다. 총 맥락막 면적(TCA)은 감소하지만 맥락막두께가 증가하는 이유로 맥락막의 두께가 황반하에서는 두꺼워지지만, 주변부에서는 감소한다는 가설을 세울 수 있다. 이러한 가정이 맞는지 확인하기 위해 황반하, 비측과 이측으로 750 μm 떨어진 지점의 맥락막곡률을 측정하였고 그 결과 황반하 맥락막곡률은 유의하게 증가하였다. 이런 사실을 기반으로 저자들이 가정한 황반하 맥락막두께는 증가하였으나, 주변부는 상대적으로 감소할 가능성이 높을 것으로 사료된다.
설로덱시드가 어떤 기전으로 맥락막두께를 증가시키는가에 대해서는 아직까지 알려진 바가 없다. 대략, 세 가지 정도의 가설이 현재까지 소개되고 있다. 그 첫째는 혈관벽의 글리코칼릭스를 보호하는 작용을 통해서 혈관벽을 보호하는 것이다. 설로덱시드를 경구 복용하면 소화기관에서 N-아세틸-D-글루코사민으로 분해되어 글리코사미노글리칸 합성에 이용 가능한 전구물질을 증가시킨다.10,11 증가된 글리코사미노글리칸 합성은 혈관벽의 주요한 요소인 글리코칼릭스를 온전한 상태로 회복시키는 데 도움을 주어 혈관벽을 보호한다.12 글리코칼릭스(glycocalyx)는 혈관내피의 내강을 덮고 있는 젤리형의 층이며, 세포 외부 혹은 내피세포와 연관된 프로테오글리칸, 당단백 그리고 흡수된 혈장 단백질과 함께 구성되어 있다.31 쥐에게 당뇨병과 고혈압을 일으켰을 때 안구의 망막과 맥락막에 있는 모세혈관 글리코칼릭스 두께가 얇아진다는 사실이 보고되었다.32 Nieuwdorp et al33,34의 연구에서 고혈당 상태가 지속되면 글리코칼릭스가 분해된다는 결과를 발표하였는데 1형 당뇨병 환자의 글리코칼릭스의 부피가 정상 대조군과 비교하였을 때 절반 정도로 감소하였다는 점으로 이를 뒷받침하였다.
두 번째는 설로텍시드가 항염증 작용을 통하여 혈관벽을 보호한다는 가설이다. 당뇨병과 같은 혈관 질환에서는 글리코칼릭스가 분해되어 혈관내피 및 혈관 투과성을 바꾸고, 백혈구의 부착력과 누출을 증가시켜 질병의 염증 요소를 증가시키는 것으로 알려져 있다.13 당뇨병 환자에서 만성적인 고혈당은 단백질과 지방의 당화를 유발하고 이때 최종당화산물(advanced glycation end-product, AGE)이 생성되는데, 최종당화산물은 그 수용체(receptor of AGE, RAGE)의 활성화를 통해 전신적인 산화스트레스와 염증을 증가시킨다.35 이러한 염증을 설로덱시드가 감소시키는 것으로 보고하고 있다.36,37 Giurdanella et al15의 연구에서 설로덱시드가 AGE에 의한 RAGE의 활성화를 막아서 고혈당에 의한 손상으로부터 사람의 망막내피세포를 보호한다는 연구 결과가 보고된 바 있다. 이와 같은 다수의 연구들이 설로덱시드의 항염증작용을 통하여 혈관내피세포를 보호한다고 보고하였다.
또 한 가지 가능성 있는 기전으로 설로덱시드에 의한 맥락막혈관의 확장이다. Raffetto et al38은 설로덱시드는 혈관내피의존성 산화질소를 생성하여 동맥 이완을 촉진하고 이렇게 유도된 동맥의 이완은 혈관확장을 촉진하고 혈관수축을 감소시키는 것을 확인하였다. 이러한 기전에 의하면 설로덱시드 복용 후에 맥락막혈관이 확장되고 이로 인해 맥락막혈관지수가 증가할 수 있다. 그러나 본 연구에서는 CVI와 LA가 유의한 변화가 관찰되지 않아 이러한 혈관확 장 기전과는 거리가 있을 것으로 생각한다.
본 연구에서 맥락막이 얇은 군과 두꺼운 군으로 나누어 분석해 보았을 때, 초기 맥락막이 얇은 군에서 설로덱시드 복용 후에 맥락막의 두께가 유의하게 증가하였지만, 두꺼웠던 군은 유의한 증가가 관찰되지 않았다. 초기 맥락막의 두께가 얇은 군에서 맥락막의 증가가 유의하게 발생한 이유에 대해서는 추가적인 연구가 필요하겠다.
맥락막두께에 영향을 줄 수 있는 다른 인자들로는 나이, 안축장 길이, 혈압, 굴절이상, 일간변동 등 매우 여러 가지가 있다.39 본 연구에서는 동일한 사람의 설로덱시드 복용 전후를 비교하였고, 맥락막의 투과성에 영향을 줄 수 있는 유리체강 내 anti-VEGF 주입술, 범망막레이저광응고술 시행 3개월 이내의 자료는 제외하였다. 그러나 일간의 변동, 여성에서의 생리주기 등을 고려할 수 없는 것은 본 연구의 한계점으로 작용할 수 있다. 또한 2년의 장기 연구로 인해 연구 시작 시의 당뇨망막병증의 단계와 종료 시의 단계가 변화한 경우도 있으나 이에 대해 따로 분석하지 못한 것도 본 연구의 제한점으로 작용할 수 있다. 당뇨망막병증을 longitudinal하게 관찰하면서 맥락막의 두께를 측정하였던 대부분의 연구에서 범망막레이저광응고술, 유리체강 내 anti-VEGF 주입술을 시행하고 3-6개월까지 맥락막두께가 감소하는 것으로 보고하고 있다.16,18,19,23,26,27,40 그러나 본 연구에서 앞서 언급한 시술 3개월 이내의 자료는 제외하였으며 시술이 주로 연구 초기에 시행되어 실제 6개월에서 12개월 이상 지난 후에 맥락막두께를 측정하였으므로 그 영향이 제한적일 것으로 생각된다. 본 연구는 당뇨망막병증 환자에서 설로덱시드 복용 이후에 종단적으로 장기간 황반하맥락막두께와 중심황반두께의 변화를 제시하였다는 점에서 의의가 있다. 설로덱시드가 맥락막두께를 증가시키는 기전과 당뇨망막병증 환자의 맥락막에 어떤 영향을 미치는지 더 정확히 예측하기 위해서 더 많은 환자들을 대상으로 한 전향적 연구가 필요할 것으로 사료된다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
차창민 / Chang Min Cha
고신대학교 의과대학 안과학교실
Department of Ophthalmology, Kosin University College of Medicine

