삼투압을 이용한 안구건조증 모델에서 예측 가능한 염증인자 분석
Inflammatory Factors Predicting Dry Eye Syndrome in a Model Using Osmotic Pressure
Article information
Abstract
목적
고삼투압 안구건조증 모델을 이용하여 안구건조증에서 연구 표지자로 사용할 수 있는 염증인자(inflammatory factor)를 알아보고자 하였다.
대상과 방법
고삼투압성 환경에 따른 세포 생존율 및 염증인자들을 평가하기 위해 배양 인체결막상피세포에 혈청 유무에 따라 400 mOsm/L, 450 mOsml/L, 500 mOsm/L, 550 mOsm/L 농도의 NaCl을 처리하여 세포생존성을 측정하였다. 또한 interleukin (IL)-1β, IL-6, IL-8, tumor necrosis factor (TNF)-α, metalloproteinase (MMP)-2, MMP-9에 대한 real-time polymerase chain reaction을 시행하여 결과를 비교하였다.
결과
NaCl의 농도가 증가할수록 500 mOsm/L에서부터 세포 생존율이 유의하게 감소하였으며(p<0.05), NaCl의 농도에 비례하여 IL-8, TNF-α, MMP-9이 유의하게 증가하였다(p<0.05).
결론
IL-8, TNF-α, MMP-9이 추후 안구건조증 연구에서 연구 표지자로 유용하게 사용할 수 있을 것으로 생각된다.
Trans Abstract
Purpose
To identify inflammatory factors that may serve as biomarkers for dry eye syndrome using a hyperosmotic dry eye syndrome model.
Methods
Cultured human conjunctival epithelial cells were subjected to 400, 450, 500, and 550 mOsm/L NaCl, and cell viability was assessed in response to osmolarity. The relative expression of inflammatory factors was evaluated by real-time polymerase chain reaction of interleukin (IL)-1β, IL-6, IL-8, tumor necrosis factor (TNF)-α, metalloproteinase (MMP)-2, and MMP-9 according to the NaCl concentration.
Results
An increase in the concentration of NaCl led to a notable decrease in cell viability (p < 0.05). IL-8, TNF-α, and MMP-9 expression levels increased significantly in proportion to NaCl concentration (p < 0.05).
Conclusions
IL-8, TNF-α, and MMP-9 may serve as effective biomarkers in dry eye studies.
안구건조증이란 눈의 불편감과 시력장애를 일으키며 눈물막을 불안정하게 하여 안구표면에 손상을 일으킬 수 있는 눈물과 안구표면의 다인성 질환으로, 눈물막의 오스몰 농도의 증가와 안구표면의 염증을 동반하는 질환이다.1
눈물막의 불안정성으로 인해 눈물막 증발이 증가하면, 눈물의 오스몰 농도 증가로 이어지고, 이는 안구건조증의 악순환의 중심 현상 중 하나로 눈물의 삼투압이 상피세포의 삼투압을 초과하여 세포 부피가 감소하고 용질 농도가 증가하는 상태를 말한다.2 이후 상피표면에서 염증 반응을 활성화시키고, 활성화된 안구표면의 염증세포로부터 interleukin (IL)-1β, IL-6, IL-8, tumor necrosis factor (TNF)-α와 같은 전염증성(proinflammatory) 사이토카인을 생성된다.3,4 이로 인한 염증 반응으로 인해 술잔세포를 포함한 안구표면의 상피세포에 세포자멸사를 유발하여 악순환이 지속되고, 안구건조증의 시작 원인에 상관없이, 염증 반응은 안구건조증을 지속시키게 된다.5,6
눈물막에는 다양한 성장인자, 전염증성 사이토카인을 비롯한 많은 종류의 단백질이 존재한다. 눈물 내 단백질은 안구표면의 상태에 따라 달라지며, 이러한 특성을 이용하여 눈물의 오스몰 농도나 특정 사이토카인의 농도를 측정하여 안구건조증의 진단 및 치료에 활용하기도 한다.7
지금까지 여러 연구에서 쇼그렌증후군 환자나 안구건조증 환자에서 진단이나 치료법 연구를 위해 눈물이나 결막세포를 채취하여 오스몰 농도에 따른 증상 정도와 분비되는 전 염증성 사이토카인의 발현량을 비교하였고, 오스몰 농도와 사이토카인의 발현량이 양의 상관관계를 갖는다고 한다.8 하지만 불균등한 성별, 제한된 나이 등 연구 대상의 다양성 및 눈물을 채취하는 과정의 오차로 인해 연구마다 상이한 결과를 나타내었다. 본 연구에서는 고삼투압을 이용한 안구건조증 모델을 이용하여 안구건조증에서 연구표지자로 사용할 수 있는 전염증성 사이토카인을 포함한 염증인자(inflammatory factor)를 알아보고자 하였다.
대상과 방법
본 연구는 조선대학교병원 임상연구심의위원회 승인을 받았으며(IRB 승인번호: 2023-02-022), 비임상연구로 인해 기관검토위원회로부터 사전 동의가 면제되었다.
Live/dead viability assay
고삼투압 환경에서 발현하는 염증인자의 농도를 평가하기 위해 먼저 live/dead 세포 염색법을 통해 세포 생존도를 평가하였다. 본 연구에서는 배양된 Wong-Kilbourne derivative of Chang conjunctival cells (WKD, ATCC CCL-20, Manassas, VA, USA)에 sodium chloride (NaCl)을 이용하여 혈청의 유무에 따라 고삼투압 환경을 조성하였다. 인체결막상피세포(human conjunctival epithelial cells, HCjECs)를 1% penicillinstreptomycin (WelGENE inc., Gyeongsan, Korea) 및 10% fetal bovine serum (Gibco Thermo Fisher Scientific, USA)이 포함된 Medium 199 (Gibco Thermo Fisher Scientific, San Diego, CA, USA)를 사용하여 6 well 배양접시에 1×104/mL로 분주하여 24시간 배양하였다. FBS를 처리한 군은 등장성인 배양 배지(312 mOsm/L)에 NaCl을 첨가하여 고삼투압성 환경(400, 450, 500, 550 mOsm/L)을 조성하였고, FBS을 처리하지 않은 군은 배양 배지를 제거하고 phosphate buffered saline (PBS) (Gibco Thermo Fisher Scientific)으로 세척하고, FBS가 없는 배양배지로 교체하여 24시간 배양 후 NaCl을 이용하여 동일한 농도의 고삼투압성 환경을 조성하여 세포의 모양을 관찰하였다. 또한 Live/Dead® viability/cytotoxicity kit (Invitrogen Inc., Carlsbad, CA)를 사용하여 세포 염색을 위해 calcein acetoxymethyl ester (Invitrogen Inc.) 0.5 μL/mL, ethidium homodimer-1 (Invitrogen Inc.) 2 μL/mL를 15분 동안 처리하여 형광현미경으로 관찰하였다.
MTT assay
고삼투압 환경이 세포에 미치는 영향은 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT, Sigma Aldrich, St. Louis, MO, USA) assay를 통해 평가하였다. 96 well 배양접시에 HCjECs를 1×104/mL로 분주하여 24시간 배양하여 live/dead viability assay와 같은 방법으로 FBS 유무에 따라 두 군으로 나눠 동일한 농도의 NaCl을 통해 고삼투압 환경을 조성하였다. 각 well에 500 μg/mL의 MTT를 처리하여 2시간 동안 배양 후, dimethylsulfoxide (DMSO; Sigma Aldrich) 100 μL를 처리하였다. 세포생존도를 확인하기 위해 microplate reader (Multiskan GO, Thermo Fisher, Waltham, MA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다. 각 농도에서 흡광도의 평균값을 계산하였고, 세포생존도는 각 농도에서 흡광도를 대조군의 흡광도로 나누어 백분율로 나타내었다.
RT-PCR
고삼투압 환경에서 발현하는 염증인자의 농도를 평가하기 위해, messenger ribonucleic acid (mRNA)의 상대적 발현량을 비교하였다. HCjECs를 100 mm 배양접시에 1×104/mL로 분주하여 24시간 배양하였고, FBS를 처리한 군과 처리하지 않은 군에 400, 450 mOsm/L 농도를 4시간, 24시간 동안 각각 세포에 조성하였다. Housekeeping gene인 glyceraldehyde 3-phosphate dehydrogenase (GAPDH)를 대조군으로 하여, HCjECs의 IL-1β, IL-6, IL-8, TNF-α, matrix metallopeptidase (MMP)-2, MMP-9의 mRNA 발현 수준을 real-time polymerase chain reaction (RT-PCR)으로 분석하였다. 배양세포에 TRIzol (Invitrogen, Life Technologies, Rockville, MD, USA) 용액을 넣어 세포를 용해시킨 후 chloroform을 넣고, isopropanol 침전 과정을 거쳐서 total RNA를 분리하였다. Complementary DNA (cDNA)는 분리한 RNA (1 mg)에 PrimescriptTM Reverse Transcriptase Reagent Kit (TaKaRa Bio, Shiga, Japan)를 사용하여 42°C에서 60분간 합성하였고, IL-1β, IL-6, IL-8, TNF-α, MMP-2, MMP-9, GAPDH primer와 TB GreenTM Premix Ex TaqTM (TaKaRa Bio)를 사용하였다(Table 1). PCR은 CFX Maestro (Bio-Rad Laboratories, Inc., Irvine, CA, USA)를 이용하여 95°C에서 5초간의 변성, 60°C에서 30초간의 결합 그리고 72°C에서 20초간의 연장 과정을 40회 반복하였다. 유전자의 발현 수준은 2-ΔΔCT 방법으로 계산하여 평가하였다.
통계적 분석
모든 실험은 최소 3회 이상 반복하여 시행하였고, 측정값은 평균 ± 표준편차로 나타내었다. 통계 분석은 IBM SPSS ver. 22.0 (IBM Corp., Armonk, NY, USA)을 이용하였다. 오스몰 농도에 따른 세포생존도, 염증성 인자의 발현량 비교를 위해 Kruskal-Wallis 분석과 Mann-Whitney 분석을 하였으며, p<0.05인 경우를 통계적으로 유의하다고 간주하였다.
결 과
배양된 HCjECs에 24시간, 48시간 동안 고삼투압성 환경을 조성하여 배양을 한 후 삼투압 농도가 증가함에 따라 세포를 관찰하였다. 500 mOsm에서 세포의 모양이 원형으로 변하고 탈락하는 세포가 나타났고, 550 mOsm에서 관찰되는 사멸한 세포 수가 급격히 늘어남을 관찰되었다(Fig. 1, 2). MTT로 측정한 세포생존율은 24시간 동안 NaCl을 처리하였을 때 10% FBS에서 배양한 HCjECs의 세포생존율이 500 mOsm에서 대조군에 비해 48.4% 이하(p<0.05), 550 mOsm에서 22.5% 이하(p<0.05)로 유의하게 감소하였고, 0% FBS, 500 mOsm에서 26.9% 이하(p<0.05), 550 mOsm에서 8.3% 이하로(p<0.05) 감소하였다(Fig. 3A). 48시간 배양하였을 때 500, 550 mOsm에서 더 낮은 생존도를 보였다(p<0.05, p<0.005) (Fig. 3B). 따라서 이후 실험에서는 고삼투압 농도를 400, 450 mOsm/L로 정하여 시행하였다.

Viability of HCjECs treated with 400 mOsm, 450 mOsm, 500 mOsm, 550 mOsm NaCl for 24 hours was determined using the live/dead cell viability assay. Representative fluorescence microscopic images of live and dead HCjECs incubated with different concentrations of 10% FBS (A), 0% FBS (B). M etabolically active cells converted non-fluorescent polyanionic calcein acetoxymethyl ester into green fluorescence. Damaged cell membranes allowed permeation of ethidium homodimer and its binding to nucleic acids, resulting in red fluorescence. Scale bar: 200 μm × 4. HCjECs = human conjunctival epithelial cells; FBS = fetal bovine serum.
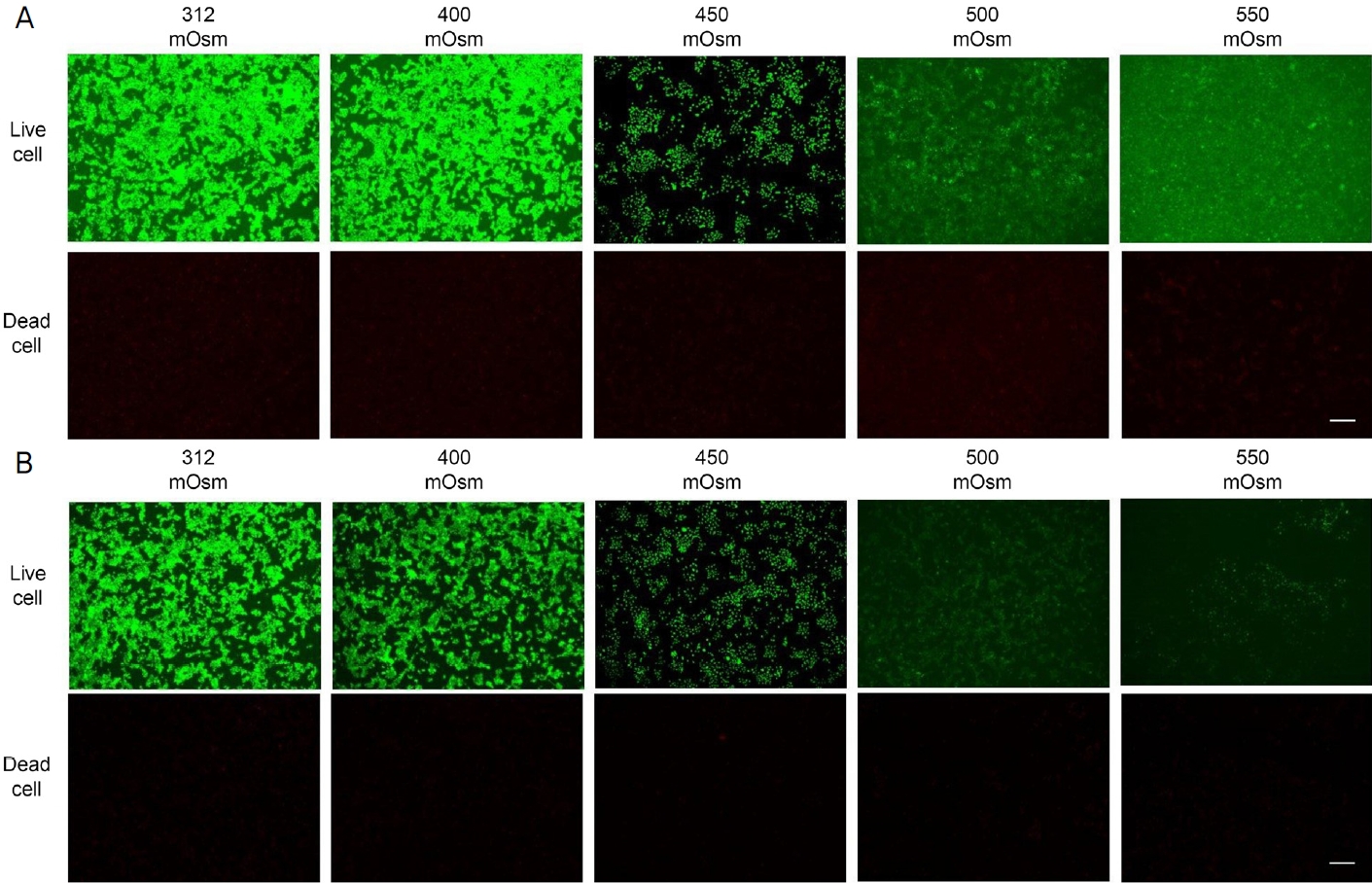
Viability of HCjECs treated with 400 mOsm, 450 mOsm, 500 mOsm, 550 mOsm NaCl for 48 hours was determined using the live/dead cell viability assay. Representative fluorescence microscopic images of live and dead HCjECs incubated with different concentrations of 10% FBS (A), 0% FBS (B). Green signals indicate live cells and red signals indicate dead cells. Scale bar: 200 μm × 4. HCjECs = human conjunctival epithelial cells; FBS = fetal bovine serum.

Cell viability of HCjECs treated with 312 mOsm, 400 mOsm, 450 mOsm, 500 mOsm, 550 mOsm NaCl for 24 hours (A), 48 hours (B), determined by MTT assay. FBS = fetal bovine serum; HCjECs = human conjunctival epithelial cells, MTT = 3-[4,5-dimethylthiazol- 2-yl]-2,5-diphenyltetrazolium bromide. *p<0.05; †p<0.005.
양된 HCjECs에 4시간, 24시간 동안 고삼투압성 환경을 조성하여 다양한 염증인자들의 mRNA 상대적 발현량을 연구한 결과, IL-8과 TNF-α의 mRNA 발현량은 오스몰 농도가 증가함에 따라 발현량이 증가하는 경향을 보였으며, 450 mOsm에서 발현량이 유의미하게 증가하였다(p<0.05). MMP-9의 mRNA 발현량은 400 mOsm와 450 mOsm로 오스몰 농도가 비례하여 통계적으로 유의하게 발현량이 증가하는 경향을 보였다(각각 p<0.05, p<0.005) (Fig. 4).
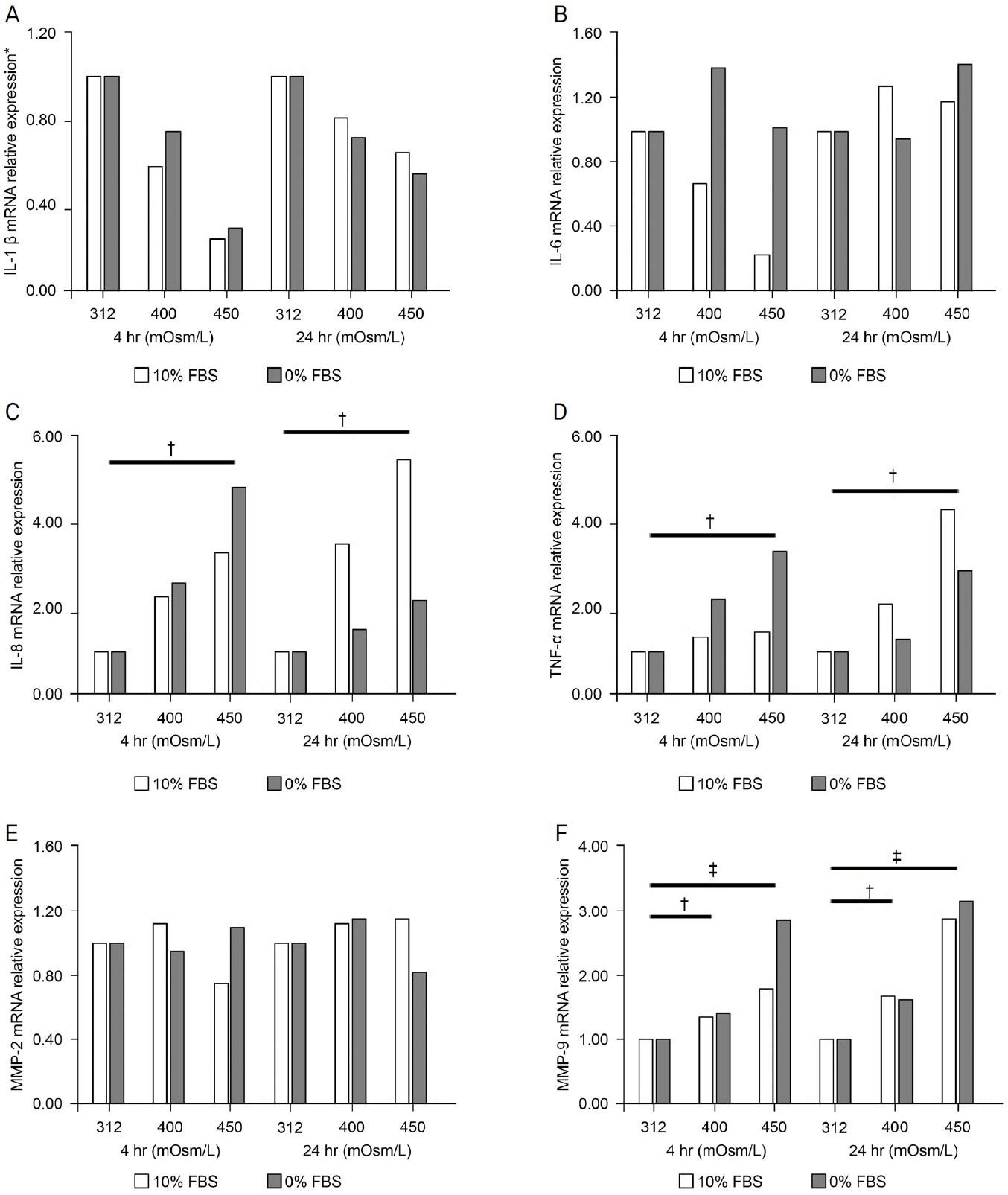
Effects of hyperosmotic stress on relative expression of various inflammatory factors on mRNA. HCjECs were treated with NaCl to evaluate IL-1β (A), IL-6 (B), IL-8 (C), TNF-α (D), MMP-2 (E) and MMP-9 (F) mRNA expressions. The inflammatory factors, IL-8, TNF-α, MMP-9 (C, D, F) significantly increased mRNA levels in HCjECs exposed to a hyperosmolar medium at 400 and 450 mOsm/L for 4 and 24 hours, respectively, compared with isosmolar control at 312 mOsm/L. IL = interleukin; mRNA = messenger ribonucleic acid; hr = hours; FBS = fetal bovine serum; TNF-α = tumor necrosis factor-alpha; MMP = matrix metalloproteinase. *Relative expression of genes was calculated using the 2-ΔΔCT method; †p<0.05; ‡p<0.005.
고 찰
안구건조증에서 눈물의 불안정성으로 인해 오스몰 농도가 증가하게 되고, 이로 인해 활성화된 염증세포로부터 전 염증성 사이토카인이 분비되어 염증반응이 나타나게 된다.9 지금까지 안구건조증에서 전염증성 사이토카인에 대한 여러 연구들이 진행되었으며, 안구건조 혹은 쇼그렌증후군을 진단받은 환자의 눈물막에서 발현하는 사이토카인을 포함한 각종 염증성 인자 그리고 그 발현량을 비교한 다양한 결과들이 보고되었다. Massingale et al8은 정상인과 안구건조증 환자의 눈물을 모세관으로 얻어 IL-2, IL-4, IL-5, IL-6, IL-8, IL-10, interferon (IFN)-γ, TNF-α, IL-β의 mRNA 발현량을 RT-PCR을 통해 비교하였고, 안구건조증 환자의 눈물에서 이러한 전염증성 사이토카인이 과생산됨을 보였다. 또한 Yoon et al10은 쇼그렌증후군 환자에서 높은 눈물 오스몰 농도와 눈물층 불안정성이 안구표면 스트레스를 촉진하여, 안구표면에서 IL-1β, TNF-α 및 MMP-9와 같은 염증성 신호를 발생시킨다고 보고하였다. 비슷하게 쇼그렌증후군 환자들을 대상으로 한 다른 연구에서는 눈물막에서 IL-6와 TNF-α의 농도를 연구하였고, IL-6의 농도는 안구건조증 증상과 유의미한 관계가 있었으나, TNF-α는 유의미한 결과를 보이지 않았다고 하였다.9 최근에는 배양한 각결막세포에 고삼투압성 환경을 조성하여 in vitro에서 안구건조증 모델을 만들어 연구에 이용하기도 하였다. Liu et al11은 인체 각막상피세포에 고삼투압성 스트레스를 주었을 때 IL-1β, TNF-α, IL-6, IL-8과 같은 염증인자가 발현된다고 보고하였다. Ju et al2의 연구에서는 인체결막세포에 290, 500 mOsm/L 농도의 삼투압성 환경을 조성하여, IL-1β, IL-6, TNF-α의 발현량을 비교하였고, 오스몰 농도가 증가함에 따라 IL-6의 발현량이 유의미하게 증가하였다고 보고되었다. 여러 연구들을 통하여 정상안에서 눈물막의 오스몰 농도는 평균적으로 302.2 mOsm/L이며, 안구건조증안에서 눈물막의 오스몰 농도는 326.9 mOsm/L으로 증가할 수 있다고 알려져 있다.1 하지만 안구표면의 삼투압은 더 높을 것으로 생각되고, 심한 안구건조증의 경우 국소적으로 900 mOsm/L까지 상승할 수 있다는 보고가 있다.12 본 연구의 안구건조증 모델에서 IL-1β, IL-6, IL-8, TNF-α, MMP-2, MMP-9 중 IL-8, TNF-α, MMP-9에서 오스몰 농도가 증가함에 따라 mRNA 상대적 발현량이 증가하는 결과를 보였다. 본 연구를 통해 IL-8, TNF-α, MMP-9이 삽투압을 이용한 안구건조증 모델 에서 오스몰 농도에 따라 유의하게 증가함을 알 수 있었고, 이를 통해 추후 안구건조증 연구에서 특정 염증인자들을 생물학적 연구 표지자로 유용하게 사용할 수 있을 것으로 생각된다.
Acknowledgements
This study was conducted using equipment from “Chosun University Ophthalmic and Optic Medical Device Globalization Project” (Ministry of Trade, Industry, and Energy, Republic of Korea) with support from Biolamp Co., Ltd.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
박건우 / Keon Woo Park
조선대학교 의과대학 안과학교실
Department of Ophthalmology, Chosun University College of Medicine

