안중증근무력증의 안과적 임상 양상
Ophthalmologic Manifestations of Ocular Myasthenia Gravis
Article information
Abstract
목적
안중증근무력증 환자의 안과적 임상 양상을 알아보고자 하였다.
대상과 방법
2011년 1월부터 2022년 8월까지 본원 안과 및 신경과에 내원하여 안중증근무력증으로 진단받은 환자 중 6개월 이상 추적 관찰이 가능하였던 58명을 대상으로 안과적 임상 양상 및 경과를 후향적으로 분석하였다.
결과
총 58명의 환자에서 발병 시 평균 연령은 55.52 ± 15.60세로 남성 29명, 여성 29명이었다. 항아세틸콜린수용체항체검사에서 양성 31명으로 양성률은 53.45%였고, 반복신경자극검사는 양성 19명, 음성 38명으로 33.33%에서 이상을 보였다. 항체 양성군에서 전신근무력증으로 더 많이 진행하였으며(p=0.011), 더 많은 흉부 이상 소견을 보였다(p<0.001). 복시와 안검하수가 동반된 복합군에서 수평, 수직복시가 모두 있는 경우가 많았으며(p<0.001), 사시의 양상이 복시 증상 단일군에서는 내사시, 복합군에서는 외사시가 가장 많아 차이가 있었다(p=0.029). 또한 증상 복합군에서 항체 농도가 높게 측정되었으며(p=0.034), 반복신경자극검사에서 이상 소견을 보이는 경우가 많았고(p=0.022) 더 많은 흉부 이상 소견을 보였다(p=0.022).
결론
안중증근무력증 환자에서 항아세틸콜린수용체항체 양성군에서 전신 중증근무력증으로 진행한 경우가 많았고, 복시와 안검하수가 동반된 복합군에서 항아세틸콜린수용체항체 농도가 높았으며, 수평사시와 수직사시가 함께 동반되는 경우가 많았다.
Trans Abstract
Purpose
We investigated the ophthalmic manifestations observed in patients diagnosed with ocular myasthenia gravis.
Methods
In total, 58 patients diagnosed with ocular myasthenia gravis visited the ophthalmology and neurology departments between January 2011 and August 2022. Patients were followed for > 6 months; their ophthalmic manifestations were analyzed retrospectively.
Results
The study included 29 males and 29 females with a mean age of 55.52 ± 15.60 years. Among the patients, 31 tested positive for anti-acetylcholine receptor antibodies, resulting in a positive rate of 53.45%. Abnormalities in repeated nerve stimulation tests were observed in 33.33% of the patients. The antibody-positive group exhibited a higher frequency of progression to generalized myasthenia gravis (p = 0.011) and a higher incidence of chest abnormalities (p < 0.001) compared to the antibody-negative group. Horizontal and vertical diplopia were commonly observed in a complex group of patients with diplopia and blepharoptosis (p < 0.001); there was a difference in the pattern of strabismus between the diplopia single group with esotropia and the complex group with exotropia (p = 0.029). In addition, the combination group demonstrated a higher antibody titer (p = 0.034), a higher frequency of abnormalities in repeated nerve stimulation tests (p = 0.022), and a higher incidence of chest abnormalities (p = 0.022).
Conclusions
The anti-acetylcholine receptor antibody-positive group had a higher incidence of progression to generalized myasthenia gravis; moreover, the complex group of patients with diplopia and ptosis exhibited elevated levels of anti-acetylcholine receptor antibodies and frequently accompanied both horizontal and vertical strabismus.
중증근무력증(myasthenia gravis)은 시냅스 후 접합부에 위치한 아세틸콜린수용체를 표적으로 하는 자가항체가 생성되어 아세틸콜린수용체를 차단 혹은 파괴하는 자가면역 질환으로 증상은 안구에만 국한되는 경우도 있으나 호흡부전에 이르기까지 다양하게 나타나는 질환이다.1-3 안중증근무력증(ocular myasthenia gravis)은 타 근육의 기능장애가 없이 외안근, 눈꺼풀올림근 그리고 눈둘레근의 약화로 인해 안검하수 및 복시를 일으키는 질환으로 대부분 활동 시 악화되며 휴식 시 완화되는 임상 양상을 나타낸다.4 중증근무력증 환자의 50% 이상에서 초기 증상으로 안검하수, 복시 및 안구운동이상이 발생하며 이후 약 90% 이상에서 이와 같은 안증상을 보이는데 이러한 임상 소견을 나타내는 환자의 50-60%는 증상 발생 1-2년 후 전신 중증근무력증(generalized myasthenia gravis, GMG)으로 진행한다고 알려져 있다.2,5
한편 안중증근무력증의 진단은 쇠약, 운동에 대한 비정상적인 피로, 변이성과 같은 특징적인 임상 양상과 함께 다음과 같은 검사를 통해 진단한다. 면역학적 검사로 혈청 항아세틸콜린수용체항체(anti-acetylcholine receptor antibody, anti-ACh Rc Ab)검사를 통해 진단할 수 있으며, 전신 중증근무력증 환자의 약 80-99%, 안중증근무력증 환자의 30-77%에서 검출되나 약 20-50%의 안중증근무력증 환자에서는 항아세틸콜린수용체항체가 검출되지 않는다.6,7 이외에도 얼음검사(ice test), 반복신경자극검사(repetitive nerve stimulation test, RNST) 및 단일섬유근전도검사(single fiber electromyography) 등을 통해 진단할 수 있으나, 안중증근무력증은 진단검사에 대한 양성률이 낮으므로 검사에서 음성이라고 해서 가능성을 완전히 배제할 수 없으며 의심되면 시험적 cholinesterase inhibitor 투여 후 증상이 호전된다면 진단할 수도 있다.1
이와 같은 다양한 임상 양상과 비특이적인 안증상으로 안중증근무력증은 안과 외래에 초진으로 내원하는 경우가 종종 있지만 뇌신경마비, 갑상샘안병증 등으로 오인되는 경우가 많다.8,9 그리고 다양한 진단법에서 음성을 보이는 경우가 많아 진단이 늦어지거나 적절한 치료 방법을 찾지 못하는 경우가 발생하기도 한다.7 이에 저자들은 안과 외래에서 만나는 다양한 양상의 양안 복시 환자 중 안중증근무력증으로 진단받은 환자에 대한 안과적 임상 소견을 알아보고자 하였다.
대상과 방법
2011년 1월부터 2022년 8월까지 본원 안과 및 신경과에서 안중증근무력증을 진단받은 58명의 환자를 대상으로 의무기록을 통한 후향적 연구를 진행하였다. 이 연구는 헬싱키선언을 준수하였고, 본원 연구윤리심의위원회(Institutional Review Board, IRB)의 승인을 받아 진행하였다(승인번호: 2023-02-003). 일중변동과 피로를 동반한 안검하수 또는 복시를 호소하는 환자에서 임상적으로 안중증근무력증이 의심되는 경우 다음과 같은 검사를 시행하였다. 혈청 항아세틸콜린수용체항체검사 양성, 반복신경자극검사에서 이상 소견이 관찰되었을 경우, 얼음검사에서 명확한 안검하수의 호전 그리고 아세틸콜린에스테라제 길항제(acetylcholinesterase inhibitor, pyridostigmine) 복용 후 복시, 안검하수 등의 명확한 임상 양상의 호전이 있는 경우 중에서 적어도 하나 이상의 검사에서 양성을 보였을 때 안중증근무력증으로 진단하였다. 추가적으로 흉부 X-선 검사를 시행하여 흉선비대나 흉선종 등의 흉부 이상에 대한 선별검사를 시행하였고, 이상 소견이 관찰되는 경우 흉부 컴퓨터단층촬영검사(computed tomography)를 시행하였다. 과거 사시수술 및 눈꺼풀수술의 과거력이 있는 경우, 활동성 갑상샘눈병증이 있거나 뇌신경마비가 의심되는 경우, 초기부터 연하곤란, 구음장애 및 호흡장애 등의 전신 중증근무력증의 증상이 나타난 경우와 6개월 이상 경과 관찰이 시행되지 못한 경우는 조사 대상에서 제외시켰다.
항아세틸콜린수용체항체검사의 역가는 방사성 동위원소 기반 방사면역측정법(radioactive isotope-based radioimmunoassay)을 사용하여 분석되었으며 0.02 nmol/L 이상일 경우 이상 소견으로 간주하였다. 반복신경자극검사는 Oh et al10의 방법을 사용하였는데 5개 근육에 관한 각각의 활동성 전위(compound muscle action potential)을 기록하여 신경 자극을 반복하여 반응이 점차 감소하는 경우 이상 소견으로 판단하였다. 얼음검사는 검사 전 환자가 전방을 응시하게 한 후 margin reflex distance 1 (MRD1)을 측정하였고, 양안을 감은 상태에서 얼음을 상안검에 2분간 접촉시킨 후 10초 이내에 다시 전방을 응시하게 한 후 MRD1을 측정하였다. 이렇게 측정된 얼음검사 전과 후의 MRD1의 차이가 2 mm 이상일 경우 얼음검사 양성으로 판단하였다. Pyridostigmine에 대한 반응은 복용 후 환자의 주관적 증상 호전과 함께 2회의 진료 시에 측정한 사시각의 감소 및 안검하수의 호전이 있는 경우 안중증근무력증으로 진단하였으며, 약제 부작용이 발생하거나 치료 효과가 불충분한 경우 부신피질호르몬제(methylprednisolone) 그리고 면역억제제(azathioprine) 등의 약물을 추가하였다. 흉부 방사선검사상 흉선종 등의 이상이 있는 경우는 흉부외과 의사의 진료 후 필요에 따라 수술적 치료가 이루어졌다. 한 명의 사시 및 신경안과 전문의에 의해 사시와 복시의 종류를 분류하였고, 사시가 있는 경우 교대프리즘가림검사를 통해 사시각을 정량화하여 사시각에 따라 수평, 수직복시로 분류하였다. 안검하수는 진료실에서 3회의 진료 시 1회 이상 관찰되거나 환자의 사진에서 중등도 이상의 안검하수가 있는 경우 양성으로 판단하였으며, 안검하수의 정도는 MRD1을 측정하여 4 mm를 기준으로 2 mm 이하로 처진 경우 경도(mild), 2 mm 초과 3 mm 이하인 경우 중등도(moderate), 4 mm 이상의 경우 중증(severe)으로 분류하였다.
해당 기준에 합당한 58명의 환자를 대상으로 의무기록에 근거하여 후향적으로 임상 양상을 분석하였으며 검사 결과와 임상 소견에 더불어 성별, 나이, 안증상(안검하수 또는 복시, 복시의 종류), 갑상샘 질환, 자가면역 질환, 흉선이상, 치료에 대한 반응, 전신 중증근무력증의 진행 여부, 첫 증상 발생으로부터 전신 중증근무력증으로 진행까지 소요 기간 등을 조사하였다. 통계 분석에는 STATA 14.0 (STATA Corporation, College Station, TX, USA)을 이용하였으며 연속형 자료의 비교에는 independent t-test, 범주형 자료의 비교에는 chi-square test, Fisher’s exact test 그리고 Pearson’s chi-square test를 사용하여 통계적 유의성(p-value)을 검증하였으며 p값이 0.05 미만인 경우를 통계학적으로 유의하다고 판단하였다.
결 과
안중증근무력증 환자의 임상 양상 및 결과
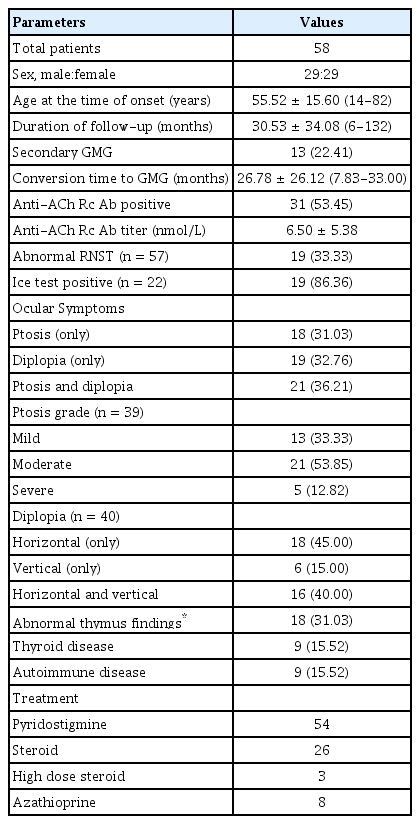
전체 58명의 환자(남성 29명, 여성 29명)가 이 연구에 포함되었고 평균 추적 관찰 기간은 초진 후 평균 30.53 ± 34.08개월(6-132개월)이었다. 발병 시 평균 연령은 55.52 ± 15.60세(14-82세)로 추적 관찰 기간 중 13명(22.41%)의 환자가 전신 중증근무력증으로 진행하였으며, 안구 증상 발생 평균 26.78 ± 26.12개월(7.8-33.0개월) 후 진행되었다. 흉선의 병변(흉선종 또는 흉선증식증)은 18명(31.03%)에서 발견되었으며 9명(15.52%)의 환자는 갑상샘 질환을 앓고 있었고, 9명(15.52%)은 류마티스 관절염 및 자가면역 용혈성 빈혈 등의 자가면역 질환이 있었다. 항아세틸콜린수용체항체는 31명에서 양성으로 53.45%의 양성률을 보였으며 평균 항체 농도는 6.50 ± 5.38 nmol/L이었다. 반복신경자극 검사는 57명에서 시행되었으며 19명(33.33%)에서 이상 소견이 확인되었고, 안검하수가 있는 총 39명의 환자 중 22명에서 얼음검사가 이루어졌고 19명(86.36%)에서 양성이 관찰되었다.
항아세틸콜린수용체항체검사에서 음성이었던 환자는 27명(46.55%)으로 이 중 4명(6.90%)에서 반복신경자극검사 이상 소견이 관찰되었고, 4명(6.90%)에서 얼음검사 양성 소견이 관찰되었다. 또한 1명(1.72%)에서는 반복신경자극검사 및 얼음검사에서 양성 소견이 관찰되었으며 3가지 검사 결과는 모두 음성이었으나 pyridostigmine 복용 후 증상 호전이 관찰되어 안중증근무력증으로 진단된 환자는 18명(31.03%)이었다.
초진 시 안검하수, 복시, 안검하수와 복시가 함께 있었던 환자는 각각 18명(31.03%), 19명(32.76%), 21명(36.21%)이었다. 안검하수는 39명 중 경도 13명(33.33%), 중등도 21명(53.85%) 그리고 중증 5명(12.82%)이었다. 복시를 보인 40명의 환자 중 수평복시가 18명(45.00%), 수직복시가 6명(15.00%)이었고 수평 및 수직복시를 모두 보인 환자는 16명(40.0%)이었다. 모든 환자에서 초기 치료로 pyridostigmine이 사용되었으며 이 중 2명에서는 pyridostigmine 복용 후 심한 위장관계 부작용으로 인해 초기 치료로 부신피질호르몬제를 투여하였다. 초기 치료로 부신피질호르몬제를 시작한 2명을 제외한 24명의 환자에서 경과 관찰 기간 중에 부신피질호르몬제가 추가되었으며, 이 중 3명에서는 연하곤란 및 구음장애 등의 전신 중증근무력증의 증상이 발생하여 고용량 부신피질호르몬 치료가 시행되었다. 치료 기간 동안 8명의 환자에서 azathioprine이 추가되었으며, 전체 환자 중 2명은 pyridostigmine, 부신피질호르몬제, 고용량 부신피질호르몬 치료 그리고 azathioprine까지 모든 약제가 순차적으로 투여되었다(Table 1).
항아세틸콜린수용체항체 결과에 따른 비교
항아세틸콜린수용체항체 양성군에서 남성은 18명(58.06%), 여성은 13명(41.94%)이었고 음성군에서 남성은 16명(59.26%), 여성은 11명(40.74%)으로 항체 유무와 성별에 따른 차이는 없었다. 항체 양성군에서 흉선이상이 발견된 환자는 17명으로 항체 음성군 1명에 비해 많았으며 이는 통계적으로 유의미하였다(p<0.001). 항체 양성군에서 전신 중증근무력증으로 진행한 환자는 11명이고, 항체 음성군에서는 2명으로 통계적으로 차이가 있었다(p=0.011).
복시가 있는 환자에서 수평, 수직복시가 모두 있는 환자는 항체 양성군에서 12명(38.71%), 항체 음성군에서 4명(14.81%)으로 항체 양성군에서 더 많았으나 통계적으로 유의미하지는 않았다(p=0.076). 부신피질호르몬 치료는 항체 양성군 중 19명, 항체 음성군 중 7명에서 시행되어 항체 양성군에서 더 많이 시행되었다(p=0.007) (Table 2).
단일 증상군(복시)과 복합 증상군(복시+안검하수)의 비교
안증상에 따라 복시 단일 증상이 있었던 환자군과 안검하수와 복시의 복합 증상이 있었던 환자군을 비교하였을 때 항아세틸콜린수용체항체 양성 환자는 단일 증상군과 복합 증상군에서 각각 7명(36.84%), 14명(66.67%)으로 복합 증상군에서 많이 관찰되었으나 통계적으로 유의미하지는 않았으며(p=0.059), 항체 농도의 평균은 각각 1.82 ± 5.69 nmol/L, 3.85 ± 4.28 nmol/L로 복합 증상군에서 항체 농도가 높았다(p=0.034). 반복신경자극검사 이상 소견은 단일 증상군과 복합 증상군에서 각각 2명(11.11%), 11명(52.38%)으로 통계적으로 유의미한 차이가 있었다(p=0.008).
복시가 있는 환자에서 나타나는 사시의 종류는 내사시, 외사시, 상사시 그리고 하사시로 분류하였을 때 단일 증상군에서는 내사시가 10명(52.63%)으로 가장 많았으며 복합 증상군에서는 외사시가 14명(66.67%)으로 가장 많아 단일 증상군과 복합 증상군에서 사시 양상의 차이가 관찰되었다(p=0.029). 수평복시와 수직복시가 모두 있는 환자는 단일 증상군에서 2명(10.53%), 복합 증상군에서 14명(66.67%)으로 복합 증상군에서 수평복시와 수직복시가 모두 있는 경우가 많았다(p<0.001). 수평 및 수직사시각은 복합 증상군에서 더 컸으나 통계적으로 유의미하지는 않았다. 그리고 복시 단일 증상군에서는 흉선이상이 2명(10.53%)에서 관찰되었으며, 복합 증상군에서는 9명(42.86%)으로 복합 증상군에서 흉선이상이 더 많이 관찰되었다(p=0.022) (Table 3).
고 찰
중증근무력증 환자의 90%에서 안검하수나 복시가 증상으로 발현되고, 이 중 약 50%의 환자에서는 중증근무력증의 초기 증상으로 안증상이 나타난다고 알려져 있다.7,11 중증근무력증에서 안증상이 잘 나타나는 이유는 외안근의 몇 가지 특징 때문으로 추측되는데 대표적으로 외안근을 구성하는 단일신경지배수축섬유(single-innervated twitch fiber)는 빠른 수축 속도와 높은 빈도에 작용하기 때문에 피로에 더 취약하며 다른 사지근육과 달리 판상종말에 아세틸콜린 수용체가 적으며 외안근은 경미한 피로도가 증상으로 나타나기 때문이다.7,8 이 연구에서는 복시와 안검하수 복합 증상을 보인 환자가 21명(36.21%)으로 가장 많았으며 복시 단일 증상을 보인 환자가 19명(32.76%), 안검하수 단일 증상을 보인 환자 18명(31.03%)으로 기존 Evoli et al12의 연구 결과인 안검하수 단독 증상 10% 그리고 복시와 안검하수의 복합 증상이 90%인 보고와는 차이가 있었다. 이는 진료 이후에 복시가 발생한 경우가 있을 수 있으며, 변동성이 있는 복시 양상으로 환자가 복시를 정확히 표현하지 못하였거나 질환의 특성상 초기 진료가 신경과에서 이루어진 경우 복시에 대한 평가가 정확히 이루어지지 못했을 가능성도 있다고 여겨진다.
이 연구에서 남성과 여성 환자는 각각 29명과 29명으로 남녀간 발병률의 차이는 관찰되지 않았으며 평균 발생 연령은 55.52세였다. Park et al13은 2011년 한국인에서 총 1,236명의 중증근무력증 환자가 발생하였으며 표준 발생률은 60-69세 환자군에서 가장 많다고 보고하였고, Lee et al14은 2010년부터 2014년까지 한국인을 대상으로 10,138명의 중증근무력증 환자의 역학을 조사하였을 때 55-59세로 갈수록 발병률이 증가하였으며 연령별 남녀 발병률은 유사한 값을 나타내어 이 연구와 유사한 값을 보였다.
한편 이 연구에서 수평복시를 보인 환자는 17명(45.00%), 수직복시는 6명(15.00%) 그리고 수평 및 수직복시를 모두를 보인 환자는 16명(40.00%)으로 나타났는데 Kupersmith and Ying4의 연구에서도 수평복시가 34.1%, 수직복시가 22.4% 그리고 수평, 수직복시를 모두 보인 환자가 43.5%로 이 연구와 유사한 값을 보고하였다. 반면 de Meel et al15은 수평복시가 5%, 수직복시는 관찰되지 않았으며 수평, 수직복시를 모두 보인 환자가 95%로 보고하여 이 연구와 차이를 보였다. 이렇게 보고마다 결과가 다른 데에는 환자가 주관적으로 호소하는 복시의 양상만을 조사하였을 경우와 이 연구와 같이 사시각을 정량화하여 측정하였을 경우에서 차이가 날 수 있다고 생각된다. Kupersmith and Ying4의 연구에서도 이 연구처럼 교대프리즘가림검사를 통해 복시를 분류하였고 복시 양상의 결과가 유사하게 보고되었다. 또한 변동성이라는 안중증근무력증의 특성상 진료 시마다 사시각의 변동으로 인해 연구마다 복시의 양상 및 정도가 달라졌을 가능성도 고려해야 할 것이다.
항아세틸콜린수용체항체 양성군에서 음성군에 비해 수평, 수직복시 모두를 보이는 환자군이 많았으나 통계적으로 유의미하지는 않았는데 이는 Cleary et al9의 연구에서 항체 음성군에서 수평, 수직복시 모두를 나타낸 환자가 많았다는 연구 결과와는 반대이나 두 연구 모두 통계적으로 유의미하지는 않았기에 추후 항체 유무에 따른 복시 양상에 대한 연구 등을 고려해 볼 수 있다고 생각된다. 흉선이상의 경우 항아세틸콜린수용체항체 양성 환자에서 더 많이 발견되었고(p<0.001), 복시와 안검하수 복합 증상군에서 더 많은 빈도로 관찰되었다(p=0.022). 특이할 점은 음성 환자 중 흉선이상은 1명에서만 관찰된 것으로 흉선이상이 항아세틸콜린수용체항체와 관련 있을 가능성이 높을 것으로 생각되며, 항체 양성 환자와 복합 증상군에서는 흉선이상에 대한 적극적인 검사가 필요할 것으로 생각된다.
안증상을 복시 단일 증상군과 복시와 안검하수 복합 증상군으로 나누어 비교하였을 때 복합 증상군의 경우 단일군에 비해 항체 농도가 높게 측정되었고(p=0.034), 반복신경자극검사에서 이상 소견을 보인 경우가 통계적으로 유의미하게 많았다(p=0.008). 이를 통해 안검하수와 복시가 동반된 경우와 같이 안증상이 심한 경우에 반복신경자극검사에서 이상 소견을 보였다는 기존 연구와 비슷하였으며, 복합 증상군에서 반복신경자극검사가 이상 소견을 보인 비율은 52.38%로 전체 환자 33.33%에 비해 비교적 높게 관찰되었다.10 한편 이 연구에서는 복합 증상군에서 항아세틸콜린수용체항체 농도가 높게 나타났지만 항체 농도에 따른 안증상 양상은 현재까지의 연구에 따르면 큰 상관관계가 없다고 알려져 있다.16,17 Peeler et al17에 의하면 항체 농도가 높을수록 전신 증상이 많이 나타났으나 안증상의 경우 항체 농도와 복시, 안검하수의 증상을 비교하였을 때 통계적으로 유의하지는 않았다. 다만 Marcuse et al18은 항아세틸콜린수용체항체 농도와 중증근무력증의 임상적 호전과의 연관성에 대한 후향적 연구에서, 항아세틸콜린수용체항체 농도가 중증근무력증의 진단뿐만 아니라 반복적 정량적 측정을 통해 스테로이드를 포함한 면역억제 치료의 지속 혹은 다른 약제로의 변경 여부를 결정함에 있어 도움을 줄 수 있어 장기간의 치료 모니터링에도 유용할 수 있다고 하였다. 따라서 항아세틸콜린수용체항체 농도를 장기간의 치료 모니터링에 활용하면서 안증상과의 상관관계에 대한 연구도 추후 고려해 볼 수 있다고 생각된다.
그리고 복합증상군에서 수평, 수직복시 모두가 동반된 경우가 많았으며(p<0.001), 수평 및 수직사시각이 더 컸으나 사시각은 통계적으로 유의미하지는 않았다. 또한 단일 증상군의 경우 내사시를 보이는 경우가 많았고 복합 증상군의 경우 외사시를 보이는 경우가 많아 사시 양상의 차이가 관찰되었다(p=0.029). 하지만 안중증근무력증의 경우 갑상샘눈병증, 뇌신경마비에 의한 마비사시에서처럼 근육의 기능 소실이나 마비를 정량적으로 평가하는 데 어려움이 있으며 일정한 양상을 보이는 것이 아니기 때문에 실제 임상에서 사시의 양상만으로 단일 증상군과 복합 증상군으로 구분하기에는 제한점이 있을 것으로 생각된다. 기존 국내에 보고된 논문에서 15세 미만의 안중증근무력증으로 진단된 24명을 대상으로 안과적 임상 양상을 보고한 Kim et al19의 연구에서는 외사시 14명, 내사시 3명이었으나, 저자들의 연구 결과는 외사시 16명, 내사시 18명으로 사시 양상에서 차이를 보였다. 연구 대상군의 환자수 및 연령대의 차이 등이 두 연구에서 다른 결과가 나오는데 영향을 미쳤을 것으로 생각된다. 이후 더 많은 소아 및 성인 환자를 대상으로 안중증근무력증의 진행에 따른 외안근 침범 및 약화 양상에 대한 연구가 보완된다면 임상 진료 시 참고할 수 있을 것이다.
이 연구에서 경과 관찰 기간 중 전신 중증근무력증으로 진행한 환자는 13명(22.41%)이며 첫 증상 발생 평균 26.78개월이 소요되었다. 안중증근무력증으로 진단받은 환자에서 전신중증근무력증으로 진행한 환자의 비율은 기존 Mazzoli et al20의 연구에서 알려진 80%보다 적은 수치를 보였으나 한국인을 대상으로 한 Hong et al21 연구의 23.3%와는 유사한 값을 보였다. 또한 항아세틸콜린수용체항체 양성 환자에서 전신 중증근무력증으로 진행한 환자가 많았으며 이는 여러 후향적 연구에서 보고한 바처럼 항아세틸콜린수용체항체 양성인 환자에서 전신 중증근무력증으로 진행할 가능성이 높다는 연구와 일치하였다.2,5,8,22 따라서 임상의사로서 항체 양성 환자에서는 전신 중증근무력증으로의 진행 가능성을 면밀히 살피고 필요한 시기에 적극적인 치료를 받을 수 있도록 해야 할 것이다.
한편 이 연구에서 항아세틸콜린수용체항체검사의 양성률은 전체 환자 중 53.49%로 기존 연구에서 알려진 33-77%의 양성률과 유사하게 관찰되었다.6,23,24 또한 반복신경자극 검사의 경우 33.33%에서 이상 소견을 보여 기존 연구에서 관찰된 30-77%와 비슷한 범위에서 관찰되었다.1,11,22 그리고 항체 양성 환자에서 부신피질호르몬제 치료가 더 많이 이루어졌는데(p=0.007), 이 연구에서 부신피질호르몬제의 투여는 pyridostigmine 투여에도 복시 혹은 안검하수와 같은 안증상이 조절되지 않는 경우 이차약제로 사용되어 항체 양성 환자에서는 안증상이 pyridostigmine 투여만으로 조절되기에는 한계가 있음을 알 수 있었다. 이에 항체 양성 환자에서는 안증상의 양상을 주의 깊게 확인하며 적절한 치료가 필요할 것으로 생각된다. Pyridostigmine은 가장 흔하게 사용되는 acetylcholinesterase 억제제로, 아세틸콜린수용체에 대한 아세틸콜린의 가용성(availability)을 향상시켜 신경근 전달을 개선한다고 알려져 있으며, 빠르게 작용하고 안전하며 장기적인 부작용이 없다는 것이 장점이다.25 이 연구에서도 총 58명 중 부작용으로 초기부터 부신피질호르몬제 치료를 시작한 2명을 제외한 56명의 환자에서 pyridostigmine 초기 치료가 이루어졌으며, 치료 후 안검하수 혹은 복시 증상의 호전을 보였다. 하지만 안중증근무력증 환자에서 장기적으로는 acetylcholinesterase 억제제 치료 단독으로는 안증상의 관해가 어려워 부신피질호르몬제와 같은 면역억제 치료가 필요하다고 하였다.25 실제 본원에서도 pyridostigmine으로 안증상이 조절되지 않은 경우 증상 조절을 위해서 고용량 부신피질호르몬 치료를 포함하여 총 29명의 환자에서 부신피질호르몬제를 투여하였다.
또한 여러 후향적 연구에서 부신피질호르몬제 치료를 포함한 면역억제 치료가 안중증근무력증 환자에서 전신 중증근무력증 발생 위험을 감소시킬 수 있다고 하였고, 이들 연구 중 가장 규모가 컸던 한 연구에서는 2년간의 추적 관찰 동안 부신피질호르몬제 치료를 받지 않은 안중증근무력증 환자의 36%가 전신 중증근무력증으로 진행된 반면, 치료받은 환자에서는 7%에 그쳤다고 보고하였다.26 부신피질호르몬제의 기전으로는 백혈구의 내피 부착의 감소 및 염증성 사이토카인 생성 감소를 통한 면역반응에 대한 광범위한 억제 효과를 갖는 것으로 알려져 있지만, 중증근무력증에서 정확한 작용 메커니즘은 현재까지는 알려져 있지 않다.4,7,27 이 연구에서는 초기 pyridostigmine 치료 후 안증상이 조절되지 않는 경우 부신피질호르몬제의 추가 투여를 시행하였으나, 안중증근무력증의 환자에서 초기 pyridostigmine 치료를 시작할 때 부신피질호르몬제의 병용 투여를 고려해 볼 수 있을 것이다.
해당 연구의 제한점으로는 첫째, 후향적 연구로서 임상 경과 및 자연 경과를 평가할 수 있는 대상 환자 수가 적다는 점이며 또한 단일 병원의 의무기록 분석으로 표본 선택에 있어서 인구 또는 지리적 위치에 따는 선택 바이어스가 발생하였을 수 있다. 둘째, 비교적 안과적 증상에 초점을 맞추어 전신 증상에 대한 평가와 함께 신경생리학적 검사가 부족하였을 수 있다. 실제로 이 연구에서는 진단을 위한 검사로 항아세틸콜린수용체항체 검사와 반복신경자극검사를 주로 시행하였으며 안검하수를 보이는 모든 환자에서 얼음검사를 시행하지 못하였고 일부 환자에서만 시행하였다. 그렇지만 이 연구는 안중증근무력증의 진단법 및 전신 중증근무력증으로 진행할 위험인자를 다루었던 기존의 연구들과는 달리 안과적 임상 소견에 중점을 맞춰 분석하였다는 데 의의가 있다.
양안시 복시 환자에서 안검하수가 동반되거나 문진상 증상의 변동성 및 피로도와의 관련성이 고려된다면 안중증근무력증에 관한 진단검사를 시행해 볼 수 있으며, 검사 결과가 음성이더라도 부작용 등에 주의를 기울이면서 cholinesterase inhibitor를 투약하여 호전 여부를 확인하는 과정까지 진행을 고려할 수 있을 것이라 생각된다. 결론적으로 안중증근무력증 환자에서 항아세틸콜린수용체항체 양성군에서 전신중증근무력증으로 진행한 경우가 많았고, 안과적 임상 소견에 대해 알아본 결과 복시와 안검하수가 동반된 복합 증상군에서 항아세틸콜린수용체항체 농도가 높았으며 안증상으로 수평사시와 수직사시가 함께 동반되는 경우가 많은 양상이었다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
서용훈 / Yong Hoon Seo
성균관대학교 의과대학 삼성창원병원 안과학교실
Department of Ophthalmology, Samsung Changwon Hospital, Sungkyunkwan University School of Medicine