 |
 |
| J Korean Ophthalmol Soc > Volume 64(8); 2023 > Article |
|
국문초록
대상과 방법
급성 중심장액맥락망막병증 33안과 연령-대응한 정상 대조군 35안의 빛간섭단층촬영 결과를 비교하였다. 대상의 기본 정보 및 황반을 통과하는 수평의 빛간섭단층촬영 이미지를 획득하여 분석에 활용하였다. 망막하액의 높이, 황반하 맥락막두께를 측정하였으며, 전체 맥락막 범위(total choroidal area, TCA), 혈관성 맥락막 범위(luminal choroidal area, LCA), 간질성 맥락막 범위(stromal choroidal area, SCA)를 측정하여 LCA와 TCA의 비를 맥락막혈관 지표(choroidal vascularity index, CVI)로 지칭하였다. 약 5.6개월 후 망막하액이 모두 흡수된 안정 상태에서 동일한 분석을 재시행하여, 초기 활성 상태와 비교하였다.
ABSTRACT
Purpose
To investigate choroidal characteristics during active and resolved (presence and absence of subretinal fluid, respectively) central serous chorioretinopathy (CSC), and to clarify their relationships with disease activity.
Methods
The choroidal characteristics of 33 CSC and 35 age-matched control eyes were analyzed using optical coherence tomography (OCT). The CSC group included eyes with subretinal fluid at baseline. Horizontal OCT images passing through the macula, and data for age, sex, visual acuity, and refractive error, were acquired. The subretinal fluid height and subfoveal choroidal thickness were measured. The total choroidal area (TCA), luminal choroidal area (LCA), and stromal choroidal area (SCA) were measured using ImageJ software. The choroidal vascularity index (CVI) was defined as the ratio of LCA to TCA. The measurements were repeated after 5.6 months following complete absorption of the subretinal fluid. The choroidal characteristics were compared between the active and resolved phases.
Results
The CSC group had significantly greater choroidal thickness, TCA, LCA, and CVI values compared to the control group. The choroidal thickness, TCA, LCA, and SCA were significantly reduced after resolution compared to active CSC. However., the decrease in SCA was greater than that in LCA, which led to a significant increase in CVI (68.6 ± 3.2 vs. 71.6 ± 3.0, p < 0.001) after CSC resolution.
중심장액맥락망막병증(central serous chorioretinopathy)은 망막색소상피층의 병적 변화와 맥락막모세혈관으로부터 누출된 삼출물로 인한 황반부 장액망막박리를 특징으로 하는 맥락망막 질환이다.1 현재까지 정확한 병인 및 병리기전이 밝혀지지 않았으나 맥락막의 정수압 상승, 맥락막모세혈관의 비정상적인 투과성 증가 및 망막색소상피의 펌프 기능과 방어벽 기능저하로 인해 황반부 망막하 공간에 장액망막박리와 망막색소상피박리가 유발되는 것으로 알려져 있다.2
대부분의 급성 중심장액맥락망막병증의 경우 3개월 이내 자연 호전되며 좋은 시력 예후를 보이고 망막하액도 자연적으로 흡수되는 경우가 많지만, 일부 만성으로 진행할 경우 재발하는 경과를 보이기도 한다.3 이에 따라 최근에는 유리체강 내 항혈관내피성장인자항체 주입술 및 형광안저 혈관조영술에서 관찰되는 누출점을 응고하는 국소레이저광응고술을 치료 방법으로 고려하고 있다.4 일부 증례에서는 광역학 치료도 좋은 치료 성과를 나타낸다.5
최근 중심장액맥락망막병증의 병인으로 생각되는 맥락망막혈관의 투과성 증가를 수치화하려는 노력들이 수행되고 있는데, 특히 그중에서도 맥락막혈관 부위와 전체 맥락막 부위의 비를 나타내는 맥락막혈관 지표(choroidal vascularity index, CVI)가 중심장액맥락망막병증에서 증가되어 있다는 결과가 보고되고 있다.6,7 이는 알려진 중심장액맥락망막병증의 병인인 맥락막의 정수압 상승과 혈관 이상을 잘 설명해 줄 수 있는 결과이다. 그러나 중심장액맥락망막병증에서 망막하액이 동반되며 시력저하를 보이는 활성 상태와 망막하액이 흡수되어 시력 호전을 보이는 안정 상태에서, 맥락막혈관이 어떻게 변화하는지는 명확히 밝혀져 있지 않다. 따라서 저자들은 중심장액맥락망막병증에서 맥락망막 특성을 수치화하여, 정상안과의 비교 분석 및 질병 활성도별로 분석하여, 중심장액맥락망막병증에서 맥락망막 특성이 질병 활성도 및 질병 경과와 연관이 있는지 알아보았다.
2021년 3월부터 2022년 4월까지 충북대학교병원 망막클리닉을 내원한 급성 중심장액맥락망막병증 33안과 연령-대응한 정상대조군 35안 총 68명 68안을 대상으로 의무기록지를 후향적으로 조사하였다. 본 연구는 본원의 임상시험윤리위원회(Institutional Review Board, IRB)의 승인을 받았으며(승인번호: 2021-04-016), 헬싱키선언(Declaration of Helsinki)을 준수하였다.
환자군은 임상병력, 빛간섭단층촬영, 형광안저혈관조영술, 인도사이아닌그린혈관조영술을 통해 급성 중심장액맥락망막병증으로 진단받고, 적어도 4개월 이상 치료 혹은 경과 관찰한 뒤에 망막하액이 완전히 소실된 환자만을 포함하였다. 염증이나 망막혈관 질환 없이 빛간섭단층촬영상 황반부에 망막하액이 관찰되며, 형광안저혈관조영술에서 국소적 누출이 있는 경우 중심장액맥락망막병증으로 진단하였고, 그 증상 지속 기간이 3개월 미만인 경우 급성 중심장액맥락망막병증으로 정의하였다.8 이전에 항혈관내피성장인자항체 혹은 국소레이저광응고술 등의 치료 기왕력이 없던 환자만을 포함하였다. 초진 시 시력저하 및 망막하액을 나타내는 시기를 활성 상태로 칭하였으며, 경과 관찰/항혈관내피성장인자항체 주입술/국소레이저광응고술 후 망막하액이 모두 소실되고 시력이 호전된 상태를 안정 상태로 명명하였다. 형광안저혈관조영술에서 광범위한 누출 혹은 염색 소견을 보이거나 인도사이아닌그린혈관조영술에서 맥락막신생혈관이 관찰되는 등의 만성 중심장액맥락망막병증 혹은 비후 맥락막신생혈관(pachychoriod neovasculopathy)이 관찰되는 경우 제외하였다. 이외에도 당뇨망막병증, 망막혈관폐쇄, 포도막염 등 다른 맥락망막 질환이 합병되는 경우 혹은 고도근시(-5 diopters [D] 이상) 환자도 연구에서 제외하였다. 대조군으로서, 경도 백내장 및 비문증으로 외래에 내원하여 망막 및 맥락막 질환이 관찰되지 않는 정상 환자들을 대상으로 35명 35안을 선별하여 연구에 활용하였다. 맥락막두께와 특성은 나이와 연관 관계가 있으므로, 나이에 따른 오차를 줄이기 위해 대조군은 중심장액맥락망막병증군과 연령대응하였다.9
모든 피험자에서 시력 측정, 안저검사, 빛간섭단층촬영(Spectralis optical coherence tomography, Heidelberg Engineering, Heidelberg, Germany)을 시행하였으며, 나이, 성별, 시력, 자동굴절검사상 구면대응치에 대한 정보를 수집하였다. 황반을 통과하는 수평의 향상된 깊이 이미지(enhanced depth imaging, EDI) 빛간섭단층촬영 사진을 분석에 활용하였다. 중심와에서 브루크막으로부터 떨어진 망막의 시세포 끝까지의 수직 길이를 망막하액의 높이로 정하였으며, 마찬가지로 황반부의 브루크막으로부터 맥락막-공막 경계까지의 높이를 맥락막두께로 측정하였다(Fig. 1). 또한, 누출점의 상대적 위치를 확인하기 위해 형광안저혈관조영술에서 나타나는 누출점의 위치와 중심와와의 거리를 프로그램(Heidelberg retina angiograph 2, Heidelberg Engineering)을 이용해 수동 측정하였다.
획득한 수평 빛간섭단층촬영 이미지를 활용해 Image J (Version 1.52; provided in the public domain by the National Institutes of Health, Bethesda, MD, USA; https://imagej.nih.gov/ij/) 프로그램을 이용하여 CVI를 측정하였다.10 다각형 선택 도구를 이용해 전체 맥락막 범위(수직으로는 브루크막에서 맥락막-공막 경계까지, 수평으로는 시신경에서 이미지의 끝까지 약 7,000 μm)를 선택하여 그 넓이를 측정하였으며, 이를 전체 맥락막 범위(total choroidal area, TCA)라고 정의하였다. 측정 오차를 줄이기 위해 무작위로 3-4개의 맥락막혈관의 밝기의 평균을 최소 밝기로 하여 이미지의 밝기를 보정하였다. 이후, 이미지를 8 bit로 변환하고 Niblack 방식으로 자동 흑백 이원화 변환하였다. 이원화된 이미지를 다시 red, green, blue (RGB) 이미지로 변환하였으며, 문턱 도구를 통해 밝은 부분의 넓이와 어두운 부분의 넓이를 각각 측정하였다. 밝은 부분의 넓이를 맥락막 간질 범위(stromal choroidal area, SCA)로, 어두운 부분의 넓이를 맥락막혈관 범위(luminal choroidal area, LCA)로 각각 정의하였다(Fig. 1). 측정의 신뢰도를 높이기 위해 동일한 이미지를 대상으로 두 명의 안과의사가(E.J.S. and G.L.) 독립적으로 변환 및 측정하였으며, 그 평균을 연구에 활용하였다.
급성 중심장액맥락망막병증 환자군 33안과 연령-대응한 정상대조군 35안을 비교하여 중심장액맥락망막병증 환자의 맥락막 특성을 이해하고자 하였으며, 중심장액맥락망막병증 환자군에서 치료 전(활성 상태)과 망막하액이 모두 흡수된 상태(안정 상태)에서 시력, 맥락막두께와 지표가 어떻게 변화하는지 비교하였다. 치료에 있어서 anti-vascular endothelial growth factor (anti-VEGF) 사용의 영향을 확인하기 위해, 안구 내 항혈관내피성장인자항체 주입술을 시행한 15안과 치료 없이 경과 관찰한 15안으로 나누어 비교 분석하였다. 시력은 통계 분석을 위하여 스넬렌시력을 logarithm of the minimal angle resolution (logMAR)으로 변환하여 비교 분석하였다. 통계적인 분석은 SPSS 통계 프로그램(Version 22.0, SPSS Inc., Chicago, IL, USA)을 사용하여 시행하였다. 두 군의 임상 특징을 비교하기 위해 독립표본 T 검정과 대응표본 T 검정이 사용되었으며, p값이 0.05 미만인 경우 통계적인 유의성이 있는 것으로 판단하였다.
총 33명 33안의 급성 중심장액맥락망막병증군과 그에 연령대응한 정상 대조군 35명 35안을 분석하였다. 초기 시력이 중심장액맥락망막병증군에서 대조군에 비해 유의하게 불량하였으나, 이외에는 나이, 굴절오차 등에서 두 군 간 차이가 없었다(Table 1). 중심장액맥락망막병증에서 누출점의 중심와로부터의 거리는 평균 875.8 ± 264.0 μm로 대부분에서 중심와부근(perifovea)에 존재하였다.
빛간섭단층촬영을 이용해 맥락막두께 및 그 특성을 분석하였다(Table 2). 중심장액맥락망막병증과 연령대응 대조군을 비교하였을 때 중심장액맥락망막병증 안에서 유의하게 두꺼운 맥락막두께, 높은 TCA, LCA 및 CVI를 나타냈다. 평균 5.6개월의 치료 기간 동안 경과 관찰, 항혈관내피성장인자항체 주입술 혹은 국소레이저광응고술 시행 후 망막하액이 모두 흡수된 상태(안정 상태)에서 optical coherence tomography (OCT) 검사를 다시 시행하였으며, 초진시의 활성 상태와 비교하였다. 활성 상태와 비교하여, 안정 상태에서 시력이 유의하게 호전되었으며 맥락막두께도 유의한 감소를 보였다. 맥락막의 특성을 관찰하였을 때, 안정 상태에서 활성 상태에 비해 TCA, LCA와 SCA 모두 감소를 보였으나, 그 감소폭이 LCA보다 SCA가 더 컸으며 결과적으로 CVI의 증가를 나타냈다(Fig. 2).
본 연구를 통해 저자들은 중심장액맥락망막병증에서 대조군에 비해 두꺼운 맥락막두께 및 증가된 CVI를 나타낸다는 사실을 확인하였으며, 나아가 활성 상태에 비해 안정 상태에서 더 높은 CVI값을 보인다는 사실을 확인하였다. 항혈관내피성장인자항체 주입술 여부는 맥락막혈관 특성 변화에 큰 연관성을 보이지 않았다.
중심장액맥락망막병증의 원인으로 맥락막혈류 증가 및 정수압 증가, 맥락막모세혈관의 미세순환 이상, 망막색소상피의 박리 및 결손, 누출 과정을 거치는 일련의 병인기전이 잘 알려져 있다.11 빛간섭단층촬영이나 빛간섭단층혈관조영술을 이용하여 맥락막을 분석해 보았을 때, 중심장액맥락망막병증에서 맥락막의 두께가 두꺼워져 있으며, 조금 더 면밀하게 그 특성을 확인하면 확장된 맥락막혈관과 증가된 CVI가 보고되었다.7,8 최근에는 맥락막의 비후, 맥락막혈관의 확장, 맥락막모세혈관의 위축의 일련의 특징을 보이는 질환군을 비후맥락막병증(pachychoriod spectrum disorders)으로 정의하고 있으며, 중심장액맥락망막병증도 이 질환군에 포함되는 것으로 생각하고 있다.12
빛간섭단층촬영, 특히 EDI를 이용한 촬영이 개발되고 보편화되면서 맥락막의 시각화가 가능해졌으며, 이를 이용해 중심장액맥락망막병증에서 CVI에 관한 연구가 많이 진행되었다. 급성 중심장액맥락망막병증에서 반대안에 비해 CVI가 증가되어 있는 현상이 보고되었는데, 이는 중심장액맥락망막병증의 병인으로 생각하는 맥락막혈관 확장 및 정수압 증가로 인한 것임을 뒷받침하는 측정 결과이다.7 정면빛간섭단층촬영을 이용해 맥락막의 깊이별로 CVI를 확인하여 보았을 때, 맥락막모세혈관에 비해 전체 맥락막두께의 25%, 33%, 50% 및 75% 깊이로 내려갈수록 CVI가 증가한다는 사실은 내측 맥락막두께보다 외측 맥락막의 혈관 확장이 두드러지는 비후 맥락막병증의 특징을 반영한다.13 또한, 정면빛간섭단층촬영으로 측정한 중심장액맥락망막병증의 외측 맥락막혈관이 정상안에 비해 그물 모양으로 재배치되어 있다는 현상은 병인에 있어 외측 맥락막혈관의 이상이 연관되어 있다는 것을 나타낸다.14
또한, 중심장액맥락망막병증환자에서는 고혈압이 흔히 관찰되며, 교감-부교감 불균형이 나타나기도 한다.15,16 실험적으로 운동부하를 통해 혈압 상승을 유도하였을 때 중심장액맥락망막병증 환자에서는 맥락막의 혈관밀도가 대조군에 비해 크게 증가하였는데, 이는 중심장액맥락망막병증에서 항진되어 있는 혈관 반응성을 보여주는 결과이다.17 맥락막혈류의 항상성은 맥락막혈관내피세포의 자율신경계 반응으로 유지되는데, 교감계와 부교감계의 균형이 깨지는 경우, 교감신경계의 과항진과 이로 인한 비혈관성 평활근의 이완으로 맥락막혈관 확장 및 맥락막두께 증가가 나타날 수 있기 때문이다.18,19 최근에는 중심장액맥락망막병증의 병인에 관여하는 각 유전자에 따라 각기 다른 맥락막의 두께와 CVI를 보여 각각의 유전자가 서로 다른 병리기전에 관여할 것으로 추정하였다.20
특히, 중심장액맥락망막병증이 맥락막의 혈류 이상과 연관되는 만큼, 만성 중심장액맥락망막병증에서는 신생혈관이 동반되기도 하는데, 이때 나타나는 신생혈관의 혈류 역시 혈압 및 자율신경계 변화와 밀접한 연관이 있었다.21 국내 연구에서도 급성 중심장액맥락망막병증 및 신생혈관이 동반되지 않은 만성 중심장액맥락망막병증에 비해 신생혈관이 동반된 만성 중심장액맥락망막병증에서 유의하게 낮은 CVI를 나타냈으며, 이는 중심장액맥락망막병증에서 신생혈관의 발생 메커니즘을 밝히는 데 도움이 될 수 있는 연구 결과로 생각된다.22
그러나 중심장액맥락망막병증에서 망막하액이 존재하는 활성 상태에서와 망막하액이 모두 흡수된 후의 안정 상태에서의 맥락막 특성 변화에 대한 보고는 그 결과가 일정치 않다.7,23,24 활성 상태에서 안정 상태에 비해 더 높은 CVI를 보인다는 결과가 보고된 바 있는데, 이는 아마도 맥락막혈관의 확장이 병인의 주된 원인이 되기 때문일 것으로 추측하였다.7 반대로 활성 상태와 안정 상태에서 CVI값이 큰 차이를 보이지 않는다는 연구 결과도 발표된 바 있다.23 이처럼 보고마다 맥락막 특성 변화에 차이가 있는 것은 그 측정 방식이 일관되지 않았기 때문으로 생각된다.
본 연구에서는 안정 상태에서 활성 상태보다 더 높은 CVI를 나타냈다. 안정 상태에서 SCA와 LCA가 모두 감소하지만, 그 감소폭에 있어서 SCA가 LCA보다 더 컸고, 따라서 CVI의 증가를 보인 것이다. 중심장액맥락망막병증의 활성 상태에서는 확장된 맥락막혈관에서 맥락막 간질로 수분이 이동하여 간질 부종이 발생하고, 맥락막 정수압 상승과 망막하 공간으로의 침투가 발생한다. 안정 상태에서는 맥락막혈관의 수축은 덜 나타나지만 간질의 부종이 대폭 호전되므로, 결국 전체 맥락막 면적 중 혈관 면적을 의미하는 CVI가 오히려 증가하는 결과를 보인 것으로 해석할 수 있다.
앞선 연구와 맥락막 결과 분석에 있어서 차이를 보인 것은 맥락막의 분석 방법 차이에서 기인할 것으로 생각해 볼 수 있다.7 앞선 연구에서는 황반부 1,500 μm의 범위에서 CVI를 계산하였으나,7 본 연구에서는 OCT에서 나타난 전체 면적인 7,000 μm의 범위에서 CVI를 계산하였다. 두 연구를 비교해 보았을 때 안정 상태에서 병변 근처의 국소적인 CVI는 감소하였으나 전반적인 CVI는 증가하였는데, 이는 활성 상태의 중심장액맥락망막병증에서 보이는 맥락막혈관의 확장이 전체 맥락막에서 균일하게 나타나는 것이 아니라 황반 근처에서 국소적으로 나타나는 것이며, 이 확장되고 누출되는 몇 개의 맥락막혈관에 의해 전체적인 맥락막의 간질 부종이 나타나고 정수압이 증가한다는 사실을 유추할 수 있다. 중심장액맥락망막병증 환자에서 맥락막을 구역별로 나누어 CVI를 계산하였을 때, 황반부 근처에서 CVI값이 가장 높았다는 사실과 이러한 특징이 정상안보다 중심장액맥락망막병증 안에서 두드러지게 나타난다는 사실은 맥락막혈관 확장이 국소적으로 나타날 수 있다는 가능성을 뒷받침한다.6,25
두 번째로 생각할 수 있는 가능성은 활성 상태와 안정 상태에서 맥락막혈관의 면적 변화가 그리 크지 않을 수 있다는 것이다. 중심장액맥락망막병증의 병인에 있어서 맥락막혈관 확장은 자율신경계의 항진 혹은 안구의 정맥압 증가 등에서 기인한다고 생각되고 있다.26,27 따라서 맥락막혈관을 확장시킬 수 있는 근본적인 원인이 교정되지 않는 경우, 맥락막혈관 면적의 변화는 미미할 수 있으며, 결국 안정 상태에서 다시 활성 상태로 자주 재발하는 경과를 보일 수 있다.
인도사이아닌그린혈관조영술을 이용한 연구에서 중심장액맥락망막병증안에서는 맥락막혈관의 확장과 과투과성이 국소적이 아닌 후극부 전반에 걸쳐 나타내므로, 중심장액맥락망막병증을 국소적인 맥락막혈관 질환으로 보기는 어렵다.26,28 그러나 본 연구를 통해 중심장액맥락망막병증의 안정 상태에 비해 활성 상태에서 맥락막혈관의 면적 확장보다도 이의 누출로 인한 미만성 간질 부종이 맥락막 전반에 걸쳐서 더욱 확연히 나타나는 것임을 확인할 수 있었다. 즉, 간질 부종 정도가 중심장액맥락망막병증의 활성도에 있어서 맥락막혈관의 면적보다 조금 더 정확한 생체 지표(biomarker)가 될 수 있음을 시사한다.
신생혈관이 동반된 만성 중심장액맥락망막병증에서는 항혈관내피성장인자항체 사용이 망막하액을 줄일 수 있다고 보고되어 있으나,29,30 급성 중심장액맥락망막병증에서 망막하액을 줄이기 위해 항혈관내피성장인자항체를 사용하는 것은 그 이론적 근거가 대체로 명확치 않다.31,32 본 연구에서는 항혈관내피성장인자항체를 사용하는 것이 맥락막의 두께 및 CVI 변화에 영향을 주지 않았다. Kim et al33은 급성 중심장액맥락망막병증에서 항혈관내피성장인자항체 치료 후 맥락막두께 감소를 보고하였고, 특히 초기 맥락막이 두꺼워져 있는 눈일수록 치료 효과가 좋다고 하였다. 본 연구에서도 항혈관내피성장인자항체 치료 후 맥락막의 두께 감소가 나타나기는 하였으나 그 경과 관찰군과 통계적으로 유의한 차이가 나지 않았다. 치료 후 시력이 유의하게 항혈관내피성장인자항체를 사용한 그룹에서 나빴으나(Table 4), 이는 본 연구가 후향적 연구이므로 경과 관찰에서 망막하액이 잘 흡수되지 않는 눈에서 항혈관내피성장인자항체를 사용하였기 때문으로 해석하였다.
본 연구는 적은 수의 표본을 이용한 후향적 연구라는 한계점이 있다. CVI 측정을 자동화된 방법이 아닌 Image J를 이용해 수동으로 측정하였다는 점에서 신뢰도가 떨어질 수 있으나, EDI 이미지만을 사용하였고 화질이 떨어지는 이미지는 분석에서 제외하였으며 두 평가자가 독립적으로 측정을 시행하고 이의 평균값을 분석에 사용하여 신뢰도를 최대한 높이고자 하였다. CVI 측정에 있어서 빛간섭단층촬영에서 측정 가능한 전체 범위에서 맥락막 특성을 평가하였으므로, 국소적인 혈관 변화를 확인하기 어렵다는 한계점이 있다. 또한 본 연구에서 누출점은 중심와에서 평균 약 875.8 ± 264.0 μm 떨어진 곳에 존재하였으므로 중심와를 가로지르는 빛간섭단층촬영 영상에서 맥락막혈관의 변화가 직접적으로 확인되지 않았을 가능성이 있다. 그러나 그럼에도 불구하고 간질 부종이 전체 맥락막에서 미만성으로 나타난다는 본 연구의 결론에는 큰 변화가 없을 것으로 생각되며, 더불어 CVI의 측정을 누출점이 포함된 1,000-1,500 μm에서 국소적으로 측정하고 동시에 1개의 횡단면 사진으로 분석하는 것이 아닌 전체 황반부 영역에서 volume scan으로 분석하는 등의 추가 연구를 계획하고 있으며, 이를 통해 국소적, 전반적 맥락막혈관과 간질의 특성에 대한 정보를 더 얻을 수 있을 것으로 기대하고 있다.
결론적으로 중심장액맥락망막병증에서는 연령대응 대조군에 비해 두꺼운 맥락막두께와 증가된 CVI를 나타냈다. 망막하액이 모두 흡수된 안정 상태에서는 망막하액이 있는 활성 상태에 비해 맥락막두께가 감소하였다. 맥락막의 특성을 보았을 때, 맥락막혈관 범위의 감소폭보다 맥락막 간질 범위의 감소폭이 더 컸으며, 이는 CVI의 증가로 나타났다. 즉, 질병의 활성도를 확인하는 지표로서 맥락막혈관의 변화보다도 맥락막 간질의 부종 정도가 더 밀접하게 연관이 있었다. 치료에 있어서 항혈관내피성장인자항체의 사용 유무는 맥락막 특성 변화에 영향을 주지 않았다.
Acknowledgments
This work was supported by the research grant of the Chungbuk National University in 2022.
Figure 1.
Measurement of the biomarkers using optical coherence tomography. (A) Representative image of central serous chorioretinopathy and the measurement of subretinal fluid height (line) and subfoveal choroidal thickness (dotted line). (B) Binarized image with Niblack method using image J software. The yellow line highlights the black area, which is considered the luminal choroidal area. The white area is considered the stromal choroidal area.

Figure 2.
Analysis of choroidal change between the active and resolved status of central serous chorioretinopathy (CSC). (A) A comparison of subfoveal choroidal thickness between the active and resolved CSC. (B) A comparison of total choroidal area (TCA), luminal choroidal area (LCA), and stromal choroidal area (SCA) between active and resolved CSC. (C) A comparison of choroidal vascularity index (CVI) between active and resolved CSC. The asterisk indicates that the p-value was below 0.05 (A-C). (D) A more significant reduction in SCA area (20.2%) than LCA (7.1%) leads to increased CVI after the resolution of subretinal fluid (SRF).
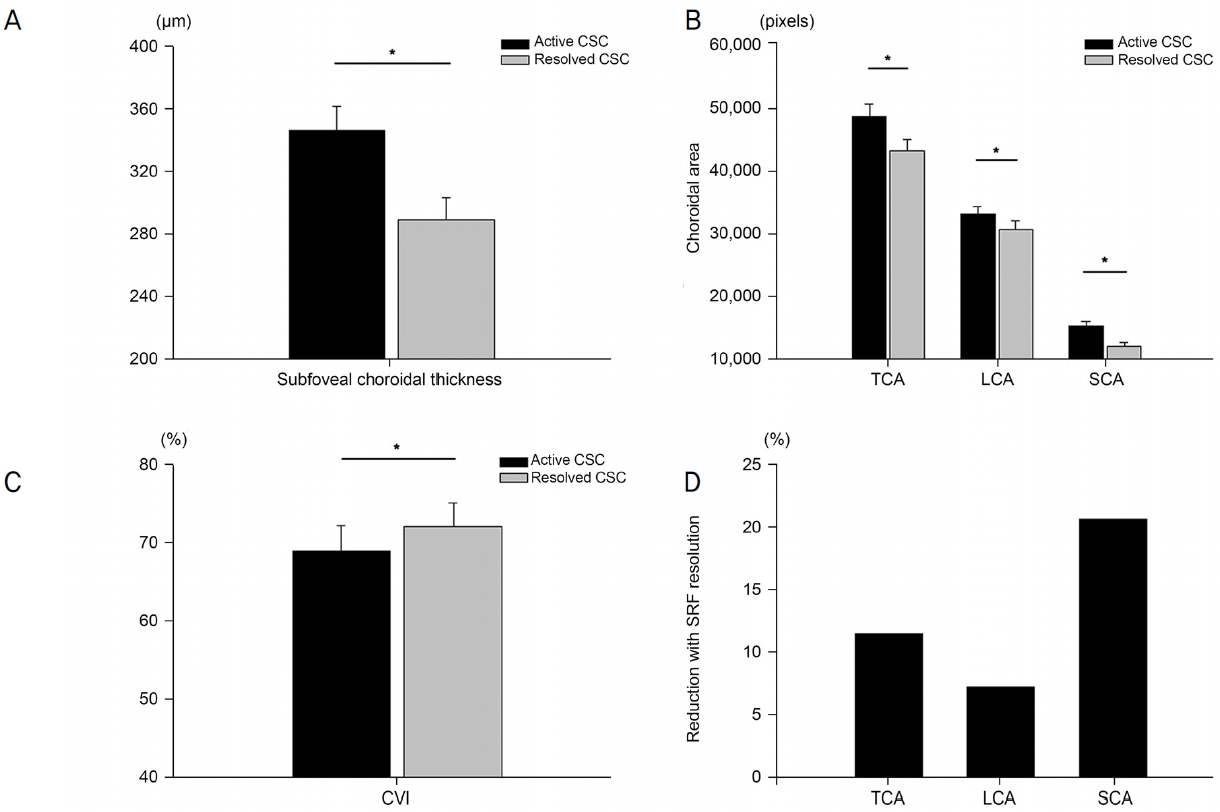
Table 1.
Demographic features of study population
| CSC (active status) | Age-matched control | p-value | |
|---|---|---|---|
| Total number (eyes) | 33 | 35 | |
| Sex, male/female | 26/7 | 22/13 | 0.150* |
| Age (years) | 55.1 ± 9.6 | 59.0 ± 7.8 | 0.072† |
| Visual acuity (logMAR) | 0.23 ± 0.20 | 0.02 ± 0.06 | <0.001† |
| Spherical equivalent (D) | -0.23 ± 1.57 | 0.13 ± 1.14 | 0.280† |
| Distance of leaking point from fovea (µm) | 875.8 ± 264.0 | - |
Table 2.
Comparison between active status and resolved status of central serous chorioretinopathy
| Age-matched control |
CSC |
p-value* | p-value† | ||
|---|---|---|---|---|---|
| Active | Resolved | ||||
| VA (logMAR) | 0.02 ± 0.06 | 0.23 ± 0.20 | 0.09 ± 0.12 | <0.001 | <0.001 |
| Sf ChThk (µm) | 234.08 ± 44.81 | 348.79 ± 86.95 | 291.82 ± 81.64 | <0.001 | <0.001 |
| TCA (pixel) | 42,811 ± 8,410 | 49,349 ± 11,508 | 43,783±10,979 | 0.016 | <0.001 |
| LCA (pixel) | 28,395 ± 5,470 | 33,634 ± 7,136 | 31,240 ± 7,488 | 0.003 | 0.011 |
| SCA (pixel) | 14,417 ± 3,169 | 15,715 ± 4,680 | 12,542 ± 3,790 | 0.244 | <0.001 |
| CVI (%) | 66.4 ± 2.43 | 68.55 ± 3.18 | 71.58 ± 2.98 | 0.008 | <0.001 |
Values are presented as mean ± standard deviation.
CSC = central serous chorioretinopathy; VA = visual acuity; logMAR = logarithm of maximum angle resolution; Sf ChThk = subfoveal choroidal thickness; TCA = total choroidal area; LCA = luminal choroidal area; SCA = stromal choroidal area; CVI = choroidal vascularity index.
Table 3.
Baseline characteristics between the eyes treated with anti-VEGF and the eyes spontaneously resolved with observation
| Anti-VEGF | Observation | p-value | |
|---|---|---|---|
| Total number (eyes) | 15 | 15 | |
| Sex, male/female | 12/3 | 11/4 | 0.666* |
| Age (years) | 57.6 ± 9.6 | 50.6 ± 7.7 | 0.037† |
| Visual acuity (logMAR) | 0.26 ± 0.14 | 0.14 ± 0.19 | 0.052† |
| Spherical equivalent (D) | -0.06 ± 1.38 | -0.68 ± 1.10 | 0.184† |
| SRF (µm) | 126.73 ± 80.18 | 158.47 ± 82.94 | 0.296† |
| Sf ChThk (µm) | 353.60 ± 102.52 | 353.73 ± 79.11 | 0.980† |
| CVI (%) | 69.07 ± 2.67 | 68.07 ± 2.83 | 0.357† |
| Distance of leaking point from fovea (µm) | 857.5 ± 250.0 | 909.4 ± 293.5 | 0.622† |
Table 4.
Comparison of central serous chorioretinopathy eyes treated with anti-VEGF and the eyes spontaneously resolved with observation
REFERENCES
1) Maumenee AE. Macular diseases: clinical manifestations. Trans Am Acad Ophthalmol Otolaryngol 1965;69:605-13.

2) Aydin E. The efficacy of intravitreal bevacizumab for acute central serous chorioretinopathy. J Ocul Pharmacol Ther 2013;29:10-3.


3) Lim SJ, Roh MI, Kwon OW. Intravitreal bevacizumab injection for central serous chorioretinopathy. Retina 2010;30:100-6.


4) Chung YR, Kim JW, Song JH, et al. Twelve-month efficacy of intravitreal bevacizumab injection for chronic, atypical, or recurrent central serous chorioretinopathy. Retina 2019;39:134-42.


5) Ma J, Meng N, Xu X, et al. System review and meta-analysis on photodynamic therapy in central serous chorioretinopathy. Acta Ophthalmol 2014;92:e594-601.


6) Singh SR, Invernizzi A, Rasheed MA, et al. Wide-field choroidal vascular analysis in central serous chorioretinopathy. Eur J Ophthalmol 2021;31:2520-7.



7) Agrawal R, Chhablani J, Tan KA, et al. Choroidal vascularity index in central serous chorioretinopathy. Retina 2016;36:1646-51.


8) Seo EJ, Um T, Yoon YH. Abnormal choroidal flow on optical coherence tomography angiography in central serous chorioretinopathy. Clin Exp Ophthalmol 2019;47:505-12.



9) Lin CY, Huang YL, Hsia WP, et al. Correlation of choroidal thickness with age in healthy subjects: automatic detection and segmentation using a deep learning model. Int Ophthalmol 2022;42:3061-70.



10) Sonoda S, Sakamoto T, Yamashita T, et al. Choroidal structure in normal eyes and after photodynamic therapy determined by binarization of optical coherence tomographic images. Invest Ophthalmol Vis Sci 2014;55:3893-9.


11) Nicholson B, Noble J, Forooghian F, Meyerle C. Central serous chorioretinopathy: update on pathophysiology and treatment. Surv Ophthalmol 2013;58:103-26.



13) Wong RL, Singh SR, Rasheed MA, et al. En-face choroidal vascularity in central serous chorioretinopathy. Eur J Ophthalmol 2021;31:536-42.



14) Savastano MC, Dansingani KK, Rispoli M, et al. Classification of haller vessel arrangements in acute and chronic central serous chorioretinopathy imaged with en face optical coherence tomography. Retina 2018;38:1211-5.


15) Eom Y, Oh J, Kim SW, Huh K. Systemic factors associated with central serous chorioretinopathy in Koreans. Korean J Ophthalmol 2012;26:260-4.



16) Daruich A, Matet A, Dirani A, et al. Central serous chorioretinopathy: recent findings and new physiopathology hypothesis. Prog Retin Eye Res 2015;48:82-118.


17) Cardillo Piccolino F, Lupidi M, Cagini C, et al. Choroidal vascular reactivity in central serous chorioretinopathy. Invest Ophthalmol Vis Sci 2018;59:3897-905.


19) May CA. Non-vascular smooth muscle cells in the human choroid: distribution, development and further characterization. J Anat 2005;207:381-90.



20) Morino K, Miyake M, Kamei T, et al. Association between central serous chorioretinopathy susceptibility genes and choroidal parameters. Jpn J Ophthalmol 2022;66:504-10.



21) Lupidi M, Fruttini D, Eandi CM, et al. Chronic neovascular central serous chorioretinopathy: a stress/rest optical coherence tomography angiography study. Am J Ophthalmol 2020;211:63-75.


22) Kim RY, Chung DH, Kim M, Park YH. Use of choroidal vascularity index for choroidal structural evaluation in central serous chorioretinopathy with choroidal neovascularization. Retina 2020;40:1395-402.


23) Rasheed MA, Goud A, Mohamed A, et al. Change in choroidal vascularity in acute central serous chorioretinopathy. Indian J Ophthalmol 2018;66:530-4.



24) Singh SR, Beale O, Nkrumah G, et al. Correlation of sectoral choroidal vascularity with angiographic leakage in central serous chorioretinopathy. Eur J Ophthalmol 2022;32:1050-6.


25) Sahoo NK, Singh SR, Beale O, et al. Choroidal vascularity map in unilateral central serous chorioretinopathy: a comparison with fellow and healthy eyes. Diagnostics (Basel) 2021;11:861.



26) Spaide RF, Gemmy Cheung CM, Matsumoto H, et al. Venous overload choroidopathy: a hypothetical framework for central serous chorioretinopathy and allied disorders. Prog Retin Eye Res 2022;86:100973.


27) Tewari HK, Gadia R, Kumar D, et al. Sympathetic-parasympathetic activity and reactivity in central serous chorioretinopathy: a case-control study. Invest Ophthalmol Vis Sci 2006;47:3474-8.


28) Jeong S, Kang W, Noh D, et al. Choroidal vascular alterations evaluated by ultra-widefield indocyanine green angiography in central serous chorioretinopathy. Graefes Arch Clin Exp Ophthalmol 2022;260:1887-98.



29) Alishiri A, Jadidi K, Mosavi SA, Torabi H. Intravitreal bevacizumab administration for the treatment of chronic central serous chorioretinopathy. J Curr Ophthalmol 2019;31:406-10.



30) Schaal KB, Hoeh AE, Scheuerle A, et al. Intravitreal bevacizumab for treatment of chronic central serous chorioretinopathy. Eur J Ophthalmol 2009;19:613-7.



31) Chung YR, Seo EJ, Lew HM, Lee KH. Lack of positive effect of intravitreal bevacizumab in central serous chorioretinopathy: meta-analysis and review. Eye (Lond) 2013;27:1339-46.




-
METRICS

-
- 0 Crossref
- 0 Scopus
- 799 View
- 61 Download
- Related articles
-
Clinical Manifestations of Steroid-associated Central Serous Chorioretinopathy.2018 April;59(4)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



