 |
 |
| J Korean Ophthalmol Soc > Volume 64(7); 2023 > Article |
|
국문초록
증례요약
48세 여자 환자가 우안 시력저하 및 통증을 주소로 내원하였다. 내원 20일 전 타병원에서 급성폐쇄각녹내장으로 진단받고 레이저홍채절개술을 받은 후 축동제를 내원 전일까지 하루 2회 점안하였다. 우안 나안시력 안전수동, 안압 33 mmHg였고, 11시 방향에 홍채절개창, 각막의 미세낭포, 전방 염증 및 각막내피침착물, 녹내장수정체혼탁이 관찰되었고, 수정체와 홍채가 전방이동되어 있었다. 아트로핀과 충분한 안압하강제 사용에도 전방은 더욱 좁아지고 근시 변화가 4.5 diopters 진행되어 방수흐름이상증후군으로 진단하였다. 유리체절제술을 먼저 시행한 후 초음파수정체유화술 및 인공수정체삽입술, 수술적 후낭절개를 하였다. 수술 중 유리체 염증, 주변부 망막의 눈덩이, 앞유리체 염증성 막이 확인되어 중간포도막염이 동반된 것을 알 수 있었다.
ABSTRACT
Purpose
We report a case of aqueous misdirection syndrome triggered by pilocarpine use after laser iridotomy, which was treated by pars plana vitrectomy and phacoemulsification.
Case summary
A 48-year-old female patient presented with sudden-onset right eye pain and decreased vision. The patient had presented to another institute with similar symptoms 20 days prior; she had been diagnosed with acute angle closure. Laser iridotomy was performed, followed by administration of pilocarpine twice daily. In the right eye, visual acuity was hand motion, and intraocular pressure was 31 mmHg. The laser iridotomy site was located at the 11 o’clock position; microcysts, anterior chamber cells, corneal endothelium precipitates, and glaukomflecken were observed. The anterior chamber was shallow due to forward movement of the lens and iris. Despite the application of atropine and pressure-lowering eyedrops, anterior chamber shallowing continued along with a progressive myopic shift of -4.5 diopters. Therefore, the patient was diagnosed with aqueous misdirection syndrome. Pars plana vitrectomy was performed, followed by phacoemulsification, intraocular lens insertion, and posterior capsulotomy. During surgery, vitreous inflammation, a peripheral snowball, and an anterior hyaloid inflammatory membrane were observed, indicating the presence of intermediate uveitis.
방수흐름이상증후군(aqueous misdirection syndrome)은 초음파수정체유화술 및 인공수정체삽입술, 유리체절제술, 섬유주절제술, 야그레이저후낭절개술 등의 안구수술 후 발생할 수 있는 안압상승을 동반한 심각한 합병증 중 하나이다.1,2 방수흐름이상증후군으로 인한 안압상승은 치료가 매우 어렵기 때문에 1869년 Von Graefe3는 악성 녹내장(malignant glaucoma)으로 명명하였다. 이후 유사한 임상 양상을 보이는 상태를 섬모유리체차단녹내장(ciliovitreal block glaucoma), 섬모체차단녹내장(ciliary block glaucoma), rock-hard eye syndrome 등으로 보고하였으며,1 이들의 정확한 기전은 알려지지 않았지만 공통적으로 수정체, 섬모체, 앞유리체의 부적절한 관계에 의해 발생하는 방수의 흐름이상(aqueous misdirection)이 원인일 것으로 생각되어 최근 방수흐름이상증후군으로 통칭하고 있다.4
전형적인 방수흐름이상증후군은 전방의 중심과 주변이 동시에 좁아지고, 안압이 21 mmHg 이상의 상승을 보이며, 축동제 치료로 안압상승이 해결되지 않는 특징을 가진다.2,5 다양한 안과 시술 후 발생할 수 있으며, 녹내장과 관련하여서는 섬유주절제술 후 0.6-4%로 가장 많이 보고되고 있으며,6-8 폐쇄각녹내장 환자에서 외과적 홍채절제술(surgical iridectomy) 후 0.4-0.6%,9 혹은 외상이나 안구 내 염증 이후 발생하였다는 보고가 있다.10,11
본 증례는 좁은 전방각과 고원홍채를 가진 중간포도막염 환자가 레이저홍채절개술 후 축동제를 사용하는 중 발생한 방수흐름이상증후군을 단계적으로 치료한 증례를 보고하고자 한다.
우안의 시력저하와 통증을 주소로 48세 여자 환자가 본원에 내원하였다. 여동생의 류마티스 질환 가족력 이외 특이 과거력, 수술력 및 약물 복용력은 없었다. 본원 내원 20일 전 구토 및 우안 안구통증, 시력저하가 있어 타병원에서 우안 급성폐쇄각녹내장 진단받고 20% 만니톨 200 mL 정맥 주사, 경구 acetazolamide (Acetazol®, Hanlim, Yongin, Korea) 250 mg을 하루 4정 복용하였고, 점안 안압하강제로 0.15% brimonidine tartrate (Alphagan®, Allergan, Irvine, CA, USA), latanoprost (Xalatan®, Pfizer, New York, NY, USA), dorzolamide hydrochloride-timolol maleate (Cosopt®, Akorn, Lake Forest, IL, USA)를 사용한 후 다음 날 레이저홍채절개술(laser iridotomy)을 시행하였다. 시술 후 2% pilocarpine hydrochloride (Ocucarpine®, Samil, Seoul, Korea)를 본원 내원 전일까지 11일간 하루 2회 점안하였다. 본원에는 첫 번째 발병의 증상과 동일한 시력저하와 안구통증으로 내원하였다.
우안 동공은 산동 상태로 고정되어 있었으며, 세극등현미경검사상 11시 방향에 홍채절개창(Fig. 1A)과 미세낭포, 각막후면침착물(keratic precipitate)이 관찰되었다. 전방의 염증은 The Standardization of Uveitis Nomenclature working group grading 기준상 grade 4로, 심하였으며 360도 홍채후유착이 관찰되었다. 수정체는 Lens Opacities Classification III 기준상 우안 핵경화 1단계로 전반적으로 앞으로 이동되어 있었으며 전낭하 녹내장수정체혼탁(glaukomfleken)이 관찰되었다(Fig. 1B). 중심각막두께의 1/4 정도로 얕아진 주변부 전방과 중심각막두께의 1/3 정도로 좁아진 중심 전방이 관찰되었다(Fig. 1C, D). 전방각경검사상 우안은 12시 방향을 제외한 나머지는 Spaeth grade A20r로 확인되었고, 좌안은 매우 좁지만 공막극이 관찰되는 C10s 상태였다(Table 1). 세극등현미경검사상 앞유리체막에 염증성 막이 관찰되었으며 염증으로 앞유리체가 혼탁하여 안저검사가 어려웠다. 본원 내원 시 교정시력 우안 안전수동, 좌안 1.0이었으며 3가지의 점안 안압하강제와 경구 acetazolamide를 최대량 사용함에도 불구하고 골드만압평안압계상 우안 33 mmHg, 좌안 10 mmHg였다(Table 1). 안압하강을 위한 20% 만니톨 200 mL 정맥 주사 후 안압은 14 mmHg로 하강되었다. 전방의 염증이 심하여 1% prednisolone acetate (Predforte®, Allergan, Irvine, CA, USA)를 하루 2시간 간격으로 추가로 점안하였으며, pilocarpine은 즉시 중단하였다. 내원 2일째 안압은 여전히 33 mmHg였고 수정체와 홍채가 더욱 전방 이동한 상태였다. 전안부 빛간섭단층촬영술(Anterion, Heidelberg Engineering, Heidelberg, Germany)로 측정한 중심전방깊이(anterior chamber depth)는 우안 1.75 mm, 좌안 2.01 mm였다. 우안은 수정체와 홍채가 동시에 앞으로 이동해 있었고(Fig. 2A). 좌안은 주변부의 좁은 전방각과 고원홍채(plateau iris)가 확인되었다(Fig. 2B). 안축장의 길이는 레이저인공수정체도수측정기(IOL Master Model, Carl Zeiss Meditec, Jena, Germany)로 측정한 결과 우안 안축장 22.97 mm, 좌안 안축장 23.30 mm였다(Table 1). 양안 B-scan 초음파검사상 상공막의 출혈, 맥락막삼출 또는 박리 등은 관찰되지 않았다. 우안의 자동굴절검사는 본원 내원 시 -2.5 diopters (D), 다음날 -3.75 D로 빠르게 근시가 진행되어 방수흐름이상증후군으로 진단하고 1% atropine sulfate (Isopto atropine®, Alcon, Fort Worth, TX, USA)를 하루 3회 점안하였다. 안압하강을 위한 최대의 약물 치료와 atropine 점안에도 불구하고 내원 5일째 -4.50 D로 더욱 근시가 진행되었고, 중심전방깊이(anterior chamber depth)도 1.75 mm에서 1.29 mm로 좁아지며(Table 2), 안압은 37 mmHg로 상승하여 수술적 치료를 계획하였다.
우안 구후마취 후 25게이지 trocar를 이용하여 중심 유리체절제술(core pars plana vitrectomy)만 먼저 시행하여 후방 유리체 압력을 감소시킨 후 2시 방향 각막 측면 통로(side port)를 만들고, 점탄물질(hyaluronate sodium)을 주입하여 홍채뒤유착을 박리하였다. 이후 수정체초음파유화술 후 낭내 인공수정체를 삽입하고 홍채주변앞유착해리술을 시행하였다. 이후 방수이상흐름을 제거하기 위해 유리체절 제침으로 전유리체절제술을 시행하여 주변부 및 앞유리체를 제거하고 후낭절개를 시행하였다. 본 증례는 연속곡선 수정체낭원형절개 중 수정체 전낭 주름 발생이 없었으며, 수술 후 연속곡선수정체낭원형절개 위치의 편위도 관찰되지 않아 유의한 섬모체소대 약화는 없었다고 판단하였다. 수술 중 4시에서 6시 방향의 주변부 망막의 눈덩이(snowball) 소견을 동반한 주변부 망막변성이 관찰되었다. 수술 후 1일째 우안 시력은 0.25, 안압은 20 mmHg였고, 전방 및 인공 수정체 위치는 잘 유지되었다. 수술 3주 후 우안 최대교정 시력은 1.0, 안압은 16 mmHg, 전방각경검사상 Spaeth grade C30r로 개선되었고, 전안부 빛간섭단층촬영술상 우안 중심전방깊이는 5.18 mm로 깊어졌다(Fig. 2C). 좌안 중심전방 깊이는 2.01 mm로 측정되었다(Fig. 2D). 시야검사상 우안 상측 시야결손이 확인되었으며(Fig. 3A) 안저검사상 유리체강 내 grade 2 염증이 지속되고 있었다. 전신 질환에 의한 포도막염을 감별하기 위한 류마티스내과 협진상 결합 조직 질환은 확인되지 않았으나 수술 6주째 중간 포도막염이 재발하여(Fig. 3B, C) 다시 국소 스테로이드 안약을 사용하여 지속적으로 치료하였다. 재발 후 환자 염증 상태에 따라 국소 스테로이드 안약을 단계적으로 감량하여 점안하였고, 또 다른 포도막염의 재발 없이 염증 조절되어 재발 4개월 후 점안 중단하였다. 수술 후 7개월인 현재 망막 및 안압이 안정적으로 유지되어 dorzolamide hydrochloride-timolol maleate (Cosopt®, Akorn)만 하루 2회 점안 유지 중이다.
방수흐름이상증후군(aqueous misdirection syndrome)은 섬모체차단녹내장(ciliary block glaucoma), 악성녹내장(malignant glaucoma), 수정체직접폐쇄녹내장(direct lens-block glaucoma) 등의 여러 명칭으로 불려왔다.5 방수흐름이상증후군의 표준화된 병태생리, 위험인자, 진단 및 치료 방법에 대해서는 아직 충분한 합의가 이루어지지 않았고, 안압 조절과 관련하여 불확실한 예후를 보이며 치료의 반응도 좋지 않다.1 방수흐름이상증후군은 중심 부분을 포함하여 전반적으로 얕아진 전방과 함께 안압이 상승하고 맥락막상강출혈 등과 같은 후안부의 해부학적 이상이 없을 때 진단할 수 있다.5 또한, 개방된 레이저홍채절개창을 통해 동공차단의 징후가 없어야 한다.5
유수정체, 인공수정체 또는 무수정체 모두에서 방수흐름이상증후군이 발생할 수 있으며, 이들의 발생기전에 유리체의 역할이 매우 중요하다. 방수가 유리체강 내로 역류하는 비정상적인 방수의 흐름으로 인해 후방 유리체의 압력이 상승되어 수정체와 홍채가 앞으로 이동하는 것이 유수정체안에서의 방수흐름이상증후군의 가능한 발생기전 중 하나이다.1 또 다른 가설은 섬모체근의 연축으로 인한 섬모체소대 이완은 수정체두께를 증가시키고, 동시에 후방 유리체 압력의 상승은 수정체를 전방 이동시켜 전방이 좁아지게 된다는 것이다.7 Lippas12는 섬모체광응고술, 섬유주절제술 등의 수술, 축동제의 사용, 수술 후 발생한 안내염과 같은 염증 등이 원인이 되어 섬모체근의 연축이 일어나고, 이로 인해 수정체-홍채면의 전방 이동이 일어날 수 있다고 보고하였다. 이때, 이차적으로 폐쇄된 전방각이 관찰되어 수정체직접폐쇄녹내장(direct lens block glaucoma)으로 불리기도 한다. 무수정체 또는 인공수정체안에서의 방수흐름이상증후군은 방수의 유리체 내 역류로 인해 유리체 및 홍채의 전방이동이 일어나 섬모체 돌기와 앞유리체가 접촉하게 된다. 따라서 앞유리막체막이 파열되거나 유리체가 상실된 경우에 오히려 악성녹내장이 호전되는 경향이 있다.
방수흐름이상증후군의 위험인자로는 소안구, 전방각폐쇄의 병력, 고원홍채, 심한 백내장, 거짓비늘증후군, 섬모체소대 약화, 수술 전 고안압, 수술 전 좁은 전방각, 짧은 안축장, 반대안의 악성녹내장 과거력 등이 있다.13 초음파수정체유화술 및 인공수정체삽입술, 공막돌륭술, 유리체절제술, 레이저수정체낭절개술, 레이저섬모체광응고술, 레이저홍채절개술, 공막편 봉합사해리술와 축동제의 사용 등이 원인이 되어 생길 수 있고, 수술 후 다음 날부터 수년 후까지 나타날 수 있다.14
방수흐름이상증후군은 발생을 예측하기 어렵기에 빠른 진단과 치료를 통해 높은 안압으로 인해 발생하는 합병증을 줄여 주어야 한다. 치료 전략은 안압을 조절하고 정상적인 수정체, 홍채, 섬모체, 앞유리체 해부학적 구조를 회복하는 것이다. 일차적 약물 치료로 안압하강제와 유리체 용적을 줄이는 고삼투압제를 사용할 수 있다. 또한, 수정체-홍채면의 후방이동을 위해 조절마비제를 사용한다.5 비수술적 치료로 효과가 없으면 평면부 유리체절제술을 시행하여 앞유리체 및 유리체강 내 방수를 제거함으로써 방수흐름이상증후군의 기전을 해결할 수 있다.1 무수정체안 또는 인공수정체안에서는 약물 치료와 함께 야그레이저후낭절개술 및 앞유리체용해술(anterior vitreolysis)을 시행하여 비정상적인 전방수의 이동을 되돌릴 수 있다.
본 증례의 환자는 홍채절개창이 잘 개방되어 있었지만 중심과 주변부 전방이 모두 좁아져 있었다. Pilocarpine을 중단하고 atropine을 사용하여도 호전되지 않았으며 수정체-홍채면이 앞으로 이동하면서 중심전방깊이는 더 얕아지고 근시화가 진행되었고 충분한 안압하강제의 사용에도 불구하고 안압은 조절되지 않아 방수흐름이상증후군으로 진단하였다. 그 외 전방 너비(anterior chamber width), vault 값(anterior vault distance), 동공 크기(pupil size)는 각각 우안 초기 11.87 mm, 1.33 mm, 5.66 mm, 좌안 초기 11.33 mm, 1.14 mm, 5.73 mm으로 수술 전 또는 후 유의미한 변화가 없었다(Table 2). 전안부 빛간섭단층촬영술상 좌안에서 좁은 전방각과 고원홍채(plateau iris)가 확인되었기에 레이저 홍채절개술 전에 우안도 좌안과 유사한 형태를 보였을 가능성이 높다. 이렇게 좁은 전방각을 가진 상태에서 레이저 홍채절개술 시행 후 전방각을 넓히기 위해 타병원에서 사용하였던 축동제가 섬모체근 연축 및 섬모체소대 이완을 유발하여 결과적으로 수정체-홍채면을 전방이동시키면서 방수의 흐름이 역전되었을 것으로 추정된다. 또한, 환자는 비록 인지하지 못하고 있었으나 홍채후유착이 있었던 점, 세극등현미경검사상 앞유리체 혼탁으로 안저가 흐렸던 점, 유리체수술 중 눈덩이가 발견된 점, 수술 후에도 포도막염이 재발한 점으로 미루어 보아 레이저홍채절개술 후 악화된 중간포도막염의 염증으로 발생한 앞유리체의 염증성 막이 섬모체소대 및 앞섬모체 돌기의 투과 영역을 막고 유착을 일으켜 안구 방수의 역류를 일으켰을 것이다.15
위의 증례를 참고하면 안구 내 염증 반응이 방수흐름이상증후군의 주요 병인 중 하나임을 알 수 있다. 안구수술 또는 안과적 레이저 치료는 다양한 수준의 이차적 안구 내 염증 반응을 유발할 수 있고, 특히 과거 포도막염 등의 만성 염증이 있었던 경우 수술 후 이차적 염증 반응이 심해질 수 있다. 따라서 포도막염의 소견을 보이거나 포도막염의 과거력이 있는 환자에서 간단한 안구의 시술은 방수흐름이상증후군의 위험성을 증가시킬 수 있음을 명심해야 한다. 유사한 예로 망막혈관증식성 종양 및 중간포도막염의 과거력을 갖는 환자에서 레이저 수정체후낭절개술(laser posterior capsulotomy) 6개월 후 방수흐름이상증후군이 발생한 보고가 있다.15 현재까지 국내에서 포도막염이 동반된 유수정체안에서 레이저홍채절개술을 시행한 후 방수흐름이상증후군이 발생한 증례가 보고된 적은 없다. 비록 본 단일 증례를 통해서 포도막염이 방수흐름이상증후군의 위험 요인임을 입증할 수는 없지만 방수흐름이상증후군 환자의 진단 및 치료에 있어 고려해야 할 요소임은 분명하다. 유수정체 상태의 상기 환자는 먼저 유리체절제술을 시행한 후 초음파수정체유화술을 시행하였다. 초음파수정체유화술을 먼저 시행하였다면 증가된 유리체용적으로 인해 백내장수술 중 전방은 더욱 좁아지고, 후방 압력은 더욱 높아져서 연속 곡선수정체낭원형절개(continuous curvilinear capsulorhexis)의 방사상 열공(radial tear), 홍채탈출, 또는 각막내피세포 손상의 가능성이 매우 높아진다. 따라서 먼저 유리체절제술을 시행하여 유리체강 내 방수를 제거하여 유리체강 내의 용적과 후방 유리체 압력을 낮춘 후 초음파수정체유화술을 시행하는 것이 중요하다.
본 증례의 환자는 좁은 전방각과 고원홍채 상태에서 포도막염이 있었고, 레이저홍채절개술 후 축동제 사용 및 안구 내 염증반응의 증가로 방수흐름이상증후군이 발생하였다고 생각되며, 유리체절제술과 초음파수정체유화술 및 수술적 후낭절개술을 시행하여 안압 조절에 성공하였다. 레이저홍채절개술 후 전방을 넓히기 위한 축동제 사용 시 주의 깊게 경과 관찰을 해야 하며, 방수흐름이상증후군이 발생하였던 과거력이 있는 환자에서는 반대안의 방수흐름이상증후군의 발생 위험을 낮추기 위해 축동제의 사용을 제한해야 할 것이다. 또한, 포도막염이 방수흐름이상증후군의 위험인자로 작용할 수 있음을 인지하고, 포도막염의 과거력 또는 가족력이 있는 경우 간단한 안구 내 시술 후라도 시력저하, 통증 등의 발생 가능성을 환자에게 교육하여, 조기 발견 및 적절한 처치가 이루어지도록 하여 안압상승으로 인한 영구적인 시신경 및 시야 손상의 가능성을 최소화해야 하겠다.
Figure 1.
Slit-lamp photographs on the third day of the initial visit. In the right eye, a patent superior peripheral iridotomy site was noted (A). Despite successful laser peripheral iridotomy, lens of the right eye moved forward. Lens showed grade 1 nuclear sclerotic cataract and glaukomflecken, confluent gray-white lens opacities at the anterior subcapsule (B). Glaukomflecken indicates previous attack of acute angle closure. Shallow peripheral anterior chamber (around 1/4 of central corneal thickness) was shown (C, D).
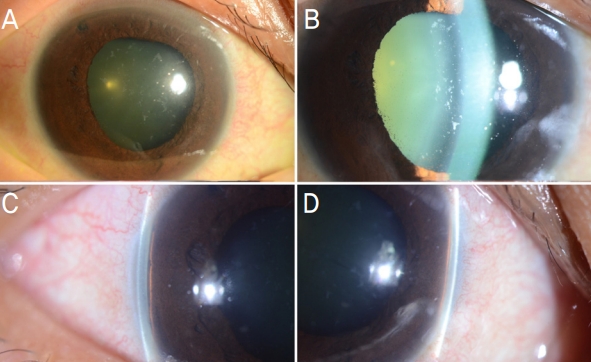
Figure 2.
Anterior optical coherence tomography images of both eyes before and after the pars plana vitrectomy followed by cataract extraction and intraocular lens insertion of the right eye. The right eye showed progressive axial shallowing of the central and peripheral anterior chamber and sharp chamber angle associated with forward movement of the lens-iris diaphragm (A). The left eye showed plateau iris configuration and thus, presumably the right eye would have plateau iris before the rise of intraocular pressure (B). Central and peripheral anterior chamber deepened after pars plana vitrectomy followed by cataract extraction and intraocular lens insertion, and the lens-iris diaphragm moved posteriorly. Inflammatory cells of anterior chamber still remained (C). The left eye still showed plateau iris after the laser iridotomy (D).
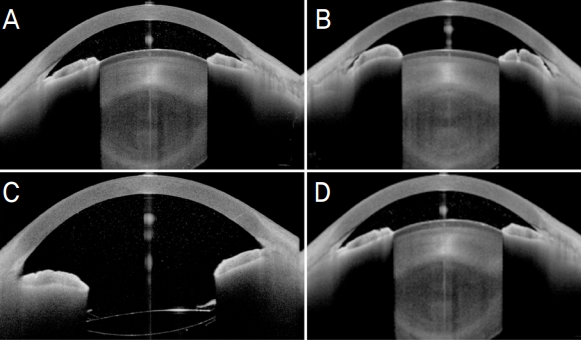
Figure 3.
Visual field and slit-lamp photographs of the vitrectomized eye 1 month after the surgery. The superior visual field defect in the right eye was noted (A). In the anterior chamber of the right eye, cells were observed due to the recurrence of the intermediate uveitis (B, C).

Table 1.
Baseline characteristics of the patient with aqueous chamber misdirection syndrome
Values are presented as number or right/left. Baseline IOP was measured by Goldmann applanation tonometer.
LogMAR VA= logarithm of the minimum angle of resolution visual acuity; HM = hand motion; IOP = intraocular pressure; PSD of VF = pattern standard deviation of visual field; PAS= peripheral anterior synechiae.
Table 2.
Changes in anterior parameters and overall spherical refractive error according to time
Values are presented as number. ACD, ACW, AVD, and PD were measured by anterior ocular computed tomography, and overall spherical refractive error was measured by ARK. Day 1 indicates one day after the initial visit to our institute.
ACD = anterior chamber depth; ACW = anterior chamber width; AVD = anterior vault distance; PD = pupil distance; ARK = autorefractor and keratometer; D = diopters.
REFERENCES
1) Grzybowski A, Kanclerz P. Acute and chronic fluid misdirection syndrome: pathophysiology and treatment. Graefes Arch Clin Exp Ophthalmol 2018;256:135-54.




2) Brooks AM, Harper CA, Gillies WE. Occurrence of malignant glaucoma after laser iridotomy. Br J Ophthalmol 1989;73:617-20.



3) Von Graefe A. Beiträge zur pathologie und therapie des glaukoms. Archiv für Ophthalmologie 1869;15:108-252.
4) Shahid H, Salmon JF. Malignant glaucoma: a review of the modern literature. J Ophthalmol 2012;2012:852659.




5) Epstein DL, Hashimoto JM, Anderson PJ, Grant WM. Experimental perfusions through the anterior and vitreous chambers with possible relationships to malignant glaucoma. Am J Ophthalmol 1979;88:1078-86.


8) Eltz H, Gloor B. [Trabeculectomy in cases of angle closure glaucoma-successes and failures (author's transl)]. Klin Monbl Augenheilkd 1980;177:556-61.

9) Greenfield JA, Smiddy WE, Greenfield DS. Malignant glaucoma after laser peripheral iridotomy. J Glaucoma 2019;28:e44-5.


12) Lippas J. Mechanics and the treatment of malignant glaucoma and the problem of a flat anterior chamber. Am J Ophthalmol 1964;57:620-7.

13) Kaplowitz K, Yung E, Flynn R, Tsai JC. Current concepts in the treatment of vitreous block, also known as aqueous misdirection. Surv Ophthalmol 2015;60:229-41.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




