망막과 망막색소상피의 복합과오종에 동반된 망막전막과 특발성 망막전막의 비교
Epiretinal Membrane of Combined Hamartoma of Retina and Retinal Pigment Epithelium Versus Idiopathic Epiretinal Membrane
Article information
Abstract
목적
망막과 망막색소상피 복합과오종에 동반된 망막전막에서 술 후의 황반부 모세혈관밀도 및 다국소망막전위도 변화를 확인하고 이를 특발성 망막전막과 비교하고자 하였다.
대상과 방법
망막과 망막색소상피 복합과오종에 동반된 망막전막으로 망막전막제거술을 시행한 환자 15명, 15안, 특발성 망막전막으로 망막전막제거술을 시행한 환자 21명, 21안을 대상으로 술 전과 술 후 6개월의 최대교정시력, 중심망막두께, 빛간섭단층혈관조영술을 통한 황반 각 영역의 표층모세혈관밀도, 망막중심오목무혈관부위, 다국소망막전위도 상의 ring 1, ring 2 P1 진폭 및 함의점 시간 결과를 비교 분석하였다.
결과
특발성 망막전막과 비교하였을 때 망막과 망막색소상피 복합과오종에서 황반부 평균 표층모세혈관밀도는 감소되어 있었으나(p=0.047) 중심와 표층모세혈관밀도는 유의하게 증가되어 있었다(p=0.003). 복합과오종에서 수술 전 망막중심오목무혈관부위가 유의하게 감소되어 있었고 수술 6개월 후에는 유의하게 증가하였다. 술 후 다국소망막전위도에 대하여 P1 진폭이 유의하게 증가하였으나 특발성 망막전막과 비교하였을 때 유의한 차이는 보이지 않았다.
결론
망막과 망막색소상피 복합과오종에 동반된 망막전막에서 황반부 평균 표층모세혈관밀도는 감소되어 있고 황반부 중심 표층모세혈관밀도 및 중심오목무혈관부위는 증가되어 있었다. 수술 후 중심오목무혈관부위 크기가 증가한 것을 볼 때 망막전막의 물리적 제거가 망막의 구조적 회복에 영향을 주지만 황반부 표층미세혈관의 개선에는 유의한 결과를 보여주지 못하였다.
Trans Abstract
Purpose
To evaluate the postoperative changes in macular vessel density and the multifocal electroretinogram (mfERG) in the epiretinal membrane (ERM) of a combined hamartoma of the retina and retinal pigment epithelium (CHRRPE). And we compared these results with those of idiopathic ERM.
Method
We retrospectively reviewed the records of 15 patients (15 eyes) with an epiretinal membrane of a CHRRPE, and 21 patients (21 eyes) with idiopathic ERM who were treated with pars plana vitrectomy and removal of the ERM. The best corrected visual acuity, central macula thickness, foveal and perifoveal vessel density, foveal avascular zone (FAZ), and mfERG rings 1 and 2 P1 amplitudes were analyzed before and 6 months after ERM removal.
Results
The average macular vessel density in the CHRRPE with ERM was reduced (p = 0.047) compared to an idiopathic epiretinal membrane, but the central foveal vessel density was significantly increased (p = 0.003). In CHRRPE, the preoperative FAZ was significantly reduced, and while it increased significantly 6 months postoperatively. After removing the ERM, the P1 amplitude increased significantly on mfERG, but there was no significant difference compared to the idiopathic ERM.
Conclusions
The macular mean superficial capillary plexus (SCP) vascular density was reduced in CHRRPE and the foveal SCP vascular density and FAZ were increased. Considering the increased size of the FAZ area after surgery, physical removal of the ERM affected the structural recovery of the fovea, but resulted in no significant improvement of the macular superficial microvascular system.
망막과 망막색소상피의 복합과오종(이하 망막-망막색소 상피 복합과오종)은 흔히 경계가 불명확한 회색 망막 종괴로 나타나는 드문 양성 종양으로 선천성이지만 비유전적이며 대개 단안에 발생한다. 특징적으로 망막표면에 교세포의 과도한 증식과 견인으로 인한 혈관의 구불거림, 유리체-망막표면의 구조적인 변화를 일으키고 많은 경우 망막전막을 동반한다고 보고되고 있다.1,2
망막-망막색소상피 복합과오종은 빛간섭단층촬영상 망막신경섬유층에 한정된 지붕 형태의 두꺼운 고반사층으로 나타나고 망막색소상피층은 비교적 정상적인 소견을 보이나 많은 경우 외망막층에 불규칙한 모양의 낭포성 소견을 동반한다. 종괴 부위 인접한 망막에 부종은 대개 없으며 종양 내의 석회화로 인한 고반사성음영이나 공동은 보이지 않고 정상망막과의 경계면이 점진적으로 이어진 모습을 보인다(Fig. 1).3,4
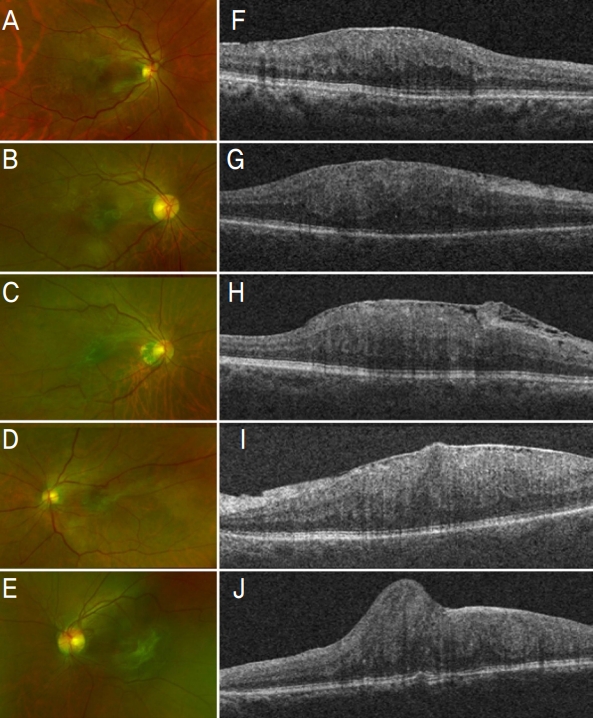
Fundus photography (A-E) and optical coherence tomography (OCT) (F-J) images of combined hamartoma of the retina and retinal pigment epithelium. (A-E) Fundus photography showing intraretinal glial tissue, parafoveal vascular tortuosity, and preretinal fibrotic change. OCT through (F, G) displayed disorganization of the inner and outer retina with marked saw-tooth like corrugations. (H, I) have macular combined hamartoma with distinct epiretinal membrane inducing distortion of foveal contour. (J) showing full thickness maxi-peaks with retinal folding.
빛간섭단층촬영 소견을 바탕으로 종괴 위치에 따라 시신경유두, 유두주위, 황반, 주변 망막으로 분류하거나5 주로 구성된 조직 아형에 따라 혈관형, 멜라닌세포형, 신경아교세포형으로, 침범 부위에 따라 망막전, 부분 망막, 망막색소상피를 포함한 완전 망막 침범으로 분류하기도 한다.6
빛간섭단층혈관조영술(optical coherence tomography angiography)은 비교적 최근에 개발된 검사 도구로 형광안저혈관조영술과 달리 조영제의 사용 없이 시신경, 망막맥락막 각각의 혈관층 구조를 비침습적으로 빠르게 분석할 수 있다. 또한 내장 소프트웨어를 이용하여 측정하고자 하는 영역의 단위면적당 혈관의 총 길이를 의미하는 혈관밀도(vessel density)와 단위면적당 혈관의 총 넓이를 뜻하는 관류밀도(perfusion density)를 측정하고, 이를 통해 시신경과 망막의 모세혈관 분포와 관류에 대해 분석하여 망막중심오목무혈관부위(foveal avascular zone)의 면적과 같은 정량적 분석 또한 가능하다. 이는 일반적인 형광안저혈관조영술의 소견과 잘 일치하며 상세한 해부학적 및 관류에 대한 정보를 제공한다고 알려져 있다.
빛간섭단층촬영의 발달로 인해 망막-망막색소상피 복합과오종의 특징적인 구조적 변화에 대한 분석을 통한 진단 및 특발성 망막전막과의 감별이 가능해졌다. 그러나 망막-망막색소상피 복합과오종의 혈관성 변화를 분석하고자 시행하였던 형광안저혈관조영술에 대한 연구는 혈관 외 형광염색 유출, 병변 내 망막층 왜곡이나 유착 등에 의해 한계가 있어 최근에는 빛간섭단층혈관조영술을 통한 망막-망막색소상피 복합과오종에 대한 망막, 맥락막혈관 분포, 모세혈관밀도 등을 통한 연구가 이루어지고 있다. 이에 Gupta et al7은 망막-망막색소상피 복합과오종 환자를 대상으로 빛간섭단층혈관조영술을 이용하여 미세혈관류, 비관류, 혈관밀도 및 망막중심오목무혈관부위 크기 등의 혈관 변화를 보고하기도 하였다(Fig. 2).
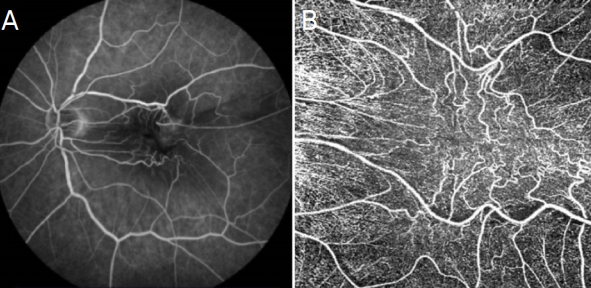
Fluorescein angiography (A) and optical coherence tomography angiography (OCTA) (B) images of combined hamartoma of the retina and retinal pigment epithelium. OCTA showed vascular tortuosity of superficial capillary plexus at parafovea and distortion of the foveal avascular zone.
다국소망막전위도검사(multifocal electroretinogram, multifocal ERG)는 비침습적으로 전체적인 망막 자극에 대한 반응뿐만 아니라 몇 개의 소영역들로 나눈 반응도 하나의 기록으로 측정할 수 있어 황반부에 국한된 망막 기능평가에 유용한 검사로 Koutsandrea et al8의 연구에 따르면 특발성 망막전막 환자에서 수술적 막의 제거 전과 후의 다국소 망막전위도검사 상의 P1의 진폭 및 함의점 시간을 분석하였을 때 수술 1년 후 통계적으로 유의한 개선이 나타났다고 보고하였다.
비교적 최근에 이루어진 연구에 의하면 망막-망막색소상피 복합과오종에 동반된 망막전막 환자와 정상안을 빛간섭단층혈관조영술을 통해 비교하였을 때 심부모세혈관밀도, 표층모세혈관밀도, 맥락막모세혈관밀도가 감소되어 있었으며 망막중심오목무혈관부위 크기가 작게 측정되는 것을 확인하고 망막-망막색소상피 복합과오종에서의 표층혈관의 왜곡, 모세혈관의 희박화를 보고하였다(Fig 2).7,9,10 이렇듯 망막-망막색소상피 복합과오종의 진단 및 진행 정도를 파악하기 위한 빛간섭단층혈관조영술의 유용성이 보고되는 가운데 망막-망막색소상피 복합과오종과의 감별이 요구되는 특발성 망막전막에 대한 비교 연구는 최근까지도 거의 이루어지지 않고 있는 실정이다. 망막중심오목무혈관부위의 크기 감소는 기존 보고된 특발성 망막전막의 특징과 공통적인 소견으로 발병된 망막전막의 중심성 견인력으로 인한 결과로 여겨지고 있다. 이러한 망막전막의 견인력으로 인한 모세혈관 분포 변화를 빛간섭단층혈관조영술을 통해 비교 분석하여 망막-망막색소상피 복합과오종에 동반된 망막전막과 특발성 망막전막의 감별에 도움을 받을 수 있다. 이에 본 연구에서는 빛간섭단층혈관조영술을 통해 망막-망막색소상피 복합과오종에 동반된 망막전막과 특발성 망막전막 환자에서의 술 전 혈관분포 및 망막중심오목무혈관부위 크기, 술 후의 미세혈관의 변화를 정량적으로 비교 분석하고자 하였다. 또한 추가적으로 술 전과 술 후 시행한 다국소망막전위도검사를 비교하여 망막층의 기능적 평가도 함께 분석하였다.
대상과 방법
2012년 7월부터 2021년 1월까지 망막-망막색소상피 복합과오종에 동반된 망막전막과 특발성 망막전막으로 진단받고 유리체절제술, 망막전막제거술을 받은 환자를 연구 대상으로 하였으며, 헬싱키선언에 입각한 본원 임상시험심사위원회(institutional review board, IRB)의 승인 아래 진행되었다(승인 번호: 2022-315).
망막혈관질환, 증식망막병증, 안 내 기타 염증 질환, 망막박리, 심한 당뇨망막병증 등의 병력이 있거나 관찰 기간이 6개월 미만인 환자는 대상에서 제외하였다. 최종적으로 망막-망막색소상피 복합과오종에 동반된 망막전막에서 수술을 통해 망막전막을 제거한 환자 15명, 15안을 I군, 특발성 망막전막에서 수술을 통해 망막전막을 제거한 환자 21명, 21안 II군, 망막-망막색소상피 복합과오종에 동반된 망막전막의 반대안, 즉 정상안 15안을 III군에 대하여 병력청취를 포함한 철저한 술 전 검사 및 최대교정시력, 세극등현미경검사, 안저검사, 중심망막두께 측정을 위해 빛간섭단층촬영을 시행하고 유리체절제술 및 망막전막제거술 시행 전, 시행 6개월 이후에 측정한 빛간섭단층혈관조영술을 이용하여 환자의 표층혈관밀도와 망막중심오목무혈관부위 크기를 측정한 결과를 통해 후향적 연구를 진행하였다.
망막-망막색소상피 복합과오종에 대한 임상적 진단은 Gass11에 의해 서술된 특징적 임상 소견을 참조하여 이루어졌다. (1) 망막색소상피, 망막 및 유리체를 포함하는 상승된 흑색 또는 진회색 종괴, (2) 망막색소상피층과 같은 깊이에 과색소 침착된 망막조직층로 구성된 과다색소 과오종성 기저, (3) 다양한 양의 두꺼워진 회백색 망막 및 망막 전 조직으로 구성된 과오종의 내부 및 중앙 부분의 존재, (4) 주변의 망막과 망막혈관이 과오종의 중심 쪽으로 당겨진 과오종의 내부 표면의 수축 소견, (5) 맥락막 침범 소견 없음, (6) 망막박리, 삼출, 출혈 및 염증 소견 없음, (7) 경과 관찰 시 종괴 성장의 증거 없음.
망막-망막색소상피 복합과오종에 동반된 망막전막과 특발성 망막전막 환자의 망막전막의 제거는 3개의 섬모체평면부 공막창을 통한 표준 3-port 유리체절제술을 통해 시행하였으며, 망막으로부터 뒤유리체피질을 제거하고, 눈속집게를 이용하여 망막전막을 제거하였다. 내경계막 제거의 범위는 시신경유두의 이측 경계로부터 위, 아래 이측 혈관궁, 중심와로부터 2시신경유두 직경 이측으로 하였으며, 제거할 내경계막을 염색하기 위해 indocyanine green (ICG; Diagnogreen injection, Daiichi Pharmaceutical, Tokyo, Japan)을 이용하였다. 내경계막의 제거는 0.05% (5.2 mg/mL) ICG 용액을 시신경유두 및 황반부에 소량(0.1 mL 미만) 주입 후, 눈속집게를 이용하여 내측 망막으로부터 제거하는 방식으로 시행하였다.
빛간섭단층혈관조영술(Cirrus HD-OCT model 5000, Carl Zeiss Meditec, Inc., Dublin, CA, USA)은 840 nm의 중심파장과 초당 68,000장의 A-scan 속도로 6×6 mm 크기를 수평 B-scan에 대하여 350개의 A-scan을 얻고, 수직으로 245개의 B-scan으로 해당 영역의 황반부와 시신경유두 부위를 스캔한 후, 자체 소프트웨어(AngioPlex, version 10.0, CarlZeiss Meditec, Inc.)를 이용, 중심와와 중심와주위에 각각 1 mm, 6 mm 직경의 2개의 동심원을 적용 후 상측, 비측, 하측, 이측으로 나누어 총 5개 영역으로 구분한 뒤 각 영역별 표층 모세혈관밀도를 정량적으로 분석하고 망막중심오목무혈관 부위(foveal avascular zone)의 면적과 둘레를 확인하였다(Fig. 3).
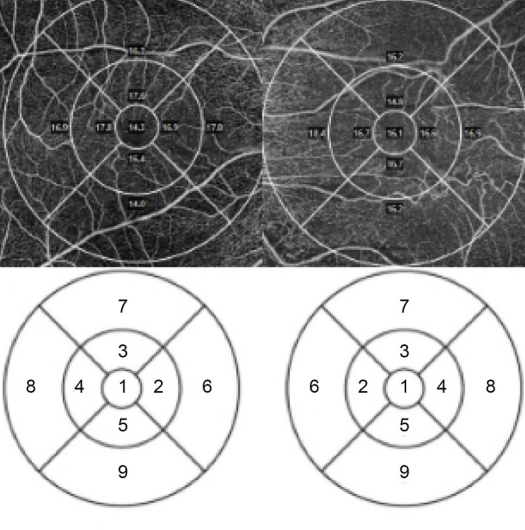
Early Treatment Diabetic Retinopathy Study grid subfield was applied to macula. ‘1’ means fovea. ‘2’, ‘6’ means nasal macula. ‘3’, ‘7’ means superior macula. ‘4’, ‘8’ means temporal macula. ‘5’, ‘9’ means inferior macula. OD = oculus dexter; OS = oculus sinister.
신호 강도가 8 미만인 이미지의 경우 재검사를 통해 모든 분석에는 신호 강도가 8 이상인 이미지만을 사용하였으며 빛간섭단층촬영, 빛간섭단층혈관조영술 스캔 결과상 영상의 질적 저하 및 관련 오류(motion artifact, segmentation error, white noise artifact)가 관찰되는 경우 연구에서 모두 제외하였다.12,13
다국소망막전위도검사는 RETIscan system (Roland Consult Instrument GmbH, Wiesbaden, Germany)을 이용하여 시행하였다. 검사하고자 하는 안에 0.5% tropicamide와 0.5% phenylephrine (Tropherine®, Hanmi Pharm., Seoul, Korea)을 5분 간격으로 3회 이상 점안하여 동공을 산동시킨 후 0.5% proparacine hydrochloride (Alcaine®, Alcon, Fort Worth, TX, USA)를 점안하여 국소마취를 한 뒤 ERG-jet corneal contact lens electrode에 1% methylcellulose를 묻힌 후 검사안의 각막에 부착하였다. 반대측 눈을 차폐시키고, 접지전극(ground electrode)은 미간 중심에서 2-3 cm 상방의 이마에 부착하였고, 기준전극(reference electrode)은 검사안의 외안각 부위에 부착하였다. Cathode Ray Tube monitor를 사용하였고 화면과 검사안과의 거리는 30 cm를 유지하였다. 환자의 턱을 턱받침에 고정하고 화면 중심의 빨간색 고시점과 시선이 일치하도록 턱받침의 높낮이를 조정하였고, 피검사자는 화면의 빨간색 고시점을 주시하도록 하였다. 화면 상에 103개의 육각형으로부터 pseudo-random sequence의 일종인 binary m-sequence에 따라서 75 Hz의 속도로 흑백의 독립적인 교차 자극을 발생하도록 하였다. 각각의 육각형으로부터 자극된 부위의 망막에서 각각의 반응이 추출되도록 하였고 환자의 주시 상태가 좋지 않거나 협조가 잘 되지 않을 경우 그 session의 결과는 배제하고 다음 session으로 넘어가 총 여덟 개의 session에 대한 결과를 채택하였다. 서로 다른 망막 부위에서 기록된 반응은 중심부로부터 주변부로의 연속적인 원형(concentric ring) 형태로 여섯 개의 group을 나누어 반응의 평균을 구하여 비교하였다. 기록되는 파형은 초기 음성파(negative wave)를 N1, 초기 양성파(positive wave)를 P1으로 하여 진폭(amplitude)을 측정하였다(Fig. 4, 5) 위 다국소망막전위도검사를 망막-망막색소상피 복합과오종에 동반된 망막전막으로 수술한 환자의 수술 전 양안과 수술 6개월 이후 술 안에 시행하여 결과를 비교 분석하였다. 이에 따른 통계 분석은 IBM SPSS ver. 22.0 for Windows (IBM Corp., Armonk, NY, USA) 프로그램을 이용하여 p-value가 0.05 미만인 경우를 통계적으로 유의한 것으로 판단하였다.
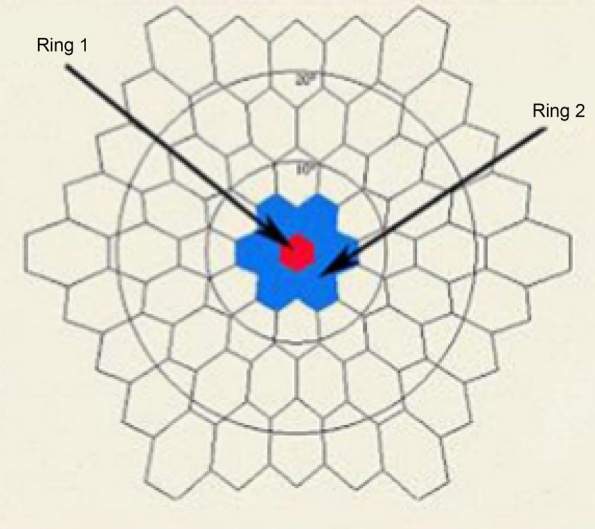
Stimulus array of 61 hexagonal elements. Ring 1 (red) and ring 2 (blue) correspond to fovea and respectively, parafovea.
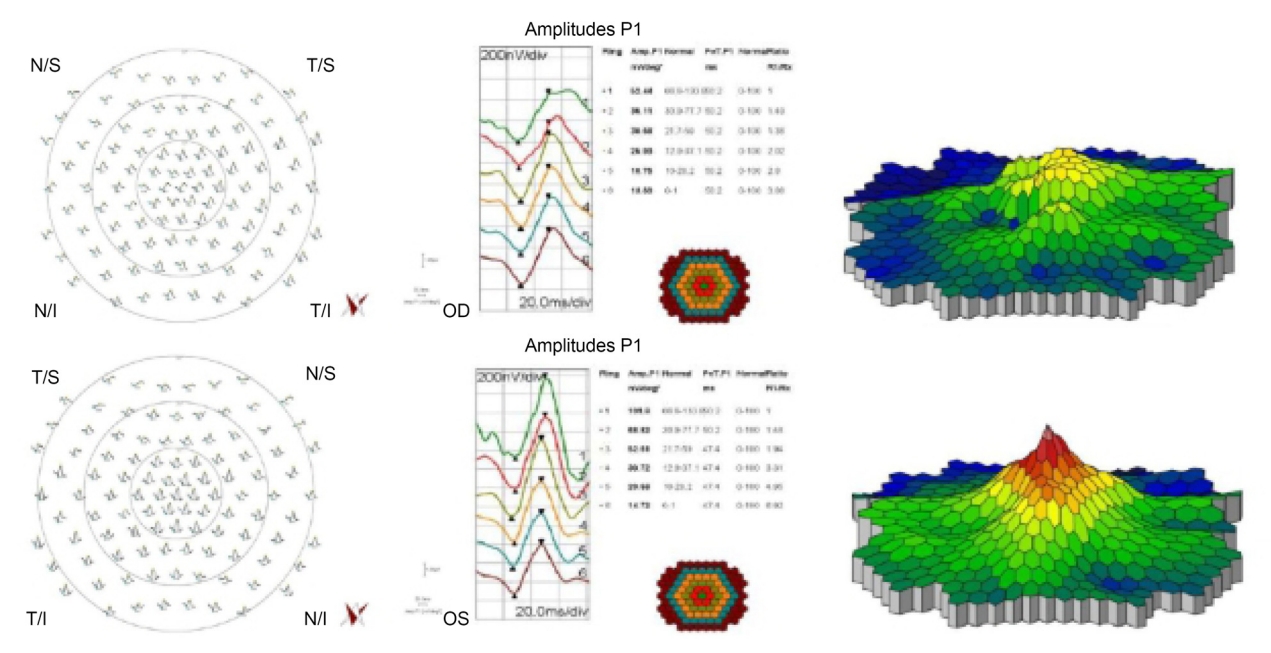
Multifocal electroretinogram findings of combined hamartoma of the retina and retinal pigment epithelium (CHRRPE) (OD) compared with contralateral eye (OS). Delayed implicit time and decreased amplitude were noted in the CHRRPE eye, moreover, slightly decreased local responses are found in the CHRRPE eye. OD = oculus dexter; OS = oculus sinister.
결 과
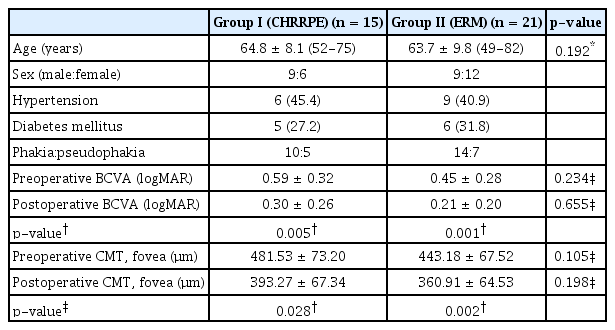
대상 환자는 망막-망막색소상피 복합과오종에 동반된 망막전막으로 수술을 통해 망막전막을 제거한 15안, 반대 정상안 15안, 특발성 망막전막으로 수술을 통해 망막전막을 제거한 21안, 총 51안을 연구 대상으로 포함하였다. 망막-망막색소상피 복합과오종 환자의 남녀 비율은 9:6이었으며, 평균 연령은 64.8 ± 8.1세, 특발성 망막전막 환자의 남녀 비율은 9:12였으며, 평균 연령 63.7 ± 9.8세로 중등도 이하의 비증식당뇨망막병증 환자는 망막-망막색소상피 복합과오종 환자군에 5안, 특발성 망막전막 환자군에서 6안 포함되어 있었다(Table 1).
망막-망막색소상피 복합과오종에 동반된 망막전막 환자군의 경우 술 전 평균 최대교정시력은 0.59 ± 0.32 logarithm of minimal angle of resolution (logMAR)이었고, 수술 후 6개월째 평균 최대교정시력은 0.30 ± 0.26 logMAR로 유의한 시력 변화가 관찰되었다(p<0.05).
수술 전 복합과오종안의 중심망막두께는 평균 481.53 ± 73.20 µm였고, 수술 후 6개월째 중심망막두께는 393.27 ± 67.34 µm로 수술 후 유의미하게 중심망막두께가 감소하였음을 확인하였다(p<0.05). 하지만 망막전막제거술 전과 후의 최대교정시력, 중심망막두께에 대해 망막-망막색소상피 복합과오종에 동반된 망막전막 환자군과 특발성 망막전막 환자군 간의 유의한 차이는 없었다(Table 1).
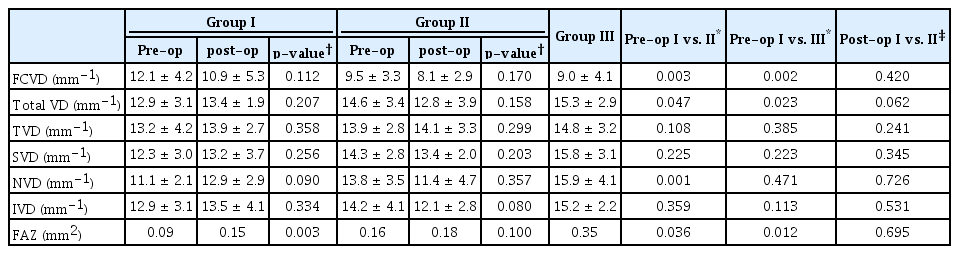
망막-망막색소상피 복합과오종 환자에서 황반부 평균 표층혈관밀도는 12.9 ± 3.1 mm-1였으며 망막전막 환자에서의 황반부 평균 표층혈관밀도는 14.6 ± 3.4 mm-1로 망막-망막색소상피 복합과오종 환자에서 황반부 평균 표층모세혈관 밀도가 감소되어 있었다(p<0.05).
영역별로 황반부 중심(영역 1)에서 망막-망막색소상피 복합과오종 환자에서의 표층혈관밀도는 12.1 ± 4.2 mm-1였으며 특발성 망막전막 환자에서의 황반부 중심 영역 표층혈관밀도는 9.5 ± 3.3 mm-1로 망막-망막색소상피 복합과오종 환자에서 황반부 중심 영역의 표층 모세혈관밀도가 증가되어 있었다(p<0.05).
황반부 비측(영역 2, 6의 평균) 즉, 시신경유두 부위측 영역에서 망막-망막색소상피 복합과오종 환자에서의 표층혈관밀도는 11.1 ± 2.1 mm-1였으며 특발성 망막전막 환자에서의 표층혈관밀도는 13.8 ± 3.5 mm-1으로 망막-망막색소상피 복합과오종 환자에서 황반부 비측에서의 표층모세혈관밀도가 감소되어 있었다(p<0.05). 그 외 나머지 영역(황반부 상측, 이측, 하측)에서의 표층모세혈관밀도에서는 통계적으로 유의한 차이를 보이지 않았고 중심망막오목무혈관부위 크기를 비교한 결과에서 망막-망막색소상피 복합과오종 환자군이 특발성 망막전막 환자군보다 무혈관부위 영역 크기가 작았으며 이는 통계적으로 유의한 수치였다.
망막-망막색소상피 복합과오종에서의 유리체절제술 및 망막전막제거술을 통한 망막전막 제거 전, 후의 빛간섭단층혈관조영술 결과를 비교한 결과 술 후의 황반부 평균 표층혈관밀도는 13.4 ± 1.9 mm-1로 술 전의 황반부 평균 표층혈관밀도보다 증가하였으나 통계적으로 유의한 차이는 아니었다. 영역별 모든 영역에서 술 전과 술 후 평균 표층모세혈관밀도에서 유의한 차이는 없었으나 술 후의 중심망막 오목무혈관부위 크기의 경우 술 전과 비교하여 크기가 증가하였다(p<0.05) (Table 2).
망막-망막색소상피 복합과오종에 동반된 망막전막 환자에서 망막전막제거술에 따른 다국소망막전위도 상의 양성파 P1의 진폭 변화는 ring 1, 2에서 수술 전 32.71 ± 11.97 nV/deg2, 20.50 ± 7.33 nV/deg2, 수술 후 31.28 ± 13.11 nV/deg2, 22.59 ± 6.91 nV/deg2로 ring 1, 2 모두 수술 6개월 후 P1의 진폭에 대해 통계적으로 유의한 변화를 보이지 않았다. 그러나 반대측 건안과 비교하였을 때 ring 1의 진폭이 감소되어 있었다(p<0.05) (Table 3).
고 찰
앞선 여러 연구를 통해 보고된 망막-망막색소상피 복합과오종에 동반된 망막전막이 특발성 망막전막과 구분되는 특징은 검거나 회색을 띠는 병변이 망막과 망막색소상피에서 과오종성 형태로 기저하여 발생해 주변부로 확장되는 소견을 보이는데 이는 주변부 망막색소상피와 융합하거나 주변 망막층을 견인하여 망막색소상피의 소실을 일으키거나 수축시키고 때로는 맥락막위축을 초래한다. 다만 망막박리나 출혈, 삼출물, 염증을 대개 일으키지 않고 안정적이며 경과 관찰 시 종괴의 성장이 드물다는 것이다. 이렇게 망막전막과 구별되는 망막-망막색소상피 복합과오종 빛간섭단층촬영 소견을 바탕으로 치료 방향 결정 및 예후 예측을 위한 병기 설정을 하려는 노력이 이전 여러 연구를 통해 시도되었다. 비록 질환의 희소성으로 인해 표본이 적어 병기 분류가 표준화되지 않았지만 가장 널리 쓰이는 분류에 의하면11 병변 위치에 따라 zone 1(황반 또는 시신경유두주위), zone 2(망막 중간 주변부), zone 3(망막 주변부) 또, 망막견인에 의한 망막 상태에 따라 stage 1(견인 소견 없는 상태), stage 2(견인에 의한 망막층간분리 상태), stage 3(병변 주위 망막박리된 상태), 병변의 침범 정도에 따라 A(망막전막 형태로만 침범), B(부분적 망막 침범), C(망막색소상피를 포함한 망막 전체 침범)로 나눌 수 있다. 본 연구에서 망막-망막생소색피 복합과오종에서 황반부 중심 및 비측 영역의 표층혈관밀도가 특발성 망막전막보다 낮은 결과가 나왔는데 이는 질환 자체의 특성뿐만 아니라 발병 위치 빈도 또한 결과에 영향을 미쳤을 것이라 생각된다. Dedania et al14에 의하면 망막-망막색소상피 중 zone 1(황반 또는 시신경유두주위)의 빈도는 77%, zone 2(망막 중간 주변부)는 15%, zone 3(망막 주변부)는 8%라고 보고하였고 본 연구에서 또한 zone 1가 전체의 90% (15안 중 12안)을 차지하였고 이 중 4안은 발병된 망막전막이 시신경유두주위를 포함하고 있었다. 이러한 발병 위치의 특성으로 인해 황반부 중심 및 비측 영역의 표층혈관밀도가 통계적으로 낮게 측정되었다고 추측할 수 있다. 이는 망막전막이 황반부 중심 뿐만 아니라 황반부 비측 영역 즉, 시신경유두주위 영역으로 발병한 경우 특발성 망막전막과 망막-망막색소상피 복합과오종에 동반된 망막전막의 주요 감별점이 될 수 있음을 시사한다. 망막-망막생소색피 복합과오종 병변에서 표층모세혈관의 빈도가 감소되어 있는 이유는 표층모세혈관의 측부 가지 혈관이 잘 발달되지 않고 종괴의 영향으로 표층모세혈관이 고리 형태로 구부러져 있어 단위면적당 혈관의 길이를 의미하는 혈관밀도가 낮게 측정되는 것이라고 여겨진다.9
빛간섭단층혈관조영술을 통한 미세혈관 구조에 대한 여러 연구가 이루어진 특발성 망막전막의 경우 형성된 전막의 견인력으로 인한 중심와부근 모세혈관의 중심성 이동으로 황반 중심부 모세혈관의 밀도가 증가되어있고 망막중심 오목무혈관 크기가 감소되어 있다는 것이 보고되었다.15,16 그러나 수술 후 망막중심오목무혈관 크기 변화에 대해서 Okawa et al17은 유의미한 크기 변화를 보이지 않았다고 보고하였다. 반면 망막-망막색소상피 복합과오종에 동반된 망막전막의 빛간섭단층혈관조영술에 대한 연구는 아직 많이 이루어지지 않았지만 Arrigo et al9은 복합과오종에 동반된 망막전막 환자에서 표층혈관총과 심층혈관총의 모세혈관밀도가 감소되어 있음을 보고하였다. 본 연구에서 망막-망막색소상피 복합과오종에 동반된 망막전막과 특발성 망막전막을 비교하였을 때 복합과오종에 동반된 망막전막 환자군에서 황반 중심부 표층혈관밀도가 증가되어 있고 황반평균표층혈관밀도는 유의하게 감소되어 있었다. 이러한 결과를 통해 전막으로부터의 견인력에 의한 중심와부근 모세혈관의 중심성 이동이 특발성 망막전막보다 망막-망막색소상피 복합과오종에서 더 크게 작용하였을 것이라고 추측할 수 있다. 이는 망막-망막색소상피 복합과오종 환자군과 대조군을 통한 비교에서 대조군보다 복합과오종 환자군에서 황반 중심부 표층모세혈관밀도가 증가되어 있고 망막중심 오목무혈관부위 크기가 감소되어 있는 결과가 이를 추가적으로 뒷받침한다.
망막전막제거술을 시행한 이후의 망막중심오목무혈관 크기 변화에 대한 현재까지의 여러 연구에 대해서는 이견이 있다. Romano et al18은 특발성 망막전막으로 망막제거술을 시행받은 환자를 대상으로 술 전과 술 후의 망막중심오목무혈관 크기 변화를 분석한 결과 술 후 무혈관 구역의 크기가 증가하였다고 보고하였다. 본 연구에서는 특발성 망막전막의 술 후 유의미한 망막중심오목무혈관 구역 크기 변화가 없었던 반면, 망막-망막색소상피 복합과오종에 동반된 망막전막 환자군의 경우 술 후 통계적으로 유의하게 무혈관 구역 크기가 증가하였다. 이는 술 전, 두 군 간의 망막중심오목무혈관 구역 크기 비교에서 망막-망막색소상피 복합과오종에 동반된 망막전막 환자군의 무혈관 구역 크기가 감소되어 있었던 결과에서 나타나듯이 망막전막의 견인력에 의한 표층모세혈관의 왜곡이 복합과오종 환자군에서 더욱 심하여 이를 수술적으로 제거하였을 시 망막중심오목무혈관 구역의 정상화가 망막-망막색소상피 복합과오종에 동반된 망막전막 환자에서 더 뚜렷이 관찰된다고 여겨진다.
이러한 형태 및 해부학적 변화를 측정하는 빛간섭단층혈관조영술과 함께 본 연구에서는 수술 전과 수술 후의 망막망막색소상피 복합과오종에 동반된 망막전막 환자군과 대조군인 특발성 망막전막 환자군에 대하여 추가적으로 다국소망막전위도검사를 시행하여 시기능에 대한 평가도 함께 실시하고자 하였다. 망막-망막색소상피 복합과오종 환자에서의 수술 전과 수술 후의 다국소망막전위도 결과에 대한 연구는 거의 이루어지지 않았지만 특발성 망막전막의 경우 앞서 이루어진 연구에 의하면 연구마다 차이는 있지만 망막전막의 수술적 제거가 다국소망막전위도검사의 ring 1, 2의 P1 진폭 및 함의점 시간에 대해 통계적 유의한 개선을 보였다는 연구가 보고되었다.19,20,21 이에 본 연구의 결과에서도 대조군인 특발성 망막전막 환자의 경우 수술 6개월 후 ring 1의 P1 진폭의 유의한 개선이 확인되었지만 망막-망막색소상피 복합과오종 환자군의 경우 수술 6개월 후 다국소망막전위도검사 상의 P1 진폭 및 함의점 시간 변화에서 대하여 통계적으로 유의한 개선은 보이지 않았다. 이는 빛간섭단층촬영을 분석하였을 때 망막-망막색소상피 복합과오종의 경우 일반적으로 특발성 망막전막보다 더 흔히 외망막층을 침범하여 해부학적 손상을 일으키기 때문에 망막전막을 제거하였음에도 불구하고 일련의 시냅스 전달의 기능적 회복이 제한적이라고 추측할 수 있다.
본 연구의 제한점은 상대적으로 적은 환자를 대상으로 시행된 후향적 연구라는 점이다. 따라서 향후 더 많은 망막과 망막색소상피의 복합과오종에 동반된 망막전막 환자와 특발성 망막전막 환자를 대상으로 빛간섭단층혈관조영술을 통한 해부학적 분석에 관한 연구가 필요하다. 또 다른 제한점은 본 연구에서는 빛간섭단층혈관조영술을 통하여 표층모세혈관총에 대해서만 분석하였으나 대부분의 망막과 망막색소상피의 복합과오종의 경우 심층모세혈관총 또한 침범하기 때문에 이에 대한 추가적인 연구가 필요할 것으로 생각된다.
결론적으로 본 연구에서 망막과 망막색소상피의 복합과오종에 동반된 망막전막 환자들의 황반부 평균 표층모세혈관밀도는 반대안 및 특발성 망막전막 대조군에 비해 감소되어 있었으나 황반부 중심 표층혈관밀도가 증가되어 있었고 중심망막오목무혈관부위 크기가 작았다. 또한 수술 후의 표층혈관 분포를 비교하였을 때 중심망막오목무혈관부위 크기만이 통계적으로 유의미하게 증가하였다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
김대용 / Dae Yong Kim
부산가톨릭의료원 메리놀병원 안과
Department of Ophthalmology, Maryknoll Hospital