 |
 |
| J Korean Ophthalmol Soc > Volume 64(5); 2023 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļé┤ņŗ£Ļ▓ĮņĀü ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņłśņłĀ ņĀäĒøä ņĢłņÖĆ ĻĄ¼ņĪ░ņÖĆ ņĢłĻĄ¼ļÅīņČ£ ļ│ĆĒÖöņØś Ļ┤ĆĻ│äņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
Ļ░æņāüņāśļłłļ│æņ”ØņØä ņ¦äļŗ©ļ░øĻ│Ā ļé┤ņŗ£Ļ▓ĮņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēļ░øņØĆ ĒÖśņ×É 18ļ¬ģņØś 33ņĢłņØä ļīĆņāüņ£╝ļĪ£ ņłśņłĀ ņĀäĒøä ņĢłĻĄ¼ļÅīņČ£Ļ│ä Ļ▓Ćņé¼ņÖĆ 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĢłņÖĆ ĻĄ¼ņĪ░ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņ¦ĆĒæ£ļōżņØä ņĖĪņĀĢĒĢśņśĆļŗż. ļŗ©ļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņłśņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ ļ│ĆĒÖöņÖĆ Ļ┤ĆļĀ©ņä▒ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉ£ ļ│ĆņłśļōżņØä ĒÅēĻ░ĆĒĢ£ ļÆż, ļŗżļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ļŗ©ļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ņłśņłĀ ņĀä ņĢłņÖĆļé┤ļ▓ĮņØś ĻĖĖņØ┤(╬▓=0.179, p=0.032)ņÖĆ ņłśņłĀ Ēøä Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤(╬▓=-0.139, p=0.006)Ļ░Ć ņłśņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ņØś ļ│ĆĒÖöņÖĆ ņŚ░Ļ┤ĆļÉ£ Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ļæÉ Ļ░Ćņ¦Ć ļ│Ćņłśļź╝ ļ░śņśüĒĢ£ ļŗżļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ņłśņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ņØś ļ│ĆĒÖöļŖö Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤(╬▓=-0.118, p=0.019)ņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż.
Ļ▓░ļĪĀ
ļé┤ņŗ£Ļ▓ĮņĀü ņĢłņÖĆĻ░ÉņĢĢņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ņØś ļ│ĆĒÖöļŖö Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤ņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ņŚłļŗż. ņØ┤ļź╝ ĒåĀļīĆļĪ£ Ļ░Éņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĢłņÖĆĻ░ÉņĢĢņłĀņØä Ļ│äĒÜŹĒĢĀ ļĢī ņĢłĻĄ¼ļÅīņČ£ ņĀĢļÅäņØś ļ│ĆĒÖöļź╝ ņśłņĖĪĒĢśļŖö ņ¦ĆĒæ£ļĪ£ Ļ│ĀļĀżĒĢ┤ļ│╝ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ABSTRACT
Purpose
To investigate orbital morphology parameters associated with exophthalmos changes in patients undergoing endoscopic orbital decompression to treat thyroid-related orbitopathy.
Methods
In total, 33 eyes of 18 patients with thyroid-related orbitopathy who underwent endoscopic orbital decompression were included in this retrospective study. Data were collected before and 6 months after surgery. We performed Hertel exophthalmometry and derived orbital morphology parameters from two-dimensional facial computed tomography records. Parameters associated with exophthalmos reduction on univariate linear regression analysis were subjected to multivariate linear regression analyses.
Results
Univariate linear regression showed that the preoperative length of the medial orbital wall (╬▓ = 0.179, p = 0.032) and the postoperative distance from the cone apex to the medial wall defect (╬▓ = -0.139, p = 0.006) were associated with exophthalmos reduction after endoscopic orbital decompression surgery. Multivariate linear regression of these two parameters showed that the distance from the apex to the medial wall defect was associated with exophthalmos reduction (╬▓ = -0.118, p = 0.019).
Ļ░æņāüņāśļłłļ│æņ”ØņØĆ ļ¦īņä▒ņĀüņØĖ ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśņØĖ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ĒÖśņ×ÉņŚÉņä£ Ļ░Ćņן ĒØöĒĢśĻ▓ī ļ░£ņāØĒĢśļŖö ĒĢ®ļ│æņ”ØņØ┤ļŗż.1 ļ¬ģĒÖĢĒĢ£ ĻĖ░ņĀäņØ┤ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśņ£╝ļéś Ļ░æņāüņāś ĒĢŁņøÉņØś ņäĖĒż ļ¦żĻ░£ ļ®┤ņŚŁ ļ░śņØæņ£╝ļĪ£ ņØĖĒĢ┤ ņĢłņÖĆ Ļ▓░ņ▓┤ņĪ░ņ¦üņØś ņŚ╝ņ”ØņØä ņ£Āļ░£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░2 ņĀ£ĒĢ£ļÉ£ ņĢłņÖĆ ļé┤ļČĆņØś ļŗżņ¢æĒĢ£ ĻĄ¼ņĪ░ļ¼╝ņØä ņ╣©ļ▓öĒĢśņŚ¼ ņĢłĻĄ¼ļÅīņČ£, ļłłĻ║╝ĒÆĆļÆżļŗ╣Ļ╣Ć, ņÖĖņĢłĻĘ╝ ļ╣äļīĆ, ļ│Ąņŗ£, ņĢĢļ░Ģņŗ£ņŗĀĻ▓Įļ│æņ”Ø ļō▒ņØä ņ£Āļ░£ĒĢ£ļŗż.3,4
Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņØś ņ╣śļŻīļŖö ĒÖ£ļÅÖĻĖ░ņŚÉņä£ļŖö Ļ│ĀņÜ®ļ¤ē ļČĆņŗĀĒö╝ņ¦łĒśĖļź┤ļ¬¼ņĀ£, ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ ļō▒ņØä ņÜ░ņäĀ Ļ│ĀļĀżĒĢśĻ▓ī ļÉśļ®░ ļ╣äĒÖ£ļÅÖĻĖ░ņŚÉņä£ 6Ļ░£ņøö ņØ┤ņāü ņĢłĻĄ¼ļÅīņČ£ņØä ĒżĒĢ©ĒĢ£ ņĢłĻ│╝ņĀü ņ”ØņāüņØ┤ ņ¦ĆņåŹļÉĀ Ļ▓ĮņÜ░ ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŗż.5,6
ļé┤ņŗ£Ļ▓ĮņĀü ņĢłņÖĆĻ░ÉņĢĢņłĀņØĆ 1990ļģä ņ▓śņØī ņåīĻ░£ļÉ£ ņØ┤Ēøä7 ĒØēĒä░Ļ░Ć ļé©ņ¦Ć ņĢŖņ£╝ļ®░, ņĢłņÖĆņ▓©ļČĆņØś ņŗ£ņĢ╝ ĒÖĢļ│┤Ļ░Ć ņÜ®ņØ┤ĒĢśļŗżļŖö ņĀÉņŚÉņä£ ļäÉļ”¼ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż.8 Ēśäņ×¼ Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĢłņÖĆĻ░ÉņĢĢņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ņØś ĻĄÉņĀĢ ņĀĢļÅäļź╝ ņśłņĖĪĒĢśĻĖ░ ņ£äĒĢ£ ņĀĢĒÖĢĒĢ£ ņ¦ĆĒæ£ļŖö ņŚåņ£╝ļ®░ ņØ┤ļź╝ ņśłņĖĪĒĢśĻĖ░ ņ£äĒĢ£ ļŗżņ¢æĒĢ£ ņ¦ĆĒæ£ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņŚłļŗż.9 ņĢłņÖĆ ĻĖĖņØ┤, ņĢłĻĄ¼ ĻĖĖņØ┤, ņĢłņÖĆ ĻĖĖņØ┤ņÖĆ ņĢłĻĄ¼ ĻĖĖņØ┤ņØś ļ╣ä, ņĢłņÖĆņ▓©ļČĆ Ļ░üļÅä, ņé¼Ļ│©ļÅÖ Ļ╣ŖņØ┤, ņĮöņżæĻ▓® ņ╣śņÜ░ņ╣© ļō▒ņØ┤ ņĢłņÖĆĻ░ÉņĢĢņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ ĻĄÉņĀĢ ņĀĢļÅäļź╝ ņśłņĖĪĒĢśĻĖ░ ņ£äĒĢ£ ņ¦ĆĒæ£ļĪ£ ņĀ£ņŗ£ļÉśņŚłļŗż.10-12 ļśÉĒĢ£ ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ņĢłņÖĆ ĻĄ¼ņĪ░ ĒśĢĒā£ļź╝ ļīĆĒæ£ĒĢśļŖö ņĢłņÖĆ ĻĖĖņØ┤, ņĢłĻĄ¼ ĻĖĖņØ┤, ņĢłņÖĆņ▓©ļČĆ Ļ░üļÅä ļō▒ņØś ņ¦ĆĒæ£ļōżņŚÉ ļīĆĒĢ┤ 3ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü Ļ▓░Ļ│╝ņÖĆ 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü Ļ▓░Ļ│╝ļź╝ ļ╣äĻĄÉĒ¢łņØä ļĢī ņ£ĀņØśĒĢ£ ņāüĻ┤Ćņä▒ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż.10
ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ ļé┤ņŗ£Ļ▓ĮņĀü ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņłśņłĀ ņĀäĒøä ņĢłņÖĆ ĻĄ¼ņĪ░ņÖĆ ņĢłĻĄ¼ļÅīņČ£ ļ│ĆĒÖöņØś Ļ┤ĆĻ│äņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
2017ļģä 2ņøöļČĆĒä░ 2021ļģä 3ņøöĻ╣īņ¦Ć ļ│Ė ļ│æņøÉ ņĢłĻ│╝ņŚÉņä£ Ļ░æņāüņāśļłłļ│æņ”ØņØä ņ¦äļŗ©ļ░øĻ│Ā ļé┤ņŗ£Ļ▓ĮņĀü ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłĀ ņŗ£Ē¢ē Ēøä 6Ļ░£ņøö ņØ┤ņāü ņČöņĀü Ļ┤Ćņ░░ļÉ£ 18ļ¬ģ(33ņĢł)ņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆņ£╝ļ®░ ņØ┤ņĀä ņĢłņÖĆĻ░ÉņĢĢņłĀ, ņÖĖņĢłĻĘ╝ņłśņłĀ, ņĢłņÖĆĻ│©ņĀł, ļ░®ņé¼ņäĀ ņ╣śļŻī, ņĢłĻĄ¼ņåÉņāü(ņĢłĻĄ¼ĒīīņŚ┤ ļō▒)ņØ┤ ņ׳ļŖö ĒÖśņ×ÉļŖö ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņØä ņżĆņłśĒĢśņśĆĻ│Ā ļ│ĖņøÉ ņ×äņāüņŗ£ĒŚśņ£żļ”¼ņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖņØä ļ░øņĢśļŗż(ņŖ╣ņØĖļ▓łĒśĖ: INHA 2022-11-036). ļ¬©ļōĀ ļé┤ņŗ£Ļ▓ĮņĀü ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłĀĻ│╝ ņ×äņāüņĀüņØĖ ĒÅēĻ░ĆļŖö ļŗ©ņØ╝ ņłĀņ×É(S.M.K.)ņŚÉ ņØśĒĢ┤ ņØ┤ļŻ©ņ¢┤ņĪīļŗż.
ļ¬©ļōĀ ļīĆņāü ĒÖśņ×ÉņŚÉņä£ ņłśņłĀ ņĀäĒøä ĻĄÉņĀĢņŗ£ļĀź, ņĢłņĢĢ, ņĢłĻĄ¼ļÅīņČ£ ņĀĢļÅä, ņ×äņāü ĒÖ£ļÅÖļÅä ņĀÉņłś(clinical activity score), ņłśņłĀ ņĀäĒøä ņĢłĻĄ¼ņÜ┤ļÅÖ ļō▒ņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā ņĀ£1ņĢłņ£äņŚÉņä£ ņĖĪņĀĢĒĢ£ 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņłśņłĀ ņĀä ņĢłņÖĆ ĻĖĖņØ┤, ņĢłĻĄ¼ ĻĖĖņØ┤, ņĢłĻĄ¼ ĻĖĖņØ┤ņÖĆ ņĢłņÖĆ ĻĖĖņØ┤ņØś ļ╣ä, ņĢłņÖĆņ▓©ļČĆ Ļ░üļÅä, ņé¼Ļ│©ļÅÖņØś Ļ╣ŖņØ┤, ņĢłņÖĆļé┤ļ▓ĮĻ│╝ ņÖĖļ▓ĮņØś ĻĖĖņØ┤, ņÖĖņĢłĻĘ╝ņØś ļŗ©ļ®┤ņĀü, ņłśņłĀ Ēøä ņĢłņÖĆļé┤ļ▓ĮņØś Ļ▓░ņåÉļÉ£ ĻĖĖņØ┤, Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņØś Ļ░Ćņן ĒøäļČĆņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤ļź╝ ĒÖĢņØĖĒĢśņŚ¼ ņłśņłĀ ņĀäĒøä ņĢłņÖĆņØś ĻĄ¼ņĪ░ņĀüņØĖ ĒśĢĒā£ļź╝ ĒīīņĢģĒĢśņśĆļŗż. 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņØś ņČĢņśüņāü(axial scan) ņżæ ņłśņĀĢņ▓┤ ņØīņśüņØ┤ Ļ┤Ćņ░░ļÉśļŖö ļŗ©ļ®┤ņŚÉņä£ ņĢłĻĄ¼ ĻĖĖņØ┤ļź╝ ņĖĪņĀĢĒĢśņśĆĻ│Ā, ņĢłņÖĆ ĻĖĖņØ┤ļŖö ņāüņĢłņÖĆņŚ┤ņØś ĒĢśņĖĪ Ļ▓ĮĻ│äļ®┤ņŚÉņä£ ņĢłņÖĆ ņ×ģĻĄ¼ņØś ņżæņĀÉĻ╣īņ¦ĆņØś ĻĖĖņØ┤ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņŗ£ņŗĀĻ▓ĮĻ┤ĆņØ┤ ļ│┤ņØ┤ļŖö ņČĢņśüņāüņŚÉņä£ ņĢłņÖĆļé┤ļ▓ĮĻ│╝ ņÖĖļ▓ĮņØ┤ ņØ┤ļŻ©ļŖö Ļ░üļÅäļĪ£ ņĢłņÖĆņ▓©ļČĆ Ļ░üļÅäļź╝ ĒÖĢņØĖĒĢśņśĆĻ│Ā10 Ļ░Ćņן Ļ╣ŖņØĆ ņé¼Ļ│©ļÅÖņØś Ļ╣ŖņØ┤ļÅä ĒĢ©Ļ╗ś ņĖĪņĀĢĒĢśņśĆļŗż. ņĢłņÖĆļé┤ļ▓ĮĻ│╝ ņÖĖļ▓ĮņØś ĻĖĖņØ┤ļŖö ņŗ£ņŗĀĻ▓ĮĻ┤ĆņØ┤ ļ│┤ņØ┤ļŖö ņČĢņśüņāüņŚÉņä£ ļé┤ņĖĪĻ│╝ ņÖĖņĖĪ ņĢłņÖĆ ņ×ģĻĄ¼ņŚÉņä£ ņĢłņÖĆņ▓©ļČĆ ņé¼ņØ┤ ĻĖĖņØ┤ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.11 Ļ┤Ćņāüņśüņāü(coronal scan)ņŚÉņä£ ņÖĖņĢłĻĘ╝ņØś ļŗ©ļ®┤ņĀüņØ┤ ņĄ£ļīĆ ļ®┤ņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśļŖö Ļ┤ĆņāüņśüņāüņØä ĻĖ░ņżĆņ£╝ļĪ£ ņÖĖņĢłĻĘ╝ņØś ļŗ©ļ®┤ņĀüņØä ņĖĪņĀĢĒĢśņśĆļŗż. ņłśņłĀ Ēøä ņŗ£Ē¢ēĒĢ£ 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ņżæ ņŗ£ņŗĀĻ▓ĮĻ┤ĆņØ┤ ļ│┤ņØ┤ļŖö ņČĢņśüņāüņŚÉņä£ ņĢłņÖĆļé┤ļ▓ĮņØś Ļ▓░ņåÉ ĻĖĖņØ┤ņÖĆ Ļ▓░ņåÉļÉ£ ļé┤ļ▓ĮņØś Ļ░Ćņן ĒøäļČĆņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż(Fig. 1). ņČöĻ░ĆļĪ£ ņłśņłĀ Ēøä ņĢłņÖĆļé┤ļ▓ĮņØś Ļ▓░ņåÉļÉ£ ĻĖĖņØ┤ņÖĆ ņĀäņ▓┤ ņĢłņÖĆļé┤ļ▓Į ĻĖĖņØ┤ņØś ļ╣äļź╝ Ļ│äņé░ĒĢśņŚ¼ ņĢłĻĄ¼ļÅīņČ£ ļ│ĆĒÖöņØś Ļ┤ĆĻ│äļź╝ ļČäņäØĒĢśņśĆļŗż. ļ¬©ļōĀ 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ņśüņāü ļČäņäØ ļ░Å ņĖĪņĀĢņØĆ ĻĖ░ņżĆņŚÉ ļČĆĒĢ®ĒĢśļŖö ņłśņłĀ ņĀäĒøä ĒŖ╣ņĀĢ ņśüņāü ļŗ©ļ®┤ņ£╝ļĪ£ ĒÖĢņØĖĒĢśņśĆĻ│Ā INFINITT PACS┬« software (INFINITT Healthcare, Seoul, Korea)ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż.
ļ¬©ļōĀ ĒÖśņ×ÉņØś ņĢłĻĄ¼ļÅīņČ£ ņĀĢļÅäļŖö Hertel ņĢłĻĄ¼ļÅīņČ£Ļ│äļĪ£ ņóīņÜ░ņØś Ļ░üļ¦ēļÅīņČ£ ņĀĢļÅäļź╝ ņĖĪņĀĢĒĢśĻ│Ā ņłśņłĀ Ēøä 6Ļ░£ņøö Ļ▓ĮĻ│╝ĒĢ£ ņŗ£ņĀÉņŚÉ ĻĄÉņĀĢņŗ£ļĀź, ņĢłņĢĢ, ņĢłĻĄ¼ļÅīņČ£ ņĀĢļÅäļź╝ ņĖĪņĀĢĒĢśņŚ¼ Ļ▓ĮĻ│╝ļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż.
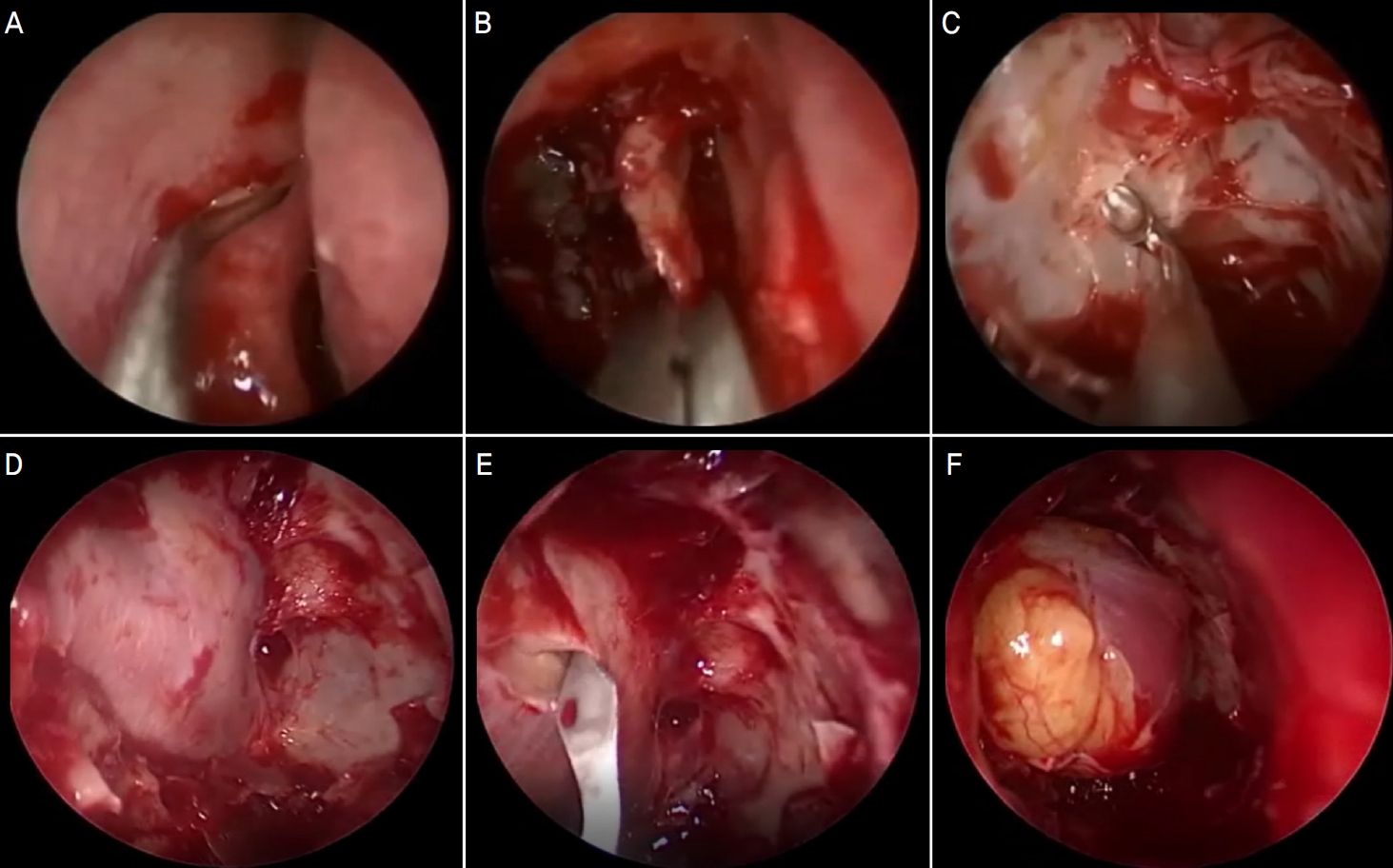
ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ņłśņłĀņØĆ ņĀäņŗĀļ¦łņĘ© ĒĢśņŚÉ ļé┤ņŗ£Ļ▓ĮņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĮöĻ▓Įņ£Ā ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłĀļĪ£ ņŗ£Ē¢ēĒĢśņśĆļŗż. OxymetazolineņØä ņĀüņŗĀ Ļ▒░ņ”łļź╝ ņĮö ņĢłņŚÉ ļ®öņøī ņĮö ņĢłņ¬Į ĒśłĻ┤Ć ņłśņČĢņØä ņŗ£ĒéżĻ│Ā 1:100,000 ņŚÉĒö╝ļäżĒöäļ”░ņØ┤ ņä×ņØĖ ļ”¼ļÅäņ╣┤ņØĖņØä ĻĄ¼ņāüļÅīĻĖ░(uncinate process)ņŚÉ ņŻ╝ņé¼ĒĢ£ Ēøä, ĻĄ¼ņāüļÅīĻĖ░ņĀłņĀ£ņłĀ(uncinectomy)ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż.13-15 ņĄ£ļīĆĒĢ£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦Ć ņĢłņÖĆļé┤ļ▓ĮņØä ļģĖņČ£ņŗ£ĒéżĻ│Ā microcuretteĻ│╝ freer elevatorļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļé┤ļ▓ĮņØä ļČäļ”¼ņŗ£Ēé© ļÆż, ņĢłņÖĆĻ│©ļ¦ēņØ┤ ļģĖņČ£ļÉśļ®┤ sharp knifeļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĢłņÖĆĻ│©ļ¦ēņØä ņĀłĻ░£ĒĢśĻ│Ā ņĢłņÖĆ ņŚ░ļČĆņĪ░ņ¦üņØä ņé¼Ļ│©ļÅÖņ£╝ļĪ£ ĒāłņČ£ņŗ£ņ╝£ ņĢłņÖĆĻ░ÉņĢĢņØä ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 2).16
ĒåĄĻ│ä ļČäņäØņØĆ SPSS statistics ver. 18.0 (IBM Corp., Armonk, NY, USA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöņÖĆ Ļ░üĻ░üņØś ņÜöņØĖņŚÉ ļīĆĒĢ┤ ļŗ©ļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ņČöĻ░ĆļĪ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ╝ ņłś ņ׳ļŖö ņÜöņØĖļōżņŚÉ ļīĆĒĢ┤ ļŗżļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. pĻ░ÆņØ┤ 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż.
ļīĆņāü ĒÖśņ×ÉļŖö ņ┤Ø 18ļ¬ģņ£╝ļĪ£ ļé©ņ×É 2ļ¬ģ(11.1%), ņŚ¼ņ×É 16ļ¬ģ(88.9%)ņØ┤ņŚłņ£╝ļ®░ ĒÅēĻĘĀ ņŚ░ļĀ╣ 31.3ņäĖ, Ļ░æņāüņāś ņ¦łĒÖśņØś ņ£Āļ│æ ĻĖ░Ļ░äņØĆ ĒÅēĻĘĀ 4.2ļģä, ņłśņłĀ ņĀä ļ│Ąņŗ£Ļ░Ć Ļ┤Ćņ░░ļÉ£ ĒÖśņ×ÉļŖö 1ļ¬ģ, ņĢłĻĄ¼ ņÜ┤ļÅÖņןņĢĀĻ░Ć Ļ┤Ćņ░░ļÉ£ ĒÖśņ×ÉļŖö 2ļ¬ģņØ┤ņŚłĻ│Ā(Table 1), ņłśņłĀ Ēøä ļ│Ąņŗ£Ļ░Ć ņāłļĪ£ ļ░£ņāØĒĢ£ ĒÖśņ×ÉļŖö 4ļ¬ģ, ņłśņłĀ Ēøä ļ│Ąņŗ£Ļ░Ć ņĢģĒÖöļÉ£ ĒÖśņ×ÉļŖö 1ļ¬ģ, ņĢłĻĄ¼ņÜ┤ļÅÖņןņĢĀĻ░Ć Ļ┤Ćņ░░ļÉ£ ĒÖśņ×ÉļŖö 7ļ¬ģņØ┤ņŚłļŗż(Table 2). ņłśņłĀ ņĀä 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ĒÅēĻĘĀ ņĢłņÖĆ ĻĖĖņØ┤ļŖö 42.08 mm, ĒÅēĻĘĀ ņĢłĻĄ¼ ĻĖĖņØ┤ļŖö 25.05 mmņØ┤Ļ│Ā ĒÅēĻĘĀ ņĢłņÖĆļé┤ļ▓Į ĻĖĖņØ┤ļŖö 41.78 mmņśĆļŗż. ņłśņłĀ Ēøä ņĢłņÖĆļé┤ļ▓ĮņØś Ļ▓░ņåÉ ĻĖĖņØ┤ļŖö ĒÅēĻĘĀ 22.78 mmņØ┤ļ®░ Ļ▓░ņåÉļÉ£ ļé┤ļ▓ĮņØś Ļ░Ćņן ĒøäļČĆņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤ņØś ĒÅēĻĘĀ Ļ░ÆņØĆ 10.27 mmņśĆļŗż. ņłśņłĀ ņĀäĒøä ņĢłĻĄ¼ļÅī ņČ£Ļ░ÆņØĆ ĒÅēĻĘĀ 2.48 mm Ļ░ÉņåīĒĢśņśĆļŗż(Table 3).
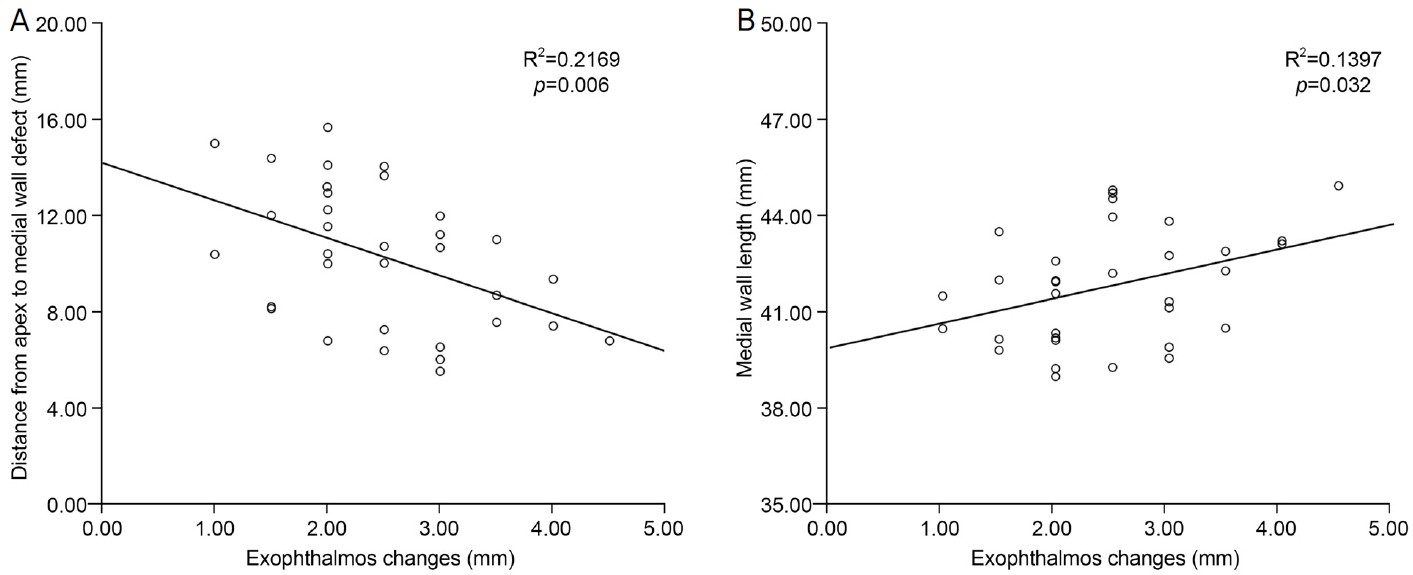
ļŗ©ļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ņłśņłĀ ņĀä ņĢłņÖĆļé┤ļ▓Į ĻĖĖņØ┤(p=0.032)ņÖĆ ņłśņłĀ Ēøä Ļ▓░ņåÉļÉ£ ļé┤ļ▓ĮņØś Ļ░Ćņן ĒøäļČĆņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤(p=0.006)Ļ░Ć ņłśņłĀ ņĀäĒøä ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļČäņäØļÉśņŚłļŗż. ĻĘĖ ņÖĖ ņĢłņÖĆ ĻĖĖņØ┤, ņĢłĻĄ¼ĻĖĖņØ┤, ņÖĖņĢłĻĘ╝ņØś ļŗ©ļ®┤ņĀü, ņĢłņÖĆļé┤ļ▓Į Ļ▓░ņåÉ ĻĖĖņØ┤ļŖö ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Fig. 3, Table 4). ļŗ©ļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöņÖĆ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØĖ 2Ļ░Ćņ¦Ć ņ¦ĆĒæ£ņŚÉ ļīĆĒĢśņŚ¼ ļŗżļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņČöĻ░ĆļĪ£ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ņłśņłĀ Ēøä Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤(p=0.019)Ļ░Ć ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöņÖĆ ņŚ░Ļ┤ĆļÉ£ ņ£ĀņØśĒĢ£ ņ¦ĆĒæ£ļĪ£ ļéśĒāĆļé¼ļŗż(Table 5).
Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢĀ ļĢī ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöļŖö ļŗżņ¢æĒĢ£ ņÜöņØĖņØś ņśüĒ¢źņØä ļ░øĻĖ░ ļĢīļ¼ĖņŚÉ ņśłņĖĪĒĢśļŖö Ļ▓āņØ┤ ņēĮņ¦Ć ņĢŖļŗż.9 ņĢłņÖĆĻ░ÉņĢĢņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöļŖö ņ¦Ćļ░® ņĪ░ņ¦üņØś Ļ░Ģņä▒(stiffness), ņÖĖņĢłĻĘ╝ņØś ļ╣äļīĆĒĢ£ ņĀĢļÅä, ņĢłņÖĆ ĻĄ¼ņĪ░ ļ░Å ņĢłĻĄ¼ Ēü¼ĻĖ░Ļ░Ć ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż.10,16 ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ņĢłņÖĆļé┤ļ▓ĮĻ│╝ ņÖĖļ▓ĮņØś Ļ░ÉņĢĢņłĀ(balanced orbital decompression)ņØä ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉņŚÉņä£ ņĢłņÖĆņ▓©ļČĆ Ļ░üļÅäĻ░Ć ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤Ćņä▒ņØä ļ│┤ņŚ¼ņŻ╝ņŚłĻ│Ā11 Borumandi et al10ņŚÉ ļö░ļź┤ļ®┤ ņĢłņÖĆņØś ļČĆĒö╝Ļ░Ć ņĀüĻ▒░ļéś ņĢłĻĄ¼ņØś Ēü¼ĻĖ░Ļ░Ć ņāüļīĆņĀüņ£╝ļĪ£ Ēü░ Ļ▓ĮņÜ░ ņĢłņÖĆĻ░ÉņĢĢņłĀļĪ£ ņØĖĒĢ£ ņĢłĻĄ¼ļÅīņČ£ņØś Ļ░Éņåī ĒÜ©Ļ│╝Ļ░Ć ņĀüņØä Ļ▓āņØ┤ļØ╝ ņśłņĖĪĒĢĀ ņłś ņ׳ļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĖĪņĀĢļÉ£ ņĢłņÖĆ ĻĖĖņØ┤, ņĢłĻĄ¼ ĻĖĖņØ┤, ņĢłĻĄ¼ ĻĖĖņØ┤ņÖĆ ņĢłņÖĆ ĻĖĖņØ┤ņØś ļ╣ä, ņĢłņÖĆņ▓©ļČĆ Ļ░üļÅä ļ¬©ļæÉ ņØ┤ņĀä ļÅÖņ¢æņØĖņØä ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ņĢłņÖĆ ĻĄ¼ņĪ░ņØś ņĖĪņĀĢĻ░ÆĻ│╝ ņ£Āņé¼ĒĢśĻ▓ī ņĖĪņĀĢļÉśņŚłļŗż.17 ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢ£ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņĢłņÖĆņ▓©ļČĆ Ļ░üļÅäņÖĆ ņĢłĻĄ¼ļÅīņČ£ĻĄÉņĀĢ ņĀĢļÅäņØś ņŚ░Ļ┤Ćņä▒ņØä ļČäņäØĒ¢łņØä ļĢī ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.165). 2ņ░©ņøÉ ņśüņāü ļČäņäØņ£╝ļĪ£ ņĢłņÖĆņØś ļČĆĒö╝ļź╝ ņśłņĖĪĒĢśĻ│Āņ×É ĒĢśļŖö ņ¦ĆĒæ£ņØĖ ņĢłĻĄ¼ ĻĖĖņØ┤(p=0.675), ņĢłņÖĆĻĖĖņØ┤(p=0.905), ņĢłĻĄ¼ ĻĖĖņØ┤ņÖĆ ņĢłņÖĆ ĻĖĖņØ┤ņØś ļ╣ä(p=0.905)ņŚÉņä£ļÅä ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöņÖĆ ņŚ░Ļ┤Ćņä▒ņØ┤ ņŚåņŚłļŗż.
Oeverhaus et al11ņŚÉ ļö░ļź┤ļ®┤ ņÖĖņĢłĻĘ╝ņØś ņ¦Ćļ”äĻ│╝ ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņŚåņŚłņ£╝ļ®░ ņ¦Ćļ░®ņĪ░ņ¦üņØś ņä¼ņ£ĀĒÖöņÖĆ ņÖĖņĢłĻĘ╝ņØś ļČĆĒö╝ļź╝ ĒÖĢņØĖĒĢśļ®┤ ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöļź╝ ņśłņĖĪĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļØ╝Ļ│Ā ņŻ╝ņןĒĢśņśĆļŗż. ņÖĖņĢłĻĘ╝ņØś ļČĆĒö╝ļź╝ ļīĆņŗĀĒĢśņŚ¼ ņÖĖņĢłĻĘ╝ņØś ļŗ©ļ®┤ņĀüņØä ĒåĄĒĢ┤ ņĢłņÖĆĻ░ÉņĢĢņłĀņŚÉ ļö░ļźĖ ņĢłĻĄ¼ļÅīņČ£ņØś ĻĄÉņĀĢ ņĀĢļÅäļź╝ ļČäņäØĒĢ┤ļ│┤ņĢśņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. Alsuhaibani et al18ņØĆ ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢ£ ļÆż ņÖĖņ¦üĻĘ╝ņØś ļČĆĒö╝Ļ░Ć ļ│ĆĒÖöĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░ Lee et al17ņØĆ ņĢłĻĄ¼ņØś ļČĆĒö╝, ņ¦Ćļ░®ņĪ░ņ¦üņØś ļČĆĒö╝, ļé┤ņ¦üĻĘ╝ņØś ļČĆĒö╝ļŖö ņŗżņĀ£ ņłĀ Ēøä ĒÜ©Ļ│╝ļź╝ ņśłņĖĪĒĢĀ ļĢī ņżæņÜöĒĢ£ ņ¦ĆĒæ£ņØ┤ļéś ņŗżņĀ£ļĪ£ ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ņØ┤ļź╝ ĒÖĢņØĖĒĢśļŖö ļŹ░ņŚÉļŖö ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļé┤ņŗ£Ļ▓ĮņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĮöĻ▓Įņ£Ā ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ ņĢłņÖĆļé┤ļ▓ĮĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņ¦ĆĒæ£ļŖö ņżæņÜöĒĢ£ ņØśļ»ĖĻ░Ć ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļŗ©ļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ĻĘĖņżæ ņłśņłĀ ņĀä ņĢłņÖĆļé┤ļ▓ĮņØś ĻĖĖņØ┤(p=0.032)ņÖĆ ņłśņłĀ Ēøä Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤(p=0.006)Ļ░Ć ņłśņłĀ ņĀäĒøä ņĢłĻĄ¼ļÅīņČ£Ļ░ÆņØś ļ│ĆĒÖöņÖĆ ņ£ĀņØśĒĢ£ Ļ┤ĆļĀ©ņä▒ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ņĢłņÖĆļé┤ļ▓ĮņØś ĻĖĖņØ┤ļŖö ņĢłņÖĆņØś ļČĆĒö╝ļź╝ ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ņ¦ĆĒæ£ļōż ņżæ ĒĢśļéśņØ┤ļ®┤ņä£ ņłśņłĀ ļ▓öņ£äņÖĆ ņ¦üņĀæņĀüņØĖ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŖö ņĢłņÖĆ ĻĄ¼ņĪ░ņØ┤ĻĖ░ ļĢīļ¼ĖņØ╝ Ļ▓āņ£╝ļĪ£ ņČöņĖĪļÉ£ļŗż. ļŗ©ļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņØĖ ņ¦ĆĒæ£ļōżļĪ£ ļŗżļ│Ćļ¤ēņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ ņłśņłĀ Ēøä Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤ņÖĆ ņĢłĻĄ¼ļÅīņČ£ Ļ░Éņåī ĒÜ©Ļ│╝ ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ Ļ┤ĆļĀ©ņä▒ņØä ļ│┤ņśĆļŗż(p=0.019). Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤Ļ░Ć ņ¦¦ņØäņłśļĪØ ļŹö ļ¦ÄņØĆ ņĢłĻĄ¼ļÅīņČ£ Ļ░Éņåī ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆĻ│Ā ņØ┤ļź╝ ĒåĄĒĢ┤ ņĢłņÖĆņ▓©ļČĆņŚÉ Ļ░ĆĻ╣īņÜ┤ ņ£äņ╣śĻ╣īņ¦Ć ņĢłņÖĆļé┤ļ▓ĮņØä ņĀ£Ļ▒░ĒĢĀņłśļĪØ ļŹö Ēü░ Ļ░ÉņĢĢ ĒÜ©Ļ│╝ļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĒĢśņ¦Ćļ¦ī ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£ņŗĀĻ▓ĮĻ┤ĆņØ┤ ļ│┤ņØ┤ļŖö ņČĢņśüņāüņŚÉņä£ ņĖĪņĀĢĒĢ£ ņĢłņÖĆļé┤ļ▓Į Ļ▓░ņåÉ ĻĖĖņØ┤ņÖĆ ņĀäņ▓┤ ņĢłņÖĆļé┤ļ▓Į ĻĖĖņØ┤ņØś ļ╣äĻ░Ć ĒÅēĻĘĀ 0.55ļĪ£ ĒÖĢņØĖļÉ£ ņĀÉņØä Ļ│ĀļĀżĒĢĀ ļĢī ņČ®ļČäĒĢ£ ņĢłņÖĆļé┤ļ▓ĮņØś ņĀ£Ļ▒░Ļ░Ć ņØ┤ļŻ©ņ¢┤ņĀĖņĢ╝ ĒÜ©Ļ│╝ņĀüņØĖ ņĢłņÖĆĻ░ÉņĢĢņłĀņØ┤ Ļ░ĆļŖźĒĢĀ Ļ▓āņØ┤ļŗż. Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢ£ ļÆż ļćīņ▓ÖņłśņĢĪ ņ£ĀņČ£, ļćīĻĖ░ņóģ ļō▒ņØ┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ļō£ļ¼╝Ļ▓ī ļ│┤Ļ│ĀļÉśņŚłļŗż.19-22 ņØ┤ņŚÉ ņĀæĒśĢļÅÖņØä ņ£Āņ¦ĆĒĢśļ®┤ņä£ Ēøäņé¼Ļ│©ļÅÖņØś ņĢłņÖĆļé┤ļ▓ĮĻ╣īņ¦Ć ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņØ┤ ņłśņłĀ ņżæ ĒĢ®ļ│æņ”ØņØä ņśłļ░®ĒĢśļŖö ļŹ░ņŚÉ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż. ļö░ļØ╝ņä£ Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢĀ ļĢī ņĢłĻĄ¼ļÅīņČ£ ĻĄÉņĀĢ ņĀĢļÅäļź╝ ļ»Ėļ”¼ ņśłņĖĪĒĢśĻ│Ā ņĀüņĀłĒĢ£ ņ£äņ╣śņÖĆ ļ▓öņ£äņØś ņĢłņÖĆļé┤ļ▓ĮņØä ņĀ£Ļ▒░ĒĢ┤ņĢ╝ ĒĢśļ®░ ĻĄÉņĀĢ ņĀĢļÅäĻ░Ć ļČĆņĪ▒ĒĢĀ Ļ▓āņ£╝ļĪ£ ņśłņāüļÉśļ®┤ ņłśņłĀ ņżæ ņ¦Ćļ░®ņĪ░ņ¦üņØä ņĀ£Ļ▒░ĒĢśĻ▒░ļéś ņČöĻ░ĆņĀüņØĖ ņĢłņÖĆĻ░ÉņĢĢņłĀņØä Ļ│ĀļĀżĒĢĀ ņłś ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļé┤ņŗ£Ļ▓ĮņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĮöĻ▓Įņ£Ā ļŗ©ļÅģ ņĢłņÖĆļé┤ļ▓ĮĻ░ÉņĢĢņłśņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ Ē¢łĻĖ░ ļĢīļ¼ĖņŚÉ ļīĆņāüņ×ÉņØś ņłśĻ░Ć ņĀüļŗż. ļśÉĒĢ£ 2ņ░©ņøÉ ņ¢╝ĻĄ┤ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü Ļ▓░Ļ│╝ļź╝ ļČäņäØĒĢśņŚ¼ ņĢłņÖĆ ĻĄ¼ņĪ░ļ¼╝ņØś ļČĆĒö╝, ņĢłņÖĆļ▓ĮņØś ļ¦īĻ│ĪļÅäĻ░Ć ļ░śņśüļÉśņ¦Ć ņĢŖņĢśļŗż. ņłśņłĀ Ēøä ņĢłņÖĆļé┤ļ▓ĮņØś Ļ▓░ņåÉ ĻĖĖņØ┤ļŖö Ļ░ÉņĢĢ ĒÜ©Ļ│╝ņÖĆ ĒåĄĻ│äņĀüņØĖ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņØĆ ņĀÉļÅä ņĢłņÖĆļé┤ļ▓ĮņØś Ļ▓░ņåÉļÉ£ ļ▓öņ£äļź╝ ņ×ģņ▓┤ņĀüņ£╝ļĪ£ ļ░śņśüĒĢśņ¦Ć ļ¬╗Ē¢łĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŖö ļŗżļźĖ ņĢłņÖĆĻ░ÉņĢĢņłĀ(2 wall decompression, 3 wall decompression)ņŚÉ ļīĆĒĢ£ ļČäņäØļÅä ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż. Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĢłĻĄ¼ļÅīņČ£ņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö ņÜöņØĖļōżņØĆ ņ£ĀņĀä, ļ®┤ņŚŁ, ĒÖśĻ▓Į ļō▒ņØä ĒżĒĢ©ĒĢśņŚ¼ ļŗżņ¢æĒĢ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā23,24 ņĢłņÖĆĻ░ÉņĢĢņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ Ļ░Éņåī ĒÜ©Ļ│╝ ņŚŁņŗ£ ņĢłņÖĆ ĻĄ¼ņĪ░ ņÖĖ ļŗżņ¢æĒĢ£ ņÜöņØĖļōżņØ┤ ņśüĒ¢źņØä ņżä ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśņ¦Ćļ¦ī ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĢłņÖĆ ĻĄ¼ņĪ░ ņÖĖ ļŗżļźĖ ņÜöņØĖļōżņŚÉ ļīĆĒĢ£ ļČäņäØņØĆ ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ļé┤ņŗ£Ļ▓ĮņĀü ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ░æņāüņāśļłłļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ 2ņ░©ņøÉ ņ¢╝ĻĄ┤ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ņśüņāüņØä ĒåĄĒĢ┤ ļČäņäØĒĢ£ Ļ▓░ņåÉļÉ£ ņĢłņÖĆļé┤ļ▓ĮņŚÉņä£ ņĢłņÖĆņ▓©ļČĆĻ╣īņ¦ĆņØś ĻĖĖņØ┤ļŖö ņłśņłĀ Ēøä ņĢłĻĄ¼ļÅīņČ£ Ļ░ÉņåīņÖĆ Ļ┤ĆļĀ©ņä▒ņØ┤ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ļö░ļØ╝ņä£ Ēøäņé¼Ļ│©ļÅÖņØä ņĄ£ļīĆĒĢ£ ĒżĒĢ©ĒĢśļ®┤ņä£ ņČ®ļČäĒĢ£ ļ▓öņ£äņØś ņĢłņÖĆļé┤ļ▓ĮņØä ņĀ£Ļ▒░ĒĢ┤ņĢ╝ ĒÜ©Ļ│╝ņĀüņØĖ ļé┤ņŗ£Ļ▓ĮņĀü ņĢłņÖĆĻ░ÉņĢĢņłĀņØä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
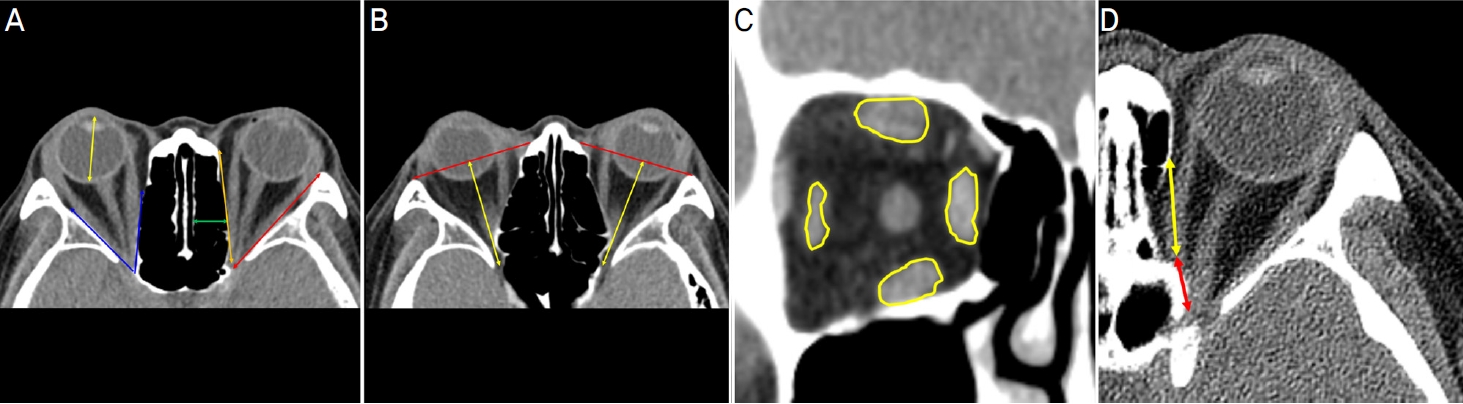
Figure┬Ā1.
Measurement of orbital parameters. (A) Globe length: antero-posterior globe length measured at optical lens level (yellow arrow), cone angle: angle between the medial and lateral orbital wall measured at optic canal level (blue arrows), medial orbital wall length: length from apex to medial orbital boundary measured at optic canal level (orange arrow), lateral orbital wall length: length from apex to lateral orbital boundary measured at optic canal level (red arrow), horizontal depth of ethmoid sinus measured at optic canal level (green arrow). (B) Measurement of orbital length: antero-posterior orbital length between orbital apex and the middle of the anterior orbital boundary line measured at the level of inferior end of superior orbital fissure (yellow arrows). (C) Size of extraocular muscle: maximum cross sectional area of extraocular muscle in coronal view (yellow lines). (D) Medial wall defect length (yellow arrow), distance from apex to medial wall defect measured at optic canal level (red arrow).
Figure┬Ā2.
Surgical procedure of the endoscopic orbital decompression. (A) Incision of the uncinate process. (B) Uncinectomy. (C) Anterior ethmoidectomy. (D) Periorbita after ethmoidectomy. (E) Incision of periorbita. (F) Orbital tissue prolapse into the ethmoid sinus.
Figure┬Ā3.
The relationship between exophthalmos changes and orbital morphology by linear regression analysis. (A) Exophthalmos changes and distance from apex to medial wall defect. (B) Exophthalmos changes and medial wall length.
Table┬Ā1.
Baseline characteristics of patients
Table┬Ā2.
Postoperative characteristics of patients
| Patient characteristics | n=18 |
|---|---|
| New onset diplopia in primary gaze | 4 (22.2) |
| Worsening of preexisting diplopia | 1 (5.6) |
| Eye movement deficit | 7 (38.9) |
Table┬Ā3.
Orbital morphology
Table┬Ā4.
Univariate linear regression analysis of associations between parameters related orbital morphology and exophthalmos changes
| Variable | ╬▓ | 95% CI | p-value* |
|---|---|---|---|
| Preoperative measurements | |||
| ŌĆāOL (mm) | -0.009 | -0.148 to 0.130 | 0.905 |
| ŌĆāGL (mm) | -0.118 | -0.665 to 0.429 | 0.675 |
| ŌĆāGL/OL ratio | -0.623 | -10.746 to 9.500 | 0.905 |
| ŌĆāCone angle (┬░) | 0.067 | -0.025 to 0.159 | 0.165 |
| ŌĆāMedial wall length (mm) | 0.179 | 0.022 to 0.336 | 0.032 |
| ŌĆāLateral wall length (mm) | 0.081 | -0.050 to 0.212 | 0.238 |
| ŌĆāDepth of ethmoidal sinus (mm) | 0.121 | -0.044 to 0.286 | 0.159 |
| ŌĆāSize of extraocular muscle (mm2) | |||
| ŌĆāŌĆāMR | 0.042 | -0.005 to 0.089 | 0.086 |
| ŌĆāŌĆāLR | 0.051 | -0.004 to 0.106 | 0.079 |
| ŌĆāŌĆāSR | 0.005 | -0.026 to 0.036 | 0.751 |
| ŌĆāŌĆāIR | 0.017 | -0.140 to 0.174 | 0.350 |
| Postoperative measurements | |||
| ŌĆāMedial wall defect length (mm) | 0.067 | -0.021 to 0.155 | 0.148 |
| ŌĆāDistance from apex to medial wall defect (mm) | -0.139 | -0.231 to -0.047 | 0.006 |
| ŌĆāRatio of defect length to total medial wall length | 0.152 | -2.154 to 5.494 | 0.399 |
Table┬Ā5.
Multivariate linear regression analysis of associations between parameters related orbital morphology and exophthalmos changes
| Variable | ╬▓ | 95% CI | p-value* |
|---|---|---|---|
| Preoperative measurements | |||
| ŌĆāMedial wall length (mm) | 0.13 | -0.019 to 0.279 | 0.099 |
| Postoperative measurements | |||
| ŌĆāDistance from apex to medial wall defect (mm) | -0.118 | -0.212 to -0.024 | 0.019 |
REFERENCES
1) Bartalena L, Pinchera A, Marcocci C. Management of Graves' ophthalmopathy: reality and perspectives. Endocr Rev 2000;21:168-99.



2) Asman P. Ophthalmological evaluation in thyroid-associated ophthalmopathy. Acta Ophthalmol Scand 2003;81:437-48.



4) Burch HB, Wartofsky L. GravesŌĆÖ ophthalmopathy: current concepts regarding pathogenesis and management. Endocr Rev 1993;14:747-93.


5) Fichter N, Guthoff RF, Schittkowski MP. Orbital decompression in thyroid eye disease. ISRN Ophthalmol 2012;2012:739236.




7) Kennedy DW, Goodstein ML, Miller NR, Zinreich SJ. Endoscopic transnasal orbital decompression. Arch Otolaryngol Head Neck Surg 1990;116:275-82.


8) Ting JY, Sindwani R. Endoscopic orbital decompression. Oper Tech Otolaryngol Head Neck Surg 2014;25:213-7.

9) Borumandi F, Hammer B, Kamer L, von Arx G. How predictable is exophthalmos reduction in Graves' orbitopathy? A review of the literature. Br J Ophthalmol 2011;95:1625-30.


10) Borumandi F, Hammer B, Noser H, Kamer L. Classification of orbital morphology for decompression surgery in Graves' orbitopathy: two-dimensional versus three-dimensional orbital parameters. Br J Ophthalmol 2013;97:659-62.


11) Oeverhaus M, Copei A, Mattheis S, et al. Influence of orbital morphology on proptosis reduction and ocular motility after decompression surgery in patients with Graves' orbitopathy. PLoS One 2019;14:e0218701.



12) Schiff BA, McMullen CP, Farinhas J, et al. Use of computed tomography to assess volume change after endoscopic orbital decompression for Graves' ophthalmopathy. Am J Otolaryngol 2015;36:729-35.


13) Kim JE, Kang SM. Factors associated with postoperative strabismus by endoscopic orbital decompression in patients with thyroid-associated ophthalmopathy. J Korean Ophthalmol Soc 2021;62:729-38.


14) Michel O, Oberl├żnder N, Neugebauer P, et al. Follow-up of transnasal orbital decompression in severe Graves' ophthalmopathy. Ophthalmology 2001;108:400-4.


15) Levy J, Puterman M, Lifshitz T, et al. Endoscopic orbital decompression for GravesŌĆÖ ophthalmopathy. Isr Med Assoc J 2004;6:673-6.

16) Kim JW, Kang SM. Surgical outcomes of endoscopic medial orbital wall decompression. J Craniofac Surg 2020;31:197-200.


17) Lee JS, Lee H, Chang MW, et al. Orbital morphology for decompression surgery in thyroid eye disease using 2-D orbital CT and 4 parameters. J Korean Ophthalmol Soc 2014;55:1267-71.

18) Alsuhaibani AH, Carter KD, Policeni B, Nerad JA. Effect of orbital bony decompression for Graves' orbitopathy on the volume of extraocular muscles. Br J Ophthalmol 2011;95:1255-8.


19) Warren JD, Spector JG, Burde R. Long-term follow-up and recent observations on 305 cases of orbital decompression for dysthyroid orbitopathy. Laryngoscope 1989;99:35-40.


20) Ghahvehchian H, Sadrhosseini SM, Fard MA. Pneumocephalus after orbital decompression surgery for thyroid eye disease. Middle East Afr J Ophthalmol 2020;27:142-4.



21) Limawararut V, Valenzuela AA, Sullivan TJ, et al. Cerebrospinal fluid leaks in orbital and lacrimal surgery. Surv Ophthalmol 2008;53:274-84.


22) Graham SM, Brown CL, Carter KD, et al. Medial and lateral orbital wall surgery for balanced decompression in thyroid eye disease. Laryngoscope 2003;113:1206-9.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




