 |
 |
| J Korean Ophthalmol Soc > Volume 64(3); 2023 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ņ”ØļĪĆņÜöņĢĮ
57ņäĖ ļé©ņ×ÉĻ░Ć 1ļģä ņĀä ņŗ£ņ×æļÉ£ ņ¢æņĢł ņŗ£ļĀźņĀĆĒĢśļĪ£ ņĢłĻ│╝ņŚÉ ļé┤ņøÉĒĢśņśĆļŗż. Ļ░üļ¦ēņØś ĒØ░ņāē Ļ▓░ņĀĢņä▒ ņ╣©ņ░®ļ¼╝ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņ¢æņĢł 1.0ņØ┤ņŚłļŗż. 3Ļ░£ņøö Ēøä ņŗ£ļĀźņØĆ ņÜ░ņĢł 0.8, ņóīņĢł 0.6ņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ņ╣©ņ░®ļ¼╝ļÅä ņ”ØĻ░ĆĒĢśņśĆļŗż. ļ”╝ĒöäĒśĢņ¦łņäĖĒżņä▒ļ”╝Ēöäņóģ ņ¦äļŗ©ļĀźņØä Ļ│ĀļĀż ĒĢśņŚ¼ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”Ø ņ¦äļŗ©ĒĢśņŚÉ ĒśłņĢĪņóģņ¢æļé┤Ļ│╝ņŚÉ ņØśļó░ĒĢśņśĆĻ│Ā, ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆļŗż. 3Ļ░£ņøö Ēøä ņ¢æņĢł ņ╣©ņ░®ļ¼╝ņØ┤ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ņ¢æņĢł ņŗ£ļĀźņØĆ 1.0ņ£╝ļĪ£ ĒśĖņĀäņØ┤ ņ׳ņŚłļŗż. 69ņäĖ ņŚ¼ņ×ÉĻ░Ć 2ļģä ņĀä ņŗ£ņ×æļÉ£ ņ¢æņĢł ņŗ£ļĀźņĀĆĒĢśļĪ£ ņĢłĻ│╝ņŚÉ ļé┤ņøÉĒĢśņśĆļŗż. Ļ░üļ¦ē ļ░Å ņłśņĀĢņ▓┤ ņĀäļéŁņØś Ļ░łņāē ņ╣©ņ░®ļ¼╝ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ļéśņĢłņŗ£ļĀźņØĆ ņÜ░ņĢł 0.4, ņóīņĢł ņĢłņĀäņłśņ¦ĆņśĆļŗż. Ēśłņ▓Ł ĻĄ¼ļ”¼ļåŹļÅäņØś ņāüņŖ╣ņØ┤ ĒÖĢņØĖļÉśņ¢┤ ļé┤Ļ│╝ņŚÉ ņØśļó░ĒĢśņśĆĻ│Ā, ļŗżļ░£ņä▒Ļ│©ņłśņóģņØ┤ ņ¦äļŗ©ļÉśņŚłļŗż. ņ╣śļŻī ņŗ£ņ×æ Ēøä ĒśłņĢĪ ņłśņ╣śļŖö ņĀĢņāü ļ▓öņ£äļĪ£ ĒÜīļ│ĄļÉśņŚłņ£╝ļéś, ņóīņĢł ņŗ£ļĀźņØĆ ņĢłņĀäņłśļÅÖņ£╝ļĪ£ Ļ░ÉņåīļÉśņŚłĻ│Ā ļ░▒ņāēļ░▒ļé┤ņן ņ¦äļŗ©ĒĢśņŚÉ ļ░▒ļé┤ņןņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłĀ Ēøä Ļ░üļ¦ēņ╣©ņ░®ņØĆ ļ╣äņŖĘĒĢśļéś ņŗ£ļĀźņØĆ 0.9ļĪ£ ņāüņŖ╣ĒĢśņśĆļŗż.
ABSTRACT
Case summary
A 57-year-old man visited the ophthalmology clinic complaining of decreased visual acuity since 1 year earlier. White crystalline deposits were observed on both corneas and the best corrected visual acuity (BCVA) of both eyes was 1.0. After 3 months, the BCVA decreased to 0.8 in the right and 0.6 in the left. Increased corneal deposits were observed. To rule out PK, his medical records were checked. The patient had been diagnosed with lymphoplasmacytic lymphoma 3 years earlier. Diagnosing PK, the patient was referred back to the Hemato-Oncology department. After 3 months of chemotherapy, the corneal deposits decreased and BCVA returned to 1.0. A 69-year-old woman presented complaining of decreased visual acuity for 2 years. The uncorrected visual acuity (UCVA) was 0.4 in the right and finger count at 30 cm in the left. Brown deposits were observed on both corneas and lenses. The serum copper level was elevated. She was referred to the internal medicine department and diagnosed with multiple myeloma. After treatment, the laboratory results returned to normal, but the UCVA decreased to hand motion in the left. A left white cataract was noted and cataract surgery was performed. 1 month postoperatively, the BCVA was 0.9, with no change in the corneal deposits.
ņØ╝ļ░śņĀüņ£╝ļĪ£ Ļ░üļ¦ēņØś Ļ▓░ņĀĢņä▒ ņ╣©ņ░®ļ¼╝ņØ┤ ļ│┤ņØ╝ ļĢī Ļ░ÉņŚ╝, Ļ░üļ¦ēņØ┤ņāüņ”Ø, ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø ļō▒ņØä ĻĘĖ ņøÉņØĖņ£╝ļĪ£ ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳ļŗż.1,2 ĒŖ╣Ē׳ Ļ░üļ¦ēņłśņłĀ Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļéś ņŖżĒģīļĪ£ņØ┤ļō£ ņĢłņĢĮņØä ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŖö Ļ▓ĮņÜ░ Ļ░ÉņŚ╝ņŚÉ ņØśĒĢ£ Ļ░üļ¦ēļ│æņ”ØņØä ļ░░ņĀ£ĒĢśņŚ¼ņĢ╝ ĒĢśļ®░, ņäĖĻĘĀļ░░ņ¢æĻ▓Ćņé¼ņāü ņØīņä▒ņØ┤ ļéśņśżļŹöļØ╝ļÅä ĒĢŁņāØņĀ£ ņĢłņĢĮņŚÉ ļ░śņØæņØ┤ ņóŗņ£╝ļ»ĆļĪ£ ļŗżļźĖ ņøÉņØĖņØä Ļ░Éļ│äĒĢśĻĖ░ ņĀäņŚÉ ĒĢäņłśņĀüņ£╝ļĪ£ Ļ░Éļ│äĒĢ┤ņĢ╝ ĒĢ£ļŗż.1 Ļ░üļ¦ēņØ┤ņāüņ”ØņØĆ ĒŖ╣ņ¦ĢņĀüņØĖ ņ×äņāü ņ¢æņāüņØ┤ ņ׳ņØä ļĢī ņØśņŗ¼ĒĢśļ®░, ņ£ĀņĀäņ×ÉĻ▓Ćņé¼ļź╝ ĒåĄĒĢśņŚ¼ ĒÖĢņ¦äĒĢĀ ņłś ņ׳ļŗż. ĒīīļØ╝ļŗ© ļ░▒Ēśłņ”ØņØĆ ĻĘĖ ņøÉņØĖĻ│╝ ņ”ØņāüņØ┤ ļŗżņ¢æĒĢśņŚ¼ Ļ░üļ¦ēļ│æņ”Øņ£╝ļĪ£ ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░ļŖö ņ”ØļĪĆļ│┤Ļ│Ā ņĀĢļÅäļĪ£ļ¦ī ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ņ£╝ļéś, ņ×äņāüņĀüņ£╝ļĪ£ ĒśłņĢĪņĢöĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ¢┤ ļé┤Ļ│╝ ņØśļó░Ļ░Ć ĒĢäņłśņØ┤ļŗż.
ņØśļ»ĖļČłļ¬ģņØś ļŗ©ņØ╝Ēü┤ļĪĀĻ░Éļ¦łĻĖĆļĪ£ļČłļ”░ļ│æņ”Ø(monoclonal gammopathy of undetermined significance), ļŗżļ░£ņä▒Ļ│©ņłśņóģ(multiple myeloma), ļ░£ļŹ┤ņŖżĒŖĖļĪ¼ ļ¦łĒü¼ļĪ£ĻĖĆļĪ£ļČłļ”░Ēśłņ”Ø(waldenstr├Čm macroglobulinemia) ļō▒ņŚÉ ņØśĒĢ┤ ĒśłņĢĪ ļé┤ ļŗ©ņØ╝ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░ņØ┤ ņ”ØĻ░ĆļÉ£ ļ│æņØä ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņØ┤ļØ╝ ĒĢ£ļŗż.3 ņØśļ»ĖļČłļ¬ģņØś ļŗ©ņØ╝Ēü┤ļĪĀĻ░Éļ¦łĻĖĆļĪ£ļČłļ”░ļ│æņ”ØņØĆ 50ņäĖ ņØ┤ņāüņØś ņä▒ņØĖņŚÉņä£ 2ĒŹ╝ņä╝ĒŖĖ ņĀĢļÅä ļ░£ļ│æĒĢśļŖö ņĀäņŗĀņØś ļŗ©ņØ╝ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░ ņłśņ╣śĻ░Ć ņ”ØĻ░ĆĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£, ĒśĢņ¦łņäĖĒżņØś ņØ┤ņāü ņ”ØņŗØņØä ĒśłņĢĪĻ▓Ćņé¼, ņåīļ│ĆĻ▓Ćņé¼ ļō▒ņØä ĒåĄĒĢ┤ ņ¦äļŗ©ĒĢ£ļŗż.4 ļīĆļČĆļČäņØś Ļ▓ĮņÜ░ ļ¼┤ņ”ØņāüņØ┤ļ®░, ļ│æņØś Ļ▓ĮĻ│╝ņŚÉ ļö░ļØ╝ ļŗżļ░£ņä▒Ļ│©ņłśņóģ, ļ░£ļŹ┤ņŖżĒŖĖļĪ¼ļ¦łĒü¼ļĪ£ĻĖĆļĪ£ļČłļ”░Ēśłņ”Ø ļō▒ņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņŚ¼ ĒŖ╣ņ¦ĢņĀüņØĖ ņ”ØņāüņØä ļéśĒāĆļé┤ļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż.2
ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø Ļ┤ĆļĀ© ņĢłĻĄ¼ ņ¦łĒÖśņ£╝ļĪ£ļŖö ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”Ø, ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä, ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒ ĒÖ®ļ░śļ│æņ”Ø ļō▒ņØ┤ ņĢīļĀżņĀĖ ņ׳ļŗż.5 ĒŖ╣Ē׳ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØĆ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņŚÉņä£ Ļ░Ćņן ļ¦ÄņØ┤ ļ│┤Ļ│ĀļÉ£ ņĢłĻĄ¼ Ļ┤ĆļĀ© ĒĢ®ļ│æņ”ØņØ┤ļéś, ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø ĒÖśņ×ÉņØś 1ĒŹ╝ņä╝ĒŖĖ ļ»Ėļ¦īņŚÉņä£ ņāØĻĖ░ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż.5 ņ”ØļĪĆļ¦łļŗż ņ”ØņāüņØ┤ ļŗżņ¢æĒĢśņŚ¼ ņĢäņ¦ü ņ¦łĒÖśņØś ņśłĒøäļéś ņ╣śļŻīļ▓ĢņŚÉ ļīĆĒĢ£ ņĀĢļ”ĮņØĆ ņŚåļŖö ņāüĒā£ņØ┤ļŗż.
ĒīīļØ╝ļŗ©ļ░▒ņØś ņóģļźś ļ░Å ĒŖ╣ņä▒ņŚÉ ļö░ļØ╝ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØĆ Ļ▓░ņĀĢņä▒ Ļ░üļ¦ēļ│æņ”Ø, Ļ▓░ņĀĢņĀĆņןņä▒ ņĪ░ņ¦üĻĄ¼ņ”Ø(crystal-storing histiocytosis), ĻĄ¼ļ”¼ņ╣©ņ░® Ļ░üļ¦ēļ│æņ”Øņ£╝ļĪ£ ļČäļźśĒĢĀ ņłś ņ׳ļŗż.5,6 ļČäļźśļ¦łļŗż ĒŖ╣ņä▒ņØ┤ ņØ╝ļČĆ ļŗżļź┤ļéś, Ļ│ĄĒåĄņĀüņ£╝ļĪ£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØĆ ĒīīļØ╝ļŗ©ļ░▒ņØś Ēśłņżæ ļåŹļÅäĻ░Ć ļåÆņØä Ļ▓ĮņÜ░ ņāØĻĖ░ļ®░ Ēśłņżæ ļåŹļÅä Ļ░Éņåī ņŚåņØ┤ Ļ░üļ¦ēņŚÉ ĻĄŁĒĢ£ļÉ£ ņ╣śļŻīļĪ£ļŖö ņ×¼ļ░£ĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ļśÉĒĢ£ ļé┤Ļ│╝ņĀü ņ╣śļŻī ņĀüņØæņ”ØņØ┤ ņĢäļŗī ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØ┤ ļ░£Ļ▓¼ļÉ£ Ļ▓ĮņÜ░ ņłśĻ░£ņøö ļé┤ļĪ£ ļŗżļ░£ņä▒Ļ│©ņłśņóģ ļō▒ņØś ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ ņĢöņ£╝ļĪ£ ņ¦äĒ¢ēĒĢ£ ņ”ØļĪĆļōżņØ┤ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż.7 ļö░ļØ╝ņä£ ņ¦äļŗ©ņØ┤ ļÉśļŖö ņ”ēņŗ£ ĒśłņĢĪņóģņ¢æļé┤Ļ│╝ ņĀäļ¼ĖņØśņŚÉĻ▓ī ņØśļó░ĒĢśņŚ¼ ĒśłņĢĪņĢö ĒÅēĻ░Ćļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņĢłĻ│╝ ņØśņé¼ļĪ£ņä£ Ļ░üļ¦ēņØś ņ╣©ņ░®ļ¼╝ņØ┤ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”Øņ×äņØä ņØĖņ¦ĆĒĢśņŚ¼ ļé┤Ļ│╝ņŚÉ ņØśļó░ĒĢśļŖö Ļ▓āņØ┤ Ļ░Ćņן ņżæņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”Ø ĒÖśņ×ÉņØś ņ¦äļŗ© ņśłļź╝ ĒåĄĒĢ┤ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø ņ╣śļŻīņØś ņŗ£ņ×æ ņŗ£ņĀÉņ£╝ļĪ£ Ļ░üļ¦ēļ│æņ”Ø ņ¦äļŗ©ņØś ņżæņÜöņä▒ņØä ņĀ£ņŗ£ĒĢśĻ│Āņ×É ĒĢ£ļŗż. ļ”╝ĒöäĒśĢņ¦łņäĖĒżņä▒ ļ”╝Ēöäņóģ ņŚ░Ļ┤Ć ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒ Ļ▓░ņĀĢņä▒ Ļ░üļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒĢŁņĢö ņ╣śļŻīļĪ£ ņŗ£ļĀźņØ┤ ĒśĖņĀäļÉ£ ņ”ØļĪĆ ļ░Å ļŗżļ░£ņä▒Ļ│©ņłśņóģ ņŚ░Ļ┤Ć ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒ ĻĄ¼ļ”¼ņ╣©ņ░® Ļ░üļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒĢŁņĢö ņ╣śļŻīņÖĆ ļ░▒ļé┤ņןņłśņłĀļĪ£ ņŗ£ļĀźņØ┤ ĒśĖņĀäļÉ£ ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
40ļīĆņŚÉ ņ¢æņĢł ļĀłņØ┤ņĀĆĻ░üļ¦ēņĀłņéŁĻ░ĆĻ│Ąņä▒ĒśĢņłĀ(laser-assisted in situ keratomileusis)ņØä ņŗ£Ē¢ēļ░øņØĆ ĻĖ░ņÖĢļĀźņØ┤ ņ׳ļŖö 57ņäĖ ļé©ņ×ÉĻ░Ć ņ¢æņĢł ņŗ£ļĀźņĀĆĒĢśļź╝ ņŻ╝ņåīļĪ£ ņĢłĻ│╝ņŚÉ ļé┤ņøÉĒĢśņśĆļŗż. 1ļģä ņĀäļČĆĒä░ ļ┐īņśćĻ▓ī ļ│┤ņśĆļŗżĻ│Ā ĒĢśņśĆņ£╝ļ®░, ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼ņāü ņ¢æņĢłņØś Ļ░üļ¦ēņŚÉ ĒØ░ņāē Ļ▓░ņĀĢņä▒ ņ╣©ņ░®ļ¼╝ņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ņóīņĢłņØ┤ ņÜ░ņĢłļ│┤ļŗż ņŗ¼ĒĢ£ ņ¢æņāüņØ┤ņŚłļŗż. ņ╣©ņ░®ļ¼╝ņØĆ Ļ░üļ¦ēņØś ņāüĒö╝ņäĖĒżņÖĆ ņĢ×ĻĖ░ņ¦ł ņ¬ĮņŚÉ ņ£äņ╣śĒĢśņśĆļŗż. ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņ¢æņĢł 1.0ņØ┤ņŚłļŗż.
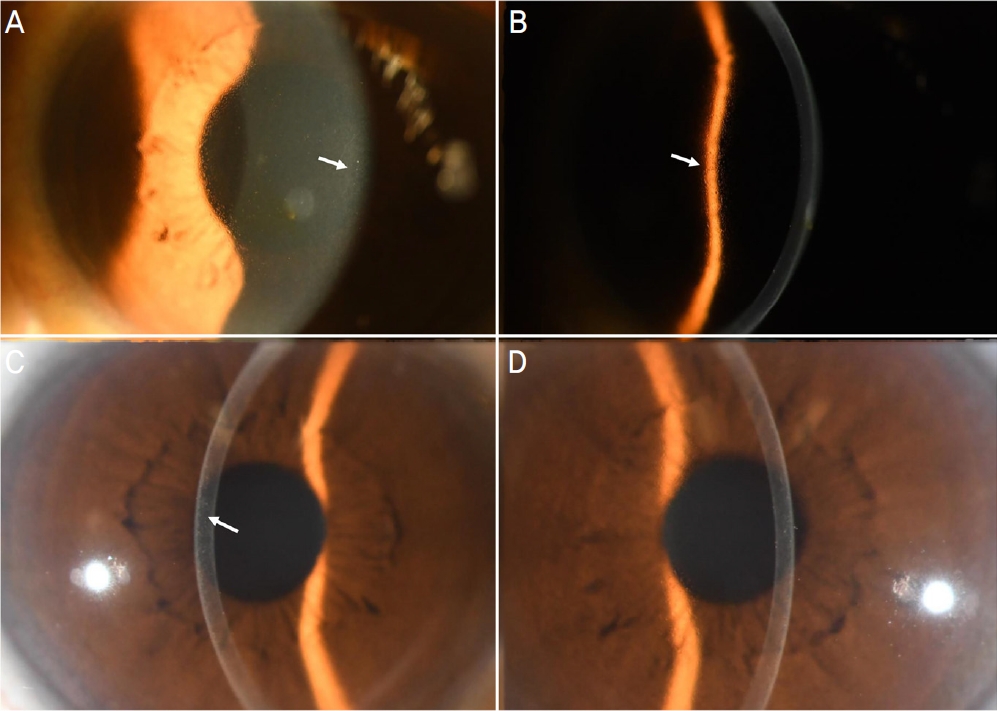
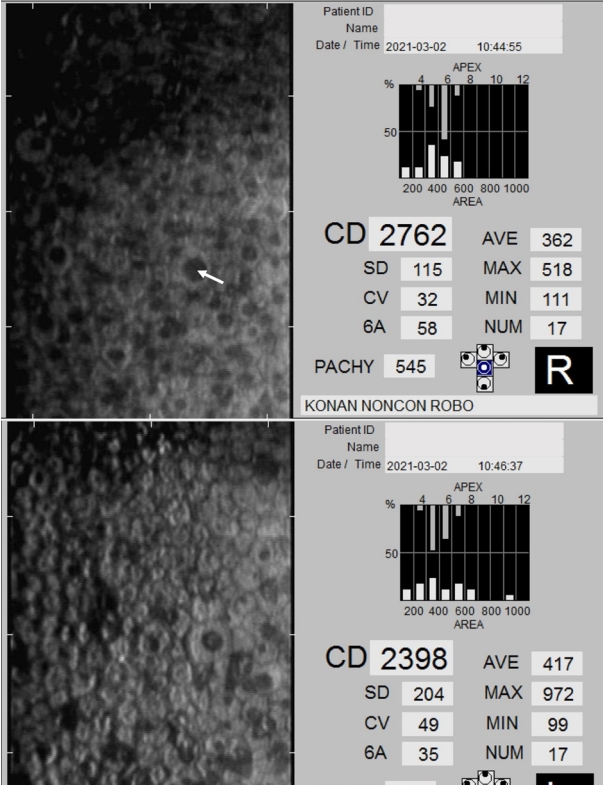
3Ļ░£ņøö Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ ņÜ░ņĢł 0.8, ņóīņĢł 0.6ņ£╝ļĪ£ Ļ░ÉņåīļÉśņŚłļŗż. ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼ņāü Ļ░üļ¦ēņāüĒö╝ ļ░Å ņĢ×ĻĖ░ņ¦łņØś ņ╣©ņ░®ļ¼╝ ņ”ØĻ░ĆĻ░Ć ĒÖĢņØĖļÉśņŚłņ£╝ļéś(Fig. 1), ņØ┤ņÖĖņŚÉ ņØ┤ņāü ņåīĻ▓¼ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. Ļ▓Įļ®┤Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼ņāü Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżņØś ņłśļŖö ņĀĢņāüņØ┤ņŚłņ£╝ļ®░, ļé┤Ēö╝ņäĖĒż ņ╣©ņ░®ļ¼╝ļĪ£ ņČöņĀĢļÉśļŖö ņåīĻ▓¼ņØ┤ ļ│┤ņśĆļŗż(Fig. 2). ņĀäņĢłļČĆļŗ©ņĖĄņ┤¼ņśüņāü Ļ░üļ¦ēļæÉĻ╗śļŖö ņÜ░ņĢł 505 ╬╝m, ņóīņĢł 496 ╬╝m ņśĆļŗż.
ĒÖśņ×ÉļŖö 3ļģä ņĀäņŚÉ ņē░ ļ¬®ņåīļ”¼ļź╝ ņŻ╝ņåīļĪ£ ĒāĆļ│æņøÉņŚÉ ļé┤ņøÉĒĢśņŚ¼ ņśüņāüĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ ĒÅÉņØś ļŹ®ņ¢┤ļ”¼ ļ░Å ļ╣äņן ņóģļīĆĻ░Ć ļ░£Ļ▓¼ļÉśņ¢┤ Ļ│©ņłśņāØĻ▓ĆņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ļ”╝ĒöäĒśĢņ¦łņäĖĒżņä▒ ļ”╝ĒöäņóģņØ┤ ņ¦äļŗ©ļÉśņŚłļŹś ĻĖ░ņÖĢļĀźņØ┤ ņ׳ņŚłļŗż. ņØ┤ņŚÉ 2ļģä ņĀä ļ│ĖņøÉ ĒśłņĢĪņóģņ¢æļé┤Ļ│╝ņŚÉ ņ▓śņØī ļé┤ņøÉĒĢśņŚ¼ ļŗ©ļ░▒ļ®┤ņŚŁĻ▓Ćņé¼ ļ░Å ĒØēļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü, ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝, ļ”╝ĒöäĒśĢņ¦łņäĖĒżņä▒ ļ”╝ĒöäņóģņŚÉ ĒĢ®ļŗ╣ĒĢ£ ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļéś, ņ╣śļŻī ņŚåņØ┤ 3Ļ░£ņøö Ļ░äĻ▓®ņ£╝ļĪ£ ĒśłņĢĪĻ▓Ćņé¼ļ¦ī ņ¦äĒ¢ēĒĢśļ®┤ņä£ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæņØ┤ņŚłļŗż. 1ļģä ņĀä ļ╣äņĀĢņāü ļ”╝ĒöäĻĄ¼ ņłśņ╣śĻ░Ć ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ņśüņāüĻ▓Ćņé¼ņāü ļ╣äņןņØ┤ ņĪ░ĻĖł ļŹö ļ╣äļīĆĒĢ┤ņĪīņ£╝ļéś, ļŗżļźĖ ļé┤Ļ│╝ņĀü ņ”ØņāüņØĆ ļ│ĆĒÖöĻ░Ć ņŚåņ¢┤ ĒĢŁņĢö ņ╣śļŻī ņŗ£ņ×æņØś ņĀüņØæņ”ØņØ┤ ļÉśņ¦Ć ņĢŖņĢä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæņØ┤ņŚłļŗż.
Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ņØś ņ”ØĻ░ĆĻ░Ć ņ׳ņ£╝ļ®░, 1ļģä ņĀä ļ”╝ĒöäĒśĢņ¦łņäĖĒżņä▒ ļ”╝Ēöäņóģ ņĢģĒÖö ņŗ£ņĀÉĻ│╝ ņŗ£ļĀźņĀĆĒĢś ņŗ£ņ×æ ņŗ£ņĀÉņØ┤ ļÅÖņØ╝ĒĢ£ ņĀÉ, Ēśłņ▓Ł M Ļ░Éļ¦łĻĖĆļĪ£ļČłļ”░ ņłśņ╣śĻ░Ć 5,599-12,200 mg/dL (ņĀĢņāü ļ▓öņ£ä 40-230 mg/dL)ļĪ£ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņĀĢņāü ļ▓öņ£äņØś 10ļ░░ ņØ┤ņāüņØĖ ņĀÉņØä Ļ│ĀļĀżĒĢśņŚ¼ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”Øņ£╝ļĪ£ ņØĖĒĢ£ ņŗ£ļĀźņĀĆĒĢś ņØśņŗ¼ĒĢśņŚÉ ĒĢŁņĢö ņ╣śļŻīļź╝ ņ£äĒĢ┤ ĒśłņĢĪņóģņ¢æļé┤Ļ│╝ņŚÉ ņ×¼ņØśļó░ĒĢśņśĆļŗż.
ĒÖśņ×ÉļŖö ļ░£ļĪ▒ļō£ļź┤ ņ×äņāüņŗ£ĒŚś(R-VRD followed by Lenalidomide maintenance in patients with Waldenstr├Čm Macroglobulinemia, Ballondor, ClinicalTrials.gov Identifier: NCT03697356)ņŚÉ ļō▒ļĪØļÉśņ¢┤ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆļŗż. ļ░£ļĪ▒ļō£ļź┤ ņ×äņāüņŗ£ĒŚśņØĆ ļ”╝ĒöäĒśĢņ¦łņäĖĒżņä▒ ļ”╝Ēöäņóģ ĒÖśņ×ÉņŚÉņä£ ļ”¼ĒłŁņŗ£ļ¦Ö, ļ│┤ļź┤ĒģīņĪ░ļ░ē, ļĀłļéĀļ”¼ļÅäļ¦łņØ┤ļō£, ļŹ▒ņé¼ļ®öĒāĆņåÉņØä ĒżĒĢ©ĒĢśļŖö ņ£ĀļÅä ĒĢŁņĢö ĒÖöĒĢÖņÜöļ▓ĢĻ│╝ ļĀłļéĀļ”¼ļÅäļ¦łņØ┤ļō£ ņ£Āņ¦ĆņÜöļ▓ĢņØś ĒÜ©Ļ│╝ ļ░Å ņĢłņĀäņä▒ Ļ▓Ćņ”ØņØä ņ£äĒĢ£ ņĀ£2ņāü ņŚ░ĻĄ¼ņØ┤ļŗż. ņ╣śļŻī ņŗ£ņ×æ 3Ļ░£ņøö Ēøä Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ņØ┤ Ļ░ÉņåīļÉ£ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņ¢æņĢł ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 1.0ņ£╝ļĪ£ ĒÜīļ│ĄļÉśņŚłļŗż.
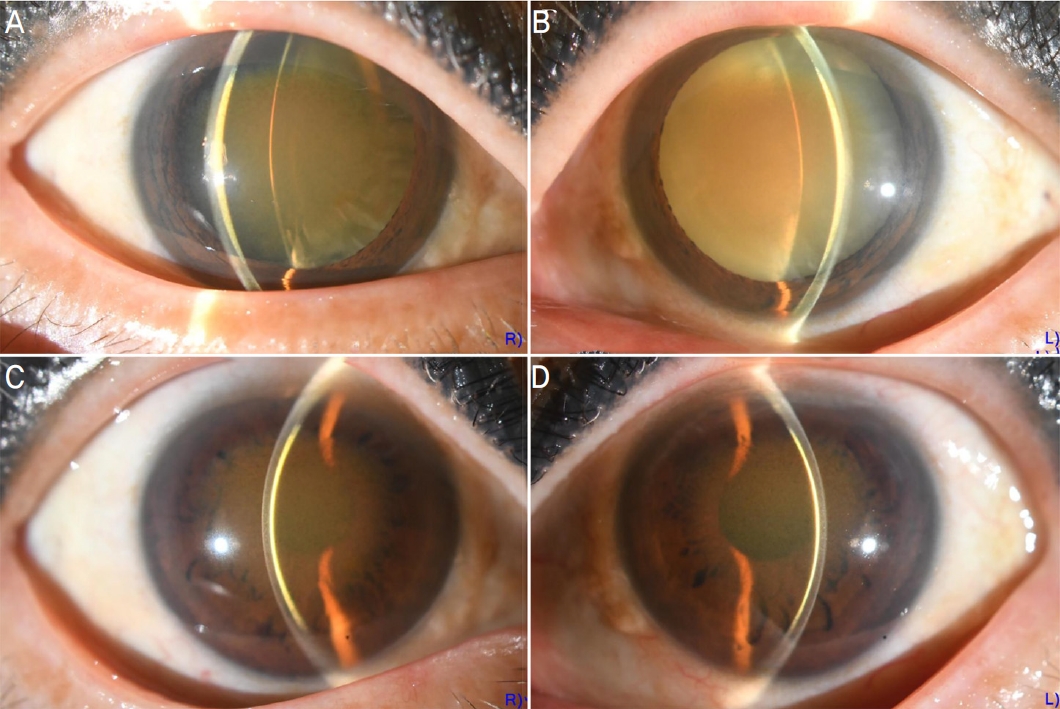
69ņäĖ ņŚ¼ņ×ÉĻ░Ć 2ļģä ņĀä ņŗ£ņ×æļÉ£ ņ¢æņĢł ņŗ£ļĀźņĀĆĒĢśļĪ£ ņĢłĻ│╝ ņÖĖļלņŚÉ ļé┤ņøÉĒĢśņśĆļŗż. ĒāĆļ│æņøÉ ņĢłĻ│╝ņŚÉņä£ ņ¢æņĢł Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżņŚÉ ņ╣©ņ░®ļ¼╝ņØ┤ ņ׳ļŗżĻ│Ā ļōŻĻ│Ā Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæņØ┤ņŚłļŗż. ļŗ╣ļć©, Ļ│ĀĒśłņĢĢ ļō▒ ļé┤Ļ│╝ņĀü ņ¦łĒÖśņØĆ ņŚåņŚłņ£╝ļ®░ ņĀĢĻĖ░ņĀüņ£╝ļĪ£ ļ│ĄņÜ® ņżæņØĖ ņĢĮ ļśÉĒĢ£ ņŚåļŗżĻ│Ā ĒĢśņśĆļŗż. ļé┤ņøÉ ļŗ╣ņŗ£ ļéśņĢłņŗ£ļĀź ņÜ░ņĢł 0.4, ņóīņĢł ņĢłņĀäņłśņ¦Ć 30 cmņśĆņ£╝ļ®░, Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ļĪ£ ņØĖĒĢśņŚ¼ ņĢłņĀĆļ░śņé¼Ļ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖĻ│Ā ņŗ£ļĀźņØĆ ĻĄÉņĀĢļÉśņ¦Ć ņĢŖņĢśļŗż. ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼ņāü ņżæņŗ¼ļČĆņØś Ļ░üļ¦ēļé┤Ēö╝ ļ░Å ņŗżņ¦łņŚÉ Ļ░łņāē ņ╣©ņ░®ļ¼╝ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ņ£żļČĆ ņŻ╝ļ│Ćņ£╝ļĪ£ Ēł¼ļ¬ģ ņ¦ĆļīĆ(lucid zone)Ļ░Ć ņ׳ņŚłļŗż(Fig. 3). ņłśņĀĢņ▓┤ ņĀäļéŁņŚÉļÅä Ļ░łņāē ņ╣©ņ░®ļ¼╝ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś Ļ░üļ¦ēņØś ņ╣©ņ░®ļ¼╝ļĪ£ ņØĖĒĢ┤ ļ¬ģĒÖĢĒĢśņ¦ĆļŖö ņĢŖņĢśļŗż. ņ╣©ņ░®ļ¼╝ņØś ņāēņ£╝ļĪ£ ļ»ĖļŻ©ņ¢┤ ĻĄ¼ļ”¼ņ╣©ņ░® ņØśņŗ¼ĒĢśņŚÉ ĻĖ░ļ│Ė ĒśłņĢĪĻ▓Ćņé¼ ļ░Å Ēśłņ▓Ł ĻĄ¼ļ”¼ļåŹļÅäĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, Ēśłņ▓Ł ĻĄ¼ļ”¼ļåŹļÅäĻ░Ć 400 ╬╝g/dLļĪ£ ņāüņŖ╣ļÉśņ¢┤ ņ׳ņŚłļŗż(ņĀĢņāü ļ▓öņ£ä 55-150 ╬╝g/dL).
ĻĄ¼ļ”¼ļåŹļÅä ņāüņŖ╣ņŚÉ ļīĆĒĢśņŚ¼ ņ£īņŖ©ļ│æ Ļ░ĆļŖźņä▒ņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ ņåīĒÖöĻĖ░ļé┤Ļ│╝ņŚÉ ņØśļó░ĒĢśņśĆņ£╝ļéś, ATP7B ņ£ĀņĀäņ×ÉĻ▓Ćņé¼ļŖö ņØīņä▒ņØ┤ņŚłņ£╝ļ®░, Ļ░ä ņ┤łņØīĒīīĻ▓Ćņé¼ņāü ņ£īņŖ©ļ│æĻ│╝ ļČĆĒĢ®ĒĢśļŖö ņåīĻ▓¼ļÅä ņŚåņŚłļŗż. ļśÉ, ņĀäĒśĢņĀüņØĖ ņ£īņŖ©ļ│æņŚÉņä£ņØś ņ╣┤ņØ┤ņĀĆ-ĒöīļØ╝ņØ┤ņģö Ļ│Āļ”¼(Kayser-Fleischer ring)ņÖĆļŖö ļŗżļźĖ ņ¢æņāüņ£╝ļĪ£, ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒ ĻĄ¼ļ”¼ņ╣©ņ░® Ļ░üļ¦ēļ│æņ”Ø ņØśņŗ¼ĒĢśņŚÉ ĒśłņĢĪņóģņ¢æļé┤Ļ│╝ ņØśļó░ĒĢśņŚ¼ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. Ēśłņ▓Łļŗ©ļ░▒ņĀäĻĖ░ņśüļÅÖĻ▓Ćņé¼(serum protein electrophoresis) ļ░Å ļ®┤ņŚŁĻ│ĀņĀĢļŗ©ļ░▒ņĀäĻĖ░ņśüļÅÖĻ▓Ćņé¼(serum immunofixation) ņāü ļ╣äņĀĢņāü Ēśłņ▓Ł GĻ░Éļ¦łĻĖĆļĪ£ļČłļ”░ļØĀ ļ░Å ļ╣äņĀĢņāü ņ╣┤Ēīī(╬║)ļØĀĻ░Ć ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, Ļ│©ņłśĻ▓Ćņé¼ņāü Ļ│©ņłś ļé┤ Ēü┤ļĪĀņä▒ĒśĢņ¦łņäĖĒżĻ░Ć 15%ļĪ£ ļŗżļ░£ņä▒Ļ│©ņłśņóģņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłļŗż.
ļö░ļØ╝ņä£ ĒÖśņ×ÉļŖö ņ╣śļŻīļź╝ ņ£äĒĢ┤ ļĀłļéĀļ”¼ļÅäļ¦łņØ┤ļō£(Revlimid)ņÖĆ ļŹ▒ņé¼ļ®öĒāĆņĪ┤ ļ│æņÜ® ĒĢŁņĢöņÜöļ▓ĢņØä ņŗ£ņ×æĒĢśņśĆļŗż. ĒĢŁņĢöņÜöļ▓Ģ ņŗ£ņ×æ Ēøä Ēśłņ▓Ł ņ£Āļ”¼ņ╣┤ĒīīĻ▓ĮņćäļåŹļÅä(free ╬║ light chain)ļŖö 71.68 mg/LņŚÉņä£ 7.07 mg/L (ņĀĢņāüļ▓öņ£ä 3.30-19.40 mg/L)ņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, Ēśłņ▓Ł GĻ░Éļ¦łĻĖĆļĪ£ļČłļ”░ ņłśņ╣ś ļśÉĒĢ£ 1555 mg/dLņŚÉņä£ 688 mg/dL (ņĀĢņāüļ▓öņ£ä 700-1600 mg/dL)ņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż.
ņ╣śļŻī 3Ļ░£ņøöņ¦Ė ĒĢŁņĢö ņ╣śļŻīņŚÉ ĒśłņĢĪļŗ©ļ░▒ņłśņ╣ś ļ░śņØæņØĆ ņ׳ņŚłņ£╝ļéś, Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ņØĆ ņØ┤ņĀäĻ│╝ ļ╣äņŖĘĒĢśņśĆņ£╝ļ®░, ļéśņĢłņŗ£ļĀźņØĆ ņÜ░ņĢł 0.1, ņóīņĢł ņĢłņĀäņłśļÅÖņ£╝ļĪ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłļŗż. ņé░ļÅÖ Ēøä ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼ļĪ£ ļŹ▒ņé¼ļ®öĒāĆņåÉņŚÉ ņØśĒĢ┤ ņÜ░ņĢłņØĆ 2ļŗ©Ļ│ä ĒĢĄ ļ░Å Ēö╝ņ¦łļ░▒ļé┤ņן, ņóīņĢłņØĆ ļ░▒ņāēļ░▒ļé┤ņןņ£╝ļĪ£ Ļ░üĻ░ü ņ¦äĒ¢ēļÉśņŚłņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņ¢æņĢł Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ ņĀĢļÅäĻ░Ć ļ╣äņŖĘĒĢ£ Ļ▓āņŚÉ ļ╣äĒĢśņŚ¼, ņóīņĢł ņŗ£ļĀźņĀĆĒĢśĻ░Ć ņĢģĒÖöļÉ£ ņÜöņØĖņØĆ ļ░▒ļé┤ņןņŚÉ ņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśņ¢┤ ņóīņĢł ļ░▒ļé┤ņןņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłśņłĀ ņĀä ņ┤łņØīĒīīĻ▓Ćņé¼ļĪ£ ļ¦Øļ¦ēņØś ņØ┤ņāü ņåīĻ▓¼ ņŚåņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ņłśņłĀ Ēøä 1ņØ╝ņ¦Ė ņóīņĢł ļéśņĢłņŗ£ļĀźņØĆ 0.6ņ£╝ļĪ£ ņāüņŖ╣ļÉśņŚłļŗż. ņłśņłĀ Ēøä 1ļŗ¼ņ¦Ė Ļ░üļ¦ē ĻĄ¼ļ”¼ņ╣©ņ░®ņØĆ ņØ┤ņĀäĻ│╝ ļ╣äņŖĘĒĢśļéś, ņóīņĢł ĻĄÉņĀĢ ņŗ£ļĀźņØĆ 0.9ļĪ£ ņĖĪņĀĢļÉśņŚłļŗż(+1.5 Dsph= -0.5 Dcyl ├Ś70┬░). ļŗżļ░£ņä▒Ļ│©ņłśņóģņ£╝ļĪ£ ņØĖĒĢ£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņŚÉ ļīĆĒĢ£ ĒĢŁņĢö ņ╣śļŻīļŖö 1ļģä ņĀĢļÅä ņŗ£Ē¢ē Ēøä ņżæņ¦Ć Ļ│ĀļĀż ņżæņØ┤ļ®░, ņÜ░ņĢłļÅä ļ░▒ļé┤ņןņłśņłĀ ņśłņĀĢņØ┤ļŗż.
ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØĆ ņ╣©ņ░®ļ¼╝ņØ┤ ņāØĻĖ░ļŖö ņ£äņ╣śņÖĆ ĒśĢņāüņØ┤ ļŗżņ¢æĒĢśļ®░ ĒؼĻĘĆĒĢśņŚ¼ ļ│┤Ļ│ĀļÉ£ ņé¼ļĪĆĻ░Ć ļ¦Äņ¦Ć ņĢŖļŗż. Ēśäņ×¼Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉ£ ļ░öņŚÉ ļö░ļź┤ļ®┤, ĒīīļØ╝ļŗ©ļ░▒ļōżņØ┤ ļłłļ¼╝ļ¦ēņØä ĒāĆĻ│Ā, Ēś╣ņØĆ ņĀäļ░® ļé┤ņØś ļ░®ņłśļź╝ ĒåĄĒĢ┤ ĒÖĢņé░ļÉśĻ▒░ļéś, ņ£żļČĆņäĖĒż ĻĘ╝ņ▓śņØś ĒśłĻ┤ĆĻČüņØä ļö░ļØ╝ Ļ░üļ¦ēĻ╣īņ¦Ć ļÅäļŗ¼ĒĢ£ļŗżĻ│Ā ņČöņĀĢĒĢśĻ│Ā ņ׳ļŗż.8,9 ņØ┤ļĀćĻ▓ī Ļ░üļ¦ēņŚÉ ļÅäļŗ¼ĒĢ£ ĒīīļØ╝ļŗ©ļ░▒ņØś ņóģļźś ļ░Å ĒŖ╣ņä▒ņŚÉ ļö░ļØ╝ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØä Ļ▓░ņĀĢņä▒ Ļ░üļ¦ēļ│æņ”Ø, Ļ▓░ņĀĢņĀĆņןņä▒ ņĪ░ņ¦üĻĄ¼ņ”Ø, ĻĄ¼ļ”¼ņ╣©ņ░® Ļ░üļ¦ēļ│æņ”Øņ£╝ļĪ£ ļČäļźśĒĢĀ ņłś ņ׳ļŗż.5,6
Ļ▓░ņĀĢņä▒ Ļ░üļ¦ēļ│æņ”ØņØś Ļ▓ĮņÜ░ ļīĆļČĆļČä ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░GņÖĆ ņ╣┤Ēīī Ļ▓ĮņćäĻ░Ć Ļ▓░ņĀĢņØä ņØ┤ļŻ©ņ¢┤ Ļ░üļ¦ēņŚÉ ņ╣©ņ░®ļÉśņ¢┤ ņāØĻĖ░Ļ│Ā, ņ¢æņĖĪņØ┤ ļīĆļČĆļČäņØ┤ņ¦Ćļ¦ī ļŗ©ņĖĪ Ēś╣ņØĆ ļ╣äļīĆņ╣ŁņĀüņ£╝ļĪ£ļÅä ļ░£ņāØĒĢśļ®░, ņ”ØĻ░ĆļÉ£ Ēśłņżæ ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░ņØś ņóģļźśņŚÉ ļö░ļØ╝ ĒÜīļ░▒ņāē, ļģĖļ×Ćņāē, ĒÜīĻ░łņāē ļō▒ ļŗżņ¢æĒĢ£ ņāēĻ╣öņØä ļØłļŗż.6,10 ņ╣©ņ░®ņØĆ Ļ░üļ¦ēņØś ņżæņĢÖ Ēś╣ņØĆ ņŻ╝ļ│ĆļČĆņŚÉ, ĻĖ░ņ¦łļČĆĒä░ ļé┤Ēö╝ņÖĆ ņāüĒö╝Ļ╣īņ¦Ć ņ╣©ļ▓ö Ļ░ĆļŖźĒĢśļ®░, ļŗżņ¢æĒĢ£ ļ¬©ņ¢æņ£╝ļĪ£ ņāØĻĖ░Ļ│Ā, ņØ╝ļČĆļŖö Ļ▓░ļ¦ēĻ│╝ ņä¼ļ¬©ņ▓┤ņÖĆ ļ¦źļØĮļ¦ēĻ╣īņ¦ĆļÅä ņ╣©ļ▓öĒĢ£ļŗż.2,6,10 ņ╣©ņ░®ļÉ£ Ļ░üļ¦ēņØś ņĪ░ņ¦üĻ▓Ćņé¼ Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤ Ļ▓░ņĀĢņØś ļīĆļČĆļČäņØĆ ņäĖĒżļ░¢ĻĖ░ņ¦łņŚÉ ņāØĻĖ░ļéś ņ¢┤ļ¢ż Ļ▓āļōżņØĆ Ļ░üļ¦ēņŗżņ¦łņäĖĒż(keratocyte) ļé┤ļČĆņŚÉļÅä ņĪ┤ņ×¼ĒĢśĻĖ░ļÅä ĒĢśļŖöļŹ░, ļīĆņŗØ ņ×æņÜ®ņØä ĒåĄĒĢ┤ ņØ┤ļÅÖĒĢśņśĆņØä Ļ▓āņØ┤ļØ╝Ļ│Ā ņāØĻ░üļÉśĻ│Ā ņ׳ļŗż.6,8
Ļ▓░ņĀĢņĀĆņןņä▒ ņĪ░ņ¦üĻĄ¼ņ”ØņØś Ļ▓ĮņÜ░ ņ╣┤ĒīīĻ▓ĮņćäĻ░Ć ņ”ØĻ░ĆĒĢ£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņŚÉņä£ ņŻ╝ļĪ£ ļéśĒāĆļéśļ®░, ņĢłņÖĆņØś ņ¦Ćļ░®ņĖĄņØä ņ╣©ļ▓öĒĢśņŚ¼ ļŹ®ņØ┤ļź╝ ņØ┤ļŻ©ļŖö ņ”ØļĪĆļōżņØ┤ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż.6
ĻĄ¼ļ”¼ņ╣©ņ░® Ļ░üļ¦ēļ│æņ”ØņØś Ļ▓ĮņÜ░ ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░GņÖĆ ļ×īļŗżĻ▓Įņćä(╬╗ light chain)Ļ░Ć ņ”ØĻ░ĆĒĢ£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņŚÉņä£ ņŻ╝ļĪ£ ļéśĒāĆļéśļ®░, ļŹ░ņŖżļ®öļ¦ēĻ│╝ ņłśņĀĢņ▓┤ļéŁņŚÉ ĻĄ¼ļ”¼ņ╣©ņ░®ņ£╝ļĪ£ ņØĖĒĢ£ ņāēĻ╣ö ļ│ĆĒÖöĻ░Ć ņāØĻĖ┤ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż.6,11 ĻĄ¼ļ”¼ļŖö Ļ░üļ¦ē ņżæņĢÖņŚÉ ņŻ╝ļĪ£ ņ╣©ņ░®ļÉśļ®░, ņ£īņŖ©ļ│æņØś ņĀäĒśĢņĀüņØĖ ņ”ØņāüņØĖ Ļ░üļ¦ē Ļ░Ćņןņ×Éļ”¼ņØś ņ╣┤ņØ┤ņĀĆ-ĒöīļØ╝ņØ┤ņģö Ļ│Āļ”¼ ļ¬©ņ¢æĻ│╝ļŖö ļŗżļź┤ļŗż.6,11 ņ£īņŖ©ļ│æņŚÉņä£ Ēśłņ▓Ł ņäĖļŻ░ļĪ£ĒöīļØ╝ņŖżļ»╝(ceruloplasmin) ļåŹļÅäĻ░Ć Ļ░ÉņåīĒĢśļŖö ņĀÉĻ│╝ ATP7B ņ£ĀņĀäņ×ÉĻ░Ć ļ░£Ļ▓¼ļÉ£ļŗżļŖö ņĀÉļÅä ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņŚÉņä£ņØś ĻĄ¼ļ”¼ņ╣©ņ░®Ļ│╝ņØś ņ░©ņØ┤ņĀÉņØ┤ļŗż.11 ļŗżļźĖ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØĻ│╝ļŖö ļŗ¼ļ”¼ ņĢäņ¦üĻ╣īņ¦Ć ĻĄ¼ļ”¼ņ╣©ņ░® Ļ░üļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒĢŁņĢö ņ╣śļŻīļĪ£ ņŗ£ļĀź Ļ░£ņäĀ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗżļŖö ļ│┤Ļ│ĀļŖö ņŚåņ£╝ļéś, ļ░▒ļé┤ņןņłśņłĀņØ┤ ņŗ£ļĀź Ļ░£ņäĀņŚÉ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗżļŖö ļ│┤Ļ│ĀļŖö ņ׳ļŗż.6
Ļ░üļ¦ēņØś ņ╣©ņ░®ļ¼╝ņØĆ ĻĘĖ ņøÉņØĖņŚÉ ļö░ļØ╝ ņ╣śļŻīļ▓ĢņØ┤ ļŗżņ¢æĒĢśļéś, ĻČüĻĘ╣ņĀüņ£╝ļĪ£ ņ╣śļŻīļĀłņØ┤ņĀĆĻ░üļ¦ēņĀłņĀ£ņłĀ, ņĀäņĖĄĻ░üļ¦ēņØ┤ņŗØ, ņŗ¼ļČĆĒæ£ņĖĄ Ļ░üļ¦ēņØ┤ņŗØ ļō▒ņØś ņłśņłĀņØä ĒåĄĒĢ┤ ĒĢ┤Ļ▓░ļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ļīĆļČĆļČäņØ┤ļŗż.12 ĒĢśņ¦Ćļ¦ī ņĀäņŗĀ ņ¦łĒÖśņŚÉ ļö░ļźĖ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØĆ ņ╣śļŻīņŚÉ ļīĆĒĢ┤ ļŗżļźĖ ņĀæĻĘ╝ņØ┤ ĒĢäņÜöĒĢśļŗż.
ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø, ĒŖ╣Ē׳ ņØśļ»ĖļČłļ¬ģņØś ļŗ©ņØ╝Ēü┤ļĪĀĻ░Éļ¦łĻĖĆļĪ£ļČłļ”░ļ│æņ”ØņØĆ ņ¦äĒ¢ēĒĢśņŚ¼ ņĀäņŗĀņĀüņØĖ ĒĢ®ļ│æņ”ØņØ┤ ļéśĒāĆļéśņ¦Ć ņĢŖļŖö ĒĢ£ Ļ┤Ćņ░░ĒĢśļŖö Ļ▓āņØ┤ ņØ╝ļ░śņĀüņØ┤ļŗż. ĻĘĖļ¤¼ļéś ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”Ø ĒÖśņ×ÉļōżņŚÉņä£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņŚÉ ļīĆĒĢ£ ņĀäņŗĀ ņ╣śļŻī Ēøä ļŗżļźĖ ņ╣śļŻī ņŚåņØ┤ Ļ░üļ¦ēļ│æņ”ØņØ┤ ĒśĖņĀäļÉ£ ļ│┤Ļ│ĀļōżņØ┤ ņ׳ņ¢┤ Ļ░üļ¦ēļ│æņ”ØņØ┤ ņ¦äļŗ©ļÉśļ®┤ ļé┤Ļ│╝ņŚÉ ĒĢŁņĢö ņ╣śļŻīļź╝ ņØśļó░ĒĢśļŖö Ļ▓āņØ┤ ņÜ░ņäĀņØ┤ļŗż.2,13 ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņØ┤ ņĪ░ņĀłņØ┤ ļÉśņ¦Ć ņĢŖļŖö ņāüĒā£ņŚÉņä£ Ļ░üļ¦ēņØ┤ņŗØņØä ļ░øņØĆ Ļ▓ĮņÜ░ Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ņØ┤ ņ×¼ļ░£ĒĢ£ ņ”ØļĪĆļōżļĪ£ ļ»ĖļŻ©ņ¢┤ ļ│┤ņĢä ļé┤Ļ│╝ņĀü ņ╣śļŻīĻ░Ć ņĢłĻ│╝ņĀü ņ╣śļŻīņŚÉ ņäĀĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż.10,14,15 ĒĢśņ¦Ćļ¦ī ĒĢŁņĢö ņ╣śļŻīļź╝ ĒåĄĒĢ┤ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņØ┤ ņĪ░ņĀłņØ┤ ļÉśļŖö ņāüĒā£ņŚÉņä£ļÅä Ļ░üļ¦ēņØ┤ņŗØ Ēøä ņ╣©ņ░®ļ¼╝ņØ┤ ņ×¼ļ░£ĒĢ£ ņ”ØļĪĆĻ░Ć ņ׳ņ£╝ļ®░, ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņØ┤ ņĪ░ņĀłņØ┤ ļÉśļŖö ņāüĒā£ņŚÉņä£ Ļ░üļ¦ēņØ┤ņŗØ ņŚåņØ┤ Ļ░üļ¦ēļ│æņ”Ø ĒśĖņĀäņØ┤ ņ׳ņŚłņØīņŚÉļÅä ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņØś ņ×¼ļ░£Ļ│╝ļŖö ļ¼┤Ļ┤ĆĒĢśĻ▓ī Ļ░üļ¦ēļ│æņ”ØņØ┤ ņ×¼ļ░£ĒĢ£ ņ”ØļĪĆļÅä ņ׳ņ¢┤ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņØś ņ╣śļŻīĻ░Ć ņÖäņĀäĒĢ£ Ļ░üļ¦ēļ▓Įņ”ØņØś ņ╣śļŻīņØĖ Ļ▓āņØĆ ņĢäļŗłļŗż.7,15
ļ│Ė ņ”ØļĪĆ2ņŚÉņä£ļŖö ĒĢŁņĢö ņ╣śļŻī Ēøä ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”ØņØ┤ ņĪ░ņĀłļÉ©ņŚÉļÅä Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ņØĆ ņØ┤ņĀäĻ│╝ ļ╣äņŖĘĒĢśņśĆņ£╝ļ®░, ņśżĒ׳ļĀż ņŗ£ļĀźņĀĆĒĢś ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ņØ┤ Ļ▓ĮņÜ░ Ļ░üļ¦ēļ│æņ”ØņØś ņ¦äĒ¢ēņ£╝ļĪ£ ņØĖĒĢ£ ņŗ£ļĀźņĀĆĒĢś Ļ░ĆļŖźņä▒ļÅä ņ׳ņ£╝ļéś, ļ░▒ļé┤ņן ļō▒ ļŗżļźĖ ņŗ£ļĀźņĀĆĒĢś ņÜöņØĖņØ┤ ņ׳ņØä ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ņŚÉ ļīĆĒĢ£ ņøÉņØĖ ĒīīņĢģņØ┤ ĒĢäņÜöĒĢśļŗż. ļ│Ė ņ”ØļĪĆļŖö ļ░▒ņāēļ░▒ļé┤ņןņ£╝ļĪ£ ņØĖĒĢ£ ņŗ£ļĀźņĀĆĒĢśņśĆņØīņØä ļ░▒ļé┤ņןņłśņłĀ ĒøäņØś ņŗ£ļĀź ĒÜīļ│ĄņØä ĒåĄĒĢ┤ ņ×äņāüņĀüņ£╝ļĪ£ ņĢī ņłś ņ׳ņŚłļŗż. ĒĢŁņĢö ņ╣śļŻīļĪ£ ņØĖĒĢ┤ Ļ░üļ¦ēņ╣©ņ░®ņØ┤ ļŹö ņØ┤ņāü ņ¦äĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŹś Ļ▓āļÅä ņŗ£ļĀź ĒÜīļ│ĄņŚÉ ļÅäņøĆņØ┤ ļÉśņŚłļŗżĻ│Ā ĒĢĀ ņłś ņ׳Ļ▓Āļŗż.
ļö░ļØ╝ņä£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”ØņØ┤ ņ¦äļŗ©ļÉ£ ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Ø ĒÖśņ×ÉļōżņØĆ ņŗ¼Ļ░üĒĢ£ ņŗ£ļĀźņØś ņåÉņāüņØ┤ ļéśĒāĆļéśĻĖ░ ņĀäņŚÉ ņĀäņŗĀņĀüņØĖ ĒĢ®ļ│æņ”ØņØ┤ ņŚåļŹöļØ╝ļÅä Ļ░üļ¦ēņØś ņ╣©ņ░® ņĀĢļÅäĻ░Ć ņ¦äĒ¢ēĒĢ£ļŗżļ®┤ ĒĢŁņĢö ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢśĻ▓Āļŗż.6 ļśÉĒĢ£ ļé┤Ļ│╝ņĀü ņ╣śļŻīņŚÉļÅä ļ░śņØæņØ┤ ņŚåļŖö ĒīīļØ╝ļŗ©ļ░▒Ēśłņ”Øņä▒Ļ░üļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņČöĻ░ĆņĀüņØĖ ņĢłĻ│╝ņĀü ļ¼ĖņĀ£ļź╝ ņל ĒīīņĢģĒĢśņŚ¼ņĢ╝ ĒĢśļ®░, ņ¢┤ļŖÉ ņŗ£ņĀÉņŚÉ Ļ░üļ¦ēņØ┤ņŗØņØä ņ¦äĒ¢ēĒĢ┤ņĢ╝ ĒĢśļŖöņ¦Ć ņŚ¼ļ¤¼ ņ”ØļĪĆļōżņØä ĒåĄĒĢśņŚ¼ ņ╣śļŻī ļ░®ļ▓ĢņŚÉ ļīĆĒĢ£ Ļ░ĆņØ┤ļō£ ļØ╝ņØĖņØ┤ ĒÖĢļ│┤ļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż. ņØ╝ļČĆ ļ│┤ņŖżĒä┤ņØĖĻ│ĄĻ░üļ¦ēņØä ĒÖ£ņÜ®ĒĢ£ ņłśņłĀ ņśłņŚÉņä£ ņĀäņŗĀ ņ╣śļŻī ņŚåņØ┤ Ļ░üļ¦ēļ│æņ”ØņØś ņ×¼ļ░£ņØ┤ ņŚåņŚłļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ņ¢┤ Ļ░üļ¦ēņØ┤ņŗØ ļ░®ļ▓ĢņŚÉ ļīĆĒĢ£ Ļ│Āļ»╝ļÅä ņČöĻ░ĆņĀüņ£╝ļĪ£ ĒĢäņÜöĒĢ┤ ļ│┤ņØĖļŗż.10,14
Figure┬Ā1.
Case 1 slit-lamp anterior segment photographs. (A) Direct illumination: white deposits at the left eye. (B) Indirect retro-illumination: crystalline deposits at the left eye. (C, D) Cross-sectional slit lamp photograph: white deposits at the anterior cornea of both eyes. Arrows pointing crystalline deposits.
Figure┬Ā2.
Specular microscopy of case 1. Specular microscopy of normal corneal endothelial cell density and abnormal endothelial deposits. Arrow pointing endothelial deposits.
Figure┬Ā3.
Case 2 slit-lamp anterior segment photographs. (A, B) Cross-sectional slit lamp photographs before cataract surgery: brown deposits at the corneal endothelium, stroma, and anterior lens capsule of both eyes. (C, D) Cross-sectional slit lamp photographs after left cataract surgery: brown deposits still observed at the corneal endothelium and stroma.
REFERENCES
1) Karani R, Sherman S, Trief D. A case of infectious crystalline keratopathy after corneal cross-linking. Am J Ophthalmol Case Rep 2021;23:101139.



2) Lisch W, Wasielica-Poslednik J, Kivel├ż T, et al. The hematologic definition of monoclonal gammopathy of undetermined significance in relation to paraproteinemic keratopathy (an American ophthalmological society thesis). Trans Am Ophthalmol Soc 2016;114:T7.


3) Girard LP, Soekojo CY, Ooi M, et al. Immunoglobulin M paraproteinaemias. Cancers (Basel) 2020;12:1688.



4) Kyle RA, Therneau TM, Rajkumar SV, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med 2002;346:564-9.


5) Moshirfar M, West W, Ronquillo Y. Paraproteinemic Keratopathy. In: StatPearls [Internet] Treasure Island (FL): StatPearls Publishing [cited 2022 Jul 25]. Available from https://www.ncbi.nlm.nih.gov/books/NBK560482/.
6) Balderman SR, Lichtman MA. Unusual manifestations of monoclonal gammopathy: I. Ocular disease. Rambam Maimonides Med J 2015;6:e0026.



7) Wang TP, Safran SG, Richter JR, et al. Subepithelial corneal immunoglobulin deposition as a manifestation of multiple myeloma: a case report and literature review. Clin Lymphoma Myeloma Leuk 2014;14:e39-42.


8) Steinberg J, Eddy MT, Katz T, et al. Bilateral crystalline corneal deposits as first clinical manifestation of monoclonal gammopathy: a case report. Case Rep Ophthalmol 2011;2:222-7.



9) Karakus S, Gottsch JD, Caturegli P, Eghrari AO. Monoclonal gammopathy of "ocular" significance. Am J Ophthalmol Case Rep 2019;15:100471.



10) Milman T, Kao AA, Chu D, et al. Paraproteinemic keratopathy: the expanding diversity of clinical and pathologic manifestations. Ophthalmology 2015;122:1748-56.


11) Shah S, Espana EM, Margo CE. Ocular manifestations of monoclonal copper-binding immunoglobulin. Surv Ophthalmol 2014;59:115-23.


12) Gupta PK, Kharod BV, Afshari NA. Crystalline Keratopathy: Spectrum of Disease, Diagnosis and Treatment [Internet]. San Francisco, CA: EyeNet Magazine; 2008 Jan [cited 2022 Aug 10]. Available from: https://www.aao.org/eyenet/article/crystallinekeratopathy-spectrum-of-disease-diagno.
13) Duquesne A, Werbrouck A, Fabiani B, et al. Complete remission of monoclonal gammopathy with ocular and periorbital crystal storing histiocytosis and Fanconi syndrome. Hum Pathol 2013;44:927-33.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 850 View
- 40 Download
- Related articles
-
A Case of Cataract Surgery in an Epikeratophakia Patient.2016 February;57(2)
A Case of Meningioma Masquerading as Ischemic Optic Neuropathy.2016 November;57(11)
Two Cases of Strabismus Surgery in Myotonic Dystrophy.2017 April;58(4)
A Case of Cataract Surgery after Radial Keratotomy.2014 July;55(7)
A Two Case of 360 Degree Keratolimbal Allograft.2015 March;56(3)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



