영구 양막이식술 이후 양막의 장기간 임상 경과
Long-term Clinical Course of Amniotic Membrane after Permanent Amniotic Membrane Transplantation
Article information
Abstract
목적
각막에 영구 양막이식술을 시행받은 환자에서 이식된 양막의 장기적인 임상 경과를 알아보고자 하였다.
대상과 방법
2014년 4월부터 2021년 3월까지 영구 양막이식술을 시행받은 환자 68명 72안의 의무기록과 외안부 디지털 사진을 후향적으로 분석하였다. 수술 후 각막의 완전한 재상피화까지의 기간 및 치료콘택트렌즈 착용 기간을 조사하였고, 수술 후 최대 6년까지의 경과 관찰 기간 동안 매년 융해된 부분을 제외한 보존된 양막의 크기를 Image J 프로그램을 이용하여 분석하였으며, 이를 단층 이식군과 복층 이식군으로 나누어 비교하였다. 또한 양막의 융해가 발생한 경우, 융해가 일어난 원인, 시점 및 관련 요인을 분석하였다.
결과
수술 후 완전한 재상피화까지 걸리는 기간은 평균 12.2 ± 11.0일이었고, 치료콘택트렌즈를 수술 후 평균 8.7 ± 8.5개월까지 착용하였다. 전체 환자군에서 수술 후 6년째까지 매년 보존된 양막의 비율은 각각 94.9%, 94.3%, 97.8%, 96.4%, 95.8%, 91.6%였고, 각 경과 관찰 시점에서 단층 이식군과 복층 이식군의 유의한 차이는 없었다. 전체 환자군의 38.9% (28안)의 환자에서 양막의 융해가 나타났으며, 수술 후 평균 16.4 ± 17.2개월째 융해가 처음 관찰되었다. 융해의 원인으로는 수포의 형성 및 파열이 71.4% (20안)로 가장 많았으며, 통계학적으로 유의하게 수포 형성에 관여하는 인자는 없었다.
결론
각막의 다양한 질환에서 시행되는 영구 양막이식술의 경우 이식된 양막은 일부 융해되지만 수술 후 6년까지는 대부분 보존되어 안정적인 안구표면을 형성하는 것으로 사료된다.
Trans Abstract
Purpose
To investigate the long-term clinical outcomes of transplanted amniotic membrane in patients who underwent permanent amniotic membrane transplantation (P-AMT) on cornea.
Methods
From April 2014 to March 2021, medical records and digital photographs of 68 patients (72 eyes) who underwent P-AMT were analyzed retrospectively. The duration of complete re-epithelization of cornea and wearing therapeutic contact lense (T-lens) after surgery were investigated, the size of preserved amniotic membrane (AM) excluding the melted portion was analyzed using the Image J program every year up to 6 years after surgery, and it was compared by dividing into a single-layer group and a double-layer group. In addition, when the AM melts, the cause, time, and related factors of melting were analyzed.
Results
The average duration to complete re-epithelialization after surgery was 12.2 ± 11.0 days, and T-lens were worn on average up to 8.7 ± 8.5 months after surgery. In total group, the average ratio of preserved AM annually up to 6 years after surgery was 94.9%, 94.3%, 97.8%, 96.4%, 95.8%, 91.6% respectively, and there was no significant difference between the single-layer group and the double-layer group. AM melting appeared in 38.9% (28 eyes) of the total group, and melting was first observed on average 16.4 ± 17.2 months after surgery. The formation and rupture of bullae was the most common cause of melting at 71.4% (20 eyes), and there were no statistically significant related factors involved in the formation of bullae.
Conclusions
In the case of P-AMT performed in various diseases of the cornea, the transplanted AM is partially melt but considered to be well preserved up to 6 years after surgery to form a stable ocular surface.
양막은 태아막 중 가장 안쪽의 막으로 두꺼운 기저막이 존재하고, 조직적합성 항원이 표시되지 않아 이식을 하여도 거부반응이 없다.1 안과 질환에서 양막이식술은 de Rotth2가 1940년에 처음으로 그 효과를 보고하였으나 한동안 각광을 받지 못했고, Kim and Tseng3이 1995년에 토끼 모델에서 양막을 사용하여 안구표면을 성공적으로 재건함을 보고한 이후 양막은 여러 가지 안과 질환에서 임상적으로 활발히 적용되고 있다.
안구에 이식된 양막은 하나의 기저막으로 작용하여 장벽 역할을 할 뿐 아니라, 상피세포의 이동과 성장, 분화를 촉진하고 각종 성장인자 및 단백질분해효소를 함유하여 염증, 신생혈관 및 반흔 형성을 억제하는 것으로 알려져 있다.4 이러한 특성을 바탕으로 양막이식술은 결막결손5, 공막연화증6 등의 결막 질환, 지속적인 각막상피결손7, 각막윤부세포결핍8, 각막천공9, 수포성 각막병증10 등의 각막 질환뿐 아니라 화학적 및 열성 안구손상11,12 등 여러 안과 질환에서 성공적인 임상 결과가 보고되었으며, 현재도 활발히 연구되어지고 있다. 특히 각막 질환 중 회복되지 않는 상피결손, 화학 물질에 의한 각막손상, 쇼그렌증후군 등의 질환에서 양막은 상피결손 회복을 위한 패치로서 일시적으로 이식 후 결손이 회복되면 제거를 하게 되고, 각막궤양과 같이 각막기질의 결손을 동반한 질환 및 수포성 각막병증 등의 질환에서 양막은 기질의 결손을 보강함과 동시에 각막상피세포의 기저막을 공급해주는 이식편으로서 영구적으로 이식을 하기도 한다.13,14
이식편으로서 각막에 영구적으로 이식된 양막은 장기적으로 안정적인 안구표면을 유지함이 그 목적이나, 오랜 시간이 경과하면서 발생하는 양막의 변화 등 장기적인 임상 경과에 대해서는 전세계적으로 보고된 바가 많지 않으며 국내에서는 보고된 바가 없다. 따라서 본 연구에서는 각막에 영구 양막이식술을 시행받은 환자에서 수술 후 6년째까지 이식된 양막의 융해 여부 및 정도, 원인 및 관련 인자를 파악하고, 단층 혹은 복층 양막이식에 따라 차이가 있는지를 알아보고자 하였다.
대상과 방법
본 연구는 2014년 4월부터 2021년 3월까지 동아대학교 병원 안과에서 지속적인 약물 치료와 보존적 치료에도 각막손상 및 증상이 호전되지 않는 각막표면 질환이 존재하거나, 미용 목적으로 염색된 양막의 이식을 원하는 환자들을 대상으로 각막 전체에 영구 양막이식술을 시행하였고, 1년 이상 추적 관찰이 가능했던 68명 72안의 의무기록과 외안부 디지털 사진을 후향적으로 조사하였다. 모든 환자는 각막이식술을 시행받더라도 시력 예후가 불량할 것으로 판단되거나 개인적인 사정으로 각막이식술을 시행받지 못하는 경우였으며, 각막천공 혹은 궤양으로 인하여 국소적인 영구 양막이식술을 시행한 경우는 대상에서 제외하였다. 본 연구는 헬싱키 선언에 입각한 동아의학연구윤리심의위원회의 승인 아래 진행되었다(승인번호 22-103).
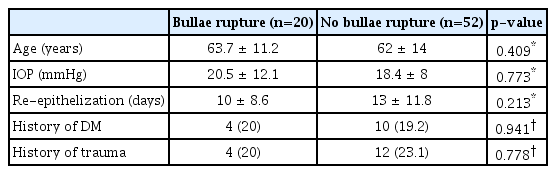
수술은 한 술자(W.C.P.)에 의해 진행되었고 수술 과정은 다음과 같다. Proparacaine (Alcaine®, Alcon laboratories, Fort Worth, TX, USA) 점안액을 5분 간격으로 3회 투여한 후 개검기를 삽입하였다. 15번 blade와 25% 알코올을 이용하여 각막윤부 안쪽의 상피세포와 양막(MS Amnion, MSBIO, Inc., Sungnam, Korea)의 상피세포를 제거한 후 양막을 각막의 상피결손 크기보다 작은 크기로 재단하였다. 상피층이 제거된 부분이 위로 향하도록 양막을 각막에 위치시킨 후 10-0 nylon으로 주머니 끈 봉합을 시행하고, 봉합 매듭은 각막기질 안으로 묻었다(Fig. 1). 이때 각막의 상피결손 범위보다 넓게 불필요한 양막이 있다면 forceps와 Vannas scissors로 제거하였다. 점탄물질 도포 후 치료콘택트렌즈를 삽입하고 수술을 마쳤으며, 빠른 재상피화를 위해 수술 후 5-7일 동안 압박 안대를 시행하였다. 압박 안대는 dexamethasone 1 mg, neomycin sulfate 3.5 mg (3500 IU), polymyxin B sulfate 6000 IU/g의 혼합 제제 안연고(Forus®, Samil Pharm. Co., Seoul, Korea)와 sodium hyaluronate 14 mg/mL (HEALON GV®, AMO, Santa Ana, CA, USA)를 점안 후 시행하였다. 각막이 완전히 재상피화되어 상피결손이 모두 호전된 후 0.5% levofloxacin (Cravit®, Santen Pharmaceutical Co., Ltd., Osaka, Japan) 하루 4회, 1% methylprednisolone 하루 1회, 일회용 인공누액(New hyaluni®, Taejoon, Yongsan, Korea)은 수시로 사용하도록 하였다.
Operation procedure. (A) Remove corneal epithelium inside the limbus using a blade. (B) Remove the epithelium of amniotic membrane (AM) using 25% alcohol and blade. (C) The AM from which epithelial cells have been removed is cut to a size smaller than the size of the epithelial defect in the cornea. (D) After implanting the AM with the basement membrane facing up, purse-string suture is performed with 10-0 nylon, and the knot is buried into the stroma of cornea.
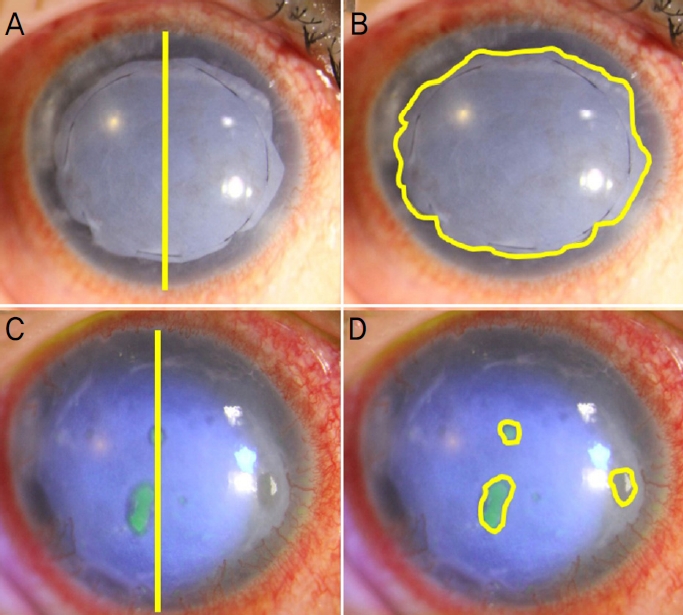
환자의 과거 병력 및 외상력, 경과 관찰 기간, 각막의 완전한 재상피화 기간 및 치료콘택트렌즈 착용 기간을 조사하였다. 재상피화 기간은 수술 이후부터 각막의 상피결손이 완전히 회복되기까지의 기간으로 정의하였으며, 치료콘택트렌즈는 이식된 양막의 안정적인 생착을 위하여 수술 후 6개월 이상 착용하도록 하였다. 하지만 환자의 치료 협조가 떨어지거나 치료용 렌즈로 인한 합병증 발생 위험이 높다고 판단될 경우 6개월보다 일찍 치료용 렌즈 착용을 중단하였고, 6개월 이후 치료용 렌즈를 제거하였는데 환자가 증상을 호소할 경우 치료용 렌즈를 더욱 오래 유지하였다. 수술 전과 수술 후 최대 6년까지 매년 나안시력을 측정하고, 비접촉성 안압계를 이용한 안압검사, 세극등현미경검사를 시행하였다. 세극등현미경검사에서 불투명한 양막이 확인되거나, 시간이 지나 양막이 일부 다소 투명해지더라도 상피결손 없이 각막표면이 연속적으로 매끄럽게 관찰된다면 양막의 융해가 없다고 판단하였고, 양막이식 및 완전한 재상피화 이후 훌루오레신 염색이 되는 각막의 결손 부위가 있거나 염색은 되지 않더라도 국소적으로 양막의 융해가 의심되는 부위가 주변의 보존된 불투명한 양막과 육안적으로 뚜렷이 구별되는 경우 양막이 융해 되었다고 판단하였다(Fig. 2). 각 경과 관찰 시기마다 보존된 양막의 크기를 측정하였고, 이를 단층 양막이식술군과 복층 양막이식술군으로 나누어 유의한 차이가 있는지 비교하였다. 술자의 판단에 따라 각막표면 질환의 정도가 심하여, 단층 영구 양막이식술 시행 후 양막의 융해 혹은 탈락의 위험이 높다고 판단될 경우, 이전 단층 영구 양막이식술 후 양막이 융해되어 병변이 재발한 경우 복층 영구 양막이식술을 시행하였다. 양막의 융해가 발생한 경우, 융해가 일어난 시점과 원인을 조사하였고, 환자의 나이, 융해를 확인한 시점의 안압, 재상피화 기간, 당뇨 병력 및 외상력이 양막의 융해와 통계적으로 연관이 있는지 분석하였다.
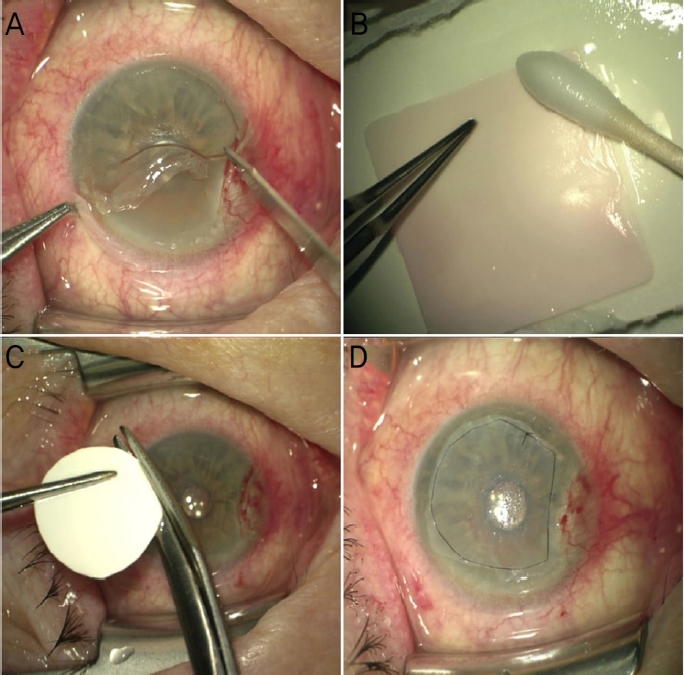
Amniotic membrane (AM) size measurement. (A) 1 day after surgery, when the AM was completely intact, a straight line passing through the center of the cornea and connecting the corneal boundary in the 12 o'clock and 6 o'clock directions is drawn, and the length of this straight line is assumed to be 100. (B) Then, the border of the AM was marked and the size inside the border was measured. (C) 1 year after surgery, the scale was set in the same manner. (D) There are fluoroscene-dyed three focal lesions, which are suspected of AM melting. The border of the melted portion was marked and the size inside the border was measured.
양막의 크기는 Image J 프로그램(National Institute of Health, Bethesda, MD, USA)의 단순크기 측정 방법을 통해 측정하였다. 수술 후 1일째 촬영한 세극등현미경 디지털 사진에서, 각막의 중심부를 통과하며 12시와 6시 방향의 각막 경계를 잇는 직선의 길이를 100으로 가정하였으며, 양막의 테두리를 이은 다음 테두리 안쪽의 면적을 측정하여 온전한 양막의 크기를 구하였다. 각 경과 관찰 시기의 세극등현미경 디지털 사진에서 동일한 방법으로 척도를 설정하고 양막이 융해된 부분의 테두리를 이어 테두리 안쪽의 면적을 측정한 후 융해된 양막의 면적을 구하였고, 이를 바탕으로 전체 양막에서 융해된 양막의 비율과 보존된 양막의 비율을 계산하였다(Fig. 3).
Determination of amniotic membrane (AM) melting through slit-lamp microscopic examination. We decided that there was no melting (A) if opaque AM with clear boundaries was observed or (B) the corneal surface was observed continuously smooth without epithelial defect although some of AM became transparent. Conversely, we decided that there was melting (C) if corneal epithelial defects due to various causes were observed or (D) the corneal surface was not observed continuously smooth and suspected melting area was clearly distinct from surrounding preserved AM.
통계적 분석은 SPSS WIN 18.0 (SPSS Inc., Chicago, IL, USA)를 사용하였다. 단층 양막이식술군과 복층 양막이식술군의 남은 양막 크기의 비교는 Mann-Whitney U test를 이용하였으며, 수포 형성 및 파열에 관여하는 요인 분석에는 Mann-Whitney U test 및 Pearson’s chi-square test를 이용하였고, p-value가 0.05보다 작은 경우 통계적으로 유의하다고 판단하였다.
결 과
본 연구에 포함된 환자는 68명 72안이었으며 43안은 남자, 29안은 여자였다. 평균 나이는 62.5 ± 13.2세였고 평균 경과 관찰 기간은 38.5 ± 21.6개월이었다. 각막에 영구 양막이식술을 받게 된 원인 질환으로는 수포성 각막병증이 58안(80.6%)으로 가장 많은 비중을 차지하였다. 수술 후 각막의 완전한 재상피화까지 걸린 기간은 평균 12.2 ± 11.0일이고, 수술 후 치료콘택트렌즈의 착용 기간은 평균 8.7 ± 8.5개월이었다. 단층 영구 양막이식술을 시행받은 환자가 57안(79.2%), 복층 영구 양막이식술을 시행받은 환자가 15안(20.8%)이었으며, 두 군의 성별, 나이, 경과 관찰 기간, 재상피화 기간, 치료콘택트렌즈 착용 기간에는 유의한 차이가 없었다(Table 1).
전체 환자 군에서 수술 후 1년째까지 경과 관찰을 한 72안의 남은 양막의 비율은 평균 94.9%, 2년째 53안은 94.3%, 3년째 36안은 97.8%, 4년째 28안은 96.4%, 5년째 20안은 95.8%, 6년째 9안은 91.6%로 측정되었다. 모든 경과 관찰 시기에서 보존된 양막은 전체 크기의 90% 이상 유지되었고 안정적인 안구표면을 형성하였다(Fig. 4).

The average ratio of preserved amniotic membrane (AM) in total group at each follow-up periods. 72 eyes observed for one year after surgery were measured 94.9 ± 14.5%, 53 eyes observed for two years after surgery were measured 94.3 ± 11.6%, 36 eyes observed for 3 years after surgery were measured 97.8 ± 5.9%, 28 eyes observed for 4 years after surgery were measured 96.4 ± 7.0%, 20 eyes observed for 5 years after surgery were measured 95.8 ± 7.2%, 9 eyes observed for 6 years after surgery were measured 91.6 ± 12.6%.
단층 영구 양막이식술을 시행받은 환자는 57안(79.2%)으로, 남은 양막의 크기는 평균적으로 수술 후 1년째 57안은 94.5%, 2년째 42안은 94.2%, 3년째 29안은 97.3%, 4년째 23안은 95.6%, 5년째 16안은 95.9%, 6년째 7안은 94.1%로 측정되었다. 복층 영구 양막이식술을 시행받은 환자는 15안(20.8%)으로, 남은 양막의 크기는 평균적으로 수술 후 1년째 15안은 96.4%, 2년째 11안은 94.5%, 3년째 7안은 100%, 4년째 5안은 100%, 5년째 4안은 95.3%, 6년째 2안은 82.9%로 측정되었다. 평균적으로 남은 양막의 비율은 수술 후 4년째까지 복층으로 수술을 시행한 군에서 더 높게 측정되었으나 모든 경과 관찰 시기에서 통계적으로 유의한 차이는 없었다(p=0.765, 0.908, 0.124, 0.104, 0.709, 0.646; Mann-Whitney U-test) (Fig. 5).
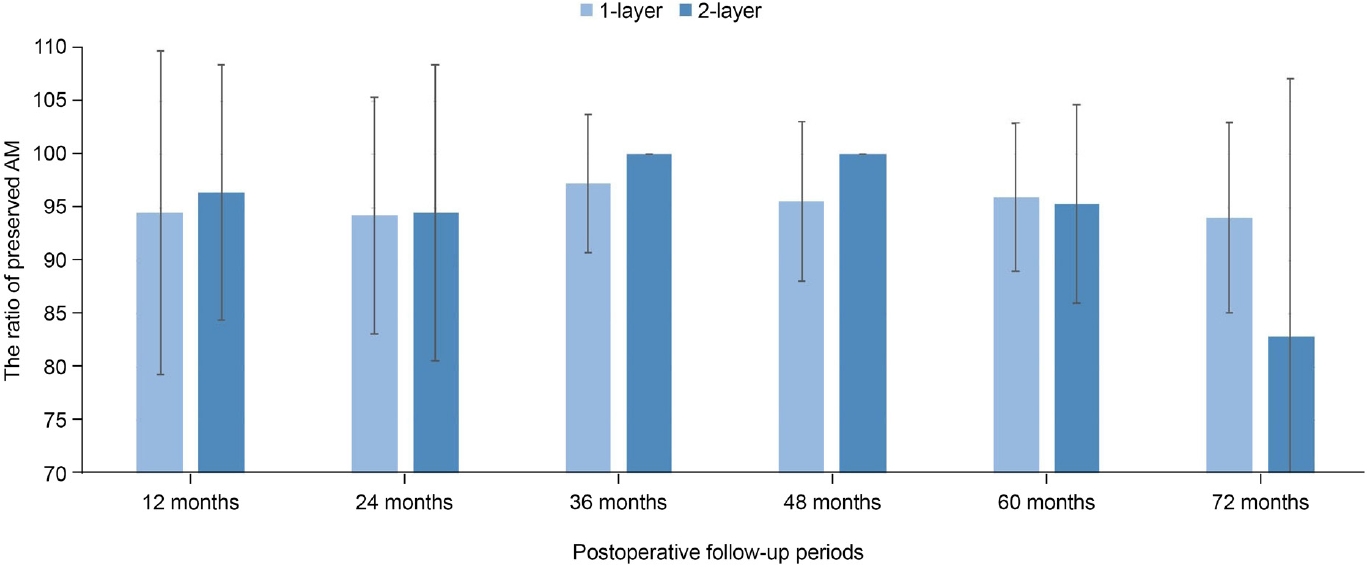
The average ratio of preserved amniotic membrane (AM) between 1-layer group and 2-layer group. In 1-layer group, the average ratio at each follow up periods was 94.5 ± 15.2% (57 eyes), 94.2 ± 11.1% (42 eyes), 97.3 ± 6.5% (29 eyes), 95.6 ± 7.5% (23 eyes), 95.9 ± 6.9% (16 eyes), 94.1 ± 8.9% (7 eyes), respectively. In 2-layer group, the average ratio at each follow up periods was 96.4 ± 12.0% (15 eyes), 94.5 ± 13.9% (11 eyes), 100% (7 eyes), 100% (5 eyes), 95.3 ± 9.3% (4 eyes), 82.9 ± 24.2%(2 eyes), respectively. There was no significant difference in the average ration of preserved AM between two groups at all follow-up periods (p=0.765, 0.908, 0.124, 0.104, 0.709, 0.646; Mann-Whitney U-test).
전체 72안 중에서 양막의 융해가 나타난 환자는 28안(38.9%)이었으며, 나머지 44안(61.1%)은 마지막 경과 관찰 시기까지 융해 없이 양막이 100%로 모두 보존되었다. 처음 양막의 융해가 관찰되는 시기는 평균적으로 수술 후 16.4 ± 17.2개월이었으며, 융해의 원인으로는 각막상피수포의 형성 및 파열이 20안(71.4%)으로 가장 많았고 그 외 각막칼슘 침착이 2안(2.8%), 각막궤양이 1안(1.4%), 원인을 알 수 없는 경우가 5안(17.9%)이었다(Table 2). 각막상피수포의 형성 및 파열에 관여하는 요인을 확인하기 위해 수포가 파열되어 양막이 융해된 환자군(20안)과 그렇지 않은 환자군(52안)을 대상으로 나이, 안압, 각막의 재상피화까지의 기간, 당뇨 유무, 외상력 유무를 비교하였으나 통계적으로 유의한 차이를 나타내는 요인은 없었다(Table 3).
고 찰
양막은 여러 가지 각막 질환에서 일시적인 패치로 사용될 수 있고, 영구적인 이식편으로도 사용될 수 있다. 지속성 각막상피결손과 같이 각막의 상피결손만 존재하거나 얕은 기질의 결손이 있는 경우, 상피결손 부위를 충분히 덮어줄 수 있도록 양막을 크게 재단한 후, 윤부 위치에서 양막을 각막에 복주머니 봉합을 통해 고정한다. 상피세포의 이동과 증식, 분화를 촉진하고 기저 상피세포의 부착을 용이하게 하는 양막의 특성을 통해 상피세포는 양막 아래로 자라 들어와 상피결손 부위를 호전 시키며 결손이 호전되었다면 양막을 제거하게 된다. 각막궤양 등 기질까지 결손이 유발된 경우는 양막을 영구적으로 이식할 수 있는데, 기질이 결손된 정도에 따라 단층 혹은 다층으로 이식할 수 있으며 이식된 양막은 안정적인 안구표면을 형성할 뿐 아니라 각종 성장인자 및 단백질 분해 효소를 함유하고 있어 염증 및 반흔 형성을 억제한다. 양막을 이식편으로 사용할 경우, 병변의 크기보다 양막을 작게 재단하고 이식하여 각막의 상피가 이식편 위로 자라 들어오도록 하는데, 이때 병변 주변부 상피 혹은 판누스를 제거하여 이식편 아래 상피가 존재하지 않도록 주의해야 한다. 내피세포부전과 심한 기질 침윤을 동반한 수포성 각막병증 혹은 헤르페스 각막포도막염 등과 같은 질환에서 위의 두 가지 양막이식 방법을 동시에 시행하는 경우도 존재한다.13,14
양막을 상피가 결손된 창상부에 이식을 하게 되면 주변의 정상적인 각막상피세포가 자라 들어온다. 완전한 재상피화까지 시간이 오래 걸린다면 2차 감염 혹은 각막의 흉터 및 혼탁의 발생 위험성이 증가하게 되어 수술 예후에 나쁜 영향을 끼치게 된다. 본 연구에서 영구 양막이식술 시행 이후 각막의 완전한 재상피화까지 평균 12일이 소요되었는데, 이는 Park et al15의 연구에서 완전한 재상피화까지 평균 25일이 걸린 것에 비하여 절반 이하의 시간으로 단축되었음을 확인할 수 있다. Grueterich et al4의 연구에서 상피를 인위적으로 제거하여 기질과 기저막만 존재하는 양막을 이식하는 것이 상피재생속도가 빠르다고 보고하였고, Jin16의 연구에서도 25% 알코올과 0.05% trypsin을 이용하여 상피를 제거한 양막이 상피가 존재하는 양막에 비하여 재상피화 속도가 빠른 것을 조직학적으로 확인하였다. 본 연구에서는 25% 알코올과 15번 blade를 이용하여 양막상피를 제거하였고, 수술 이후에도 치료콘택트렌즈뿐만 아니라 매일 압박 안대를 시행하였다. 압박 안대는 눈을 비비는 행동 등 외적 요인에 의한 손상을 방지할 수 있으며 외부 환경에 직접적으로 노출되는 것을 막을 수 있는 장점이 있다. 기저막을 공급해주는 양막이식 외에도 양막의 상피를 제거하는 방법, 수술 후 초기의 적극적인 치료 등 여러 가지 요인에 의해서 빠른 재상피화를 유도할 수 있고, 이는 수술 후 경과에 도움이 될 것으로 생각한다.
수술 후 안정적인 각막표면이 형성되기 전까지 치료콘택트렌즈를 착용하는데, Seitz et al17의 연구에서는 4주 가량, Gregory et al18의 연구에서는 5주에서 8주가량 치료콘택트렌즈를 착용한 것에 비해 본 연구에서는 수술 후 평균 8.7개월까지 오랜 기간 동안 착용하였다. 조직 병리학적으로 양막이식술 시행 이후 이식된 양막이 각막의 상피 및 기질 내에 완전히 통합되기까지 평균 79주가 걸린다는 연구 결과가 존재한다.19 따라서 양막이식술 이후 수개월 이상 치료콘택트렌즈를 착용하는 것이 이식된 양막의 안정적인 생착에 기여함과 동시에 눈 깜빡임 등 안검에 의한 각막 자극 및 손상으로부터 양막과 각막상피세포를 보호하는 효과가 있다고 사료된다. 하지만 치료콘택트렌즈를 장기적으로 사용할 경우, 감염성 각막염 혹은 윤부신생혈관 등의 합병증이 발생할 가능성이 있기 때문에, 정기적인 렌즈의 교체 및 경과 관찰을 환자에게 적절히 교육해야 한다.20
전체 환자군을 대상으로 한 본 연구에서 수술 후 1년째부터 6년째까지 모든 경과 관찰 시기에서 보존된 양막은 전체 크기의 90% 이상 유지되었다. Siu et al21의 연구에서도 수술 후 평균 61개월까지, Gregory et al18의 연구에서도 수술 후 평균 67주, 최대 139주까지 이식된 양막이 각막상피 아래 안정적으로 위치하고 유지됨을 공초점현미경을 통해 확인하였다. 또한 본 연구에서 수포성 각막병증의 정도가 심하거나 단층 영구 양막이식술 이후 병변이 재발한 환자 15안을 대상으로 복층 영구 양막이식술을 시행하였는데, 수술 후 5년과 6년째를 제외한 시기에서 복층으로 수술을 시행한 군이 단층으로 수술을 시행한 군에 비해 평균적으로 보존된 양막의 비율이 높았으나 유의한 차이를 나타내지는 않았다. 하지만 본 결과는 복층 환자군이 수포성 각막병증의 정도가 심할 것으로 판단했던 환자군으로, 무작위 배정을 시행하지 못했다는 한계가 존재한다. 추후에는 동일한 특성의 환자군을 무작위 배정하여 시행하는 추가 연구가 필요할 것으로 사료된다. 수술 후 6년째에는 단층으로 수술을 시행한 군에서 보존된 양막의 비율이 높게 측정되었는데, 이는 추적 관찰 탈락한 환자의 수가 많아 대상자 수가 적어져 발생한 오차로 생각된다. 또한 전체 환자군과 단층 및 복층으로 수술을 시행한 환자군 각각의 결과에서 수술 후 3년째, 4년째, 5년째 보존된 양막의 비율이 수술 후 1년째, 2년째보다 크게 측정되었는데 이는 양막이 조기에 넓게 융해된 환자들이 수술 후 3년째부터 추적 관찰 탈락하여 발생한 오차로 생각된다.
전체 72안 중 28안(38.9%)에서 양막의 융해가 나타났고, 융해의 원인은 각막상피수포의 형성 및 파열이 가장 많았다. Gregory et al18의 연구에서 수포성 각막병증 12안에서 양막이식술 이후 3안(25%)에서 수포의 재발이 나타났는데, 본 연구에서도 72안 중 20안(27.8%)에서 수포의 재발 및 파열이 발생하였고 이전 연구와 상응하는 결과를 나타냈다. 수포의 재발을 억제하면 수포의 파열로 인한 양막의 융해를 일부 방지할 수 있다고 생각되어 수포의 재발에 관여하는 요인을 확인하고자 나이, 안압, 재상피화까지 기간, 당뇨 유무, 외상력 유무와 수포 형성 간의 관계를 분석하였으나 통계적으로 유의하게 관련 있는 요인은 없었다. 본 연구는 수술의 원인 질환이 다양하고 수포의 재발이 발생한 환자 수가 작아 재발과 관련된 요인을 분석하기에는 제한적이다. 향후 더욱 많은 수의 단일 질환 환자군을 대상으로 추가적인 연구를 진행하여 수포의 재발과 관련 있는 요인을 확인한다면, 수포의 파열로 인한 양막의 융해를 일부 예방할 수 있을 것으로 생각한다.
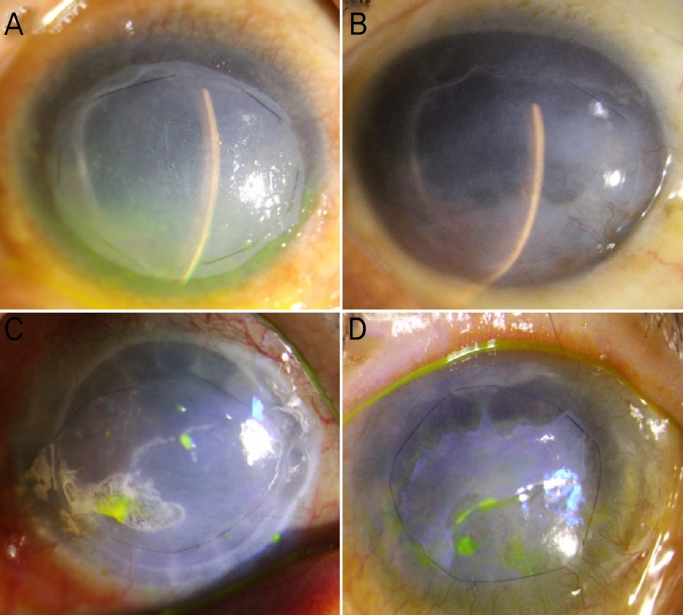
각막에 이식된 양막은 시간이 지나며 불투명한 양막의 기질이 얇아지며 육안적으로 점차 투명해지며 각막과 구별이 어려워진다. 하지만 이식된 양막은 오랜 시간이 지나더라도 각막에 잘 유지됨을 확인한 연구가 있는데, Seitz et al17의 연구에서 광학현미경과 전자현미경을 통해 이식된 양막이 각막의 상피 아래로 잘 위치함을 확인하였고, Siu et al21의 연구에서도 이식된 양막은 수술 후 61개월까지 잘 유지됨을 공초점현미경을 통하여 확인하였다. 본 연구에 참여한 1안은 수포성 각막병증을 진단받고 통증 조절을 목적으로 영구 양막이식술을 시행받고, 4년 3개월 이후 전층 각막이식술을 시행받았다. 전층 각막이식술 당시 획득한 환자의 각막 조직으로 특수 염색을 시행하여 병리학적으로 분석하였고, 양막의 일부 기질과 기저막은 각막의 상피세포 아래로 잘 이식되어 유지됨을 확인할 수 있었다(Fig. 6).
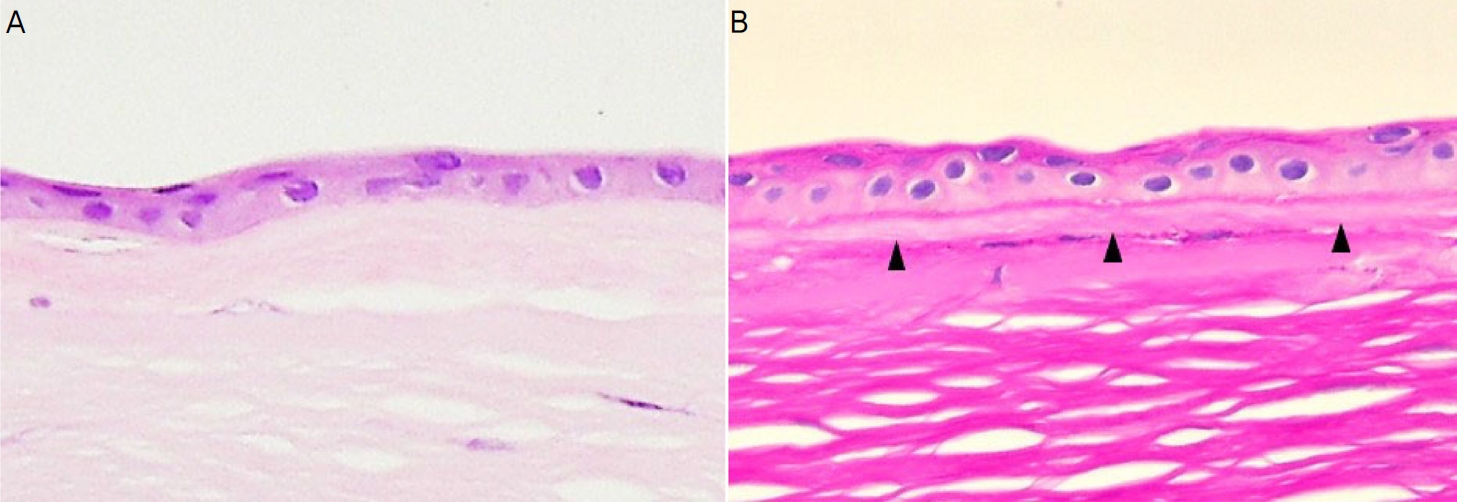
Histologic findings of cornea transplanted with amniotic membrane (AM). (A ) The distinction between the transplanted AM and cornea is not clear (Hematoxylin and Eosin stain, ×400 magnification). (B) The transplanted AM is clearly distinguished from the cornea (periodic acid-Schiff [PAS] stain, ×400 magnification). Under the corneal epithelial cells, PAS-positive basement membrane of AM and PAS-negative stroma of AM were observed (black arrow head). Below the AM, PAS-positive basement membrane of cornea and PAS-negative bowman's layer were observed.
본 연구의 제한점으로는 의무기록 및 세극등현미경 디지털 사진을 후향적으로 분석하였고, 경과 관찰 기간이 오래될수록 중간 탈락한 대상자가 많아 추적 탈락 오차가 존재한다는 점이다. 또한 영구 양막이식술을 시행받게 된 원인 질환이 다양하여 각 질환마다 수술 후 임상적인 경과에 발생할 수 있는 차이를 고려하지 못하였고 단층 환자군과 복층 환자군의 대상자들이 무작위 배정되지 않았다. 그리고 양막의 융해를 세극등현미경 디지털 사진을 통해 육안으로 판단하기 때문에 주관적인 요소가 개입되었다. 이러한 한계는 추후 일정 기간 이상 경과 관찰한 단일 질환군의 환자를 대상으로, 전안부 컴퓨터단층촬영 등의 객관적인 평가 방법을 추가한 후속 연구가 필요할 것으로 생각된다. 하지만 본 연구는 많은 수의 대상자와 오랜 경과 관찰 기간을 통해 각막에 이식된 양막의 장기적인 임상 경과와 안전성을 평가할 수 있다는 점과 보존된 양막의 크기를 최초로 수치로 나타냈다는 점에서 의의가 있을 것으로 생각된다.
결론적으로 각막의 다양한 질환에서 시행되는 영구 양막이식술의 경우, 이식된 양막은 각막상피의 수포 형성 및 파열 등의 원인으로 인해 일부 융해되지만, 수술 후 6년까지는 대부분 보존되어 안정적인 안구표면을 형성하는 것으로 사료된다.
Acknowledgements
This work was supported by the Dong-A University Research Fund.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
김태환 / Tae Hwan Kim
동아대학교 의과대학 안과학교실
Department of Ophthalmology, Dong-A University College of Medicine