 |
 |
| J Korean Ophthalmol Soc > Volume 64(1); 2023 > Article |
|
국문초록
대상과 방법
21명의 치료 경험이 없는 중심망막정맥폐쇄 환자 21명의 21안과 나이 및 성별을 매칭한 정상 대조군 42명의 42안이 분석에 포함되었다. 맥락막혈관지수는 ImageJ 소프트웨어를 통해 측정하였다.
결과
치료 경험이 없는 중심망막정맥폐쇄안의 평균 중심오목하 맥락막혈관지수는 0.6464 ± 0.0326, 정상 대조군의 중심오목하 맥락막혈관지수는 0.6209 ± 0.0434였으며 통계적으로 유의한 차이를 보였다(p=0.024). 6개월 경과 후, 중심망막정맥폐쇄안의 평균 중심오목하 맥락막혈관지수는 0.6311 ± 0.0600이었으며, 정상 대조군과 유의한 차이를 보이지 않았다(p=0.238). 중심망막정맥폐쇄안 21안 중 18안(85.7%)은 유리체강내 bevacizumab, ranibizumab, aflibercept 또는 triamcinolone을 주입받았으며, 4안(19.0%)은 범망막레이저광응고술을 시행받았다.
ABSTRACT
Purpose
To compare the subfoveal choroidal vascularity indices (CVIs) of treatment-naïve patients with central retinal vein occlusion (CRVO) with controls.
Methods
Twenty-one eyes of 21 treatment-naïve CRVO patients and 42 age- and sex-matched control eyes (of 42 subjects) lacking any retinal disease were included. The subfoveal CVIs were measured using ImageJ software.
Results
The mean subfoveal CVI in eyes with treatment-naïve CRVO at the initial visit was significantly higher than that of control eyes (0.6464 ± 0.0326 vs. 0.6209 ± 0.0434 respectively; p = 0.024). In contrast, no significant difference in the mean subfoveal CVI was found between CRVO eyes 6 months after initial diagnosis and control eyes (0.6311 ± 0.0600 vs. 0.6209 ± 0.0434 respectively; p = 0.238). Of the 21 eyes with CRVO, 18 (85.7%) received intravitreal injections (bevacizumab, ranibizumab, aflibercept, or triamcinolone) and four (19.0%) underwent panretinal photocoagulation.
Conclusions
The subfoveal CVI of eyes with treatment-naïve CRVO at the initial visit was significantly higher than that of control eyes, but decreased by 6 months. Further studies are needed to determine whether CRVO treatments such as intravitreal injection or panretinal photocoagulation affect choroid hemodynamics.
망막정맥폐쇄는 당뇨망막병증에 이어 두 번째로 흔한 망막혈관 질환으로, 그 중 중심망막정맥폐쇄는 심각한 시력 상실을 초래할 수 있는 단안 실명의 중요 원인이다.1 중심망막정맥폐쇄에서 시력상실을 유발하는 원인으로는 황반부종, 유리체출혈, 신생혈관 및 신생혈관녹내장 등이 있다.2
Enhanced depth imaging 또는 파장가변(swept-source) 빛간섭단층촬영(optical coherence tomography, OCT)의 발달로 맥락막 영역의 정량적 평가가 가능해지면서 망막혈관 질환들과 맥락막혈관 구조 사이의 연관성에 대한 관심이 증가하였다.3 당뇨망막병증, 나이관련황반변성, 미숙아망막병증 등에서 맥락막의 혈관 변화가 망막혈관의 변화에 선행하거나 병행하여 발생한다고 알려져 있다.4,5 그렇지만 중심망막정맥폐쇄에서 맥락막의 변화가 발생하는 기전은 아직까지 명확하게 밝혀지지 않았다.6 망막정맥폐쇄 환자에서 중심오목하 맥락막두께(subfoveal choroidal thickness)의 증가와 항혈관내피성장인자(anti vascular endothelial growth factor) 주사 후 중심오목하 맥락막두께의 감소에 대해 보고된 바 있다.7,8 최근 맥락막 영역 대비 혈관 영역에 대한 비율인 맥락막혈관지수(choroidal vascularity index)가 다양한 망막 질환에서 새로운 정량적 모수(parameter)로 활용되고 있다.9 황반부종을 동반한 분지망막정맥폐쇄 환자와 중심 및 분지망막정맥폐쇄환자의 맥락막혈관지수도 보고되었으나 치료 경험이 없는(treatment naïve) 중심망막정맥폐쇄 환자의 맥락막혈관지수와 그 변화에 대한 연구는 매우 드물었다.6,10 이에 본 연구에서는 치료 경험이 없는 중심망막정맥폐쇄 환자와 정상 대조군의 맥락막혈관지수를 비교하고, 첫 진단으로부터 6개월 뒤 맥락막혈관지수에 변화가 있는지 평가하고자 하였다.
본 연구는 헬싱키선언(Declaration of Helsinki)을 준수하였으며 본원의 연구윤리심의위원회(Institutional Review Board, IRB)의 승인을 받아 이루어졌다(IRB 승인 번호: 2022-05-004-003). 환자의 의무기록은 후향적으로 분석하였다. 2017년 9월부터 2021년 6월까지 단일 기관 안과에 내원한 18세 이상 환자 중 안저 사분면 모두에서 화염상의(flame-shaped) 망막출혈이 보이고 망막정맥의 울혈이 관찰되어 중심망막정맥폐쇄로 진단받았으며, 치료 경험이 없고 6개월 이상 경과 관찰을 받은 환자를 중심망막폐쇄군으로 하였다(Fig. 1A). 정상 대조군은 만 18세 이상의 성인 중 안과적 과거력이 없고 양안 모두에서 이상 소견이 관찰되지 않거나, 한 쪽 눈에 녹내장 의증, 황반주름이 동반되지 않는 셀로판망막반사만 보이는 경미한 망막전막, 또는 10개 미만의 경성 드루젠이 있지만 반대안은 이상 소견이 관찰되지 않는 정상안을 대상으로 하였다(Fig. 1C). 양안 다 정상인 경우, 두 눈 중 한 눈을 무작위로 선택하였으며, 나이와 성별에 의한 편향을 보정하기 위해 나이-성별에 따라 1:2 매칭을 실시하였다. 빛간섭단층촬영이 이루어지지 않은 경우, 맥락막혈관지수를 계산하기 어려운 경우, 형광안저조영술상 팔-맥락막 순환시간의 지연이 보여 안허혈증후군이 의심되는 경우, 타원에서 진단되어 유리체강내주사나 레이저광응고술을 시행받은 경우는 제외하였다.
중심망막정맥폐쇄군과 대조군은 내원 시 최대교정시력, 안압측정, 굴절검사, 세극등현미경검사, 안저검사, 광각안저촬영(Optos 200tx, Optos plc, Dunfermline, Scotland) (Fig. 1A, C)과 파장가변 빛간섭단층촬영(Swept-source OCT, DRI OCT Triton, Topcon, Tokyo, Japan) (Fig. 1B, D)을 시행하였고, 중심망막정맥폐쇄군에서는 광각형광안저촬영를 시행하여 다른 망막혈관질환을 감별하였다. 최대교정시력은 Snellen 시력표를 사용하여 측정하였으며, 굴절검사는 자동굴절검사기(KR800, Topcon, Tokyo, Japan)로 측정하였다.
본 연구의 일차평가지표로 치료 경험이 없는 중심망막정맥폐쇄군의 첫 진단 시, 6개월 경과 후, 그리고 정상대조군의 중심오목하 맥락막혈관지수를 비교하였다. 이차 평가지표로 중심오목하 맥락막두께와 중심망막두께를 같은 방식으로 비교하였다. 맥락막을 보다 잘 평가하기 위해 파장가변 빛간섭단층촬영의 고해상도 다섯줄 라스터 스캔(high definition 5-line raster scan) 방법으로 촬영하였으며 중심오목을 지나는 사진은 연구자가 직접 선정하였다(Fig. 2A). 선택된 사진은 축척을 1:1로 변환한 후 전용 뷰어의 내보내기 기능으로 다운로드하였다. 이후 ImageJ 소프트웨어(Version 1.47, National Institute of Health, Bethesda, MD, USA)에서 8-bit로 전환 후 Niblack’s auto local threshold를 이용하여 이진화(binarize)하였다(Fig. 2B). 그 뒤 ImageJ의 Polygon 도구를 사용하여 중심오목으로부터 비측으로 500 µm, 이측으로 500 µm, 망막색소상피의 바깥쪽 경계, 공막 안쪽경계 사이를 맥락막 관심 범위(region of interest, ROI)로 지정하였다(Fig. 2C). 이진화된 사진은 다시 적색-녹색-청색(Red-Green-Blue, RGB) 사진으로 변환하여 Threshold color 도구로 어둡게 나타나는 맥락막혈관의 내강을 지정하였다(Fig. 2D). 맥락막 관심범위 전체 면적 대비 그 안의 맥락막혈관 내강 면적의 비율을 맥락막혈관지수로 정의하였다.11 중심오목하 맥락막두께는 사진의 축척을 1:1로 변환 후, 중심오목하 망막색소상피층 바깥 경계부터 수직 방향으로 공막 안쪽 경계까지의 거리를 측정하였다. 맥락막혈관지수와 중심오목하 맥락막두께는 독립된 2인(Y.M., H.J.J.)이 동시에 측정하여 비교하였으며 맥락막혈관지수는 소수점 둘째 자리부터 불일치하는 사례, 맥락막두께는 20% 이상 값이 차이가 나는 사례들을 모아 맥락막 경계에 대한 논의와 재측정을 반복하였다.
연속형 자료는 Mann-Whitney U 검정을 사용하여 두 군 간 차이를 분석하였으며, 범주형 자료는 chi square 검정 또는 Fisher's exact 검정으로 분석하였다. 통계 분석은 SPSS version 26.0 (IBM Corp., Armonk, NY, USA)을 이용하였으며, p값이 0.05 미만인 경우를 통계학적으로 유의하다고 판단하였다.
전체 환자 63명, 63안이 연구에 포함되었으며, 그중 21명, 21안은 치료 경험이 없는 중심망막정맥폐쇄군, 42명, 42안은 대조군이었다. 평균 연령은 중심망막정맥폐쇄군 68.4 ± 13.2세, 대조군 68.1 ± 13.5세였으며, 두 군 간 기저 질환 분포는 통계적으로 유의한 차이가 관찰되지 않았다(Table 1). 중심오목하 맥락막혈관지수는 대조군에서 0.6209 ± 0.0434, 치료 경험이 없는 중심망막정맥폐쇄 환자군의 첫 진단 시 0.6464 ± 0.0326이었으며, 통계적으로 유의한 차이를 보였다(p=0.024) (Fig. 3A). 치료 경험이 없는 중심망막정맥폐쇄군에서 6개월 뒤 경과 관찰 시 중심오목하 맥락막혈관지수는 0.6311 ± 0.0600이었으며, 정상 대조군과 유의한 차이는 보이지 않았다(p=0.238) (Fig. 3A). 중심망막정맥폐쇄 환자군의 첫 진단 시보다 6개월 뒤 경과 관찰 시 맥락막혈관지수는 감소하였으나 통계적으로 유의한 차이는 보이지 않았다(p=0.068) (Fig. 3A). 중심오목하 맥락막두께는 대조군에서 245.78 ± 74.81 µm, 치료 경험이 없는 중심망막정맥폐쇄 환자군의 첫 진단 시 305.57 ± 84.93 µm였으며, 통계적으로 유의한 차이를 보였다(p=0.008) (Fig. 3B). 치료 경험이 없는 중심망막정맥폐쇄군에서 6개월 뒤 경과 관찰 시 중심오목하 맥락막두께는 310.48 ± 121.52 µm였으며, 정상 대조군과 유의한 차이를 보였다(p=0.012) (Fig. 3B). 중심망막정맥폐쇄 환자군의 첫 진단 시와 6개월 뒤 경과 관찰 시 중심오목하 맥락막두께에 유의한 변화는 없었다(p=0.702) (Fig. 3B). 중심망막두께는 대조군에서 225.14 ± 22.10 µm, 치료 경험이 없는 중심망막정맥폐쇄 환자군의 첫 진단 시 471.52 ± 192.20 µm였으며, 통계적으로 유의한 차이를 보였다(p<0.001) (Fig. 3C). 치료 경험이 없는 중심망막정맥폐쇄군에서 6개월 뒤 경과 관찰 시 중심망막두께는 283.19 ± 165.66 µm였으며, 정상 대조군과 유의한 차이는 없었다(p=0.351) (Fig. 3C). 중심망막정맥폐쇄 환자군의 첫 진단 시보다 6개월 뒤 경과 관찰 시 중심망막두께는 유의한 감소를 보였다(p=0.006) (Fig. 3C). 6개월간 중심망막정맥폐쇄군에서 85.7% (n=18)가 40회의 유리체강내 항혈관내피성장인자(anti-vascular endothelial growth factor) 또는 스테로이드 주입술을 시행받았으며, bevacizumab은 12안에 26회, ranibizumab은 1안에 2회, aflibercept는 1안에 1회, triamcinolone은 6안에 11회 주입되었다. 범망막레이저광응고술(panretinal photocoagulation)은 19.0% (n=4)에서 시행되었다. 본 연구에 포함된 중심망막정맥폐쇄안은 적어도 유리체강내 주사 또는 범망막레이저광응고술 중 한 가지 이상은 시행받았다.
본 연구에서 치료 경험이 없는 중심망막정맥폐쇄안의 초기 평균 중심오목하 맥락막혈관지수는 정상 대조군에 비해 유의하게 높았다. 6개월 동안 중심망막정맥폐쇄안의 85.7%에서 유리체강내 항혈관내피성장인자 또는 스테로이드 주입이 이루어졌으며, 19.0%에서 범망막레이저광응고술이 시행되었다. 첫 진단으로부터 6개월 이후 평균 중심오목하 맥락막혈관지수는 감소하여 정상 대조군과 차이를 보이지 않았다. 중심망막정맥폐쇄안에서 첫 진단 시와 6개월 경과 후의 맥락막혈관지수를 직접 비교했을 때 맥락막혈관지수의 감소가 관찰되었지만, 이는 통계적으로 유의하지는 않았다. 중심오목하 맥락막두께는 맥락막혈관지수와 다르게 대조군과의 유의한 차이가 진단 후 6개월 후에도 지속되었다. 중심망막두께는 맥락막혈관지수와 유사하게 첫 진단 시에는 대조군과 유의한 차이를 보였으나 6개월 후에는 유의한 차이를 보이지 않았다.
맥락막은 무혈관성의 망막 바깥층의 산소공급을 담당할 뿐 아니라, 저산소 상황에서 망막세포의 산소 요구에도 반응한다.5,12 따라서 망막정맥폐쇄 과정 중에 맥락막의 구조적, 기능적 변화가 동반될 것이라고 추론할 수 있다.6 본 연구에서 치료 경험이 없는 중심망막정맥폐쇄안의 초기 평균 중심오목하 맥락막혈관지수는 정상 대조군에 비해 유의하게 높았다. 이전 중심망막정맥폐쇄안에서의 초기 맥락막두께에 관한 연구에서 정상인 반대안 대비 평균 중심오목하 맥락막두께의 증가를 보고한 바 있으며, 이를 맥락막혈관의 과투과성에 의한 액체의 축적으로 인해 맥락막혈관이 팽창한 것을 원인으로 생각해 볼 수 있다고 주장하였다.7,13,14 또한, 망막정맥폐쇄안에서는 망막내피세포, 망막색소상피, 뮬러 세포 등에서 혈관내피성장인자의 발현이 증가되어 있으며, 이런 혈관내피성장인자 발현의 상향조절은 산화질소의 생성을 유도하여 혈관확장을 일으킨다고 알려져 있다.5,15 빛간섭단층촬영에서 보이는 맥락막의 혈관 면적은 주로 자율신경계에 의해 신경이 지배되는 풍부한 평활근과 탄성섬유를 가진 혈관층인 할러층(Haller’s layer)에 의해 영향을 받으며, 위와 같은 기전으로 확장된 혈관 내경에 의한 면적 증가와 본 연구에서 치료 경험이 없는 중심망막정맥폐쇄안의 초기 맥락막혈관지수의 증가와 연관이 있다고 추론해 볼 수 있다.
본 연구에서 6개월 동안 중심망막정맥폐쇄안의 85.7%에서 유리체강내 항혈관내피성장인자 또는 스테로이드 주입, 그리고 19.0%에서 범망막광응고술이 이루어졌으며, 첫 진단으로부터 6개월 이후 평균 중심오목하 맥락막혈관지수는 감소하여 정상 대조군과 차이를 보이지 않았다. 다른 여러 연구에서 유리체강내 항혈관내피성장인자 또는 스테로이드 주입 후 망막정맥폐쇄안에서 중심오목하 맥락막두께가 감소하는 양상에 대해 보고하고 있다.7,8,15,16 트리암시놀론(triamcinolone)은 혈관내피성장인자의 발현을 줄이고, 망막혈관 투과성과 관련된 단백질인 glial fibrillary acidic protein의 발현을 줄이고, 코티코스테로이드(corticosteroid)는 혈관 내피의 산화질소의 생성을 억제하는 작용을 한다고 알려져 있다.15,17 범망막광응고술의 경우 당뇨망막병증 환자에서 시행된 이후 중심오목하 맥락막두께와 맥락막혈류의 감소가 보고된 바 있으며, 범망막광응고술이 혈관내피성장인자의 생성을 줄여 확장된 혈관을 줄이고 혈관투과성의 감소를 유발하였다고 보고되었다.18 본 연구에서 6개월간 시행된 유리체강내 항혈관내피성장인자, 스테로이드 주입 또는 범망막광응고술이 가지는 위와 같은 기전과 첫 진단으로부터 6개월째 평가된 맥락막혈관지수 감소가 연관이 있다고 추론해 볼 수 있다. 다만 중심망막정맥폐쇄안에서 첫 진단 시와 6개월 후의 맥락막혈관지수를 직접 비교하였을 때 감소 경향을 보였으나 통계적으로 유의하지 않았으며, 이는 적은 환자수로 인해 통계적 검정력이 떨어졌을 것으로 추정된다. 또한 맥락막혈관지수가 첫 진단 시에는 대조군과 차이를 보였으나 6개월째에는 차이를 보이지 않은 경향을 지녔던 반면, 중심오목하 맥락막두께는 6개월째에도 여전히 대조군과 유의한 차이가 지속되었다. Lee et al16은 덱사메타손 임플란트 주입 후 첫 1개월째에 맥락막두께가 크게 감소하지만, 그 이후 5개월까지 다시 지속적으로 증가함을 보고하고 있다. 본 연구는 6개월째의 중심오목하 맥락막두께를 측정하였기 때문에 이러한 경향에 비추어 볼 때 맥락막두께에 변화가 없는 것처럼 보였을 가능성이 있다.
다른 선행 연구에서는 분지망막정맥폐쇄안이 반대안에 비해 낮은 맥락막혈관지수를 보이기도 하였다.6,10 하지만 Aribas et al6은 본 연구처럼 치료 경험이 없는(treatment naïve) 환자가 아니라 3년 이상의 질병 경과를 보이고 망막부종이 유리체강내 주사 등으로 조절되고 있던 환자들을 대상으로 하였다. 이미 맥락막혈관계의 변화가 발생한 이후의 맥락막혈관지수를 비교하였다는 점에서, 치료 경험이 없는 중심망막혈관폐쇄안의 맥락막혈관지수를 관찰한 본 연구와 다른 결과를 보인 것으로 생각된다. Hwang et al10은 치료 경험이 없는, 황반부종이 동반된 분지망막정맥폐쇄안에서 반대안 대비 낮은 맥락막혈관지수와 항혈관내피성장인자 주사 후 맥락막혈관지수의 증가를 보고하였으며, 분지망막정맥폐쇄로 인한 혈액망막장벽의 손상으로 망막혈관으로부터 세포외액(extracellular fluid)이 맥락막 기질(stroma)로 이동하면서 맥락막혈관지수가 감소하였다가, 황반부종 치료 후 혈액망막장벽의 회복으로 해당 기전의 작용이 멈추면서 맥락막혈관지수가 감소한 것이라고 추론하였다. 하지만 해당 선행 연구는 본 연구와 달리 대상이 분지망막정맥폐쇄이다. 허혈성 망막은 혈관내피성장인자를 유리시킨다.19 이러한 혈관내피성장인자는 산화질소 생성을 유도하여 혈관의 직경을 커지게 하는 것으로 알려져 있다.5,15 분지망막정맥폐쇄보다 중심망막정맥폐쇄의 허혈성 망막 영역이 훨씬 넓어 유리되는 혈관내피성장인자의 농도도 상대적으로 매우 높을 것이며, 이는 맥락막혈관의 직경을 분지망막정맥폐쇄에서보다 더 많이 확장시켜 중심망막정맥폐쇄 첫 진단 시의 맥락막혈관지수가 분지망막정맥폐쇄에서의 선행 연구와는 달리 높아졌을 가능성이 있다.
본 연구는 치료 경험이 없는 중심망막정맥폐쇄안의 맥락막혈관지수를 나이 및 성별을 매칭한 정상 대조군과 비교했던 연구가 드물기 때문에 선행 연구로서 그 의의를 지닌다. 그럼에도 불구하고 몇 가지 제한점이 있다. 첫째, 경과 관찰 기간이 6개월로 장기간 변화를 관찰하지 못했다. 둘째, 본 연구에 포함된 중심망막정맥폐쇄안이 적어도 범망막레이저광응고술 혹은 유리체강내 항혈관내피성장인자주입술 중 한 가지 이상을 시행받았기 때문에 치료를 하지 않은 중심망막정맥폐쇄안에서의 맥락막혈관지수의 변화를 관찰하지 못했다. 또한 적은 환자 수로 인해 범망막레이저광응고술을 받은 군과 유리체강내 항혈관내피성장인자 주입술을 받은 군 사이에 맥락막혈관지수의 변화가 차이가 있는지 분석하는 데 제한이 있었다. 셋째, 맥락막혈관지수와 장기적인 시력변화 또는 합병증 발생과 같은 예후와의 관련성을 분석에 포함시키지 못했다. 넷째, 중심망막정맥폐쇄군의 환자 수가 많지 않았다. 후속 연구에서는 환자를 더 모집하고, 장기간 경과 관찰하여 시력 또는 합병증 발생과 같은 예후와의 관련성을 살펴보는 것이 필요할 것이다.
결론적으로 치료 경험이 없는 중심망막정맥폐쇄안에서 초기는 정상안 대비 맥락막혈관지수가 유의하게 높았으며, 6개월 후 정상안 대비 유의한 차이가 없는 정도로 감소하였다. 6개월 동안 항혈관내피성장인자 또는 스테로이드의 유리체강내 주입, 범망막광응고술 등의 치료를 받았으며, 선행 연구에 따르면 상기 시술은 맥락막혈관지수를 낮추는 요인으로 작용할 수도 있지만 치료를 받지 않은 중심망막정맥폐쇄안이 연구에 포함되지 않기 때문에 이에 대한 후속 연구가 필요하다. 또한 향후 치료 경험이 없는 중심망막정맥폐쇄안에서의 맥락막혈관지수가 장기간 시력 또는 합병증 발생률 등과 같은 임상적 지표와 어떠한 관련성이 있을지에 대한 연구 또한 필요하다.
Figure 1.
Representative images of an eye with central retinal vein occlusion (CRVO) and a control eye. (A) Fundus photo of an eye with CRVO. (B) Optical coherence tomography (OCT) of an eye with CRVO. (C) Fundus photo of a control eye. (D) OCT of a control eye.
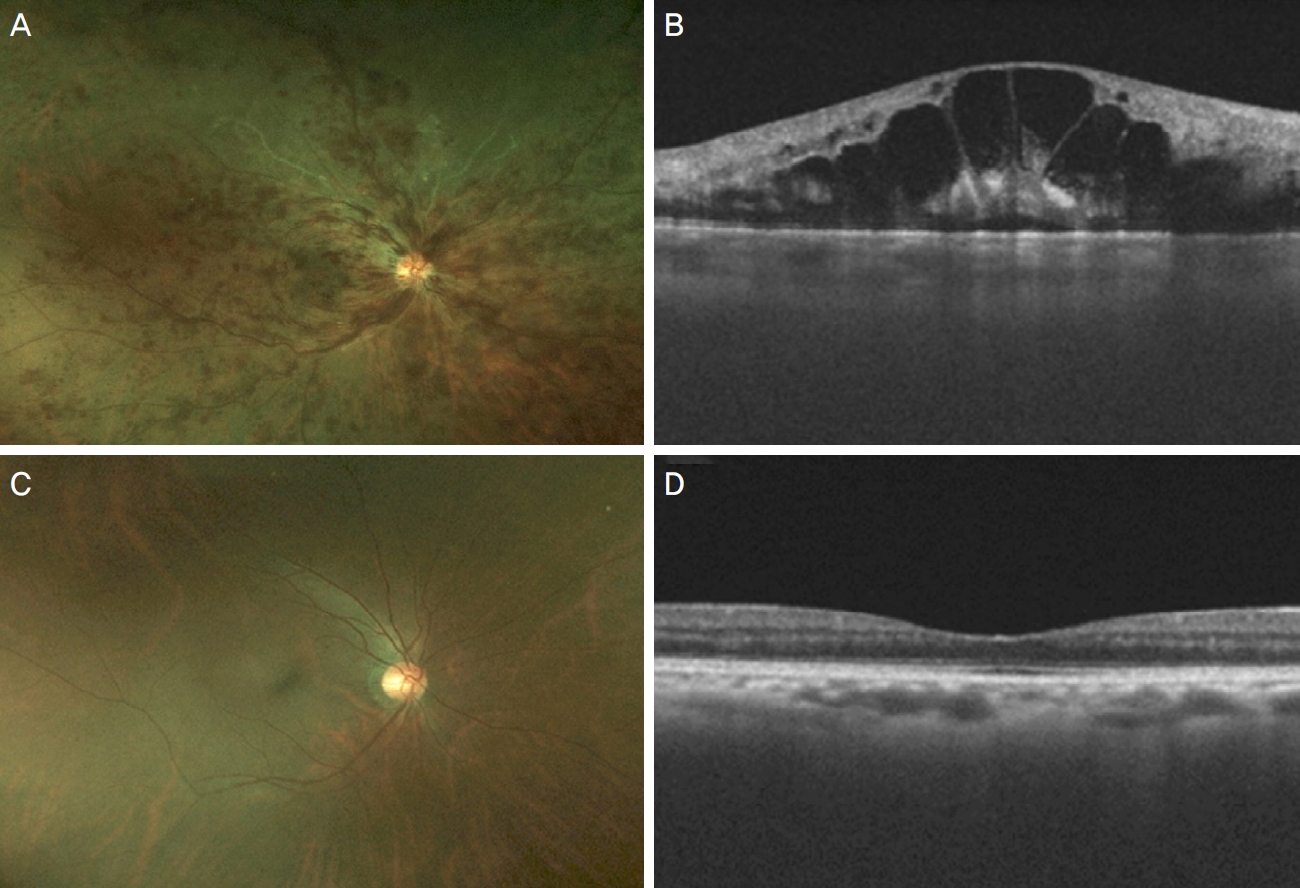
Figure 2.
Flow of choroidal vascularity index calculation. (A) An original image of optical coherence tomography in control. (B) Binarization (Niblack auto local threshold) in control. (C) Measuring total area (subfoveal, w idth: 1,000 μm) in control. (D) Measuring luminal area (subfoveal, width: 1,000 μm) in control. (E) An original image of optical coherence tomography in central retinal vein occlusion (CRVO). (F) Binarization (Niblack auto local threshold) in CRVO. (G) Measuring total area (subfoveal, width: 1,000 μm) in CRVO. (H) Measuring luminal area (subfoveal, width: 1,000 μm) in CRVO.
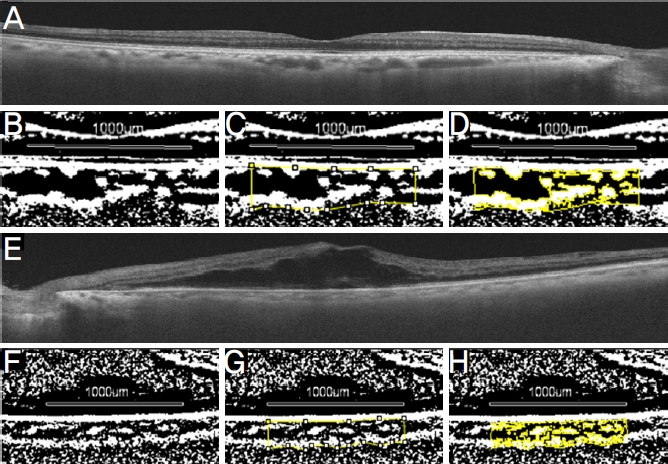
Figure 3.
Comparison of choroidal vascularity index, subfoveal choroidal thickness, and central macular thickness between eyes with central vein occlusion (CRVO) and control eyes. (A) Choroidal vascularity index. (B) Subfoveal choroidal thickness. (C) Central macular thickness. *Mann-Whitney U test.
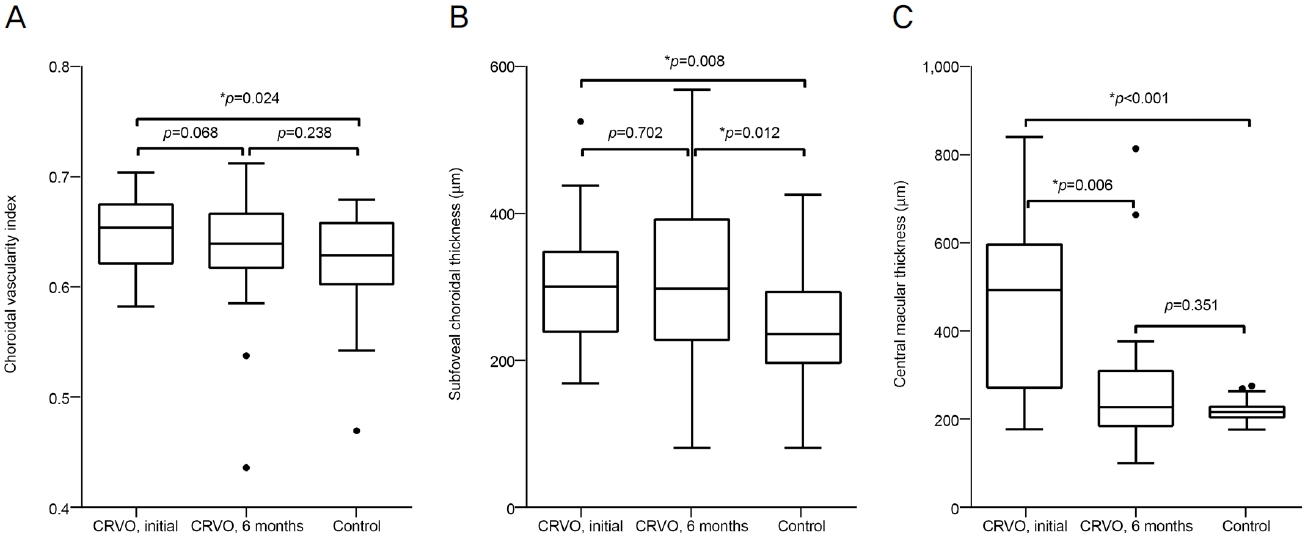
Table 1.
Baseline characteristics of eyes with central retinal vein occlusion and controls eyes
| Central retinal vein occlusion (n = 21) | Controls (n = 42) | p-value | ||
|---|---|---|---|---|
| Age at diagnosis (years) | 68.4 ± 13.2 | 68.1 ± 13.5 | 0.948* | |
| 25-29 | M: 0, F: 0 | M: 2, F: 0 | ||
| 45-49 | M: 0, F: 1 | M: 0, F: 2 | ||
| 55-59 | M: 1, F: 1 | M: 2, F: 2 | ||
| 60-64 | M: 0, F: 2 | M: 0, F: 4 | ||
| 65-69 | M: 2, F: 2 | M: 4, F: 4 | ||
| 70-74 | M: 2, F: 1 | M: 4, F: 2 | ||
| 75-79 | M: 0, F: 4 | M: 0, F: 8 | ||
| 80-84 | M: 4, F: 0 | M: 8, F: 0 | ||
| Systemic comorbidities | ||||
| Diabetes mellitus | 9 (42.9) | 26 (61.9) | 0.151† | |
| Hypertension | 11 (52.4) | 24 (57.1) | 0.720† | |
| Cardiovascular disease | 1 (4.8) | 8 (19.0) | 0.251‡ | |
| Cerebrovascular disease | 1 (4.8) | 2 (4.8) | 1.000‡ | |
| Ocular comorbidities | ||||
| Epiretinal membrane | 2 (9.5) | 0 (0.0) | ||
| Glaucoma | 1 (4.8) | 0 (0.0) | ||
| Diabetic retinopathy | 0 (0.0) | 0 (0.0) | ||
| Age-related macular degeneration | 0 (0.0) | 0 (0.0) | ||
| Best corrected visual acuity (logMAR) | 0.8926±0.7209 | 0.0861 ± 0.1234 | <0.001* | |
| Central macular thickness (µm) | 471.52 ± 192.20 | 225.14 ± 22.10 | <0.001* | |
| Subfoveal choroidal thickness (µm) | 305.57 ± 84.93 | 245.78 ± 74.81 | 0.008* | |
| The total number of intravitreal injections | 40 (n = 18) | N/A | N/A | |
| Bevacizumab | 26 (n = 12) | N/A | ||
| Ranibizumab | 2 (n = 1) | N/A | ||
| Aflibercept | 1 (n = 1) | N/A | ||
| Triamcinolone | 11 (n = 6) | N/A | ||
| Dexmethasone | 0 | N/A | ||
| Panretinal photocoagulation | 4 (19.0) | N/A | N/A | |
REFERENCES
1) Cugati S, Wang JJ, Rochtchina E, Mitchell P. Ten-year incidence of retinal vein occlusion in an older population: the Blue Mountains Eye Study. Arch Ophthalmol 2006;124:726-32.


2) McIntosh RL, Rogers SL, Lim L, et al. Natural history of central retinal vein occlusion: an evidence-based systematic review. Ophthalmology 2010;117:1113-23.


3) Adhi M, Duker JS. Optical coherence tomography--current and future applications. Curr Opin Ophthalmol 2013;24:213-21.



4) Shao Z, Dorfman AL, Seshadri S, et al. Choroidal involution is a key component of oxygen-induced retinopathy. Invest Ophthalmol Vis Sci 2011;52:6238-48.


5) Mrejen S, Spaide RF. Optical coherence tomography: imaging of the choroid and beyond. Surv Ophthalmol 2013;58:387-429.


6) Aribas YK, Hondur AM, Tezel TH. Choroidal vascularity index and choriocapillary changes in retinal vein occlusions. Graefes Arch Clin Exp Ophthalmol 2020;258:2389-97.



7) Tsuiki E, Suzuma K, Ueki R, et al. Enhanced depth imaging optical coherence tomography of the choroid in central retinal vein occlusion. Am J Ophthalmol 2013;156:543-7.e1.


8) Coban-Karatas M, Altan-Yaycioglu R, Ulas B, et al. Choroidal thickness measurements with optical coherence tomography in branch retinal vein occlusion. Int J Ophthalmol 2016;9:725-9.


9) Agrawal R, Gupta P, Tan KA, et al. Choroidal vascularity index as a measure of vascular status of the choroid: Measurements in healthy eyes from a population-based study. Sci Rep 2016;6:21090.




10) Hwang BE, Kim M, Park YH. Role of the choroidal vascularity index in branch retinal vein occlusion (BRVO) with macular edema. PLoS One 2021;16:e0258728.



11) Sonoda S, Sakamoto T, Yamashita T, et al. Choroidal structure in normal eyes and after photodynamic therapy determined by binarization of optical coherence tomographic images. Invest Ophthalmol Vis Sci 2014;55:3893-9.


12) Gallice M, Zhou T, Aptel F, et al. Hypoxic, hypercapnic, and hyperoxic responses of the optic nerve head and subfoveal choroid blood flow in healthy humans. Invest Ophthalmol Vis Sci 2017;58:5460-7.


13) Maruko I, Iida T, Sugano Y, et al. One-year choroidal thickness results after photodynamic therapy for central serous chorioretinopathy. Retina 2011;31:1921-7.


14) Maruko I, Iida T, Sugano Y, et al. Subfoveal choroidal thickness in fellow eyes of patients with central serous chorioretinopathy. Retina 2011;31:1603-8.


15) McAllister IL, Vijayasekaran S, Chen SD, Yu DY. Effect of triamcinolone acetonide on vascular endothelial growth factor and occludin levels in branch retinal vein occlusion. Am J Ophthalmol 2009;147:838-46.e1-2.


16) Lee EK, Han JM, Hyon JY, Yu HG. Changes in choroidal thickness after intravitreal dexamethasone implant injection in retinal vein occlusion. Br J Ophthalmol 2015;99:1543-9.


17) Liu Y, Mladinov D, Pietrusz JL, et al. Glucocorticoid response elements and 11 beta-hydroxysteroid dehydrogenases in the regulation of endothelial nitric oxide synthase expression. Cardiovasc Res 2009;81:140-7.

-
METRICS

-
- 0 Crossref
- 0 Scopus
- 875 View
- 44 Download
- Related articles
-
Clinical Course of Young Adults With Central Retinal Vein Occlusion.2008 December;49(12)
Intravitreal Bevacizumab Treatment of Macular Edema in Central Retinal Vein Occlusion.2010 May;51(5)
Electroretinographic Findings in Patients with Branch Retinal Vein Occlusion.1998 October;39(10)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



