 |
 |
| J Korean Ophthalmol Soc > Volume 63(12); 2022 > Article |
|
ęľëŹ¸ě´ëĄ
몊ě
ëšë맼ěźěą ěííěě 경ëłěŚ íěěě ííě´ ě´íë ëśëŠ´ě ě¤ěŹěźëĄ íěŹ ě꾏 ë´ ëŞ¨ě¸íę´ë°ë뼟 ëśěíęł ě íë¤.
ëěęłź ë°Šë˛
ěŚěě´ ë°ěíě§ í ëŹ ě´ë´ě ë´ěí í ëě ëšë맼ěźěą ěííěě 경ëłěŚ íěě ě돴기ëĄě ííĽě ěźëĄ ëśěíěë¤. ě´íë ëęłź ě´íëě§ ěě ëě ěľëęľě ěë Ľ, ěěź, ěę°ę˛ěŹ 결곟뼟 ëšęľíęł , ě´ě§ ëšě ě´Źěí ëšę°ěë¨ě¸ľě´Źě(optical coherence tomography), ëšę°ěë¨ě¸ľě´Źě íę´ěĄ°ěě (optical coherence tomography angiography)뼟 íľí´ ě ë죟ě ë§ë§ě 경ěŹě 츾ëęť, 미ě¸íę´ě´ë°ë ë° íŠë°ëś íę´ë°ë뼟 ëśěíěë¤. ęˇ¸ëŚŹęł ě´íë ëë§ě ëěěźëĄ íěŹ íęˇ íę´ë°ëě ěľëęľě ěë Ľęłźě ěę´ę´ęłëĽź ěěëł´ěë¤.
결곟
íě 25ëŞ
(ë¨ěą 11ëŞ
, ěŹěą 14ëŞ
)ě´ ëěě íŹí¨ëěë¤. íęˇ ëě´ë 65.92 Âą 9.37ě¸ěë¤. ě ë죟ě ë§ë§ě 경ěŹě 츾 ëęťë ě´íë ëěě 197.32 Âą 60.52 ÎźmëĄ ë°ëěě 108.52 Âą 13.27 Îźmě ëší´ ě ěíę˛ ëęşźě ęł (p<0.001), íęˇ ě ë죟ě 모ě¸íę´ě´ě íę´ë°ë ëí ě´íë ëěě 45.63% Âą 7.60%ëĄ, ë°ëěě 51.44% Âą 3.40%ě ëší´ ě ěíę˛ ëŽěë¤(p=0.001). ě´íë ëě ëěěźëĄ íěŹ ě ë죟ě ë§ë§ě 경츾ëęťě íę´ë°ë ěŹě´ě ëśíëł ěę´ę´ęłëĽź ëśěíěě ë 모ë ëśíěě ěę´ę´ęłę° ěěë¤. ííě´ ě´íëě§ ěě ě´ëśëŠ´ě íę´ë°ëě ěľëęľě ěë Ľě ěę´ęłě -0.608ëĄ ěě ěę´ę´ęłę° ěěë¤(p=0.001).
결ëĄ
ëšë맼ěźěą ěííěě 경ëłěŚ íěěě ě§ë¨ ëšě ííě´ ě´íëě§ ěě ě´ëśëŠ´ě ě ë죟ě íę´ë°ëę° ëěěëĄ ěľëęľě ěë Ľě´ ě˘ë¤ë 결곟뼟 ëł´ěě ë, ěě 경ě ëëśěě íëĽę° 보쥴ë ěěě íę´ ę¸°ëĽě´ ěë Ľě ę¸ě ě ě¸ ěíĽě 미욨ě ě ě ěë¤.
ABSTRACT
Purpose
To investigate the intraocular vessel density in patients with nonarteritic anterior ischemic optic neuropathy (NAION) using optical coherence tomography angiography (OCTA).
Methods
Medical records of patients with NAION were retrospectively analyzed. Their age, sex, best corrected visual acuity, color vision results, mean deviation of visual field test were analyzed. Using results of OCT and OCTA that was performed at first visit within 3 weeks of symptom onset, vessel densities in eyes with NAION were evaluated by comparing contralateral unaffected eyes. Furthermore, in only affected eyes, the correlation between visual acuity at the time of diagnosis and anatomical factors such as mean vessel density and retinal nerve fiber layer (RNFL) thickness was investigated.
Results
Twenty-five patients (11 males and 14 females) were enrolled in this study and the mean age was 65.92 Âą 9.37 years. Whole RNFL thickness in affected eye was significantly lower than that in unaffected eye (p < 0.001). The average peripapillary vessel density was also significantly lower in affected eyes, 45.63% Âą 7.60% compared to that in the contralateral eyes, 51.44% Âą 3.40% (p = 0.004). In analysis of only 25 affected eyes, there was no significant correlation between each sectoral peripapillary RNFL thickness and vessel density. There was also no significant correlation between the visual acuity and the vessel density and retinal nerve fiber layer thickness in the ischemic peripapillary hemisphere. However, there was a significant negative correlation between the visual acuity and the un-ischemic peripapillary hemisphere with a coefficient of -0.608 (p = 0.001).
ëšë맼ěźěą ěííěě 경ëłěŚě ěě 경ě ëě íěĄ ę´ëĽě íëĄ ě기ë ěě 경ě ííěą ě§íěźëĄ, íěë íľěŚě´ ěęą°ë 경미í ë 죟ě ëśí¸ę°ęłź í¨ęť ę°ěě¤ëŹě´ ěë Ľ ě í뼟 í¸ěíë¤. ěěźę˛ěŹěě ěí ë°ěěź ę˛°ěě´ ě íě ě´ëŠ°, ěŁźëĄ ěë쪽 ëśëŠ´ě ëíë늰 ě¤ěŹ ěě ě´ë ě ë°ě ę°ëě í ëąë ëíë ě ěë¤[1]. ěźë°ě ěźëĄ 50ě¸ ě´ěě ęł íě, ëšë¨ëł, ě´ěě§ě§íěŚ, ěŹíę´ęłě 기ě ě§íě´ ěë íěěě íí ë°ěíë¤[2,3].
ěľęˇź ëšěš¨ěľě ě´ëŠ´ě, ë´ěĽë íëĄęˇ¸ë¨ě ě´ěŠíěŹ ëšęľě ě˝ę˛ ěěëł íę´ ęľŹěĄ° ëśěě´ ę°ëĽí ëšę°ěë¨ě¸ľě´Źě쥰ěě (optical coherence tomography angiography, OCTA) [4]ě íěŠíěŹ ëšë맼ěźěą ěííěě 경ëłěŚěě íę´ëŻ¸ě¸ęľŹěĄ°ëĽź ëśěí ě°ęľŹë¤ě´ ëł´ęł ëęł ěë¤[5-12]. Moon et al [10]ě OCTA ëłě ě¤ ę¸ěąę¸°ě ě´ě¸Ą ě ë죟ě íę´ë°ëë ěľě˘
ěë Ľě ě¤ěí ě츥 ëłěëĄ ěěŠíë¤ęł ëł´ęł íęł , Aghsaei Fard et al [9]ě íěě ě ë죟ě íę´ë°ë뼟 ěí츥 ě´ëśëŠ´ěźëĄ ëëěě ë ę°ę°ě ëłě 모ë ěë Ľęłź ě ěí ěę´ę´ęłę° ěěě ëł´ęł íěë¤.
ě´ě ę°ě´ ëëśëśě OCTA ě°ęľŹěěë ěě 경ě ë ë° íŠë°ëśě 미ě¸íę´ęľŹěĄ°ëĽź ëśěí ë íęˇ ę°ě ě´ěŠíęą°ë ěŹëśëŠ´ěźëĄ ëëě´ ëśěíěë¤[9,10,13,14]. íě§ë§ ëšë맼ěźěą ěííěě 경ëłěŚ íěěě ě íě ě¸ ę˛˝ě° ěí경ě ě 기ě¤ěźëĄ ěě 경 íí ë° ěěíë ë°ěěź ę˛°ěě´ ëíë기 ë돸ě, íę´ ëŻ¸ě¸ęľŹěĄ°ëĽź ëśěí ë ííě´ ě´íë ëśëŠ´ě 기ě¤ěźëĄ íěŹ ě¸ëśě ěźëĄ ëśěíë ę˛ ëí ěëŻ¸ę° ěěźë, í´ëš ě°ęľŹę° ëł´ęł ë ë° ěë¤.
ë°ëźě 본 ě°ęľŹě 몊ě ě íëě ëšë맼ěźěą ěííěě 경ëłěŚ íěěě 기쥴 ě°ęľŹěě ëśëĽíěë ěí츥 íšě ěŹëśëŠ´ě´ ěë, ííě´ ě´íë ě´ëśëŠ´ęłź ꡸ë ě§ ěě ě´ëśëŠ´ě ě¤ěŹěźëĄ íěŹ ěě 경ě ëëśě 미ě¸íę´ęľŹěĄ°ëĽź ě¸ëś ëśěíęł ě기ëĽęłźě ě°ę´ěąě ěěëł´ęł ě íěë¤.
ě´ ě°ęľŹë 본ě ěěě°ęľŹě¤ëŚŹěěí(Institutional review board, IRB)ě ěšě¸ě ë°ěěźëŠ° íŹěąí¤ě ě¸(Declaration of Helsinki)ě ě¤ěíěŹ ě§ííěë¤(ěšě¸ ë˛í¸: CR_22_039). 2021ë
4ěëśí° 2021ë
9ěęšě§ 본ěě ë´ěíěŹ í ëě ëšë맼ěźěą ěííěě 경ëłěŚěźëĄ ě§ë¨ë°ě íě뼟 ëěěźëĄ ě돴기ëĄě ííĽě ěźëĄ ëśěíěë¤. ëě íěë ę¸ěąěźëĄ ě§íë ěë Ľě í뼟 í¸ěíë íě ě¤ íľěŚě´ ěęą°ë 경미íęł , ěŚě ë°ěěźëĄëśí° 3죟 ě´ë´ě ë´ěí 경ě°ëĽź ëěěźëĄ 쥰ěŹíěë¤. ěęłźę˛ěŹěě ěë꾏ěŹëęłľ ë°ěě í뼟 ëł´ě´ęł ěě 경ě ëëśě ëśě˘
ě´ ę´ě°°ë늰 ě´ě ě°ę´ë ěěź ę˛°ěě´ ěěźę˛ěŹěě ę´ě°°ëë 경ě°ëĄ 기í íěĄę˛ěŹ, ě 경íě ę˛ěŹ ë° ëěěę˛ěŹěě ë¤ëĽ¸ ěě¸ě´ ë°°ě ë 경ě°ě ëšë맼ěźěą ěííěě 경ëłěŚě ě§ë¨íěë¤[1].
ě ěěě 기ě¤ě í´ëšíë 경ě°ëĽź ëšë맼ěźěą ěííěě 경ëłěŚě´ ě´íëěë¤ęł ě ěíěęł , ë°ëěě ëšë맼ěźěą ěííěě 경ëłěŚě´ ě´íëě§ ěěźëŠ´ě ěźë°ě ěźëĄ ëł´ě´ë 쥰ě ë Ľě í ě¸ě ěë Ľě ěíĽě ě¤ ě ěë 기í ë§ë§, ě 경ěęłź ě§íě´ ěë 경ě°ě ě°ęľŹ ëěěźëĄ íŹí¨íěë¤.
ëěě íŹí¨ë 모ë íěěę˛ ě˛Ť ë´ěěźě ěľëęľě ěë Ľ ë° ëšě ě´ ěěęłëĄ ěěě 츥ě íěë¤. ęˇ¸ëŚŹęł ě¸ęˇšëąí미경ě ě´ěŠí ě ěëśę˛ěŹ, ěě ę˛ěŹ, ě´ěíëźěę°ę˛ěŹëĽź ěííěë¤. OCT (Carl Zeiss Meditec, Dublin, CA, USA), OCTA (Optovue, Inc., Fremont, CA, USA)뼟 ěííěŹ ë§ë§ëިě¸íę´ęľŹěĄ°ëĽź íě
íěë¤. ě´ë, OCTě Optic Disc Cube 200Ă200 íëĄí ě˝ě ě´ěŠíěěźëŠ°, OCTAě HD Angio Disc 4.5 mm, HD Retina Disc 6.0 mm, 3D disc íëĄí ě˝ě ě´ěŠíěë¤. ëí Humphrey ěëěěźę˛ěŹ(Zeiss-Humphrey, San Leandro, CA, USA)ëĄ ě´ěŠíěŹ ěěź ę˛°ěě íě
íěëë° SITA Standard 24-2 íëĄí ě˝ě ě´ěŠíěěźëŠ° ě 뢰ë ě§í ě¤ ěŁźě ěě¤ě´ 20% ě´í, ěěěą ë° ěěěą ę˛°ęłźę° 30% ě´íě¸ ę˛˝ě°ě 결곟ę°ë§ ëśěě ě´ěŠíěë¤.
ë ëě ëšë맼ěźěą ěííěě 경ëłěŚě´ ěë íě, ěŚěě´ ë°ěí í 3ěŁźę° ě§ëě ë´ěí íě, ë
šë´ěĽ, ë맼ěźěą ííěě 경ëłěŚęłź ę°ě ë¤ëĽ¸ ěě 경ëłěŚě´ ěë 경ě°ě 6 D ě´ěě ěŹí ęľ´ě ě´ě, ěë Ľě í뼟 ě´ëí ě ěë ę°ë§ ě§íě´ë ë§ë§ ě§íě´ ěë íěë ëěěě ě ě¸íěë¤. ě꾏 ě¸ěë Ľě´ ěęą°ë, ě꾏 ë´ ěě ě ěíí íěë¤ ëí ëěěě ě ě¸íěë¤. OCT ë° OCTAěě ě í¸ę°ëę° 6 미ë§ě´ęą°ë 츥ě ëśěëĄëśí° ě´ě ě´ ě´íëě´ ěë 경ě°ë ëěěě ě ě¸íěë¤.
íěě ěąëł, ě§ë¨ ëšě ě°ë š, ííě´ ę´ě°°ëë ě ëěěě ě´ëśëŠ´, 기ě ě§í ěŹëś ë° ěľëęľě ěë Ľ, ęľ´ě ě´ě, ě´ěíëźěę°ę˛ěŹ 결곟뼟 쥰ěŹíěěźëŠ°, ěěź ę˛°ěě ěŹí ě ëë íęˇ í¸ě°¨ ë° í¨í´ íě¤í¸ě°¨, ěěź ě§í뼟 ě´ěŠíěŹ ëśěíěë¤.
본 ě°ęľŹěěë OCT ë° OCTA뼟 ě´ěŠíěŹ NAIONě´ ě´íë ëęłź ë°ë ëě í´ëśíě ě¸ ëŞ¨ě¸íę´ëśíŹëĽź ěě 경ě ë죟ěě íŠë°ëśëĄ ëëě´ ëšęľ ëśěíěë¤. ë§ë§ě 경ěŹě 츾ëęťë ë´ěĽë OCT íëĄęˇ¸ë¨ě ěë ëśěě ë°ëź íęˇ ëęť ë° ě츥, í츥 ëę°ě§ ëśíęłź ě츥, í츥, ëšě¸Ą, ě´ě¸Ąě ë¤ ę°ě§ ëśíěźëĄ ëëě´ ëęťëĽź 츥ě íěë¤. ë°ŠěŹëިě ě ë죟ě 미ě¸íę´ë°ë ë° ě ëë´ íę´ë°ë, íęˇ ě ë죟ě 미ě¸íę´ě´ě íę´ë°ë뼟 츥ě íěěźëŠ°, ě ë죟ě 미ě¸íę´ě´ě íę´ë°ë ëí ë´ěĽë OCTA íëĄęˇ¸ë¨ě ěë ëśěě ë°ëź ëśíě ëëě´ ě¸ëśě ěźëĄ ëśěíěë¤. 본 ě°ęľŹě ěŹěŠë OCTA ěĽëšë ë´ę˛˝ęłë§ ěë 3 ÎźmëĄëśí° ë´ë§ě츾 ěë 15 Îźmęšě§ëĽź í츾모ě¸íę´ě´ěźëĄ, ë´ë§ě츾 15 Îźměě 70 Îźmęšě§ëĽź ěŹě¸ľëިě¸íę´ě´ěźëĄ 츾ě ëëěë¤[15]. íŠë°ëśě í츾모ě¸íę´ě´ ë° ěŹě¸ľëިě¸íę´ě´ě íę´ ë°ëë ě 체 íęˇ , ě¤ěŹě(íŠë°ëś ě¤ěŹěźëĄëśí° ě§ëŚ 1 mm ě´ë´), ě¤ěŹěëśęˇź(1-3 mm) ë° ě¤ěŹě죟ě(3-6 mm)ëĄ ëëě´ ëšęľíěë¤.
ëí NAIONě´ ě´íë ë ë§ě ëěěźëĄ íěŹ ě ë죟ě ë§ë§ě 경ěŹě 츾ëęťě íę´ë°ëě ę°ě í´ëśęľŹěĄ°ě ěë Ľęłźě ěę´ę´ęłëĽź ěěëł´ěë¤. 꾏íëł ě¸ëś ëśěěě ě ë죟ě ěěě 꾏íëłëĄ ëë ë íšě§ě ěźëĄ ěěźę˛ěŹěě ë°ěěźę˛°ěě´ ěźě´ë늴ě, OCTAěě ě´ě ëěëë ěě 경ě ëëśě ííě´ ę´ě°°ëë 경ě°ëĄ ěě 경ě ëě ííě´ ę´ě°°ëë ě´ëśëŠ´ęłź ííě´ ę´ě°°ëě§ ěë ě´ëśëŠ´ě ëëě´ ëśěíěë¤.
íľęłíě ëśěě SPSS ver. 25.0 (IBM Corp., Armonk, NY, USA)ě ě´ěŠíěęł , ěě˝ě¨ ëśí¸ěě ę˛ě ě íľí´ ě´íë ëęłź ë°ë ëě ëšęľíěŹ ë§ë§ęłź íŠë°ě 꾏쥰ě ëłí뼟 ëśěíěë¤. Spearman ěę´ëśěě íľí´ ě´íë ëěě ë§ë§ě 경ěŹě 츾ëęťě íę´ë°ëěě ę´ęłëĽź íě
íěěźëŠ°, ěë Ľęłź íę´ë°ë, ë§ë§ě 경ěŹě 츾ëęť ěŹě´ě ěę´ěąě ííě´ ę´ě°°ëěëě§ ěŹëśě ë°ëź ëë ę° ě´ëśëŠ´ě ëěěźëĄ ëśěíěë¤. 모ë íľęłě ě¸ ě ěěąě p-valueę° 0.05 ě´íěź ę˛˝ě°ëĄ ě ěíěë¤.
í ëě ëšë맼ěźěą ěííěě 경ëłěŚěźëĄ ě§ë¨ë°ě íě 25ëŞ
ě´ ëěě íŹí¨ëěë¤. ě´ ě¤ ë¨ěąě 11ëŞ
, ěŹěąě 14ëŞ
ě´ěęł , íěě íęˇ ě°ë šě 65.92 Âą 9.37ě¸ěë¤. ííě´ ę´ě°°ëë ě ëěěě ëśëŠ´ě ě ě´ëśëŠ´ 16ëŞ
, ěë ě´ëśëŠ´ 4ëŞ
, ě 체 ěěě¸ ę˛˝ě°ę° 5ëŞ
ě´ěë¤. í ëŞ
ě ě ě¸í íěěě ëšë¨, ęł íě, ęł ě§ě§íěŚ, ěŹíę´ęł ě§íęłź ę°ě 기ě ě§íě ę°ě§ęł ěěë¤. ě´ě¸ě 기본ě ě¸ íšě§ě Table 1ęłź ę°ěë¤.
ëšë맼ěźěą ěííěě 경ëłěŚě´ ě´íë ëęłź ě´íëě§ ěě ëě ę°ę° ëšęľíěě ë, ěľëęľě ěë Ľ(logarithm of the minimum angle of resolution, logMAR)ě ě´íë ëě´ 0.42 Âą 0.58ëĄ ě´íëě§ ěě ëě 0.08 Âą 0.09ě ëší´ ě ěíę˛ ëëš´ë¤(p=0.011). ěěźę˛ěŹ 결곟ěě íęˇ í¸ě°¨ë ě´íë ëěě -11.61 Âą 8.12 dB, ě´íëě§ ěě ëěěě -2.98 Âą 3.50 dBě ëší´ ě ěíę˛ ëëš´ěźëŠ°, í¨í´ íě¤í¸ě°¨ ë° ěěź ě§í ëí ě´íëě§ ěě ëęłź ëšęľíěŹ ëě ěěšëĽź ëł´ěë¤(모ë p<0.001). OCTAę˛ěŹ 결곟ěě íęˇ ě ë죟ě ë§ë§ě 경ěŹě 츾ëęťëĽź ëšęľíěě ë, ě´íë ëěě 197.32 Âą 60.52 ÎźmëĄ ě´íëě§ ěě ëěě 108.52 Âą 13.27 Îźmě ëší´ ëęşźě ë¤(p<0.001). íęˇ ě ë죟ě 모ě¸íę´ě´ě íę´ë°ëë ě´íë ëěě 45.63% Âą 7.60%ëĄ, ě´íëě§ ěě ëěě 51.44% Âą 3.40%ě ëší´ ëŽěë¤(p=0.001). íŠë°ëśě í츾모ě¸íę´ě´ě íęˇ íę´ë°ëë ě´íë ëěě 44.86% Âą 5.26%ě´ęł ě´íëě§ ěě ëěě 47.82% Âą 2.99%ëĄ íę´ë°ëę° ëŽěěźë(p=0.003), íŠë°ëśě ěŹě¸ľëިě¸íę´ě´ě íęˇ íę´ë°ëë ę°ę° 45.04% Âą 6.43%, 46.08% Âą 4.29%ëĄ ě ěí ě°¨ě´ę° ěěë¤(p=0.520) (Table 2).
ëšë맼ěźěą ěííě 경ëłěŚě´ ě´íë ëë§ě ëěěźëĄ íę´ë°ëě ě ë죟ě ë§ë§ě 경ěŹě 츾ëęťěě ě°ę´ěąě ěě보기 ěí´ Spearman ěę´ëśěě ěííěęł ëŞ¨ë 꾏íěě íľęłě ě ěěąě ë§ěĄąíě§ ëŞťíë¤. ęˇ¸ëŚŹęł ě§ë¨ ëšěě ěľëęľě ěë Ľęłź í´ëś 꾏쥰ěě ě°ę´ěąě ěě보기 ěí Spearman ěę´ëśěěě íęˇ ě ë죟ě íę´ë°ë ë° ë§ë§ě 경ěŹě 츾ëęťě ěľëęľě ěë Ľ ěŹě´ě ěę´ěąě ěěë¤.
ě 체 ěěě ííě´ ę´ě°°ë 5ëŞ
ě ě ě¸í ě´ 20ëŞ
ě ëěěźëĄ ííě´ ę´ě°°ë ě´ëśëŠ´ęłź ꡸ë ě§ ěě ě´ëśëŠ´ěźëĄ ëë ě¸ëś ëśěěě ííě´ ę´ě°°ë ě´ëśëŠ´ě íę´ë°ëě ěľëęľě ěë Ľě ěę´ęłěë -0.608ëĄ íľęłě ěźëĄ ě ěí ěě ěę´ę´ęłę° ěěë¤(p=0.001) (Table 3).
본 ě°ęľŹë í ë ëšë맼ěźěą ěííěě 경ëłěŚ íěěě ę¸ěąę¸°ě ě꾏 ë´ ë§ë§ě 경츾ëęťě íę´ë°ë뼟 ě ëě ěźëĄ ëśěíěęł , ë°ëěě ëší´ ě ěí ě°¨ě´ę° ěěě íě¸íěë¤. ęˇ¸ëŚŹęł ě´ëŹí í´ëśíě ëłíę° ěë Ľě ěíĽě 미ěšëě§ ëśěíěě ë ííě´ ě´íëě§ ěě ě´ëśëŠ´ě íę´ë°ëę° ëěěëĄ ě´ě§ ěë Ľě´ ě˘ë¤ë 결곟뼟 íě¸íěë¤.
OCTAë 쥰ěě 뼟 ěŹěŠíě§ ěěźëŠ´ě ë§ë§íę´ě 꾏쥰ě ë°ë ëąě ëśěí ě ěë¤ë ěĽě ě´ ěë 기ęłëĄě¨, 2014ë
ě´í ěěě ěŠě´ íë°í´ě§ě ë°ëź[16] ëšë맼ěźěą ěííěě 경ëłěŚě ííěą ěě 경꾏쥰뼟 OCTAëĄ ëśěí ě°ęľŹë¤ě´ ë¤ě ëł´ęł ëěęł [5-12] Ling et al [5]ě ë쥰꾰곟 ě§íě´ ěë ëě ëšęľí 기쥴ě OCTA ě°ęľŹ 14í¸ě ëŠíëśěí기ë íěë¤.
íí¸ ěě 경ě íěĄęłľę¸ě 짧ěë¤ěŹëŞ¨ě˛´ë맼ě ëśě§ę° Zinn-Haller ëë§Ľęł ëŚŹëĽź ě´ëŁ¨ëŠ° ěí경ě ě 기ě¤ěźëĄ ěěëëĄ ëëě´ ęłľę¸ë기 ë돸ě íěě ěě ę˛ěŹěě ěě 경ě ëśëśě ě¸ ííęłź í¨ęť ě´ě ěěíë ěíěěźę˛°ěě´ ě죟 ę´ě°°ëęł , ěŁźëĄ ěë쪽 ěíěěźę˛°ěě´ ë ííë¤ęł ěë ¤ě ¸ ěë¤[1]. ě´ë ę˛ ë°ě ëšëě ě°¨ě´ę° ěęł , ě°ęľŹ ëśěě í¸ě´ëĽź ěí´ ëëśëśě ě°ęľŹěě 꾏íëł ě¸ëś ëśěě ěí츥 íšě ěŹëśëŠ´ěźëĄ ëëě´ ëśěíěë¤. íě§ë§ ě ěë¤ě ě§íě ëłíě댏뼟 ę°ěíęł , Figure 1ěě ě ěí ë°ě ę°ě´ í츥ëśě íę´ęł 댏ě ë°ëłí ëšë맼ěźěą ěííěě 경ëłěŚ íěě íí ě§í뼟 ě미 ěę˛ ëśěí기 ěí´ěë ěě 경ě ëěě ííě´ ę´ě°°ëë ě´ëśëŠ´ęłź íëĽę° ě ě§ëë ě´ëśëŠ´ěźëĄ ëë ě°ęľŹ ě¤ęł ëí ě¤ěíë¤ęł ěę°íěë¤.
ë°ëźě 본 ě°ęľŹë ě¤ęłíë ęłźě ěě ě´íěęłź ë°ëěě 꾏íëł ě¸ëś ëšęľěěë ě´íěě ííě´ ę´ě°°ëë 꾏íě ëěí ë°ëěě ě ě í 꾏íě ě§ě í기 ě´ë ¤ě´ íęłę° ěě기 ë돸ě ëśëě´ ę¸°ěĄ´ ě°ęľŹě ë§ě°Źę°ě§ëĄ ěŹëśëŠ´ěźëĄ ëëě´ ëśěíěě§ë§ ě´íě ë§ě ëěěźëĄ íěě ëěë ííě´ ę´ě°°ëë ě´ëśëŠ´ęłź ꡸ë ě§ ěě ě´ëśëŠ´ěźëĄ ëëě´ ëšęľí ę˛ě 본 ě°ęľŹě ě미뼟 ëë¤.
먟ě 첍 ë˛ě§¸ ě°ęľŹ ę˛°ęłźëĄ ëłě´ ě´íë ëě ěě 경ě ëíę´ë°ëę° ë°ëěě ëší´ ě ěíę˛ ëŽěęł , 모ë ëśíě ě ë죟ě ě 경ěŹě 츾ëęťę° ěŚę°í¨ě íě¸íěëë° ě´ë ěě 경ě ííęłź ꡸ě ë°ëĽ¸ ě 경ěŹě 츾ě ëśě˘
ěźëĄ ě¸í ę˛ěźëĄ ěę°ëë¤. ë쥰ě íšě ěě 경ëśě˘
ě ëë°í ě 경ěęłź ě§íęłź ëšęľíěŹ ëšë맼ěźěą ěííěě 경ëłěŚ íěěě ěě 경ě ëëśě íě í íę´ë°ëě ę°ěë ě´ëŻ¸ ë¤ěě ě°ęľŹěě ëł´ęł ë ë° ěęł [5-12]. 본 ě°ęľŹ 결곟 ëí 기쥴 ě°ęľŹ 결곟ě ěźěšíë¤. ęˇ¸ëŚŹęł OCTA 기ęłëĽź ě´ěŠíěŹ ëšěš¨ěľě ěźëĄ íí ěŹëśëĽź íě¸í ě ěë¤ë ě ě ě´ę¸° ěě 경 ëśě˘
ě´ ę´ě°°ë ě ěë ěě 경ěź, ěě 경ě ëë루ě íšě ě ëëśě˘
ęłź ě´ ě§íě ę°ëłě ě´ ë ě ě기 ë돸ě[17,18] OCTAě ěěě ě´ěŠě ę°ěšëĽź íě¸í ě ěë¤. Ling et al [5]ě ëŠíëśěěěë ë쥰꾰곟 ëšęľíěŹ ě´íęľ°ěě ě ë죟ě ě 경ěŹě 츾ě ě ěí ëęť ę°ě뼟 ëł´ęł íěě§ë§ Ling et al [5]ě ě°ęľŹë ë§ěąę¸°ě ëšë맼ěźěą ěííěě 경ëłěŚ íěě OCTAě ěěšę° ë¤ě íŹí¨ëě기 ë돸ě ę¸ěąę¸°ě íě뼟 ëěěźëĄ í ě ěë¤ě ě°ęľŹě ěë°ë 결곟뼟 ëíë¸ ę˛ěźëĄ ěę°ëë¤.
ë ë˛ě§¸ëĄ íŠë°ëś íę´ë°ë뼟 ë°ëěęłź ëšęľíěě ë íęˇ í츾모ě¸íę´ě´ ë°ëë ě ěíę˛ ě´íěěě ëŽěěźë íęˇ ěŹě¸ľëިě¸íę´ě´ ë°ëë ě ěí ě°¨ě´ę° ěěë¤(Fig. 2). 기쥴ě ě°ęľŹ ě¤ Augstburger et al [6]ě íě 21ěě íę´ë°ë뼟 ěĽę¸°ę°ě ěśě íěě ë, ę¸ěąę¸°ě ě ë죟ě 모ě¸íę´ě´ęłź íŠë°ëśě í츾모ě¸íę´ě´ ë°ëë ë쥰꾰곟 ëšęľíěŹ ě ěíę˛ ëŽěěźë ěŹě¸ľëިě¸íę´ě´ ë°ëë ë ęľ° ę° ě°¨ě´ę° ěěë¤ęł íěŹ ëł¸ ě°ęľŹě ěěíë 결곟뼟 ëł´ęł íěë¤. ęˇ¸ëŚŹęł ě´ë ę˛ ëšë맼ěźěą ěííěě 경ëłěŚěě OCTAě íę´ë°ë ę°ěę° ëíëë 기ě ě ëšë¨, ęł íěęłź ę°ě ě ě ě§íě ěíĽěźëĄ ě¸í ë¤ěŹëŞ¨ě˛´ ë맼ě ě ę´ëĽ íšě ěě 경ě ëśě˘
ěźëĄ ě¸í íę´ě ě§ě ě ě¸ ěë°ëżë§ ěëëź íëě ě¸ ëěŹěĄ°ě§ě¸ ë§ë§ě 경ěŹě 츾ě 기ëĽě í ëí ě ë°ě ěźëĄ ěěŠí기ě ěě 경ě ëëś íę´ęłź íŠë°ëś í츾모ě¸íę´ě´ě ë°ëę° ëěě ę°ěíë ę˛ěźëĄ ěśě íěë¤[6]. Aghsaei Fard et al [9] ëí ëšë맼ěźěą ěííěě 경ëłěŚěě íŠë°ëś í츾모ě¸íę´ě´ ë°ëë ę°ěíěě§ë§ ěŹě¸ľëިě¸íę´ě´ ë°ëë 보쥴ëë¤ë 결곟뼟 ëł´ęł í늴ě ě´ ě§íě´ ë
šë´ěĽěą ěě 경ëłěŚęłźë ë¤ëĽ¸ 기ě ěźëĄ ë°ëłíë¤ęł ěśě íěë¤. íě§ë§ Liu et al [8]ě ëł´ęł ě ę°ě´ ě§íęľ°ěě ě ěí íŠë°ëś íę´ë°ëě ę°ěë ěë¤ë ě°ęľŹ 결곟ë ě기ě ě´ę˛Źě´ ěë ëśëśě´ęł íě ě°ęľŹę° íěíë¤.
ě¸ ë˛ě§¸ëĄ ě´íě ë§ě ëěěźëĄ ę°ěí íę´ë°ëě ěŚę°í ě ë죟ě ë§ë§ě 경ěŹě 츾 ěŹě´ě ěę´ę´ęłëĽź ěěëł´ěě ë ě ěí ěę´ěąě ěěęł , ííě´ ę´ě°°ëë ě´ëśëŠ´ęłź ꡸ë ě§ ěě ě´ëśëŠ´ěźëĄ ëëě´ ě¸ëś ëśěíěŹë ě ěěąě ë§ěĄąíě§ ěěë¤. Augstburger et al [6]ě ě°ęľŹěěë ę¸ěąę¸°ěě ë ěě ěŹě´ě ě ěí ěę´ě ěë¤ęł íěŹ ëł¸ ě°ęľŹ 결곟ě ěźěšíěëë° íí¸ ë§ěąę¸°ě íěë§ě ëěěźëĄ íěě ëěë íę´ë°ëę° ëŽěěëĄ ě ë죟ě ě 경ěŹě 츾ě ëęťë ě ěíę˛ ěë¤ë 결곟뼟 ëł´ęł í ě°ęľŹë ë¤ě ěě´ě[6,19,20] ě§íě ë°ëł ě´í ěę°ě´ ě§ë¨ě ë°ëź íę´ë°ëę° ě 경ěŹě 츾ě ëęťě ěíĽě ëŻ¸ěš ěë ěěě ěę°í´ ëłź ě ěë¤.
ë§ě§ë§ěźëĄ ě´ę¸° ěë Ľě ěíĽě 죟ë í´ëśíě ěě뼟 ěěëł´ěě ë ííě´ ę´ě°°ëě§ ěě ě´ëśëŠ´ě íę´ë°ëę° ëěěëĄ ě´ę¸° ěë Ľě´ ě˘ě 결곟뼟 ëł´ěë¤. OCTA뼟 ě´ěŠíěŹ ě ë죟ě ë§ë§íę´ęłź 모ě¸íę´ě íí뼟 ę´ě°°íęł ě 기ëĽęłźě ę´ęłëĽź ëśěí Gaier et al [13]ě ę¸ěąę¸° 7ëŞ
ě íěěě 죟ě ë§ë§íę´ě 기ëĽě´ ë¨ě´ě ¸ ěë ë°ëŠ´ íëĽ íëŚě´ ę´ě°°ëë í츾 모ě¸íę´ě íěĽëě´ ěë¤ęł í늴ě 모ě¸íę´ě´ íěĽë ě´ě ë ěě 경 ěśěě ííě ëł´ěí기 ěí ěę° ěĄ°ě 기ě ë돸ě´ëźęł íěë¤. ëí íëĽę° ě ě§ëęł íěĽëě´ ěë í츾모ě¸íę´ë°ëę° ëŽěěëĄ ěěźę˛°ěě ěŹíęł ěë Ľě ě ěíę˛ ëŽë¤ęł ëł´ęł í ë° ěë¤. ě´ě ę°ě´ íëĽę° ě ě§ëë ëśëśě´ ě기ëĽęłź ę´ęłę° ěë¤ë Gaier et al [13]ě ëł´ęł ë 본 ě°ęľŹ 결곟ě ěěíë¤. ęˇ¸ëŚŹęł ę¸ěąę¸°ěě ííëĄ ě¸í´ ě´ëŻ¸ ěěě´ ë°ěí ěě 경 ěśěëł´ë¤ë íëĽę° ě ě§ëęł ěë ëśëśě ěśě 기ëĽě´ ě´ę¸° ěë Ľě 결ě íë ěěëĄ ěěŠí기 ë돸ěźëĄ ěę°ëë¤.
본 ě°ęľŹë ëŞ ę°ě§ íęłě ě´ ěë¤. 먟ě ě§íě ë°ëłëĽ ě´ ëŽě íšěąěźëĄ ě¸í´[5] ěěě íě ë§ě ëěěźëĄ íěŹ ě돴 ę¸°ëĄ ëśěěźëĄ ě§íë ě°ęľŹě´ęł , ëšë맼ěźěą ěííě 경ëłěŚěźëĄ ě¸í ěě 경ě ëě ëśě˘
ě´ ę¸ěąę¸°ëĽź ęą°ěł ë§ěąěźëĄ ě§íëë ęłźě ěě íę´ë°ëě ëłí ěŹëśëĽź íě¸íě§ ëŞťí ííĽě ë¨ëŠ´ ě°ęľŹëźë ě ě´ ěë¤. ęˇ¸ëŚŹęł OCTAě íę´ ëśěě ěě´ě í° íę´ě ë°°ě íě§ ëŞťíęł ě 체 íę´ë°ëę°ě ëśěě ě´ěŠíěěźëŠ° íę´ë°ë ëśěěě ëšë맼ěźěą ě ííěě 경ëłěŚě íšě§ě¸ ę¸ěąę¸° ěě 경 ëśě˘
ěźëĄ ě¸í´ íę´ë°ëę° ě íę°ëěě ę°ëĽěąë ěë¤. ëí ě꾏 ë´ íę´ ë°ëë ëšë¨, ęł íěęłź ę°ě ě ě íę´ ě§íě ěŹëśě ěíĽě ë°ëë¤ë ëł´ęł ę° ěëë°[21] ëěě íŹí¨ë íěę° ěęł ěë ě ě ě§íě 경ě¤ě íľě íě§ ëŞťí´ě íę´ë°ë 결곟ě ěíĽě 미쳤ě ę°ëĽěąě´ ěë¤. ě´ëŹí íęłě ě ëł´ěíęł ěśí ëęˇëިě íě뼟 ëěěźëĄ íěŹ ěę°ě ë°ëĽ¸ íę´ ë°ëě ëłíě ě기ëĽě ę´ęłě ëí ěśę°ě ě¸ ě°ęľŹę° ě§íëë¤ëŠ´ ěěě ěźëĄ ěëŻ¸ę° ěě ę˛ěźëĄ ěę°ëë¤.
ę˛°ëĄ ě ěźëĄ í ëě ëšë맼ěźěą ěííě 경ëłěŚ íěěě ě§ë¨ ëšě ěě 경ě ë죟ěě íëĽę° 보쥴ëë ě´ëśëŠ´ě íę´ë°ëę° ëěěëĄ ě´ę¸° ěë Ľě´ ëě 결곟뼟 ëł´ěě ë, ě´ë ííëĄ ě¸í í´ëśíě ëłíę° ě기ëĽě íě ěíĽě 미ěšë¤ë 기쥴ě ëł´ęł [20] ě¸ěë íëĽę° 보쥴ëě´ ę¸°ëĽě ě ě§íë ěě¸íŹ ěśěě íë ëí ě기ëĽě ę¸ě ě ě¸ ěíĽě ě¤ë¤ęł ěę°í ě ěë¤.
Figure 1.
Clinical findings of the left eye, of a 64-year-old acute phase NAION patients. (A) Fundus photograph showed optic disc edema especially in inferior margin. (B) Humphery visual field test showed superior altitudinal field defect corresponding to the defect of inferior margin at fundus photograph. (C) Inferior peripapillary RNFL thickness were noted. (D) Focal loss of inferior peripapillary vessel was showed in OCTA (yellow arrows). NAION = nonarteritic anterior ischemic optic neuropathy; RNFL = retinal nerve fiber layer; OCTA = optical coherence tomography angiography.
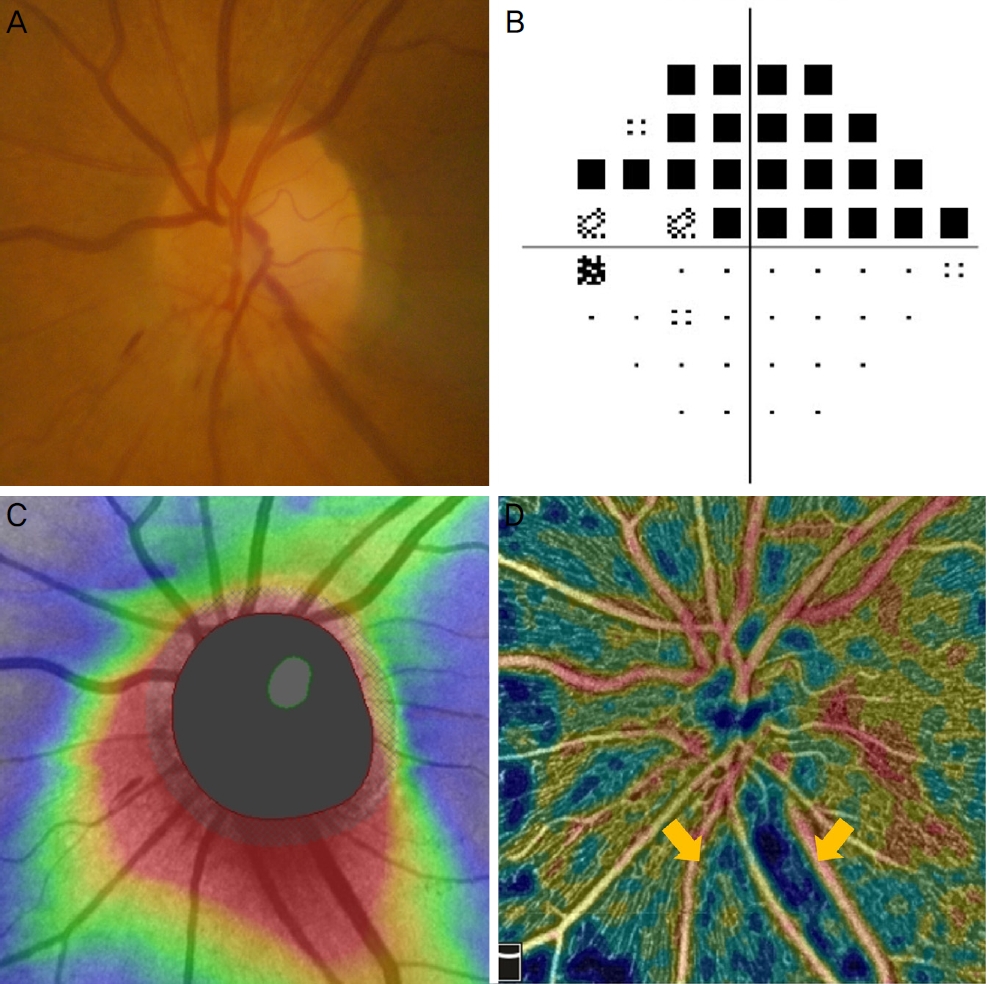
Figure 2.
Representative case image of a 61-year-old female patient with right non-arteritic anterior ischemic optic neuropathy (NAION). Optical coherence tomography angiography (OCTA) color-coded scans illustrating the acquisition of various parameters. Vessel densities of radial peripapillary capillary (RPC), superficial capillary plexus (SCP), and deep capillary plexus (DCP) w ere compared between the NAION eye and contralateral eye. VD = vessel density.
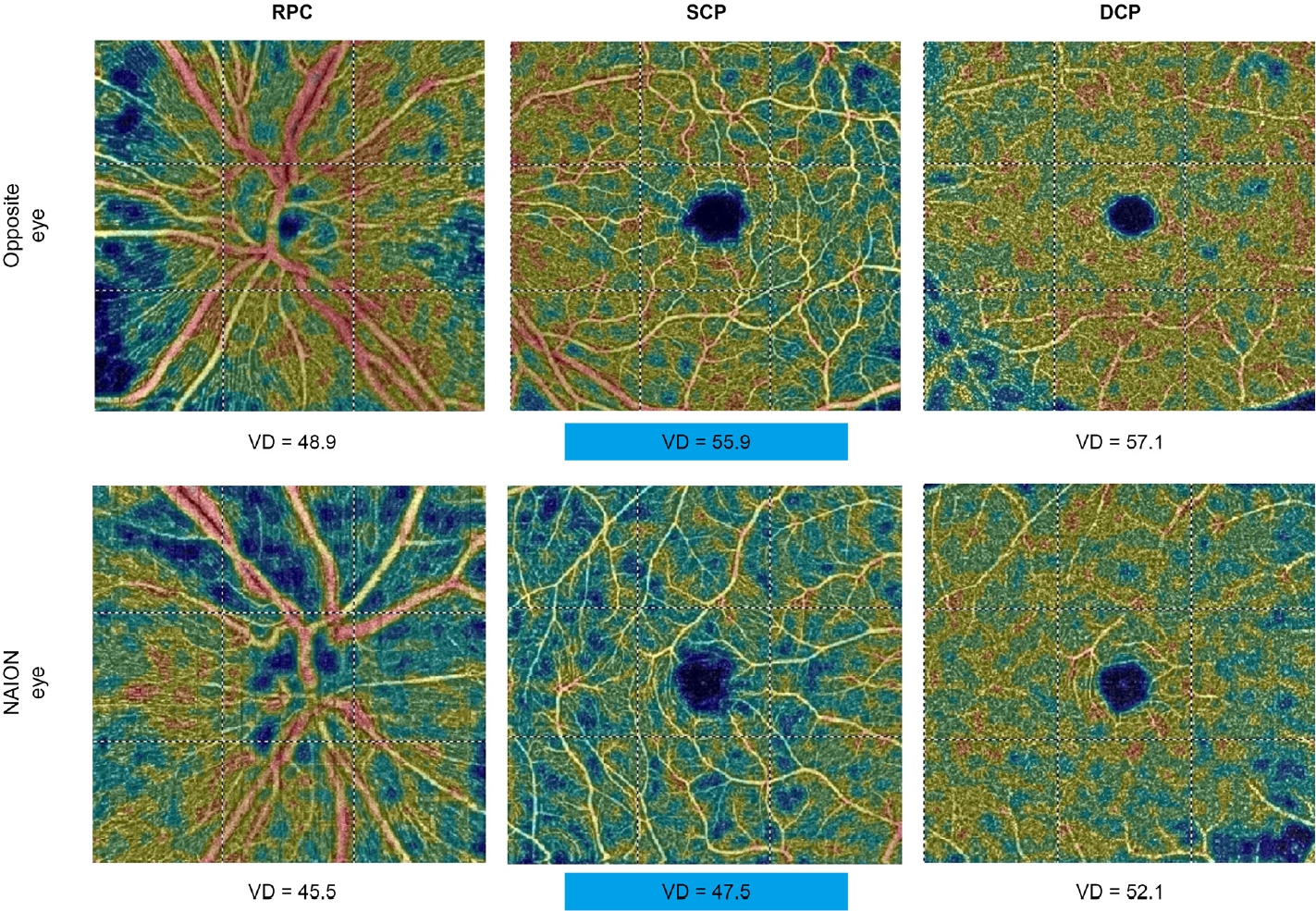
Table 1.
Baseline characteristics of patients with nonarteritic anterior ischemic optic neuropathy
Table 2.
Comparison of optic disc and fovea structure between affected eye and unaffected eye
| Affected eye | Unaffected eye | p-value* | |
|---|---|---|---|
| BCVA at initial visit (logMAR) | 0.42 Âą 0.58 | 0.08 Âą 0.09 | 0.011 |
| Refractive error (diopters, SE) | -0.44 Âą 1.46 | -0.15 Âą 1.51 | 0.355 |
| Intraocular pressure (mmHg) | 12.02 Âą 2.91 | 12.16 Âą 2.48 | 0.599 |
| Value of Ishihara color plate tests | 11.16 Âą 4.96 | 14.28 Âą 0.89 | 0.004 |
| Index of visual field test | |||
| âMD (dB) | -11.61 Âą 8.12 | -2.98 Âą 3.50 | <0.001 |
| âPSD | 9.10 Âą 4.24 | 3.61 Âą 2.35 | <0.001 |
| âVFI (%) | 67.36 Âą 26.99 | 94.23 Âą 7.48 | <0.001 |
| pRNFL thickness (Âľm) | |||
| âAverage | 197.32 Âą 60.52 | 108.52 Âą 13.27 | <0.001 |
| âSuperior hemi | 229.08 Âą 99.91 | 108.52 Âą 13.2 | <0.001 |
| âInferior hemi | 164.32 Âą 57.74 | 107.96 Âą 13.64 | <0.001 |
| âSuperior quadrant | 246.12 Âą 105.95 | 130.96 Âą 19.74 | <0.001 |
| âInferior quadrant | 211.52 Âą 86.81 | 141.68 Âą 21.96 | <0.001 |
| âNasal quadrant | 184.36 Âą 73.64 | 91.44 Âą 13.34 | <0.001 |
| âTemporal quadrant | 144.04 Âą 66.77 | 73.76 Âą 10.19 | <0.001 |
| Whole image RPC density (%) | 43.13 Âą 5.76 | 48.53 Âą 2.83 | <0.001 |
| Inside disc vessel density (%) | 43.02 Âą 7.31 | 46.63 Âą 5.28 | 0.067 |
| Average peripapillary vessel density (%) | 45.63 Âą 7.60 | 51.44 Âą 3.40 | 0.001 |
| âSuperior hemi | 42.84 Âą 8.57 | 51.17 Âą 3.41 | <0.001 |
| âInferior hemi | 47.68 Âą 9.85 | 51.46 Âą 4.16 | 0.187 |
| âSuperior quadrant | 41.18 Âą 9.26 | 51.48 Âą 4.03 | <0.001 |
| âInferior quadrant | 50.01 Âą 10.56 | 54.00 Âą 5.04 | 0.117 |
| âNasal quadrant | 42.04 Âą 7.68 | 49.60 Âą 5.90 | <0.001 |
| âTemporal quadrant | 46.88 Âą 8.65 | 51.68 Âą 5.25 | 0.028 |
| Average macular SCP vessel density (%) | 44.86 Âą 5.26 | 47.82 Âą 2.99 | 0.003 |
| âFovea | 18.29 Âą 6.87 | 19.24 Âą 4.67 | 0.230 |
| âParafovea | 47.27 Âą 6.42 | 50.08 Âą 4.02 | 0.051 |
| âPerifovea | 45.50 Âą 5.58 | 48.67 Âą 2.74 | 0.002 |
| Average macular DCP vessel density (%) | 45.04 Âą 6.43 | 46.08 Âą 4.29 | 0.520 |
| âFovea | 32.97 Âą 8.48 | 33.47 Âą 5.75 | 0.706 |
| âParafovea | 50.69 Âą 5.29 | 51.69 Âą 3.75 | 0.443 |
| âPerifovea | 45.57 Âą 6.96 | 47.28 Âą 4.76 | 0.382 |
Values are presented as mean Âą standard deviation.
BCVA = best corrected visual acuity; logMAR = logarithm of the minimum angle of resolution; SE = spherical equivalent; MD = mean deviation; PSD = pattern standard deviation; VFI = visual field index; pRNFL = peripapillary retinal nerve fiber layer; RPC = radial peripapillary capillary; SCP = superficial capillary plexus; DCP = deep capillary plexus.
Table 3.
Correlations between visual acuity and optic disc structure of affected eye (n = 20)
REFERENCES
1) Kim SJ. Ischemic optic neuropathy. In: Jang BL, ed. Neuro-Ophthalmology, 3rd ed. Seoul: Ilchokak Publishing Co., 2017;237-9.
2) Hayreh SS, Joos KM, Podhajsky PA, Long CR. Systemic diseases associated with nonarteritic anterior ischemic optic neuropathy. Am J Ophthalmol 1994;118:766-80.


3) Park WC, Chang BL. Clinical features of anterior ischemic optic neuropathy. J Korean Ophthalmol Soc 2003;44:144-9.
4) Akil H, Falavarjani KG, Sadda SR, Sadun AA. Optical coherence tomography angiography of the optic disc; an overview. J Ophthalmic Vis Res 2017;12:98-105.



5) Ling L, Ji K, Xie L, et al. Optical coherence tomography angiography assessment of the peripapillary vessel density and structure in patients with nonarteritic anterior ischemic optic neuropathy: a meta-analysis. Biomed Res Int 2020;2020:1359120.




6) Augstburger E, Ballino A, Keilani C, et al. Follow-up of nonarteritic anterior ischemic optic neuropathy with optical coherence tomography angiography. Invest Ophthalmol Vis Sci 2021;62:42.



7) Rougier MB, Delyfer MN, Korobelnik JF. OCT angiography of acute non-arteritic anterior ischemic optic neuropathy. J Fr Ophtalmol 2017;40:102-9.


8) Liu CH, Kao LY, Sun MH, et al. Retinal vessel density in optical coherence tomography angiography in optic atrophy after nonarteritic anterior ischemic optic neuropathy. J Ophthalmol 2017;2017:9632647.




9) Aghsaei Fard M, Ghahvechian H, Subramanian PS. Follow-up of nonarteritic anterior ischemic optic neuropathy with optical coherence tomography angiography. J Neuroophthalmol 2021;41:e433-9.


10) Moon Y, Song MK, Shin JW, Lim HT. Optical coherence tomography angiography characteristics and predictors of visual outcomes in patients with acute and chronic nonarteritic anterior ischemic optic neuropathy. J Neuroophthalmol 2021;41:e440-50.


11) Al-Nashar HY, Hemeda S. Assessment of peripapillary vessel density in acute non-arteritic anterior ischemic optic neuropathy. Int Ophthalmol 2020;40:1269-76.



12) Sharma S, Ang M, Najjar RP, et al. Optical coherence tomography angiography in acute non-arteritic anterior ischaemic optic neuropathy. Br J Ophthalmol 2017;101:1045-51.


13) Gaier ED, Wang M, Gilbert AL, et al. Quantitative analysis of optical coherence tomographic angiography (OCT-A) in patients with non-arteritic anterior ischemic optic neuropathy (NAION) corresponds to visual function. PLoS One 2018;13:e0199793.



14) Contreras I, Noval S, Rebolleda G, MuĂąoz-Negrete FJ. Follow-up of nonarteritic anterior ischemic optic neuropathy with optical coherence tomography. Ophthalmology 2007;114:2338-44.


15) Shin YU, Lee DE, Kang MH, et al. Optical coherence tomography angiography analysis of changes in the retina and the choroid after haemodialysis. Sci Rep 2018;8:17184.




16) Spaide RF, Fujimoto JG, Waheed NK, et al. Optical coherence tomography angiography. Prog Retin Eye Res 2018;64:1-55.


17) Fard MA, Jalili J, Sahraiyan A, et al. optical coherence tomography angiography in optic disc swelling. Am J Ophthalmol 2018;191:116-23.


18) Abri Aghdam K, Ashraf Khorasani M, Soltan Sanjari M, et al. Optical coherence tomography angiography features of optic nerve head drusen and nonarteritic anterior ischemic optic neuropathy. Can J Ophthalmol 2019;54:495-500.


19) Rebolleda G, DĂez-Ălvarez L, GarcĂa MarĂn Y, et al. Reduction of peripapillary vessel density by optical coherence tomography angiography from the acute to the atrophic stage in non-arteritic anterior ischaemic optic neuropathy. Ophthalmologica 2018;240:191-9.







 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




