 |
 |
| J Korean Ophthalmol Soc > Volume 63(12); 2022 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
2016ļģä 12ņøöļČĆĒä░ 2021ļģä 6ņøöĻ╣īņ¦Ć ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØä ņ▓śņØī ņŗ£Ē¢ēļ░øņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×É 36ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ļČäņäØņØä ĒĢśņśĆļŗż. ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢ┤ ņĖĪņĀĢļÉ£ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś ņłĀ ņĀä, ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ļ│ĆĒÖöļź╝ ļ╣äĻĄÉ ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņłĀ ņĀä ĒÅēĻĘĀ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śļŖö Ļ░üĻ░ü 214.28 ┬▒ 80.00 ╬╝m, 307.89 ┬▒ 96.30 ╬╝m, 525.64 ┬▒ 133.24 ╬╝mņśĆņ£╝ļ®░, ņłĀ Ēøä 1Ļ░£ņøöņŚÉ 199.56 ┬▒ 75.76 ╬╝m, 290.36 ┬▒ 94.63 ╬╝m, 409.72 ┬▒ 98.45 ╬╝mļĪ£ ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(Ļ░üĻ░üp=0.001,p<0.001,p<0.001). ņłĀ ņĀä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śļŖö ņłĀ Ēøä 1Ļ░£ņøö ļÆż ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłņ£╝ļ®░, ņłĀ ņĀä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śĻ░Ć ļæÉĻ║╝ņÜĖņłśļĪØ ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ ņóŗņĢśļŗż(Žü=-0.342,p=0.041).
Ļ▓░ļĪĀ
ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ņ▓½ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä 1Ļ░£ņøöņ¦Ė Ļ┤Ćņ░░ĒĢśņśĆņØä ļĢī, ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ¬©ļæÉ ņ£ĀņØśĒĢ£ Ļ░ÉņåīĻ░Ć ņ׳ņŚłņ£╝ļ®░, ņłĀ ņĀä ļæÉĻ║╝ņÜ┤ ĒĢĀļ¤¼ņĖĄļæÉĻ╗śļŖö ņóŗņØĆ ļŗ©ĻĖ░ņĀü ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņśłņĖĪņØĖņ×ÉĻ░Ć ļÉĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ABSTRACT
Purpose
To analyze the changes in subfoveal Haller layer thickness (SFHT), subfoveal choroidal thickness (SFCT), and central macular thickness (CMT) after intravitreal aflibercept injection.
Methods
This was a retrospective analysis of 36 diabetic macular edema patients who underwent intravitreal aflibercept injection between December 2016 and June 2021. The SFHT, SFCT, and CMT before and 1 month after the injection were compared using spectral-domain optical coherence tomography.
Results
Mean baseline SFHT, SFCT, and CMT were 214.28 ┬▒ 80.00 ╬╝m, 307.89 ┬▒ 96.30 ╬╝m, and 525.64 ┬▒ 133.24 ╬╝m, which were reduced 1 month after the injection to 199.56 ┬▒ 75.76 ╬╝m, 290.36 ┬▒ 94.63 ╬╝m, and 409.72 ┬▒ 98.45 ╬╝m, respectively (p = 0.001, < 0.001, and < 0.001, respectively). There was a significant correlation between baseline SFHT and 1-month post-injection best-corrected visual acuity (BCVA), while thicker subfoveal Haller layers before the injection were associated with better BCVA after the injection (Žü = ŌłÆ0.342;p = 0.041).
ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØĆ ĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØś ņåÉņāüņ£╝ļĪ£ ņāØĻĖ┤ ņ▓┤ņĢĪ ļ░Å ĒśłņןņØś ļłäņČ£ ļ░Å ņČĢņĀüņŚÉ ņØśĒĢ£ ņżæņŗ¼ļ¦Øļ¦ē ļ╣äĒøäņØ┤ļ®░, ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉņØś ņŗ£ļĀźņĀĆĒĢśņØś ņŻ╝ņÜö ņøÉņØĖņØ┤ļŗż. ņ£äņŖżņ╗©ņŗĀ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ņŚŁĒĢÖņĪ░ņé¼ņŚÉ ņØśĒĢśļ®┤ ņĀ£1ĒśĢ ļŗ╣ļć©ļ│æ ĒÖśņ×ÉņØś 20%, ņĀ£2ĒśĢ ļŗ╣ļć©ļ│æ ĒÖśņ×ÉņØś 25%ņŚÉņä£ 10ļģäņØś ņČöņĀü Ļ┤Ćņ░░ Ēøä Ļ▓░ĻĄŁ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØ┤ ļ░£ņāØĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[1]. ņ”ØņŗØļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ļŖö 70-74%ņŚÉņä£ ĒÖ®ļ░śļČĆņóģņØ┤ ļ░£Ļ▓¼ļÉ£ļŗż[1]. Ēśäņ×¼ ļŗ╣ļć©ĒÖ®ļ░ś ļČĆņóģņØś ņ╣śļŻīļĪ£ļŖö ĒÖ®ļ░ś ĻĄŁņåīļĀłņØ┤ņĀĆ ņ╣śļŻī, ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ļśÉļŖö ņŖżĒģīļĪ£ņØ┤ļō£ ņŻ╝ņé¼ ņ╣śļŻī, ņłśņłĀ ņÜöļ▓Ģ ļō▒ ņŚ¼ļ¤¼ ļ░®ļ▓ĢņØ┤ Ļ░ĆļŖźĒĢśļŗż[2].
ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ¦Øļ¦ēĒŚłĒśłļĪ£ ņØĖĒĢśņŚ¼ ļ¦Øļ¦ēņĪ░ņ¦üņŚÉņä£ ļČäļ╣äļÉ£ ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É(vascular endothelial growth factor, VEGF)ļŖö ļ¦Øļ¦ēĒśłĻ┤ĆļłäņČ£Ļ│╝ ĒÖ®ļ░śļČĆņóģņØä ņØ╝ņ£╝Ēéżļ®░, ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņ×ģņłĀņØĆ ļŗżļźĖ ņ╣śļŻī ņÜöļ▓ĢņŚÉ ļ╣äĒĢ┤ ņÜ░ņøöņä▒ņØ┤ ņ×ģņ”ØļÉ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś Ēæ£ņżĆ ņ╣śļŻī ļ░®ļ▓ĢņØ┤ļŗż[2]. ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ(Eylea┬«, Regeneron Pharmaceuticals, Inc., Tarrytown, NY, USA)ļŖö ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░ G1 (immunoglobulin G1)ņØś Ļ▓░ņĀĢĻ░ĆļŖźņĪ░Ļ░ü(fragment crystallizable, Fc) ļČĆņ£äņŚÉ ņ£ĄĒĢ®ļÉ£ 115 kDaņØś ņłśņÜ®ņä▒ ņ×¼ņĪ░ĒĢ® ļŗ©ļ░▒ņ¦łļĪ£, ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņłśņÜ®ņ▓┤-1 (vascular endothelial growth factor receptor 1, VEGFR-1)Ļ│╝ ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņłśņÜ®ņ▓┤-2 (VEGFR-2)ņØś ņäĖĒżņÖĖ ņä▒ļČäņØś ļ”¼Ļ░äļō£ Ļ▓░ĒĢ® ņÜöņåīļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ļ¦Øļ¦ē ļ¬©ļōĀ ņĖĄņØä ĒåĄĻ│╝ĒĢśļ®░ VEGF-AņÖĆ VEGF-B, Ēā£ļ░śņä▒ņןņØĖņ×É(placental growth factor)ņÖĆļÅä Ļ▓░ĒĢ®ĒĢ£ļŗż[3]. ņØ┤ļ¤¼ĒĢ£ ĒŖ╣ņä▒ņ£╝ļĪ£, ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņäĖ Ļ░Ćņ¦Ć ņĢĮņĀ£ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö(Lucentis┬«, Genetech, South San Francisco, CA, USA), ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö(Avastin┬«, Genetech)ņØś ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝, ņ┤łĻĖ░ ņŗ£ļĀź 20/50 ņØ┤ĒĢśņØś ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ņ╣śļŻī 1ļģäņ¦ĖņŚÉ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖĻ░Ć ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö, ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņŚÉ ļ╣äĒĢ┤ ļŹö ĒÜ©Ļ│╝ņĀüņØĖ ņŗ£ļĀź Ļ░£ņäĀņØä ļ│┤ņśĆļŗż[4]. ļśÉĒĢ£, ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØ┤ļéś ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņŚåļŖö ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖĻ░Ć ņ£ĀņØśĒĢ£ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś(central macular thickness) Ļ░Éņåī ļ░Å ņŗ£ļĀź Ļ░£ņäĀņØä ļéśĒāĆļāłļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[5,6]. ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ņ╣śļŻī ĒÜ©Ļ│╝ņØś ņןĻĖ░Ļ░ä ļ╣äĻĄÉ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö, ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņ╣śļŻī 5ļģäņ¦ĖņŚÉ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śļŖö ņäĖ ĻĄ░ ļ¬©ļæÉ ņ╣śļŻī ņĀäņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖĻ░Ć Ļ░Ćņן ņÜ░ņłśĒĢśĻ▓ī Ļ░£ņäĀļÉśņŚłļŗż[7]. ĻĄŁļé┤ ļ¼ĖĒŚīņŚÉņä£ļÅä ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņé¼ Ēøä ļŗ©ĻĖ░ņĀüņ£╝ļĪ£ ļÜ£ļĀĘĒĢ£ ņŗ£ļĀź ĒśĖņĀäĻ│╝ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś Ļ░ÉņåīĻ░Ć ļéśĒāĆļé¼ļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[8].
ņĄ£ĻĘ╝ ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü(spectral-domain optical coherence tomography)Ļ│╝ Ļ│ĀĻĖē Ļ╣ŖņØ┤ ļ¬©ļō£(enhanced depth imaging) ĻĖ░ļ▓ĢņØ┤ ļÅäņ×ģļÉ©ņŚÉ ļö░ļØ╝ ļ¦Øļ¦ēļ┐Éļ¦ī ņĢäļŗłļØ╝ ļ¦źļØĮļ¦ēņØś ĒśĢĒā£ņŚÉ Ļ┤ĆĒĢ£ ļ╣äņ╣©ņŖĄņĀüņØĖ ĒÅēĻ░ĆļÅä Ļ░ĆļŖźĒĢśĻ▓ī ļÉśņŚłļŗż[9]. ļ¦źļØĮļ¦ē ĒśłĻ┤ĆņĖĄņØĆ ņ×æņØĆ Ēü¼ĻĖ░ ļ░Å ņżæĻ░ä Ēü¼ĻĖ░ņØś ņäĖļÅÖļ¦źņØä ņØ┤ļŻ©ļŖö ļé┤ņĖĄņØś ņ×ÉĒŗĆļ¤¼ņĖĄĻ│╝ Ēü░ ĒśłĻ┤Ćņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņÖĖņĖĄņØś ĒĢĀļ¤¼ņĖĄņ£╝ļĪ£ ļéśļēśļ®░, ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļ¦źļØĮļ¦ēņØś Ēśłļźś ņāüĒā£ļź╝ ļ░śņśüĒĢśļŖö ņżæņÜöĒĢ£ ņ¦ĆĒæ£ņØ┤ļŗż[10]. ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ ņØ┤ņĀä ņŚ░ĻĄ¼ļōżņØĆ ņä£ļĪ£ ļŗżļźĖ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż[11]. Ēśäņ×¼Ļ╣īņ¦Ć ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻī Ēøä ļ¦źļØĮļ¦ē Ēśłļźś ļ│ĆĒÖöņØś ĻĖ░ņĀäņØĆ ņĀĢĒÖĢĒ׳ ĒÖĢļ”ĮļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ĻĄŁļé┤ņŚÉņä£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņŚåļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØä ņ▓śņØī ņŗ£Ē¢ēļ░øņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś(subfoveal Haller layer thickness), ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś(subfoveal choroidal thickness) ļ░Å ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś ļ│ĆĒÖöļź╝ ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉļČäņäØĒĢśņśĆļŗż. ļśÉĒĢ£ Ļ░üĻ░üņØś ļæÉĻ╗ś ļ│ĆĒÖöņÖĆ ņŗ£ļĀź ņé¼ņØ┤ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļČäņäØĒĢśņŚ¼ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä ņŗ£ļĀź ĒśĖņĀäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ēśłļźś ļ│ĆĒÖöņØś ĻĖ░ņĀäņØś ņØ┤ĒĢ┤ņŚÉ ļÅäņøĆņØ┤ ļÉśĻ│Āņ×É ĒĢśņśĆļŗż.
2016ļģä 12ņøöļČĆĒä░ 2021ļģä 6ņøöĻ╣īņ¦Ć ļ│ĖņøÉņŚÉņä£ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØä ņ▓śņØī ņŗ£Ē¢ēļ░øĻ│Ā 1Ļ░£ņøö ņØ┤ņāü Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ĒĢ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×É 36ļ¬ģ 36ņĢłņØä ļīĆņāüņ£╝ļĪ£ ņØśļ¼┤ĻĖ░ļĪØņØä ĒåĄĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņØä ņżĆņłśĒĢśņśĆĻ│Ā, ļ│ĖņøÉ ņŚ░ĻĄ¼ņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖņØä ļ░øņĢä ņ¦äĒ¢ēĒĢśņśĆļŗż(ņŖ╣ņØĖ ļ▓łĒśĖ: CEH-2021-4). ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØĆ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ļ¦Øļ¦ēļé┤ņĢĪņØ┤ļéś ļ¦Øļ¦ēĒĢśņĢĪņØ┤ Ļ┤Ćņ░░ļÉśļ®┤ņä£ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śĻ░Ć 300 ╬╝m ņØ┤ņāüņØĖ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØä ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēļÉśņŚłņ£╝ļ®░, ņØ┤ņĀäņŚÉ ļŗżļźĖ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ Ēś╣ņØĆ ļĀłņØ┤ņĀĆĻ┤æņØæĻ│ĀņłĀņØä ĒżĒĢ©ĒĢ£ ļŗżļźĖ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåņŚłļŹś ĒÖśņ×É ļśÉĒĢ£ ĒżĒĢ©ļÉśņŚłļŗż. ņĢłņČĢņן 26 mm ņØ┤ņāü, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś -6 diopters (D) ņØ┤ņāüņØś Ļ│ĀļÅäĻĘ╝ņŗ£, ļŗżļźĖ ļ¦Øļ¦ē ļśÉļŖö ļ¦źļØĮļ¦ē ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ņłĀ ņĀä 6Ļ░£ņøö ņØ┤ļé┤ņŚÉ ļ░▒ļé┤ņןņłśņłĀ, ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ, ļģ╣ļé┤ņןņłśņłĀņØä ļ░øņØĆ Ļ▓ĮņÜ░ļŖö ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņÖĖļÉśņŚłļŗż.
ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØĆ ņÖĖļל ņłśņłĀņŗżņŚÉņä£ 0.5% ĒöäļĪ£ĒīīļØ╝ņ╣┤ņØĖņŚ╝ņé░ņŚ╝(Alcaine┬«, Alcon Laboratories, Forthworth, TX, USA)ņØä ņØ┤ņÜ®ĒĢ£ ņĀÉņĢł ļ¦łņĘ© Ēøä ņŗ£Ē¢ēļÉśņŚłļŗż. 5% Ēżļ╣äļÅł ņÜöņśżļō£ ņÜ®ņĢĪņØä ņĀÉņĢłĒĢśņŚ¼ ņĢłĻĄ¼ Ēæ£ļ®┤ ņåīļÅģ Ēøä Ļ░üļ¦ē ņ£żļČĆņŚÉņä£ 3.5 mm ĒĢśņØ┤ņĖĪ ņé¼ļČäļ®┤ņŚÉ 30Ļ▓īņØ┤ņ¦Ć ņØ╝ĒÜīņÜ® ļ░öļŖśņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ 2.0 mg/0.05 mLļź╝ ņŻ╝ņé¼ĒĢśņśĆļŗż. ņłĀ Ēøä ņ▓śņ╣śļŖö ļÅÖņØ╝ĒĢśĻ▓ī 0.5% ļĀłļ│┤ĒöīļĪØņé¼ņŗĀ(Cravit┬«, Santen, Osaka, Japan)ņØä ĒĢśļŻ© 4ĒÜī 1ņŻ╝ ļÅÖņĢł ņĀÉņĢłĒĢśņśĆļŗż.
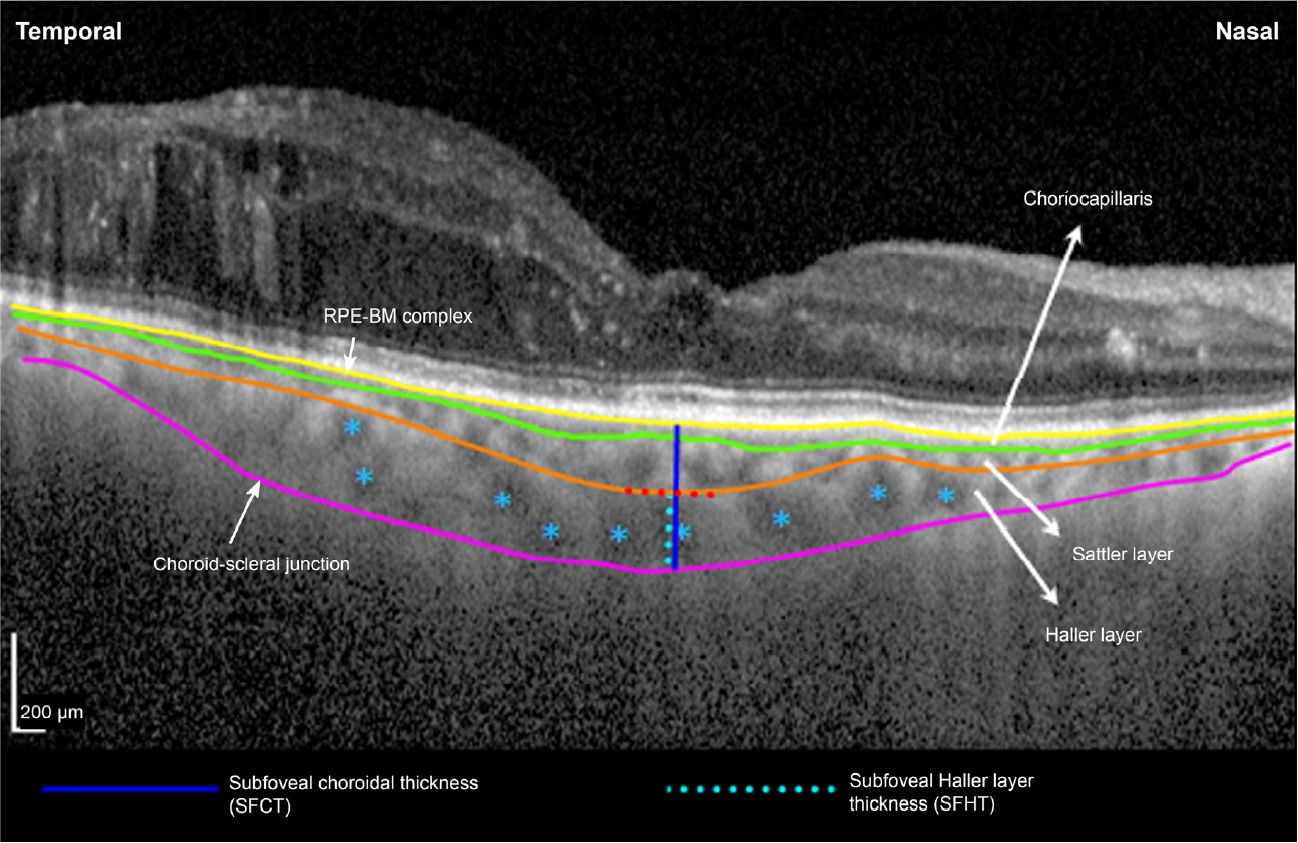
ļ¬©ļōĀ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņÖĖļל ļé┤ņøÉņŗ£ ļ│æļĀź ņ▓ŁņĘ©, ņŻ╝ņé¼ ļŗ╣ņØ╝ ņłĀ ņĀä Ēśłļŗ╣Ļ▓Ćņé¼, ļ¦ż ļ░®ļ¼Ė ņŗ£ĻĖ░ļ¦łļŗż ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼, ņĢłņĀĆĻ▓Ćņé¼, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźĻ▓Ćņé¼(logarithm of the minimum angle of resolution, logMAR), ļ╣äņĀæņ┤ēņĢłņĢĢĻ│ä(Full auto tonometer TX-F, Canon, Inc., Tokyo, Japan)ļź╝ ņé¼ņÜ®ĒĢ£ ņĢłņĢĢ ņĖĪņĀĢ, ņ×ÉļÅÖĻ░üļ¦ēĻ│ĪļźĀĻ│ä(Auto Ref-Keratometer RK-F2, Canon, Tokyo, Japan)ļź╝ ņé¼ņÜ®ĒĢ£ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś ņĖĪņĀĢņØä ĒĢśņśĆļŗż. ļśÉĒĢ£ ņŻ╝ņé¼ ņĀä, ņŻ╝ņé¼ Ēøä 1Ļ░£ņøöņ¦Ė ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻĖ░(Spectralis┬« Heidelberg retinal angiography-optical coherence tomography, Heidelberg Engineering, Heidelberg, Germany)ļĪ£ Ļ│ĀĻĖē Ļ╣ŖņØ┤ ļ¬©ļō£ļź╝ ņØ┤ņÜ®ĒĢ£ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śņÖĆ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ņĖĪņĀĢ ļ░Å ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ņĖĪņĀĢņØä ĒĢśņśĆļŗż. ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻĖ░ņŚÉ ļé┤ņןļÉ£ ņåīĒöäĒŖĖņø©ņ¢┤ņØś ņĖĪņĀĢ ļÅäĻĄ¼ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņżæņŗ¼ņÖĆļź╝ Ļ┤ĆĒåĄĒĢśļŖö ņäĀĒśĢņØś ņłśĒÅēņŖżņ║öņŚÉņä£ ņżæņŗ¼ņÖĆņĢäļל ļ¦Øļ¦ēņāēņåīņāüĒö╝-ļĖīļŻ©Ēü¼ļ¦ē ļ│ĄĒĢ®ņ▓┤ņØś Ļ│Āļ░śņé¼ņäĀ ņÖĖņĖĪļČĆĒä░ ļ¦źļØĮļ¦ē-Ļ│Ąļ¦ē Ļ▓ĮĻ│ä ļé┤ņĖĪĻ╣īņ¦Ć ņłśņ¦üņäĀņØä ĻĘĖņ¢┤ ņĖĪņĀĢĒĢśņśĆļŗż. ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śļŖö ņżæņŗ¼ņÖĆ ņ¢æņ¬Į 750 ╬╝m ļé┤ņŚÉņä£ ņ¦üĻ▓Į 100 ╬╝m ņØ┤ņāüņØĖ Ēü░ ļ¦źļØĮļ¦ēĒśłĻ┤ĆņØä ĒÖĢņØĖĒĢśņŚ¼, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ņĖĪņĀĢņäĀņŚÉņä£ ņØ┤ ĒśłĻ┤Ć ļé┤Ļ░Ģ Ļ░Ćņן ņĢłņ¬Į Ļ░Ćņןņ×Éļ”¼ļź╝ ņ×ćļŖö ņłśņ¦üņäĀņØä ĻĘĖņ¢┤, ņØ┤ ņłśņ¦üņäĀĻ│╝ ļ¦źļØĮļ¦ē-Ļ│Ąļ¦ē Ļ▓ĮĻ│ä ļé┤ņĖĪ ņé¼ņØ┤ Ļ▒░ļ”¼ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż(Fig. 1). ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śņÖĆ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ņĖĪņĀĢņØĆ ļæÉ ļ¬ģņØś ņĖĪņĀĢņ×ÉĻ░Ć ļÅģļ”ĮņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢ£ ļÆż, ļæÉ ļ¬ģņØś ņĖĪņĀĢņ×É Ļ░äņØś ņ×¼Ēśäņä▒ņØä ļČäņäØĒĢśņśĆņ£╝ļ®░, ļæÉ ļ¬ģņØś ņĖĪņĀĢņ╣śņØś ĒÅēĻĘĀĻ░ÆņØä ļČäņäØĒĢśņśĆļŗż. ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śļŖö ņżæņŗ¼ ĒÖ®ļ░śļČĆ ņ¦üĻ▓Į 1 mm ņśüņŚŁņØś ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śĻ░Ć ņåīĒöäĒŖĖņø©ņ¢┤ņŚÉņä£ ņ×ÉļÅÖņ£╝ļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ļ¬©ļōĀ ņÖĖļלĻ▓Ćņé¼ļŖö ņśżņĀä 9ņŗ£ņÖĆ ņśżĒøä 5ņŗ£ ņé¼ņØ┤ņŚÉ ņŗ£Ē¢ēļÉśņŚłņ£╝ļ®░, ĒÖśņ×Éļ│ä ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņŗ£Ļ░äļīĆļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż.
ĒåĄĻ│ä ļČäņäØņØĆ SPSS software ver. 18.0 (SPSS Inc., Chicago, IL, USA)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ ņĀäĒøä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņĢłņĢĢ ļ│ĆĒÖöņØś ņ£ĀņØśņä▒ Ļ▓ĆņĀĢņØä ņ£äĒĢ┤ņä£ ļīĆņØæĒæ£ļ│Ė t-Ļ▓ĆņĀĢ(paired t-test)ņØä, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ░Å ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ļ│ĆĒÖö, ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņŗ£Ļ░äļīĆ ņ░©ņØ┤ņØś ņ£ĀņØśņä▒ Ļ▓ĆņĀĢņØä ņ£äĒĢ┤ņä£ ņ£īņĮĢņŖ© ļČĆĒśĖņł£ņ£ä Ļ▓ĆņĀĢ(Wilcoxon signed-rank test)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ļæÉ ļ¬ģņØś ņĖĪņĀĢņ×É Ļ░äņØś ļ¦źļØĮļ¦ēļæÉĻ╗ś ņĖĪņĀĢņØś ņ×¼Ēśäņä▒ņØä ļČäņäØĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ĻĖēļé┤ņāüĻ┤ĆĻ│äņłś(intraclass correlation coefficient) ļ░Å ņŗĀļó░ĻĄ¼Ļ░ä(confidence interval)ņØä ĻĄ¼ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż. ļśÉĒĢ£ ņłĀ Ēøä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ│ĆĒÖöļ¤ē Ļ░ä ņāüĻ┤ĆĻ┤ĆĻ│ä, ņłĀ Ēøä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░üĻ░üņØś ļ│ĆĒÖöļ¤ēĻ│╝ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ļ│ĆĒÖöļ¤ē ņé¼ņØ┤ ņāüĻ┤ĆĻ┤ĆĻ│ä, ņłĀ ņĀä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņÖĆ ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņé¼ņØ┤ ņāüĻ┤ĆĻ┤ĆĻ│ä, ņłĀ Ēøä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░üĻ░üņØś ļ│ĆĒÖöļ¤ēĻ│╝ ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņé¼ņØ┤ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ņŖżĒö╝ņ¢┤ļ¦ī ņł£ņ£äņāüĻ┤ĆļČäņäØ(Spearman rank correlation analysis)ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļ¬©ļæÉ p-valueĻ░Ć 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ ņ┤Ø 36ļ¬ģ 36ņĢłņØä ņŚ░ĻĄ¼ ļīĆņāüņ£╝ļĪ£ ĒżĒĢ©ĒĢ£ Ļ░ĆņÜ┤ļŹ░, ļīĆņāü ĒÖśņ×ÉņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 57.50 ┬▒ 10.06ņäĖļĪ£, ļé©ņä▒ 26ļ¬ģ, ņŚ¼ņä▒ 10ļ¬ģ, ņłśņĀĢņ▓┤ņĢłņØĆ 25ņĢł, ņØĖĻ│ĄņłśņĀĢņ▓┤ņĢłņØ┤ 11ņĢłņØ┤ņŚłļŗż. 36ņĢł ņżæ 28ņĢł(77.8%)ņŚÉņä£ ņØ┤ņĀäņŚÉ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ņ╣śļŻīļź╝ ļ░øņØĆ Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ņŚłņ£╝ļ®░, ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░Ļ░Ć 25ņĢł(69.4%)ņ£╝ļĪ£ Ļ░Ćņן ĒØöĒĢśņśĆĻ│Ā ĒÅēĻĘĀ 3.12ĒÜīļź╝ ņŗ£Ē¢ēļ░øņĢśļŗż. ļŗżņØīņ£╝ļĪ£ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒŖĖļ”¼ņĢöņŗ£ļåĆļĪĀ ņŻ╝ņ×ģņłĀņØä ļ░øņĢśļŹś Ļ▓ĮņÜ░Ļ░Ć 13ņĢł(36.1%)ņ£╝ļĪ£ ĒØöĒĢśņśĆņ£╝ļ®░ ĒÅēĻĘĀ 2.69ĒÜī ņŗ£Ē¢ēļ░øņĢśļŗż. ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ļŹ▒ņé¼ļ®öĒāĆņåÉ ņéĮņ×ģļ¼╝ ņŻ╝ņ×ģņłĀ(Ozurdex┬«, AllerganInc., Irvine, CA, USA), ĻĄŁņåī ļ¦Øļ¦ēĻ┤æņØæĻ│ĀņłĀņØĆ Ļ░üĻ░ü 2ņĢł(5.6%)ņŚÉņä£ ņŗ£Ē¢ēĒĢ£ Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ņŚłņ£╝ļ®░, ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉļŖö ņŚåņŚłļŗż. 36ņĢł ņżæ 24ņĢł(66.7%)ņØ┤ ņØ┤ņĀäņŚÉ ļ▓öļ¦Øļ¦ēĻ┤æņØæĻ│ĀņłĀņØä ļ░øņØĆ ņāüĒā£ņśĆĻ│Ā, ĒÅēĻĘĀ 18.4Ļ░£ņøö ņØ┤ņĀäņŚÉ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņłĀ ņĀä 3Ļ░£ņøö ņØ┤ļé┤ņŚÉ ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉļŖö ņŚåņŚłļŗż. ĻĖ░ņĀĆ ņ¦łĒÖśņ£╝ļĪ£ 14ļ¬ģ(38.9%)ņŚÉņä£ Ļ│ĀĒśłņĢĢņØ┤ ņ׳ņŚłĻ│Ā, 7ļ¬ģ(19.4%)ņŚÉņä£ Ļ│Āņ¦ĆĒśłņ”Ø, 5ļ¬ģ(13.9%)ņŚÉņä£ ļ¦īņä▒ņŗĀņ¦łĒÖśņØ┤ ņ׳ņŚłļŗż. ņłĀ ņĀä Ēśłļŗ╣ņØĆ ĒÅēĻĘĀ 212.17 ┬▒ 89.04 mg/dL, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ĒÅēĻĘĀ 0.56 ┬▒ 0.31 logMARņØ┤ņŚłļŗż. ņłĀ ņĀä ņĢłņĢĢņØĆ ĒÅēĻĘĀ 14.30 ┬▒ 3.14 mmHg, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö ĒÅēĻĘĀ -0.88 ┬▒ 1.98 DņśĆļŗż(Table 1). ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śņÖĆ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ĻĖēļé┤ņāüĻ┤ĆĻ│äņłśļŖö 0.995ņŚÉņä£ 0.997 ņé¼ņØ┤ļĪ£ ļæÉ ņĖĪņĀĢņ×É Ļ░äņŚÉ ļåÆņØĆ ņØ╝ņ╣śņ£©ņØä ļ│┤ņśĆļŗż(Table 2).
ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śņÖĆ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö Ļ░üĻ░ü ņłĀ ņĀä 214.28 ┬▒ 80.00 ╬╝m, 307.89 ┬▒ 96.30 ╬╝mņśĆņ£╝ļ®░, ņłĀ Ēøä 1Ļ░£ņøöņŚÉ Ļ░üĻ░ü 199.56 ┬▒ 75.76 ╬╝m, 290.36 ┬▒ 94.63 ╬╝mļĪ£ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(p=0.001, p<0.001). ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śļŖö ņłĀ ņĀä 525.64 ┬▒ 133.24 ╬╝mņŚÉņä£ ņłĀ Ēøä 1Ļ░£ņøöņŚÉ 409.72 ┬▒ 98.45 ╬╝mļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(p<0.001). ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ļśÉĒĢ£ ņłĀ ņĀä 0.56 ┬▒ 0.31 logMARņŚÉņä£ ņłĀ Ēøä 1Ļ░£ņøöņŚÉ 0.50 ┬▒ 0.39 logMARļĪ£ ņ£ĀņØśĒĢśĻ▓ī ĒśĖņĀäļÉśņŚłļŗż(p=0.012). ņĢłņĢĢņØĆ ņłĀ ņĀä, ņłĀ Ēøä 1Ļ░£ņøöņŚÉ Ļ░üĻ░ü 14.30 ┬▒ 3.14 mmHg, 14.34 ┬▒ 3.25 mmHgļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.947) (Table 3). ļīĆļČĆļČäņØś ĒÖśņ×ÉļōżņØ┤ ņłĀ Ēøä 1Ļ░£ņøöņ¦ĖņŚÉ Ļ░üĻ░ü ņłĀ ņĀäĻ│╝ ļÅÖņØ╝ĒĢ£ ņŗ£Ļ░äļīĆņŚÉ ļ░®ļ¼ĖĒĢśņŚ¼ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņ┤¼ņśü ņŗ£Ļ░äļīĆļŖö ņłĀ ņĀä 12.10 ┬▒ 2.76ņŗ£, ņłĀ Ēøä 11.79 ┬▒ 2.62ņŗ£ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.308).
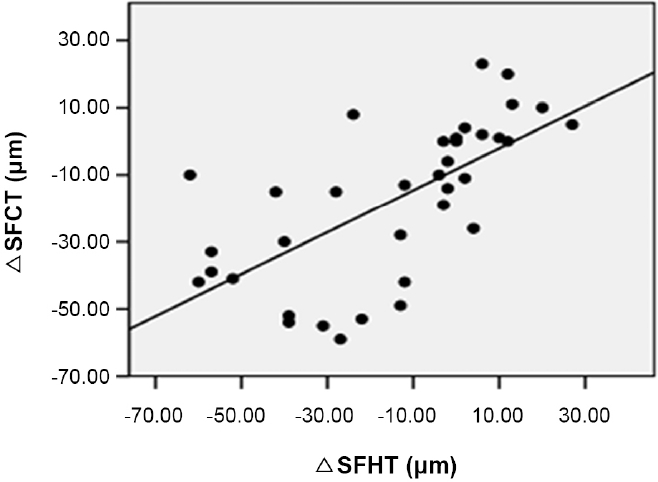
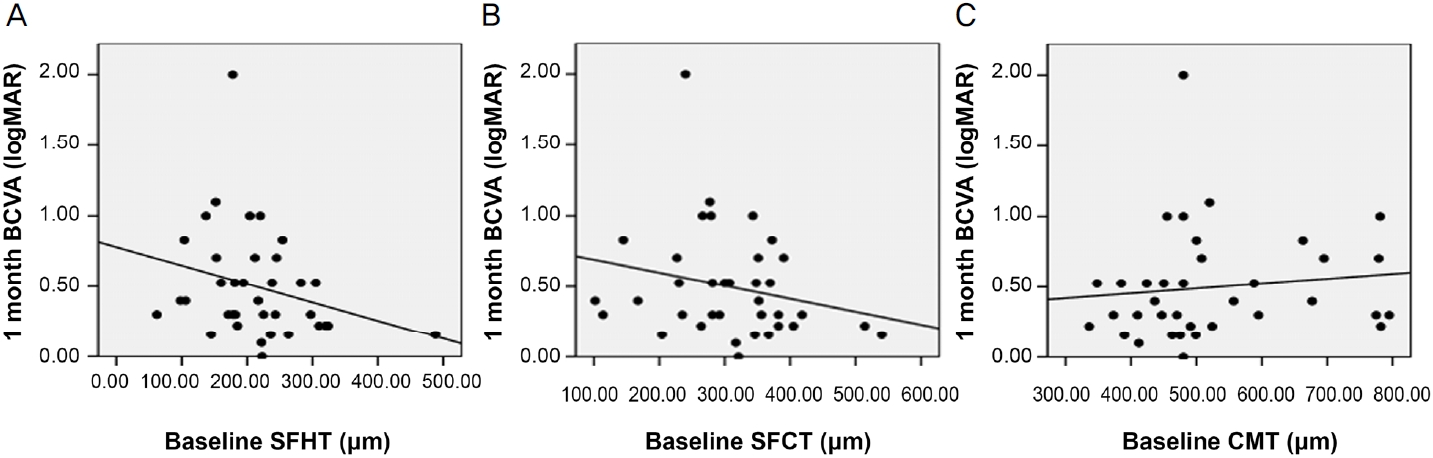
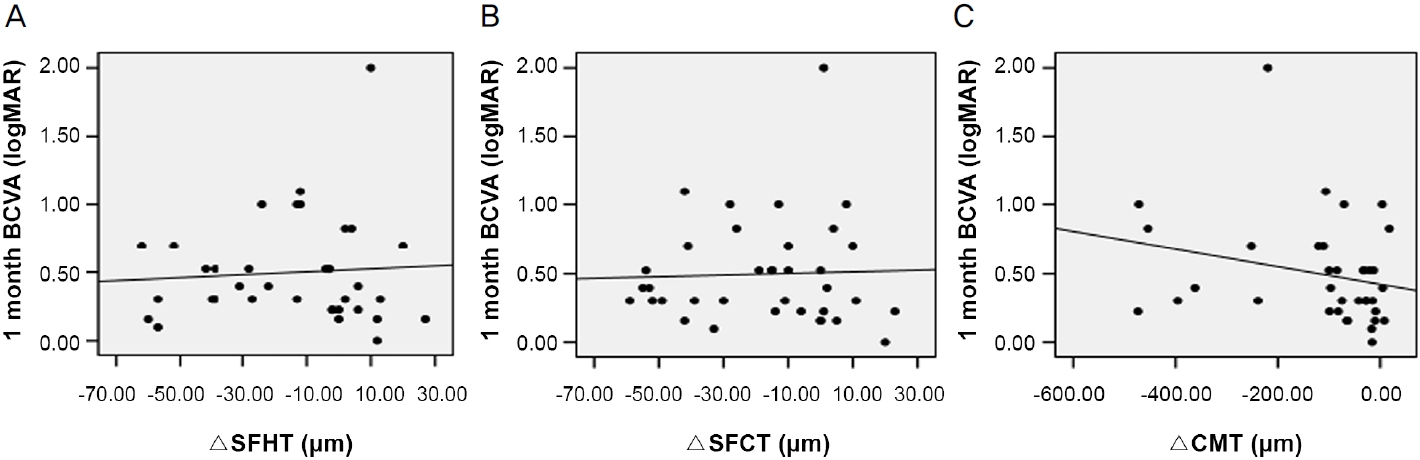
ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ 1Ļ░£ņøöņ¦Ė ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ│ĆĒÖöļ¤ēņØĆ ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ēĻ│╝ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(Spearman correlation coefficient Žü=0.729, p<0.001)(Fig. 2). ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ē ļ¬©ļæÉ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ│ĆĒÖöļ¤ēĻ│╝ļŖö ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņ¢┤, ņłĀ Ēøä ļ¦źļØĮļ¦ēļæÉĻ╗ś Ļ░ÉņåīļŖö ļ¦Øļ¦ēņØś ĒĢ┤ļČĆĒĢÖņĀü ĒśĖņĀäĻ│╝ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(Ļ░üĻ░ü Spearman correlation coefficient Žü=0.263, Žü=0.238, ļ¬©ļōĀ p>0.05). ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ│ĆĒÖöļ¤ē ļ░Å ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ēņØĆ Ļ░üĻ░ü ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ļ│ĆĒÖöļ¤ēĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłņ£╝ļéś(Ļ░üĻ░ü Spearman correlation coefficient Žü=-0.076, Žü=-0.015, ļ¬©ļōĀ p>0.05), ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ│ĆĒÖöļ¤ēņØĆ ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ļ│ĆĒÖöļ¤ēĻ│╝ ņ£ĀņØśĒĢ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłļŗż(Spearman correlation coefficient Žü=0.400, p=0.016) (Fig. 3). ņłĀ ņĀä ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļæÉĻ║╝ņÜĖņłśļĪØ ņłĀ Ēøä 1Ļ░£ņøö ļÆż ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ ņóŗņĢśņ£╝ļéś ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ņłĀ ņĀä ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļśÉĒĢ£ ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü Spearman correlation coefficient Žü=-0.276, Žü=0.227, ļ¬©ļōĀ p>0.05). ĒĢ£ĒÄĖ ņłĀ ņĀä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śļŖö ņłĀ Ēøä 1Ļ░£ņøö ļÆż ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźĻ│╝ ņ£ĀņØśĒĢ£ ņØīņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłņ£╝ļ®░, ņłĀ ņĀä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śĻ░Ć ļæÉĻ║╝ņÜĖņłśļĪØ ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ ņóŗņĢśļŗż(Spearman correlation coefficient Žü=-0.342, p=0.041) (Fig. 4). ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ│ĆĒÖöļ¤ēņØĆ ļ¬©ļæÉ ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü Spearman correlation coefficient Žü=-0.112, Žü=-0.079, Žü=-0.295, ļ¬©ļōĀ p>0.05) (Fig. 5).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØä ņ▓śņØī ņŗ£Ē¢ēļ░øņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ░Å ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼Ļ▓░Ļ│╝ ņ▓½ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä 1Ļ░£ņøöņ¦Ė Ļ┤Ćņ░░ĒĢśņśĆņØä ļĢī, 36ņĢłņŚÉņä£ ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ¬©ļæÉ ņ£ĀņØśĒĢ£ Ļ░ÉņåīĻ░Ć ņ׳ņŚłļŗż.
ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØĆ ļé┤ņĖĪĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØś ņåÉņāüņ£╝ļĪ£ ļ¦Øļ¦ēĒśłĻ┤Ć ļłäņČ£Ļ│╝ ĒÖ®ļ░śļČĆņóģņØä ņ£Āļ░£ĒĢ£ļŗż. ĒĢ£ĒÄĖ, ļŗ╣ļć©ļ│æņä▒ ļ¦źļØĮļ¦ēļ│æņ”Ø ņŚ░ĻĄ¼ņŚÉņä£ ļ│┤Ļ│ĀļÉ£ ļ¦źļØĮļ¦ēĒśłĻ┤ĆņØś ņĪ░ņ¦üļ│æļ”¼ĒĢÖņĀü ļ│ĆĒÖöļŖö ņŗĀņāØĒśłĻ┤Ć ņāØņä▒, ņ”ØĻ░ĆļÉ£ ĒśłĻ┤Ć ņŚ╝ņĀä(vascular torsion), ĒśłĻ┤ĆņÖĖņČ£Ēśł, ļ»ĖņäĖļÅÖļ¦źļźś, ļ╣äĻ┤Ćļźś, ĒśłĻ┤Ć ĒÖĢņן ļ░Å Ēśæņ░® ļō▒ ļ¦Øļ¦ēĒśłĻ┤Ć ļ│ĆĒÖöņÖĆ ņ£Āņé¼ĒĢśļŗż[12]. ļ¦Øļ¦ē ņÖĖņĖĄĻ│╝ ņżæņŗ¼ņśżļ¬®ļ¼┤ĒśłĻ┤ĆļČĆņ£äļŖö ļ¦źļØĮļ¦ē ĒśłĻ┤ĆĻ│äļĪ£ļČĆĒä░ ņśüņ¢æ Ļ│ĄĻĖēņØä ļ░øņ£╝ļ®░, ļ¦źļØĮļ¦ēņØś ņŚ╝ņ”Ø ļ░Å ĒŚłĒśłņØĆ ņÖĖņĖĪĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņŚÉ ņśüĒ¢źņØä ļü╝ņ│É ļ¦Øļ¦ēĒĢśņĢĪņØś ņČĢņĀüņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż[13]. ļŗ╣ļć©ļĪ£ ņØĖĒĢ£ ļīĆņé¼ ņŖżĒŖĖļĀłņŖż ĒĢśņŚÉņä£ ļ¦Øļ¦ēņāēņåīņāüĒö╝ņØś ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×ÉņØś Ļ│╝ņ×ē ņāØņé░ņØĆ ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄ ļ░Å ņÖĖņĖĪĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØś Ēł¼Ļ│╝ņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝£ ļŗ╣ļć©ĒÖ®ļ░ś ļČĆņóģņŚÉ ĻĖ░ņŚ¼ĒĢśĻ│Ā, ļĢīļĪ£ļŖö ĻĖēņä▒ĻĖ░ņŚÉ ņżæņŗ¼ņÖĆņĢäļל ņŗĀĻ▓Įļ¦Øļ¦ēļ░Ģļ”¼ļź╝ ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ¢┤ ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöĻ░Ć ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ļź╝ ĒåĄĒĢ┤ ļÉśļÅīļ”┤ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[14,15]. ĻĘĖ ņÖĖņŚÉļÅä ļŗ╣ļć©ņŚÉ ņØśĒĢ£ ņ×Éņ£©ņŗĀĻ▓ĮĻ│äņØś ĻĖ░ļŖź ņןņĢĀļĪ£ ļ¦źļØĮļ¦ēĒśłļźś ņł£ĒÖś ļ░Å ņĢĢļĀźņØ┤ ņĪ░ņĀłļÉśņ¦Ć ņĢŖņ£╝ļ®┤ ļ¦źļØĮļ¦ēņ£╝ļĪ£ļČĆĒä░ ļ¦Øļ¦ēņāēņåīņāüĒö╝ļź╝ ĒåĄĒĢ£ ļłäņČ£ņŚÉ ņØśĒĢ┤ņä£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØ┤ ņāØĻĖĖ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[16]. ņĄ£ĻĘ╝ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ļ│æĒā£ņāØļ”¼ĒĢÖņŚÉņä£ ļ¦źļØĮļ¦ēņØś ņŚŁĒĢĀ ņŚ░ĻĄ¼ņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŗż[11]. ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØ┤ ņŚåĻ▒░ļéś ņ┤łĻĖ░ņØĖ ļŗ╣ļć© ĒÖśņ×ÉļŖö ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤Ć Ļ┤Ćļźś Ļ░Éņåī ļ░Å ĒŚłĒśłļĪ£ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņĀĢņāüļ│┤ļŗż ņ¢ćĻ▒░ļéś[17] ļ¦źļØĮļ¦ēĒśłĻ┤Ć ņ¦ĆņłśĻ░Ć Ļ░ÉņåīĒ¢łļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[18]. ĒĢśņ¦Ćļ¦ī ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØ┤ ņ¦äĒ¢ēļÉĀņłśļĪØ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ē ļæÉĻ╗śĻ░Ć ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ļ▓öļ¦Øļ¦ēĻ┤æ ņØæĻ│ĀņłĀņØä ļ░øņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļŹö ļæÉĻ║╝ņøĀļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[18,19].
ļ¦źļØĮļ¦ēņØĆ ļīĆļČĆļČä ĒśłĻ┤Ćņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŖö ņĪ░ņ¦üņ£╝ļĪ£, ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņżæņŗ¼ ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļŖö ņŻ╝ļĪ£ ĒĢĀļ¤¼ņĖĄņØś ļæÉĻ╗ś ļ│ĆĒÖöņŚÉ ĻĖ░ņØĖĒ¢łļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[20]. ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻ│╝ Ļ┤ĆļĀ©ļÉ£ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņä▒ņןņØĖņ×É ņ”ØĻ░ĆļŖö ļ¦źļØĮļ¦ē ņÖĖņĖĄņØś ĒśłĻ┤Ć ĒÖĢņןņØä ņØ╝ņ£╝ĒéżĻ│Ā, ļ¦źļØĮļ¦ē Ēśłļźś ļ░Å ĒśłĻ┤Ć Ēł¼Ļ│╝ņä▒ņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗż[20]. ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü Ļ│ĀĻĖē Ļ╣ŖņØ┤ ļ¬©ļō£ņØś ņØ┤ņ¦äĒÖö(binarization) ĻĖ░ļ▓ĢņØä ĒåĄĒĢśņŚ¼ ļ¦źļØĮļ¦ē ĻĖ░ņ¦łĻ│╝ ĒśłĻ┤Ć ļé┤Ļ░Ģ ļ®┤ņĀüņØä ĒśĢĒā£ĒĢÖņĀüņ£╝ļĪ£ ļČäņäØĒĢ£ Ļ▓░Ļ│╝, ļ¦źļØĮļ¦ē ļæÉĻ╗ś ņ”ØĻ░ĆņÖĆ ĒĢ©Ļ╗ś ĒśłĻ┤Ćļ®┤ņĀü ņ”ØĻ░ĆĻ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż[21]. Endo et al [22]ņØĆ ĒÅēĻĘĀ ņŚ░ļĀ╣ 61.3 ┬▒ 11.8ņäĖņØś ļŗ╣ļć© ĒÖśņ×É ņżæ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö 222 ┬▒ 83 ╬╝m, 283 ┬▒ 88 ╬╝mļĪ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ (193 ┬▒ 63 ╬╝m, 251 ┬▒ 70 ╬╝m)ņŚÉ ļ╣äĒĢ┤ ļæÉĻ║╝ņøĀņ£╝ļ®░, ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤Ć ļ░Å ņ×ÉĒŗĆļ¤¼ņĖĄņØś ļæÉĻ╗śļŖö ņ░©ņØ┤Ļ░Ć ņŚåļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤ņĀä ņŚ¼ļ¤¼ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ļśÉļŖö ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŚ░ĻĄ¼ņŚÉņä£ ļŗ╣ļć©ĒÖ®ļ░ś ļČĆņóģņŚÉņä£ ņ£Āļ”¼ņ▓┤Ļ░Ģļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņ×ģņłĀ Ēøä ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö Ļ░ÉņåīĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[23-27]. ņ▓½ ņŻ╝ņé¼ ņØ┤Ēøä ĒĢäņÜö ņŗ£ ņŻ╝ņé¼ĒĢśņśĆņØä ļĢī, Kniggendorf et al [23]ņØĆ ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņłĀ ņĀä 246.89 ┬▒ 8.94 ╬╝mņŚÉņä£ 6Ļ░£ņøö Ēøä 215.66 ┬▒ 8.29 ╬╝mļĪ£, Yiu et al [24]ņØĆ ņłĀ ņĀä 246.6 ╬╝mņŚÉņä£ 6Ļ░£ņøö Ēøä 224.8 ╬╝mļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒ¢łļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņ▓½ 3Ļ░£ņøöĻ░ä ļ¦żļŗ¼ ņŻ╝ņé¼ĒĢ£ ņŚ░ĻĄ¼ļōżņŚÉņä£ļÅä ņłĀ Ēøä 3Ļ░£ņøöņŚÉ ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝ ļ│┤ņŚ¼ ņØ╝ņ╣śĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļāłļŗż[25-27]. ļŗ©, Lee et al [25]ņØĆ ļ¦źļØĮļ¦ēļæÉĻ╗ś Ļ░ÉņåīļŖö ņ▓½ ņŻ╝ņé¼ Ēøä 1Ļ░£ņøöņŚÉ ļÜ£ļĀĘņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļéśĒāĆļé¼ņ£╝ļ®░, ļæÉ ļ▓łņ¦Ė ļśÉļŖö ņäĖ ļ▓łņ¦Ė ņŻ╝ņé¼ Ēøä ņ£ĀņØśĒĢ£ ņČöĻ░Ć Ļ░ÉņåīļŖö ņŚåņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. La├Łns et al [28]ņØĆ ņ¢æņĢłņŚÉ Ļ░ÖņØĆ ņĀĢļÅäņØś ņ”ØņŗØļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ļśÉļŖö ļ╣äņ”ØņŗØ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØä Ļ░Ćņ¦ä ĒÖśņ×ÉņŚÉņä£ ĒĢ£ ļłłņŚÉļŖö ĻĄŁņåī ļśÉļŖö ļ▓öļ¦Øļ¦ēĻ┤æņØæĻ│ĀņłĀļ¦ī ņŗ£Ē¢ē, ļ░śļīĆņĢłņØĆ ļĀłņØ┤ņĀĆĻ┤æņØæĻ│ĀņłĀĻ│╝ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ļź╝ ĒĢ©Ļ╗ś ņŗ£Ē¢ēĒĢśņŚ¼ ņ¢æņĢł ļ╣äĻĄÉņŗ£, ņŻ╝ņé¼ ņ╣śļŻīļź╝ ĒĢ©Ļ╗ś ņŗ£Ē¢ēĒĢ£ ņĢłņØ┤ ņłĀ Ēøä ļŹö ņ¢ćņØĆ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ļéśĒāĆļāłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņןĻĖ░ņĀü ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļĪ£ļŖö Campos et al [29]ņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ņ▓½ 3Ļ░£ņøöĻ░ä ļ¦żļŗ¼ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ļśÉļŖö ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņé¼ Ēøä 24Ļ░£ņøöĻ╣īņ¦Ć ĒĢäņÜö ņŗ£ ņ╣śļŻīĒĢśņśĆņØä ļĢī, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņłĀ ņĀä 346.6 ┬▒ 75.6 ╬╝mņŚÉņä£ ņłĀ Ēøä 3Ļ░£ņøö, 6Ļ░£ņøö, 12Ļ░£ņøö, 18Ļ░£ņøö, 24Ļ░£ņøöņŚÉ Ļ░üĻ░ü ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ -22.5 ╬╝m, -25.6 ╬╝m, -31.8 ╬╝m, -33.7 ╬╝m, -31.2 ╬╝m ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤ņÖĆ ļŗ¼ļ”¼, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻī Ēøä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢ£ ņŚ░ĻĄ¼ļōżļÅä ņ׳ļŖöļŹ░, Adhi et al [30]ņØĆ ņŻ╝ņé¼ ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉņÖĆ ļ░øņ¦Ć ņĢŖņØĆ ĒÖśņ×É ņé¼ņØ┤ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. Manjunath et al [31]ņØĆ ņŻ╝ņé¼ ņ╣śļŻīļź╝ ļ░øņØĆ Ļ▓ĮņÜ░ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś(237.43 ┬▒ 76.38 ╬╝m)ļŖö ņ╣śļŻīļ░øņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░(261.75 ┬▒ 86.18 ╬╝m)ņÖĆ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåļŗżĻ│Ā ĒĢśņśĆļŗż. ļśÉĒĢ£, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä ņ▓½ 3Ļ░£ņøöĻ░ä ļ¦żļŗ¼, ņØ┤Ēøä ĒĢäņÜö ņŗ£ ņŻ╝ņé¼ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ 12Ļ░£ņøö Ēøä ļ¦źļØĮļ¦ēļæÉĻ╗ś(191.3 ┬▒ 60.3 ╬╝m)ļŖö ņłĀ ņĀä(189.3 ┬▒ 49.9 ╬╝m)ļ│┤ļŗż ņĢĮĻ░ä ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś ņ£ĀņØśĒĢśņ¦Ć ņĢŖļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[32]. ĻĘĖļ¤¼ļéś ņäĖ ņŚ░ĻĄ¼ņØś ņŻ╝ņé¼ ņ╣śļŻī ļīĆņāüņĢłņØĆ Ļ░üĻ░ü 8ņĢł, 7ņĢł, 23ņĢłņ£╝ļĪ£ Ēæ£ļ│ĖņłśĻ░Ć ņĀüņŚłļŗżļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż[30-32]. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö Ļ░üĻ░ü ņłĀ ņĀä 214.28 ┬▒ 80.00 ╬╝m, 307.89 ┬▒ 96.30 ╬╝mņŚÉņä£, ņłĀ Ēøä 1Ļ░£ņøöņŚÉ 199.56 ┬▒ 75.76 ╬╝m, 290.36 ┬▒ 94.63 ╬╝mļĪ£ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņŚ¼ ņØ┤ņĀäņØś ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ Ēøä ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć Ļ░ÉņåīĒĢ£ ņŚ░ĻĄ¼ļōżĻ│╝ ņØ╝ņ╣śĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ļśÉĒĢ£ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ│ĆĒÖöļ¤ēņØĆ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ēĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļéśĒāĆļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä ņżæņŗ¼ ļ¦źļØĮļ¦ēļæÉĻ╗ś Ļ░ÉņåīļŖö ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś Ļ░ÉņåīņŚÉ ĻĖ░ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖļŖö ļŗżļźĖ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņĢĮņĀ£ņŚÉ ļ╣äĒĢ┤ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ņ╣śļŻīņŚÉ ļŗ©ĻĖ░ņĀüņ£╝ļĪ£ ļŹö ĒÜ©Ļ│╝ņĀüņØĖ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[4-6]. ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö, ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØś ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼(Protocol-T) Ļ▓░Ļ│╝, ņ┤łĻĖ░ ņŗ£ļĀź 20/50 ņØ┤ĒĢśņØś ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ļŖö ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ(+18.9 ĻĖĆņ×Éņłś)Ļ░Ć ņ╣śļŻī 1ļģäņ¦ĖņŚÉ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö(+14.2ĻĖĆņ×Éņłś), ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö(+11.8ĻĖĆņ×Éņłś)ņŚÉ ļ╣äĒĢ┤ ļŹö ĒÜ©Ļ│╝ņĀüņØĖ ņŗ£ļĀź Ļ░£ņäĀ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, ņןĻĖ░Ļ░ä ņŚ░ņן ņŚ░ĻĄ¼ņŚÉņä£ 5ļģä Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņ╣śļŻī 2ļģäņ¦ĖņŚÉ ļ╣äĒĢśņŚ¼ Ļ░ÉņåīĒĢśņśĆņ£╝ļéś, ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖĻ░Ć +8.0ĻĖĆņ×ÉņłśļĪ£ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö(+7.6ĻĖĆņ×Éņłś)Ļ│╝ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö(+6.6ĻĖĆņ×Éņłś)ļ│┤ļŗż ņÜ░ņłśĒĢśĻ▓ī Ļ░£ņäĀļÉśņŚłļŗż[4,7]. ņ╣śļŻī 5ļģäņ¦ĖņŚÉ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śļŖö ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö, ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņ╣śļŻīĻĄ░ Ļ░üĻ░ü -161 ╬╝m, -150 ╬╝m, -150 ╬╝m ņ╣śļŻī ņĀäņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż[7]. ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖļŖö ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØ┤ļéś ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņŚåļŖö ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ļÅä ņ£ĀņØśĒĢ£ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░Éņåī ļ░Å ņŗ£ļĀź ĒśĖņĀäņØä ļéśĒāĆļāłļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[5,6]. ĻĄŁļé┤ņŚÉņä£ļÅä ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņé¼ Ēøä 1Ļ░£ņøöņŚÉ ņ£ĀņØśĒĢ£ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░Éņåī ļ░Å ņŗ£ļĀź ĒśĖņĀäņØä ļ│┤ņśĆņ£╝ļ®░, ņØ┤ņĀäņŚÉ ņŗ£Ē¢ēļÉ£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņ╣śļŻīļ│┤ļŗż ļŹö ļéśņØĆ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļāłļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[8]. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śļŖö ņłĀ ņĀä 525.64 ┬▒ 133.24 ╬╝mņŚÉņä£ ņłĀ Ēøä 1Ļ░£ņøöņŚÉ 409.72 ┬▒ 98.45 ╬╝mļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ļ¦Øļ¦ēņØś ĒĢ┤ļČĆĒĢÖņĀü ĒśĖņĀäņØĆ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØś Ļ░£ņäĀ ņĀĢļÅäņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłļŗż.
ĒĢ£ĒÄĖ, ņØ┤ņĀä ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ Ēøä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīļŖö ļ¦Øļ¦ēņØś ĒĢ┤ļČĆĒĢÖņĀü ĒśĖņĀä ļ░Å ņŗ£ļĀź Ļ░£ņäĀĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłņ£╝ļ®░, ļŗ©ņ¦Ć ņ╣śļŻīņŚÉ ņØśĒĢ£ 2ņ░©ņĀüņØĖ ĒÜ©Ļ│╝ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż[24,25,29]. Campos et al [29]ņØĆ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ Ēøä ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīļŖö ņŗ£ļĀź Ļ░£ņäĀĻ│╝ ņ£ĀņØśĒĢ£ Ļ┤ĆĻ│äĻ░Ć ņŚåņŚłņ£╝ļ®░, ļŗ©ņł£Ē׳ ļ¦źļØĮļ¦ēņāüĻ░ĢņØś ņĖĄĒīÉ(lamellae)Ļ│╝ Ļ░äņ¦łņŚÉņä£ņØś ņłśļČä ņ×¼ĒØĪņłśļĪ£ ņØĖĒĢ£ Ļ▓āņØ╝ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ░Å ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīļŖö ļ¬©ļæÉ ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░Éņåī ļ░Å ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź Ļ░£ņäĀ ņĀĢļÅäņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņ¢┤ ņØ┤ņĀä ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżĻ│╝ Ļ░ÖņĢśļŗż. ĒĢśņ¦Ćļ¦ī ļĀłņØ┤ņĀĆļ░śņĀÉĒśłļźśņĪ░ņśüņłĀ(laser speckle flowgraphy)ņØä ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņ×ģņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ļ¦źļØĮļ¦ē ĒśłļźśņØś Ļ░ÉņåīļŖö ņØ┤ņĀäņŚÉ ļ▓öļ¦Øļ¦ēĻ┤æņØæĻ│ĀņłĀņØä ņŗ£Ē¢ēļ░øņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░Éņåī ļ░Å ņŗ£ļĀź Ļ░£ņäĀĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[33]. Ē¢źĒøä ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ┐Éļ¦ī ņĢäļŗłļØ╝ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü Ļ│ĀĻĖē Ļ╣ŖņØ┤ ļ¬©ļō£ņØś ņØ┤ņ¦äĒÖö ĻĖ░ļ▓ĢņØä ĒåĄĒĢśņŚ¼ ļ¦źļØĮļ¦ē ĻĖ░ņ¦łĻ│╝ ĒśłĻ┤Ć ļé┤Ļ░Ģ ĒśĢĒā£ļź╝ ļČäņäØĒĢ£ ļ¦źļØĮļ¦ēĒśłĻ┤Ć ņ¦Ćņłś ļ│ĆĒÖöņŚÉ ļö░ļźĖ ņŗ£ļĀź Ļ░£ņäĀņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀņØä ņ▓śņØī ņŗ£Ē¢ēļ░øņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ĒĢśņśĆņ£╝ļéś, ņłĀ ņĀä ļŗżļźĖ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ņ╣śļŻīļź╝ ļ░øņØĆ Ļ│╝Ļ▒░ļĀź ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ĻĖ░Ļ░äņØĆ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉ ņśüĒ¢źņØä ļ»Ėņ│żņØä ņłś ņ׳ļŗż. ņØ┤ņĀäņŚÉ ņ╣śļŻīļź╝ ļ░øņØĆ ņĀüņØ┤ ņŚåņŚłļŹś ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ļōżņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ļśÉļŖö ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ ņ╣śļŻī Ēøä ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś Ļ░ÉņåīļŖö ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░Éņåī ļ░Å ņŗ£ļĀź Ļ░£ņäĀĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆļŗż[26,27]. ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻī ņĀä ļæÉĻ║╝ņÜ┤ ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ņ╣śļŻī ļ░śņØæņØś ņóŗņØĆ ņāØņ▓┤ņ¦ĆĒæ£Ļ░Ć ļÉĀ ņłś ņ׳ņ£╝ļ®░, ņ▓śņØīņ£╝ļĪ£ ņ╣śļŻīļź╝ ļ░øĻ▒░ļéś ņśżļלļÉśņ¦Ć ņĢŖņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ļŹö ļéśņØĆ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[11]. ņĄ£ĻĘ╝ Dweikat et al [34]ļŖö ņ╣śļŻīļ░øņ¦Ć ņĢŖņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ ņ╣śļŻī Ēøä ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ēņØĆ ņŗ£ļĀź Ļ░£ņäĀĻ│╝ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłņ£╝ļéś, ņłĀ ņĀä ļæÉĻ║╝ņÜ┤ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļŗ©ĻĖ░ņĀü ņ╣śļŻī ļ░śņØæņØś ņóŗņØĆ ņśłņĖĪņØĖņ×ÉņśĆļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ĻĘĖ ĻĖ░ņĀäņ£╝ļĪ£ ĻĖ░ņĪ┤ņØś ļæÉĻ║╝ņÜ┤ ļ¦źļØĮļ¦ēņØä Ļ░Ćņ¦ä Ļ▓ĮņÜ░, ļ╣äĻĄÉņĀü ņåÉņāüļÉśņ¦Ć ņĢŖņØĆ ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄ, ļŹö ņĀüņØĆ ļ¦Øļ¦ēņÖĖņĖĄ ĒŚłĒśł ļ░Å ļŹö ĻĖ░ļŖźņĀüņØĖ Ļ┤æņłśņÜ®ņ▓┤ņÖĆ Ļ┤ĆļĀ© ņ׳ņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņĢśļŗż[34]. ĒĢśņ¦Ćļ¦ī ņ¦äĒ¢ēļÉ£ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņä▒ņןņØĖņ×É ņ”ØĻ░ĆļĪ£ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØ┤ ņ¦äĒ¢ēļÉĀņłśļĪØ, ļ¦źļØĮļ¦ē Ēśłļźś ļ░Å ļæÉĻ╗śĻ░Ć ņ”ØĻ░ĆĒĢśļ®░, ņżæĻ░ä Ēü¼ĻĖ░ ĒśłĻ┤ĆņĖĄ ļ░Å ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄņØś ļæÉĻ╗śļŖö ļŹö ņ¢ćļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[29,30]. ļīĆņĢłņĀü Ļ░ĆņäżņØĆ ļŹö ļæÉĻ║╝ņÜ┤ ļ¦źļØĮļ¦ēņØĆ ļŹö ļåÆņØĆ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņä▒ņןņØĖņ×É ņłśņ╣śņÖĆ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņ£╝ļ®░, ĒÖ®ļ░śļČĆņóģņØ┤ ņŻ╝ļĪ£ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņä▒ņןņØĖņ×ÉņŚÉ ņØśĒĢ┤ ņ£Āļ░£ļÉśļŖö ļ│æņØĖņØä ļéśĒāĆļé┤ņ¢┤ ņØ┤ļ¤¼ĒĢ£ ĒÖśņ×ÉĻ░Ć ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņ╣śļŻīņŚÉ ļŹö ņל ļ░śņØæĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗżļŖö Ļ▓āņØ┤ļŗż[35]. ĒŖ╣Ē׳, ņןņĢĪĒÖ®ļ░śļ░Ģļ”¼(serous macular detachment)ņÖĆ Ļ┤ĆļĀ©ļÉ£ ļ¦źļØĮļ¦ēļæÉĻ╗ś ņ”ØĻ░Ć, ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄ Ēł¼Ļ│╝ņä▒ ņ”ØĻ░Ć, ņÖĖņĖĪĒśłņĢĪļ¦Øļ¦ēņןļ▓Į ņןņĢĀļŖö ņ▓śņØīņ£╝ļĪ£ ņ╣śļŻīļź╝ ļ░øĻ▒░ļéś ņśżļלļÉśņ¦Ć ņĢŖņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ĒśĖļ░£ĒĢ£ļŗż[30]. ļ¦Øļ¦ēņāēņåīņāüĒö╝ņØś ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É Ļ│╝ņ×ēņāØņé░ņŚÉ ņØśĒĢ£ ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄ ļ░Å ņÖĖņĖĪĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØś Ēł¼Ļ│╝ņä▒ ņ”ØĻ░ĆļŖö ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ļ░Å ņןņĢĪĒÖ®ļ░śļ░Ģļ”¼ļź╝ ņØ╝ņ£╝Ēéżļ®░ ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöĻ░Ć ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ņŚÉ ņóŗņØĆ ņ╣śļŻī ļ░śņØæņØä ļéśĒāĆļéĖ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ņ▓½ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ ņĀä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śĻ░Ć ļæÉĻ║╝ņÜĖņłśļĪØ ņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņóŗņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņłĀ ņĀä ļæÉĻ║╝ņÜ┤ ĒĢĀļ¤¼ņĖĄļæÉĻ╗śļŖö ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻīņØś ņóŗņØĆ ļŗ©ĻĖ░ņĀü ņłĀ Ēøä ņŗ£ļĀź ņśłņĖĪņØĖņ×ÉĻ░Ć ļÉĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ļŗżļ¦ī, ļŹö ļ│Ąņ×ĪĒĢ£ Ļ┤ĆĻ│äĻ░Ć ļæÉ ļ│Ćņłś ņé¼ņØ┤ņŚÉ ņ×æņÜ®ĒĢĀ ņłś ņ׳ņ¢┤, Ē¢źĒøä ņ▓śņØīņ£╝ļĪ£ ņ╣śļŻīļź╝ ļ░øĻ▒░ļéś ņśżļלļÉśņ¦Ć ņĢŖņØĆ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØä ĒżĒĢ©ĒĢ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ņ╣śļŻī ĻĖ░Ļ░ä, ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØś ņ¦äĒ¢ē ņĀĢļÅäņŚÉ ļö░ļźĖ ļ╣äĻĄÉ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖļŖö VEGF-A, VEGF-B, Ēā£ļ░śņä▒ņןņØĖņ×Éļź╝ ņ¢ĄņĀ£ĒĢśĻ│Ā ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×ÉņŚÉ Ļ░ĢĒĢśĻ▓ī Ļ▓░ĒĢ®ĒĢśņŚ¼ ļ¦źļØĮļ¦ē Ēśłļźś ļ░Å ĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņŚÉ ņśüĒ¢źņØä ļ»Ėņ│żņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļ®░, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ņ£ĀņØśĒĢ£ ļ¦źļØĮļ¦ē ļ░Å ļ¦Øļ¦ēņØś ĒĢ┤ļČĆĒĢÖņĀü ĒśĖņĀä ļ░Å ņŗ£ļĀź Ļ░£ņäĀņØä ļ│┤ņŚ¼ ņÜ░ņłśĒĢ£ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļāłļŗż. Ē¢źĒøä ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ņ╣śļŻī ĻĖ░Ļ░ä ļ░Å ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØś ņ¦äĒ¢ē ņĀĢļÅäņŚÉ ļö░ļźĖ ļ¦źļØĮļ¦ē Ēśłļźś ļ│ĆĒÖöņŚÉ Ļ┤ĆĒĢ£ ņןĻĖ░ņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ĒĢ£Ļ│äņĀÉņØĆ ņØśļ¼┤ĻĖ░ļĪØņØä ĒåĄĒĢ£ ļŗ©ĻĖ░ņĀüņØĖ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ ļŗ╣ļć©ļ│æņØś ļČäļźś(ņĀ£1ĒśĢ Ēś╣ņØĆ ņĀ£2ĒśĢ), ņ£Āļ│æ ĻĖ░Ļ░ä ļ░Å ļŗ╣ĒÖöĒśłņāēņåī ņłśņ╣ś ĒÖĢņØĖņØ┤ ņ¢┤ļĀżņøī ļŗ╣ļć©ļ│æ ņĪ░ņĀł ņāüĒā£ņŚÉ ļö░ļźĖ Ļ▓░Ļ│╝ ņ░©ņØ┤ļź╝ ļ░śņśüĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. Endo et al [20]ņØĆ ļŗ╣ļć©ļ│æ ņĪ░ņĀłņØ┤ ņלļÉ£ ļŗ╣ĒÖöĒśłņāēņåī ņłśņ╣śĻ░Ć ļé«ņØĆ ĒÖśņ×ÉļŖö ņĀĢņāüņØĖĻ│╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ņżæņŗ¼ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņ¢┤, ņĀäņŗĀņĀüņØĖ ļŗ╣ļć© ņ╣śļŻīĻ░Ć ļ¦źļØĮļ¦ē ņÖĖņĖĄ ļæÉĻ╗śņØś ņĢłņĀĢĒÖöņŚÉ Ēü¼Ļ▓ī ĻĖ░ņŚ¼Ē¢łņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņĢśļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś ļīĆņāüņĢł 36ņĢł ņżæ 24ņĢłņØ┤ ņØ┤ņĀäņŚÉ ļ▓öļ¦Øļ¦ēĻ┤æņØæĻ│ĀņłĀņØä ņŗ£Ē¢ēļ░øņĢśņ£╝ļéś, ĒśĢĻ┤æņĢłņĀĆĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņØĆ ĒÖśņ×ÉĻ░Ć ļŗżņłś ĒżĒĢ©ļÉśņ¢┤ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØś ņĀĢļÅäļéś ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ņ£ĀĒśĢņŚÉ ļö░ļźĖ Ļ▓░Ļ│╝ ņ░©ņØ┤ļŖö ļČäņäØĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. ļ¦źļØĮļ¦ēņØś ļæÉĻ╗śļŖö ļéśņØ┤(ņŚ░ņżæ ļ│ĆļÅÖ), ņĢłņČĢņן, ĒśłņĢĢ, ņĢłņĢĢ, ņØ╝ņżæļ│ĆļÅÖ ļō▒ ņŚ¼ļ¤¼ ņØĖņ×ÉņŚÉ ņśüĒ¢źņØä ļ░øņ£╝ļéś[11], ļ│Ė ņŚ░ĻĄ¼ļŖö 1Ļ░£ņøöņØ┤ļØ╝ļŖö ņ¦¦ņØĆ ĻĖ░Ļ░äņØś Ļ░£ņØĖ ļé┤ ļ╣äĻĄÉļĪ£ ņĀäņŗĀņØĖņ×ÉĻ░Ć Ļ▓░Ļ│╝ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ņĀüņŚłņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ņłĀ ņĀäĻ│╝ ņłĀ Ēøä ņĢłņĢĢ ņé¼ņØ┤ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļ®░, ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņŗ£Ļ░äļīĆ ļśÉĒĢ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņ¢┤ ņØ╝ņżæ ļ│ĆļÅÖņŚÉ ņØśĒĢ£ ņśüĒ¢źņØĆ ņĀüņŚłņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ļŖö ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ņŖżĒÄÖĒŖĖļ¤╝ ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ▓½ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņ×ģņłĀ Ēøä 1Ļ░£ņøöņ¦Ė ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ░Å ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś ļ│ĆĒÖöļź╝ ļČäņäØĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝, ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś, ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ĒśĖņĀäļÉśņ¢┤ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņŻ╝ņé¼Ļ░Ć ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉ ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīņ×äņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śņØś Ļ░ÉņåīļŖö ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆņ£╝ļéś, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś Ļ░Éņåī ļ░Å ņŗ£ļĀź Ļ░£ņäĀĻ│╝ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļŖö ņŚåņŚłļŗż. ĻĘĖļ¤¼ļéś ņłĀ ņĀä ĒÖ®ļ░śĒĢś ĒĢĀļ¤¼ņĖĄļæÉĻ╗śĻ░Ć ļæÉĻ║╝ņÜĖņłśļĪØ ņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ ņóŗņĢśļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĻĄŁļé┤ņŚÉņä£ ņ▓śņØīņ£╝ļĪ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņŚÉņä£ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņ£Āļ”¼ņ▓┤Ļ░Ģļé┤ņŻ╝ņ×ģņłĀ Ēøä ĒĢĀļ¤¼ņĖĄļæÉĻ╗ś ļ░Å ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ│ĆĒÖöņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśņśĆļŗż. 1Ļ░£ņøöņØ┤ļØ╝ļŖö ņ¦¦ņØĆ ļŗ©ĻĖ░ Ļ▓░Ļ│╝ņØ┤ņ¦Ćļ¦ī, ņŻ╝ņé¼ ņĀä ĒĢĀļ¤¼ņĖĄļæÉĻ╗śļŖö ņłĀ Ēøä ļŗ©ĻĖ░ņĀü ņŗ£ļĀź ņśłĒøäļź╝ ņśłņĖĪĒĢśļŖö ļŹ░ ņ£ĀņÜ®ĒĢ£ ņØĖņ×ÉĻ░Ć ļÉĀ ņłś ņ׳ļŗżĻ│Ā ņĀ£ņŗ£Ē¢łļŗżļŖö ņĀÉņŚÉņä£ ņØśņØśĻ░Ć ņ׳ļŗż. Ē¢źĒøä ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ ņ╣śļŻī Ēøä ļ¦źļØĮļ¦ē ļ│ĆĒÖöņŚÉ Ļ┤ĆĒĢ£ ņל ĒåĄņĀ£ļÉ£ ņןĻĖ░ņĀüņØĖ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ĒĢäņÜöĒĢśļŗż.
Figure┬Ā1.
Illustrates the method used for subfoveal Haller layer thickness (SFHT) and subfoveal choroidal thickness (SFCT) measurement on a spectral-domain optical coherence tomography with enhanced depth imaging. In a linear horizontal scan penetrating the fovea, SFCT was measured by drawing a subfoveal vertical line (blue solid line) extending from outer border of the hyperreflective retinal pigment epithelium (RPE)-BruchŌĆÖs membrane (BM) complex to the inner border of the choroid-scleral junction. The large choroidal vessel lumen with a diameter of 100 ╬╝m or more (blue asterisks) within 750 ╬╝m on either side of the fovea was identified. A line horizontal to this lumen (red-dotted line) was drawn at the innermost margin of the large vessel lumen. A line perpendicular to this horizontal line (light blue-dotted line) extending to the inner border of the choroid-scleral junction was drawn which gave
SFHT.
Figure┬Ā2.
Scatter plots for correlation between change in subfoveal Haller layer thickness (╬öSFHT) and change in subfoveal choroidal thickness (╬öSFCT) 1 month after intravitreal aflibercept injection. There was significant correlation between ╬öSFHT and ╬öSFCT (Žü = 0.729, p < 0.001). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.
Figure┬Ā3.
Scatter plots for each correlation between change in subfoveal Haller layer thickness (╬öSFHT), subfoveal choroidal thickness (╬öSFCT), central macular thickness (╬öCMT) and change in best-corrected visual acuity (╬öBCVA) 1 month after intravitreal aflibercept injection. (A) There was no significant correlation between ╬öSFHT and ╬öBCVA (Žü = -0.076, p = 0.657). (B) There was no significant correlation between ╬öSFCT and ╬öBCVA (Žü = -0.015, p = 0.930). (C) There was significant correlation between ╬öCMT and ╬öBCVA (Žü = 0.400, p = 0.016). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.

Figure┬Ā4.
Scatter plots for each correlation between baseline subfoveal Haller layer thickness (SFHT), subfoveal choroidal thickness (SFCT), central macular thickness (CMT) and best corrected visual acuity (BCVA) 1 month after intravitreal aflibercept injection (IVA). (A) There was significant correlation between baseline SFHT and BCVA 1 month after IVA (Žü = -0.342, p = 0.041). (B) There was no significant correlation between baseline SFCT and BCVA 1 month after IVA (Žü = -0.276, p = 0.103). (C) There was no significant correlation between baseline CMT and BCVA 1 month after IVA (Žü = 0.227, p = 0.184). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.
Figure┬Ā5.
Scatter plots for each correlation between change in subfoveal Haller layer thickness (╬öSFHT), subfoveal choroidal thickness (╬öSFCT), central macular thickness (╬öCMT) and best corrected visual acuity (BCVA) 1 month after intravitreal aflibercept injection (IVA). (A) There was no significant correlation between ╬öSFHT and BCVA 1 month after IVA (Žü = -0.112, p = 0.515). (B) There was no significant correlation between ╬öSFCT and BCVA 1 month after IVA (Žü = -0.079, p = 0.646). (C) There was no significant correlation between ╬öCMT and BCVA 1 month after IVA (Žü = -0.295, p = 0.081). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.
Table┬Ā1.
Demographic characteristics and clinical features of the patients
Table┬Ā2.
Reproducibility of the choroidal thickness by two observers at each period
Table┬Ā3.
Values of parameters at baseline and at 1 month after intravitreal aflibercept injection
| Variable | Pre-injection | Post-injection 1 month | p-value |
|---|---|---|---|
| Subfoveal Haller layer thickness (╬╝m) | 214.28 ┬▒ 80.00 | 199.56 ┬▒ 75.76 | 0.001* |
| Subfoveal choroidal thickness (╬╝m) | 307.89 ┬▒ 96.30 | 290.36 ┬▒ 94.63 | <0.001* |
| Central macular thickness (╬╝m) | 525.64┬▒133.24 | 409.72 ┬▒ 98.45 | <0.001ŌĆĀ |
| BCVA (logMAR) | 0.56 ┬▒ 0.31 | 0.50 ┬▒ 0.39 | 0.012ŌĆĀ |
| IOP (mmHg) | 14.30 ┬▒ 3.14 | 14.34 ┬▒ 3.25 | 0.947* |
REFERENCES
1) Klein R, Klein BE, Moss SE, et al. The Wisconsin epidemiologic study of diabetic retinopathy. IV. Diabetic macular edema. Ophthalmology 1984;91:1464-74.


2) Schmidt-Erfurth U, Garcia-Arumi J, Bandello F, et al. Guidelines for the management of diabetic macular edema by the European Society of Retina Specialists (EURETINA). Ophthalmologica 2017;237:185-222.



3) Papadopoulos N, Martin J, Ruan Q, et al. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis 2012;15:171-85.




4) Wells JA, Glassman AR, Ayala AR, et al. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med 2015;372:1193-203.



5) Chen YY, Chang PY, Wang JK. Intravitreal aflibercept for patients with diabetic macular edema refractory to bevacizumab or ranibizumab: analysis of response to aflibercept. Asia Pac J Ophthalmol (Phila) 2017;6:250-5.


6) Bahrami B, Hong T, Zhu M, et al. Switching therapy from bevacizumab to aflibercept for the management of persistent diabetic macular edema. Graefes Arch Clin Exp Ophthalmol 2017;255:1133-40.



7) Glassman AR, Wells JA 3rd, Josic K, et al. Five-year outcomes after initial aflibercept, bevacizumab, or ranibizumab treatment for diabetic macular edema (Protocol T Extension Study). Ophthalmology 2020;127:1201-10.


8) Hwang JH, Park S, Kim CG, et al. Short-term efficacy of intravitreal aflibercept therapy for diabetic macular edema. J Retin 2021;6:34-40.

9) Spaide RF, Koizumi H, Pozzoni MC. Enhanced depth imaging spectral-domain optical coherence tomography. Am J Ophthalmol 2008;146:496-500.


10) Bayhan HA, Bayhan SA, Can ─░. Evaluation of the macular choroidal thickness using spectral optical coherence tomography in pseudoexfoliation glaucoma. J Glaucoma 2016;25:184-7.


11) Campos A, Campos EJ, Martins J, et al. Viewing the choroid: where we stand, challenges and contradictions in diabetic retinopathy and diabetic macular oedema. Acta Ophthalmol 2017;95:446-59.



12) Hidayat AA, Fine BS. Diabetic choroidopathy. Light and electron microscopic observations of seven cases. Ophthalmology 1985;92:512-22.


13) Kaur C, Foulds WS, Ling EA. Blood-retinal barrier in hypoxic ischaemic conditions: basic concepts, clinical features and management. Prog Retin Eye Res 2008;27:622-47.


14) Funatsu H, Yamashita H, Noma H, et al. Increased levels of vascular endothelial growth factor and interleukin-6 in the aqueous humor of diabetics with macular edema. Am J Ophthalmol 2002;133:70-7.


15) Vujosevic S, Torresin T, Berton M, et al. Diabetic macular edema with and without subfoveal neuroretinal detachment: two different morphologic and functional entities. Am J Ophthalmol 2017;181:149-55.


16) Yazici A, Sogutlu Sari E, Koc R, et al. Alterations of choroidal thickness with diabetic neuropathy. Invest Ophthalmol Vis Sci 2016;57:1518-22.


17) Endo H, Kase S, Saito M, et al. Choroidal thickness in diabetic patients without diabetic retinopathy: a meta-analysis. Am J Ophthalmol 2020;218:68-77.


18) Hamadneh T, Aftab S, Sherali N, et al. Choroidal changes in diabetic patients with different stages of diabetic retinopathy. Cureus 2020;12:e10871.



19) Kim JT, Lee DH, Joe SG, et al. Changes in choroidal thickness in relation to the severity of retinopathy and macular edema in type 2 diabetic patients. Invest Ophthalmol Vis Sci 2013;54:3378-84.


20) Endo H, Kase S, Takahashi M, et al. Alteration of layer thickness in the choroid of diabetic patients. Clin Exp Ophthalmol 2018;46:926-33.



21) Gupta P, Thakku SG, Sabanayagam C, et al. Characterisation of choroidal morphological and vascular features in diabetes and diabetic retinopathy. Br J Ophthalmol 2017;101:1038-44.


22) Endo H, Kase S, Takahashi M, et al. Relationship between diabetic macular edema and choroidal layer thickness. PLoS One 2020;15:e0226630.



23) Kniggendorf VF, Novais EA, Kniggendorf SL, et al. Effect of intravitreal anti-VEGF on choroidal thickness in patients with diabetic macular edema using spectral domain OCT. Arq Bras Oftalmol 2016;79:155-8.


24) Yiu G, Manjunath V, Chiu SJ, et al. Effect of anti-vascular endothelial growth factor therapy on choroidal thickness in diabetic macular edema. Am J Ophthalmol 2014 158:745-51. e2.



25) Lee SH, Kim J, Chung H, Kim HC. Changes of choroidal thickness after treatment for diabetic retinopathy. Curr Eye Res 2014;39:736-44.


26) Nourinia R, Ahmadieh H, Nekoei E, et al. Changes in central choroidal thickness after treatment of diabetic macular edema with intravitreal bevacizumab correlation with central macular thickness and best-corrected visual acuity. Retina 2018;38:970-5.


27) Rayess N, Rahimy E, Ying GS, et al. Baseline choroidal thickness as a predictor for response to anti-vascular endothelial growth factor therapy in diabetic macular edema. Am J Ophthalmol 2015 159:85-91. e1-3.


28) La├Łns I, Figueira J, Santos AR, et al. Choroidal thickness in diabetic retinopathy: the influence of antiangiogenic therapy. Retina 2014;34:1199-207.

29) Campos A, Campos EJ, do Carmo A, et al. Choroidal thickness changes stratified by outcome in real-world treatment of diabetic macular edema. Graefes Arch Clin Exp Ophthalmol 2018;256:1857-65.



30) Adhi M, Brewer E, Waheed NK, Duker JS. Analysis of morphological features and vascular layers of choroid in diabetic retinopathy using spectral-domain optical coherence tomography. JAMA Ophthalmol 2013;131:1267-74.



31) Manjunath V, Yiu G, Chiu S, et al. Effect of focal laser and anti-VEGF therapy on choroidal thickness in diabetic macular edema as measured by enhanced-depth imaging optical coherence tomography. Invest Ophthalmol Vis Sci 2013;54:2363.
32) Giorno P, Parravano M, Oddone F, et al. Retinal-choroidal changes after intravitreal ranibizumab in diabetic macular edema: 12 months follow-up. Invest Ophthalmol Vis Sci 2014;55:576.
33) Okamoto M, Yamashita M, Ogata N. Effects of intravitreal injection of ranibizumab on choroidal structure and blood flow in eyes with diabetic macular edema. Graefes Arch Clin Exp Ophthalmol 2018;256:885-92.







 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




