20대 한국인에서 관찰되는 제2형 과립각막이상증의 다양한 표현형에 대한 고찰
Phenotypes of Granular Corneal Dystrophy Type 2 among Koreans in Their Twenties
Article information
Abstract
목적
제2형 과립각막이상증(granular corneal dystrophy type 2, GCD2)은 각막에 과립 및 격자형 침착물이 생기는 유전 질환으로, 동형접합자와 이형접합자가 있다. GCD2는 중심각막수술 후 악화되며, 이형접합자의 표현형에 개인차가 보고되는 바, 굴절수술이 잦은 국내 20대에서 관찰된 다양한 표현형을 조사하였다.
대상과 방법
유전자(transforming growth factor β induced gene)검사 결과 R124H 변이가 발견되어 GCD2로 진단된 20대 환자 중 동형접합자 1인, 복합이형접합자 1인, 단순 이형접합자임에도 과립형 참착물이 나이에 비하여 많은 1인, 보편적인 표현형의 이형접합자 1인, 각막에 초기 증상인 과립형 침착물이 보이지 않는 이형접합자 4인의 각막을 세극등현미경으로 관찰 및 촬영하였다.
결과
동형접합자는 각막을 뒤덮는 융합성의 과립침착물을 보였다. 복합이형접합자의 경우 중심각막을 대부분 덮는 과립형과 격자형 각막혼탁을 보였다. 단순 이형접합자임에도 단안에 30개 내외의 과립형 침착물이 존재하는 경우도 있었다. 투명각막으로 판정받았던 이형접합자 4인 중에서 1인은 6개월 뒤 단안에 미세한 1개의 병변을, 1인은 3주 뒤 재검 시 단안에 매우 희미한 의심 병변 1개를 보였으며, 2인은 1회 조사 후에 투명각막으로 판정하였다.
결론
20대의 GCD2 환자에서, 매우 혼탁한 각막부터 거의 투명한 경우까지 다양한 표현형이 나타남을 확인하였다. 병변 발견이 힘든 GCD2 각막이 존재하므로 각막 중심부 수술 전 세심한 관찰과 검사가 필요하다.
Trans Abstract
Purpose
Granular corneal dystrophy type 2 (GCD2) is a hereditary disease that features granular and lattice stromal deposits in the cornea. There are homozygotes and heterozygotes and the opacities are exacerbated by corneal trauma or surgery, such as laser in situ keratomileusis (LASIK). As there is individual variability in GCD2 phenotypes, we investigated various corneal features of GCD2 patients in their twenties, the main age group for refractive surgery.
Methods
From genetically confirmed GCD2 patients who had an R124H mutation of the transforming growth factor β induced (TGFBI) gene at age 20 to 29 years, we chose representative patients: one homozygote; one compound heterozygote; one simple heterozygote with a severe phenotype with many granular deposits; one common heterozygote; and four heterozygotes with normal corneas. The corneas of all patients were subject to slit-lamp examination and photographed.
Results
The homozygote had confluent granular deposits covering the cornea. The compound heterozygote had granular and lattice deposits covering the center of the cornea. The patient with a severe phenotype had more than 30 granular deposits in one eye, but was a simple GCD2 heterozygote, verified by full-sequencing of the TGFBI gene. In the four patients with normal corneas, a single small lesion was subsequently detected during follow-up in two, at 3 weeks and 6 months, respectively. Both corneas were judged clear at chance examinations.
Conclusions
Among Koreans in their twenties, GCD2 patients have various phenotypes, from clear corneas to severe confluent opacities. There are GCD2 heterozygotes with nearly clear corneas, so caution must be taken when choosing patients for refractive surgery.
제2형 과립각막이상증(granular corneal dystrophy type 2, GCD2)은 각막에 과립형과 격자형의 침착물이 생기는 상염색체 우성 유전 질환이다[1-3]. 5번 염색체의 장완(5q31)에 위치한 TGFBI 유전자(transforming growth factor β-induced gene)의 124 코돈에 아르기닌이 히스티딘으로 대체되는 (R124H) 돌연변이로 인해 생성된 비정상적인 단백질(transforming growth factor β induced protein, TGFBIp)이 각막세포 외기질에 침착되어 혼탁을 유발한다[4-6]. 국내 이형접합자의 빈도는 1만 명당 11.5명[7] 또는 29.1명[8]으로 보고되는 등 적지않은 빈도를 보인다.
GCD2는 상염색체 R124H 변이를 2개 갖는 동형접합자가 1개 갖는 이형접합자보다 심한 혼탁을 보이는 것으로 보고되었다. 즉 동형접합자의 경우 3-5세부터 각막에 침착물이 나타나기 시작하여, 이른 나이에 심한 각막혼탁을 보이는 것을 특징으로 하며[9,10], 이형접합자에서는 6-16세 사이 처음 각막에 과립형 병변을 발견할 수 있고, 35세 이후에는 과립형과 격자형의 침착물이 동시에 관찰되다가, 50세 이후에 각막실질의 광범위한 혼탁(haze)이 생긴다[11,12]. 이형접합자에서의 과립 및 격자형의 침착물의 개수는 매우 다양하여[2], 그 표현형에 개인차가 있다. 최근에는 TGFBI 유전자에 R124H 외에 또 다른 돌연변이가 대립유전자(allele)에 동반되는 복합이형접합자에서 심한 각막혼탁이 나타나는 것이 보고되었다[13-16].
Laser-assisted in situ keratomileusis (LASIK)나 laserassisted subepithelial keratomileusis 등 각막을 포함한 굴절수술 후 각막혼탁이 악화된 GCD2 환자들의 사례가 국내외에서 보고된 이후로, 중심각막에 시술이 이루어지는 굴절수술은 GCD2 환자들의 경우 금기로 여겨진다[3,17-19]. 한편 굴절수술의 주요 연령층인 20대에서는 GCD2 이형접합자의 표현형이 노년층에 비하여 적게 나타나는 세대로 수술대상자 선정에 주의가 필요하다. 따라서 본 연구는 20대로 한정시킨 GCD2 환자들을 대상으로, 임상에서 관찰된 심한 표현형의 동형접합자와 복합이형접합자, 표현형이 정상 또는 정상에 가까운 단순 이형접합자를 포함한 다양한 형태의 GCD2 각막혼탁 사례를 제시하며, 또한 각막중심부수술환자 선정 등에 대한 참고적인 자료를 제시하고자 한다.
대상과 방법
2010년부터 2022년 2월까지 수집된 20세에서 29세 사이의 GCD2 환자들 중 각 유전형에 따른 대표적인 환자를 선정하여 의무기록을 후향적으로 조사하였다. 본 연구는 자료가 수집된 두 기관의 임상연구심의위원회(Institutional Review Board [IRB])의 승인에 따라 진행되었다(IRB 승인 번호 : 새빛안과병원 202205-001-01, 세브란스 병원 4-2012-0209)
유전자검사 결과 동형접합자 1인, 복합 이형접합자 1인, 단순 GCD2 이형접합자임에도 비교적 심한 표현형을 보이는 1인, 다수의 GCD2 이형접합자 중 보편적으로 볼 수 있는 1인, 초기 세극등현미경으로 각막 침착물이 보이지 않는 이형접합자 4인을 선정하여 안과적 병력을 조사하고 세극등현미경으로 자세히 관찰 및 촬영하였다. 본 논문에서는 환자 기술의 편의를 위하여 상기 기술한 순서대로 각 환자의 번호를 붙이기로 하였다.
유전자검사는 혈액 혹은 구강 상피를 이용하여 시행하였는데, 두 기관 이상의 자료를 수집하여 환자별로 유전자검사 방식이 다소 상이하였다. 환자 1, 2, 3, 5는 QIAmp DNA blood kit (Qiagen, Hilden, Germany)를 이용하여 말초 백혈구의 DNA를 채취하였다. Maxime PCR premix kit (iNtRON Biotechnology, Seongnam, Korea)를 이용하여 제조사의 지침에 따라 R124H를 포함하는 exon4의 프라이머로 중합효소연쇄반응(polymerase chain reaction, PCR)을 수행하였다. 환자 4, 6, 7은 Copan CLASSIQSwabs®155C(Copan Diagnostics, Inc., Murrieta, CA, USA)를 이용하여 구강상피를 채취, Avellino Lab USA, Inc. (Menlo Park, CA, USA)를 통해 real-time PCR을 수행하였으며 그 과정에서 7500 FAST PCR system (ThermoFisher Scientific, Waltham, MA, USA)을 이용하였다. 환자 8은 혈액검사와 구강상피검사 두 가지 방법을 모두 사용하여 검사하였다. 복합 이형접합자인 환자 2와 보통 이형접합자이나 심한 표현형을 보인 환자 3의 경우 혈액에서 추출된 DNA를 Sanger sequencing을 통해 17개 exon 모두를 각각의 프라이머를 이용하여 이전 연구와 동일한 방식으로 TGFBI 전체 유전자를 분석하였다[13].
결 과
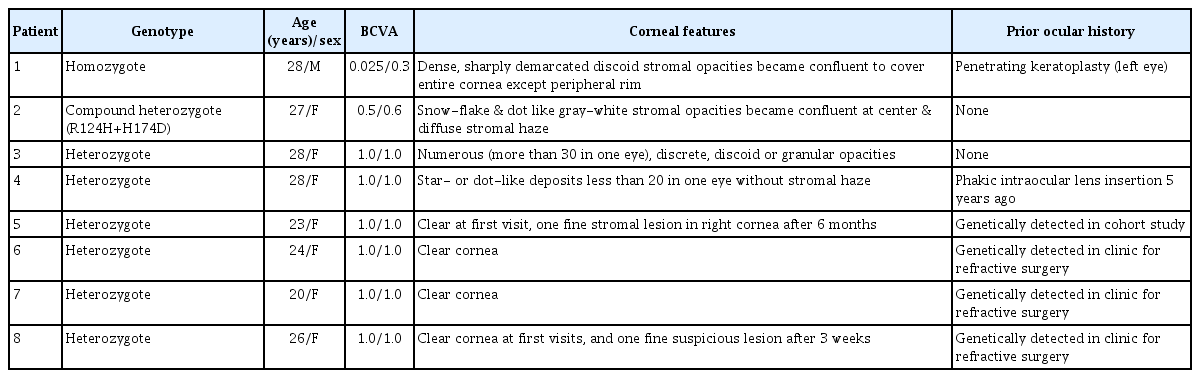
환자 1-8의 유전형, 나이, 성별, 임상적 특징을 Table 1에 정리하였다. 환자 1(동형접합자)는 28세 남자로 R124H 동형접합자이며, 좌안은 과거에 각막이식수술을 하였다. 수술력이 없는 우안은 최대교정시력 0.025로 흰 색의 경계가 명확한 원반형 각막기질 침착물이 크기가 커지고 서로 융합되어 각막 중심부 전체를 뒤덮은 모습으로 각막윤부는 침착물 없이 깨끗하였다(Fig. 1).
Cornea of patient 1, homozygote of granular corneal dystrophy type 2. (A, B) Right cornea. Dense, sharply demarcated stromal opacities became confluent to cover entire cornea except peripheral rim.
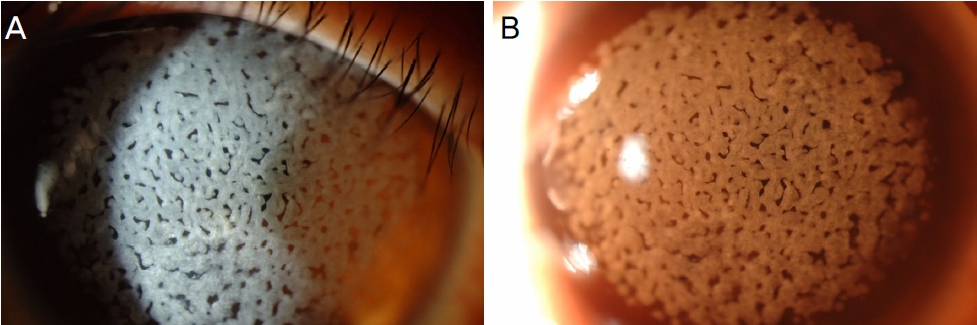
환자 2(복합 이형접합자)는 27세 여자로 TGFBI 유전자의 한 쪽 대립유전자(allele)에는 R124H (Arg124His), 반대쪽 대립유전자에는 H174D (His174Asp) 돌연변이가 생긴 복합이형접합자이다. 우안 및 좌안의 최대교정시력이 각각 0.5, 0.6으로, 눈꽃 송이 모양 혹은 점 모양의 회백색 기질 혼탁이 관찰되며 각막 중심부에서는 서로 융합되는 모습을 보인다. 또한 각막실질 흐림이 중심부에 나타났다(Fig. 2).
Corneas of patient 2, compound heterozygote (R124H+H174D) of granular corneal dystrophy type 2 ([A] right eye, [B] left eye). Multiple snow-flake and dot like gray-white stromal opacities became confluent at the center of the corneas and diffuse stromal haze (yellow arrows) can be detected.
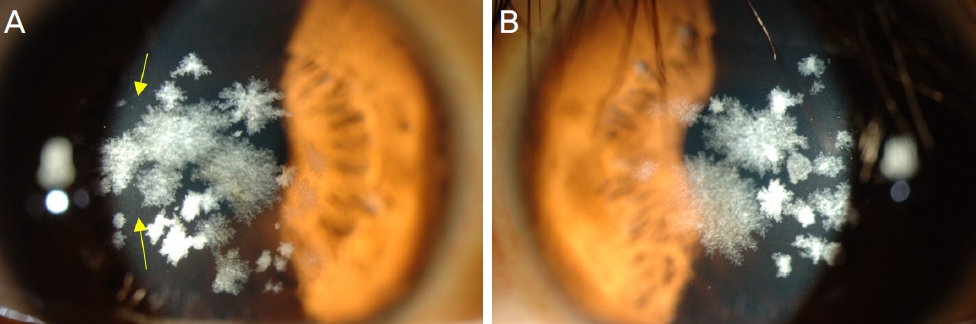
환자 3(단순 GCD2 이형접합자임에도 심한 표현형을 보이는 환자)은 28세 여자 R124H 이형접합자 환자로, 경계가 명확한 과립성 혹은 원반형의 침착물들이 한 쪽 각막에 30개 이상 보였다. 보통의 20대 이형접합자보다 심한 표현형을 보여 TGFBI 전체 유전자를 Sanger sequencing으로 검사하였지만 R124H 외의 돌연변이를 발견할 수 없었다. 최대교정시력은 양안 1.0이었다(Fig. 3).
Corneas of patient 3 (simple heterozygote of granular corneal dystrophy type 2) show severe phenotypes ([A] right eye, [B] left eye). Numerous, discrete granular opacities more than 30 in one eye can be detected.
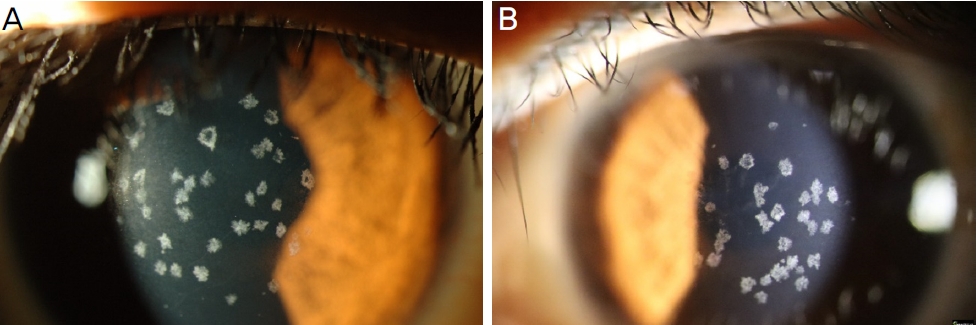
환자 4(보편적인 표현형의 GCD2 이형접합자)는 28세 R124H 이형접합자로 한 쪽 각막에 10개 내외의 과립성 침착을 보였으며 미만성 각막실질 흐림은 관찰되지 않았다. 양안에 5년전 유수정체 안내렌즈삽입술(AQUA ICL; STAAR Surgical Company, Monrovia, CA, USA)을 시행받았으며, 최대교정시력 양안 1.0이었다(Fig. 4).
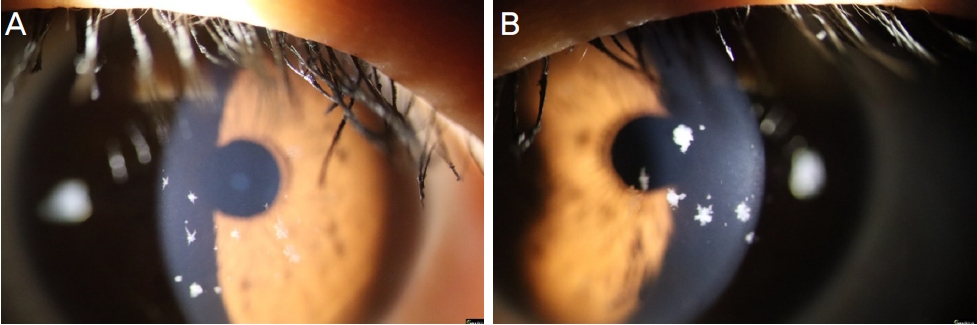
Corneas of patient 4, simple heterozygote of granular corneal dystrophy type 2 ([A] right eye, [B] left eye). Star-like and dot-like deposits less than 20 in one eye were detected without diffuse stromal haze.
환자 5(투명한 각막을 보이는 이형접합자)는 23세로 GCD2 가족 코호트 연구의 대상자로서, GCD2 이형접합자의 세극등 소견을 보이는 어머니와 동행한 상황에서 GCD2의 세극등 관찰을 받았으며, 투명각막 판정을 받았다. 이후 연구 방법상 시행된 유전자검사에서 이형접합자로 확인되었다(Fig. 5). 유전자검사 6개월 후 각막을 정밀하게 재검한 결과 우안에 미세한 각막실질 병변이 발견되었다(환자 5는 이전 연구[2]에서 언급된 환자로 희귀한 예이므로 본 연구에 참고문헌 제시와 함께 인용하되 이전 연구와는 다른 세극등 사진을 게재하였다).
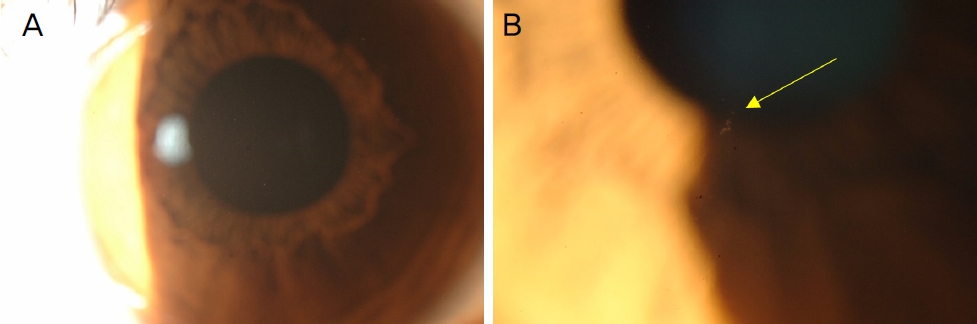
Right cornea of patient 5, heterozygote of granular corneal dystrophy type 2 (GCD2). She had clear cornea when was firstly diagnosed with GCD2 (A, sclerotic scatter) but after 6 months, one fine stromal lesion (B, arrow) in right cornea was detected.
환자 6, 7(투명한 각막을 보이는 이형접합자)은 각각 24세, 20세로 굴절수술을 활발히 시행하는 안과의원에서 굴절수술을 받기 위해 시행한 세극등검사에서 병변이 발견되지 않았다(Fig. 6). 세극등검사 직후 시행한 유전자검사에서 GCD2 진단을 받았으며, 사진 배율이 높지 않으나 노련한 집도 예정의들의 판정이 있어 투명각막으로 분류하였다.
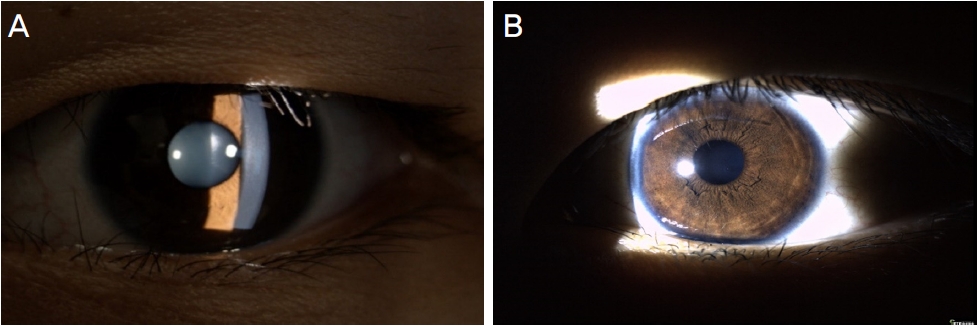
Photographs of patient 6, 7 (heterozygotes of granular corneal dystrophy type 2 [GCD2]) show clear cornea ([A] left eye of patient 6, [B] left eye of patient 7). They visited the ophthalmologists for refractive surgery and were incidentally diagnosed with GCD2 by genetic test.
환자 8(투명한 각막을 보이는 이형접합자)은 26세 환자로 역시 굴절수술을 위해 두 곳의 굴절수술의원을 방문하여, 투명각막과 GCD2 유전자 이형접합자로 진단받았다. 두 곳의 유전자검사 결과를 지참한 상태에서 재차 고배율 세극등검사로 양안의 각막을 면밀히 검사하였으나 아주 작은 병변도 발견할 수 없었다. 혈액과 구강상피를 이용한 2차례의 유전자검사를 다시 시행하였으며 R124H 이형접합자로 결과가 동일하였다. 3주 후 내원 시 세극등현미경검사를 다시 시행하였을 때도 역시 투명한 각막이었지만, 극도의 엄격한 기준을 적용하면 우안에 미세한 각막실질 병변을 볼 수 있었다(Fig. 7).
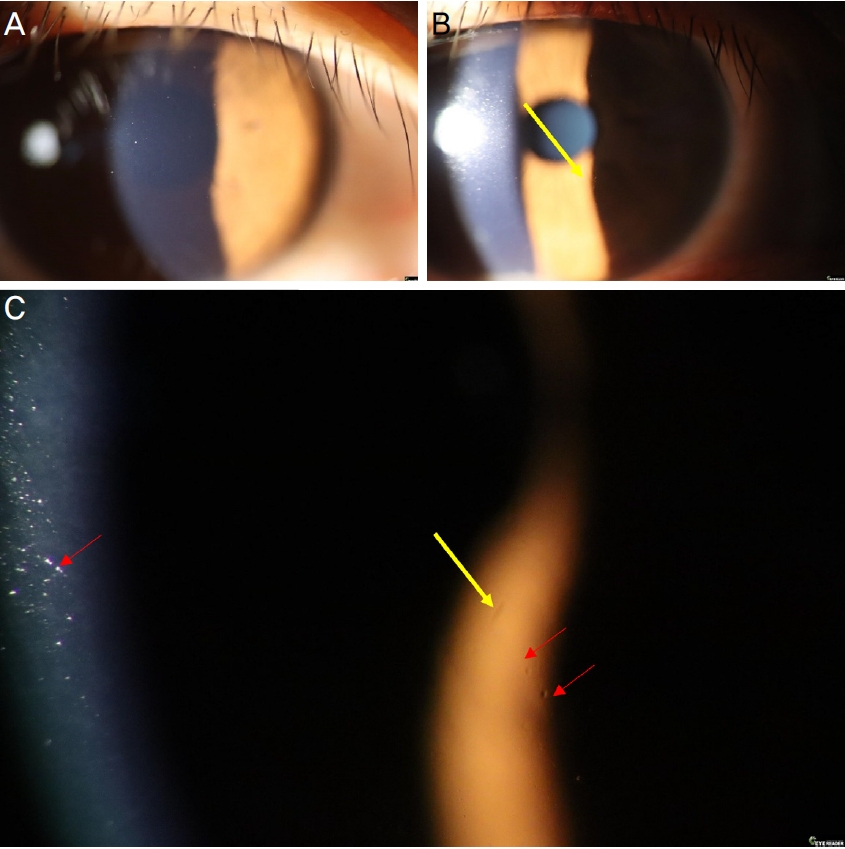
Cornea of patient 8, heterozygote of granular corneal dystrophy type 2 (GCD2). She was diagnosed with GCD2 heterozygote when she visited the ophthalmologist for refractive surgery. She had clear cornea at first visit ([A] right cornea) but one suspicious stromal lesion ([B, C] yellow arrows) was found in right cornea 6 months later. Red arrows in (C) are dusts in tear film.
고 찰
이 연구의 결과는 GCD2 20대 환자의 각막 표현형이 매우 다양할 수 있음을 보여주고 있다. 즉, 동형접합자의 경우 기존에 보고된 바와 같이 매우 심한 혼탁을 보여, 안과 의사는 바로 진단을 유추할 수 있는 정도이나[9], 이형접합자는 매우 심한 경우와 세극등으로 혼탁의 발견이 어려운 경우까지 다양하였다.
임상에서 GCD2의 표현형이 다양하게 발생하는 이유에 대한 설명은 현재로서는 확정되어 있지 않다. GCD2의 R124H 돌연변이는 각막에 TGFBIp 축적을 증가시켜 각막 혼탁을 유발한다. 이전 연구에 따르면, 동형접합자 각막의 섬유모세포는 자가 포식 기능(autophagy)이 손상된 채로 심한 산화 스트레스를 받아, 변이된 TGFBIp의 세포 밖으로의 배출이 늦어진다[20,21]. 즉 동형접합자의 각막혼탁이 본 연구의 환자 1과 같이 매우 심한 이유는 생성된 TGFBIp이 각막에 과도하게 침착된 결과로 보인다.
일반적인 20대의 GCD2 이형접합자의 경우에는 혼탁의 정도가 심하지 않아 비교적 양호한 시력을 보이며, 본 연구의 환자 4 또한 단안에 10개 내외의 과립성 혼탁을 보이며 시력을 유지하였다. Chung et al [1]은 경계가 명확한 병변의 개수를 세어 중증 정도를 분류하였는데, 10개 미만인 군의 평균 연령은 23세, 10개 이상 25개 미만인 군의 평균 연령은 40세, 25개 이상인 군의 평균 연령은 53세로 보고한 바 있다. 그러나 일부 예에서 보통보다 심한 경우가 보고되고 있으며, 이런 경우에는 한 유전자에 두 가지 이상의 변이가 존재하는 복합이형접합자(compound heterozygote)의 경우도 알려졌다(Fig. 8) [13]. 본 연구의 환자 2의 경우, 5번 염색체의 한 쪽 대립유전자에는 R124H 돌연변이를, 반대쪽 대립유전자에 H174D를 가진 trans형 복합이형접합자였으며 그 결과 기존에 보고된 바와 같이 심한 각막 표현형을 보였다[13-16]. 복합이형접합자가 일반적인 이형접합자보다 심한 표현형을 보이는 원인에 대해서는 아직 밝혀진 바가 없으나, H174D를 발현하는 세포와 R124H 각막 섬유모세포를 함께 배양한 체외 연구[13]에서 TGFBIp oligomer와 응집체가 증가하는 것이 확인되었다. 이러한 관찰 결과를 분석하여, GCD2의 R124H 돌연변이는 반대쪽 대립유전자가 정상인 경우에는 R124H의 발현 정도가 억제되고, 반대쪽 대립유전자도 비정상인 복합 이형접합자의 경우에는 R124H의 발현이 억제되지 않아 일반적인 이형접합자보다 혼탁이 심하게 발생될 것이라는 가설도 있다[13]. 본 연구 환자 3의 경우, 보편적인 20대의 GCD2 이형접합자보다 심한 표현형을 보였는데[1], TGFBI 전체 유전자검사 시에도 R124H 외의 다른 돌연변이를 찾을 수 없어, 일반적인 이형접합자 표현형의 범위가 매우 넓음을 보여주었다. 세포 내의 TGFBIp는 용해 소체(lysosome)를 통해 제거되는데, 배양된 GCD2 각막 섬유모세포에서는 이러한 기능이 손상되어 있는 것이 밝혀졌다[22]. 또한 GCD2 각막 섬유모세포를 배양하여 분석한 결과, TGF-β 수용체 관련 신호 외에 세포 분화 및 분열, 면역 체계, 세포부착 등과 관련된 유전자가 다수 과발현되는 것이 보고되었으며[23], GCD2에서 미토콘드리아 기능이 떨어져 있는 것이 확인되었다[21]. 본 연구의 환자 3에서 보통의 이형접합자보다 심한 표현형을 보인 것 등 다양한 표현형의 발생 기전에는 개개인에 따른 다수의 유전자적 차이가 영향을 미칠 것으로 추론된다.

Genotypes of granular corneal dystrophy type 2 (GCD2). Transforming growth factor β induced (TGFBI) gene is on the long arm of chromosome 5. GCD2 patients have mutation on TGFBI gene; substitution of arginine to histidine at codon 124 (R124H). In compound heterozygote, there is another mutation at TGFBI gene (e.g., p.(His174Asp)). The double mutation in the same allele is called as cis-phase, while the double mutation in the opposite allele is called trans-phase.
GCD2의 치료로는 치료레이저각막절제술(phototherapeutic keratectomy, PTK), 전체층 각막이식수술(penetrating keratoplasty, PKP), 심부앞층판각막이식술(deep anterior lamellar keratoplasty, DALK) 등이 시행된다. 동형접합자의 경우 시력을 유지하기 위해 이른 시기부터 PTK와 각막이식 등을 반복적으로 시행받게 되는데, 동형접합자의 PTK와 각막이식술 후 재발까지의 기간은 각각 10-18개월, 12-24개월로 보고되었고, PTK가 반복될수록 재발은 더욱 일찍, 더욱 심하게 나타나는 특성을 보인다[9]. 이형접합자의 시력저하는 중년 이후 서서히 나타나며, PTK 후 즉각적인 시력 회복이 가능하지만[11,12,24,25], 재발까지의 기간은 약 3년 후로 알려져 있다[26,27]. 복합이형접합자의 경우 시력저하로 인해 일반적인 단순이형접합자보다 이른 시기에 PTK 혹은 각막이식술을 시행받게 되고, 치료 이후에 즉시 시력 개선을 보이며, DALK나 PKP 등 각막이식술은 시행 후 3년까지 재발하지 않았던 보고[13]와 더불어 3년 후에 재발하였던 보고[15] 등이 있어 결과가 일정하지 않다.
한편, 투명한 각막을 보이는 GCD2의 존재에 대한 기존 보고를 보면, Kim et al [28]은 부착성 테이프를 이용한 GCD2 유전자검사를 시험하던 중 대조군에서 각막이 투명한 26세 GCD2 이형접합자를 발견하였으며 그의 55세 아버지도 각막이 투명하였으나 유전적으로 GCD2 이형접합자로 측정된 검사 결과를 보고하였다. 한편, Cao et al [29]은 환자의 각막을 촬영하여 판독한 연구에서 GCD2 이형접합자인 29세 딸은 보편적인 GCD2 각막혼탁을 보였으나, 이형접합자인 59세 아버지는 투명한 각막을 보였다고 하였다. 본 연구진은 초기 진료에서 세극등현미경 관찰에도 불구하고 각막이 정상으로 판정된 20대 4명의 피검자를 기술하였다. 이와 같은 무증상의 GCD2 환자의 장기적인 예후에 대하여 연구된 바는 없지만, Jun et al [19]의 연구에서 각막혼탁이 거의 없는 환자가 LASIK 14개월 후 각막절편 부분에 혼탁을 보이기 시작하여 6년 후엔 각막 중심부로 혼탁이 진행하는 것이 보고된 바 있다. 본 연구진은 이러한 경우들을 고찰하며 20대 굴절수술 희망자의 경우, GCD2 환자 배제를 위한 매우 세심한 진찰이 필요할 수 있다고 판단하였다.
본 연구의 제한점은 첫째, 표본이 적고 일부 환자들의 경우 충분한 추적 관찰을 하지 못했고, 둘째, 모든 환자들에게 17개 exon을 포함한 TGFBI 전체 유전자검사를 시행하지 않았다는 점이다. 하지만 다양한 유전형과 표현형을 가진 GCD2 환자들을 비교하였으며, 굴절수술이 활발히 시행되는 20대 환자에서의 임상 양상을 제시하였다는 데 본 연구의 의의가 있다.
결론적으로, 본 연구를 통해 20대의 GCD2 환자에서 다양한 각막 표현형이 존재함을 확인하였다. 동형접합자와 복합 이형접합자의 경우 20대부터 매우 심한 혼탁을 보이는 것과 더불어 단순 이형접합자임에도 다양한 혼탁 정도를 보이는 것을 관찰하였다. 또한 20대 GCD2 이형접합자 중 세심한 세극등현미경 관찰에도 각막에서 병변을 어려운 환자들이 있음을 확인하였다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
서지형 / Ji Hyung Suh
새빛안과병원
Saevit Eye Hospital