시력 결과가 불량하였던 세균각막염의 균주 분포와 임상 특징
Microbiological Profile and Clinical Characteristics of Bacterial Keratitis with Poor Visual Outcome
Article information
Abstract
목적
배양 양성 세균각막염에서 최종시력불량군(poor visual outcome, PVO)과 최종시력양호군(good visual outcome, GVO) 사이에 임상 특징을 비교해보고자 하였다.
대상과 방법
2007년부터 2020년까지 배양 양성 세균각막염으로 치료한 230안(PVO 44안, GVO 186안)을 대상으로 하여 후향적으로 분석하였다. PVO는 최종최대교정시력이 0.1 미만이면서 초진시력보다 개선되지 않은 경우로 정의하였으며 그 이외에는 GVO로 정의하였다. PVO와 GVO 사이에 균주 분포, 역학, 선행인자, 임상양상을 비교하였으며 PVO의 위험인자를 분석하였다.
결과
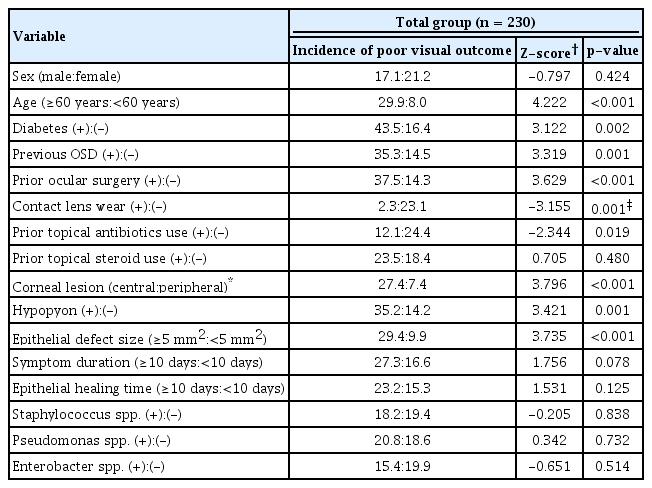
PVO와 GVO 모두 Staphylococcus spp.와 Pseudomonas spp.가 흔한 균주였으며, 두 군 사이에 균주 분포의 차이는 없었다. 역학 및 선행인자에서 두 군 사이에 성별, 계절, 각막외상, 이전 점안 스테로이드 사용은 차이가 없었으며, PVO에서 GVO에 비해 콘택트렌즈 착용은 유의하게 적었다. PVO에 이르는 위험인자 분석에서, 나이 ≥60세(Z =4.22, two-proportion Z-test), 중심각막 병변(Z =3.80), 상피결손크기 ≥5 mm2 (Z =3.74), 안수술력(Z =3.63), 전방축농(Z =3.42), 이전 안구표면질환(Z =3.32) 그리고 당뇨(Z =3.12)가 유의한 인자로서 확인되었다.
결론
세균각막염에서 시력예후불량은 균주 자체보다 고령, 초기의 심한 각막 소견, 안과적 과거력 및 당뇨 유무와 더 연관되었다.
Trans Abstract
Purpose
To compare clinical characteristics between the poor visual outcome (PVO) and good visual outcome (GVO) groups in culture-proven bacterial keratitis.
Methods
A total of 230 cases (44 and 186 eyes in the PVO and GVO groups, respectively) of culture-proven bacterial keratitis, treated between January 2007 and December 2020, were reviewed retrospectively. The PVO group included cases with the final best-corrected visual acuity (BCVA) of less than 0.1 and no improvement compared to the initial BCVA. The remaining cases were included in the GVO group. The microbiological profiles, epidemiology, predisposing factors, and clinical characteristics were compared between the PVO and GVO groups, and the risk factors for PVO were analyzed.
Results
Staphylococcus spp. and Pseudomonas spp. were common isolates in both the PVO and GVO groups, with no significant differences in the distribution of isolates. There were no significant differences between the groups in terms of sex, seasonal distribution, corneal trauma, and prior topical steroid use, but contact lens wear was significantly less in the PVO group. Significant risk factors for PVO were age ≥60 years (Z = 4.22, two-proportion Z-test), central corneal lesions (Z = 3.80), epithelial defect size ≥5 mm2 (Z = 3.74), prior ocular surgery (Z = 3.63), hypopyon (Z = 3.42), previous ocular surface disease (Z = 3.32), and diabetes (Z = 3.12).
Conclusions
In patients with bacterial keratitis, PVO was associated with older age, severe initial corneal findings, previous ocular disease history, and diabetes, but not with the causative pathogen itself.
세균각막염은 전 세계적으로 실명의 대표적인 원인 중 하나이며, 중증으로 진행하는 경우 각막천공과 같은 심한 합병증이 동반될 수 있고 치료 후에도 각막혼탁으로 인해 시력 결과가 불량할 수 있다[1-3].
감염각막염에서 불량한 치료 결과로 이어지는 위험인자로는 이전의 많은 연구들에서 안외상 유무, 나쁜 초진시력, 이전 안구수술 및 안구표면질환의 유무, 콘택트렌즈 착용 및 고령의 나이 등으로 다양하게 보고되고 있다[4-6]. 하지만 불량한 치료 결과의 정의는 연구마다 다소 다를 뿐 아니라, 불량한 치료 결과를 보이는 비율 및 그 위험인자는 연구가 진행된 지역의 특성과 연구 대상에 포함된 균주의 범주에 따라 달라질 수 있다[5,7,8]. 그 예로 Green et al [7]은 감염각막염 전체의 28%에서 불량한 치료 결과를 보고하였고, Mun et al [8] 및 Morlet et al [5]은 세균각막염의 8-12%에서 불량한 치료 결과를 보였다고 하였다.
감염각막염에서 불량한 치료 결과의 위험인자를 조사한 기존의 연구들은 진균 및 아메바까지 포함하였거나 배양 음성 각막염, 또는 특정 균주만을 포함하여 진행한 연구들이 많았다. 한편 배양 양성 세균각막염 전체를 대상으로 시력예후불량에 주로 초점을 맞추어 위험인자를 분석한 연구는 저자들의 문헌 검색에서는 드물었다[6]. 이에 본 연구에서는 배양 양성 세균각막염에서 최종시력 결과에 따라 최종 시력불량군(poor visual outcome, PVO)과 최종시력양호군(good visual outcome, GVO)으로 나누어 균주 분포, 역학, 선행인자 및 임상 양상에 대해 비교 분석하고자 하였으며, 최종시력불량과 관계된 위험인자에 대해 분석해보고자 하였다.
대상과 방법
대상 환자 분류
2007년 1월부터 2020년 12월까지 14년간 영남대학교병원 안과에서 감염각막염으로 입원 치료한 환자 중 배양검사에서 세균이 동정된 환자를 대상으로 의무기록을 통해 후향적으로 분석을 시행하였으며, 진균이 포함된 경우와 추적 관찰 실패 등으로 치료 후 시력 결과를 알 수 없었던 경우들은 대상에서 제외하였다. 전체 군을 PVO 및 GVO로 나누어 두 군 간의 균주 분포, 역학적 특성, 선행인자, 임상 양상 및 치료 결과를 비교하였다. PVO의 기준은 치료 시작 시점으로부터 3개월 후 최종최대교정시력이 0.1 미만이면서 초진 시력보다 저하된 경우로 정의하였으며, 이외에는 GVO로 정의하였다. 본 연구는 헬싱키선언(Declaration of Helsinki)을 준수하였으며 영남대학교병원 임상연구윤리위원회(Institutional review board, IRB)의 승인을 얻었다(승인 번호: 2021-11-054).
세균의 배양 및 동정
세균각막염의 원인균 동정을 위해 모든 증례에서 초진 시 각막 찰과를 통해 검체를 채취하고 도말검사 및 배양검사를 시행하였다. 각막 찰과 전 0.5% proparacaine hydrochloride (Alcaine®; Alcon, Fort worth, TX, USA)로 점안마취를 시행한 후, No.15 Bard-Parker knife (Bard-Parker Co., Danbury, CT, USA)로 병변의 가장자리와 기저 부위를 긁어서 유리 슬라이드에 도말 표본을 만들고 그람 염색을 시행하였다. 배양검사를 위해 검체를 묻힌 면봉을 이송배지에 넣어 미생물 검사실로 보내고 도착 즉시 바로 blood agar와 MacConkey agar medium에 접종한 뒤 48시간 동안 배양을 시행하였다. 배양된 세균의 동정은 미생물자동분석기(VITEK System; BioMerieux-Co, Lyon, France)를 이용하여 이루어졌다.
역학, 선행인자 및 초진 임상 양상 조사
환자의 성별, 연령, 증상내원기간(증상 발생 후 본원 내원까지의 기간), 각막염 발생 계절 등의 역학인자에 대해 조사하였다. 연령은 0-19세, 20-39세, 40-59세, 60-79세, 80세 이상의 다섯 군으로 구분하여 분석하였다. 선행인자로는 각막외상 유무, 이전 안구표면질환 유무, 안수술의 과거력, 기존에 가지고 있었던 전신질환, 내원 전 점안 스테로이드의 사용 유무 등에 대해 조사하였다.
임상적 특징으로 초진 시 각막 병변의 위치와 크기, 전방 축농 유무, 각막내피반 유무 및 초진 최대교정시력에 대해 조사하였다. 각막 병변의 위치는 중심에서 반경 1/2 이내를 중심부, 그 바깥쪽을 주변부로 정의하여 분류하였다. 각막 병변의 크기는 각막상피결손의 크기로 나타냈으며, Mukerji et al [9]이 보고한 방식과 같이 세극등현미경의 ruler를 이용하여 상피결손 부위의 가장 긴 직경과 그에 수직인 직경을 측정하고 그 값을 곱한 직사각형의 면적으로 계산하였다. 초진 최대교정시력은 Snellen 시력을 기준으로 0.1 이상과 그 미만인 두 군으로 나누어 분류하였다.
약물요법
초진 시 각막찰과에 의한 미생물검사를 실시한 후 결과가 나오기 전 경험적으로 전신적 항생제(2세대 cephalosporin, aminoglycoside)를 투여하고 점안 항생제 2% tobramycin과 cephalosporin계 항생제(5% cefamandole, 2007-2010; 5% ceftazidime, 2011-2020)를 사용하였으며, 상용화된 fluoroquinolone 항생제 안약(0.5% moxifloxacin, Vigamox®; Alcon)을 병합하여 30분에서 1시간 간격으로 점안하였다. 임상 소견의 호전을 보일 시 균의 감수성 결과에 관계없이 항생제를 계속 점안하면서 감량해 나갔고, 악화되는 양상을 보이면 항생제 감수성 결과를 반영하여 점안 항생제를 바꾸어 사용하였다.
치료 결과 분석
상피재생 완료기간, 최종최대교정시력, 치료 후 시력 감소 여부, 수술적 치료 여부를 조사하여 PVO와 GVO 사이에 비교 분석하였다. 상피재생 완료기간은 초진 이후 상피가 완전히 회복되었을 때까지의 기간으로 정의하였다. 최종최대교정시력은 치료 시작 시점으로부터 3개월 후 각막염의 기질 침윤이 소실되고 상피재생이 완료되었을 시 Snellen 시력으로 측정한 것을 기준으로 하였으며, 통계학적 분석을 위하여 logarithm of the minimum angle of resolution (logMAR)로 변환하였다. 치료 중 병변이 악화되는 경우에는 각막전공 전문의의 의학적 판단에 따라 양막이식술, 결막판피복술 및 안구적출술 등의 수술적 치료가 시행되었다.
통계 분석
자료의 분석은 IBM SPSS ver. 25.0 for Windows (IBM Corp., Armonk, NY, USA)를 사용하여 시행하였다. 통계 기법은 범주형 자료는 chi-square test를 사용하였으며, 연속형 자료는 평균값 비교를 위해 independent t-test를 이용하였다. 통계학적 유의수준은 p값이 0.05 미만인 경우로 하였다. 최종시력불량(PVO)에 대한 위험인자를 분석하기 위해, two-proportion Z-test를 통해 각 독립변수의 유무가 최종시력불량을 일으키는 비율의 차이를 Z-점수로 평가하였다. Z점수는 각 독립변수에 대한 정규 모집단의 평균값에서 얼마나 멀리 떨어져 있는가를 표준편차의 배수로 나타낸 것으로, 각 지정된 독립변수의 조건을 만족할 때를 Z-점수의 양의 방향으로 설정하였다[10]. Z-점수의 95%, 99%, 99.9%의 신뢰구간에 해당하는 값은 각각 ±1.96, ±2.58, ±3.29로 정의되었다.
결 과
전체 14년의 기간 동안 본원에서 감염각막염으로 입원 치료한 환자 중 배양검사 양성이 총 256안 확인되었다. 이 중 진균감염이 포함된 경우와 추적 관찰 실패 등으로 치료 후 시력 결과를 알 수 없었던 26안은 대상에서 제외되었으며, 최종적으로 230안이 연구에 포함되었다. 그중 PVO는 44안(19.1%), GVO는 186안(80.9%)이었다.
미생물학적 특성
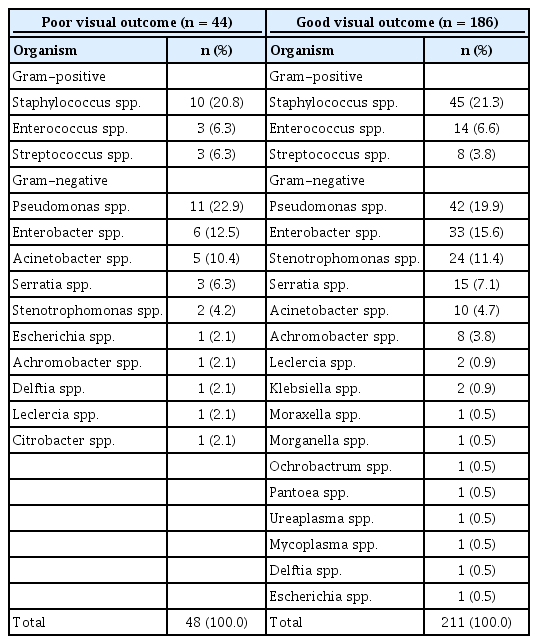
전체 230안에서 259균주가 확인되었다. 그람음성균의 비율은 PVO에서 66.6% (32균주), GVO에서 68.2% (144균주)로 두 군 간에 유의한 차이를 보이지 않았다(p=0.509). 흔한 균주로는 PVO에서 Pseudomonas spp. (n=11, 22.9%), Staphylococcus spp. (n=10, 20.8%) 및 Enterobacter spp. (n=6, 12.5%) 순이었으며, GVO에서 Staphylococcus spp. (n=45, 21.3%), Pseudomonas spp. (n=42, 19.9%) 및 Enterobacter spp. (n=33, 15.6%) 순이었다. 총 230안 중 28안(12.2%)에서 2균주 이상의 복합감염이 확인되었으며, 그 비율은 PVO에서 9.1% (4안)였고 GVO에서 12.9% (24안)로 두 군 사이에 차이를 보이지 않았다(p=0.487) (Table 1).
역학적 특성
남성의 비율은 PVO에서 45.5%, GVO에서 52.2%로 유의미한 차이는 보이지 않았다(p=0.424). 평균 나이는 PVO에서 67.9 ± 15.2세(range 10-92), GVO에서 51.9 ± 21.1세(range 7-93)로 PVO에서 유의하게 높았다(p<0.001). 증상내원기간이 7일 이상인 경우는 PVO에서 56.8%, GVO에서 36.0%로 PVO에서 유의하게 많았다(p=0.011). 계절 분포(p=0.994) 및 시골 지역 거주(p=0.909)는 두 군 사이에 통계적으로 유의한 차이를 보이지 않았다. 농업 종사자(75.0% vs. 44.7%, p=0.048)는 PVO에서 GVO에 비해 유의하게 높은 비율을 보였다(Table 2).
선행인자
선행인자로 PVO와 GVO 모두에서 각막외상이 가장 많았으며 두 군 사이에 그 비율의 유의한 차이는 없었다(PVO 47.7% vs. GVO 59.1%, p=0.169). 이전 안구표면질환(40.9% vs. 17.7%, p=0.001), 이전 안수술력(40.9% vs 17.7%, p<0.001), 당뇨(22.7% vs. 7.0%, p=0.002), 고혈압(38.6% vs. 17.2%, p=0.002)은 PVO에서 GVO에 비해 그 비율이 유의하게 높았다. 이전 안구표면질환의 종류로는 PVO에서 수포각막병증 8안(18.2%) 및 헤르페스각막염 5안(11.4%) 순으로 많았으며, GVO에서는 헤르페스각막염 15안(8.1%) 및 과거 각막궤양으로 치료받은 경우 5안(2.7%) 순으로 많았다. 콘택트렌즈 착용은 PVO에서 GVO에 비해 유의하게 적었으며(2.3% vs. 23.1%, p=0.001), 두 군 사이에 이전 점안 스테로이드 사용 유무는 유의한 차이가 없었다(18.2% vs. 14.0%, p=0.480) (Table 3).
임상 양상 및 치료 결과
초진 임상 양상으로 PVO에서 GVO에 비해 중심각막 병변(84.1% vs. 52.7%, p<0.001), 상피결손크기 5 mm2 이상(72.7% vs. 41.4%, p<0.001), 심부 기질 침윤(29.5% vs. 12.9%, p=0.007)이 유의하게 많았다. 각막내피반의 유무는 두 군 사이에 통계적으로 유의한 차이는 없었다. PVO에서 GVO에 비해 초진시력 0.1 미만(90.9% vs. 44.6%, p<0.001)이 유의미하게 많았다(Table 4).
치료 결과로 상피재생기간 10일 이상인 경우(59.1% vs. 46.2%, p=0.125)의 비율은 PVO에서 GVO에 비해 다소 높았으나 두 군 사이에 유의한 차이가 없었다. PVO에서 GVO에 비해 수술적 치료(25.0% vs. 5.4%, p<0.001)가 유의미하게 많았다. 그중 양막이식술은 PVO에서 8안(18.2%), GVO에서 8안(4.3%)이 시행되어 PVO에서 높은 비율을 보였으며 통계적으로도 유의미한 차이를 보였다(p=0.001). 안구내용제거술, 결막판피복술은 PVO에서만 각각 3안(6.8%)과 1안(2.3%)이 시행되었다. 눈꺼풀봉합술, 공막편이식 및 전층각막이식술은 GVO에서만 각 1안(0.5%)이 확인되었다(Table 4).
최종시력불량에 이르는 위험인자 분석
전체군에서 two-proportion Z-test를 시행한 결과 60세 이상의 나이(Z=4.22), 중심부 각막 병변(Z=3.80), 상피결손크기 5 mm2 이상(Z=3.74), 이전 안수술력(Z=3.63), 전방축농(Z=3.42), 이전 안구표면질환(Z=3.32) 및 당뇨(Z=3.12)가 유의한 PVO의 위험인자로 나타났다. 이전 점안 스테로이드 사용(Z=0.71), 남성(Z=-0.80), 상피재생기간이 10일 이상(Z=1.53) 및 증상내원기간 10일 이상(Z=1.76)은 유의한 결과를 보이지 않았다. 흔하게 동정된 균주들인 Staphylococcus spp. (Z=-0.21), Pseudomonas spp. (Z=0.34) 및 Enterobacter spp. (Z=-0.65) 또한 유의한 결과를 보이지 않았다(Table 5).
고 찰
본 연구의 전체군에서 Staphylococcus spp.와 Pseudomonas spp.가 가장 흔하게 동정된 균주였다. 세균각막염의 원인 균주를 조사한 이전 연구들에 따르면, 그람양성균에서는 Staphylococcus spp.가, 그람음성균에서는 Pseudomonas spp.가 가장 흔한 것으로 보고되었다[11,12]. 국내 8개 3차 병원에서 시행된 You et al [4]의 감염각막염 연구에서도 그람양성균 중 Staphylococcus spp.가 55.5%로, 그람음성균 중 Pseudomonas spp.가 29.1%로 각각 가장 많이 검출되었다고 보고하여 본 연구의 결과와 유사한 경향을 보였다. 한편 국내 광주 전남 지역을 대상으로 한 Noh et al [13]의 연구에서는 Stenotrophomonas maltophilia가 가장 흔하다고 보고하였으며, 인도의 남부 지역에서 이루어진 Bharathi et al [14]의 연구에서는 세균각막염에서 Streptococcus pneumoniae (36.0%)가 가장 흔하다고 보고하였다. 균주 분포의 차이는 연구가 시행된 국가, 기후, 지역적 특성에 따를 것으로 생각된다.
임상적인 측면에서, 각막염에서 원인 균주에 따른 임상 양상 및 치료 결과의 차이가 있을 수 있다. 그 예로 Pseudomonas spp.에 의한 각막염의 경우 급속한 각막기질 괴사와 천공을 보이는 등 임상적 중요성과 심각성이 잘 알려져 있는 반면에, Serratia spp.에 의한 각막염은 비교적 치료 결과가 양호하다고 보고되고 있다[15,16]. 따라서 저자는 연구 디자인 단계에서 PVO에서 GVO에 비해 특정 균주가 특정 그룹에 더 많이 분포할 것이라고 예상하였다. 그러나 본 연구 결과 PVO 및 GVO 모두 Staphylococcus spp., Pseudomonas spp. 및 Enterobacter spp.가 흔한 균으로 확인되어 두 군 간 균주 분포는 유사한 것으로 확인되었으며, 균주에 따른 불량한 치료 결과의 비율 또한 유의한 차이를 나타내지 않았다. 이러한 결과는 세균각막 염에서 불량한 치료 결과는 특정 균주의 감염 여부보다 균주 이외의 요인들에 더 많은 영향을 받는 것으로 생각되었다. 한편 복합감염의 비율은 GVO에서 12.9%로 PVO의 9.1%에 비해 높았으나 통계적으로는 유의하지 않았다. 이러한 결과는 본 연구에서 진균감염과 같은 상대적으로 더 위중한 증례들이 포함되지 않았다는 점 및 각막염의 세균 배양 양성률이 30-60% 가량으로 낮다는 점 등과 연관되는 것으로 생각된다[17-21]. 본 연구의 결과만으로 복합감염과 불량한 치료 결과의 연관성을 제시하기는 어려울 것으로 생각되며, 향후 다기관 연구를 통한 분석이 필요할 것으로 생각된다.
본 연구에서 60세 이상의 고령 비율은 PVO에서 GVO에 비해 유의하게 높았다. 고령이 상대적으로 불량한 치료 결과와 관계된다는 것은 다른 연구들에서도 비슷한 경향을 보였다. Kim et al [22]은 최종교정시력이 0.1 미만인 경우는 60세 미만인 군에서 26.2%, 60세 이상인 군에서 52.0%로 고령에서 나쁜 시력 결과가 더 많았다고 보고하였으며, 치료 후 2줄 이상 시력 증가가 있었던 경우는 60세 미만인 군에서 51.1%, 60세 이상인 군에서 40.5%로 고령에서 치료 후 시력 개선 정도가 더 낮았다고 보고하였다. 고령에서 상대적으로 불량한 시력 결과를 보이는 이유에 대한 연구들로는, 고령일수록 치유 속도가 느려지며 동반된 전신질환이 치유 반응의 저하에 영향을 줄 수 있다고 보고한 Thomas [23]의 연구와 고령의 나이는 젊은 층에 비해 창상 치유 반응의 지연 및 면역력저하로 감염에 취약할 수 있다고 보고한 Weksler [24]의 연구 등이 있다.
증상내원기간 7일 이상인 비율은 PVO에서 GVO에 비해 유의하게 높았다. 이와 유사하게, 충남 지역에서 시행된 Sun et al [18]의 연구에서는 증상 발현 후 내원하기까지의 시간과 치료기간 사이에 유의한 양의 상관관계를 가진다고 보고하여(r=0.364, p=0.034), 늦은 치료 시작과 불량한 치료 결과와의 연관성을 시사한 바 있다. 또한 Millodot [25]의 연구에서는 고령일수록 각막지각이 감소하며 이것이 늦은 내원, 늦은 치료로 이어진다고 하였으며, 상피재생불량 및 상대적으로 불량한 치료 결과와 연관될 것으로 보고하였다. 본 연구에서도 60세 이상 연령에서 증상내원기간이 7일 이상인 경우가 유의하게 많아 비슷한 경향을 보였다. 3차 의료 기관인 본원에 내원하기까지의 기간이 길었다는 것은 증상 발생 후 일차 의료기관의 방문 및 치료가 늦어졌거나, 또는 일차기관에서 적절한 치료를 시행했음에도 불구하고 병변이 악화되어 의뢰된 경우로 생각되며 두 가지 모두 임상 양상의 악화와 관계된다. 본 연구 결과는 환자 측면에서 감염각막염 증상 발생 후 빠른 병원 내원의 중요성을 시사하며, 의료진 측면에서는 초기의 정확한 진단과 신속한 치료의 중요성을 시사한다.
이전 안구표면질환은 PVO에서 GVO에 비해 유의하게 높은 비율로 관찰되었다. 이는 이전의 여러 연구들에서도 공통적인 경향을 보였는데, Ong et al [26]은 Staphylococcus aureus 각막염의 환자에서 이전 안구표면질환이 예후를 가늠하는데 있어 중요한 인자로 언급하였고, Lee et al [27]의 연구 또한 이전 안구표면질환이 있는 경우를 치료 실패의 위험인자로 보고하기도 하였다. 이전의 안구표면질환이 있는 경우 기존 각막 병변의 특성에 따라 상피치유 반응의 지연을 보일 수 있으며, 기존의 각막혼탁으로 인해 성공적인 치료 후에도 시력 결과는 불량할 수 있기 때문으로 생각된다. 한편 본 연구에서 수포각막병증은 8안 모두가 PVO에 분포한 것으로 확인되었다. 이는 8안 모두에서 감염각막염 치료 후에도 남은 각막혼탁 및 각막부종으로 인해 시력개선이 없었기 때문으로 확인되었다. 수포각막병증 8안을 GVO 186안과 비교해 보았을 때, 전방축농(50% vs. 18.8%, p=0.053), 수술적 치료(12.5% vs. 5.4%, p=0.379) 및 상피재생기간 10일 이상인 경우(87.5% vs. 46.2%, p=0.029)가 상대적으로 많은 것을 알 수 있었다. 또한 수포각막병증 8안 중 4안에서는 기존 안질환(홍채각막내피증후군, 개방각녹내장, 견인망막박리, 이전 각막궤양)이 있었던 것으로 확인되어 이와 관계되어 시력예후가 좋지 않았던 것으로 생각되었다.
전신질환 중 당뇨와 고혈압은 PVO에서 GVO에 비해 유의하게 많았다. 당뇨와 각막상피 치유와의 관계에 대해 분석한 Zhao et al [28]의 연구에서는 당뇨가 있는 경우 각막상피 재생 및 창상치유의 지연을 보고하였다. 또한 당뇨와 눈물 분비와의 관계에 대해 분석한 Goebbels [29]의 연구 및 Dogru et al [30]의 연구에 따르면 당뇨 환자군에서 각막지각 감소로 인해 반사적 눈물 분비가 저하되어 재발각막상피미란, 결막 편평상피화생이 증가하였다고 보고하였다[31]. 한편 당뇨와 고혈압 등의 전신질환들은 젊은 연령에 비해 고령에서 유병률이 높기 때문에, 상대적으로 PVO와 더 관계되었을 것으로도 생각된다.
콘택트렌즈 착용은 세균각막염의 위험인자로서 잘 알려져 있다[1,6]. 하지만 치료 결과 측면에서 살펴보았을 때, 본 연구의 결과와 같이 콘택트렌즈 착용 비율이 PVO에서 오히려 유의하게 낮은 것을 확인할 수 있었다. 이러한 경향은 여러 연구들에서 공통적으로 살펴볼 수 있는데, Khoo et al [32]는 치료 결과 불량군에서 유의하게 콘택트렌즈 착용이 적다고 보고한 바 있으며(p<0.001), Keay et al [33]는 고령에서 콘택트렌즈 착용 횟수가 비교적 적다고 보고한 바 있다(p<0.001). 이러한 결과는 콘택트렌즈 착용으로 발생한 각막염이 다른 원인에 의한 각막염보다 치료 결과에 유리한 측면이 있다고 하기보다는 콘택트렌즈 착용자의 연령대가 주로 젊은 연령대에서 이루어진다는 점과 관계 있는 것으로 생각된다. 본 연구에서도 콘택트렌즈 사용력이 있었던 41안 모두 60세 미만으로 젊은 연령에 해당한 것을 확인할 수 있었다. 따라서 저자들은 연령의 영향을 배제하기 위해 로지스틱 회귀분석을 통해 연령을 보정하여 콘택트렌즈 착용 유무에 따른 PVO 위험인자를 분석하였다. 그 결과, odds ratio 0.306 (95% confidence interval 0.035-2.681, p=0.285)으로 유의하지 않아 콘택트렌즈 착용 여부 자체는 PVO 발생에 유의한 영향이 없음을 확인하였다. 이에 대해서는 향후 더 많은 환자 수를 대상으로 추가적인 검토 확인이 필요할 것으로 여겨진다.
본 연구에서 이전 점안 스테로이드 사용 비율은 PVO와 GVO 두 군 간 유의한 차이를 보이지 않았다. 한편 Wilhelmus [34]의 연구에서는 세균각막염에서 이전 점안 스테로이드를 사용한 경우에 치료 결과 불량이 많았다고 보고하였다. 또한 진균, 아메바를 포함한 감염각막염을 대상으로 한 Wong et al [35]의 연구에서는 이전 점안 스테로이드 사용은 감염각막염 치료 후 시력 결과 불량과 유의미하게 연관되었다고 하였는데(p=0.006), 스테로이드 사용이 면역 반응을 억제하여 미생물의 증식을 유발하기 때문인 것으로 분석하였다. 전체 감염각막염을 대상으로 한 Khoo et al [32]의 연구에서도 이전 점안 스테로이드 사용은 감염각막염의 치료 결과 불량과 유의하게 연관됨을 보고하였다(p=0.003). 본 연구에서는 이전 스테로이드 사용과 치료 결과 사이에 유의한 연관성까지는 확인되지 않았으나, 일반적으로 감염각막염에서의 스테로이드 사용은 세균 이외에도 진균, 아메바의 증식을 증가시킬 수 있으며 기질융해 및 각막천공 발생 위험이 높아지므로 불량한 결과로 이어질 가능성이 더 높을 것으로 여겨진다.
초기 임상 양상으로 본 연구에서는 PVO에서 GVO에 비해 5 mm2 이상의 큰 각막 병변, 중심각막 병변 및 전방축농이 있는 경우가 유의하게 많았다. 감염각막염에서 초기 임상 양상의 심각성이 불량한 예후에 미치는 중요성은 이전의 많은 연구들에서도 보고된 바 있다. 그 예로 각막 병변크기가 클수록 치료기간이 유의하게 길었으며[18], 궤양크기가 클수록 초기 치료 실패가 높았고[5], 시력 호전 실패의 유의한 위험인자로 상피결손이 5 mm2 이상인 경우가 포함되었으며[13], 큰 궤양의 크기가 치료 실패의 유의한 위험인자였다는 보고들[27,32] 등이다. 이외에도 You et al [4]의 연구에서는 초진시력 0.02 미만, 전방축농 및 각막중심부 궤양이 세균각막염의 불량한 임상 결과의 유의한 위험인자로 보고하기도 하였다. 각막중심부 궤양은 크기가 작더라도 중심부에 남은 각막혼탁이 시축을 가려 시력 호전의 제한을 보일 수 있다. 또한 큰 각막 병변과 전방축농 등의 불량한 초진 임상 양상은 더 많은 염증 반응을 수반하고 더 긴 치료 기간이 소요되며, 치료 후 각막혼탁이 비교적 더 크게 남을 것으로 기대된다는 점 등으로 인해 불량한 시력 결과와 연관되는 것으로 여겨진다.
약물 치료 과정에서 약제 반응이 충분하지 않아 점안제를 tobramycin에서 vancomycin으로 바꾼 경우는 GVO에서 3안(1.6%), PVO에서 1안(2.3%) 확인되었으며, 두 군 사이에 유의한 차이를 보이지 않았다(p=0.575). 감염각막염에서 적절한 약물 치료에도 불구하고 병변이 진행하여 각막기질이 괴사되어 천공이 발생하거나, 지속각막상피결손으로 이어지면 수술적 치료가 필요하게 되며, 성공적인 회복이 이루어지더라도 각막혼탁이 남을 가능성이 높다. 본 연구에서는 전체군의 9.1%, PVO의 25.0%, GVO의 5.4%에서 수술적 치료가 시행되어 PVO에서 유의하게 높았다. 대부분의 증례에서 임상 양상의 악화로 인해 수술적 치료를 시행하였으므로 PVO에 포함되는 비율이 높았던 것으로 생각된다. 한편 본 연구에서 양막이식술을 시행한 16안 중 8안은 GVO에, 8안은 PVO에 포함되었는데, GVO에 속한 8안은 지속각막상피결손 증례에서 상피재생을 위한 양막이식술을 시행하여 성공적인 상피재생 후 좋은 시력 결과를 보인 경우들로 확인되었다.
본 연구의 결과와 비교하기 위하여, 기존에 여러 국가에서 시행된 감염각막염의 불량한 치료 결과의 위험인자를 분석한 문헌들을 정리하여 Table 6에 제시하였다. 연구마다 불량한 치료 결과의 정의가 조금씩 달랐으며 최종시력과 수술적 치료가 정의로 제시된 경우가 많았다. 제시된 14개의 연구 중 불량한 치료 결과의 위험인자로 가장 흔하였던 것은 고령의 나이로 10개의 연구에서 언급되었다[2,4,6,36]. 두 번째로는 큰 각막 병변이 7개의 연구에서 언급되었으며, 그 다음으로 이전 안구표면질환이 5개의 연구에서 언급되어 본 연구에서 큰 상피결손 및 이전 안구표면질환이 불량한 시력 결과의 유의한 위험인자라는 점과 유사한 경향을 보이는 것으로 확인되었다. 한편 남부 인도의 시골 지역에서 시행된 Chidambaram et al [37]의 연구에서는 불량한 치료 결과의 유의한 위험인자로 궤양의 특징들 이외에도 사회인구학적 인자로서 초등학교 이상의 정규교육을 받지 못한 저학력자(p=0.019, by multivariate logistic regression), 긴 증상내원기간(p=0.032) 및 여성(p=0.040)이 언급되기도 하였다(Table 6).

Comparison of risk factors for poor treatment outcome of microbial keratitis reported in previous study
본 연구의 한계점으로는 첫째는 후향적으로 분석하였고 단일 3차 의료기관에서 시행된 연구라는 점에서 본 연구 결과를 국내 세균각막염 전체에 대하여 일반화하기에는 부족하다는 점이다. 같은 세균각막염 범주 안에서도 연구마다 균주 분포, 지역적 특성 및 환자군의 특성이 다를 수 있으므로 향후 다기관 연구들을 통한 확인이 필요할 것으로 생각된다. 둘째로 본 연구에서는 최종시력불량 위험인자를 각 요인마다 개별적으로 분석하였는데, 치료 결과는 한 가지 요인뿐만 아니라 여러 요인들에 의해 복합적인 영향을 받는다는 점이다. 추후 요인들 간의 상대적 중요도를 점수로 평가하여 치료예후불량을 예측할 수 있는 시스템이 연구 개발된다면 임상에서 유용하게 사용될 수 있을 것으로 생각된다. 한편 본 연구는 14년이라는 장기간에 걸쳐 비교적 많은 수의 세균각막염 환자를 분석하였다는 점에서 임상적인 가치가 있다고 생각되며, 향후 각막염 예후 연구들의 기초 자료로 쓰일 수 있을 것으로 생각된다. 향후 더 오랜 기간 동안 더 많은 환자 수를 대상으로 시기의 변화에 따른 질환군 및 예후인자 변화 추이를 살펴볼 필요가 있을 것으로 생각된다. 또한 각막병변의 중증도 지표에 있어 상피결손크기와 함께 침윤크기를 분석에 포함하고, 치료 지표로서 상피재생시간과 함께 각막침윤과 전방축농의 호전 정도를 분석에 포함하면 더욱 심층적인 분석이 가능할 것으로 여겨진다.
결론적으로 본 연구에서 배양 양성 세균각막염의 최종시력불량과 관계된 유의한 위험인자로 60세 이상의 고령, 중심각막병변, 큰 상피결손, 이전 안구표면질환 및 당뇨 등이 확인되었으며, 계절 또는 균주에 따른 최종시력불량 비율의 유의한 차이는 없었다. 본 연구 결과는 실제 임상에서 시력불량에 관계된 위험인자를 초기에 파악하는 것이 중요하다는 것을 의미하며, 위험인자가 다수 포함된 환자에서는 보다 더 집중적인 치료와 면밀한 관찰이 필요하다는 것을 시사한다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
임지남 / Jinam Lim
영남대학교 의과대학 안과학교실
Department of Ophthalmology, Yeungnam University College of Medicine