 |
 |
| J Korean Ophthalmol Soc > Volume 63(6); 2022 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļīĆļ╣äĻ░ÉļÅäļ×Ć ļ░░Ļ▓Į ļśÉļŖö ņØĖņĀæ ņé¼ļ¼╝ļĪ£ļČĆĒä░ ĒŖ╣ņĀĢ ļ¼╝ņ▓┤ņØś ņāüļīĆņĀü ļ░ØĻĖ░ ņ░©ņØ┤ļź╝ Ļ░Éņ¦ĆĒĢśļŖö ĻĖ░ļŖź(ļŖźļĀź)ņ£╝ļĪ£ ļŗżņ¢æĒĢ£ ĒÖśĻ▓ĮņŚÉņä£ņØś ņŗ£ĻĖ░ļŖźņØä ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŗż. ņĀ£2ĒśĢ Ļ│╝ļ”ĮĻ░üļ¦ēņØ┤ņāüņ”Ø(granular corneal dystrophy type 2, GCD2)ņØĆ Ļ░üļ¦ē ĻĖ░ņ¦łņØś Ēś╝Ēāüņ£╝ļĪ£ ņŗ£ĻĖ░ļŖźņØś ņĀĆĒĢśļź╝ ņØ╝ņ£╝Ēé©ļŗż. ņØ┤ņŚÉ ļ│Ė ņĀĆņ×ÉļōżņØĆ GCD2ņŚÉņä£ ņ╣śļŻīļĀłņØ┤ņĀĆĻ░üļ¦ēņĀłņĀ£ņłĀ(phototherapeutic keratectomy, PTK) ņĀäĒøä ļīĆļ╣äĻ░ÉļÅäļź╝ ļ╣äĻĄÉĒĢśņŚ¼, ņ╣śļŻī ņĀäĒøäņØś ņŗ£ĻĖ░ļŖźņØä ļ╣äĻĄÉĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
22ļ¬ģņØś GCD2 ņØ┤ĒśĢņĀæĒĢ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£, PTK ņĀäĻ│╝ ĒøäņØś ņŗ£ļĀźĻ│╝ ļīĆļ╣äĻ░ÉļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļīĆļ╣äĻ░ÉļÅäļŖö ņĢ╝Ļ░ä(3 cd/m2)Ļ│╝ ņŻ╝Ļ░ä(85 cd/m2) ņĪ░ļÅäņŚÉņä£ ļłłļČĆņŗ¼ 0, 1, 2ļŗ©Ļ│ä(glare [G]; G0, G1, G2), Ļ│ĄĻ░äņŻ╝Ēīīņłś 1.5, 3, 6, 12, 18 cycles per degrees (cpd)ņŚÉ ļīĆĒĢśņŚ¼ Ļ░üĻ░ü Ļ▓Ćņé¼ĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņłśņłĀ Ēøä 1.5, 3 cpdņŚÉņä£ ņĢ╝Ļ░äĻ│╝ ņŻ╝Ļ░ä ņĪ░ļÅä ņŗ£, G0-2ņØś ļ¬©ļōĀ ļłłļČĆņŗ¼ ļŗ©Ļ│äņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäņØś Ē¢źņāüņØä ļ│┤ņśĆļŗż(p<0.05). 6 cpdņŚÉņä£ļŖö ņĢ╝Ļ░ä ņŗ£ G1, ņŻ╝Ļ░ä ņŗ£ G0-2ņØś ļłłļČĆņŗ¼ ļŗ©Ļ│äņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäņØś Ē¢źņāüņØ┤ ņ׳ņŚłļŗż(p<0.05). ļ░śļ®┤ 12, 18 cpdņŚÉņä£ļŖö ņĢ╝Ļ░ä, ņŻ╝Ļ░ä ņĪ░ļÅä ņŗ£ G0-2ņØś ļ¬©ļōĀ ļłłļČĆņŗ¼ ļŗ©Ļ│äņŚÉņä£ ņłśņłĀ ņĀäĒøäņØś ļīĆļ╣äĻ░ÉļÅä ņ░©ņØ┤ļź╝ ļ│╝ ņłś ņŚåņŚłļŗż.
ABSTRACT
Purpose
Contrast sensitivity, the ability to distinguish the relative difference in luminance of an object from its surrounding or adjacent objects, is a useful measure of visual function. In granular corneal dystrophy type 2 (GCD2), opacity of the corneal stroma causes deterioration in visual function. We compared the contrast sensitivity of GCD2 patients before and after phototherapeutic keratectomy (PTK) to evaluate the perioperative visual function in these patients.
Methods
This study included 22 eyes of heterozygote GCD2 patients. The visual acuity and contrast sensitivity were measured before and after PTK. The contrast sensitivity was measured in mesopic and photopic background luminances, with glare (G) levels of 0-2 (G0, G1, and G2, respectively) and spatial frequencies at 1.5, 3, 6, 12, and 18 cycles per degree (cpd).
Results
The contrast sensitivity increased after PTK at 1.5 and 3 cpd in mesopic and photopic conditions with G0-2 glare (p < 0.05). At 6 cpd, the contrast sensitivity increased in the mesopic condition with G1 glare, and in the photopic condition with G0-2 glare (p < 0.05). However, there was no change in contrast sensitivity at any glare level at 12 and 18 cpd after PTK.
ļīĆļ╣ä(contrast)ļ×Ć ĒŖ╣ņĀĢ ļ¼╝ņ▓┤Ļ░Ć ļ░░Ļ▓Į ļśÉļŖö ņØĖņĀæ ņé¼ļ¼╝ļĪ£ļČĆĒä░ ņ¦ĆļŗłļŖö ņāüļīĆņĀü ļ░ØĻĖ░ ņ░©ņØ┤ļź╝ ļ¦ÉĒĢ£ļŗż. ĒØ░ ļ░öĒāĢņŚÉ Ļ▓ĆņØĆ ĻĖĆņö©ļŖö ļåÆņØĆ ļīĆļ╣äļź╝ Ļ░¢ļŖö ļ░śļ®┤, ĒØ░ ļ░öĒāĢņŚÉ ĒÜīņāē ĻĖĆņö©ļŖö ļé«ņØĆ ļīĆļ╣äļź╝ ļ│┤ņØĖļŗż. ļåÆņØĆ ļīĆļ╣äļź╝ ņ¦Ćļŗī ņŗ£Ēæ£ļŖö ņĢīņĢäļ│┤ĻĖ░ ņēĮĻ│Ā, ļ░░Ļ▓ĮņØś ļ░ØĻĖ░ņÖĆ Ļ▒░ņØś ļ╣äņŖĘĒĢ£ ļ¬ģņĢöņØä Ļ░Ćņ¦ä ņŗ£Ēæ£ļŖö ņĢīņĢäļ│┤ĻĖ░ Ēלļōżļŗż. ĒĢ£ĒÄĖ ļÅÖņØ╝ĒĢ£ ļīĆļ╣äļź╝ ļéśĒāĆļé┤ļŖö ņŗ£Ēæ£ļØ╝ļÅä Ēü¼ĻĖ░Ļ░Ć ņ×æņĢäņ¦łņłśļĪØ ĻĄ¼ļČäĒĢśĻĖ░ ņ¢┤ļĀżņøīņ¦äļŗż. ņ¢┤ļ¢ż ĒÖśņ×ÉĻ░Ć ņØ╝ņĀĢĒĢ£ Ēü¼ĻĖ░ņØś ļ¼╝ņ▓┤ļź╝ ņØĖņŗØĒĢśĻĖ░ ņ£äĒĢ┤ ĻĘĖ ļ¼╝ņ▓┤Ļ░Ć ļ░░Ļ▓ĮĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņ¦ĆļģĆņĢ╝ ĒĢśļŖö ņĄ£ņåīĒĢ£ņØś ļ¬ģņĢö ņ░©ņØ┤ļź╝ ĻĘĖ ĒÖśņ×ÉņØś ŌĆ£ļīĆļ╣ä ņŚŁņ╣ś(contrast threshold)ŌĆØļØ╝Ļ│Ā ņĀĢņØśĒĢśļ®░, ņØ┤Ļ▓āņØś ņŚŁņØä ŌĆ£ļīĆļ╣äĻ░ÉļÅä(contrast sensitivity)ŌĆØļØ╝Ļ│Ā ņĀĢņØśĒĢ£ļŗż[1,2].
ĒĢ£ĒÄĖ, ĒŖ╣ņĀĢ ņŗ£Ļ░ü(visual angle) ņĢłņŚÉ Ļ▓ĆĻ│Ā ļ░ØņØĆ ņäĀņØś ļ░śļ│ĄņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö Ļ░£ņłśļź╝ ŌĆ£Ļ│ĄĻ░äņŻ╝Ēīīņłś(spatial frequency)ŌĆØļØ╝ ĒĢ£ļŗż. ņ”ē ņ¢ćĻ│Ā ļ╣Įļ╣ĮĒĢ£ ņäĀļōżņØä ĻĄ¼ļČäĒĢśļŖö Ļ▓āņØĆ ļåÆņØĆ Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉ ĒĢ┤ļŗ╣ĒĢśĻ│Ā, ĻĄĄņØĆ ņäĀņØ┤ ļō¼ņä▒ļō¼ņä▒ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö ļé«ņØĆ Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉ ĒĢ┤ļŗ╣ĒĢ£ļŗż[1,3]. ņŗ£ļĀź(visual acuity) ņĖĪņĀĢņŚÉ ņé¼ņÜ®ļÉśļŖö ņŗ£ļĀźĒæ£ļŖö ļåÆņØĆ ļīĆļ╣äļź╝ Ļ░Ćņ¦ä ĻĖ░ĒśĖļź╝, Ļ│ĄĻ░äņŻ╝Ēīīņłśļź╝ ņĀÉņ░© ļåÆņŚ¼Ļ░Ćļ®░ ņŗ£ļĀźņØä ņĖĪņĀĢĒĢśļŖö ĒśĢĒā£ļĪ£ņä£, ļåÆņØĆ ļīĆļ╣ä ņśüņŚŁņŚÉņä£ņØś ņŗ£ĻĖ░ļŖźļ¦īņØä ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŗż. ĒÖśņ×ÉĻ░Ć ņØ╝ņāüņŚÉņä£ ļ¦łņŻ╝ĒĢśĻ▓ī ļÉśļŖö ĒÖśĻ▓ĮņØĆ ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ņÖĆ ļīĆļ╣äļź╝ ļ│┤ņØ┤ļŖö ļ¼╝ņ▓┤ļōżļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ļŗż. ĻĘĖļלņä£ ņØĄņłÖĒĢ£ Ēü¼ĻĖ░ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä ļÅäļĪ£ņŚÉņä£ ņÜ┤ņĀäĒĢĀ ļĢīļÅä, ļ¦æņØĆ ļéĀĻ│╝ ĒØÉļ”░ ļéĀņØĆ ļīĆļ╣äļØ╝ļŖö Ļ┤ĆņĀÉņŚÉņä£ļŖö ņĀäĒśĆ ļŗżļźĖ ĒÖśĻ▓ĮņØ┤ ļÉ£ļŗż. ņØ┤ļź╝ Ļ░ÉņĢłĒĢ£ Ļ▓░Ļ│╝, ļŗżņ¢æĒĢ£ ļīĆļ╣äņÖĆ ļŗżņ¢æĒĢ£ Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉņä£ ņĖĪņĀĢĒĢ£ ļīĆļ╣äĻ░ÉļÅäĻ░Ć ņĀäņ▓┤ņĀüņØĖ ņŗ£ĻĖ░ļŖźņØä ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŖö ņ¦ĆĒæ£ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[3-7]. ņĄ£ĻĘ╝ ļōżņ¢┤ ļīĆļ╣äĻ░ÉļÅäļŖö ļ░▒ļé┤ņן, Ļ▒┤ņä▒ņĢł, ĒÖ®ļ░śļ│Ćņä▒, ļģ╣ļé┤ņן ļō▒ ļŗżņ¢æĒĢ£ ņ¦łĒÖśĻĄ░ņŚÉņä£ņØś ņŗ£ĻĖ░ļŖź ĒÅēĻ░ĆņŚÉņä£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[4-6,8-13].
Ļ│╝Ļ▒░ ņĢäļ▓©ļ”¼ļģĖ Ļ░üļ¦ēņØ┤ņāüņ”Øņ£╝ļĪ£ ļČłļ”¼ĻĖ░ļÅä ĒĢ£ ņĀüņØ┤ ņ׳ļŖö ņĀ£ 2ĒśĢ Ļ│╝ļ”ĮĻ░üļ¦ēņØ┤ņāüņ”Ø(Granular corneal dystrophy type 2, GCD2)ņØĆ ņ╣©Ēł¼ņ£©ņØ┤ ļ¦żņÜ░ ļåÆņØĆ ņāüņŚ╝ņāēņ▓┤ ņÜ░ņä▒ņ¦łĒÖśņØ┤ļŗż. ĻĄŁļé┤ņŚÉņä£ļŖö ļÅÖĒśĢņĀæĒĢ®ņ×É ņłśļź╝ ĻĘ╝Ļ▒░ļĪ£ ĒĢ£ Hardy-Weinberg Ļ│ĄņŗØņŚÉ ļö░ļźĖ ņé░ņČ£ņØś Ļ▓ĮņÜ░ ņØ┤ĒśĢņĀæĒĢ®ņ×ÉņØś ļ╣łļÅäĻ░Ć 1ļ¦ī ļ¬ģļŗ╣ 11.5ļ¬ģ[14], ņØ╝ļČĆ ĒśłņĢĪņøÉņŚÉ ņłśņ¦æļÉ£ ņĀ£ļīĆĒśł ņĀäņłśĻ▓Ćņé¼ņŚÉ ņØśĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 1ļ¦ī ļ¬ģļŗ╣ 29.1ļ¬ģņØś ņ£Āļ│æļźĀ[15]ņØä ļ│┤ņØ┤ļŖö ļō£ļ¼╝ņ¦Ć ņĢŖņØĆ ņ¦łĒÖśņØ┤ļŗż. Ļ░üļ¦ēņŚÉ Ļ│╝ļ”ĮĒśĢ ņ╣©ņ░®ļ¼╝(granular deposit)Ļ│╝ Ļ▓®ņ×ÉĒśĢ ņ╣©ņ░®ļ¼╝(lattice deposit or linear deposit)ņØ┤ ņāØĻĖ░Ļ│Ā, ĒøäĻĖ░ņŚÉļŖö ļ│┤ņÜ░ļ¦īņĖĄ ļ░öļĪ£ ņĢäļל Ļ┤æļ▓öņ£äĒĢ£ Ļ░üļ¦ē ņŗżņ¦ł ĒØÉļ”╝(diffuse stromal haze)ņØ┤ ļ░£ņāØĒĢśļ®░ ņŗ£ļĀźņØ┤ Ļ░ÉņåīĒĢśĻ▓ī ļÉ£ļŗż[16-18]. ņŗ£ļĀź ņåīņŗżņØś ņŻ╝ņÜö ņøÉņØĖņØĆ ĒøäĻĖ░ņŚÉ ļ░£ņāØĒĢśļŖö ļ│┤ļŗż ņ¢ĢņØĆ ņĖĄņØś Ļ┤æļ▓öņ£ä Ļ░üļ¦ē ņŗżņ¦ł ĒØÉļ”╝ņ£╝ļĪ£, ņØ┤ļŖö Ļ│╝ļ”ĮĒśĢĻ│╝ Ļ▓®ņ×ÉĒśĢ ņ╣©ņ░®ļ¼╝ļ│┤ļŗż ņ¢ĢņØĆ ņĖĄņŚÉ ņāØĻĖ░ļŖö ĒŖ╣ņ¦ĢņØ┤ ņ׳ļŗż[19,20]. ļö░ļØ╝ņä£ GCD2 ĒÖśņ×ÉņŚÉņä£ ņŗ£ļĀźņØ┤ ņĀĆĒĢśļÉśņŚłņØä ļĢī, ņ╣śļŻīļĀłņØ┤ņĀĆĻ░üļ¦ēņĀłņĀ£ņłĀ(phototherapeutic keratectomy, PTK)ņØä ņŗ£Ē¢ēĒĢśņŚ¼ Ļ░üļ¦ē ņŗżņ¦ł ĒØÉļ”╝ņØä ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņØ┤ Ēśäņ×¼ ņé¼ņÜ®ļÉśļŖö ļ░®ļ▓ĢņØ┤ļŗż[21-26].
PTKļź╝ ĒåĄĒĢ£ ņŗ£ļĀź Ē¢źņāüņØĆ Ēśäņ×¼Ļ╣īņ¦Ć ņ×ģņ”ØļÉśņ¢┤ ņÖöņ¦Ćļ¦ī[23,25-27], ļīĆļ╣äĻ░ÉļÅäņŚÉ ņ׳ņ¢┤ņä£ļŖö ņĢäņ¦ü ņŚ░ĻĄ¼Ļ░Ć ņŚåņŚłļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ļŖö GCD2 ĒÖśņ×ÉņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäļź╝ ņĖĪņĀĢĒĢśņŚ¼ ņóģĒĢ®ņĀüņØĖ ņŗ£ĻĖ░ļŖźņŚÉ ļīĆĒĢ£ ĒÅēĻ░Ćļź╝ ĒĢśĻ│Ā, PTK ņĀäĻ│╝ ĒøäņØś ļīĆļ╣äĻ░ÉļÅäļź╝ ļ╣äĻĄÉĒĢśņŚ¼ ņŗ£ĻĖ░ļŖźņŚÉ ņ׳ņ¢┤ PTKņØś ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö 2021ļģä 4ņøöļČĆĒä░ 2021ļģä 9ņøöĻ╣īņ¦Ć ļ│ĖņøÉņŚÉņä£ PTKļź╝ ņŗ£Ē¢ēļ░øņØĆ GCD2 ĒÖśņ×É 22ļ¬ģņØś 22ņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ļČäņäØņØä ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ņ×äņāüņŚ░ĻĄ¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board)ņØś ņŖ╣ņØĖņŚÉ ļö░ļØ╝ ņ¦äĒ¢ēļÉśņŚłļŗż(ņŖ╣ņØĖ ļ▓łĒśĖ: 202201-002-01). ņ£ĀņĀäņ×É Ļ▓Ćņé¼ļĪ£ ĒÖĢņ¦äļÉ£ GCD2 ņØ┤ĒśĢņĀæĒĢ®ņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. Ļ│╝Ļ▒░ PTK Ēøä ņ×¼ļ░£ĒĢśņŚ¼ ņ×¼ņłśņłĀņØä ļ░øļŖö 2ņĢłņØä ĒżĒĢ©ĒĢśņśĆņ£╝ļ®░, PTK ņØ┤ņĀäņŚÉ ņØ┤ļ»Ė ļ░▒ļé┤ņןņłśņłĀņØä ļ░øņØĆ 2ņĢłļÅä PTK ņĀäĒøäņØś ļīĆļ╣äĻ░ÉļÅä ļ╣äĻĄÉņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ņØ┤ļ»ĆļĪ£ ĒżĒĢ©ņŗ£ņ╝░ļŗż. ņŗ¼ĒĢ£ ĒĢĄļ░▒ļé┤ņן(Lens opacity classification system, LOCS N4)Ļ│╝ ĒøäļéŁĒĢśļ░▒ļé┤ņןņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö ļ░▒ļé┤ņןņŚÉ ņØśĒĢ£ ļīĆļ╣äĻ░ÉļÅä ņĀĆĒĢśĻ░Ć ņĀäņ▓┤ ļīĆļ╣äĻ░ÉļÅäņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ ļäłļ¼┤ Ēü¼ļŗżĻ│Ā ņāØĻ░üļÉśņ¢┤ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż[3,9].
PTKļŖö ņłÖļĀ©ļÉ£ 1ļ¬ģņØś ņłĀņ×É(E.K.K.)ņŚÉ ņØśĒĢ┤ ņŗ£Ē¢ēļÉśņŚłļŗż. ņłśņłĀ ņĀä ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓Įņ£╝ļĪ£ ļ│æļ│ĆņØś ļ▓öņ£äļź╝ ņ┤¼ņśüĒĢśņśĆļŗż. Proparacine 0.5% (Paracaine┬«; Hanmi, Seoul, Korea) ņĀÉņĢłņĢĪņØä 3ĒÜī Ēł¼ņŚ¼ĒĢ£ Ēøä Ļ░£Ļ▓ĆĻĖ░ļź╝ ņéĮņ×ģĒĢśĻ│Ā ņŻ╝Ļ▒▒ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ░üļ¦ē ņāüĒö╝ļź╝ ĻĖ░Ļ│äņĀüņ£╝ļĪ£ ļ▓ŚĻ▓©ļāłļŗż. ņŚæņŗ£ļ©ĖļĀłņØ┤ņĀĆ(WaveLight┬« EX500; Alcon, Fort Worth, TX, USA)ņØś ļ░®ņé¼ņäĀ ņĪ░ņé¼ Ļ░ĢļÅäļŖö 160 mJ/cm2ņśĆļŗż. ņŗ£ņČĢņØä ņżæņŗ¼ņ£╝ļĪ£ ņ¦üĻ▓Į 6.0 mm ļ▓öņ£äņŚÉ 10 HzņØś Ēīīņןņ£╝ļĪ£ ļĀłņØ┤ņĀĆļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż. ņ▓½ ļ▓łņ¦Ė ļĀłņØ┤ņĀĆ ņĪ░ņé¼ļŖö 20-30 ╬╝m Ļ╣ŖņØ┤ļĪ£ ņĀłņĀ£ĒĢśņśĆĻ│Ā, ņĀłņĀ£ Ēøä ĒÖśņ×Éļź╝ ņäĖĻĘ╣ļō▒ Ēśäļ»ĖĻ▓Įņ£╝ļĪ£ Ļ┤Ćņ░░ĒĢśņŚ¼ ņČöĻ░Ć ļĀłņØ┤ņĀĆ ņŚ¼ļČĆļź╝ Ļ▓░ņĀĢĒĢśņśĆļŗż. ņČöĻ░Ć ļĀłņØ┤ņĀĆ ņĪ░ņé¼ļŖö ļ¦żļ▓ł 5-10 ╬╝m Ļ╣ŖņØ┤ļĪ£ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ ņŚ¼ļ¤¼ ļ▓ł ļ░śļ│ĄĒĢśņśĆļŗż[23]. ņČöĻ░Ć ņĀłņĀ£ ņĀĢļÅäļŖö ļ¦żļ▓ł ņĀłņĀ£ ņŗ£ļ¦łļŗż ņ¦üņĀäņØś ņ×öņŚ¼ Ēś╝Ēāü ņĀĢļÅäļź╝ ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓Įņ£╝ļĪ£ Ļ┤Ćņ░░ĒĢśņŚ¼ Ļ▓░ņĀĢĒĢ©ņ£╝ļĪ£ņŹ©, Ļ│╝ļÅäĒĢ£ ņĀłņĀ£ļź╝ ņśłļ░®ĒĢśņśĆļŗż. ļ¦ż 10 ╬╝m ņĀłņĀ£ ņŗ£ļ¦łļŗż preservative-free carboxymethylcellulose sodium 0.5% (Refresh Plus┬«; Allergan, Irvine, CA, USA)ļź╝ ļÅäĒżĒĢśņŚ¼ ņĀłņĀ£ Ēæ£ļ®┤ņØś ļČłĻĘ£ņ╣Öņä▒ņØä ņżäņØ┤ļÅäļĪØ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ļģĖļĀźĒĢśņśĆļŗż. Ļ┤æļ▓öņ£äĒĢ£ Ļ░üļ¦ē ņŗżņ¦łņØś ĒØÉļ”╝ņØ┤ ņĀ£Ļ▒░ļÉĀ ļĢīĻ╣īņ¦Ć ņĀłņĀ£ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļŗ©, Ļ╣ŖņłÖņØ┤ ņ£äņ╣śĒĢ£ Ļ│╝ļ”ĮĒśĢĻ│╝ Ļ▓®ņ×ÉĒśĢņØś Ļ░üļ¦ēņ╣©ņ░®ļ¼╝ņØĆ ļé©Ļ▓©ļæÉņŚłļŗż[20,23-25]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ļÉ£ ņŚæņŗ£ļ©ĖļĀłņØ┤ņĀĆ ĻĖ░ĻĖ░ļŖö PTK ņåīĒöäĒŖĖņø©ņ¢┤ņØś ĻĄ¼ņä▒ņāü ņŻ╝ļ│ĆļČĆņØś ņĀłņĀ£ļ¤ēņØ┤ ņżæņŗ¼ļČĆņØś ņĀłņĀ£ļ¤ēļ│┤ļŗż ļ¦ÄņĢä ņłĀ Ēøä ĻĘ╝ņŗ£Ļ░Ć ņ£Āļ░£ļÉśļŖö ĒŖ╣ņ¦ĢņØ┤ ņ׳ņ¢┤, ĻĘ╝ņŗ£ĒÖöļź╝ ļ¦ēĻĖ░ ņ£äĒĢ┤ ņĀüņØĆ ņ¢æņØś ĻĄ┤ņĀłĻĄÉņĀĢļĀłņØ┤ņĀĆĻ░üļ¦ēņĀłņĀ£ņłĀ(photorefractive keratectomy, PRK)ņØ┤ ĒĢäņÜöĒĢśņśĆļŗż. ļö░ļØ╝ņä£ Ļ│╝ļÅäĒĢ£ ĻĘ╝ņŗ£ĒÖöĻ░Ć ņ£Āļ░£ļÉĀ Ļ▓āņ£╝ļĪ£ ņśłņāüļÉśļŖö 12ņĢłņŚÉņä£ļŖö PTKņÖĆ ĒĢ©Ļ╗ś PRKļź╝ ņČöĻ░ĆņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤ļĢī ņłśĒ¢ēļÉ£ PRKņØś Ļ╣ŖņØ┤ļŖö ļ¦żņÜ░ ņ×æņĢśĻ│Ā(3.5-9.7 ╬╝m), PTK Ļ╣ŖņØ┤ņŚÉ ĒżĒĢ©ĒĢśņŚ¼ Ēæ£ņŗ£ĒĢśņśĆļŗż. ņłśņłĀ Ēøä ņ×ÉĻ░ĆĒśłņ▓ŁņĢłņĢĮĻ│╝ Ofloxacin 0.3% (Tarivid┬« ointment, Taejoon, Seoul, Korea)ļź╝ ņĀÉņĢłĒĢ£ Ēøä ņĢĢļ░Ģ ņĢłļīĆļź╝ ņ░®ņÜ®ņ╝Ć ĒĢśņśĆļŗż. ņłśņłĀ Ēøä 1ņØ╝ņ¦ĖļČĆĒä░ 3ņØ╝ņ¦ĖĻ╣īņ¦ĆļŖö ĒĢśļŻ© 1ĒÜī ņ×ÉĻ░ĆĒśłņ▓ŁņĢłņĢĮ, Ofloxacin 0.3% (Taejoon, Seoul, Korea), dexamethasone, neomycin sulfate, polymyxin B sulfate Ēś╝ĒĢ® ņŚ░Ļ│Ā(Forus┬« ointment; Samil, Seoul, Korea)ļź╝ ņĀÉņĢłĒĢśļÅäļĪØ ĒĢśņśĆĻ│Ā, ņĢĢļ░Ģ ņĢłļīĆļŖö 4ņØ╝ņ¦ĖļČĆĒä░ ņĀ£Ļ▒░ĒĢśņśĆļŗż. ņłśņłĀ Ēøä 4ņØ╝ņ¦ĖļČĆĒä░ļŖö moxifloxacin 0.5% (Vigamox┬«; Novartis, Seoul, Korea), fluorometholone 0.1% (Flumetholone┬« 0.1%; Taejoon, Seoul, Korea)ņØä ĒĢśļŻ© 4ĒÜīņö® 4ņŻ╝Ļ░ä Ēł¼ņŚ¼, ĻĘĖ ĒøäņŚÉļŖö 3ĒÜīņö® 4ņŻ╝, 2ĒÜīņö® 4ņŻ╝, 1ĒÜīņö® 4ņŻ╝ļź╝ ņøÉņ╣Öņ£╝ļĪ£ ņżäņŚ¼ ļéśĻ░öļŗż. ņ×ÉĻ░ĆĒśłņ▓ŁņĢłņĢĮņØĆ Ļ░üļ¦ē ņāüĒö╝ņØś ņøÉĒÖ£ĒĢ£ ĒÜīļ│ĄņØä ļÅĢĻ│Āņ×É ņé¼ņÜ®ĒĢśņśĆļŗż.
ļīĆļ╣äĻ░ÉļÅäļŖö ņłśņłĀ ņĀäĻ│╝ ĒøäņŚÉ OPTEC 6500┬« (Stereo Optic Co, Inc., Chicago, IL, USA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. Ļ▓Ćņé¼ĻĖ░ĻĖ░ļŖö ņŚ░ĻĄ¼ ņ¦üņĀäņŚÉ Ļ┤Ćļ”¼ ņŚģņ▓┤ļĪ£ļČĆĒä░ņØś ņĀĢļÅä Ļ┤Ćļ”¼ņāü ļ│┤ņ”ØļÉ£ ĻĖ░ĻĖ░ļź╝ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ņĀĢņāüņØĖņØä ņāüļīĆļĪ£ ņĀÉĻ▓ĆĒĢ£ Ļ▓░Ļ│╝ ņØ┤ņāüņØ┤ ņŚåļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. Ļ▓Ćņé¼ĻĖ░ĻĖ░ņŚÉ ĻĖ░ļ│Ėņ£╝ļĪ£ ņäżņĀĢļÉ£ ņ┤Ø 6Ļ░Ćņ¦Ć ņāüĒÖ®ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. ļ░░Ļ▓Į ņĪ░ļÅäļŖö ņŻ╝Ļ░ä ņŗ£(photopic condition, 85 cd/m┬▓)ņÖĆ ņĢ╝Ļ░ä ņŗ£(mesopic condition, 3 cd/m┬▓) ņāüĒÖ®ņ£╝ļĪ£ ļéśļłäņ¢┤ ņäżņĀĢĒĢśņśĆĻ│Ā, Ļ░üĻ░üņŚÉ ļīĆĒĢ┤ ļłłļČĆņŗ¼(glare) ļŗ©Ļ│äļź╝ 3Ļ░Ćņ¦ĆļĪ£ ļłłļČĆņŗ¼ ņŚåņØī(no glare, G0), ļłłļČĆņŗ¼ 1ļŗ©Ļ│ä(glare level 1, G1), ļłłļČĆņŗ¼ 2ļŗ©Ļ│ä(glare level 2, G2)ļĪ£ ņäżņĀĢĒĢśņśĆļŗż. ļłłļČĆņŗ¼ņØ┤ļ×Ć ņŗ£ ļīĆņāüļ¼╝ ņŻ╝ļ│ĆņŚÉ ņČöĻ░ĆņĀüņØĖ Ļ┤æņøÉņŚÉ ņØśĒĢ£ ļ╣øņ£╝ļĪ£, ļ╣øņØś ņé░ļ×ĆņØä ņ£Āļ░£ĒĢśļŖöļŹ░, OPTEC 6500┬«ņŚÉņä£ļŖö ņŗ£Ēæ£Ļ░Ć ņ׳ļŖö ņżæņŗ¼ļČĆ ņŻ╝ļ│ĆņŚÉ LED ļō▒ņØä ļæśļ¤¼ ņØ┤ ļō▒ņØś ļ░ØĻĖ░ļź╝ ņĪ░ņĀłĒĢ©ņ£╝ļĪ£ņŹ© ļłłļČĆņŗ¼ ņĀĢļÅäļź╝ ņĪ░ņĀłĒĢśņśĆļŗż. ņØ┤ļź╝ ņóģĒĢ®ĒĢśņŚ¼ ļ│Ė ņŚ░ĻĄ¼ļŖö ņŻ╝Ļ░ä ņŗ£ņÖĆ ņĢ╝Ļ░ä ņŗ£ ņĪ░ļÅäņŚÉ Ļ░üĻ░ü ļłłļČĆņŗ¼ņØś 3ļŗ©Ļ│äļź╝ ņäżņĀĢĒĢśņŚ¼ ņ┤Ø 6Ļ░Ćņ¦Ć ļŗ©Ļ│äņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļśÉĒĢ£ Ļ░üĻ░üņØś ļŗ©Ļ│äņŚÉņä£, 1.5, 3, 6, 12, 18 cycles per degree (cpd)ņØś Ļ│ĄĻ░äņŻ╝ĒīīņłśņŚÉ ļīĆĒĢ┤ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØä ļ│┤ņØ┤ļŖö ņĢłĻ▓ĮņØä ņ░®ņÜ®ĒĢśĻ▓ī ĒĢ£ Ēøä ļīĆļ╣äĻ░ÉļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
ļīĆļ╣äĻ░ÉļÅäļź╝ ņĖĪņĀĢĒĢ£ Ēøä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņÜ®ņØ┤ĒĢ£ ņ▓śļ”¼ļź╝ ņ£äĒĢ┤ ļ░æņØ┤ 10ņØĖ ļĪ£ĻĘĖļĪ£ ļ│ĆĒÖśĒĢśņŚ¼ Ēæ£ņŗ£ĒĢśņśĆļŖöļŹ░, Ļ▓░ĻĄŁ log contrast sensitivity (log CS)Ļ░Ć 1ņØĖ ĒÖśņ×ÉņØś ļīĆļ╣äņŚŁņ╣śļŖö log CSĻ░Ć 2ņØĖ ĒÖśņ×ÉņØś ļīĆļ╣äņŚŁņ╣śņØś 10ļ░░Ļ░Ć ļÉ£ļŗż. ļśÉĒĢ£ area under the log contrast sensitivity function (AULCSF)ņØä Ļ│äņé░ĒĢśņśĆļŖöļŹ░, logļĪ£ ļ│ĆĒÖśĒĢ£ Ļ│ĄĻ░äņŻ╝Ēīīņłśļź╝ xņČĢņ£╝ļĪ£, logļĪ£ ļ│ĆĒÖśĒĢ£ ļīĆļ╣äĻ░ÉļÅä Ļ░ÆņØä yņČĢņ£╝ļĪ£ ļæÉļŖö ĻĘĖļלĒöäļź╝ ĻĘĖļ”¼Ļ│Ā, ļīĆļ╣äĻ░ÉļÅäņØś Ļ░ÆņØä 3ņ░© ļ░®ņĀĢņŗØĒÖöĒĢśņŚ¼ ĻĘĖ ņĢäļלņØś ļ®┤ņĀüņØä ĻĄ¼ĒĢ£ Ļ░ÆņØ┤ļ®░ ĻĘĖ ļ░®ņŗØņØĆ Applegate et al [28]ņØä ņ░ĖĻ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£, ņłśņłĀ ņĀäĻ│╝ ĒøäņŚÉ 4 m Ļ▒░ļ”¼ņØś ņ¦äņÜ®ĒĢ£ņŗ£ļĀźĒæ£ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØä ņĖĪņĀĢĒĢśņŚ¼ logarithm of minimal angle of resolution (logMAR)ņ£╝ļĪ£ ĒÖśņé░ĒĢśņśĆļŗż. ņ×ÉļŻīļČäņäØņØĆ SPSS statistics ver. 17.0(SPSS Inc., Chicago, IL, USA)ļź╝ ņé¼ņÜ®ĒĢśņśĆĻ│Ā, Wilcoxon-signed rank testļĪ£ ņ╣śļŻī ņĀäĒøä ļ│ĆĒÖöļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. Kruskal-Wallis testļĪ£ ņäĖ ļŗ©Ļ│äņØś ļłłļČĆņŗ¼ ĒÖśĻ▓ĮņŚÉņä£ AULCSFņØś ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦Ć Ļ▓ĆņĀĢĒĢ£ Ēøä, ņé¼Ēøä ļČäņäØņØĆ Mann-Whiteny testļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. Wilcoxon-signed rank testņÖĆ Kruskal-Wallis testļŖö pĻ░ÆņØ┤ 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░, Mann-Whiteny testņØś Ļ▓ĮņÜ░ BonferroniŌĆÖs methodļź╝ ņĀüņÜ®ĒĢśņŚ¼ pĻ░ÆņØ┤ 0.017 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśļŗżĻ│Ā ņĀĢņØśĒĢśņśĆļŗż.
ļŹöļČłņ¢┤, ņŗ£ļĀź Ē¢źņāüņØ┤ Ēü¼ņ¦Ć ņĢŖņØĆ ĒÖśņ×ÉĻĄ░ņØä ļö░ļĪ£ ļ¬©ņĢä AULCSFņŚÉ ļīĆĒĢ£ ņČöĻ░Ć ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. Jung et al [23]ņØś ņŚ░ĻĄ¼ņŚÉņä£ ļ│Ė ņŚ░ĻĄ¼ņÖĆ ļÅÖņØ╝ĒĢ£ ņłĀņ×ÉĻ░Ć GCD2 ĒÖśņ×ÉņØś 43ņĢłņØä ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśņśĆļŹś PTK Ļ▓░Ļ│╝, ĒÅēĻĘĀ ņĢĮ 0.218 logMARņØś ņŗ£ļĀź Ē¢źņāüņØ┤ ņ׳ņŚłļŹś ļ░ö, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ 0.218 logMAR ņØ┤ĒĢśņØś ņŗ£ļĀź Ē¢źņāüņØä ļ│┤ņØĖ 12ņĢłņØä ņŗ£ļĀź Ē¢źņāüņØ┤ ņĀüņŚłļŹś ĻĄ░ņ£╝ļĪ£ ņäżņĀĢĒĢśņŚ¼ ņ╣śļŻī ņĀäĒøäņØś AULCSF ļ│ĆĒÖöļź╝ Wilcoxon-signed rank testļĪ£ ļ╣äĻĄÉĒĢśņśĆļŗż.
PTK ņłśņłĀņØä ļ░øņØĆ GCD2 ņØ┤ĒśĢņĀæĒĢ®ņ×É 22ļ¬ģņØś 22ņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. ņ░ĖņŚ¼ ĒÖśņ×ÉļōżņØś ņŚ░ļĀ╣ņØĆ ĒÅēĻĘĀ 67.68 ┬▒ 7.97ņäĖņśĆņ£╝ļ®░, ļé©ņä▒ņØ┤ 8ļ¬ģ, ņŚ¼ņä▒ņØ┤ 14ļ¬ģņØ┤ņŚłļŗż. ĒÅēĻĘĀ ņČöņĀü Ļ┤Ćņ░░ ĻĖ░Ļ░ä, ņ”ē PTK Ēøä ļīĆļ╣äĻ░ÉļÅä Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻĖ░Ļ╣īņ¦ĆņØś ĻĖ░Ļ░äņØĆ ĒÅēĻĘĀ 38 ┬▒ 28ņØ╝ļĪ£ 1ņŻ╝ļČĆĒä░ 4Ļ░£ņøöĻ╣īņ¦Ć ļŗżņ¢æĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņ¦äņØĆ PTK Ēøä ņ×¼ļ░£ņØĆ ĒåĄņāü 32-38Ļ░£ņøö ĒøäņŚÉ Ļ┤Ćņ░░ļÉśļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢśņŚ¼, PTK Ēøä 1ņŻ╝-4Ļ░£ņøö ļé┤ņŚÉ ņłśĒ¢ēĒĢ£ ņŗ£ļĀź ļ░Å ļīĆļ╣äĻ░ÉļÅäļŖö Ļ░üļ¦ē Ēł¼ļ¬ģļÅäņŚÉ ņ׳ņ¢┤ ņśüĒ¢źņØä ļ░øņ¦Ć ņĢŖņĢśļŗżĻ│Ā ĒīÉļŗ©ĒĢśĻ│Ā ņ×ÉļŻīļź╝ ņłśņ¦æĒĢśņśĆļŗż[29,30]. PTK ņłśĒ¢ē ņŗ£ ņĀłņĀ£ņØś Ļ╣ŖņØ┤ļŖö ĒÅēĻĘĀ 66.61 ┬▒ 13.27 ╬╝mņśĆĻ│Ā, 22ņĢł ņżæ 13ņĢłņŚÉ ļīĆĒĢśņŚ¼ PRKļź╝ ļÅÖņŗ£ņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŗż(3.5-9.7 ╬╝m, ĒÅēĻĘĀ 7.97 ╬╝m). ņłśņłĀ ņĀä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 0.48 ┬▒ 0.18 logMARņśĆņ£╝ļ®░, ņłśņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 0.27 ┬▒ 0.10 logMARļĪ£ ņłśņłĀ ņĀäĻ│╝ ĒøäņŚÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŗ£ļĀźņØś ĒśĖņĀäņØä ļ│┤ņśĆļŗż(p<0.0001) (Table 1).
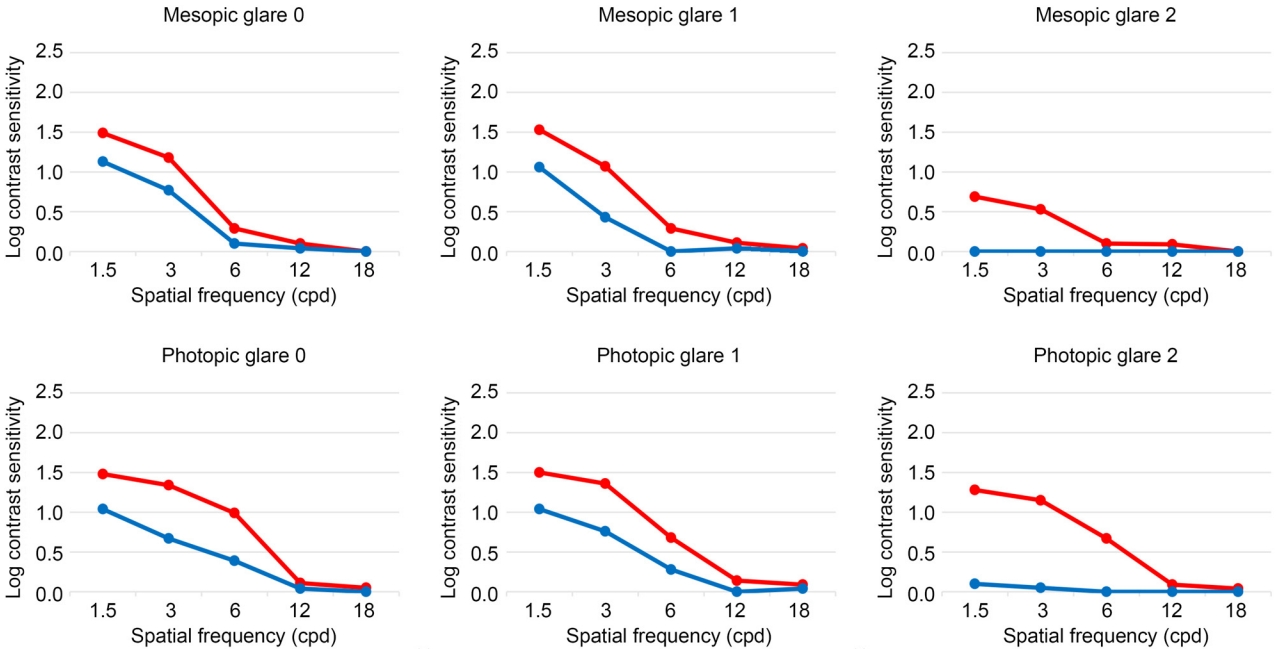
Table 2ņÖĆ Table 3ņØĆ Ļ░üĻ░ü ņĢ╝Ļ░ä ņŗ£ņÖĆ ņŻ╝Ļ░ä ņŗ£ ļ░░Ļ▓ĮņĪ░ļÅä ņāüĒÖ® ĒĢśņŚÉ GCD2 ĒÖśņ×ÉņŚÉņä£ PTK ņłśĒ¢ē ņĀäĻ│╝ ĒøäņØś ļīĆļ╣äĻ░ÉļÅäļź╝ ļ╣äĻĄÉĒĢ£ Ēæ£ņØ┤ļŗż. ņĢ╝Ļ░ä ņŗ£ ņĪ░ļÅä ĒĢś, ļ¬©ļōĀ ļłłļČĆņŗ¼ ļŗ©Ļ│ä(G0, G1, G2)ņŚÉņä£ 1.5 cpdņÖĆ 3 cpdņØś ļé«ņØĆ Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņØś ļīĆļ╣äĻ░ÉļÅäĻ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ē¢źņāüļÉśņŚłļŗż(G0: 1.5 cpd, p<0.000; 3 cpd, p<0.002; G1: 1.5 cpd, p<0.000; 3 cpd, p<0.002; G2: 1.5 cpd, p<0.003; 3 cpd, p<0.007; by Wilcoxon-signed rank test). ļśÉĒĢ£, ļłłļČĆņŗ¼ 1ļŗ©Ļ│ä(G1)ņŚÉņä£ļŖö 6 cpdņØś ņżæĻ░ä Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉņä£ļÅä ļīĆļ╣äĻ░ÉļÅäņØś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ ĒÖĢņØĖĒĢśņśĆļŗż(p<0.039). ņŻ╝Ļ░ä ņŗ£ ņĪ░ļÅä ĒĢś, ļ¬©ļōĀ ļłłļČĆņŗ¼ ļŗ©Ļ│äņŚÉņä£ 1.5 cpd, 3 cpdņØś ļé«ņØĆ Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁĻ│╝ 6 cpdņØś ņżæĻ░ä Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäĻ░Ć Ē¢źņāüļÉśņŚłļŗż(G0: 1.5 cpd, p<0.000; 3 cpd, p<0.001; 6 cpd, p<0.003; G1: 1.5 cpd, p<0.000; 3 cpd, p<0.001; 6 cpd, p<0.032; G2: 1.5 cpd, p<0.000; 3 cpd, p<0.000; 6 cpd, p<0.003; by Wilcoxon-signed rank test). ļŗżļ¦ī ļ¬©ļōĀ ņāüĒÖ®ņŚÉņä£ 12 cpdņÖĆ 18 cpdņŚÉņä£ļŖö ņłśņłĀ Ēøä ļīĆļ╣äĻ░ÉļÅäĻ░Ć Ē¢źņāüļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 1).
ļłłļČĆņŗ¼ ņĀĢļÅäņŚÉ ļö░ļźĖ ļīĆļ╣äĻ░ÉļÅäļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, PTK ņłśņłĀ ņĀä, ņĢ╝Ļ░ä ņŗ£ņÖĆ ņŻ╝Ļ░ä ņŗ£ ļ░░Ļ▓ĮņĪ░ļÅä ņāüĒÖ®ņŚÉņä£ G0, G1, G2ņØś ņäĖ ĻĘĖļŻ╣ņØś AULCSF ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłĻ│Ā(ņĢ╝Ļ░ä ņŗ£ p<0.000, ņŻ╝Ļ░ä ņŗ£ p<0.000 by Kruskal-Wallis test), Mann- Whitney testļź╝ ņØ┤ņÜ®ĒĢ£ ņé¼Ēøä ļČäņäØņŚÉņä£ G1Ļ│╝ G2, ĻĘĖļ”¼Ļ│Ā G0ņÖĆ G2 ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłļŗż(ņĢ╝Ļ░ä ņŗ£ G1 & G2 p<0.000, ņĢ╝Ļ░ä ņŗ£ G0 & G2 p<0.000, ņŻ╝Ļ░ä ņŗ£ G1 & G2 p<0.000, ņŻ╝Ļ░ä ņŗ£ G0 & G2 p<0.000) (Table 4). PTK ņłśņłĀ ĒøäņŚÉļŖö, ņĢ╝Ļ░ä ņŗ£ ļ░░Ļ▓ĮņĪ░ļÅäņŚÉņä£ļŖö G0, G1, G2 ņäĖ ĻĘĖļŻ╣ņØś AULCSF ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłņ¦Ćļ¦ī(p<0.001), ņŻ╝Ļ░ä ņŗ£ ļ░░Ļ▓ĮņĪ░ļÅäņŚÉņä£ļŖö ņäĖ ĻĘĖļŻ╣ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.272). PTK ņłśņłĀ Ēøä, ņĢ╝Ļ░ä ņŗ£ ļ░░Ļ▓ĮņĪ░ļÅä ņāüĒÖ®ņŚÉņä£ ņé¼Ēøä ļČäņäØ Ļ▓░Ļ│╝, G1Ļ│╝ G2, ĻĘĖļ”¼Ļ│Ā G0Ļ│╝ G2 ņé¼ņØ┤ņŚÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłļŗż(G1 & G2, p<0.001; G0 & G2, p<0.002) (Table 5).
ņŗ£ļĀź Ē¢źņāüņØ┤ 0.218 logMAR ņØ┤ĒĢśļĪ£ ņĀüņŚłļŹś 12ņĢłņŚÉ ļīĆĒĢ£ ņČöĻ░Ć ļČäņäØ Ļ▓░Ļ│╝, ņłśņłĀ ņĀä ņŗ£ļĀźņØĆ 0.35 ┬▒ 0.09 logMAR, ņłśņłĀ Ēøä ņŗ£ļĀźņØĆ 0.27 ┬▒ 0.10 logMARņśĆņ£╝ļ®░ ņŗ£ļĀź ļ│ĆĒÖöļ¤ēņØĆ ĒÅēĻĘĀ 0.08 ┬▒ 0.08 logMARņśĆļŗż. ņŗ£ļĀź Ē¢źņāüņØĆ ņĀüņŚłļŹś ļ░śļ®┤, AULCSFļŖö ņĢ╝Ļ░ä ņŗ£ņÖĆ ņŻ╝Ļ░ä ņŗ£, ļ¬©ļōĀ ļłłļČĆņŗ¼ ļŗ©Ļ│äņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņāüņŖ╣ĒĢśņśĆļŗż(ņĢ╝Ļ░ä ņŗ£ G0 p<0.047, G1 p<0.047, G2 p<0.028; ņŻ╝Ļ░ä ņŗ£ G0 p<0.017, G1 p<0.037, G2 p<0.008) (Table 6).
ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņłśņłĀ ņĀä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 0.48 ┬▒ 0.18 logMAR, ņłśņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 0.27 ┬▒ 0.10 logMARļĪ£ ļŗżļźĖ ņŚ░ĻĄ¼ļōżĻ│╝[23,25-27] ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņłśņłĀ ņĀäĻ│╝ ĒøäņŚÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŗ£ļĀźņØś ĒśĖņĀäņØä ļ│┤ņśĆļŗż(p<0.0001). ļ│Ė ņŚ░ĻĄ¼ļŖö Ēśäņ×¼Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉ£ ļ░öĻ░Ć ņŚåļŖö, GCD2 ĒÖśņ×ÉņØś ļīĆļ╣äĻ░ÉļÅäļź╝ ĒÅēĻ░ĆĒĢśĻ│Ā, PTK ņłśņłĀ ņĀäĻ│╝ Ēøäļź╝ ļ╣äĻĄÉĒĢśņŚ¼ ņŗ£ĻĖ░ļŖźņŚÉ ņ׳ņ¢┤ņä£ņØś PTKņØś ĒÜ©Ļ│╝ļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż. Ēśä ņŚ░ĻĄ¼ņŚÉņä£, GCD2 ĒÖśņ×ÉņŚÉņä£ņØś PTK ņłśņłĀ ņĀä ļīĆļ╣äĻ░ÉļÅäļŖö AULCSFļĪ£ ņ╣śĒÖśĒĢśņśĆņØä ļĢī ņĢ╝Ļ░ä ņŗ£ 0.234, ņŻ╝Ļ░ä ņŗ£ 0.327ļĪ£, ņØ┤ņĀä ņŚ░ĻĄ¼31ņŚÉņä£ ņĢīļĀżņ¦ä ņĀĢņāüņ╣ś(ņĢ╝Ļ░ä ņŗ£ 1.34, ņŻ╝Ļ░ä ņŗ£ 1.53)ņŚÉ ļ╣äĒĢ┤ ĒśäņĀĆĒĢśĻ▓ī ņĀĆĒĢśļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░, ĒŖ╣Ē׳ ļłłļČĆņŗ¼ ņĀĢļÅäĻ░Ć Ļ░ĢĒĢĀ ļĢī(G2) ņĀĆĒĢśļÉśņ¢┤ ņ׳ņŚłļŗż(Fig. 1). ļśÉĒĢ£, PTK ņłśņłĀ Ēøä ļīĆļ╣äĻ░ÉļÅäļŖö AULCSFļĪ£ ņ╣śĒÖśĒĢśņśĆņØä ļĢī ņĢ╝Ļ░ä ņŗ£ 0.548, 0.885ļĪ£ ņĀĢņāüņ╣śņŚÉ ļ╣äĒĢśņŚ¼ ļé«ņ¦Ćļ¦ī ņłśņłĀ ņĀäļ│┤ļŗż Ēü¼Ļ▓ī Ē¢źņāüļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļīĆļ╣äĻ░ÉļÅäĻ▓Ćņé¼ ņŗ£, ņŗ£Ēæ£ņØś ņŻ╝ļ│ĆļČĆņŚÉ 10Ļ░£ņØś LED Ļ┤æņøÉņØä ļæśļ¤¼, LED ņĀäĻĄ¼ņØś ļ░ØĻĖ░ļź╝ ņĪ░ņĀłĒĢśņŚ¼ ļłłļČĆņŗ¼ņØä ņ£Āļ░£ĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝ ņłśņłĀ ņĀä, ņŻ╝Ļ░ä ņĪ░ļÅäņÖĆ ņĢ╝Ļ░ä ņĪ░ļÅä ĒÖśĻ▓ĮĒĢśņŚÉņä£, ĻĘĖļ”¼Ļ│Ā ņłśņłĀ ĒøäņŚÉļŖö ņĢ╝Ļ░ä ņĪ░ļÅä ĒĢśņŚÉņä£, ļłłļČĆņŗ¼ 0ļŗ©Ļ│äļéś ļłłļČĆņŗ¼ 1ļŗ©Ļ│äļ│┤ļŗż, ļłłļČĆņŗ¼ 2ļŗ©Ļ│äņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäĻ░Ć ņĀĆĒĢśļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ļłłļČĆņŗ¼ņØĆ ņŗ£ņäĀ ļ░®Ē¢źņØś ņŻ╝ļ│ĆņŚÉ ņ£äņ╣śĒĢ£, ņ¦Ćļéśņ╣śĻ▓ī ļ░ØņØĆ Ļ┤æņøÉņŚÉ ņØśĒĢ┤ ņŗ£ļĀźņØ┤ ņĀĆĒĢ┤ļÉśļŖö ĒśäņāüņØä ņØśļ»ĖĒĢ£ļŗż. ļČłĒĢäņÜöĒĢ£ ļ░ØņØĆ ļ╣øņØĆ ņĢłĻĄ¼ ļé┤ņŚÉņä£ ņé░ļ×ĆļÉśļŖöļŹ░, ņé░ļ×ĆļÉ£ ļ╣øņØ┤ ļ¦Øļ¦ē ņĢ×ņŚÉ ņ╗żĒŖ╝ņ▓śļ¤╝ ļō£ļ”¼ņøīņ¦äļŗż ĒĢśņŚ¼ ņØ┤ļź╝ ŌĆ£Ļ┤æļ¦ē Ē£śļÅä(veiling luminance)ŌĆØ ļØ╝Ļ│Ā ļČĆļź┤ļ®░, Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ļ¦Øļ¦ēņŚÉ ļ¦║Ē׳ļŖö ņāüņØś ļīĆļ╣äļź╝ Ļ░Éņåīņŗ£Ēé©ļŗż. ļśÉĒĢ£, ļ│┤Ļ│Āņ×É ĒĢśļŖö ņŗ£ ļīĆņāüļ¼╝Ļ│╝ ņé░ļ×ĆņØä ņ£Āļ░£ĒĢśļŖö Ļ┤æņøÉņØ┤ ņØĖņĀæĒĢĀņłśļĪØ ļīĆļ╣äĻ░ÉļÅäņØś Ļ░ÉņåīĻ░Ć ļŹöņÜ▒ ņŗ¼ĒÖöļÉ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[32-35]. Paulsson and Sj├Čstrand [36]ņØĆ ņĢłĻĄ¼ ļé┤ ļ¦żņ▓┤ņØś ņ¢┤ļ¢ż ļČłĻĘ£ņ╣Öņä▒ņØ┤ļØ╝ļÅä ļīĆļ╣äĻ░ÉļÅäņØś Ļ░Éņåīļź╝ ņ┤łļלĒĢĀ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆĻ│Ā, Ļ░üļ¦ē ļČĆņóģ ņŚåņØ┤ ĻĄ¼ĒāĆĒāĆļ¦ī ņ׳ļŖö ņ┤łĻĖ░ Ēæ╣ņŖżĻ░üļ¦ēņØ┤ņāüņ”ØņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäņØś ņåÉņŗżņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░[8,37], Oie et al [38]ņØĆ Ēæ╣ņŖżĻ░üļ¦ēņØ┤ņāüņ”ØņŚÉņä£ ļīĆļ╣äĻ░ÉļÅä ņåÉņŗżņØś ņøÉņØĖņØ┤ ĻĄ¼ĒāĆĒāĆņŚÉ ņØśĒĢ£ ļ╣øņØś ņé░ļ×Ć ļĢīļ¼ĖņØ┤ļØ╝Ļ│Ā ņäżļ¬ģĒĢśņśĆļŗż. Koh et al [13]ņØĆ Ēæ£ņĖĄņĀÉņāüĻ░üļ¦ēņŚ╝ņØ┤ ļÅÖļ░śļÉ£ Ļ▒┤ņä▒ņĢł ĒÖśņ×ÉņŚÉņä£ 20/20ņØś ņóŗņØĆ ņŗ£ļĀźņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļīĆļ╣äĻ░ÉļÅäĻ░Ć ņĀĆĒĢśļÉśļŖö Ļ▓āņØä ļ│┤Ļ│ĀĒĢśļ®░ ļČłņĢłņĀĢĒĢ£ ļłłļ¼╝ļ¦ēņ£╝ļĪ£ ņØĖĒĢ┤ ļČłĻĘ£ņ╣ÖĒĢ┤ņ¦ä ņĢłĻĄ¼ Ēæ£ļ®┤ņØ┤ ĻĘĖ ņøÉņØĖņØ┤ļØ╝Ļ│Ā ĒĢśņśĆļŗż. Koh et al [39]ņØĆ ņ▓┤ļé┤ ļ”¼ņåīņóĆņŚÉ sphingolipidĻ░Ć ņČĢņĀüļÉśļŖö ņä▒ņŚ╝ņāēņ▓┤ ņ£ĀņĀäņ¦łĒÖśņØĖ Fabry ļ│æņŚÉņä£ņØś ļīĆļ╣äĻ░ÉļÅä ņĀĆĒĢśņŚÉ ļīĆĒĢ┤ņä£ļÅä ļ░£Ēæ£ĒĢśņśĆļŖöļŹ░, Fabry ļ│æņØś ņŻ╝ņÜö ņ”ØņāüņØĖ corneal verticillateļŖö ņŗ£ļĀźĻ│╝ļŖö ļ¼┤Ļ┤ĆĒĢśļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ņ¦Ćļ¦ī, Ļ░üļ¦ēņØś Ēł¼ļ¬ģļÅäņŚÉ ņśüĒ¢źņØä ļ»Ėņ│É ļ╣øņØś ņé░ļ×ĆņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā ļīĆļ╣äĻ░ÉļÅäļź╝ ļ¢©ņ¢┤ļ£©ļ”░ļŗżĻ│Ā ņäżļ¬ģĒĢśņśĆļŗż. GCD2ņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäĻ░Ć ņĀĆĒĢśļÉśļŖö ņøÉņØĖņØĆ ņĢäņ¦ü ļ░ØĒśĆņ¦ä ļ░öĻ░Ć ņŚåņ¦Ćļ¦ī, ņāüĻĖ░ ņ¦łĒÖśņŚÉ Ļ┤ĆĒĢ£ ņ░ĖĻ│Āļ¼ĖĒŚīņØä Ļ│ĀļĀżĒĢśļ®┤, Ļ░üļ¦ēņØś Ēś╝ĒāüņŚÉ ņØśĒĢ┤ ļ¦Øļ¦ēņŚÉ ļ¦║Ē׳ļŖö ļ╣øņØ┤ ņé░ļ×ĆļÉśĻĖ░ ļĢīļ¼ĖņØ╝ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗżĻ│Ā ņāØĻ░üļÉśĻ│Ā, PTK ĒøäņŚÉ Ļ┤æļ▓öņ£ä ņŗżņ¦ł ĒØÉļ”╝ņØ┤ ņĀ£Ļ▒░ļÉśļ®┤ņä£ ļīĆļ╣äĻ░ÉļÅäĻ░Ć Ē¢źņāüļÉśļŖö Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż. ļśÉĒĢ£, ņØ╝ļČĆ ņśłņŗ£ņŚÉņä£ PTK ņĀäĒøä ņŗ£ļĀź ļ│ĆĒÖöĻ░Ć ņĀüņØĆ Ļ▓āņØĆ ņłśņłĀ ņĀä Ēś╝Ēāü ņé¼ņØ┤ņØś ņ×æņØĆ Ēł¼ļ¬ģĻ│ĄĻ░äņØ┤ ņĀ£Ļ│ĄĒĢśļŖö ļ░öļŖśĻĄ¼ļ®Ź ĒÜ©Ļ│╝(pinhole effect)ļĪ£ ņØĖĒĢśņŚ¼ ņłśņłĀ ņĀä ņŗ£ļĀźņØ┤ ĻĘ╣ļīĆĒÖöļÉśņŚłĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Ginsburg [3]ļŖö ļ░▒ļé┤ņןņŚÉņä£ ņłśņĀĢņ▓┤ņØś Ēś╝ĒāüņØ┤ ļ╣øņØś ņé░ļ×ĆņØä ņØ╝ņ£╝ņ╝£ ļīĆļ╣äĻ░ÉļÅäĻ░Ć ļ¢©ņ¢┤ņ¦äļŗżĻ│Ā ņäżļ¬ģĒĢśļ®░, ļ░▒ļé┤ņן ĒÖśņ×ÉļōżņØ┤ ļłłļČĆņŗĀ Ē¢ćļ╣ø ņĢäļלņŚÉņä£ļéś ņĢ╝Ļ░äņØś ĒŚżļō£ļØ╝ņØ┤ĒŖĖ ļČłļ╣øņŚÉ ņØśĒĢ┤ ņŗ¼ĒĢ£ ļłłļČĆņŗ¼ ņ”ØņāüņØä ļŖÉļü╝ļŖö Ļ▓āļÅä ļ╣øņØś ņé░ļ×ĆĻ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ĒĢ£ĒÄĖ ļ░▒ļé┤ņן Ēś╝ĒāüņØ┤ ņŗ¼ĒĢĀņłśļĪØ ļłłļČĆņŗ¼ņŚÉ ņØśĒĢ£ ļīĆ ļ╣äĻ░ÉļÅä ņĀĆĒĢśĻ░Ć ņ”ØĻ░ĆĒĢ©ņØä ļ│┤Ļ│ĀĒĢ£ ļ░öĻ░Ć ņ׳ņ£╝ļ®░[33,40], ņØ┤ļŖö ļ╣øņØś ņ¦äĒ¢ē ņāü ļ¦żņ▓┤ņØś Ēś╝ĒāüņØ┤ ņĪ┤ņ×¼ĒĢĀ Ļ▓ĮņÜ░, ļ╣øņØś ņé░ļ×ĆņØ┤ ņ┤ēņ¦äļÉśņ¢┤ ļłłļČĆņŗ¼ņŚÉ ņØśĒĢ£ ņŗ£ĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ļŹöņÜ▒ ņŗ¼ĒÖöļÉśļŖö Ļ▓āņ£╝ļĪ£ ņäżļ¬ģļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļÅÖņØ╝ĒĢ£ ņĢłĻĄ¼ņŚÉņä£ ņłśĻ░£ņøö ļé┤ņŚÉ PTK ņĀäĒøäņØś ļīĆļ╣äĻ░ÉļÅäļ¦īņØä ļ╣äĻĄÉĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ, PTK ņĀä GCD2ņŚÉņä£ Ļ░üļ¦ēņØś Ēś╝Ēāüņ£╝ļĪ£ ņØĖĒĢ£ ļīĆļ╣äĻ░ÉļÅä ņĀĆĒĢśņÖĆ Ļ░üļ¦ēĒś╝ĒāüņØä ņĀ£Ļ▒░ĒĢ£ Ēøä PTKņØś ļīĆļ╣äĻ░ÉļÅä Ē¢źņāü ĒÜ©Ļ│╝ļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£, GCD2 ĒÖśņ×ÉņŚÉņä£ PTKņŚÉ ņØśĒĢ┤ ņŻ╝Ļ░ä ņŗ£ņÖĆ ņĢ╝ Ļ░ä ņŗ£ņØś ļīĆļ╣äĻ░ÉļÅäĻ░Ć ļ¬©ļæÉ Ēü¼Ļ▓ī ņ”ØĻ░ĆļÉśņŚłņ£╝ļ®░, ĒŖ╣Ē׳ ļ╣äĻĄÉņĀü Ēü░ ļ¼╝ņ▓┤ļź╝ ņØĖņŗØĒĢśļŖö Ļ▓āņŚÉ ņåŹĒĢśļŖö ļé«ņØĆ Ļ│ĄĻ░äņŻ╝ĒīīņłśņÖĆ ņżæĻ░ä Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉņä£ ļīĆļ╣äĻ░ÉļÅä Ļ░£ņäĀņØś ĒÜ©Ļ│╝Ļ░Ć ļÜ£ļĀĘĒĢ©ņØä ĒÖĢ ņØĖĒĢśņśĆļŗż. ņ×æĻ│Ā ņäĖļ░ĆĒĢ£ ļ¼╝ņ▓┤ļź╝ ĻĄ¼ļČäĒĢśļŖö ļŖźļĀźņØä ļīĆļ│ĆĒĢśļŖö ļåÆ ņØĆ Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉņä£ņØś ļīĆļ╣äĻ░ÉļÅäļŖö PTK ņĀäĒøäļĪ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. 20/20ņØś ņŗ£ļĀźņØĆ 30 cpd, 20/40ņØś ņŗ£ļĀźņØĆ ņĢĮ 15 cpd, 20/600ņØś ņŗ£ļĀźņØĆ 1 cpdņŚÉ ņāüņØæĒĢśļŖöļŹ░,41,42 ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ PTK Ēøä ņŗ£ļĀźņØ┤ 0.27 logMAR (ņĢĮ 20/37)ņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ļåÆņØĆ Ļ│ĄĻ░äņŻ╝ Ēīīņłś ņśüņŚŁņØś ļīĆļ╣äĻ░ÉļÅä Ļ▓Ćņé¼ņŚÉ ņĀ£ĒĢ£ņØ┤ ņ׳ņŚłņØä Ļ▓āņØ┤ļØ╝ ņśłņĖĪĒĢĀ ņłś ņ׳ļŗż. 20/20ņØä ļ│┤ļŖö ĒÖśņ×ÉņØś ņŗ£ļĀźņØĆ ļåÆņØĆ Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁ ņŚÉņä£ņØś ņŗ£ĻĖ░ļŖźļ¦īņØä ļīĆļ│ĆĒĢśļ®░, 20/20ļ│┤ļŗż Ēü¼ĻĖ░ļŖö Ēü¼ņ¦Ćļ¦ī, ļīĆ ļ╣äļŖö ļé«ņØĆ ņŗżņäĖĻ│äņØś ļ¼╝ņ▓┤ļź╝ ļ│┤ļŖö ļŖźļĀźņØĆ ņŗ£ļĀźļ¦īņ£╝ļĪ£ļŖö ņĖĪņĀĢ ĒĢśĻĖ░Ļ░Ć ņ¢┤ļĀĄļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż.1,43 ņ”ē, ĻĖ░ņĪ┤ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ņĀĆ-ņżæļō▒ļÅäņØś Ļ│ĄĻ░äņŻ╝ĒīīņłśņØĖ 3-6 cpd ņé¼ņØ┤ņØś Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁ ņŚÉ ļīĆļ╣äĻ░ÉļÅäņØś ņĀĢņĀÉ(peak)ņØ┤ ņĪ┤ņ×¼ĒĢ£ļŗżļŖö Ļ▓āņØ┤ ļ░ØĒśĆņĪīĻ│Ā, ņØ┤ ļ¤░ ņśüņŚŁņØś ļīĆļ╣äĻ░ÉļÅäĻ░Ć ņØ╝ņāüņāØĒÖ£ņØä ņśüņ£äĒĢśļŖö ļŹ░ ĒĢäņÜöĒĢ£ ņŗ£ ĻĖ░ļŖź(ņøĆņ¦üņ×ä Ļ░Éņ¦Ć, ņÜ┤ņĀäņØ┤ļéś ļ│┤Ē¢ē ņżæņØś ļ¼╝ņ▓┤ ņŗØļ│ä ļō▒)ņØä Ļ░Ć ņן ņל ņśłņĖĪĒĢĀ ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż.1,7,9,44-46 ļ│Ė ņŚ░ĻĄ¼ņ¦äņØĆ GCD2 ĒÖśņ×ÉņŚÉņä£ PTKļź╝ ĒåĄĒĢ┤ ņŗ£ļĀźņØś Ē¢źņāüĻ│╝, ņĀĆ-ņżæļō▒ļÅä Ļ│Ą Ļ░äņŻ╝Ēīīņłś ņśüņŚŁņØś ļīĆļ╣äĻ░ÉļÅäņØś Ē¢źņāü ļæÉ Ļ░Ćņ¦Ćļź╝ ļ¬©ļæÉ ĒÖĢņØĖĒĢśņśĆ ņ£╝ļ®░, ņŗ£ļĀź Ē¢źņāüņØ┤ Ēü¼ņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉļÅä ļīĆļ╣äĻ░ÉļÅäļŖö Ļ░£ņäĀļÉ£ļŗż ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ PTKĻ░Ć ņŗ£ļĀźĻ▓Ćņé¼ļ¦īņ£╝ļĪ£ļŖö ļ»Ėņ▓ś ĒÅēĻ░ĆĒĢśņ¦Ć ļ¬╗ĒĢśļŖö ņóģĒĢ®ņĀüņØĖ ņŗ£ĻĖ░ļŖźņØś Ē¢źņāüņØä Ļ░ĆņĀĖņś©ļŗż ļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢśĻ▓ī ļÉśņŚłļŗż.
GCD2 ņØ┤ĒśĢņĀæĒĢ®ņ×ÉņŚÉņä£, ņ¦łĒÖśņØś ņ┤łĻĖ░ņŚÉ ņāØĻĖ░ļŖö Ļ│╝ļ”ĮĒśĢĻ│╝ Ļ▓®ņ×ÉĒśĢņØś ņ╣©ņ░®ļ¼╝ņØĆ ĻĘĖ ņé¼ņØ┤ņŚÉ Ēł¼ļ¬ģĒĢ£ Ļ│ĄĻ░äņØ┤ ņ׳ņ¢┤ ļ╣äĻĄÉņĀü ņŗ£ļĀźņØ┤ ņ£Āņ¦ĆļÉśņ¦Ćļ¦ī, ĒøäĻĖ░ņŚÉļŖö Ļ│╝ļ”ĮĒśĢĻ│╝ Ļ▓®ņ×ÉĒśĢņØś ņ╣©ņ░®ļ¼╝ ņé¼ņØ┤ņŚÉ Ļ░üļ¦ē ņŗżņ¦ł ĒØÉļ”╝ņØ┤ ļ░£ņāØĒĢśņŚ¼ ļ│ĖĻ▓®ņĀüņØĖ ņŗ£ļĀźņĀĆĒĢśĻ░Ć ņ┤łļלļÉ£ļŗż[20,23]. ļ░śļ®┤ GCD2ņŚÉņä£ Ļ░üļ¦ēņØś Ēś╝ĒāüņØĆ PTK ĒøäņŚÉ ņ×¼ļ░£ĒĢśļ®░, GCD2 ņØ┤ĒśĢņĀæĒĢ®ņ×ÉņŚÉņä£ PTK Ēøä ņ×¼ļ░£Ļ╣īņ¦ĆņØś ĻĖ░Ļ░äņØĆ ņŚ░ĻĄ¼ņŚÉ ļö░ļØ╝ 32Ļ░£ņøö[29], 38.4Ļ░£ņøö[30] ļō▒ņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż. PTK Ēøä ņ×öņŚ¼ Ļ░üļ¦ēņØ┤ ņ¢ćņĢäņ¦ĆļŖö ņāüĒÖ®Ļ│╝ ņ×¼ļ░£ļĪ£ ņØĖĒĢ£ PTKņØś ļ░śļ│Ą ĒĢäņÜöņä▒ņØä Ļ│ĀļĀżĒĢśļ®┤, Ļ░ĆļŖźĒĢśļ®┤ ņāØņĢĀņŚÉņä£ ļŖ”ņØĆ ņŗ£ĻĖ░ņŚÉ PTKļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż[25,26,29,30,47]. ņØ┤ņŚÉ ļö░ļØ╝ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ PTKļź╝ ļ░øņØĆ ĒÖśņ×ÉņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 67.88ņäĖ ņśĆņ£╝ļ®░, ĻĖ░ņĪ┤ PRK, ļØ╝ņŗØ, ļØ╝ņä╣ ļō▒ ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢ£ ĻĄ┤ņĀł ņłśņłĀļĪ£ ņżæņŗ¼ Ļ░üļ¦ēņØś Ēś╝ĒāüņØ┤ ņŗ¼ĒĢ£ Ļ▓ĮņÜ░ņØ┤Ļ▒░ļéś, ĻĖ░ņĪ┤ ņłśņłĀ ņŚåņØ┤ļÅä Ļ░üļ¦ēĒś╝ĒāüņØ┤ ņŗ¼ĒĢśņŚ¼ ņØ╝ņāüņāØĒÖ£ņŚÉ ņ¦ĆņןņØ┤ ļ¦ÄņØĆ ņØ╝ļČĆ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ļŖö Ļ░üļ¦ē ņØ┤ņŗØņØä ņŚ░ĻĖ░ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ 40ļīĆ Ēøäļ░śļČĆĒä░ PTKļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż[48].
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ļŖö ņłśņłĀ Ēøä Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ ņØ╝ņĀĢĒĢśņ¦Ć ņĢŖĻ│Ā ņĄ£ļīĆ 4Ļ░£ņøöļĪ£ ņ¦¦ļŗżļŖö Ļ▓āņØ┤ļŗż. ņøÉĻ▒░ļ”¼ņŚÉņä£ ļ░®ļ¼ĖĒĢśļŖö ĒÖśņ×ÉņØś ĒŖ╣ņä▒ņāü ņłĀ Ēøä Ļ▓Ćņé¼ ņŗ£Ļ╣īņ¦ĆņØś ĻĖ░Ļ░äņØ┤ ļŗżņ¢æĒĢśņśĆņ£╝ļéś, GCD2 ņØ┤ĒśĢņĀæĒĢ®ņ×ÉņØś PTK Ēøä Ēś╝ĒāüņØś ņ×¼ļ░£ņØĆ ņĢĮ 3ļģä Ēøä ņŗ£ņ×æļÉ£ļŗżļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢĀ ļĢī[29,30], Ļ▓░Ļ│╝ļź╝ ļÅäņČ£ĒĢśļŖö Ļ▓āņŚÉļŖö ļ¼ĖņĀ£Ļ░Ć ņŚåņŚłļŗż. ļśÉĒĢ£, Watanabe et al [49]ņØĆ Ēæ╣ņŖżĻ░üļ¦ēņØ┤ņāüņ”ØņŚÉņä£ ĻĄ¼ĒāĆĒāĆņØś ļäōņØ┤Ļ░Ć Ēü┤ņłśļĪØ ļīĆļ╣äĻ░ÉļÅäĻ░Ć Ļ░ÉņåīĒĢ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ļÅÖĻ│Ą ļé┤ņŚÉ Ļ░üļ¦ēĒś╝ĒāüņØ┤ ņ¦äĒ¢ēļÉśņ¢┤ PTKĻ░Ć ĒĢäņÜöĒĢ£ GCD2 ĒÖśņ×ÉļōżņØś ļīĆļ╣äĻ░ÉļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŖöļŹ░, ļÅÖĻ│Ą ļé┤ņØś Ļ░üļ¦ē Ēś╝ĒāüņŚÉ ņ׳ņ¢┤ ĻĘĖ Ēü¼ĻĖ░ļéś ņ£äņ╣ś ļ│ĆĒÖöņŚÉ ļö░ļźĖ ļīĆļ╣äĻ░ÉļÅäņØś ņ░©ņØ┤ļŖö ņĖĪņĀĢĒĢśņ¦Ć ļ¬╗Ē¢łļŗżļŖö ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ļŗż. ļŹöļČłņ¢┤, ļÅÖĻ│ĄņØś Ēü¼ĻĖ░Ļ░Ć ļīĆļ╣äĻ░ÉļÅäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ļ│┤Ļ│ĀņŚÉņä£ļŖö ņ×æņØĆ ļÅÖĻ│ĄņØĆ ĒÜīņĀłņŚÉ ņØśĒĢ┤, Ēü░ ļÅÖĻ│ĄņØĆ ĻĄ¼ļ®┤ ņłśņ░©ņØś ņ”ØĻ░ĆņŚÉ ņØśĒĢ┤ ļīĆļ╣äĻ░ÉļÅäĻ░Ć ņĀĆĒĢśļÉĀ ņłś ņ׳ļŗżĻ│Ā ņ¢ĖĻĖēļÉśĻ│Ā ņ׳ņ£╝ļéś[50], ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÖśņ×ÉņØś ļÅÖĻ│Ą Ēü¼ĻĖ░ļź╝ ļö░ļĪ£ ņĖĪņĀĢĒĢśņ¦ĆļŖö ņĢŖņĢśļŗż. ļŗżļ¦ī ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ OPTEC 6500┬«ņØĆ Ļ▓Ćņé¼ ņŗ£ ņÖĖļČĆņØś ļ╣øņØ┤ Ļ▒░ņØś ņ░©ļŗ©ļÉĀ ņĀĢļÅäļĪ£ ņØ┤ļ¦łļź╝ ĻĖ░Ļ│ä ņĢłņ£╝ļĪ£ ļäŻņ¢┤ņĢ╝ ņ¦äĒ¢ēņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓Ćņé¼ĻĖ░ĻĖ░ļĪ£, ļ¬©ļōĀ Ļ▓Ćņé¼ ņŗ£ ņŻ╝ļ│ĆņØś ņĪ░ļÅäļŖö Ļ▒░ņØś ņØ╝ņĀĢĒĢśņśĆļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŗż. ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£, ĒÖśņ×ÉņØś ņŻ╝Ļ┤ĆņĀüņØĖ ļ¦īņĪ▒ļÅäļź╝ ņäżļ¼Ėņ¦Ć ļō▒ņØś ĒĢŁļ¬®ņØä ĒåĄĒĢ┤ ĒÅēĻ░ĆĒĢśņ¦Ć ņĢŖņØĆ Ļ▓āņØ┤ ņĀ£ĒĢ£ņĀÉņØ┤ ļÉĀ Ļ▓āņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī ļ│Ė ņŚ░ĻĄ¼ļŖö GCD2 ĒÖśņ×ÉņØś PTK ņĀäĒøä ļīĆļ╣äĻ░ÉļÅäļź╝ Ļ░ØĻ┤ĆņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņĄ£ņ┤łļĪ£ ņĪ░ņé¼ĒĢśņśĆļŗżļŖö ņØśņØśĻ░Ć ņ׳ņ£╝ļ®░ Ļ│ĄĻ░äņŻ╝ĒīīņłśņÖĆ ļ░░Ļ▓Į ņĪ░ļÅä, ļłłļČĆņŗ¼ ņĀĢļÅäļź╝ ņäĖļČäĒĢśņŚ¼ ņāüĒÖ®ļ│äļĪ£ ņäĖļ░ĆĒĢ£ ļīĆļ╣äĻ░ÉļÅäļź╝ ĒÅēĻ░ĆĒĢśņśĆļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗżĻ│Ā ņāØĻ░üĒĢ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ņĀ£2ĒśĢ Ļ│╝ļ”ĮĻ░üļ¦ēņØ┤ņāüņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĀĢņāüņØĖņŚÉ ļ╣äĒĢ┤ ļīĆļ╣äĻ░ÉļÅäĻ░Ć ņĀĆĒĢśļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░, ņ£Āļ░£ļÉ£ ļłłļČĆņŗ¼ ņĀĢļÅäĻ░Ć ņŗ¼ĒĢĀ ļĢī ļīĆļ╣äĻ░ÉļÅä ņåÉņŗżņØś ņĀĢļÅäĻ░Ć ņŗ¼ĒĢśņśĆļŗż. ņ╣śļŻīļĀłņØ┤ņĀĆ Ļ░üļ¦ēņĀłņĀ£ņłĀņØä ĒåĄĒĢ┤ ļīĆļ╣äĻ░ÉļÅäĻ░Ć Ēü¼Ļ▓ī Ē¢źņāüļÉśņŚłņ£╝ļ®░, ĒŖ╣Ē׳ ņĀĆ-ņżæļō▒ļÅäņØś Ļ│ĄĻ░äņŻ╝Ēīīņłś ņśüņŚŁņŚÉņä£ ĻĘĖ ĒÜ©Ļ│╝Ļ░Ć ļÜ£ļĀĘĒĢśņśĆļŗż. ļŹöļČłņ¢┤, ņŗ£ļĀź Ē¢źņāüņØ┤ Ēü¼ņ¦Ć ņĢŖņĢśļŹś ĒÖśņ×ÉļōżņŚÉņä£ļÅä ļīĆļ╣äĻ░ÉļÅäĻ░Ć Ē¢źņāüļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņ”ē, ņĀ£2ĒśĢ Ļ│╝ļ”ĮĻ░üļ¦ēņØ┤ņāüņ”Ø ĒÖśņ×ÉņŚÉņä£ ļīĆļ╣äĻ░ÉļÅäĻ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ĒÖśņ×ÉņØś ņŗ£ĻĖ░ļŖźņØ┤ ņĀĆĒĢśļÉ£ Ļ▓āņØä ņĖĪņĀĢĒĢśņśĆĻ│Ā, ņ╣śļŻīļĀłņØ┤ņĀĆĻ░üļ¦ēņĀłņĀ£ņłĀļĪ£ ņ×¼ļ░£ ņĀäĻ╣īņ¦ĆņØś ņŗ£ĻĖ░ļŖźņØä Ē¢źņāüņŗ£Ēé¼ ņłś ņ׳ņØīņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż.
Figure┬Ā1.
Contrast sensitivity comparison between before and after phototherapeutic keratectomy in granular corneal dystrophy type 2. Blue line means preoperative values and red line means postoperative values. cpd = cycles per degrees.
Table┬Ā1.
Demographic and clinical data of 22 eyes
Table┬Ā2.
Comparison of log contrast sensitivity under mesopic condition, between preoperative versus postoperative phototherapeutic keratectomy
| Spatial frequency (cpd) | Pre-PTK | Post-PTK | p-value* |
|---|---|---|---|
| No glare (G0) | |||
| ŌĆā1.5 | 1.13 ┬▒ 0.47 | 1.49 ┬▒ 0.24 | 0.001 |
| ŌĆā3 | 0.77 ┬▒ 0.54 | 1.18 ┬▒ 0.50 | 0.002 |
| ŌĆā6 | 0.10 ┬▒ 0.33 | 0.29 ┬▒ 0.55 | 0.074 |
| ŌĆā12 | 0.04 ┬▒ 0.21 | 0.10 ┬▒ 0.33 | 0.655 |
| ŌĆā18 | 0 | 0 | 1.000 |
| Glare 1 (G1) | |||
| ŌĆā1.5 | 1.06 ┬▒ 0.45 | 1.53 ┬▒ 0.23 | 0.000 |
| ŌĆā3 | 0.43 ┬▒ 0.52 | 1.07 ┬▒ 0.60 | 0.002 |
| ŌĆā6 | 0 | 0.29 ┬▒ 0.54 | 0.039 |
| ŌĆā12 | 0.04 ┬▒ 0.18 | 0.11 ┬▒ 0.35 | 0.285 |
| ŌĆā18 | 0 | 0.04 ┬▒ 0.16 | 0.317 |
| Glare 2 (G2) | |||
| ŌĆā1.5 | 0 | 0.69 ┬▒ 0.71 | 0.003 |
| ŌĆā3 | 0 | 0.53 ┬▒ 0.65 | 0.007 |
| ŌĆā6 | 0 | 0.10 ┬▒ 0.33 | 0.180 |
| ŌĆā12 | 0 | 0.09 ┬▒ 0.28 | 0.180 |
| ŌĆā18 | 0 | 0 | 1.000 |
Table┬Ā3.
Comparison of log contrast sensitivity under photopic condition, between preoperative versus postoperative phototherapeutic keratectomy
| Spatial frequency (cpd) | Pre-PTK | Post-PTK | p-value* |
|---|---|---|---|
| No glare (G0) | |||
| ŌĆā1.5 | 1.04 ┬▒ 0.44 | 1.48 ┬▒ 0.26 | 0.000 |
| ŌĆā3 | 0.67 ┬▒ 0.63 | 1.34 ┬▒ 0.38 | 0.001 |
| ŌĆā6 | 0.39 ┬▒ 0.57 | 0.99 ┬▒ 0.70 | 0.003 |
| ŌĆā12 | 0.04 ┬▒ 0.19 | 0.11 ┬▒ 0.36 | 0.285 |
| ŌĆā18 | 0 | 0.05 ┬▒ 0.17 | 0.157 |
| Glare 1 (G1) | |||
| ŌĆā1.5 | 1.04 ┬▒ 0.45 | 1.50 ┬▒ 0.22 | 0.000 |
| ŌĆā3 | 0.76 ┬▒ 0.54 | 1.36 ┬▒ 0.37 | 0.001 |
| ŌĆā6 | 0.28 ┬▒ 0.52 | 0.68 ┬▒ 0.70 | 0.032 |
| ŌĆā12 | 0 | 0.14 ┬▒ 0.34 | 0.102 |
| ŌĆā18 | 0.04 ┬▒ 0.16 | 0.09 ┬▒ 0.23 | 0.577 |
| Glare 2 (G2) | |||
| ŌĆā1.5 | 0.10 ┬▒ 0.31 | 1.28 ┬▒ 0.53 | 0.000 |
| ŌĆā3 | 0.05 ┬▒ 0.24 | 1.15 ┬▒ 0.57 | 0.000 |
| ŌĆā6 | 0 | 0.67 ┬▒ 0.69 | 0.003 |
| ŌĆā12 | 0 | 0.09 ┬▒ 0.30 | 0.180 |
| ŌĆā18 | 0 | 0.04 ┬▒ 0.19 | 0.317 |
Table┬Ā4.
Comparison of the average of AULCSF under mesopic and photopic condition, at G0, G1, and G2 in pre-operative patients
| G0 (AUCSF) | G1 (AUCSF) | G2 (AUCSF) | p-value* | p-valueŌĆĀ (G0 vs. G1) | p-valueŌĆĀ (G1 vs. G2) | p-valueŌĆĀ (G0 vs. G2) | |
|---|---|---|---|---|---|---|---|
| Mesopic | 0.428 | 0.274 | 0 | 0.000 | 0.056 | 0.000 | 0.000 |
| Photopic | 0.482 | 0.472 | 0.029 | 0.000 | 0.962 | 0.000 | 0.000 |
Table┬Ā5.
Comparisons of the average of AULCSF under mesopic and photopic condition, at G0, G1, and G2 in post-operative patients
| G0 (AUCSF) | G1 (AUCSF) | G2 (AUCSF) | p-value* | p-valueŌĆĀ (G0 vs. G1) | p-valueŌĆĀ (G1 vs. G2) | p-valueŌĆĀ (G0 vs. G2) | |
|---|---|---|---|---|---|---|---|
| Mesopic | 0.684 | 0.654 | 0.307 | 0.001 | 0.778 | 0.001 | 0.002 |
| Photopic | 0.983 | 0.888 | 0.782 | 0.272 |
Table┬Ā6.
Comparison of AULCSF among 12 patients whose visual acuity improvement was not more than 0.218 logMAR
|
AULCSF |
p-value* | ||
|---|---|---|---|
| Pre-PTK, average | Post-PTK, average | ||
| Mesopic | |||
| ŌĆāG0 | 0.428 | 0.652 | 0.047 |
| ŌĆāG1 | 0.336 | 0.650 | 0.047 |
| ŌĆāG2 | 0.000 | 0.316 | 0.028 |
| Photopic | |||
| ŌĆāG0 | 0.592 | 1.008 | 0.017 |
| ŌĆāG1 | 0.588 | 0.940 | 0.037 |
| ŌĆāG2 | 0.052 | 0.863 | 0.008 |
REFERENCES
1) Richman J, Spaeth GL, Wirostko B. Contrast sensitivity basics and a critique of currently available tests. J Cataract Refract Surg 2013;39:1100-6.


3) Ginsburg AP. Contrast sensitivity: determining the visual quality and function of cataract, intraocular lenses and refractive surgery. Curr Opin Ophthalmol 2006;17:19-26.

4) Vasavada VA, Praveen MR, Vasavada AR, et al. Contrast sensitivity assessment in pediatric cataract surgery: comparison of preoperative and early postoperative outcomes. J Cataract Refract Surg 2014;40:1862-7.


6) Faria BM, Duman F, Zheng CX, et al. Evaluating contrast sensitivity in age-related macular degeneration using a novel computer-based test, the spaeth/richman contrast sensitivity test. Retina 2015;35:1465-73.


7) Owsley C, Sloane ME. Contrast sensitivity, acuity, and the perception of 'real-world' targets. Br J Ophthalmol 1987;71:791-6.



8) Augustin VA, Weller JM, Kruse FE, Tourtas T. Influence of corneal guttae and nuclear cataract on contrast sensitivity. Br J Ophthalmol 2021;105:1365-70.


9) Bal T, Coeckelbergh T, Van Looveren J, et al. Influence of cataract morphology on straylight and contrast sensitivity and its relevance to fitness to drive. Ophthalmologica 2011;225:105-11.



10) Keane PA, Patel PJ, Ouyang Y, et al. Effects of retinal morphology on contrast sensitivity and reading ability in neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci 2010;51:5431-7.



11) Hawkins AS, Szlyk JP, Ardickas Z, et al. Comparison of contrast sensitivity, visual acuity, and humphrey visual field testing in patients with glaucoma. J Glaucoma 2003;12:134-8.


12) Lahav K, Levkovitch-Verbin H, Belkin M, et al. Reduced mesopic and photopic foveal contrast sensitivity in glaucoma. Arch Ophthalmol 2011;129:16-22.


13) Koh S, Maeda N, Ikeda C, et al. The effect of ocular surface regularity on contrast sensitivity and straylight in dry eye. Invest Ophthalmol Vis Sci 2017;58:2647-51.


14) Lee JH, Cristol SM, Kim WC, et al. Prevalence of granular corneal dystrophy type 2 (avellino corneal dystrophy) in the Korean population. Ophthalmic Epidemiol 2010;17:160-5.


15) Park JE, Yun SA, Roh EY, et al. Prevalence of granular corneal dystrophy type 2-related TGFBI p.R124H variant in a South Korean population. Mol Vis 2021;27:283-7.


16) Han KE, Kim TI, Chung WS, et al. Clinical findings and treatments of granular corneal dystrophy type 2 (avellino corneal dystrophy): a review of the literature. Eye Contact Lens 2010;36:296-9.


17) Jun I, Jung JW, Choi YJ, et al. Long-term clinical outcomes of phototherapeutic keratectomy in corneas with granular corneal dystrophy type 2 exacerbated after LASIK. J Refract Surg 2018;34:132-9.


18) Kim SW, Hong S, Kim T, et al. Characteristic features of granular deposit formation in granular corneal dystrophy type 2. Cornea 2011;30:848-54.


19) Kim HS, Rim TH, Kim TI, Kim EK. Association between visual acuity and the corneal area occupied by granular lesions, linear lesions, or diffuse haze in patients with granular corneal dystrophy type 2. Cornea 2018;37:542-7.


20) Hong JP, Kim TI, Chung JL, et al. Analysis of deposit depth and morphology in granular corneal dystrophy type 2 using fourier domain optical coherence tomography. Cornea 2011;30:729-38.


21) Nakamura T, Kataoka T, Kojima T, et al. Refractive outcomes after phototherapeutic refractive keratectomy for granular corneal dystrophy. Cornea 2018;37:548-53.


22) Fagerholm P. Phototherapeutic keratectomy: 12 years of experience. Acta Ophthalmol Scand 2003;81:19-32.



23) Jung SH, Han KE, Stulting RD, et al. Phototherapeutic keratectomy in diffuse stromal haze in granular corneal dystrophy type 2. Cornea 2013;32:296-300.


24) Wilson SE, Marino GK, Medeiros CS, Santhiago MR. Phototherapeutic keratectomy: science and art. J Refract Surg 2017;33:203-10.


25) Han KE, Choi SI, Kim TI, et al. Pathogenesis and treatments of TGFBI corneal dystrophies. Prog Retin Eye Res 2016;50:67-88.


26) Das S, Langenbucher A, Seitz B. Excimer laser phototherapeutic keratectomy for granular and lattice corneal dystrophy: a comparative study. J Refract Surg 2005;21:727-31.


27) Rapuano CJ. Phototherapeutic keratectomy: who are the best candidates and how do you treat them? Curr Opin Ophthalmol 2010;21:280-2.


28) Applegate RA, Howland HC, Sharp RP, et al. Corneal aberrations and visual performance after radial keratotomy. J Refract Surg 1998;14:397-407.


29) Dinh R, Rapuano CJ, Cohen EJ, Laibson PR. Recurrence of corneal dystrophy after excimer laser phototherapeutic keratectomy. Ophthalmology 1999;106:1490-7.


30) Inoue T, Watanabe H, Yamamoto S, et al. Recurrence of corneal dystrophy resulting from an R124H Big-h3 mutation after phototherapeutic keratectomy. Cornea 2002;21:570-3.


31) Hohberger B, Laemmer R, Adler W, et al. Measuring contrast sensitivity in normal subjects with OPTEC 6500: influence of age and glare. Graefes Arch Clin Exp Ophthalmol 2007;245:1805-14.



32) Aslam TM, Haider D, Murray IJ. Principles of disability glare measurement: an ophthalmological perspective. Acta Ophthalmol Scand 2007;85:354-60.


33) Abrahamsson M, Sj├Čstrand J. Impairment of contrast sensitivity function (CSF) as a measure of disability glare. Invest Ophthalmol Vis Sci 1986;27:1131-6.

34) Patterson EJ, Bargary G, Barbur JL. Understanding disability glare: light scatter and retinal illuminance as predictors of sensitivity to contrast. J Opt Soc Am A Opt Image Sci Vis 2015;32:576-85.


35) Mainster MA, Turner PL. Glare's causes, consequences, and clinical challenges after a century of ophthalmic study. Am J Ophthalmol 2012;153:587-93.


36) Paulsson LE, Sj├Čstrand J. Contrast sensitivity in the presence of a glare light. theoretical concepts and preliminary clinical studies. Invest Ophthalmol Vis Sci 1980;19:401-6.

37) Cabrerizo J, Livny E, Musa FU, et al. Changes in color vision and contrast sensitivity after descemet membrane endothelial keratoplasty for fuchs endothelial dystrophy. Cornea 2014;33:1010-5.


38) Oie Y, Watanabe S, Nishida K. Evaluation of visual quality in patients with fuchs endothelial corneal dystrophy. Cornea 2016;35 Suppl 1:S55-8.


39) Koh S, Haruna M, Asonuma S, et al. Quantitative evaluation of visual function in patients with cornea verticillata associated with Fabry disease. Acta Ophthalmol 2019;97:e1098-104.



40) Lasa MS, Datiles MB 3rd, Podgor MJ, Magno BV. Contrast and glare sensitivity. association with the type and severity of the cataract. Ophthalmology 1992;99:1045-9.


41) Kalloniatis M, Charles Luu. Visual acuity [Internet]. Salt Lake City (UT): WEBVISIOIN; c2017 [cited 2022 Mar 1]. Available from: https://webvision.med.utah.edu/book/part-viii-psychophysics-of-vision/visual-acuity/.
42) Iyer KK, Bradley AP, Wilson SJ. Conducting shorter VEP tests to estimate visual acuity via assessment of SNR. Doc Ophthalmol 2013;126:21-8.



43) Elliott DB, Bullimore MA. Assessing the reliability, discriminative ability, and validity of disability glare tests. Invest Ophthalmol Vis Sci 1993;34:108-19.

44) Legge GE, Rubin GS, Pelli DG, Schleske MM. Psychophysics of reading--II. Low vision. Vision Res 1985;25:253-65.


45) Marron JA, Bailey IL. Visual factors and orientation-mobility performance. Am J Optom Physiol Opt 1982;59:413-26.


46) Regan D, Neima D. Low-contrast letter charts as a test of visual function. Ophthalmology 1983;90:1192-200.


47) Moon JW, Kim SW, Kim TI, et al. Homozygous granular corneal dystrophy type II (avellino corneal dystrophy): natural history and progression after treatment. Cornea 2007;26:1095-100.

48) Jun I, Ji YW, Choi SI, et al. Compound heterozygous mutations in TGFBI cause a severe phenotype of granular corneal dystrophy type 2. Sci Rep 2021;11:6986.




-
METRICS

- Related articles
-
Phototherapeutic Keratectomy for Granular Corneal Dystrophy.2003 November;44(11)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



