 |
 |
| J Korean Ophthalmol Soc > Volume 63(2); 2022 > Article |
|
국문초록
대상과 방법
결절맥락막혈관병증 환자를 라니비주맙으로 4주 간격 3회 주사 시행 후 24주까지 전향적 다기관 연구를 진행하였다. 4주마다 최대교정시력, 세극등검사, 안저촬영, 빛간섭단층촬영을 시행하였으며, 주사 전, 주사 후 8주째, 재발 시점 또는 20주째에 방수를 채취하여 사이토카인의 변화를 조사하였다. 사이토카인 농도와 시력 변화, 중심황반두께, 중심맥락막두께, 이상혈관 면적, 결절 폐쇄 여부 사이의 상관관계를 분석하였다.
결과
총 25안이 연구에 포함되었다. 평균 나이는 70.3 ± 6.1세였다. 치료 전에 비해 치료 후 8주에는 VEGF가 유의한 감소를 보였으나, 재발 시에는 IFN-γ, TIMP-2, MCP-2만이 유의하게 감소하였다. 치료 전 ENA-78, IL-17, Leptin, TGB-β1 농도가 높을수록 재발까지 시간이 길었으며, 중심황반두께는 FGF-4, IL-10 농도가 높을수록 두꺼웠다. 중심맥락막두께는 bFGF 농도가 낮거나, IFN-γ 농도가 높을수록 두꺼웠다. 결절이 폐쇄된 2안은 치료 전에 비해 MCP-3, Tie-2의 농도가 유의하게 감소하였다.
ABSTRACT
Purpose
To investigate the changes in intraocular cytokines after ranibizumab treatment in patients with polypoidal choroidal vasculopathy (PCV).
Methods
This multicenter, prospective study enrolled patients with PCV treated with three monthly ranibizumab followed by a pro re nata regimen for 24 weeks. Best corrected visual acuity, slit lamp examination, fundus photography, and optical coherence tomography were performed every 4 weeks. Aqueous humor was collected to measure intraocular cytokines at baseline, week 8, and the time of recurrence or week 20. The association of changes in intraocular cytokines with visual acuity, central macular thickness, central choroidal thickness, area of abnormal vessels, and polyp closure was assessed.
Results
This study included 25 eyes. The mean patient age was 70.3 ± 6.1 years. The vascular endothelial growth factor (VEGF) concentration decreased at week 8, but only interferon (IFN)-γ, tissue inhibitors of matrix metalloproteinases (TIMP)-2, and monocyte chemoattractant protein (MCP)-2 decreased at the time of recurrence. The recurrence interval was positively associated with the baseline epithelial-neutrophil activating peptide (ENA)-78, interleukin (IL)-17, leptin, and transforming growth factor-β1, and baseline central macular thickness was positively correlated with the baseline fibroblast growth factor-4 and IL-10. Thick central choroidal thickness was associated with a low basic fibroblast growth factor and high IFN-γ at baseline. The MCP-3 and Tie-2 levels decreased in two eyes with polyp closure.
Conclusions
Ranibizumab significantly reduced intraocular VEGF concentrations and consequently improved PCV. However, the cytokines IFN-γ, TIMP-2, and MCP-2, rather than VEGF, were associated with PCV recurrence. Further studies of intraocular cytokines involved in neovascularization in PCV are needed.
나이관련황반변성에는 황반부 망막색소상피 아래 드루젠 및 지도모양위축을 특징으로 하는 비삼출성이 전체 황반변성 환자의 85%를 차지하며, 맥락막신생혈관(choroidal neovascularization)의 형성을 특징으로 하는 삼출성이 나머지를 차지한다. 이러한 나이관련황반변성은 50세 이상 인구에서 실명의 주요 원인으로 알려져 있는데, 우리나라도 고령화가 진행됨에 따라 나이관련황반변성의 유병 인구가 2014년 964만 명에서 2040년 1,857만 명으로 증가할 것으로 추정하고 있다[1-3]. 삼출성 나이관련황반변성은 신생혈관의 형태에 따라 전형 맥락막신생혈관(classic choroidal neovascularization), 결절맥락막혈관병증(polypoidal choroidal vasculopathy), 망막혈관종증식(retinal angiomatous proliferation) 등으로 나눌 수 있는데, 인종에 따라 유병률의 차이가 있는 것으로 보고되어 있다[4]. 백인에서는 전형 맥락막신생혈관이 가장 흔하며, 삼출성 나이관련황반변성의 대부분을 차지하는 것으로 알려져 있지만, 한국을 포함한 동양에서는 결절맥락막혈관병증이 가장 흔하며, 약 50%의 빈도까지 보고되었다[5-8].
삼출성 나이관련황반변성에서는 신생혈관이 성장하면서 신경망막층의 심한 반흔을 일으켜 비가역적인 시력소실을 일으키게 된다. 따라서 치료 목표는 맥락막신생혈관 퇴축이며, 국소레이저광응고술, 광역학치료 등이 치료에 사용되어 왔으나, 혈관내피성장인자(vascular endothelial growth factor, VEGF)가 맥락막신생혈관의 발생과 증식에 관련된 주요 안구 내 사이토카인으로 알려진 뒤 항혈관내피성장인자(anti-VEGF)를 이용한 치료가 널리 이용되고 있다[9-13].
Anti-VEGF 안구 내 주사 치료는 이전 치료 방법들에 비해 심한 시력저하를 일으키는 빈도를 줄일 수 있으며, 시력 개선도 얻을 수 있는 효과적인 치료로 여러 다기관 연구를 통해 보고되고 있다[13,14]. 하지만 anti-VEGF 안구 내 주사 치료는 짧은 안구 내 약제의 반감기로 인해 반복적인 치료가 필요하며, 치료 간격을 늘리거나 중지하는 경우 많은 경우에서 재발을 경험하게 된다. 이러한 만성적인 질병의 치료 경과는 지속적인 anti-VEGF 치료에도 불구하고 장기간에 걸쳐 비가역적인 시력저하를 유발하게 된다[13].
아직까지 삼출성 나이관련황반변성의 재발 기전에 대해서는 자세히 알려져 있지 않으나, 맥락막신생혈관의 발생에는 VEGF 뿐만 아니라 다양한 안구 내 사이토카인과 관련이 있음이 보고된 바 있으며, 지금의 anti-VEGF 치료만으로 부족한 치료 반응과 반복적인 재발에는 이러한 여러 안구 내 사이토카인들이 관련되어 있을 수 있다[15-20]. 특히 나이관련황반변성 환자에서 증가된 염증 관련 사이토카인은 망막 조직에 백혈구 침윤으로 인한 손상을 일으킬 수 있다고 알려져 있다[21-23]. 하지만, 대부분의 사이토카인 연구들이 서양인에서 흔한 전형 맥락막신생혈관 아형에서 이루어져, 우리나라를 포함한 동양인에서 흔한 결절맥락막혈관병증에 대해서는 이해가 부족한 상황이다. 이에 본 저자들은 결절맥락막혈관병증 환자에서 라니비주맙으로 치료를 받는 기간 동안 질병의 재발을 평가하고, 재발과 관련된 안구 내 사이토카인의 변화를 조사하고자 하였다.
2017년도 3월부터 2018년도 6월까지 16개월간 부산대학교병원과 양산부산대학교병원에서 삼출성 나이관련황반변성 환자 중 인도사이아닌그린혈관조영술(indocyanine green angiography)을 통해 결절맥락막혈관병증으로 진단된 환자를 대상으로 전향적 연구를 진행하였다. 본 연구는 헬싱키 선언(Declaration of Helsinki)을 준수하여 부산대학교병원 임상연구윤리심의위원회(Institutional Review Board, IRB)의 승인을 받았다(승인 번호: 1608-002-055). 모든 환자에게 연구 시행 전 연구 목적 및 과정에 대해 설명 후 동의서를 받았다.
대상 기준으로는 빛간섭단층촬영(optical coherence tomography)에서 중심와를 침범하는 삼출성 변화가 있으면서 인도사이아닌그린혈관조영술에서 황반하 맥락막에 분지하는 혈관망이나 포도송이모양 혈관확장을 보여 결절맥락막혈관병증으로 진단된 환자이며, 0.06 (Early Treatment Diabetic Retinopathy Study [ETDRS] 25 letters) 이상 0.5 (ETDRS 70 letters) 이하의 시력을 보이는 경우로 하였다. 제외 기준으로는 병변이 중심와에서 2유두직경 이상 떨어진 경우, 망막하출혈이나 다른 망막의 병변이 맥락막신생 혈관 병변의 50%를 넘는 경우, 이전 안구 내 주사 및 광역 학요법 치료 병력이 있는 경우, 90일 이전에 시행 받은 백내장수술을 제외한 안구 내 수술을 받은 병력이 있는 경우, 반대안에 주사 치료를 필요로 하는 삼출성 나이관련황반변성이 있는 경우, 시력에 영향을 주는 안과적 질환이 있는 경우(녹내장, 시축을 침범한 백내장 등), 조절되지 않는 전신질환이 있는 경우(당뇨, 고혈압, 심혈관질환, 뇌혈관질환등), 안구 내 또는 안와 주위 활동성 염증 및 감염의 증가가 보이는 경우, 약제 과민 반응을 보이는 경우로 하였다.
대상 환자들은 매 방문 시기마다 최대교정시력검사, 세극등현미경검사, 안저촬영검사, 6×6 mm 영역의 빛간섭단층촬영검사를 시행하였으며, 형광안저혈관조영술과 인도사이아닌그린혈관조영술은 치료 전과 치료 후 8주 및 재발시, 그리고 치료 후 20주째에 시행하였다(Fig. 1). 연구 대상으로 포함된 결절맥락막혈관병증 환자들은 라니비주맙 0.5 mg/0.05 mL 유리체내에 주사하여 치료하였다. 처음에는 4주 간격으로 3회 주사하였으며, 3회 주사 치료 이후 4주마다 24주까지 치료 반응 평가를 하여 재발이 확인되는 경우에는 유리체내 라니비주맙 주사를 시행하였으며, 재발 하지 않은 환자의 경우에서는 20주에 유지요법으로 유리체내 라니비주맙 주사를 시행하였다.
재발은 다음과 같은 기준으로 판단하였다. 12주 방문 평가에서 황반부종과 망막하액이 완전 소실된 경우에는 16주 혹은 20주 방문 평가에서 황반부종이나 망막하액이 다시 발생한 경우 또는 12주 방문 평가에서 황반부종과 망막하 액이 10% 미만으로 남은 경우에는 16주 혹은 20주 방문 평가에서 12주 방문 평가에 비해 10% 이상 증가한 경우를 재발로 판단하였다. 한편, 외래 방문마다 시행한 빛간섭단층 촬영검사에서 환자의 중심황반두께가 10% 이상 증가하거나, 시력이 15글자 이상 감소하는 경우는 약제에 반응이 없는 경우로 판단하여 추가적인 광역학치료나 다른 약제로의 변경을 위해 연구에서 탈락하는 것으로 하였다.
주사는 모든 환자의 동의(informed consent) 하에 시행하였으며, 대상안을 4% 리토카인으로 점안마취하였고, 5% povidone-iodine (betadine, Avrio Helath, Stamford, CT, USA) 용액으로 안검 및 결막을 소독한 후, 소독된 개검기를 삽입하였다. 각막과 결막낭 또한 5% povidone-iodine (betadine, Avrio Helath)을 점안하여 소독한 후, 라니비주맙 안내주입술 직전에 안압을 낮추기 위해 30 gauge 주사바늘이 부착된 1 mL 주사기로 주사바늘이 상이측 각막윤부로 홍채와 평행하게 진입하도록 하여 0.05 mL 방수를 제거하 였다. 0.5 mg/0.05 mL 라니비주맙을 각막윤부에서 3.5 mm 떨어진 하이측 섬모체평면부에서 30 gauge 주사바늘을 이용하여 주입하였다. 주사 직후 주사 부위를 면봉으로 압박하여 약물 및 유리체 누출을 막고 지혈하였다. 또한, 환자가 손가락 개수를 셀 수 있는지 확인하거나, 안저검사를 통해 망막동맥폐쇄가 일어나지 않았음을 확인하였다.
방수 내 사이토카인 변화를 분석하기 위해 주사 전과 주사 후 8주째, 그리고 재발 시 혹은 20주째에 유리체내주사 전방천자를 시행하여 방수 0.05 mL를 채취 후 즉시 영하 20°C 이하 저온 냉동고에 보관하였다. 보관한 방수는 Human Angiogenesis Array Q1000 (RayBiotech, Peachtree Corners, GA, USA)을 사용하여 채취된 지 2개월 이내에 분석하였다. 분석방법은 제조회사의 검사 지침에 따라 시행하였으며, 혈관신생과 관련된 60종의 사이토카인들을 정량 분석하였다. 60종의 사이토카인은 다음과 같다: Activin A, Agouti-related protein (AgRP), Angiopoietin-1, Angiopoietin-2, Angiogenin, Angiostatin, Angiopoietin-like protein (ANGPTL) 4, Basic fibroblast growth factor (bFGF), C-X-C Motif Chemokine Ligand 16 (CXCL16), Epidermal Growth Factor (EGF), Epithelial-neutrophil activating peptide (ENA)-78, FGF-4, Follistatin, Granulocyte colony stimulating factor (G-CSF), Granulocyte-macrophage colony-stimulating factor (GM-CSF), growth-regulatory properties (GRO) α/β/γ, hemoglobin (HB), Epidermal Growth Factor (EGF), Hepatocyte Growth Factor (HGF), CCL1 (Chemokine (C-C motif) ligand 1), Interferon (IFN)-γ, Insulin like growth factor (IGF)-1, Interleukin (IL)-10, IL-12 p40, IL-12 p70, IL-17, IL-1 α (IL-1 F1), IL-1 β (IL-1 F2), IL-2, IL-4, IL-6, IL-8 (CXCL8), Induced protein (IP) -10 (CXCL10), Interferon-inducible T-cell alpha chemoattractant (I-TAC) (CXCL11), Leptin, Leukemia inhibitory factor (LIF), Monocyte chemoattractant protein (MCP)-1 (CCL2), MCP-2 (CCL8), MCP-3 (CL7), MCP-4 (CCL13), Matrix metalloproteinase (MMP)-1, MMP-9, Platelet Derived Growth Factor (PDGF)-BB, Platelet endothelial cell adhesion molecule (PECAM)-1 (CD31), Placental growth factor (PLGF), RANTES (Regulated upon activation, normal T cell expressed and presumably secreted), Transforming growth factor (TGF)-α, TGF-β1, TGF β3, Tie-1, Tie-2, Tissue inhibitors of matrix metalloproteinases (TIMP)-1, TIMP-2, Tumor necrosis factor (TNF) α, TNF β, Thrombopoietin (TPO), Urokinase-type plasminogen activator receptor (uPAR), Vascular endothelial growth factor (VEGF)-A, VEGFR2, VEGFR3, VEGF-D. 방수를 채취하는 대상들은 방수 채취 전 형광안저혈관조영과 인도사이아닌그린혈관조영술을 추가적으로 시행하였다.
채취한 방수를 통해 첫 주사 후 8주째와 재발 시기에 VEGF를 포함한 안구 내 사이토카인의 농도 변화를 알아보고자 하였다. 추가적으로 주사 전과 주사 후 8주째 농도 차이를 보이는 사이토카인들과 재발까지의 기간, 시력변화, 중심황반두께, 중심맥락막두께, 이상혈관의 면적, 결절의 폐쇄 유무 등과 관련이 있는 사이토카인도 조사하였다. 주사 후 8주째와 20주째 시행한 인도사이아닌그린혈관조영술에서 결절의 폐쇄 유무를 확인하였다.
통계 분석을 위해서 SPSS 18.0 버전(IBM Corp., Armonk, NY, USA)을 사용하였으며, 주사 후 8주째와 재발 시기의 사이토카인 비교와 주사 전과 주사 후 8주째의 사이토카인 비교에는 Wilcoxon singed-rank test를 사용하였다. 주사 전사이토카인 농도와 재발하기까지 걸린 시간, 시력 변화의 상관관계를 spearman rank correlation을 사용하여 분석하였다. 주사 전 사이토카인 농도와 중심황반두께, 중심맥락막두께, 맥락막신행혈관 면적과의 연관성 분석에도 spearman rank correlation을 사용하였다. 주사 후 8주째, 20주째 결절 폐쇄에 따른 사이토카인 비교에는 Mann-Whitney U test를 사용하였다. p-value가 0.05 미만인 경우를 통계학적으로 유의한 것으로 정의하였다.
연구 기간 중 총 28안이 인도사이아닌그린혈관조영을 통해 결절맥락막혈관병증으로 진단되었으며, 3안은 스크리닝 이후 주사 시행 전 연구 참여 의사를 철회하여 최종적으로 25안이 연구에 포함되었다. 연구에 포함된 25안은 모두 4주마다 방문하여 24주까지 경과 관찰을 완료하였다. 환자들의 평균 나이는 70.1 ± 6.0세(59-78세), 평균 시력은 58.7 ± 9.5 letters (37-71 letters)였다. 초진 검사 시 이상혈관의 면적은 5.0 ± 3.7 mm², 평균 중심황반두께는 307.8 ± 147.5 μm, 평균 중심맥락막두께는 256.2 ± 65.0 μm였다. 연구 기간 동안 평균 주사 횟수는 4.2 ± 0.7회였다(Table 1). 인도사이 아닌그린혈관조영검사에서 결절 폐쇄가 확인된 경우는 주사 후 8주째 2안(8.0%)이었으며, 20주째에도 동일한 2안 (8.0%)에서만 결절이 폐쇄되었다. 최종 24주째 평균 시력은 61.6 ± 15.7 letters로 주사 전에 비해 차이는 없었으며, 중심황반두께는 237.8 ± 76.3 μm로 주사 전에 비해 의미 있는 개선을 보였으나(p=0.021), 중심맥락막두께는 유의한 변화가 없었다. 연구 기간 동안 이상반응(adverse effects)이 나타난 경우는 없었다.
VEGF는 치료 시작 전 10 pg/mL에서 라니비주맙 치료 8주(2회 주사 후 4주 시점) 후 2.1 pg/mL로 유의미한 감소를 보였으나(p=0.001), 다른 사이토카인들은 의미 있는 변화가 없었다. 24주까지의 연구 기간 중 18안(72.0%)에서 재발 소견을 보였다. 재발했을 때 채취한 방수에서는 치료 8주 때와 비교했을 때 IFN-γ는 103 pg/mL에서 38.2 pg/mL (p=0.019)로, TIMP-2는 2,048.9 pg/mL에서 1,759.6 pg/mL (p<0.001)로, MCP-2는 1.5 pg/mL에서 0.6 pg/mL (p=0.014)로 농도가 유의하게 감소하였고, VEGF는 차이가 없었다 (Table 2).
치료 전 ENA-78 (p=0.034, r=0.444), IL-17 (p=0.018, r=0.487), leptin (p=0.004, r=0.572), TGF-β1 (p=0.006, r=0.557)의 농도가 높을수록 재발까지의 시간이 길었다. 치료 후 8주 때의 사이토카인 농도는 재발 시기와 관련이 없었다. 치료 전 중심황반두께와 관련이 있는 사이토카인에는 FGF-4와 IL-10이 있었는데, 두 사이토카인 모두 농도가 낮을수록 치료 전 중심황반두께가 두꺼웠다(p=0.014, r=-0.496 for FGF-4; p=0.021, r=-0.496 for IL-10). 한편, 치료 전 중심맥락막두께는 bFGF의 농도가 낮거나(p=0.049, r=-0.406), IFN-γ의 농도가 높을수록 두꺼웠다(p=0.040, r=0.422). 치료 후 8주째에 결절 폐쇄가 확인된 2안에서 MCP-3 (p=0.047), Tie-2 (p=0.047)의 농도는 치료 전과 비교하여 유의하게 낮았다(Table 3). 시력 변화나 이상혈관의 면적과 유의한 상관관계를 가지는 사이토카인은 없었다. Fig. 2는 재발 시기에 사이토카인 변화를 보인 대표 증례를 나타내었다.
본 연구에서는 라니비주맙 주사치료를 받은 결절맥락망 막병증 환자에서 재발과 관련된 다양한 안구 내 사이토카인들의 변화를 확인할 수 있었다. 라니비주맙 주사치료 후에는 치료 전과 비교하여 VEGF가 유의하게 감소되었으나, 재발 시점에는 의미 있는 변화는 없었다. 오히려 재발 시점에는 IFN-γ, TIMP-2, MCP-2가 유의한 감소를 보였다. 한편, 치료 전 ENA-78, IL-17, Leptin, TGB-β1의 농도가 높은 경우 재발까지의 시간이 길었다. 시력변화나 이상혈관의 면적과 연관된 안구 내 사이토카인은 없었다.
여러 나이관련황반변성 연구에서 VEGF 외에도 다양한 혈관 생성 자극 경로(angiogenic signaling cascade)가 질병의 발생과 진행에 관여하는 것으로 보고되었다. MCP-1, IL-6, IL-8, TNF-a, sICAM-1, sVCAM-1, IGF-1, IGFBP-2 와 같은 다양한 안구 내 사이토카인들이 나이관련황반변성 환자에서 증가되어 있으며, 질병의 활성과 관련이 있을 것으로 알려져 있다[15-18]. 이러한 사이토카인들은 대식세포, 백혈구 뿐만 아니라 내피세포, 망막색소상피세포에서도 생성 및 분비되는데, anti-VEGF 주사 치료에도 낮은 치료 반응과 재발을 보이는 경우 위와 같이 다양한 사이토카인들이 관련 있을 것으로 생각되었다[19]. Funk et al [24]의 연구에서도 PDGF-AA가 라니비주맙 치료를 받은 황반변성 환자에서 VEGF와 연관되어 작용함이 확인되었다. 본 연구에서도, 비록 지금까지 알려진 사이토카인들과 종류는 달랐지만, 이전 연구들에서와 같이 VEGF 외 여러 사이토카인들이 결절맥락막혈관병증의 재발과 관련이 있음을 확인할 수 있었다.
삼출성 나이관련황반변성에서 치료 전 높았던 방수 내 VEGF 농도는 유리체내 라니비주맙주입술 후 현저하게 감소하는 것으로 알려져 있는데, 본 연구를 통해 결절맥락막혈관병증 환자에서도 연속적인 라니비주맙 주사 후 VEGF 농도가 유의하게 감소하였음을 확인하였다[24]. 하지만, 재발 시에는 라니비주맙 주사 후 8주째와 비교하여 의미 있는 VEGF의 농도 변화는 없었다. 재발한 경우에서 추가적인 라니비주밥 치료 후 사이토카인의 변화 및 경과는 본 연구 범위에 포함되어 있지 않아 장기적인 질병의 재발에 있어 VEGF 변화와 관련성에 대해서는 향후 추가적인 연구가 필요할 것으로 생각된다.
한편, 치료 후 8주째와 비교하여 재발 시에는 TIMP-2, IFN-γ, MCP-2가 유의하게 감소하였다. 세포외기질에서 염증 반응으로 인해 생성된 면역복합체의 제거에 관여하는 TIMPs는 삼출성 및 비삼출성 나이관련황반변성 환자의 방수에서 모두 감소되어 있는 것으로 보고되었는데, 재발 시에는 감소된 TIMPs로 인해 염증물질이 축적되어 질병의 재발에 영향을 주었을 것으로 생각된다[25]. IFN-γ도 TIMP-2 와 마찬가지로 염증 반응에 관여하는 사이토카인으로 대식 세포 활성화에 가장 핵심적인 역할을 하며, VEGF의 분비를 증가시켜 맥락막신생혈관의 병인에 중요한 역할을 하는 것으로 알려져 있다[26,27]. Spindler et al [28]은 anti-VEGF로 치료 중인 삼출성 나이관련황반변성 환자에서 IFN-γ 유래 대식세포 농도가 상승되어 있고, IFN-γ 농도는 주사 치료 전후 동일하게 유지되었다고 하였다. Ambati et al [29]은 동물실험을 통해 대식세포 주화 인자인 MCP-1의 감소로 인해 망막색소상피에서 면역복합체가 제거되지 못하고 축적되어, 망막색소상피의 기능 이상과 연관됨을 증명한 바 있는데, 본 연구에서 재발 시점에 감소된 MCP-2는 MCP-1과 유사한 작용을 하는 것으로 알려져 있다[30,31]. 이와 같이 결절맥락막혈관병증 환자에서 TIMP-2, IFN-γ, MCP-2의 감소는 병적인 면역복합체 축적을 유도하여 질병 재발에 영향을 줄 수 있는 것으로 판단된다. 하지만, 본 연구 결과와 달리 IFN-γ, MCP 증가가 황반변성 발생과 진행에 관련이 있다는 연구들도 있는데, 이러한 차이는 대상 환자군이나 질환의 아형이 다르고, 치료 및 방수 채취 시점이 다른 것에서 기인했을 수 있다[16,26,30]. 또한, 본 연구는 정상 대조군과 비교한 연구가 아닌 결절맥락막혈관병증 환자에서 치료 전후의 사이토카인 변화를 조사하였기 때문에 다른 연구들과 차이가 있을 수 있다. 이러한 점을 고려할 때, 사이토카인 변화에 대해서는 추가적인 연구와 해석이 필요할 것으로 생각된다.
본 연구에서 치료 전 ENA-78, IL-17, leptin, TGF-β1의농도가 높을수록 재발까지의 시간이 길었다. 이전 연구에서는 황반변성 환자의 방수에서 ENA-78, IL-17이 정상인에 비해 증가되어 있는 것이 확인되어 이들 사이토카인이 황반변성의 발생과 관련이 있는 것으로 보고되었다[28,32-34]. 이들은 IL-6, IL-8, MCP의 생성을 유도하여 황반변성의 발생과 진행에 관여하는 것으로 보고된 바 있으나, 본 연구에서는 ENA-78, IL-17이 높을수록 오히려 질환의 재발 시기가 늦은 결과를 보였다[30,33]. 앞서 언급한 것처럼, MCP는 망막색소상피에서 면역복합체의 제거에 관여하는 것으로 알려져 있기 때문에 상승된 ENA-78, IL-17이 MCP의 생성을 촉진하여 면역복합체 해소에 관여하고, 재발 시점을 늦춘 것으로 생각된다. Leptin은 지방세포에서 분비되는 아미노산 단백질로서 노화와 관련이 있는 베타 아밀로이드 침착 및 세포 내 지질 농도를 감소시키는 역할을 한다. 황반변성 환자에서는 leptin 농도가 감소되어 아밀로이드 침착이 일어나고, 드루젠의 발생과 망막색소상피의 손상 등 질병의 초기 병인에 기여하는 것으로 알려져 있다[35]. 따라서, 본 연구에서 치료 전 높은 leptin 농도를 보이는 환자들은 아밀로이드의 침착이 상대적으로 적을 가능성이 있으며, 이러한 경우 anti-VEGF 치료에 반응이 좋고 재발까지의 기간도 긴 것으로 생각된다. TGF-β1은 항염증작용에 관여하는 사이토카인으로 망막색소상피세포에서 항산화작용을 통해 산화스트레스로부터 세포를 보호하는 작용을 하기 때문에, 높은 TGF-β1을 보이는 경우 상대적으로 재발 시기도 늦어질 수 있을 것으로 생각된다[36,37].
치료 전 중심황반두께는 염증전구 사이토카인인 FGF-4 가 높을수록, 항염증 사이토카인인 IL-10이 낮을수록 두꺼웠다. FGF-4는 허혈성 망막에서 증가하고, 신생혈관의 발생에 관여하는데, 망막허혈로 인해 증가된 FGF-4가 맥락막 신생혈관 발생에 관여하여 황반두께 증가와 연관된 것으로 판단된다[38-40]. IL-10은 망막색소상피세포에서 분비되는 항염증 사이토카인으로 나이관련황반변성 환자에서 만성 염증으로 인한 황반부 위축이 있을 때 증가하는 것으로 알려져 있는데, 본 연구에서도 중심황반두께가 두꺼울수록 그 농도는 낮았다[34,41]. 치료 전 중심맥락막두께는 bFGF 농도가 낮을수록, IFN-γ 농도가 높을수록 두꺼웠다. bFGF는 허혈이나 염증이 있을 때 뮬러세포에서 분비되고, 신생혈관의 발생에 관여하는 것으로 알려져 있으며, IFN-γ도 역시 맥락 막신생혈관의 발생과 관련이 있는 사이토카인이다[26,42,43]. 각각의 사이토카인과 맥락막두께 사이에 상반된 결과가 나타난 것은 본 연구에서 맥락막두께를 중심와 아래에서만 측정하여 전체적인 맥락막의 상태를 모두 설명할 수 없었기 때문으로 생각되며, 향후 사이토카인과 관련된 맥락막 두께의 변화에 대해서는 추가적인 연구가 필요하다.
결절이 폐쇄된 2안은 폐쇄되지 않은 23안에 비해 치료전 MCP-3, Tie-2의 농도가 높았다. 망막색소상피에서 분비되는 MCP-3는 chemokine receptor-3 수용체에 작용하여 맥락막신생혈관의 형성에 관여하며, Tie-2는 망막혈관에 작용하여 혈액학적 안정화를 통해 혈관 투과성을 감소시키고, 염증을 완화시킨다[27,44,45]. 본 연구에서는 결절이 폐쇄된 경우가 2안으로 적어 결절 폐쇄 여부와 사이토카인과의 연관성에 대해서는 결론을 내릴 수 없었다. 짧은 연구 기간과 적은 주사 치료 횟수로 인해 결절 폐쇄가 상대적으로 적었다고 판단되며, 향후 장기간의 추적 관찰 연구가 필요할 것으로 생각된다.
본 연구는 대조군이 없고, 환자수가 비교적 적다는 한계점이 있다. 또한, 방수 채취가 라니비주맙 세 번째 주사 시행 직전에 이루어져, 치료 후 사이토카인 변화를 보기에 치료 횟수와 기간이 부족했을 수 있다. 하지만 이는 침습적인 시술을 최소화하기 위해 계획된 연구 방법으로, 결과적으로는 2회 주사 후 VEGF의 상당한 감소를 확인할 수 있었으므로 치료 후 방수 채취까지의 시기가 사이토카인 변화를 보기에 부족하지는 않았다고 생각된다. 또한 재발 시에는 라니비주맙 주사 직전 방수를 채취하여, 재발과 관련한 사이토카인 분석에서 충분한 정보를 얻을 수 있었다. 그러나 짧은 연구 기간 및 적은 주사 횟수로 인해 인도사이아닌그린혈관조영술에서 결절의 크기, 개수 등 결절맥락막혈관병증의 해부학적인 변화에 대한 영상학적 분석과 그와 관련된 사이토카인에 대한 정밀 분석은 어려웠다. 또한 치료제로서 다른 종류의 anti-VEGF를 사용한 경우 본 연구와 다른 결과가 나타날 가능성도 배제할 수 없다. 그럼에도 불구하고 본 연구는 전향적으로 시행된 다기관 연구로써 라니비주맙으로 치료한 결절맥락막병증에서 재발과 관련된 사이토카인과 그 변화를 확인할 수 있었던 국내 첫 연구라는 점에서는 의의가 있다.
결론적으로 결절맥락막혈관병증 환자에서 유리체내 라니비주맙 주사는 유의하게 방수 내 VEGF 농도를 감소시켰다. 재발 시에는 VEGF 변화보다는 IFN-γ, TIMP-2, MCP-2 등 혈관신생과 염증에 관여하는 여러 사이토카인 변화가 관찰되었다. 이는 향후 결절맥락막혈관병증 치료에 있어 장기적으로 재발을 최소화하고, 심한 시력저하를 막기 위해 다양한 안구 내 사이토카인을 억제할 수 있는 새로운 치료법에 대한 연구가 필요하다는 것을 제시한다.
Acknowledgments
This study was supported by Novartis research fund. I.S.Byon: Alcon (H), AIinsight (C,H), Bayer (C,H), Novartis (C,F,H), Samil (H); J.E.Lee: Bayer (C,H), Norvartis (C,F,H). The following authors have no financial disclosures: Y.A Choi, S.H.Kim, S.K.Choi, J.J.Lee, S.M.Lee, H.J.Kwon, S.H.Park. C: consultant, F: fund, H: honoraria.
Figure 1.
Schematic schedule of the study. ‘X’ means mandatory examination ‘(X)’ means examination when necessary. AH = aqueous humor acquired; BCVA = best corrected visual acuity; SS-OCT = swept source optical coherence tomography; FA = fluorescein angiography; ICGA = indocyanine green angiography.
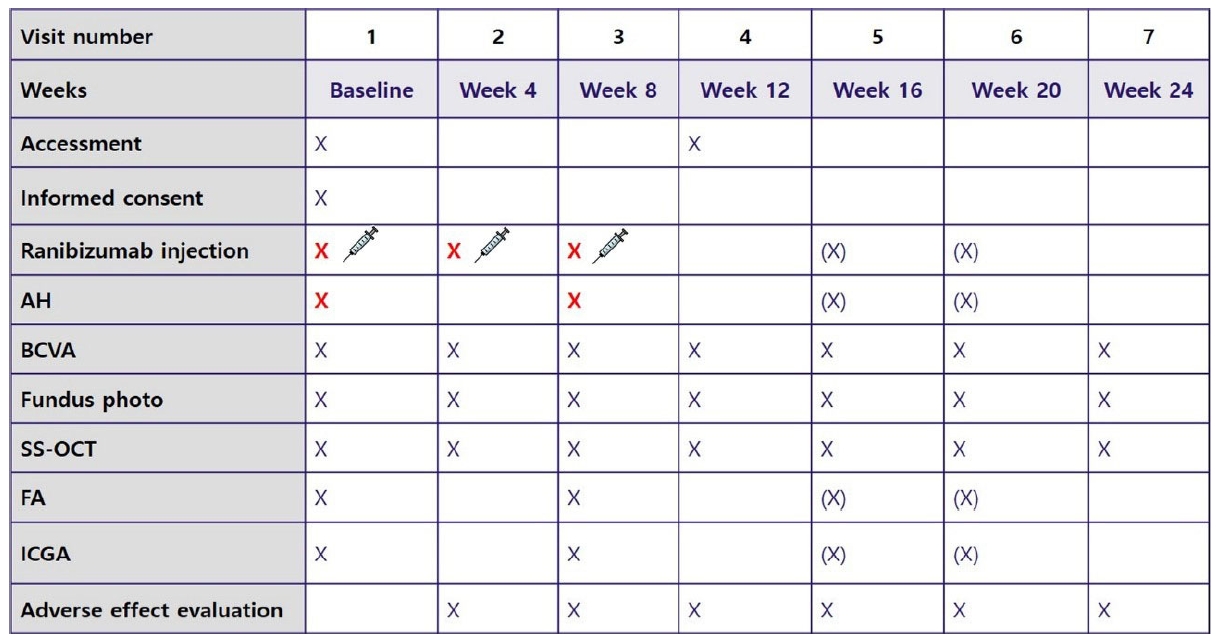
Figure 2.
A 66-year-old man with polypoidal choroidal vasculopathy. (A) Fundus photo shows orange-red polypoidal lesions. (B) Indocyanine green angiography shows a branching vascular network with small, multiple polyps (yellow arrows). (C) Optical coherence tomography shows fibrovascular pigment epithelial detachment and subretinal fluid at baseline. (D) At week 8, subretinal fluid disappeared. The aqueous concentration of interferon (IFN)-γ was 109.5 pg/mL, tissue inhibitors of matrix metalloproteinases (TIMP)-2 was 2,500.1 pg/mL and monocyte chemoattractant protein (MCP)-2 was 10.2 pg/mL. (E) At week 12, a recurrence of subretinal fluid was detected. The aqueous concentration of IFN-γ decreased to 10.0 pg/mL, TIMP-2 to 2,083.1 pg/mL and MCP-2 to 4.4 pg/mL.
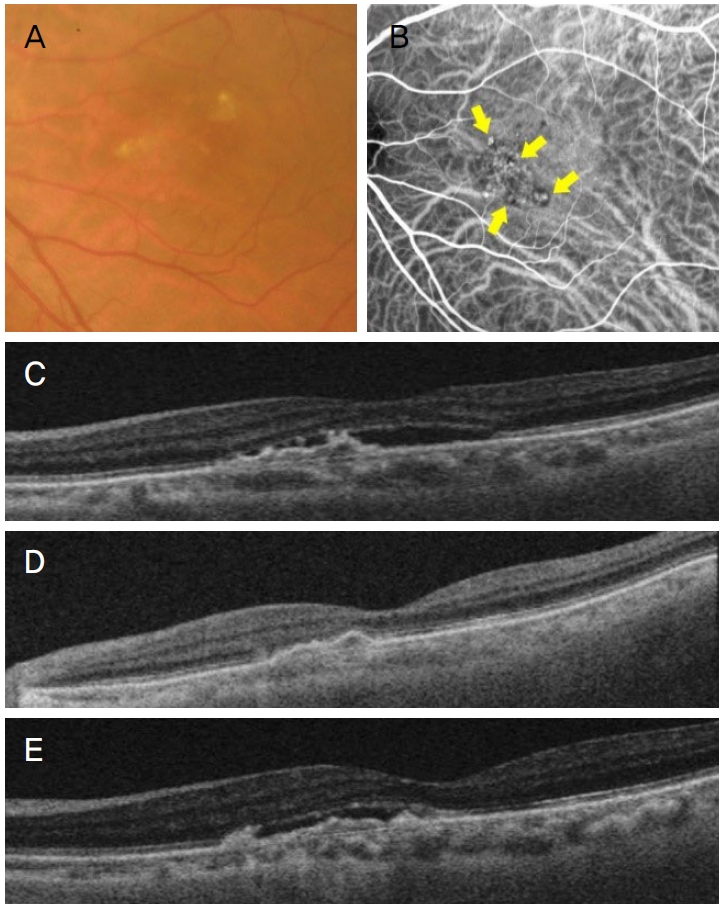
Table 1.
Baseline characteristics
Table 2.
Cytokine Levels at week 8 and at the time of recurrence in patients with polypoidal choroidal vasculopathy treated with ranibizumab
| Baseline | Week 8 | Time of recurrence | p-value* | |
|---|---|---|---|---|
| IFN-γ (pg/mL) | 97.2 ± 187.8 | 103 ± 136.7 | 38.2 ± 61.3 | 0.0019 |
| TIMP-2 (pg/mL) | 1,980.7 ± 1,558.6 | 2,048.9 ± 1,050.9 | 1,759.6 ± 706.2 | <0.001 |
| MCP-2 (pg/mL) | 2.2 ± 4.2 | 1.5 ± 2.6 | 0.6 ± 1.2 | 0.014 |
| VEGF (pg/mL) | 10.0 ± 12.4 | 2.1 ± 6.9 | 1.5 ± 4.6 | 0.374 |
| ENA-78 (pg/mL) | 11.9 ± 27.1 | 10.8 ± 27.7 | 6.0 ± 16.7 | 0.753 |
| IL-17 (pg/mL) | 31.0 ± 54.6 | 23.2 ± 50.9 | 12.7 ± 26.4 | 0.575 |
| Leptin (pg/mL) | 1.0 ± 2.6 | 0.7 ± 2.6 | 0.1 ± 0.2 | 0.500 |
| TGF-β1 (pg/mL) | 3,978.8 ± 5,379.9 | 2,094.3 ± 3,226.3 | 1,690.1 ± 2,341.7 | 0.515 |
| FGF-4 (pg/mL) | 173.5 ± 300.5 | 191.1 ± 310.3 | 142.8 ± 265.7 | 0.374 |
| IL-10 (pg/mL) | 2.9 ± 2.7 | 3.8 ± 3.2 | 3.2 ± 2.9 | 0.227 |
| bFGF (pg/mL) | 0.3 ± 1.4 | 0.2 ± 0.6 | 0.0 ± 0.1 | 0.273 |
Values are presented as mean ± standard deviation.
IFN = interferon; TIMP = tissue inhibitors of matrix metalloproteinases; MCP = monocyte chemoattractant protein; VEGF = vascular endothelial growth factor; ENA = epithelial-neutrophil activating peptide; IL = interleukin; TGF = transforming growth factor; FGF = fibroblast growth factor; bFGF = basic fibroblast growth factor.
Table 3.
Correlation between intraocular cytokines and clinical features including the time of recurrence, central macular thickness, central choroidal thickness, and closure of polys
| Cytokines | Correlation coefficient (r) | p-value* |
|---|---|---|
| ENA-78† | 0.444 | 0.034 |
| IL-17† | 0.487 | 0.018 |
| Leptin† | 0.572 | 0.004 |
| TGF-β1† | 0.557 | 0.006 |
| FGF-4‡ | -0.496 | 0.014 |
| IL-10‡ | -0.496 | 0.021 |
| bFGF§ | -0.406 | 0.049 |
| IFN-γ§ | 0.422 | 0.040 |
| MCP-3∏ | - | 0.047 |
| Tie-2∏ | - | 0.047 |
REFERENCES
1) Taylor HR. Eye care for the future: the Weisenfeld lecture. Invest Ophthalmol Vis Sci 2003;44:1413-8.


2) Vingerling JR, Dielemans I, Hofman A, et al. The prevalence of age-related maculopathy in the Rotterdam Study. Ophthalmology 1995;102:205-10.


3) Ryu S, Kim DW, Rim TH, et al. Prevalence of exudative age-related macular degeneration and projections of the cost of ranibizumab in Korea. J Korean Ophthalmol Soc 2019;60:253-60.

4) Majithia S, Tham YC, Chee ML, et al. Cohort profile: the Singapore epidemiology of eye diseases study (SEED). Int J Epidemiol 2021;50:41-52.


5) Lafaut BA, Leys AM, Snyers B, et al. Polypoidal choroidal vasculopathy in Caucasians. Graefes Arch Clin Exp Ophthalmol 2000;238:752-9.


6) Maruko I, Iida T, Saito M, et al. Clinical characteristics of exudative age-related macular degeneration in Japanese patients. Am J Ophthalmol 2007;144:15-22.


7) Sho K, Takahashi K, Yamada H, et al. Polypoidal choroidal vasculopathy: incidence, demographic features, and clinical characteristics. Arch Ophthalmol 2003;121:1392-6.


8) Klein R, Klein BEK, Linton KLP. Prevalence of age-related maculopathy. The Beaver Dam Eye Study. Ophthalmology 1992;99:933-43.


9) Bressler NM; Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: two-year results of 2 randomized clinical trials-tap report 2. Arch Ophthalmol 2001;119:198-207.

10) Lam DS, Chan WM, Liu DT, et al. Photodynamic therapy with verteporfin for subfoveal choroidal neovascularisation of pathologic myopia in Chinese eyes: a prospective series of 1 and 2 year follow up. Br J Ophthalmol 2004;88:1315-9.



11) Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev 2004;25:581-611.


12) Ferrara N, Henzel WJ. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun 1989;161:851-8.


13) Rofagha S, Bhisitkul RB, Boyer DS, et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: a multicenter cohort study (SEVEN-UP). Ophthalmology 2013;120:2292-9.


14) Writing Committee for the UK Age-Related Macular Degeneration EMR Users Group. The neovascular age-related macular degeneration database: multicenter study of 92 976 ranibizumab injections: report 1: visual acuity. Ophthalmology 2014;121:1092-101.


15) Kramer M, Hasanreisoglu M, Feldman A, et al. Monocyte chemoattractant protein-1 in the aqueous humour of patients with age-related macular degeneration. Clin Exp Ophthalmol 2012;40:617-25.


16) Jonas JB, Tao Y, Neumaier M, Findeisen P. Cytokine concentration in aqueous humour of eyes with exudative age-related macular degeneration. Acta Ophthalmol 2012;90:e381-8.


17) Miao H, Tao Y, Li XX. Inflammatory cytokines in aqueous humor of patients with choroidal neovascularization. Mol Vis 2012;18:574-80.


18) Cha DM, Woo SJ, Kim HJ, et al. Comparative analysis of aqueous humor cytokine levels between patients with exudative age-related macular degeneration and normal controls. Invest Ophthalmol Vis Sci 2013;54:7038-44.


19) Varinthra P, Huang SP, Chompoopong S, et al. 4-(Phenylsulfanyl) Butan-2-One attenuates the inflammatory response induced by amyloid-β oligomers in retinal pigment epithelium cells. Mar Drugs 2020;19:1.



20) Yang S, Zhao J, Sun X. Resistance to anti-VEGF therapy in neovascular age-related macular degeneration: a comprehensive review. Drug Des Devel Ther 2016;10:1857-67.


21) Liu RT, Gao J, Cao S, et al. Inflammatory mediators induced by amyloid-beta in the retina and RPE in vivo: implications for inflammasome activation in age-related macular degeneration. Invest Ophthalmol Vis Sci 2013;54:2225-37.


22) Song YJ, Jung JH, Kim DG. Analysis of aqueous humor cytokines in diabetic retinopathy. J Korean Ophthalmol Soc 2014;55:1821-7.

23) Noma H, Funatsu H, Yamasaki M, et al. Aqueous humour levels of cytokines are correlated to vitreous levels and severity of macular oedema in branch retinal vein occlusion. Eye (Lond) 2008;22:42-8.


24) Funk M, Karl D, Georgopoulos M, et al. Neovascular age-related macular degeneration: intraocular cytokines and growth factors and the influence of therapy with ranibizumab. Ophthalmology 2009;116:2393-9.


25) Nita M, Strzałka-Mrozik B, Grzybowski A, et al. Age-related macular degeneration and changes in the extracellular matrix. Med Sci Monit 2014;20:1003-16.



26) Mo FM, Proia AD, Johnson WH, et al. Interferon gamma-inducible protein-10 (IP-10) and eotaxin as biomarkers in age-related macular degeneration. Invest Ophthalmol Vis Sci 2010;51:4226-36.


27) Nagineni CN, Kommineni VK, Ganjbaksh N, et al. Inflammatory cytokines induce expression of chemokines by human retinal cells: role in chemokine receptor mediated age-related macular degeneration. Aging Dis 2015;6:444-55.



28) Spindler J, Zandi S, Pfister IB, et al. Cytokine profiles in the aqueous humor and serum of patients with dry and treated wet age-related macular degeneration. PLoS One 2018;13:e0203337.



29) Ambati J, Anand A, Fernandez S, et al. An animal model of age-related macular degeneration in senescent Ccl-2- or Ccr-2-deficient mice. Nat Med 2003;9:1390-7.


30) Jonas JB, Tao Y, Neumaier M, Findeisen P. Monocyte chemoattractant protein 1, intercellular adhesion molecule 1, and vascular cell adhesion molecule 1 in exudative age-related macular degeneration. Arch Ophthalmol 2010;128:1281-6.


31) Zhang C, Shen JK, Lam TT, et al. Activation of microglia and chemokines in light-induced retinal degeneration. Mol Vis 2005;11:887-95.

32) Liu F, Ding X, Yang Y, et al. Aqueous humor cytokine profiling in patients with wet AMD. Mol Vis 2016;22:352-61.


33) Knickelbein JE, Chan CC, Sen HN, et al. Inflammatory mechanisms of age-related macular degeneration. Int Ophthalmol Clin 2015;55:63-78.


34) Nassar K, Grisanti S, Elfar E, et al. Serum cytokines as biomarkers for age-related macular degeneration. Graefes Arch Clin Exp Ophthalmol 2015;253:699-704.


35) Seshasai S, Liao J, Toh QC, et al. Serum leptin and age-related macular degeneration. Invest Ophthalmol Vis Sci 2015;56:1880-6.


36) Tosi GM, Caldi E, Neri G, et al. HTRA1 and TGF-β1 concentrations in the aqueous humor of patients with neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci 2017;58:162-7.


37) Zeev D, Ayala P. Protective effect of TGF-b1 in RPE cells upon oxidative stress as a model for oxidative damage during dry AMD. Invest Ophthalmol Vis Sci 2013;54:1805.


38) Borrelli E, Souied EH, Freund KB, et al. Reduced choriocapillaris flow in eyes with type 3 neovascularization and age-related macular degeneration. Retina 2018;38:1968-76.


39) Choi MY, Heo JH, Auh SJ, Yu YS. Effect of oxygen on photoreceptor degeneration in retinal degeneration mice. J Korean Ophthalmol Soc 1999;41:1824-33.
40) Fuhrmann V, Kinkl N, Leveillard T, et al. Fibroblast growth factor receptor 4 (FGFR4) is expressed in adult rat and human retinal photoreceptors and neurons. J Mol Neurosci 1999;13:187-97.


41) Zhao Q, Ji M, Wang X. IL-10 inhibits retinal pigment epithelium cell proliferation and migration through regulation of VEGF in rhegmatogenous retinal detachment. Mol Med Rep 2018;17:7301-6.


42) Wong CG, Taban M, Osann K, et al. Subchoroidal release of VEGF and bFGF produces choroidal neovascularization in rabbit. Curr Eye Res 2017;42:237-43.


43) Wong CG, Rich KA, Liaw LH, et al. Intravitreal VEGF and bFGF produce florid retinal neovascularization and hemorrhage in the rabbit. Curr Eye Res 2001;22:140-7.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 2,253 View
- 74 Download
- Related articles
-
A Case of a Patient with Refractory Scleritis Treated with Rituximab2023 May;64(5)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



