원발개방각녹내장 및 녹내장의증 환자에서 점안 안압하강제 사용이 각막생체역학인자에 미치는 영향
The Effects of Anti-glaucoma Eyedrops on Corneal Hysteresis in Patients with Open-angle Glaucoma and Glaucoma-suspect
Article information
Abstract
목적
개방각녹내장 및 녹내장의증 환자에서 점안 안압하강제가 각막 생체역학인자에 미치는 영향을 분석하였다.
대상과 방법
개방각녹내장 115명 225안, 녹내장의증 98명 128안을 대상으로 후향적 연구를 시행하였다. Ocular response analyzer를 이용해 연구 대상자의 각막이력현상 수치를 측정하고, 이에 영향을 미치는 인자들을 선형 모형을 이용한 일반화된 추정 방정식으로 분석하였다.
결과
평균 각막이력현상 수치는 개방각녹내장군에서 녹내장의증군에 비해 낮았다(p<0.001). 개방각녹내장군에서 생체역학인자를 보정한 안압이 낮을수록, 베타-차단제 및 알파2-작용제를 동시에 사용하는 경우, 시야검사 mean deviation가 클수록, 중심각막두께가 두꺼울수록 각막이력현상이 큰 것으로 나타났다.
결론
개방각녹내장에서 베타-차단제 및 알파2-작용제를 혼합하여 사용하는 것이 각막이력현상과 관련되어 있었다.
Trans Abstract
Purpose
We explored the effects of topical anti-glaucoma medications on the corneal biochemical properties of patients with open-angle glaucoma (OAG) and glaucoma suspect (GS patients).
Methods
We retrospectively reviewed data on 115 OAG and 98 GS patients (225 and 128 eyes respectively). Corneal hysteresis (CH) was measured using an ocular response analyzer. Factors influencing CH were determined using a generalized estimation equation.
Results
The mean CH was lower in OAG than GS patients (p < 0.001). A lower cornea-compensated intraocular pressure, concomitant use of a beta-adrenergic blocker and an alpha2-adrenergic agonist, a higher visual field mean deviation, and a larger central corneal thickness were associated with a higher CH in the OAG group.
Conclusions
Concomitant use of a topical beta-adrenergic blocker and an alpha2-adrenergic agonist was associated with a higher CH.
각막의 생체역학인자는 최근 녹내장성 시신경 변화 및 시야결손 진행의 위험인자로 밝혀져 녹내장의 새로운 생체 지표로서 주목받고 있다[1]. 각막이력현상(corneal hysteresis, CH)은 각막의 점성 및 탄성과 관계된 생체역학인자의 하나로, 안구가 기계적인 힘을 흡수하고 분산시킬 수 있는 수용력을 의미한다. 각막이력현상은 각막의 두께[2], 안압[3,4], 연령[5] 등의 영향을 받는 것으로 알려져 있으며 각 눈마다 고유의 각막이력현상을 지니고 있는데, 이에 따라 안압이 실제와 다르게 측정될 수 있기 때문에, 안압 측정 시 각막이력현상을 고려하는 것이 보다 정확한 측정값을 얻기 위해 중요하다. Ocular response analyzer (ORA) (Reichert Technologies, Inc., Depew, NY, USA)는 각막이력현상과 이를 보정한 안압을 측정할 수 있도록 고안된 장비이다. ORA는 각막을 편평하게 만들기 위해 필요한 공기의 압력을 이용해 안압을 측정한다. 이 때 각막이력현상 수치가 클수록, 각막에 가해지는 힘이 점차 증가할 때와 감소할 때 각각 측정된 안압의 차이가 크다[6]. 이 두 안압의 평균을 Goldmann-correlated intraocular pressure (IOPg)로 표현하며 골드만압평안압계(Goldmann applanation tonometry, GAT)로 측정한 안압에 상응하는 값으로 추정한다. ORA의 측정값 중에서 corneal-compensated IOP (IOPcc)는 각막두께와 무관하고 각막생체역학인자의 영향을 최소화하도록 보정한 안압이다.
녹내장 환자에서 장기간 사용하는 점안 안압하강제는 각막이력현상에 영향을 미치는 것으로 알려져 있다. 대표적으로 프로스타글란딘 유사체는 각막이력현상을 감소시키는 것으로 알려져 있으며[7], 그 밖에도 알파-작용제 및 베타-차단제 혼합 제제를 장기간 점안한 녹내장 환자에서 각막 이력현상이 증가하였다는 보고가 있다[8]. 저자들은 개방각녹내장 환자에서 여러 가지 조합의 안압하강제 사용이 각막이력현상에 미치는 영향을 알아보기 위해 1개월 이상 점안 안압하강제를 사용 중인 개방각녹내장 환자와 안압하강제를 사용하지 않는 녹내장의증 환자를 대상으로 ORA를 이용하여 각막이력현상 수치를 측정하고, 이에 영향을 미치는 인자들을 분석하였다.
대상과 방법
2020년 12월 1일부터 2020년 12월 31일까지 본원 안과에 내원한 개방각녹내장 환자 및 녹내장의증 환자 중 ORA를 시행한 환자를 대상으로 후향적 의무기록 분석을 시행하였다. 본 연구는 본원 생명윤리심의위원회로부터 승인을 받았다(승인 번호: B-2107-696-106).
대상자들은 세극등현미경검사를 포함한 안과 검사를 시행받았다. 안압은 점안마취제를 점안 후 GAT를 이용해 측정하였고, ORA를 이용하여 IOPg와 IOPcc 및 CH를 측정하였다. ORA 측정 시 waveform score가 6.5 이하인 경우는 연구 대상에서 제외하였다. 시야검사는 험프리 자동시야계(Humphrey® Visual Field Analyzer, Carl Zeiss Meditec Inc., Dublin, CA, USA)의 Central 24-2를 이용하였으며 20% 이상의 주시 실패, 15% 이상의 거짓 양성 또는 거짓 음성인 경우는 제외하였다.
시신경유두주위 망막신경섬유층의 두께는 Spectralis optical coherence tomography (Heidelberg Engineering, Heidelberg, Germany)를 이용해 측정하였으며 망막신경섬유층의 경계가 불분명한 경우는 분석에서 제외하였다. 안축장은 부분결합간섭계 장비를 이용해 5회 반복 측정하여 평균 값을 이용하였고(IOL Master®, Carl Zeiss, Jena, Germany), 중심각막두께는 각막지형도 장비를 이용해 측정하였다(Galilei G4, Ziemer Ophthalmic Systems AG, Port, Switzerland).
개방각녹내장 환자 및 녹내장의증 환자 진단은 1인의 안과 전문의에 의해서 이루어졌다. 개방각녹내장 환자는 세극등현미경검사 및 전방각경검사에서 전방각폐쇄 소견이 없고 녹내장성 시신경 변화 또는 망막신경섬유층결손과 함께 상응하는 시야결손이 있는 환자로 정의하였다. 녹내장의증은 시야검사상 정상 소견을 보이지만 전형적인 녹내장성 시신경유두 변화가 관찰되는 경우 혹은 GAT를 이용한 안압측정에서 2회 이상 21 mmHg로 측정되어 고안압증으로 분류된 경우를 포함하였다.
녹내장성 시신경유두 변화는 0.6 이상 증가된 수직 시신경유두함몰비, 양안 간 0.2 이상의 시신경유두함몰비의 차이, 시신경유두테의 국소적 또는 미만성 소실, 국소적인 시신경유두테 패임, 시신경유두출혈 등으로 정의하였다. 녹내장성 시야결손은 두 번 이상의 신뢰할 만한 시야검사에서 다음의 기준 중 두 가지 이상을 만족하는 경우로 정의하였다: 1) Glaucoma Hemifield test 결과 outside normal limit, 2) pattern standard deviation에서 정상의 5% 이하로 편위된 경우, 3) pattern deviation probability map에서 인접한 세 개 이상의 점의 역치가 정상의 5% 미만에서 나타나고, 그 중 한 개 이상은 1% 미만이거나 1% 미만인 두 점이 연결되어 있을 때.
통계 분석은 SPSS Version 21 (IBM Corp., Armonk, NY, USA)을 이용하여 시행하였다. 인구학적 인자 및 각막이력 현상과 시야검사, 망막신경섬유층 두께 등은 정규성 여부에 따라 그대로 또는 자연로그 변환 후 student t-test를 시행하거나 Mann-Whitney U test를 시행하였다. 인구통계학적 인자와 약물치료 및 수술 병력, 안압, 시야검사, 망막신경섬유층 두께, 중심각막두께, 안축장 및 점안 안압하강제 종류별 사용 여부와 기간 등이 각막이력현상에 미치는 영향을 분석하였다. 양안의 상호관련성을 보정하기 위해 일반화된 추정 방정식의 선형 모형을 이용해 분석하였다. 점안 안압하강제는 프로스타글란딘 유사체, 탄산탈수소화효소 억제제, 베타-차단제, 알파-작용제 등 네 가지 성분 약제의 가능한 모든 조합에 대해 통계 분석을 시행하였다. 통계 분석 시 특정 조합의 점안 안압하강제를 사용하는 것이 사용하지 않는 것에 대해 더 큰 독립변수 값을 가지도록 설정하였다.
결 과
개방각녹내장 환자 115명 225안, 녹내장의증 환자 98명 128안이 연구에 포함되었다. Table 1은 개방각녹내장군과 녹내장의증군의 인구통계학적 인자 및 임상적 특징의 비교이다. 개방각녹내장 환자의 평균 연령이 59.7 ± 14.2세로 녹내장의증 환자의 평균 연령인 54.0 ± 12.6세에 비해 더 많았다(p=0.002). 각막이력현상은 개방각녹내장군에서 10.6 ± 1.2 mmHg로 측정되어 녹내장의증군의 11.1 ± 1.1 mmHg 보다 낮았다(p<0.001). GAT로 측정한 안압은 개방각녹내장군에서 녹내장의증군보다 낮았다(각각, 12.3 ± 3.0 mmHg, 12.9 ± 2.8 mmHg, p=0.037). IOPg 역시 개방각녹내장군에서 더 낮았으나(각각, 14.0 ± 4.0 mmHg, 15.1 ± 4.2 mmHg, p=0.019), IOPcc는 두 군 간 통계적 차이를 보이지 않았다(p=0.377). 시야검사 mean deviation (MD) 값과 시신경유두주위 망막신경섬유층 두께는 개방각녹내장군에서 녹내장의증군보다 작았다(모두 p<0.001). 백내장수술을 시행받은 눈의 비율은 개방각녹내장군에서 더 컸고(각각 19.1%, 11%, p=0.008), 굴절교정수술을 시행받은 눈의 비율은 녹내장의증군에서 더 컸다(각각 14%, 19%, p=0.007).

Comparison of the demographic and ophthalmic characteristics between the open angle glaucoma and glaucoma suspect groups
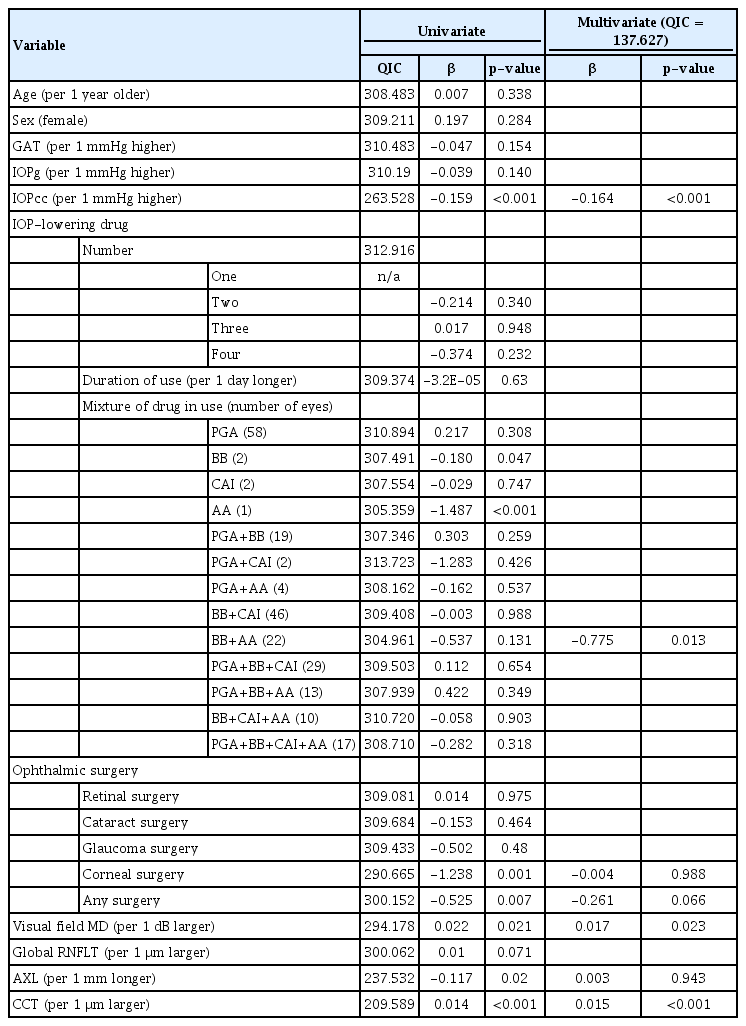
각막이력현상에 영향을 주는 인자들을 선형모형을 이용한 일반화 추정방정식으로 분석하였다(Table 2-4). 전체 연구 참여자를 대상으로 시행한 분석(Table 2)에서 각막이력 현상은 성별이 여성인 경우(β=0.428, p=0.004), IOPcc가 낮을수록(β=-0.148, p<0.001), 녹내장으로 진단되지 않은 경우(β=-0.553, p<0.001), 점안 안압하강제를 사용하지 않는 경우(β=-0.553, p<0.001), 점안 안압하강제 사용 기간이 짧을수록(β=-0.00016, p=0.003), 각막굴절교정수술 병력이 없는 경우(β=-0.59, p=0.047), 이전 안구내 수술 병력이 없는 경우(β=-0.474, p=0.006), 시야검사 MD 값이 클수록(β=0.031, p<0.001), 망막신경섬유층 두께가 클수록(β=0.013, p<0.001), 안축장이 짧을수록(β=-0.11, p=0.004), 중심각막두께가 두꺼울수록(β=0.013, p<0.001) 높았다. 점안 안압하강제 중에서는 베타-차단제를 단독으로 사용하는 경우(β=-0.382, p<0.001), 탈수소화효소 억제제를 단독으로 사용하는 경우(β=-0.231, p=0.002), 그리고 알파-작용제를 단독으로 사용하는 경우(β=-1.693, p<0.001) 각막이력현상이 감소하는 방향으로 유의한 관련성이 확인되었다. 베타-차단제와 알파-작용제를 조합하여 사용하는 경우에도 각막이력현상이 감소하는 방향으로 관련성이 있었으나, 통계적으로 유의하지는 않았다(β=-0.618, p=0.061). 선행하여 시행한 다변수 회귀분석과 동일한 독립 변수를 선택한 모형과, 일반화 추정 방정식을 이용한 단변수 분석에서 90% 유의 수준하에 통계적으로 유의한 변수들을 선택한 모형의 적합도를 비교하였다. 모형의 적합도는 corrected quasi-likelihood under the independence model criterion (QICc)를 이용하여 비교하였다. 그 결과 첫 번째 모형의 적합도가 우수하여 이를 선택하였다(QICc=182.857 vs. QICc=186.883). 다변수 분석에서 각막이력현상과 통계적으로 유의한 관련성을 보인 인자는 IOPcc (β=-0.186, p<0.001) 및 중심각막두께였다(β=0.016, p<0.001). 베타-차단제와 알파-작용제를 조합하여 사용하는 경우에도 각막이력현상이 감소하는 방향으로 관련성이 있었으나 통계적으로 유의하지는 않았다(β=-0.482, p=0.189).
개방각녹내장군에 대해 동일한 방법으로 분석한 결과를 Table 3에 기술하였다. 단변수 분석 결과 각막이력현상은 IOPcc가 낮을수록(β=-0.159, p<0.001), 각막굴절교정수술력이 없는 경우(β=-1.238, p=0.001), 이전 안구내 수술력이 없는 경우(β=-0.525, p=0.007), 시야검사 MD 값이 클수록(β=0.022, p=0.021), 안축장이 짧을수록(β=-0.117, p=0.02), 중심각막두께가 두꺼울수록(β=0.014, p<0.001) 높았다. 베타-차단제를 단독으로 사용하는 경우(β=-0.180, p=0.047), 알파-작용제를 단독으로 사용하는 경우(β=-1.487, p<0.001) 각막이력현상과의 관련성이 확인되었다. 베타-차단제와 알파-작용제를 조합하여 사용하는 경우에도 각막이력현상이 감소하는 방향으로 관련성이 있었으나 통계적으로 유의하지는 않았다(β=-0.537, p=0.131). 전체 참여자를 대상으로한 분석에서와 같은 방법으로, 다변수 분석을 위한 두 모형을 비교하였다. 선행하여 시행한 다변수 회귀분석과 동일한 변수를 사용한 모형의 QICc 값이 더 낮아 이를 채택하였다(QICc=133.729 vs. QICc=141.969). 다변수 분석에서 각막이력현상과 통계적으로 유의한 관련성을 보인 인자는 IOPcc (β=-0.164, p<0.001), 시야검사 MD 값(β=0.017, p=0.023), 중심각막두께였다(β=0.015, p<0.001). 베타-차단제와 알파-작용제를 조합하여 사용하는 경우 각막이력현상이 감소하는 방향으로 통계적으로 유의한 관련성이 있었다(β=-0.775, p=0.013).
녹내장의증군에 대해 동일한 방법으로 분석하였다(Table 4). 단변수 분석에서 각막이력현상은 성별이 여성인 경우(β=0.697, p=0.002), IOPcc가 낮을수록(β=-0.122, p<0.001), 망막수술력이 없는 경우(β=-1.489, p<0.001), 중심각막두께가 두꺼울수록(β=0.01, p<0.001) 높았다. 다변수 분석을 위해 전체 참여자를 대상으로 한 분석에서와 같은 방법으로 두 모형을 비교하였다. 단변수 일반화 추정 방정식 분석에 근거한 다변수 모형의 QICc의 값이 더 작아 이를 채택하였다(QICc=62.692 vs. QICc=96.579). 이 때 다변수 분석 결과에서 통계적으로 유의한 인자는 없었다.
고 찰
각막이력현상은 녹내장의증 환자에 비해 녹내장 환자에서 더 감소해 있는 것으로 알려져 있으며[9], 낮은 각막이력현상은 녹내장성 시야결손의 진행[5,10], 망막신경섬유층 두께 감소[11], 사상판 변형[12]과도 관련된 것으로 보고된 바 있다. 개별 안구에서 각막, 공막, 시신경유두 주변부 및 사상판을 구성하는 세포외기질은 동일한 교원질 유전자로부터 발현한다[10]. 각막과 사상판의 생체 역학인자가 비슷하다는 가정 하에 각막이력현상이 낮은 안구에서는 각막뿐 아니라 사상판 역시 쉽게 변형이 가능하고, 따라서 사상판이 안압의 변화에 따른 완충 작용을 잘 해주지 못할 가능성이 크며, 이에 따라 안압상승 및 변동으로 인한 녹내장성 손상에 더욱 취약할 가능성이 있다[13-18]. Abitbol et al [19]은 단면 연구에서 건강한 대조군과 비교할 때 녹내장 환자의 평균 각막이력현상 수치가 더 낮은 것으로 보고하였고, Anand et al [20]은 양안 개방각녹내장 환자에서 녹내장성 시야결손이 더 심한 눈이 더 낮은 각막이력현상 수치를 가지는 것으로 보고하였다. 본 연구에서도 개방각녹내장군이 녹내장의증군에 비해 낮은 각막이력현상 수치를 보였고, 녹내장성 시야결손이 심할수록 더 낮은 것으로 나타나, 기존 연구와 부합하는 결과를 보였다. GAT 및 IOPg는 개방각녹내장군에서 녹내장의증군에 비해 유의하게 낮았지만, IOPcc는 두 군 간 유의한 차이가 없었다. 이는 녹내장 환자들의 각막이력현상 수치가 더 낮음으로 인하여 나타난 결과로 보이며, 녹내장 환자에서 안압 측정치를 해석할 때 각막이력현상을 고려하는 것이 중요함을 시사한다.
각막이력현상은 안압이 낮을수록[3,4], 중심각막두께가 두꺼울수록[2] 증가하는 것으로 알려져 있다. 본 연구에서 또한 전체 참여자 및 개방각녹내장 환자군에서 IOPcc가 낮을수록, 중심각막두께가 두꺼울수록 각막이력현상 수치가 높아 기존에 알려진 연구 결과와 부합하였다. 녹내장 환자가 사용하는 점안 안압하강제도 각막이력현상에 영향을 줄 수 있는 것으로 알려져 있다. 초기 각막이력현상 수치가 낮은 환자에서 프로스타글린딘 유사체를 단기간 사용할 경우 각막이력현상 수치가 증가한다는 보고가 있다[3,4]. 그런데 각막이력현상 수치가 작을수록 안압하강제에 의한 안압하강이 더 크므로[3,4], 프로스타글란딘 유사체가 각막이력현상 수치에 미치는 영향은 안압하강으로 인해 나타난 결과였을 가능성이 있다[7]. Meda et al [7]은 초기 각막이력현상 수치가 낮은 환자가 장기간 프로스타글란딘 유사체를 사용하다가 중지할 경우 각막이력현상 수치가 상승하며, 다시 사용을 시작하면 장기간에 걸쳐 각막이력현상이 다시 감소하는 것으로 보고하였다. 프로스타글란딘 유사체가 섬모체의 기질 금속단백분해효소의 활성을 증가시켜 방수 유출을 증가시킴으로써 안압을 감소시키는데[21], 이 때 공막의 기질 금속단백분해효소 활성 또한 증가하는 것으로 알려져 있다[22,23]. Meda et al [7]은 이를 근거로 프로스타글란딘 유사체 점안이 각막내 세포외 기질의 분해를 촉진함으로써 장기간 사용 시에는 오히려 각막이력현상을 감소시킬 것이라는 가설을 제시하였다.
본 연구에서는 개방각녹내장환자군에서 베타-차단제와 알파-작용제를 조합하여 사용하는 것이 각막이력현상이 더 낮은 것과 유의한 연관성이 있었다. 사람의 각막에는 베타2-수용체 및 알파2-수용체가 존재하는 것으로 알려져 있다[24]. 베타-차단제 및 알파2-작용제는 이들 각 수용체에 결합하여 공통적으로 각막상피세포내 고리형 아데노신 일인산(cyclic adenosine monophosphate) 농도를 감소시킴으로써 단백질 인산화효소 A (protein kinase A)를 활성화한다. 이후 활성화된 단백질 인산화효소는 세포내 신호 전달을 매개하여 각막상피층 두께의 증가 및 각막기질의 가역적 부종을 유발하는데, 이 때 두 약제 모두 각막내피층 두께에는 영향을 주지 않는 것으로 알려져 있다[25,26]. 각막부종이 있을 때 비록 중심각막두께가 증가하더라도 각막이력현상은 오히려 감소하는 것으로 알려져 있으므로[27] 본 연구 결과 또한 이런 기존 연구 가설들과 일치한다. 베타-차단제 및 알파2-작용제를 각각 단일 요법으로 사용할 경우 중심각막두께의 증가는 가역적이며 수일 뒤 호전되는 것으로 알려져 있는데[25,26], 이는 28일 이상 약제를 사용한 환자를 대상으로 한 본 연구 결과와는 완전히 부합하지 않는다. Grueb and Rohrbach [26]은 중심각막두께가 가역적인 변화를 보이는 이유로 베타-수용체 및 알파-수용체의 감작과 탈감작 기전이 관여할 가능성을 제시하였고[25,26], 이 경우 약제 농도에 따라서 시간에 따른 중심각막두께 변화 양상이 달라질 수 있을 것으로 예상하였다. 이에 따르면 본 연구에서처럼 베타-차단제와 알파2-작용제를 동시에 사용할 경우 하부 세포신호 전달 과정의 변화로 인해 각막중심두께의 장기적 변화를 유발할 수 있을 것으로 가정해볼 수 있으나, 상세한 기전에 대해서는 아직 밝혀진 바가 없으며 추가적인 연구가 필요하다.
반면, 탈수소화효소 억제제는 기저 각막내피세포 질환이 있는 환자에서 가역적인 각막내피세포부전 및 중심각막두께의 증가를 유발하는 것으로 알려져 있고[28], 정상 각막에서는 각막내피세포에 영향을 주지 않는 것으로 알려져 있다[29]. 본 연구에서도 베타-차단제와 탄산 탈수소화효소 억제제를 동시에 사용하는 것은 각막이력현상과의 유의한 관련성이 없었다. 이에 대한 보다 정량적인 분석이 필요하며 추후 각막내피기능과 점안 안압하강제가 각막이력현상에 미치는 영향에 대한 추가적인 연구가 필요하다.
본 연구에서 다변수 분석 결과, 개방각녹내장군의 점안 안압하강제 사용 기간은 각막이력현상과 무관한 것으로 나타났다. Sun et al [30]은 다양한 종류의 점안 안압하강제를 2-4주간 점안했을 때 각막이력현상의 변화를 추적 관찰하였으며, 초기 2주 이내 각막이력현상 수치가 증가하였지만 2주 이후부터는 변화가 없었다고 하였다. 본 연구는 점안 안압하강제 사용 기간이 28일 미만인 환자는 제외하였고, 따라서 안압하강제의 점안 기간이 각막이력현상과 관련이 없었을 가능성이 있다.
Aydemir et al [31]는 안압하강제 성분 외에도 약제에 포함된 보존제가 각막이력현상에 영향을 줄 수 있을 가능성을 제시하였다. Aydemir et al [31]는 이 연구에서 프로스타글란딘 계열의 활성 제제 또는 전구체와 다양한 종류의 보존제 조합에 따라 각막이력현상의 변화 여부가 다르다고 하였다. 또한, 알파-작용제에서도 보존제와의 조합에 따라 유의미한 각막이력현상 변화를 보고하였다. 이는 단일 안압하강제 성분뿐만 아니라 점안액에 포함된 다른 성분과의 조합에 따라 각막이력현상 변화가 다양하게 나타날 수 있음을 시사한다.
본 연구는 후향적 의무 기록 분석을 통한 단면 연구이므로 점안 안압하강제 사용과 각막이력현상의 인과관계를 증명하는 것에는 한계가 있다. 안압 및 각막생체역학인자의 일중변동에 대한 검토가 이루어질 수 없었다는 것도 단면 연구 설계로 인한 한계점이었다. 또한, 각막굴절교정수술을 시행할 경우 각막이력현상은 감소하는 것으로 알려져 있는데[32], 본 연구의 개방각녹내장군에서 각막굴절교정술을 시행 받은 환자의 수가 녹내장의증군에 비해 유의하게 낮았다. 그럼에도 불구하고 개방각녹내장군의 각막이력현상 수치가 더 낮았던 점과 굴절교정수술을 받은 환자 숫자가 많지 않았던 점, 그리고 다변수 선형모형 분석에서 각막굴절교정수술 병력이 각막이력현상과 무관하였던 점을 고려할 때, 굴절교정수술을 받은 환자를 포함한 것이 최종 결과에는 영향을 미치지 않았을 것으로 생각된다.
본 연구에서 안압하강제 성분 및 조합에 따라 점안 안압하강제의 사용이 각막이력현상에 영향을 줄 수 있음을 확인하였다. 그러므로 개방각녹내장 환자 진료 시 각막이력현상을 측정할 때에는 사용 중인 점안 안압하강제의 종류에 따라 그 해석에 주의가 필요하다. 추후 베타-차단제 및 알파-작용제 사용 시 단기 및 장기적인 각막이력현상 변화에 대한 전향적 연구가 필요하다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
최용제 / Yong Je Choi
서울대학교 의과대학 안과학교실
Department of Ophthalmology, Seoul University College of Medicine