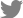|
 |
| J Korean Ophthalmol Soc > Volume 62(12); 2021 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ļģ╣ļé┤ņןņØś ļČäļźśņŚÉ ļö░ļźĖ ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ļ╣äĻĄÉĒĢśĻ│Ā Ļ┤ĆļĀ© ņØĖņ×ÉļōżņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
Mean deviation Ļ░ÆņØ┤ -12 dB ņØ┤ĒĢśņØś ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×É 133ļ¬ģņØś 133ņĢłņØä ļīĆņāüņ£╝ļĪ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļæÉ ĻĄ░ņ£╝ļĪ£ ļČäļźśĒĢ£ Ēøä ĒÖ®ļ░śĒĢś ļ░Å ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. ļśÉĒĢ£ ņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ĒåĄĒĢ┤ ĒÖ®ļ░śĒĢś ļ░Å ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×ÉļōżņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤ņĢśļŗż.
Ļ▓░Ļ│╝
ĒÅēĻĘĀ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ 99.20 ┬▒ 46.85 ┬ĄmļĪ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØś 121.85 ┬▒ 45.39 ┬ĄmņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņ¢ćņĢśņ£╝ļ®░(p=0.006), ĻĄ¼ņŚŁļ│ä ļ╣äĻĄÉņŚÉņä£ļÅä ļ¬©ļōĀ ņśüņŚŁņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØ┤ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņŚÉ ļ╣äĒĢ┤ ņ¢ćņØĆ ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ļ│┤ņśĆļŗż(ļ¬©ļæÉ p<0.05). ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņØĖņ×ÉļōżņŚÉ ļīĆĒĢ£ ņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ļģ╣ļé┤ņןņØś ļČäļźś(p=0.007), ļéśņØ┤(p=0.005), ĻĖ░ņĀĆ ņĢłņĢĢ(p=0.024)ņØ┤ ņ£ĀņØśĒĢ£ ņØĖņ×ÉļĪ£ ļéśĒāĆļé¼ļŗż. ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļæÉ ĻĄ░ Ļ░äņŚÉ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░, ļéśņØ┤(p=0.029)ņÖĆ ĒÖ®ļ░śļæÉĻ╗ś(p=0.002)Ļ░Ć ņ£ĀņØśĒĢ£ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŖö ņØĖņ×ÉļĪ£ ļéśĒāĆļé¼ļŗż.
Ļ▓░ļĪĀ
ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņŚÉņä£ ļé«ņØĆ ĻĖ░ņĀĆņĢłņĢĢ, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļ░Å Ļ│ĀļĀ╣ņØĆ ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēĻ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ│æņØĖņØś ņŚ░Ļ┤Ćņä▒ņØä Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ņ£╝ļéś, ļģ╣ļé┤ņןņØś ļ│æņØĖņŚÉ ņ׳ņ¢┤ ļ¦źļØĮļ¦ēņØ┤ ņ¢┤ļ¢ĀĒĢ£ ņØśļ»Ėļź╝ Ļ░¢ļŖöņ¦Ć ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņČöĒøä ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśĻ▓Āļŗż.
ABSTRACT
Purpose
We investigated choroidal thickness according to the classification of glaucoma and related factors in patients with advanced glaucoma.
Methods
The present study included 133 eyes of 133 advanced glaucoma patients with a mean deviation of <-12 dB. Patients were classified into primary open angle glaucoma (POAG) and normal-tension glaucoma (NTG) groups. Factors related to the subfoveal and peripapillary choroidal thickness were analyzed using linear regression analysis.
Results
The mean peripapillary choroid thickness was 99.20 ┬▒ 46.85 ┬Ąm in the NTG group, which was significantly thinner than in the POAG group (121.85 ┬▒ 45.39 ┬Ąm, p = 0.006). Additionally, in the sectoral comparison, the NTG group had thinner choroids than the POAG group in all areas (p < 0.05 for all). In the linear regression analysis, glaucoma class (p = 0.007), age (p = 0.005), and intraocular pressure (IOP) (p = 0.024) significantly affected the peripapillary choroid thickness. Moreover, age (p = 0.029) and macular thickness (p = 0.002) were significantly associated with subfoveal choroid thickness.
Conclusions
In advanced glaucoma, low baseline IOP, NTG, and old age were significantly associated with a thin peripapillary choroid, suggesting an association between thin peripapillary choroid and the etiology of NTG. Further studies are needed to clarify the significance of a thin choroid in the pathogenesis of glaucoma.
ļģ╣ļé┤ņןņØĆ ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ņŗżļ¬ģņØś ņŻ╝ņÜö ņøÉņØĖņØä ņ░©ņ╣śĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£, ņ¦äĒ¢ēĒĢśļŖö ļ¦Øļ¦ē ļ░Å ņŗ£ņŗĀĻ▓ĮņØś ņĀäĒśĢņĀüņØĖ ĻĄ¼ņĪ░ ļ│ĆĒÖöņŚÉ ļö░ļźĖ ņåÉņāüņØä ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢ£ļŗż[1,2]. ļģ╣ļé┤ņןņØś ļ░£ņāØ ĻĖ░ņĀäņ£╝ļĪ£ ņĢłņĢĢņāüņŖ╣ņ£╝ļĪ£ ņØĖĒĢ£ ĻĖ░Ļ│äņĀüņØĖ ņŗ£ņŗĀĻ▓ĮņåÉņāü(mechanical theory)ņØ┤ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļ¬©ļæÉņŚÉņä£ ņŻ╝ņÜö ņ£äĒŚś ņØĖņ×ÉĻ░Ć ļÉśņ¦Ćļ¦ī, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ļ░Å ņŻ╝ļ│Ć ņĪ░ņ¦üņØś Ļ┤ĆļźśļČĆņĀäņŚÉ ņØśĒĢ£ ņŗ£ņŗĀĻ▓ĮņØś ĒŚłĒśłņä▒ ņåÉņāü(ischemic theory)ļÅä ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Įļ│æņ”ØņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśĻ│Ā ņ׳ļŗż[3-6]. ĒŚłĒśłņä▒ ņåÉņāü ņØ┤ļĪĀņŚÉ ļö░ļź┤ļ®┤, ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØś ļ│æņØĖņØĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņØś ņĀäņé¼ņāüĒīÉ ņśüņŚŁņØś ĒśłņĢĪ Ļ│ĄĻĖēĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳Ļ│Ā, ļ¦źļØĮļ¦ē ņĪ░ņ¦üņØĆ ļÆżņä¼ļ¬©ņ▓┤ļÅÖļ¦ź(posterior ciliary artery)ņØś ļČäņ¦ĆļĪ£ļČĆĒä░ ĒśłņĢĪ Ļ│ĄĻĖēņØä ļ░øņĢä ļ¦Øļ¦ēņÖĖņĖĄĻ│╝ ņĀäņé¼ņāüĒīÉ ņĪ░ņ¦üņŚÉ ņé░ņåīņÖĆ ņśüņ¢æņØä Ļ│ĄĻĖēĒĢśļŖö ņĪ░ņ¦üņ£╝ļĪ£, ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņŗ£ņŗĀĻ▓ĮņØś Ļ┤Ćļźś ņāüĒā£ņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ņ׳ļŗż[7,8]. ĒŖ╣Ē׳ ĒĢ£ĻĄŁņØĖņŚÉņä£ Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØś 77%ļź╝ ņ░©ņ¦ĆĒĢśļ®░ ņĢäņŗ£ņĢä ņØĖņóģņŚÉņä£ ļåÆņØĆ ņ£Āļ│æļźĀņØä ļ│┤ņØ┤ļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£, ĒśłĻ┤Ć Ēś╣ņØĆ ĒśłļźśĒĢÖņĀüņØĖ ņĪ░ņĀł ņןņĢĀĻ░Ć ļģ╣ļé┤ņן ļ░£ņāØ ļ░Å ņ¦äĒ¢ēņŚÉ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņØīņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[9,10].
ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü(optical coherence tomography)ņØś ļ░£ļŗ¼ļĪ£ ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ņĀĢļ¤ēņĀüņ£╝ļĪ£ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳Ļ▓ī ļÉśļ®┤ņä£, ņØ┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£Ē׳ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓ĮņåÉņāüĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņŗ£ņŗĀĻ▓Į ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņĀĢņāüņØĖņŚÉ ļ╣äĒĢ┤ ņ¢ćņĢśņ£╝ļ®░[11-13], ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻ│╝ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØś ļ╣äĻĄÉņŚÉņä£ļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØ┤ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉļōżņŚÉ ļ╣äĒĢ┤ ļŹö ņ¢ćņØĆ ļ¦źļØĮļ¦ēņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż[14-16]. ĒĢśņ¦Ćļ¦ī ņØ┤ņÖĆļŖö ļ░śļīĆļĪ£ ņ£ĀļæÉņŻ╝ņ£ä ļ░Å ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļģ╣ļé┤ņן ĒÖśņ×ÉļōżĻ│╝ ņĀĢņāüņĢłņŚÉņä£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåļŗżļŖö ņŚ░ĻĄ¼ļōżļÅä ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ņ¢┤, ļģ╣ļé┤ņןņØś ļ│æņØĖņŚÉ ļ¦źļØĮļ¦ēņØ┤ ņ¢┤ļ¢ĀĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŖöņ¦Ć ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņŗżņĀĢņØ┤ļŗż[17-20].
ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņĢłņŚÉņä£ļŖö ņ£ĀļæÉĒĢ©ļ¬░ļ╣äņØś ņ”ØĻ░Ć, ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄņØś ņ¢ćņĢäņ¦É, ņé¼ņāüĒīÉ ļæÉĻ╗śņØś Ļ░Éņåī ļō▒ ļģ╣ļé┤ņןņŚÉ ņØśĒĢ£ ļŗżņ¢æĒĢ£ ĻĄ¼ņĪ░ņĀü ņåÉņāüļōżņØ┤ ļéśĒāĆļéśĻ▓ī ļÉ£ļŗż. ĒĢ£ĒÄĖ ļ¦źļØĮļ¦ēņŚÉ ņ׳ņ¢┤ņä£ļŖö ļģ╣ļé┤ņןņĢłņŚÉņä£ ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ¢ćņĢäņĪīļŗżļŖö ļ│┤Ļ│ĀļōżņØĆ ļ¦ÄņØ┤ ņ׳ņ£╝ļéś, ļģ╣ļé┤ņןņØ┤ ņ¦äĒ¢ēĒĢĀņłśļĪØ ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļŹö ņ¢ćņĢäņ¦ĆļŖöņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢäņ¦ü ņØ┤Ļ▓¼ņØ┤ ņ׳ņ£╝ļ®░, Hirooka et al [13]ņØĆ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņØ╝ņłśļĪØ ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļŹö ņ¢ćņĢäņĪīļŗżĻ│Ā ĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ļōżņØĆ ņŗ¼ĒĢśņ¦Ć ņĢŖņØĆ ņ┤łĻĖ░ ļśÉļŖö ņżæĻĖ░ ļģ╣ļé┤ņןļ¦īņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśĻ│Ā, ļśÉļŖö ļŗżņ¢æĒĢ£ ņżæņ”ØļÅäņØś ļģ╣ļé┤ņן ĒÖśņ×Éļź╝ ĒĢ£ ļ▓łņŚÉ ļČäņäØĒĢśņŚ¼ ļģ╣ļé┤ņן ņżæņ”ØļÅäĻ░Ć ļ¦źļØĮļ¦ēļæÉĻ╗ś ņĖĪņĀĢņŚÉ ļ»Ėņ╣śļŖö Ēś╝ļ×Ć ņÜöņØĖņØä ņČ®ļČäĒ׳ Ļ│ĀļĀżĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗżļŖö ļ¼ĖņĀ£Ļ░Ć ņ׳ļŗż. ļśÉĒĢ£ ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉ£ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØś ļ╣äņ£©ņØ┤ ņĀüĻ│Ā, ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉļØ╝Ļ│Ā ĒĢśļŹöļØ╝ļÅä ĻĘĖ ņĀĢļÅäĻ░Ć ļ╣äĻĄÉņĀü ņŗ¼ĒĢśņ¦Ć ņĢŖņĢä ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņĢłņŚÉņä£ņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļČĆņĪ▒ĒĢ£ ņĖĪļ®┤ņØ┤ ņ׳ļŗż. ļģ╣ļé┤ņןņØ┤ ņ¦äĒ¢ēļÉ£ ņāüĒā£ņŚÉņä£ļÅä ĻĖ░ņĪ┤ņØś ļ│┤Ļ│Āņ▓śļ¤╝ ļģ╣ļé┤ņןņØś ļČäļźśņŚÉ ļö░ļźĖ ļæÉĻ╗śņØś ņ░©ņØ┤Ļ░Ć ņĪ┤ņ×¼ĒĢśļŖöņ¦Ć ņĢīņĢäļ│┤ļŖö Ļ▓āņØĆ ļģ╣ļé┤ņןņØś ļ│æņØĖņŚÉ ņ׳ņ¢┤ ļ¦źļØĮļ¦ēņØ┤ ņ¢┤ļ¢ĀĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖöņ¦Ć ņØ┤ĒĢ┤ĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉĀ Ļ▓āņØ┤ļŗż. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļģ╣ļé┤ņן ņżæņ”ØļÅäņØś ļŗżņ¢æņä▒ņØ┤ ļČäņäØņŚÉ ļ»Ėņ╣Ā ņłś ņ׳ļŖö Ēś╝ļ×Ć ņÜöņØĖņØä ņĄ£ņåīĒÖöĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņ¦äĒ¢ēļÉ£ ņāüĒā£ņØś ļģ╣ļé┤ņןņĢłļ¦īņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņŚ¼ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ĒŖ╣ņä▒ņØä ņĢīņĢäļ│┤Ļ│Ā, ļģ╣ļé┤ņןņØś ļČäļźśņŚÉ ļö░ļźĖ ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦Ć ļČäņäØĒĢśĻ│Āņ×É ĒĢśņśĆņ£╝ļ®░, ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉļōżņŚÉņä£ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆļÉ£ ņØĖņ×ÉņŚÉļŖö ņ¢┤ļ¢ż Ļ▓āļōżņØ┤ ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
2018ļģä 8ņøöļČĆĒä░ 2020ļģä 12ņøöĻ╣īņ¦Ć ņĀäļé©ļīĆĒĢÖĻĄÉļ│æņøÉ ļģ╣ļé┤ņן Ēü┤ļ”¼ļŗēņØä ļé┤ņøÉĒĢśņŚ¼ ļģ╣ļé┤ņןņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×É ņżæ 30-2 ņŗ£ņĢ╝Ļ▓Ćņé¼ mean deviation (MD)Ļ░Ć -12 dBļ│┤ļŗż ļé«ņØĆ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×É 133ļ¬ģ 133ņĢłņØä ļīĆņāüņ£╝ļĪ£ ņØśļ¼┤ĻĖ░ļĪØņ¦Ć ļČäņäØņØä ĒåĄĒĢ£ ĒøäĒ¢źņĀü ļŗ©ļ®┤ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ŌĆśņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉņØś ĻĖ░ļŖźņĀü, ĻĄ¼ņĪ░ņĀü ņåÉņāüņØä ļČäņäØĒĢśļŖö ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ŌĆÖņØś ņØ╝ĒÖśņ£╝ļĪ£, ĒŚ¼ņŗ▒ĒéżņäĀņ¢Ė(Declaration of Helsinki)ņØä ņżĆņłśĒĢśņśĆņ£╝ļ®░, ļ│ĖņøÉ ņ×äņāüņŚ░ĻĄ¼ņ£żļ”¼ņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖ ņĢäļל ņ¦äĒ¢ēļÉśņŚłļŗż(ņŖ╣ņØĖ ļ▓łĒśĖ: 2021-102).
ļ¬©ļōĀ ĒÖśņ×ÉļōżņØĆ ļé┤ņøÉ ņŗ£ ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮņØä ĒåĄĒĢ£ ņĀäņĢłļČĆĻ▓Ćņé¼, ņĀäļ░®Ļ░üĻ▓ĮĻ▓Ćņé¼, Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļź╝ ĒåĄĒĢ£ ņĢłņĢĢ ņĖĪņĀĢ, ņĢłņĀĆ ņé¼ņ¦äņ┤¼ņśü, ņĀĆĻ░äņäŁņä▒ļ░śņé¼Ļ│ä(Lenstar; Haag-Streit AG, Koeniz, Switzerland)ļź╝ ĒåĄĒĢ£ Ļ░üļ¦ēļæÉĻ╗śņÖĆ ņĢłņČĢņן ņĖĪņĀĢ, ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü(Heidelberg Spectralis spectral domain optical coherence tomography; Spectralis software version 6.9.4; Heidelberg Engineering GmbH, Heidelberg, Germany), Swedish interactive threshold algorithm (SITA) standard 30-2 ļ░®ņŗØņØä ņØ┤ņÜ®ĒĢ£ ņ×ÉļÅÖņŗ£ņĢ╝Ļ▓Ćņé¼(Humphrey Field Analyzer; Carl Zeiss Meditec, Inc., Dublin, CA, USA)ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØĆ ņĀäļ░®Ļ░üĻ▓ĮĻ▓Ćņé¼ņāü Ļ░£ļ░®Ļ░üņØ┤Ļ│Ā ņĀäļ░śņĀüņØ┤Ļ▒░ļéś ĻĄŁņåīņĀüņØĖ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉĒģīņØś ņóüņĢäņ¦É, Ēī©ņ×ä, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņČ£Ēśł, ņŗ£ņĢ╝ņåÉņāüĻ│╝ ņØ╝ņ╣śĒĢśļŖö ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ Ļ▓░ņåÉĻ│╝ Ļ░ÖņØĆ ĒŖ╣ņ¦ĢņĀüņØĖ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓ĮņåÉņāüņØ┤ Ļ┤Ćņ░░ļÉśĻ│Ā, ļģ╣ļé┤ņן ņØ┤ņÖĖņØś ņŗ£ņŗĀĻ▓ĮņåÉņāüņØä ņØ╝ņ£╝Ēé¼ ļ¦īĒĢ£ ņøÉņØĖ ņ¦łĒÖśņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ ņ¦äļŗ©ĒĢśņśĆļŗż. ĻĘĖņżæ ņ┤łņ¦ä ņŗ£ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļĪ£ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņØä ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗ś Ļ░Æ 520 ╬╝mļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ļ│┤ņĀĢĒĢśņŚ¼(ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗śĻ░Ć 10 ╬╝mĻ░Ć ņ╗żņ¦łņłśļĪØ ņĢłņĢĢ Ļ░ÆņŚÉņä£ 0.7 mmHgļź╝ ļ╣╝Ļ│Ā, ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗śĻ░Ć 10 ╬╝mĻ░Ć ņ×æņĢäņ¦łņłśļĪØ ņĢłņĢĢ Ļ░ÆņŚÉņä£ 0.7 mmHgļź╝ ļŹöĒĢ©) ĻĘĖ Ļ░ÆņØ┤ 21 mmHg ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņ£╝ļĪ£ ļČäļźśĒĢśņśĆĻ│Ā, 21 mmHgļź╝ ņ┤łĻ│╝ĒĢśļŖö ņĢłņĢĢņØä Ļ░ĆņĪīļŹś ĒÖśņ×Éļź╝ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņ£╝ļĪ£ ļČäļźśĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż[21]. ņĢłņĢĢņØĆ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļź╝ ĒåĄĒĢ┤ 2ĒÜī ņØ┤ņāü ņĖĪņĀĢĒĢ£ ĒÅēĻĘĀĻ░Æņ£╝ļĪ£ ĒĢśņśĆņ£╝ļ®░, ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗śļŖö ļČĆļČäĻ▓░ĒĢ®Ļ░äņäŁĻ│äļź╝ ņé¼ņÜ®ĒĢśņŚ¼ 5ĒÜī ņŚ░ņåŹ ņĖĪņĀĢĒĢśņŚ¼ ņżæĻ░ä Ļ░Æ 3Ļ░£ļź╝ ĒÅēĻĘĀĒĢśņŚ¼ ņĀĢĒĢśņśĆļŗż. ņ┤łņ¦ä ņŗ£ ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŖö ĒÖśņ×ÉņØś Ļ▓ĮņÜ░, ņåīĻ▓¼ņä£ņāü ņĢĮļ¼╝ņ╣śļŻī ņĀä ņĢłņĢĢņØ┤ ļ¬ģņŗ£ļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ļ¦īņØä ļČäņäØņŚÉ ĒżĒĢ©ĒĢśņśĆļŗż. ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ 0.3 logarithm of minimum angle of resolution (logMAR)ļ│┤ļŗż ļé«ņØĆ Ļ▓ĮņÜ░ ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś ņŗĀļó░ļÅäĻ░Ć ļ¢©ņ¢┤ņ¦ł ņłś ņ׳ņ£╝ļ»ĆļĪ£ ļČäņäØņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļśÉĒĢ£ 18ņäĖ ņØ┤ĒĢś, ĻĄ┤ņĀłņØ┤ņāüņØ┤ ĻĄ¼ļ®┤ļīĆņØæņ╣ś -6.0 diopters (D)ņÖĆ +6.0 D ņé¼ņØ┤ļź╝ ļ▓Śņ¢┤ļéśļŖö Ļ▓ĮņÜ░, ļģ╣ļé┤ņןņłśņłĀņØä ĒżĒĢ©ĒĢ£ ņĢłļé┤ņłśņłĀņØś ĻĖ░ņÖĢļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░(ļŗ©ņł£ ļ░▒ļé┤ņןņłśņłĀņØĆ ņĀ£ņÖĖ), ļģ╣ļé┤ņן ņØ┤ņÖĖņØś ņŗ£ņĢ╝ņåÉņāüņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŖö ļ¦Øļ¦ēņĀäļ¦ē, ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø, ļ¦Øļ¦ēĒśłĻ┤ĆĒÅÉņćäņ¦łĒÖś ļō▒Ļ│╝ Ļ░ÖņØĆ ļ¦Øļ¦ēņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņŚŁņŗ£ ļČäņäØņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļæÉ ļłł ļ¬©ļæÉ ņäĀņĀĢ ņĀ£ņÖĖ ĻĖ░ņżĆņØä ļ¦īņĪ▒ĒĢśļŖö Ļ▓ĮņÜ░ ņ×äņØśļĪ£ ĒĢ£ ļłłļ¦ī ņäĀĒāØĒĢśņŚ¼ ļČäņäØņŚÉ ĒżĒĢ©ņŗ£ņ╝░ļŗż.
ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØĆ ņłÖļĀ©ļÉ£ ļŗ©ņØ╝ Ļ▓Ćņé¼ņ×ÉņŚÉ ņØśĒĢ┤ ņŗ£Ē¢ēļÉśņŚłĻ│Ā, ņśüņāü ĒÖöņ¦ł ņĀÉņłś 30ņĀÉ ļ»Ėļ¦īņØĖ ņŖżņ║ö ņØ┤ļ»Ėņ¦ĆļŖö ļČäņäØņŚÉņä£ ņĀ£ņÖĖļÉśņŚłļŗż. ļ¬©ļōĀ ĒÖśņ×ÉļŖö ņ┤łņ¦ä ņŗ£ ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ņŗ£Ē¢ē ļ░øņĢśĻ│Ā, ņ┤łņ¦ä ņŗ£ ņśüņāüņØś ņ¦łņØ┤ ņóŗņ¦Ć ņĢŖĻ▒░ļéś ņĢłņĢĢņØ┤ 21 mmHg ņØ┤ņāüņ£╝ļĪ£ ņĢłņĀĢļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉļŖö 3Ļ░£ņøö ņØ┤ļé┤ ļŗżņØī ņÖĖļל ļé┤ņøÉ ņŗ£ņØś Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ļČäņäØņŚÉ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śļŖö ļé┤ņןļÉ£ Glaucoma Module Premium Edition ņåīĒöäĒŖĖņø©ņ¢┤ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļĖīļŻ©Ēü¼ļ¦ē Ļ░£ļ░® ņżæņŗ¼(Bruch's membrane opening center)ņØä ĻĖ░ņżĆņ£╝ļĪ£ 360┬░, 3.5 mm ņ¦üĻ▓ĮņØś ņøÉĒśĢ ņŖżņ║öņØä ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░, ĒÅēĻĘĀĻ░Æ(global thickness)Ļ│╝ ĒĢ©Ļ╗ś ņØ┤ņĖĪ(temporal), ņāüņØ┤ņĖĪ(superotemporal), ņāüļ╣äņĖĪ(superonasal), ļ╣äņĖĪ(nasal), ĒĢśļ╣äņĖĪ(inferonasal), ĒĢśņØ┤ņĖĪ(inferotemporal) 6Ļ░£ņØś ĻĄ¼ņŚŁņ£╝ļĪ£ ļéśļłäņ¢┤ ņĖĪņĀĢĒĢśņśĆļŗż. ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄņØä ņĖĪņĀĢĒĢĀ ļĢīņÖĆ ļÅÖņØ╝ĒĢśĻ▓ī 3.5 mm ņ¦üĻ▓ĮņØś ņøÉĒśĢ ņŖżņ║ö ņé¼ņ¦äņŚÉņä£ Heidelberg Eye Explorer ņåīĒöäĒŖĖņø©ņ¢┤ņØś ļ¦Øļ¦ēņĖĄ ņłśļÅÖ ņäżņĀĢ ĻĖ░ļŖź(manual segmentation function)Ļ│╝ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗ś ņ×ÉļÅÖ ņĖĪņĀĢ ĻĖ░ļŖźņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. ļ¦Øļ¦ēņĖĄ ņłśļÅÖ ņäżņĀĢ ĻĖ░ļŖźņØä ĒåĄĒĢ┤ ļĖīļŻ©Ēü¼ļ¦ēņØś Ļ│Āļ░śņé¼ņäĀ ņÖĖņĖĪņØä ņĢłņ¬Į Ļ▓ĮĻ│äņäĀņ£╝ļĪ£ ņäżņĀĢĒĢśĻ│Ā ļ¦źļØĮļ¦ē-Ļ│Ąļ¦ēņØś Ļ▓ĮĻ│ä(chorioscleral interface)ļź╝ ļ░öĻ╣ź Ļ▓ĮĻ│äņäĀņ£╝ļĪ£ ņäżņĀĢĒĢśņŚ¼ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļ¦źļØĮļ¦ē-Ļ│Ąļ¦ēņØś Ļ▓ĮĻ│äĻ░Ć ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉļŖö ļ¦źļØĮļ¦ēĒśłĻ┤ĆņØä ļ░öĻ╣ź Ļ▓ĮĻ│äņäĀņ£╝ļĪ£ ņäżņĀĢĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż(Fig. 1A). ĒÖ®ļ░śļæÉĻ╗ś(macular thickness)ļŖö ļé┤ņןļÉ£ ņåīĒöäĒŖĖņø©ņ¢┤ņØś Posterior Pole ņĢīĻ│Āļ”¼ņ”śņØä ņé¼ņÜ®ĒĢśņŚ¼, ņżæņŗ¼ņÖĆļź╝ ņżæņŗ¼ņ£╝ļĪ£ 30-25┬░ ļ│╝ļź© ņŖżņ║öņ£╝ļĪ£ ņĖĪņĀĢļÉ£ Ļ░ÆņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗ś ņĖĪņĀĢņØĆ ņżæņŗ¼ņÖĆņÖĆ ļĖīļŻ©Ēü¼ļ¦ē Ļ░£ļ░® ņżæņŗ¼ņØä Ļ┤ĆĒåĄĒĢśļŖö ņäĀĒśĢņØś ņŖżņ║öņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖ®ļ░śĒĢśņŚÉņä£ ļĖīļŻ©Ēü¼ļ¦ē Ļ│Āļ░śņé¼ņäĀņØś ņÖĖņĖĪņŚÉņä£ ļ¦źļØĮļ¦ē-Ļ│Ąļ¦ēņØś Ļ▓ĮĻ│äĻ╣īņ¦Ć ņłśņ¦üņäĀņØä ĻĘĖņ¢┤ ņĖĪņĀĢĒĢśņśĆļŗż(Fig. 1B). ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņĖĪņĀĢņØĆ 2ļ¬ģņØś ņĖĪņĀĢņ×ÉĻ░Ć ļÅģļ”ĮņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, ļæÉ Ļ░ÆņØś ĒÅēĻĘĀņØä ļČäņäØņŚÉ ņØ┤ņÜ®ĒĢśņśĆļŗż.
ņŗ£ņĢ╝Ļ▓Ćņé¼ļŖö Central 30-2 SITA-standard strategyļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ┤łņ¦ä ņŗ£ ņ▓½ ļ▓łņ¦Ė Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, 2Ļ░£ņøö ņØ┤ļé┤ņŚÉ ļæÉ ļ▓łņ¦Ė Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼, ĒĢÖņŖĄ ĒÜ©Ļ│╝ ļ░░ņĀ£ļź╝ ņ£äĒĢ┤ ļæÉ ļ▓łņ¦Ė Ļ▓░Ļ│╝ļź╝ ļČäņäØņŚÉ ņØ┤ņÜ®ĒĢśņśĆļŗż. ņØ┤ ņżæ MDĻ░Ć -12 dBļ│┤ļŗż ļé«ņØĆ Ļ▓ĮņÜ░ļź╝ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņŚ¼ ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ņŗ£ņ╝░Ļ│Ā, ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś ņŗĀļó░ļÅäļź╝ ņ£äĒĢśņŚ¼ 15% ņØ┤ņāüņØś Ļ▒░ņ¦ōņ¢æņä▒(false positive)ņØ┤ļéś Ļ▒░ņ¦ōņØīņä▒(false negative), 20% ņØ┤ņāüņØś ņŻ╝ņŗ£ ņŗżĒī©(fixation loss)Ļ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ ĒĢ┤ļŗ╣ ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś Ļ▓░Ļ│╝ļŖö ļČäņäØņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś MD, pattern standard deviation (PSD)Ļ░ÆņØä ņłśņ¦æĒĢśņśĆļŗż.
IBM SPSS software (IBM Corp., Armonk, NY, USA)ĻĄ░ Ļ░ä ļ╣äĻĄÉļź╝ ņ£äĒĢ┤ t-Ļ▓ĆņĀĢ(independent t-test)Ļ│╝ ņ╣┤ņØ┤ņĀ£Ļ│▒Ļ▓ĆņĀĢ(Žć2 test)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ļæÉ ļ¬ģņØś ņĖĪņĀĢņ×ÉĻ░Ć ņĖĪņĀĢĒĢ£ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņĖĪņĀĢ ņØ╝ņ╣śļÅä ĒÅēĻ░ĆļŖö ĻĖēļé┤ņāüĻ┤ĆĻ│äņłś(intraclass correlation coefficients, ICCs)ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņØĖņ×ÉļŖö ļŗ©ļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņŚ¼ p<0.05ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ļŖö ņØĖņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ļŗżļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļŗżļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ĻĄÉļ×Ćļ│ĆņłśļĪ£ ņ×æņÜ®ĒĢĀ ņłś ņ׳ļŖö ļģ╣ļé┤ņןņØś ļČäļźśņÖĆ ņĢłņĢĢņØä model 1 ļ░Å model 2ļĪ£ ļéśļłäņ¢┤ ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן 87ņĢłĻ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן 46ņĢłņØ┤ ļČäņäØņŚÉ ĒżĒĢ©ļÉśņŚłļŗż. ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×É ņżæ ļé©ņ×ÉļŖö 69ļ¬ģ(79.3%)ņØ┤ņŚłĻ│Ā, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×É ņżæ ļé©ņ×ÉļŖö 23ļ¬ģ(50.0%)ņ£╝ļĪ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņŚÉņä£ ļé©ņä▒ņØś ļ╣äņ£©ņØ┤ ļŹö ļåÆņĢśļŗż(p<0.001). ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 61.89 ┬▒ 13.77ņäĖ, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 63.20 ┬▒ 12.03ņäĖļĪ£ ļæÉ ĻĄ░ ņé¼ņØ┤ņØś ņ░©ņØ┤ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(p=0.587). ĻĖ░ņĀĆņĢłņĢĢņØĆ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņŚÉņä£ 32.63 ┬▒ 7.43 mmHgļĪ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņØś 16.89 ┬▒ 1.72 mmHgļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśņ£╝ļ®░(p<0.001), ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņŗ£ņĀÉņØś ņĢłņĢĢņØĆ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņŚÉņä£ 14.44 ┬▒ 3.44 mmHg, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņŚÉņä£ 12.43 ┬▒ 2.27 mmHgļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż(p=0.001). ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņ£╝ļĪ£ Ļ│äņĖĪĒĢ£ ĒÅēĻĘĀ ņ£ĀļæÉņŻ╝ņ£ä ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śļŖö ņøÉļ░£Ļ░£ļ░®Ļ░ü ļģ╣ļé┤ņןĻĄ░ņŚÉņä£ 46.33 ┬▒ 9.63 ╬╝mļĪ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņŚÉņä£ 56.70 ┬▒ 14.27 ╬╝mļ│┤ļŗż ļé«ņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż(p<0.001). ĒÖ®ļ░śļæÉĻ╗śļŖö ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņŚÉņä£ 302.91 ┬▒ 17.59 ╬╝mļĪ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņØś 315.69 ┬▒ 13.13 ╬╝mļ│┤ļŗż ļé«Ļ▓ī ļéśĒāĆļé¼ļŗż(p<0.001). ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś MD ļ░Å PSD, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś, ņŗ£ļĀź, ņĢłņČĢņן, ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗ś, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ņ£äņČĢņØĆ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(ļ¬©ļæÉ p>0.05) (Table 1).
ļ¦źļØĮļ¦ēļæÉĻ╗śņĖĪņĀĢņØś ņĖĪņĀĢ ņØ╝ņ╣śļÅä ĒÅēĻ░ĆņŚÉņä£, ĒÅēĻĘĀ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ICCsļŖö 99.1% (p<0.001), ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ICCsļŖö 97.6% (p<0.001)ļĪ£ ĒÅēĻ░Ćņ×É Ļ░ä ņóŗņØĆ ņØ╝ņ╣śļÅäļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉņä£ļŖö ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░(212.82 ┬▒ 66.70 ┬Ąm)Ļ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░(198.95 ┬▒ 74.64 ┬Ąm) ņé¼ņØ┤ņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.327). ĒĢśņ¦Ćļ¦ī ĒÅēĻĘĀ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņŚÉņä£ 99.20 ┬▒ 46.85 ┬ĄmļĪ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņØś 121.85 ┬▒ 45.39 ┬ĄmņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņ¢ćņĢśņ£╝ļ®░(p=0.006), ĻĄ¼ņŚŁļ│ä ļ╣äĻĄÉņŚÉņä£ļÅä ļ¬©ļōĀ ņśüņŚŁņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņØ┤ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ¢ćņØĆ ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ļ│┤ņśĆļŗż(ļ¬©ļæÉ p<0.05) (Table 2, Fig. 2A). ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻ│╝ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØś ĻĄ¼ņŚŁļ│ä ļ¦źļØĮļ¦ēļæÉĻ╗ś ņ░©ņØ┤ļź╝ ņé┤ĒÄ┤ļ│┤ņĢśņØä ļĢī, ļ╣äņĖĪ ĻĄ¼ņŚŁņŚÉņä£ Ļ░Ćņן Ēü░ ļæÉĻ╗ś ņ░©ņØ┤ļź╝ ļ│┤ņśĆĻ│Ā ĒÖ®ļ░śĒĢś ļ░Å ĒĢśļ╣äņĖĪņŚÉņä£ Ļ░Ćņן ņ×æņØĆ ļæÉĻ╗ś ņ░©ņØ┤ļź╝ ļéśĒāĆļāłļŗż(Fig. 2B).
ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņØĖņ×ÉļōżņŚÉ ļīĆĒĢ£ ļŗ©ļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ļģ╣ļé┤ņןņØś ļČäļźś(p=0.006), ļéśņØ┤(p=0.004), ņĢłņĢĢ(p=0.012)ņØ┤ ņ£ĀņØśĒĢ£ ņØĖņ×ÉļĪ£ ļéśĒāĆļé¼ļŗż. ņØ┤ņŚÉ ļīĆĒĢśņŚ¼ ļģ╣ļé┤ņןņØś ļČäļźś ļ░Å ļéśņØ┤ļź╝ ĒżĒĢ©ĒĢ£ model 1 ļŗżļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ ļģ╣ļé┤ņןņØś ļČäļźś(p=0.007) ļ░Å ļéśņØ┤(p=0.005) ļ¬©ļæÉ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆļÉ£ ņ£ĀņØśĒĢ£ ņØĖņ×ÉņśĆņ£╝ļ®░, ļéśņØ┤ ļ░Å ņĢłņĢĢņØä ĒżĒĢ©ĒĢ£ model 2 ļŗżļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ļÅä ļéśņØ┤(p=0.013), ņĢłņĢĢ(p=0.024) ļ¬©ļæÉ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆļÉ£ ņ£ĀņØśĒĢ£ ņØĖņ×ÉļĪ£ ļéśĒāĆļé¼ļŗż(Table 3). ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņØĖņ×ÉļōżņŚÉ ļīĆĒĢ£ ļŗ©ļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆ ļČäņäØņŚÉņä£ ļéśņØ┤(p=0.003) ļ░Å ĒÖ®ļ░śļæÉĻ╗ś(p=0.003)Ļ░Ć ņ£ĀņØśĒĢ£ ņØĖņ×ÉļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░, ļæÉ ļ│ĆņłśņŚÉ ļīĆĒĢ£ ļŗżļ│Ćļ¤ē ņäĀĒśĢĒÜīĻĘĆļČäņäØņŚÉņä£ļÅä ļéśņØ┤(p=0.029)ņÖĆ ĒÖ®ļ░śļæÉĻ╗ś(p=0.002) ļ¬©ļæÉ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(Table 4).
ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØś ļ│æņØĖņŚÉņä£ ļ¦źļØĮļ¦ēņØś ņŚŁĒĢĀņØĆ ņĢäņ¦üĻ╣īņ¦Ć ļ¬ģĒÖĢĒ׳ ĻĘ£ļ¬ģļÉśņ¦Ć ņĢŖņĢśņ£╝ļéś, ņŗ£ņŗĀĻ▓ĮņØś ĒŚłĒśłņä▒ ņåÉņāü ņØ┤ļĪĀĻ│╝ ĒĢ©Ļ╗ś ļ¦Øļ¦ēņÖĖņĖĄ ļ░Å ņĀäņé¼ņāüĒīÉņŚÉ ĒśłņĢĪ ņł£ĒÖśņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ļ¦źļØĮļ¦ēņØ┤ ļģ╣ļé┤ņן ļ│æĒā£ņāØļ”¼ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ ņłś ņ׳ņØīņØ┤ ņĀ£ņŗ£ļÉ£ ļ░ö ņ׳ļŗż[3-8]. ņØ┤ļŖö ļģ╣ļé┤ņן ĒÖśņ×ÉņØś ĒśĢĻ┤æņĢłņĀĆņ┤¼ņśüņŚÉņä£ ļ¦źļØĮļ¦ē ņČ®ļ¦īņØ┤ ņ¦ĆņŚ░ļÉśĻ│Ā ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ē ņČ®ļ¦ī Ļ▓░ņåÉņØ┤ ļæÉļō£ļ¤¼ņ¦ĆĻ▓ī Ļ┤Ćņ░░ļÉśļŖö Ļ▓āņØ┤ļéś, ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉ ļīĆĒĢ£ ņĪ░ņ¦üĒĢÖņĀü ņŚ░ĻĄ¼ņŚÉņä£ ļ¦źļØĮļ¦ēĒśłĻ┤ĆņØś ņ¦üĻ▓Į ņłśņČĢ ļ░Å ĒśłĻ┤Ć ļ░ĆļÅäņØś Ļ░ÉņåīļĪ£ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░Éņåīļź╝ ļ│┤ņśĆļŗżļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ļÅä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż[22,23]. ĒŖ╣Ē׳ ĒĢ£ĻĄŁņØĖņŚÉņä£ Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØś 77%ļź╝ ņ░©ņ¦ĆĒĢśļ®░, ņĢäņŗ£ņĢä ņØĖņóģņŚÉņä£ ļåÆņØĆ ņ£Āļ│æļźĀņØä ļ│┤ņØ┤ļŖö ņĀĢņāüņĢłņĢĢ ļģ╣ļé┤ņןņØĆ ņĢłņĢĢņØś ņśüĒ¢ź ņÖĖņŚÉļÅä ļŗżļźĖ ļ│æņØĖņØ┤ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[9,24-26]. ĒŖ╣Ē׳, ĒśłĻ┤Ć Ēś╣ņØĆ ĒśłļźśĒĢÖņĀüņØĖ ņĪ░ņĀł ņןņĢĀĻ░Ć ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ│æņØĖņŚÉ ņżæņÜöĒĢ£ ņØĖņ×É ņżæ ĒĢśļéśļĪ£ ņāØĻ░üļÉśĻ│Ā ņ׳ņ£╝ļ®░ ļ¦Éņ┤łĒśłĻ┤ĆņןņĢĀ, ĒÄĖļæÉĒåĄ, ņŚ¼ņä▒ņŚÉņä£ ļŹö ļ¦ÄņØĆ ņ£Āļ│æļźĀ ļō▒ņØ┤ ņØ┤ļ¤¼ĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļÆĘļ░øņ╣©ĒĢ£ļŗż[10,27-30].
ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņĀĢņāüņØĖņŚÉ ļ╣äĒĢ┤ ņ¢ćņĢśņ£╝ļ®░[11-13], ĒŖ╣Ē׳ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןļ│┤ļŗż ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļŹö ņ¢ćņĢśļŗżĻ│Ā ĒĢśņśĆļŗż[14-16]. ļ░śļ®┤ņŚÉ ņĀĢņāüņĢłĻ│╝ ļģ╣ļé┤ņןņĢł ņé¼ņØ┤ņŚÉ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåļŗżļŖö ņŚ░ĻĄ¼ļōżļÅä ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ņ¢┤ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ļģ╣ļé┤ņןĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØ┤ ļ¬ģĒÖĢĒ׳ ĻĘ£ļ¬ģļÉ£ Ļ▓āņØĆ ņĢäļŗłļŗż[17-20]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ļČäņäØņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņØś ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ņ¢ćņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņ¦ĆĻĖłĻ╣īņ¦Ć ĒĢ£ĻĄŁņØĖņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņŚÉņä£ņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ļīĆĒĢ£ ļ╣äĻĄÉ ņŚ░ĻĄ¼ļŖö ļČĆņĪ▒ĒĢśļ®░ ļģ╣ļé┤ņןņØś ļČäļźśņŚÉ ļö░ļźĖ ļ╣äĻĄÉ ļ░Å Ļ░ü ņØĖņ×ÉļōżņØś ņāüĻ┤ĆĻ┤ĆĻ│äņŚÉ ļīĆĒĢ£ ļČäņäØņØĆ ņŚåņ¢┤, ļ│Ė ņŚ░ĻĄ¼ļŖö ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ļīĆĒĢ£ ĻĘ╝Ļ▒░ ņ×ÉļŻīļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗżļŖö ņĀÉņŚÉņä£ ņżæņÜöĒĢ£ ņØśņØśļź╝ Ļ░Ćņ¦ł Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņØś ĒÖ®ļ░śĒĢś ļ░Å ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö 212.82 ┬▒ 66.70 ┬Ąm ļ░Å 121.85 ┬▒ 45.39 ┬ĄmņśĆņ£╝ļ®░, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņŚÉņä£ļŖö Ļ░üĻ░ü 198.95 ┬▒ 74.64 ┬Ąm ļ░Å 99.20 ┬▒ 46.85 ┬ĄmņśĆļŗż. ļģ╣ļé┤ņןņØ┤ ņŚåļŖö ņĀĢņāü ĒĢ£ĻĄŁņØĖņØś ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö Kim et al [31]ņØś ņŚ░ĻĄ¼ņŚÉņä£ 307.26 ┬▒ 95.18 ╬╝m, Park et al [32]ņØś ņŚ░ĻĄ¼ņŚÉņä£ 309.57 ┬▒ 56.44 ╬╝mļĪ£ ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļŖö Sacconi et al [33]ņØś ņŚ░ĻĄ¼ņŚÉņä£ ļ░£Ēæ£ĒĢ£ ņ¦äĒ¢ēļÉ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņŚÉņä£ņØś ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ¢ćņĢśļŗżļŖö Ļ▓░Ļ│╝ņÖĆ ļ╣äņŖĘĒĢśĻ▓ī ņāØĻ░üĒĢ┤ ļ│╝ ņłśļÅä ņ׳Ļ▓Āņ£╝ļéś, ļ│Ė ņŚ░ĻĄ¼ņÖĆ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōż ņé¼ņØ┤ņŚÉ ļČäņäØ ļīĆņāüņ×ÉņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ ļ░Å ņä▒ļ│ä, ņĢłņČĢņן ļō▒ņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ņ¢┤ ņ¦üņĀæņĀüņ£╝ļĪ£ ļ╣äĻĄÉĒĢśļŖö ļŹ░ņŚÉ ļ¼┤ļ”¼Ļ░Ć ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļśÉĒĢ£ ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļéśņØ┤ ļ░Å ņĢłņČĢņןĻ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ļåÆņ£╝ļ®░, ļģ╣ļé┤ņןņØś ņżæņ”ØļÅäņÖĆļŖö ņ¦üņĀæņĀüņØĖ Ļ┤ĆļĀ©ņØ┤ ņŚåļŗżļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ņ¢┤, ņČöĒøä ĻĄÉļ×Ćļ│Ćņłśļź╝ ĒåĄņĀ£ĒĢ£ ļīĆņĪ░ĻĄ░Ļ│╝ņØś ņČöĻ░ĆņĀüņØĖ ļ╣äĻĄÉ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśĻ▓Āļŗż. ĒĢ£ĒÄĖ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░Ļ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ ņé¼ņØ┤ņŚÉ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŖöļŹ░, ņØ┤ļŖö ņØ┤ņĀäņØś ņŚ░ĻĄ¼ļōżĻ│╝ Ļ░ÖņØĆ Ļ▓░Ļ│╝ļĪ£ņä£[14,19,34], ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ļģ╣ļé┤ņן ļ│æņØĖņØś ņÜöņåīļĪ£ ņāØĻ░üĒĢśĻĖ░ņŚÉ ĒĢ£Ļ│äĻ░Ć ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż.
ĻĄ¼ņŚŁļ│ä ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗ś ļČäĒżļź╝ ļ│┤ļ®┤, ļæÉ ĻĄ░ ļ¬©ļæÉ ņØ┤ņĖĪĻ│╝ ņāüņØ┤ņĖĪņŚÉņä£ Ļ░Ćņן ļæÉĻ║╝ņÜ┤ Ļ▓ĮĒ¢źņØ┤ ņ׳ņŚłĻ│Ā ĒĢśņØ┤ņĖĪĻ│╝ ĒĢśļ╣äņĖĪņŚÉņä£ Ļ░Ćņן ņ¢ćņØĆ Ļ▓ĮĒ¢źņØä ļ│┤ņśĆņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ĻĄ¼ņŚŁļ│ä ļæÉĻ╗ś ļČäĒżļŖö ņĀĢņāü ņĢäņŗ£ņĢäņØĖņØä ļīĆņāüņ£╝ļĪ£ Ē¢łļŹś ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ņØś Ļ▓░Ļ│╝ņÖĆ ļ╣äņŖĘĒĢ£ ņ¢æņāüņØ┤ņŚłļŗż[35]. ĻĄ¼ņŚŁļ│ä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤ņØś ņøÉņØĖņØĆ ņĢäņ¦üĻ╣īņ¦Ć ļČäļ¬ģĒĢśĻ▓ī ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, ņŗ£ņŗĀĻ▓ĮņØś ļ░£ņāØ Ļ│╝ņĀĢ ņżæ optic fissureĻ░Ć ĒĢśņĖĪņŚÉ ņ£äņ╣śĒĢśņŚ¼ optic cupņØś ĒĢśņĖĪņØ┤ Ļ░Ćņן ļŖ”Ļ▓ī ļŗ½Ē׳ļŖö Ļ▓āņØ┤ ĒĢśņĖĪņØś ļŹö ņ¢ćņØĆ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśĻ│Ā ņ׳ļŗż[36]. ņØ┤ļ¤¼ĒĢ£ ņĀÉņØĆ ņØ┤ņĀäņØś ņŚ░ĻĄ¼ņŚÉņä£ ņŚ░ļĀ╣ņŚÉ ļö░ļźĖ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīĻ░Ć ĒĢśņĖĪ ļČĆņ£äņŚÉņä£ Ļ░Ćņן ņ╗ĖļŗżļŖö Ļ▓░Ļ│╝ņÖĆ ņŚ░Ļ┤Ćņ¦Ćņ¢┤ ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓ĀĻ│Ā, ļśÉĒĢ£ ļģ╣ļé┤ņןņä▒ ņåÉņāüņØ┤ ņŗ£ņŗĀĻ▓ĮņØś ĒĢśņĖĪņŚÉņä£ Ļ░Ćņן ņĘ©ņĢĮĒĢ£ Ļ▓āĻ│╝ļÅä Ļ┤ĆļĀ©ņØ┤ ņ׳ņØä ņłś ņ׳ņØīņØä ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż[37]. ņŗżņĀ£ļĪ£ Ļ│╝Ļ▒░ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ĒĢśņØ┤ņĖĪ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ņåÉņāüņØ┤ ļŹö ņŗ¼ĒĢ£ Ļ▓ĮņÜ░ ĒĢśņØ┤ņĖĪņØś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļŹö ņ¢ćņĢśļŗżļŖö Ļ▓░Ļ│╝ļÅä ļ░£Ēæ£ļÉ£ ļ░ö ņ׳ļŗż[11].
ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ņĢłņŚÉņä£ņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļŖö ņŚ░ĻĄ¼ņ×ÉņŚÉ ļö░ļØ╝ ņØ┤Ļ▓¼ņØ┤ ņ׳ņ¦Ćļ¦ī, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻ│╝ ņ¢ćņØĆ ļ¦źļØĮļ¦ēļæÉĻ╗ś ņé¼ņØ┤ņØś ņŚ░Ļ┤Ćņä▒ņØĆ ļ╣äĻĄÉņĀü ņØ╝Ļ┤ĆļÉśĻ▓ī ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļ░Å ļé«ņØĆ ĻĖ░ņĀĆ ņĢłņĢĢņØĆ ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņØīņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. ņØ┤ļŖö Jin et al [16]Ļ│╝ Park et al [14]ņØś ņŚ░ĻĄ¼ņŚÉņä£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņŚÉ ļ╣äĒĢ┤ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ¢ćņĢśļŹś Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśļŖö ļČĆļČäņØ┤ļŗż. ĻĘĖļ¤¼ļéś ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņØĆ ļČäņäØņŚÉ ĒżĒĢ©ļÉ£ ĒÖśņ×ÉļōżņØś ĒÅēĻĘĀ MD Ļ░ÆņØ┤ Ļ░üĻ░ü -4 dBĻ│╝ -5 dB ņĀĢļÅäļĪ£ ļ│Ė ņŚ░ĻĄ¼ņØś ļģ╣ļé┤ņן ĒÖśņ×ÉļōżņŚÉ ļ╣äĒĢ┤ ļģ╣ļé┤ņן ņ¦äĒ¢ē ņĀĢļÅäĻ░Ć Ļ▓ĮĒĢ£ ĒÖśņ×ÉļōżņØ┤ņŚłļŗżļŖö ņ░©ņØ┤Ļ░Ć ņ׳ņ£╝ļ®░, ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņŚÉņä£ļÅä ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņĢłĻ│╝ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņĢł ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤Ļ░Ć ņ׳ņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņ¦¦ņØĆ ļÆżņä¼ļ¬©ņ▓┤ļÅÖļ¦źņŚÉņä£ ņ£ĀļלļÉ£ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēņØĆ ņŗ£ņŗĀĻ▓ĮņØś ņĀäņé¼ņāüĒīÉ ĒśłņĢĪ Ļ│ĄĻĖēĻ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳ņ£╝ļ»ĆļĪ£ ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēņØ┤ ņĀäņé¼ņāüĒīÉņĪ░ņ¦üņØś Ļ┤ĆļźśļČĆņĀäņØä ņ┤łļלĒĢśņŚ¼ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ│æņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ ņłś ņ׳ļŗżļŖö ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ Ļ│ĀļĀżĒĢśņśĆņØä ļĢī, ļ│Ė ņŚ░ĻĄ¼ļŖö ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēņØ┤ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓ĮņåÉņāüĻ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņØä ņłś ņ׳ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņĢłņĢĢņØ┤ ļé«ņØĆ ļłłņŚÉņä£ ļŹö ņżæņÜöĒĢĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØä ņŗ£ņé¼ĒĢśļŖö Ļ▓░Ļ│╝ļØ╝Ļ│Ā ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż[4]. ĒĢśņ¦Ćļ¦ī ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ĒåĄĒĢ£ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņĖĪņĀĢņØĆ ļ¦źļØĮļ¦ēņØś ņĀĢņĀüņØĖ ĻĄ¼ņĪ░ļ¦īņØä ļ░śņśüĒĢĀ ļ┐É, ļ¦źļØĮļ¦ēņØś ĒśłļźśĒĢÖņĀü ļ│ĆĒÖö ļ░Å Ļ┤ĆļźśņĢĢņØś ņ░©ņØ┤ļź╝ ļ░śņśüĒĢ£ļŗżĻ│Ā ĒĢĀ ņłś ņŚåņ£╝ļ®░, Ļ▒┤Ļ░ĢĒĢ£ ņé¼ļ×īļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ Ēśłļźś ņé¼ņØ┤ņŚÉ ņŚ░Ļ┤Ćņä▒ņØ┤ ņŚåļŗżļŖö ņŚ░ĻĄ¼ļÅä ņ׳ņ¢┤ ļ¦źļØĮļ¦ēņØ┤ ļģ╣ļé┤ņןņŚÉņä£ Ļ░¢ļŖö ņ×äņāüņĀü ņØśļ»ĖņŚÉ ļīĆĒĢ┤ņä£ļŖö Ē¢źĒøä ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśĻ▓Āļŗż[38,39].
ļéśņØ┤ļŖö ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŖö ņØĖņ×ÉļĪ£ ņל ņĢīļĀżņĀĖ ņ׳ļŗż[32,35,40,41]. ĻĘĖ ņÖĖ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŖö ņØĖņ×ÉļĪ£ ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗ś, ņĢłņĢĢ, ĒśłņĢĢ ļ░Å ņØ┤ņÖäĻĖ░ ņĢłĻĄ¼Ļ┤ĆļźśņĢĢ ļō▒ņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[16,35,40-42]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļŗżļ│Ćļ¤ē ļČäņäØņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļ░Å ļé«ņØĆ ĻĖ░ņĀĆ ņĢłņĢĢ ļ┐Éļ¦ī ņĢäļŗłļØ╝ Ļ│ĀļĀ╣ņØ┤ ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĀĢņāüņØĖ ļ░Å ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ļéśņØ┤Ļ░Ć 10ņäĖ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņĢĮ 9-31 ╬╝mņØś Ļ░Éņåīļź╝ ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśļŖöļŹ░[35,40-45], ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļéśņØ┤Ļ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļźĖ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ Ļ░ÉņåīĻ░Ć ņ׳ņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĻĘĖ ņøÉņØĖņ£╝ļĪ£ļŖö ļ¦źļØĮļ¦ēņØĆ ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ņŻ╝ļĪ£ ĒśłĻ┤ĆņĪ░ņ¦ü ļ░Å ĻĖ░ņ¦łņĪ░ņ¦üņ£╝ļĪ£ ĻĄ¼ņä▒ņØ┤ ļÉśļŖöļŹ░ ņØ┤ļ¤¼ĒĢ£ ņÜöņåīļōżņØ┤ ļéśņØ┤Ļ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ░ÉņåīĒĢśĻ▓ī ļÉśĻ│Ā, ņØ┤ļ¤¼ĒĢ£ Ļ▓ĮĒ¢źņä▒ņØĆ ļģ╣ļé┤ņןņØ┤ ņ¦äĒ¢ēļÉśļŹöļØ╝ļÅä ļ│ĆĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ĒĢ┤ņäØĒĢĀ ņłś ņ׳Ļ▓Āļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĒÖ®ļ░śļæÉĻ╗śĻ░Ć ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņÜöņØĖņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņŚÉņä£ļÅä ĒÖ®ļ░śļæÉĻ╗śņÖĆ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņØīņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż[46,47]. ĒĢ┤ļČĆĒĢÖņĀüņ£╝ļĪ£ ļ¦Øļ¦ē ņżæņŗ¼ņÖĆļŖö ļ¦Øļ¦ēļ¬©ņäĖĒśłĻ┤ĆņØ┤ ņŚåņ¢┤ ļ¼┤ĒśłĻ┤Ćņä▒ ņśüņŚŁņØ┤ ļÉśļ®░, ņØ┤ ņśüņŚŁņØĆ ļ¦źļØĮļ¦ēĒśłĻ┤ĆņŚÉ ņØśĒĢ┤ņä£ļ¦ī ņśüņ¢æņØä Ļ│ĄĻĖēļ░øņ£╝ļ»ĆļĪ£[48], ļ¦źļØĮļ¦ē ņł£ĒÖśņŚÉ ĒŖ╣Ē׳ ņĘ©ņĢĮĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņśüĒ¢źņ£╝ļĪ£ ņØĖĒĢ£ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ĒÖ®ļ░śļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ņäżļ¬ģĒĢ┤ļ│╝ ņłś ņ׳Ļ▓Āļŗż. Ļ│ĀļÅäĻĘ╝ņŗ£ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ļ¦źļØĮļ¦ēņØ┤ ņ¢ćņĢäņ¦Ćļ®┤ ļ¦źļØĮļ¦ē ņł£ĒÖśņØ┤ ņāüļīĆņĀüņ£╝ļĪ£ Ļ░ÉņåīĒĢśņŚ¼ ļīĆņé¼ņĀüņ£╝ļĪ£ Ļ░Ćņן ĒÖ£ļ░£ĒĢ£ ņżæņŗ¼ņÖĆ ņśüņŚŁņŚÉ ĒĢäņÜöĒĢ£ ņé░ņåī ļ░Å ņśüņ¢æņåī ņĀäļŗ¼ņØ┤ Ļ░ÉņåīļÉĀ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż[49]. ĻĘĖļ¤¼ļéś ļ¦źļØĮļ¦ēļæÉĻ╗ś Ļ░ÉņåīĻ░Ć ļ¦źļØĮļ¦ē ņł£ĒÖś ļČĆņĀäņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ĆļŖöņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢäņ¦ü ļČłļČäļ¬ģĒĢśļ®░, ļŗ©ļ®┤ņĀü ļööņ×ÉņØĖņØś ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ņä£ļŖö ļæś ņé¼ņØ┤ņØś ņŚ░Ļ┤Ćņä▒ņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ļź╝ ņ¢╗ĻĖ░ ņ¢┤ļĀżņøī, ĒÖ®ļ░śļæÉĻ╗śņÖĆ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņāüĻ┤ĆĻ┤ĆĻ│äņŚÉ ļīĆĒĢ£ ļČĆļČäņØĆ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż[38].
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░Ļ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņØś ļé©ļģĆ ļ╣äņ£©ņØ┤ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļŖö ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņŚÉņä£ļŖö ļé©ņä▒ņØ┤, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ļŖö ņŚ¼ņä▒ņØś Ļ░üĻ░ü ļŹö ļåÆņØĆ ļ╣äņ£©ņØä ļ│┤ņØĖ ņØ┤ņĀäņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśļŖö ļČĆļČäņØ┤ļŗż[50-52]. ņØ╝ļČĆ ņŚ░ĻĄ¼ņŚÉņä£ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ļé©ņä▒ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆĻ▓ī ļéśĒāĆļé¼ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ņ¢┤ ņØ┤ļ¤¼ĒĢ£ ņĀÉņØ┤ ļæÉ ĻĄ░ Ļ░ä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤ņŚÉ ņśüĒ¢źņØä ļ»Ėņ│żņØä Ļ░ĆļŖźņä▒ļÅä ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż[53,54]. ļé©ņä▒ņØś ļłłņØ┤ ļŹö Ēü¼Ļ│Ā, ĒśĖļź┤ļ¬¼ņĀü ņāüĒā£ ļ░Å ņŚ¼ņä▒ņØś ĒÅÉĻ▓ĮņØ┤ ļ¦źļØĮļ¦ē Ēśłļźś ņł£ĒÖśņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¢┤ ņä▒ļ│äņØś ņ░©ņØ┤Ļ░Ć ņ׳ļŗżļŖö ņäżļ¬ģņØ┤ ņ׳ļŗż[55-57]. ĒĢśņ¦Ćļ¦ī ļśÉ ļŗżļźĖ ņŚ░ĻĄ¼ļōżņŚÉņä£ļŖö ņä▒ļ│äņØ┤ ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņØīņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░[11,31,35,44], ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļŗ©ļ│Ćļ¤ē ļČäņäØņŚÉņä£ ņä▒ļ│äņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ░Å ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢä, ĻĄ░ Ļ░ä ņä▒ļ│äņØś ņ░©ņØ┤Ļ░Ć ļ¦źļØĮļ¦ēļæÉĻ╗ś ļČäņäØņŚÉ ņśüĒ¢źņØä ļ»Ėņ│żņØä Ļ░ĆļŖźņä▒ņØĆ ļé«ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
ļśÉĒĢ£ ĒØźļ»ĖļĪŁĻ▓īļÅä ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØś ņŗ£ņĢ╝Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļŖö ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś, ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄļæÉĻ╗śļŖö ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļé«Ļ▓ī ļéśĒāĆļé¼ļŗż. ņ▓½ ļ▓łņ¦Ė, ņØ┤ņŚÉ ļīĆĒĢ£ ņØ┤ņ£ĀļĪ£ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņŚÉņä£ļŖö ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü Ļ▓░Ļ│╝ņ╣śĻ░Ć ļ░öļŗźĒÜ©Ļ│╝ņŚÉ ĻĘ╝ņĀæĒĢśņŚ¼ ņĢĮĒĢ£ ĻĄ¼ņĪ░-ĻĖ░ļŖź ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ļ¦ÉĻĖ░ļģ╣ļé┤ņןņŚÉņä£ļÅä ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śĻ░Ć 45-55 ╬╝m ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļŖö ļō£ļ¼╝ļ®░, ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņĀäņ▓┤ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄļæÉĻ╗śĻ░Ć ņĢĮ 50 ╬╝mņŚÉ ļŗ¼ĒĢśĻ▓ī ļÉśļ®┤ ļ░öļŗźĒÜ©Ļ│╝ļĪ£ ņØĖĒĢ┤ ĻĄ¼ņĪ░-ĻĖ░ļŖź ņāüĻ┤ĆĻ┤ĆĻ│ä ĻĘĖļלĒöäĻ░Ć ņÖäļ¦īĒĢ┤ņ¦äļŗżĻ│Ā ĒĢśņśĆļŗż[58,59]. ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉ£ ĒÖśņ×ÉļōżņØś ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄļæÉĻ╗śļŖö ļ╣äĻĄÉņĀü ņØ┤ņŚÉ ĻĘ╝ņĀæĒĢ£ ņłśņ╣śļĪ£ ņŗ£ņĢ╝Ļ▓Ćņé¼ņāüņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņØīņŚÉļÅä ņĢĮĒĢ£ ĻĄ¼ņĪ░-ĻĖ░ļŖź ņāüĻ┤ĆĻ┤ĆĻ│äļĪ£ ņØĖĒĢ┤ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄļæÉĻ╗śņŚÉņä£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņØä ņłś ņ׳ļŗż. ļæśņ¦Ė, ļ╣äļĪØ ņŗ£ņĢ╝Ļ▓Ćņé¼ņāü ĻĘĖ ņ░©ņØ┤Ļ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦ĆļŖö ņĢŖņĢśņ¦Ćļ¦ī, ņŗżņĀ£ļĪ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░ņØ┤ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ņŚÉ ļ╣äĒĢ┤ ļģ╣ļé┤ņןņØ┤ ļŹö ņ¦äĒ¢ēļÉ£ ņāüĒā£ņśĆņØä Ļ░ĆļŖźņä▒ņØ┤ļŗż. ņČöĒøä ļ│┤ļŗż ļ¦ÄņØĆ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦äļŗżļ®┤, ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ£ ļ│┤ļŗż ļČäļ¬ģĒĢ£ ĒĢ┤ņäØņØä ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ļŖö ņ▓½ņ¦Ė, ņĀĢņāü ļīĆņĪ░ĻĄ░Ļ│╝ņØś ļ╣äĻĄÉĻ░Ć ņŚåļŗżļŖö ņĀÉņØ┤ļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņĢłņŚÉņä£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻĄ░Ļ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןĻĄ░ ņé¼ņØ┤ņŚÉ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ņØīņØä ĒÖĢņØĖĒĢ£ ņĀÉņŚÉ ņżæņÜöĒĢ£ ņØśņØśĻ░Ć ņ׳ņØä Ļ▓āņØ┤ļŗż. ņČöĒøä ņĀĢņāü ļīĆņĪ░ĻĄ░Ļ│╝ņØś ļ╣äĻĄÉ ņŚ░ĻĄ¼Ļ░Ć ņČöĻ░ĆņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦äļŗżļ®┤ ņ×äņāüņĀüņ£╝ļĪ£ ļ│┤ļŗż ņ£ĀņÜ®ĒĢ£ ņĀĢļ│┤ļź╝ ņżä ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż. ļæśņ¦Ė, ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŖö ņłśņČĢĻĖ░ ļ░Å ņØ┤ņÖäĻĖ░ ĒśłņĢĢ, Ļ│ĀĒśłņĢĢ ļ░Å ļŗ╣ļć© ļō▒ņØś ņĀäņŗĀņØĖņ×ÉņŚÉ ļīĆĒĢ£ ļČäņäØņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢśļŗżļŖö ņĀÉņØ┤ļŗż. ņĀäņŗĀņØĖņ×ÉņØś ņśüĒ¢źņØä Ļ│ĀļĀżĒĢ£ ņČöĻ░ĆņĀüņØĖ ļČäņäØņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦äļŗżļ®┤ ļģ╣ļé┤ņןņĢłņŚÉņä£ņØś ļ¦źļØĮļ¦ēņØś ļ│ĆĒÖö ļ░Å ņŚŁĒĢĀņØä ĻĘ£ļ¬ģĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉĀ Ļ▓āņØ┤ļŗż. ņģŗņ¦Ė, ņĢłņĢĢņØ┤ ņĪ░ņĀłļÉśņ¦Ć ņĢŖņØĆ ņāüĒā£ņŚÉņä£ņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ļīĆĒĢ£ ņĖĪņĀĢņØ┤ ĒĢäņÜöĒĢĀ ņłś ņ׳Ļ▓Āļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļé«ņØĆ ĻĖ░ņĀĆņĢłņĢĢņØ┤ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŖöļŹ░, ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØś ņŗ£ņĀÉņØĆ ņĢłņĢĢņØ┤ ņĪ░ņĀłļÉśļŖö ņāüĒā£ņŚÉņä£ ņĖĪņĀĢĒĢ£ Ļ▓āņØ┤ņŚłļŗż. ņČöĒøä ņĢłņĢĢņØ┤ ļåÆņØĆ ĒÖśņ×ÉļōżņŚÉņä£ ņ╣śļŻī ņĀä Ļ│ĀņĢłņĢĢ ņāüĒā£ņŚÉņä£ņØś ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ ņĖĪņĀĢĒĢśņŚ¼ ļ╣äĻĄÉĒĢ£ļŗżļ®┤ ļģ╣ļé┤ņןņØś ļ│æņØĖĻ│╝ ļ¦źļØĮļ¦ēļæÉĻ╗ś ņé¼ņØ┤ņØś ņŚ░Ļ┤Ćņä▒ņØä ĻĘ£ļ¬ģĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļäĘņ¦Ė, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļæÉ ĻĄ░ ņé¼ņØ┤ņØś Ēæ£ļ│Ė ņłśĻ░Ć ĻĘĀļō▒ĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. ņÜ░ļ”¼ļéśļØ╝ ļģ╣ļé┤ņן ņ£Āļ│æļźĀņØĆ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØ┤ ļŹö ļ¦ÄņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ¦ÉĻĖ░ļģ╣ļé┤ņן ĒÖśņ×É ņżæ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ ļé┤ņןņØś ļ╣äņ£©ņØ┤ ļåÆņĢśļŖöļŹ░, ņØ┤ļŖö 3ņ░© ĻĖ░Ļ┤ĆņØś ĒŖ╣ņä▒ņāü ņĢłņĢĢ ņĪ░ņĀłņØ┤ ņל ļÉśņ¦Ć ņĢŖņØĆ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļ¦ÄņĢä ļČłĻĘĀļō▒ĒĢśĻ▓ī ļČäĒżļÉ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņĢłņØĆ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņĢłņŚÉ ļ╣äĒĢ┤ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ¢ćņĢśļŗż. ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņןņŚÉņä£ ļé«ņØĆ ĻĖ░ņĀĆņĢłņĢĢ ļ░Å ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן, Ļ│ĀļĀ╣ņØĆ ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆļÉ£ ņżæņÜöĒĢ£ ņØĖņ×ÉņśĆļŗż. ļģ╣ļé┤ņןņØś ļČäļźśņŚÉ ļö░ļźĖ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śņŚÉ ņ░©ņØ┤ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśņ£╝ļéś, ļéśņØ┤ ļ░Å ĒÖ®ļ░śļæÉĻ╗śņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤ĆņØ┤ ņ׳ņŚłļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ļŖö ņ¢ćņØĆ ņ£ĀļæÉņŻ╝ņ£ä ļ¦źļØĮļ¦ēĻ│╝ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ│æņØĖņØś ņŚ░Ļ┤Ćņä▒ņØä ņŗ£ņé¼ĒĢĀ ņłś ņ׳ņ£╝ļéś, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£äņØś ļ¦źļØĮļ¦ēņØ┤ ļģ╣ļé┤ņןņØś ļ░£ņāØ ļ░Å ņ¦äĒ¢ēņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖöņ¦ĆņŚÉ ļīĆĒĢ£ ņŚ¼ļČĆļź╝ ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
Figure┬Ā1.
Measurement of choroidal thickness. (A) Circular peripapillary scan of 3.5 mm is obtained. After the manual segmentation of basement membrane (red solid line) and the chorioscleral border (green solid line), peripapillary choroidal thickness was calculated. The global and the 6 Garway-Heath regional values of spectral domain optical coherence tomography (nasosuperior, nasal, nasoinferior, temporoinferior, temporal, temporosuperior) was used. (B) Enhanced depth imaging horizontal scan passing through the center of the fovea was used to measure subfoveal choroidal thickness.
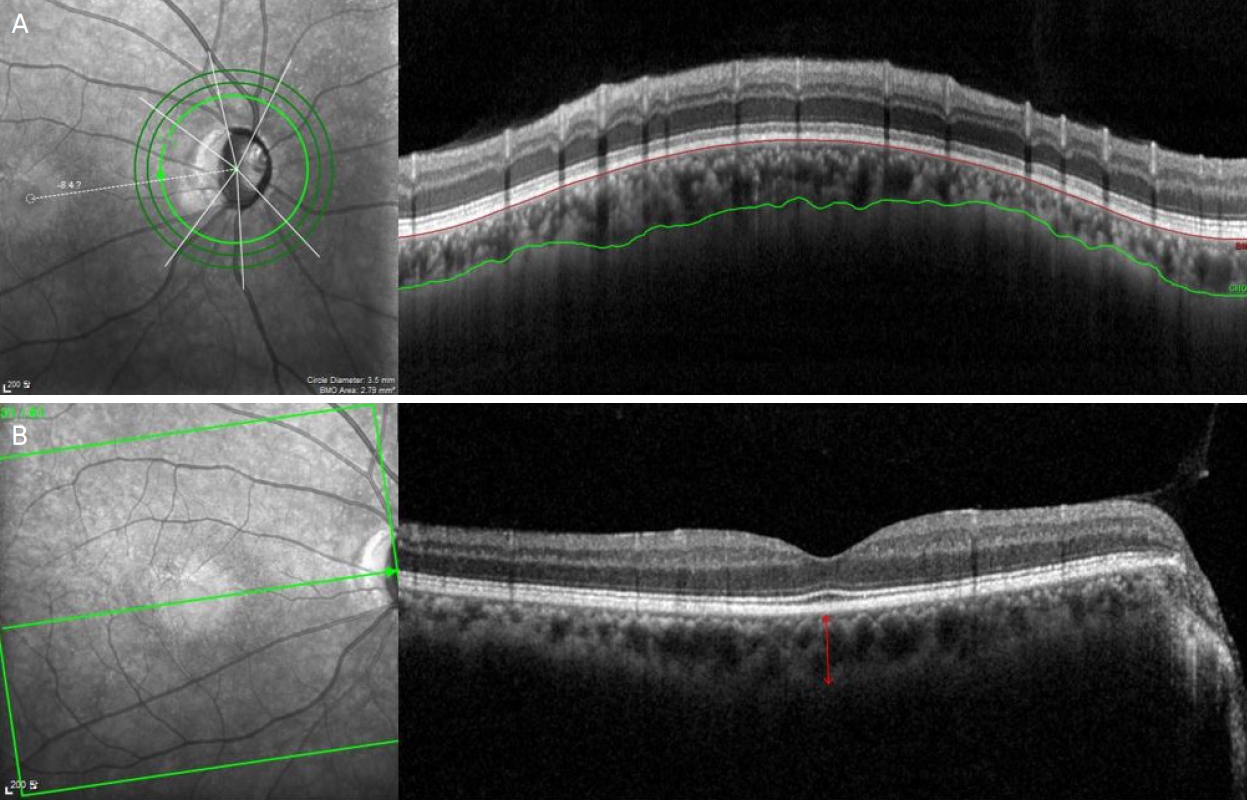
Figure┬Ā2.
The distribution of subfoveal and peripapillary choroidal thickness of primary open angle glaucoma (POAG) and normal tension glaucoma (NTG). (A) Subfoveal choriodal thickness, global and sectoral peripapillary choroidal thickness are shown. Red asterisks show a significant difference between the groups. (B) Difference between POAG and NTG are shown.
Table┬Ā1.
Demographics and ocular characteristics of the eyes with advanced glaucoma
| POAG (n = 87) | NTG (n = 46) | p-value* | |
|---|---|---|---|
| Age (years) | 61.89 ┬▒ 13.77 | 63.20 ┬▒ 12.03 | 0.587 |
| Sex (male/female) | 69/18 | 23/23 | <0.001 |
| Baseline IOP (mmHg) | 32.63 ┬▒ 7.43 | 16.89 ┬▒ 1.72 | <0.001 |
| IOP at imaging (mmHg) | 14.44 ┬▒ 3.44 | 12.43 ┬▒ 2.27 | 0.001 |
| Spherical equivalent (D) | -1.49 ┬▒ 2.63 | -1.51 ┬▒ 3.61 | 0.968 |
| Visual acuity (logMAR) | 0.09 ┬▒ 0.19 | 0.09 ┬▒ 0.18 | 0.979 |
| Axial length (mm) | 24.35 ┬▒ 1.17 | 24.41 ┬▒ 1.73 | 0.846 |
| Central corneal thickness (╬╝m) | 525.94 ┬▒ 54.05 | 534.41 ┬▒ 30.57 | 0.365 |
| Peripapillary RNFL thickness (╬╝m) | |||
| ŌĆāGlobal | 46.33 ┬▒ 9.63 | 56.70 ┬▒ 14.27 | <0.001 |
| ŌĆāSuperotemporal | 53.72 ┬▒ 17.10 | 64.22 ┬▒ 29.33 | 0.029 |
| ŌĆāTemporal | 45.59 ┬▒ 13.27 | 53.65 ┬▒ 14.21 | 0.001 |
| ŌĆāInferotemporal | 49.26 ┬▒ 17.93 | 45.57 ┬▒ 17.83 | 0.260 |
| ŌĆāInferonasal | 48.01 ┬▒ 14.33 | 57.33 ┬▒ 21.91 | 0.011 |
| ŌĆāNasal | 42.41 ┬▒ 25.59 | 55.72 ┬▒ 20.09 | 0.003 |
| ŌĆāSuperonasal | 53.63 ┬▒ 20.28 | 69.67 ┬▒ 30.62 | 0.002 |
| Macular thickness (╬╝m) | 302.91 ┬▒ 17.59 | 315.69 ┬▒ 13.13 | <0.001 |
| Presence of peripapillary atrophy | 11 (12.6) | 7 (15.2) | 0.680 |
| Mean deviation (dB) | -20.27 ┬▒ 5.93 | -18.62 ┬▒ 5.72 | 0.178 |
| Pattern standard deviation (dB) | 11.55 ┬▒ 3.48 | 12.90 ┬▒ 3.18 | 0.059 |
Table┬Ā2.
Comparison of subfoveal and peripapillary choroidal thickness between the groups
| POAG (n = 87) | NTG (n = 46) | p-value* | |
|---|---|---|---|
| Subfoveal choroidal thickness (╬╝m) | 212.82 ┬▒ 66.70 | 198.95 ┬▒ 74.64 | 0.327 |
| Peripapillary choroidal thickness (╬╝m) | |||
| ŌĆāGlobal | 121.85 ┬▒ 45.39 | 99.20 ┬▒ 46.85 | 0.006 |
| ŌĆāSuperotemporal | 127.30 ┬▒ 50.12 | 102.65 ┬▒ 47.45 | 0.006 |
| ŌĆāTemporal | 126.66 ┬▒ 54.78 | 104.22 ┬▒ 58.32 | 0.024 |
| ŌĆāInferotemporal | 99.10 ┬▒ 43.94 | 79.85 ┬▒ 40.92 | 0.012 |
| ŌĆāInferonasal | 99.33 ┬▒ 39.70 | 83.78 ┬▒ 44.85 | 0.034 |
| ŌĆāNasal | 130.25 ┬▒ 48.84 | 104.50 ┬▒ 51.12 | 0.004 |
| ŌĆāSuperonasal | 127.18 ┬▒ 46.48 | 105.13 ┬▒ 46.28 | 0.007 |
Table┬Ā3.
Factors affecting peripapillary choroidal thickness by linear regression analysis in advanced glaucoma patients
Model 1 is a multivariate linear regression analysis with group and age. Model 2 is a multivariate linear regression analysis with age and IOP.
CI = confidence interval; POAG = primary open angle glaucoma; IOP = intraocular pressure; D = diopters; logMAR = logarithm of minimum angle of resolution; RNFL = retinal nerve fiber layer.
Table┬Ā4.
Factors affecting subfoveal choroidal thickness by linear regression analysis in advanced glaucoma patients
REFERENCES
1) Hyman L, Wu SY, Connell AM, et al. Prevalence and causes of visual impairment in The Barbados Eye Study. Ophthalmology 2001;108:1751-6.


2) Quigley HA, Broman AT. The number of people with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol 2006;90:262-7.



3) Flammer J, Org├╝l S, Costa VP, et al. The impact of ocular blood flow in glaucoma. Prog Retin Eye Res 2002;21:359-93.


4) Hayreh SS. Blood supply of the optic nerve head and its role in optic atrophy, glaucoma, and oedema of the optic disc. Br J Ophthalmol 1969;53:721-48.



5) Duijm HF, van den Berg TJ, Greve EL. Choroidal haemodynamics in glaucoma. Br J Ophthalmol 1997;81:735-42.



6) Grunwald JE, Piltz J, Hariprasad SM, DuPont J. Optic nerve and choroidal circulation in glaucoma. Invest Ophthalmol Vis Sci 1998;39:2329-36.

8) Kubota T, Jonas JB, Naumann GO. Decreased choroidal thickness in eyes with secondary angle closure glaucoma. An aetiological factor for deep retinal changes in glaucoma? Br J Ophthalmol 1993;77:430-2.



9) Kim CS, Seong GJ, Lee NH, Song KC. Prevalence of primary open-angle glaucoma in central South Korea the Namil study. Ophthalmology 2011;118:1024-30.


10) Galassi F, Giambene B, Varriale R. Systemic vascular dysregulation and retrobulbar hemodynamics in normal-tension glaucoma. Invest Ophthalmol Vis Sci 2011;52:4467-71.


11) Lee KM, Lee EJ, Kim TW. Juxtapapillary choroid is thinner in normal-tension glaucoma than in healthy eyes. Acta Ophthalmol 2016;94:e697-708.


12) Karahan E, Tuncer I, Er D, Zengin MO. Correlation of peripapillary choroidal thickness and retinal nerve fiber layer thickness in normal subjects and in patients with glaucoma. Semin Ophthalmol 2017;32:602-6.


13) Hirooka K, Fujiwara A, Shiragami C, et al. Relationship between progression of visual field damage and choroidal thickness in eyes with normal-tension glaucoma. Clin Exp Ophthalmol 2012;40:576-82.


14) Park HY, Lee NY, Shin HY, Park CK. Analysis of macular and peripapillary choroidal thickness in glaucoma patients by enhanced depth imaging optical coherence tomography. J Glaucoma 2014;23:225-31.


15) Lin Z, Huang S, Huang P, et al. The diagnostic use of choroidal thickness analysis and its correlation with visual field indices in glaucoma using spectral domain optical coherence tomography. PLoS One 2017;12:e0189376.



16) Jin SW, Choi WS, Seo HR, et al. Analysis of choroidal thickness measured using RTVue and associated factors in open-Angle glaucoma. J Korean Ophthalmol Soc 2015;56:1065-74.

17) Li L, Bian A, Zhou Q, Mao J. Peripapillary choroidal thickness in both eyes of glaucoma patients with unilateral visual field loss. Am J Ophthalmol 2013;156:1277-84.e1.


18) Suh W, Cho HK, Kee C. Evaluation of peripapillary choroidal thickness in unilateral normal-tension glaucoma. Jpn J Ophthalmol 2014;58:62-7.


19) Kim JW, Rhew JY, Choi KR. Choroidal thickness in primary open-angle glaucoma using spectral-domain optical coherence tomography. J Korean Ophthalmol Soc 2014;55:868-76.

20) Wang W, Zhang X. Choroidal thickness and primary open-angle glaucoma: a cross-sectional study and meta-analysis. Invest Ophthalmol Vis Sci 2014;55:6007-14.


21) Ehlers N, Bramsen T, Sperling S. Applanation tonometry and central corneal thickness. Acta Ophthalmol (Copenh) 1975;53:34-43.


22) Alm A, Bill A. Blood flow and oxygen extraction in the cat uvea at normal and high intraocular pressures. Acta Physiol Scand 1970;80:19-28.


23) Yin ZQ, Millar TJ, et al. Widespread choroidal insufficiency in primary open-angle glaucoma. J Glaucoma 1997;6:23-32.


24) Moon SK, Jun RM, Choi KR. Comparison of retinal nerve fiber layer thickness in early normal-tension glaucoma and early primary open-angle glaucoma. J Korean Ophthalmol Soc 2010;51:248-53.

25) Yokoyama Y, Maruyama K, Konno H, et al. Characteristics of patients with primary open angle glaucoma and normal tension glaucoma at a university hospital: a cross-sectional retrospective study. BMC Res Notes 2015;8:360.



26) Shields MB. Normal-tension glaucoma: is it different from primary open-angle glaucoma? Curr Opin Ophthalmol 2008;19:85-8.


27) McLeod SD, West SK, Quigley HA, Fozard JL. A longitudinal study of the relationship between intraocular and blood pressures. Invest Ophthalmol Vis Sci 1990;31:2361-6.

28) Becker B. Diabetes mellitus and primary open-angle glaucoma. The XXVII Edward Jackson Memorial Lecture. Am J Ophthalmol 1971;71(1 Pt 1):1-16.

30) Pradalier A, Hamard P, Sellem E, Bringer L. Migraine and glaucoma: an epidemiologic survey of French ophthalmologists. Cephalalgia 1998;18:74-6.


31) Kim M, Kim SS, Koh HJ, Lee SC. Choroidal thickness, age, and refractive error in healthy Korean subjects. Optom Vis Sci 2014;91:491-6.


32) Park JY, Kim BG, Hwang JH, Kim JS. Choroidal thickness in and outside of vascular arcade in healthy eyes using spectral-domain optical coherence tomography. Invest Ophthalmol Vis Sci 2017;58:5827-37.


33) Sacconi R, Deotto N, Merz T, et al. SD-OCT choroidal thickness in advanced primary open-angle glaucoma. J Glaucoma 2017;26:523-7.


34) Mwanza JC, Hochberg JT, Banitt MR, et al. Lack of association between glaucoma and macular choroidal thickness measured with enhanced depth-imaging optical coherence tomography. Invest Ophthalmol Vis Sci 2011;52:3430-5.



35) Shibata H, Sawada Y, Ishikawa M, et al. Peripapillary choroidal thickness assessed by spectral-domain optical coherence tomography in normal Japanese. Jpn J Ophthalmol 2021;65:666-71.


36) Schoenwolf GC, Bleyl SB, Brauer PR, Francis-West PH. LarsenŌĆÖs human embrology, 4th ed. Philadelphia: Elsevier, 2009;602-16.
37) Yang H, Luo H, Gardiner SK, et al. Factors influencing optical coherence tomography peripapillary choroidal thickness: a multicenter study. Invest Ophthalmol Vis Sci 2019;60:795-806.



38) Sogawa K, Nagaoka T, Takahashi A, et al. Relationship between choroidal thickness and choroidal circulation in healthy young subjects. Am J Ophthalmol 2012;153:1129-32.e1.


39) Ooto S, Hangai M, Yoshimura N. Effects of sex and age on the normal retinal and choroidal structures on optical coherence tomography. Curr Eye Res 2015;40:213-25.


40) Maul EA, Friedman DS, Chang DS, et al. Choroidal thickness measured by spectral domain optical coherence tomography: factors affecting thickness in glaucoma patients. Ophthalmology 2011;118:1571-9.


41) Ho J, Branchini L, Regatieri C, et al. Analysis of normal peripapillary choroidal thickness via spectral domain optical coherence tomography. Ophthalmology 2011;118:2001-7.


42) Saeedi O, Pillar A, Jefferys J, et al. Change in choroidal thickness and axial length with change in intraocular pressure after trabeculectomy. Br J Ophthalmol 2014;98:976-9.


43) Jiang R, Wang YX, Wei WB, et al. Peripapillary choroidal thickness in adult Chinese: The Beijing Eye Study. Invest Ophthalmol Vis Sci 2015;56:4045-52.


44) Zhang C, Tatham AJ, Medeiros FA, et al. Assessment of choroidal thickness in healthy and glaucomatous eyes using swept source optical coherence tomography. PLoS One 2014;9:e109683.



45) Roberts KF, Artes PH, OŌĆÖLeary N, et al. Peripapillary choroidal thickness in healthy controls and patients with focal, diffuse, and sclerotic glaucomatous optic disc damage. Arch Ophthalmol 2012;130:980-6.


46) Flores-Moreno I, Ruiz-Medrano J, Duker JS, Ruiz-Moreno JM. The relationship between retinal and choroidal thickness and visual acuity in highly myopic eyes. Br J Ophthalmol 2013;97:1010-3.


47) Chen W, Wang Z, Zhou X, et al. Choroidal and photoreceptor layer thickness in myopic population. Eur J Ophthalmol 2012;22:590-7.


48) Levin LA, Nilsson SFE, Hoeve JV, Wu SM. AdlerŌĆÖs physiology of the eye, 11th ed. New York: Elsevier, 2011;254-5.
49) Nishida Y, Fujiwara T, Imamura Y, et al. Choroidal thickness and visual acuity in highly myopic eyes. Retina 2012;32:1229-36.


50) Drance S, Anderson DR, Schulzer M. Risk factors for progression of visual field abnormalities in normal-tension glaucoma. Am J Ophthalmol 2001;131:699-708.


51) Kamal D, Hitchings R. Normal tension glaucoma-a practical approach. Br J Ophthalmol 1998;82:835-40.



52) Ng SK, Burdon KP, Fitzgerald JT, et al. Genetic association at the 9p21 glaucoma locus contributes to sex bias in normal-tension glaucoma. Invest Ophthalmol Vis Sci 2016;57:3416-21.


53) Barteselli G, Chhablani J, El-Emam S, et al. Choroidal volume variations with age, axial length, and sex in healthy subjects: a three-dimensional analysis. Ophthalmology 2012;119:2572-8.


54) Li XQ, Larsen M, Munch IC. Subfoveal choroidal thickness in relation to sex and axial length in 93 Danish university students. Invest Ophthalmol Vis Sci 2011;52:8438-41.


55) Miglior S, Brigatti L, Velati P, et al. Relationship between morphometric optic disc parameters, sex and axial length. Curr Eye Res 1994;13:119-24.


56) Kavroulaki D, Gugleta K, Kochkorov A, et al. Influence of gender and menopausal status on peripheral and choroidal circulation. Acta Ophthalmol 2010;88:850-3.


57) Centofanti M, Bonini S, Manni G, et al. Do sex and hormonal status influence choroidal circulation? Br J Ophthalmol 2000;84:786-7.



-
METRICS

- Related articles
-
Idiopathic Chiasmal Optic Neuritis in a Pediatric Patient2021 December;62(12)
Characteristics of Visual Field Defects in Korean Advanced Glaucoma2021 August;62(8)
Choroidal Thickness Analysis in Primary Rhegmatogenous Retinal Detachment2020 October;61(10)
Changes in Choroidal Thickness in Branch Retinal Vein Occlusion.2016 August;57(8)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print