 |
 |
| J Korean Ophthalmol Soc > Volume 62(10); 2021 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£Ē¢ēĒĢ£ mitomycin-C (MMC)ļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģ ņŚ¼ļČĆņŚÉ ļö░ļźĖ ņłśņłĀ ņä▒Ļ│ĄļźĀņØä ļ╣äĻĄÉĒĢ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ņŗ£Ē¢ē Ēøä ņĄ£ņåī 1ļģä ņØ┤ņāü Ļ┤Ćņ░░ņØ┤ Ļ░ĆļŖźĒĢśņśĆļŹś 108ļ¬ģ 108ņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ņØśļ¼┤ĻĖ░ļĪØ ļČäņäØņØä ĒåĄĒĢ£ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØä ņéĮņ×ģĒĢ£ ĻĄ░ņØĆ 55ņĢł, ļīĆņĪ░ĻĄ░ņØĆ 53ņĢłņØ┤ņŚłļŗż. ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņé¼ņÜ® ņŚ¼ļČĆņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ ņĢłņĢĢņØ┤ ņŚ░ņåŹĒĢśņŚ¼ 2ĒÜī ņØ┤ņāü 18 mmHgļ│┤ļŗż ļåÆĻ▒░ļéś 5 mmHgļ│┤ļŗż ļé«Ļ▓ī ņĖĪņĀĢļÉĀ ļĢīļź╝ ņłśņłĀ ņŗżĒī©ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ ļ¬©ļæÉņŚÉņä£ ņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ ņłĀ Ēøä ņĢłņĢĢ ļ░Å ņĢłņĢĢĒĢśĻ░ĢņĀ£ Ļ░£ņłśĻ░Ć ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(ļ¬©ļæÉ p<0.001). ņ¢æ ĻĄ░ Ļ░äņØś ņłĀ Ēøä ņĢłņĢĢ ļ░Å ņĢłņĢĢĒĢśĻ░ĢņĀ£ Ļ░£ņłśņŚÉļŖö ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. Kaplan-Meier ņāØņĪ┤ļČäņäØ Ļ▓░Ļ│╝ ļģ╣ļé┤ņןņłśņłĀ Ēøä 1ļģä ļłäņĀü ņä▒Ļ│ĄļźĀņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 78.2%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 79.2%ņśĆĻ│Ā, ņ¢æ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.54). Ļ│ĀņĢłņĢĢĻĖ░ņØś ļ░£ņāØļ¦īņØ┤ ņłśņłĀ ņŗżĒī©ņÖĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņśĆļŗż(hazard ratio=3.81, 95% confidence interval=1.72-8.41, p<0.001). Ļ┤ĆņØä ņĀäļ░®ņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░ņØ┤ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņłĀ Ēøä 1ļģä ļÆż ņØśļ»Ė ņ׳ļŖö ņŗ£ļĀźņĀĆĒĢśļź╝ ļ│┤ņśĆņ£╝ļéś(p=0.011), ņŗ£ļĀźņĀĆĒĢśņÖĆ Ļ┤ĆļĀ©ļÉ£ ņ£äĒŚśņØĖņ×É ļČäņäØ ņŗ£ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļŖö ņÜöņØĖņØĆ ņŚåņŚłļŗż.
ABSTRACT
Purpose
To compare the surgical outcomes of adjunctive mitomycin-C (MMC) Ahmed valve implantation with and without collagen matrix insertion.
Methods
We retrospectively reviewed 108 eyes of 108 patients who underwent Ahmed valve implant surgery with adjunctive MMC. Collagen matrix insertion/Ahmed valve implant surgery (CM-AGV) was performed on 55 eyes, while conventional Ahmed valve implant surgery (AGV) was performed on 53 eyes. We defined surgical failure as an intraocular pressure (IOP) > 18 mmHg or <5 mmHg on two or more consecutive visits, regardless of medication status.
Results
After surgery, the IOP and number of topical medications required fell significantly (compared with the preoperative period) in both groups (both p < 0.001); these findings did not significantly differ between groups. The cumulative surgical success rates at 1 year did not significantly differ between groups (78.2% vs. 79.2%, p = 0.54). The only risk factor significantly associated with surgical failure was a postoperative hypertensive phase. Anterior chamber (compared with sulcus) tube placement was significantly associated with visual acuity loss at 1 year postoperatively, but this did not significantly differ between groups.
ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņן, ĒżļÅäļ¦ēņŚ╝ņŚÉ ņØśĒĢ£ ņØ┤ņ░©ļģ╣ļé┤ņן, ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀļĪ£ ņŗżĒī©ĒĢ£ Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ļŖö ļģ╣ļé┤ņן, ņĄ£ļīĆ ņĢĮļ¼╝ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĢłņĢĢņØ┤ ņĪ░ņĀłļÉśņ¦Ć ņĢŖļŖö ļģ╣ļé┤ņןņØś ņłśņłĀņĀü ņ╣śļŻīļź╝ ņ£äĒĢśņŚ¼ ļŗżņ¢æĒĢ£ ļ░®ņłśņ£ĀņČ£ņןņ╣śĻ░Ć Ļ░£ļ░£ļÉśņŚłļŗż[1-3]. ļŗżņ¢æĒĢ£ ļ░®ņłśņ£ĀņČ£ņןņ╣ś ņżæ ņĢäļ®öļō£ļ░ĖļĖī(New World Medical Inc., Rancho Cucamonga, CA, USA)ļŖö ļ░ĖļĖīņØś ņןņ╣śĒīÉņŚÉ silicone elastomer membraneņØ┤ ņ׳ņ£╝ļ®░, ņØ┤Ļ▓āņØ┤ ņØ╝ņóģņØś check valve ņŚŁĒĢĀņØä ĒĢ£ļŗż. ņØ┤ļĪĀņāü 8 mmHg ņØ┤ņāüņØś ņĢłņĢĢņŚÉņä£ļ¦ī ļ░ĖļĖīĻ░Ć ņŚ┤ļĀżņä£ ņĀäļ░®ļé┤ņØś ļ░®ņłśĻ░Ć Ļ▓░ļ¦ēĒĢś Ļ│ĄĻ░äņ£╝ļĪ£ ļéśĻ░ł ņłś ņ׳ļÅäļĪØ Ļ│ĀņĢłļÉśņ¢┤ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ Ēøä ļ░£ņāØ Ļ░ĆļŖźĒĢ£ ņŻ╝ņÜö ĒĢ®ļ│æņ”ØņØĖ ņĀĆņĢłņĢĢņØä ņśłļ░®ĒĢśļŖö ļŹ░ ĒÜ©Ļ│╝ņĀüņØ┤ļŗż[4-6]. ņØ┤ņŚÉ ĒŖ╣Ē׳ ņ╣śļŻīĻ░Ć ņ¢┤ļĀżņÜ┤ ļé£ņ╣śņä▒ ļģ╣ļé┤ņןņŚÉņä£ ļ¦ÄņØ┤ ĒÖ£ņÜ®ļÉśļ®░ ņóŗņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż[6-13].
ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņןņ╣śĒīÉ ņŻ╝ņ£äņŚÉ ĒśĢņä▒ļÉśļŖö ņä¼ņ£Āļ¦ēņØĆ ļ░®ņłśņ£ĀņČ£ ņĀĢļÅäņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖöļŹ░, ņä¼ņ£Āļ¦ēņØś ļ¬©ņ¢æņØ┤ļéś ĒśĢņä▒ ņĀĢļÅäĻ░Ć ņןĻĖ░Ļ░ä ņłśņłĀ ņä▒Ļ│Ą ņŚ¼ļČĆņŚÉ ņśüĒ¢źņØä ņżĆļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[14]. ņØ┤ņĀä ņŚ░ĻĄ¼ļōżņŚÉņä£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀ ņŗ£ Ļ│╝ļÅäĒĢ£ ņä¼ņ£Āņä▒ ļ░śĒØöņĪ░ņ¦üņØś ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ĒĢŁļīĆņé¼ņĀ£ļź╝ ļ│æņÜ®ĒĢśļŖö Ļ▓āņØ┤ ņןĻĖ░Ļ░ä ņ╣śļŻī ņä▒Ļ│ĄļźĀņØä Ē¢źņāüņŗ£Ēé¼ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņ¢┤[14-17], ņŻ╝ļĪ£ mitomycin-C (MMC)ļéś 5-fluorouracil (5-FU)Ļ░Ć ļäÉļ”¼ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[18]. ĒĢśņ¦Ćļ¦ī ĒĢŁļīĆņé¼ņĀ£ņØś ļ│æņÜ®ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņä¼ņ£Āņä▒ ļ░śĒØöņĪ░ņ¦ü ĒśĢņä▒ņØś ņÖäņĀäĒĢ£ ņ¢ĄņĀ£ņŚÉļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ņ¢┤, MMC ļśÉļŖö 5-FUļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØś 2ļģä ņä▒Ļ│ĄļźĀņØĆ 44-87% ņĀĢļÅäļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[17,19,20]. ņĄ£ĻĘ╝ ņØ┤ļ¤¼ĒĢ£ Ļ│╝ļÅäĒĢ£ ņä¼ņ£Āņä▒ ļ░śĒØöņĪ░ņ¦üņØś ļ░£ņāØņØä ņČöĻ░ĆņĀüņ£╝ļĪ£ ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņāØņ▓┤ ļé┤ņŚÉņä£ ļČäĒĢ┤ļÉśļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł(Ologen┬«, Aeon Astron Europe B.V., Leiden, The Netherlands)ņØ┤ ņåīĻ░£ļÉśņŚłļŗż.
ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØĆ ņĢäļ®öļō£ļ░ĖļĖī ņןņ╣śĒīÉņØś ņāüļČĆņŚÉ ņ£äņ╣śņŗ£ĒéżĻ▓ī ļÉśļŖöļŹ░, ņØ┤ļź╝ ĒåĄĒĢ┤ ņןņ╣śĒīÉĻ│╝ Ļ▓░ļ¦ēĒĢś ņĪ░ņ¦üņØä ļ¼╝ļ”¼ņĀüņ£╝ļĪ£ ļČäļ”¼ņŗ£ņ╝£ ņןņ╣śĒīÉ ņŻ╝ļ│ĆņØś Ļ│╝ļÅäĒĢ£ ņä¼ņ£ĀĒÖöļź╝ ļ░®ņ¦ĆĒĢ£ļŗż. ļśÉĒĢ£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØś ļŗżĻ│Ąņä▒ ĻĄ¼ņĪ░ ļŹĢļČäņŚÉ ņä¼ņ£Āļ¬©ņäĖĒżĻ░Ć ņØ╝ņĀĢĒĢ£ ļ░®Ē¢źņä▒ ņŚåņØ┤ ņ×ÉļØ╝ ļōżņ¢┤Ļ░Ćļ®░ ņä¼ņ£Āļ¦ēņØ┤ ĒśĢņä▒ļÉĀ ņłś ņ׳Ļ▓ī ĒĢ┤ņżśņä£ ļ╣äĻĄÉņĀü ņĢĮĒĢ£ Ļ▓░ĒĢ®ņĪ░ņ¦üņØ┤ ĒśĢņä▒ļÉśĻ▓ī ĒĢ┤ņżĆļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[21,22]. Kim et al [23]ņØĆ MMCļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ņŗ£Ē¢ēĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ 8ņĢłņØś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ 12ņĢłņØś ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢ£ 1ļģä ņä▒Ļ│ĄļźĀņØä ļ░£Ēæ£ĒĢśņśĆļŖöļŹ░, ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ņłśņłĀ ņä▒Ļ│ĄļźĀņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗżĻ│Ā ĒĢśņśĆļŗż. ļ░śļ®┤ Sastre-Ib├Ī├▒ez et al [24]ņØĆ MMCļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ņŗ£Ē¢ēĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ 26ņĢłņØś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ 31ņĢłņØś ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢ£ ņä▒Ļ│ĄļźĀņØä ļ░£Ēæ£ĒĢśņśĆļŖöļŹ░, ņ¢æ ĻĄ░ Ļ░ä ņä▒Ļ│ĄļźĀņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåļŗżĻ│Ā ĒĢśņśĆļŗż.
ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģņØś ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ļ¬ćļ¬ć ņŚ░ĻĄ¼Ļ░Ć ņ׳ņŚłņ£╝ļéś ņĀüņØĆ ņłśņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēļÉ£ ņŚ░ĻĄ¼ņśĆņ£╝ļ®░, ļ¬©ļæÉ MMCļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖņØĆ ņłśņłĀņØś Ļ▓░Ļ│╝ņśĆļŗż. ņĀĆņ×ÉļōżņØĆ ļ│┤ļŗż ļ¦ÄņØĆ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£, MMCļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØś ņŚŁĒĢĀņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢśņŚ¼ MMCļź╝ ļ│æņÜ®ĒĢśņŚ¼ ņŗ£Ē¢ēĒĢ£ ņĢäļ®öļō£ ļ░®ņłśņ£ĀņČ£ņןņ╣śņéĮņ×ģņłĀņŚÉņä£ 55ņĢłņØś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ 53ņĢłņØś ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢśņŚ¼ 1ļģä ņłśņłĀ ņä▒Ļ│ĄļźĀņØä ļ╣äĻĄÉĒĢ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ĒøäĒ¢źņĀü ļŗ©ļ®┤ ņŚ░ĻĄ¼ļĪ£, 2014ļģä 3ņøöļČĆĒä░ 2020ļģä 3ņøöĻ╣īņ¦Ć ļ│ĖņøÉ ļģ╣ļé┤ņן Ēü┤ļ”¼ļŗēņŚÉņä£ ļÅÖņØ╝ĒĢ£ ņłĀņ×ÉņŚÉ ņØśĒĢ┤ MMCļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖī(FP 7 model) ņéĮņ×ģņłĀņØä ļ░øņØĆ ļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņłśņłĀ Ēøä 12Ļ░£ņøöĻ░ä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØä ņŗ£Ē¢ēĒĢśņ¦Ć ļ¬╗Ē¢łĻ▒░ļéś, ļ¦ī 19ņäĖ ļ»Ėļ¦īņØś ļ»Ėņä▒ļģäņ×É, ņØ┤ņĀäņŚÉ ļģ╣ļé┤ņןņłśņłĀņØä ļ░øņĢśļŹś Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ņ░Įņāüņ╣śņ£Ā Ļ│╝ņĀĢņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö ņĀäņŗĀņ¦łĒÖśņØ┤ ņ׳ļŖö ĒÖśņ×ÉļŖö ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņÖĖļÉśņŚłļŗż. ņ┤Ø 136ļ¬ģņØś ĒÖśņ×ÉĻ░Ć ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØä ņŗ£Ē¢ē ļ░øņĢśņ£╝ļ®░, ņØ┤ ņżæ 1ļģä ņØ┤ņāü Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØä ĒĢĀ ņłś ņŚåņŚłļŹś 19ļ¬ģņØś ĒÖśņ×É, 19ņäĖ ļ»Ėļ¦īņØś ĒÖśņ×É 1ļ¬ģ, ņØ┤ņĀäņŚÉ ļģ╣ļé┤ņןņłśņłĀņØä ļ░øņĢśļŹś 8ļ¬ģņØś ĒÖśņ×ÉĻ░Ć ņĀ£ņÖĖļÉśņ¢┤ 108ļ¬ģ 108ņĢłņØ┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉśņŚłļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØś Ļ▓ĮņÜ░ 2015ļģä 8ņøöļČĆĒä░ 2019ļģä 10ņøöĻ╣īņ¦Ć ņłśņłĀņØä ļ░øņØĆ ĒÖśņ×ÉļōżņØ┤ ĒżĒĢ©ļÉśņŚłļŗż. ņłĀņ×ÉņØś ļŖźņłÖļÅäņŚÉ ļö░ļźĖ ņłśņłĀ Ļ▓░Ļ│╝ ņ░©ņØ┤ļź╝ ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļīĆņĪ░ĻĄ░ņØś Ļ▓ĮņÜ░ 2015ļģä 8ņøö ņØ┤ņĀäņŚÉ ņłśņłĀ ļ░øņØĆ ĒÖśņ×É 25ņĢł, 2019ļģä 10ņøö ņØ┤Ēøä ņłśņłĀ ļ░øņØĆ ĒÖśņ×É 11ņĢł, ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ ļÅÖņØ╝ĒĢ£ ĻĖ░Ļ░äņŚÉ ņłśņłĀ ļ░øņØĆ ĒÖśņ×É 17ņĢłņØä ĒżĒĢ©ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņØä ņżĆņłśĒĢśņŚ¼ ņŗ£Ē¢ēļÉśņŚłĻ│Ā, ļ│ĖņøÉ ņ×äņāüņŚ░ĻĄ¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŗ¼ņé¼ļź╝ ļ░øĻ│Ā ņŖ╣ņØĖ ļ░øņĢśļŗż(IRB ņŖ╣ņØĖ ļ▓łĒśĖ: AJIRB-MED-MDB-21-126).
108ņĢł ņżæ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØĆ 55ņĢł, ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØä ņéĮņ×ģĒĢśņ¦Ć ņĢŖņØĆ ļīĆņĪ░ĻĄ░ņØĆ 53ņĢłņØ┤ņŚłļŗż. ļ¬©ļōĀ ĒÖśņ×ÉļŖö ņłĀ ņĀä ņŗ£ļĀźĻ│╝ ņĢłņĢĢņØä ņĖĪņĀĢĒĢśņśĆĻ│Ā, ņłĀ Ēøä 1ņØ╝, 1ņŻ╝, 2ņŻ╝, 1ļŗ¼, 2ļŗ¼, 3ļŗ¼, 6ļŗ¼, 9ļŗ¼, 12ļŗ¼ņ¦Ė Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØä ĒĢśņśĆļŗż. Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņŗ£ ĒÖśņ×ÉņØś ņŗ£ļĀźĻ│╝ ņĢłņĢĢņØä ņĖĪņĀĢĒĢśĻ│Ā, ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņłśņłĀĻ│╝ Ļ┤ĆļĀ©ļÉ£ ĒĢ®ļ│æņ”Ø ņŚ¼ļČĆ, ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś ņé¼ņÜ® Ļ░£ņłś, 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ņŚ¼ļČĆ, needling ņŗ£Ē¢ē ņŚ¼ļČĆ, ļ░▒ļé┤ņן ņ¦äĒ¢ē ņŚ¼ļČĆ, Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżņłś(Topcon SP-2000P, Topcon America Corp., Oakland, NJ, USA)ļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż. ļ¬©ļōĀ ĒÖśņ×ÉļōżņŚÉņä£ ņĢłņĢĢņØĆ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, ņŗ£ļĀźņØĆ 4 m ņÜ® ĒĢ£ņ▓£ņäØņŗ£ļĀźĒæ£ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢ£ ļÆż ņŗ£ļĀźņØ┤ ņĢłņĀäņłśņ¦ĆņØĖ Ļ▓ĮņÜ░ ļČäņłś ņŗ£Ēæ£ņŚÉņä£ 0.005ļĪ£, ņĢłņĀäņłśļÅÖņØĖ Ļ▓ĮņÜ░ 0.0025ļĪ£, Ļ┤æĻ░üņ£ĀņØś Ļ▓ĮņÜ░ 0.00125ļĪ£, Ļ┤æĻ░üļ¼┤ņØś Ļ▓ĮņÜ░ 0.001ļĪ£ ĒÖśņé░ĒĢśņŚ¼ ņØ┤ļź╝ ļīĆņłśņŗ£ļĀź(logarithm of the minimal angle of resolution, logMAR)ņ£╝ļĪ£ ļ│ĆĒÖśĒĢśņŚ¼ Ēæ£ņŗ£ĒĢśņśĆļŗż.
ņłśņłĀ ņä▒Ļ│ĄņØĆ ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś ņé¼ņÜ® ņ£Āļ¼┤ņÖĆ ņāüĻ┤ĆņŚåņØ┤ ņłśņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ĒĢśļŖö 1ļģä ļÅÖņĢł ļ¦ż ļ░®ļ¼Ė ņŗ£ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņØ┤ 6-18 mmHgļĪ£ ņ£Āņ¦ĆļÉśĻ│Ā 2ļ▓łņØś ņŚ░ņåŹļÉ£ ļ░®ļ¼ĖņŚÉņä£ ņØ┤ ļ▓öņ£äļź╝ ļ▓Śņ¢┤ļéśņ¦Ć ņĢŖņ£╝ļ®░, Ļ┤æĻ░üļ¼┤ņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņŗ£ļĀźņāüņŗż ļśÉļŖö Ļ░üļ¦ē ļČĆņĀäĻ│╝ Ļ░ÖņØĆ ņŗ¼Ļ░üĒĢ£ ĒĢ®ļ│æņ”ØņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀĻ│╝ needling ņÖĖņØś ņłśņłĀņĀü ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ▒░ļéś ņłśņłĀ ņĀä ņĢłņĢĢņŚÉ ļ╣äĒĢśņŚ¼ 20% ņØ┤ņāü ņĢłņĢĢĒĢśĻ░ĢņØ┤ ņØ┤ļżäņ¦Ćņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░, Ļ┤æĻ░üņØ┤ ņåīņŗżļÉ£ Ļ▓ĮņÜ░ļŖö ņĢłņĢĢņØ┤ ņĀĢņØśĒĢ£ ņä▒Ļ│Ą ĻĖ░ņżĆņØä ļ¦īņĪ▒ĒĢ£ļŗż ĒĢśļŹöļØ╝ļÅä ņłśņłĀ ņŗżĒī©ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż. Ļ│ĀņĢłņĢĢĻĖ░ļŖö ņłśņłĀ 3Ļ░£ņøö ņØ┤ļé┤ņŚÉ ņĢłņĢĢņØ┤ 22 mmHg ņØ┤ņāü ņāüņŖ╣ĒĢ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
ņłśņłĀņØĆ ņāüņØ┤ņĖĪ Ēģīļģ╝ļéŁĒĢś Ļ│ĄĻ░äņŚÉ lidocaineņØä ņŻ╝ņé¼ĒĢśņŚ¼ ļ¦łņĘ©ĒĢ£ ļÆż Ļ░üļ¦ēņ£żļČĆņ¬Į Ļ▓░ļ¦ēņØä ņĀłĻ░£ĒĢśņŚ¼ ņøÉļČĆĻĖ░ņĀĆĻ▓░ļ¦ēĒÄĖņØä ļ¦īļōĀ Ēøä Ēģīļģ╝ļéŁĻ│╝ Ļ│Ąļ¦ē ņé¼ņØ┤ļź╝ ļ░Ģļ”¼ĒĢśņśĆļŗż. ļ░Ģļ”¼ĒĢ£ Ļ│ĄĻ░äņŚÉ ņĢäļ®öļō£ļ░ĖļĖīļź╝ ļäŻņ¢┤ Ļ│ĄĻ░äņØ┤ ņČ®ļČäĒĢ£ņ¦Ćļź╝ ĒÖĢņØĖĒĢśņśĆļŗż. ļ░ĖļĖīļź╝ ņĀ£Ļ▒░ĒĢ£ ļÆż ļ▓©ļĖīņØś ņןņ╣śĒīÉņØ┤ ņ£äņ╣śĒĢĀ Ļ│Ąļ¦ē Ēæ£ļ®┤ņŚÉ 0.04% MMCļź╝ ņĀüņŗĀ cellulose material (Weck-cel┬«, Beaver-Visitec International Sales Ltd., Abingdon, UK)ņØä ņ£äņ╣śņŗ£Ēé© Ēøä 5ļČä ļÆż ņĀ£Ļ▒░ĒĢśņśĆļŗż. ĒÅēĒśĢņŚ╝ņĢĪ(balanced salt solution)ņ£╝ļĪ£ Ļ│Ąļ¦ē Ēæ£ļ®┤ ļ░Å Ļ▓░ļ¦ēņŚÉ ļé©ņĢäņ׳ļŖö MMCļź╝ ņČ®ļČäĒ׳ ņäĖņ▓ÖĒĢśņśĆļŗż. ņĢäļ®öļō£ļ░ĖļĖīņØś Ļ┤Ć ļüØņŚÉ 30 gauge cannulaļź╝ ņéĮņ×ģĒĢ£ ļÆż ĒÅēĒśĢņŚ╝ņĢĪņØä ĒåĄĻ│╝ņŗ£ņ╝£ ļ░ĖļĖīĻ░Ć ņĀĢņāüņĀüņ£╝ļĪ£ ņ×æļÅÖĒĢśļŖöņ¦Ć ĒÖĢņØĖĒĢśņśĆļŗż. ņłśņłĀ Ēøä Ļ│╝ļÅäĒĢ£ ļ░®ņłśņ£ĀņČ£ļĪ£ ņØĖĒĢ£ ĒĢ®ļ│æņ”ØņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņŗżļ”¼ņĮśĻ┤Ć ļé┤ņŚÉ 5-0 proleneņØä ļäŻņØĆ Ēøä ņןņ╣śĒīÉļ│┤ļŗż 1 mm ņĢ×ņ¬Į Ļ┤ĆņŚÉ 8-0 vicrylļĪ£ ļČĆļČä Ļ▓░ņ░░ņØä ĒĢśņśĆļŗż. 5-0 proleneņØä ņĀ£Ļ▒░ĒĢśĻ│Ā ĒÅēĒśĢņŚ╝ņĢĪņØä ļŗżņŗ£ ĒåĄĻ│╝ņŗ£ņ╝£ ņĢäļ®öļō£ļ░ĖļĖīņØś ņ×æļÅÖ ņāüĒā£ļź╝ ĒÖĢņØĖĒĢśņśĆļŗż. ņĢäļ®öļō£ļ░ĖļĖīļź╝ ņāüņØ┤ņĖĪ Ļ│Ąļ¦ēņ£äņŚÉ ņ£äņ╣śņŗ£Ēé© ļÆż 7-0 proleneņ£╝ļĪ£ ņןņ╣śĒīÉņØä Ļ│Ąļ¦ēņŚÉ ļ┤ēĒĢ®ĒĢśņŚ¼ Ļ│ĀņĀĢĒĢśņśĆļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØś Ļ▓ĮņÜ░ ņןņ╣śĒīÉ ņ£äņŚÉ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØä 10-0 nylonņ£╝ļĪ£ ļ┤ēĒĢ®ĒĢśņŚ¼ ņןņ╣śĒīÉĻ│╝ Ļ▓░ļ¦ēĒĢś Ļ│ĄĻ░ä ņé¼ņØ┤ņŚÉ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØ┤ ņ£äņ╣śĒĢśļÅäļĪØ ĒĢśņśĆļŗż. ņŗżļ”¼ņĮśĻ┤ĆņØ┤ ņĢłĻĄ¼ ļé┤ņŚÉ ņĀüļŗ╣ĒĢ£ ĻĖĖņØ┤ļ¦īĒü╝ ņ£äņ╣śĒĢśļÅäļĪØ ĒÖĢņØĖĒĢ£ ļÆż Ļ┤ĆņØä bevel up ļ░®Ē¢źņ£╝ļĪ£ ņלļ×Éļŗż. ņŗżļ”¼ņĮśĻ┤ĆņØä ņĀäļ░®ņŚÉ ņéĮņ×ģĒĢĀ Ļ▓ĮņÜ░ Ļ░üļ¦ēņ£żļČĆņŚÉņä£ 1.5 mm, ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņéĮņ×ģĒĢĀ Ļ▓ĮņÜ░ļŖö Ļ░üļ¦ēņ£żļČĆņŚÉņä£ 2.0 mm ļÆżņ¬Į Ļ│Ąļ¦ēņŚÉ caliperļĪ£ Ēæ£ņŗ£ĒĢ£ ļÆż 23 guage ļ░öļŖśņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖŹņ▒äļ®┤Ļ│╝ ĒÅēĒ¢ēĒĢ£ ļ░®Ē¢źņ£╝ļĪ£ Ļ│Ąļ¦ēņØä ņ▓£ņ×ÉĒĢśņśĆļŗż. ļ░öļŖśņØ┤ ļōżņ¢┤Ļ░öļŹś ļČĆņ£äļź╝ ĒåĄĒĢ┤ ņŗżļ”¼ņĮśĻ┤ĆņØä ļ░Ćņ¢┤ ļäŻņ¢┤ ņĢłĻĄ¼ ļé┤ņŚÉ ņ£äņ╣śņŗ£Ēé© Ēøä ļģĖņČ£ļÉ£ Ļ┤ĆņØä 5 ├Ś 5 mm Ēü¼ĻĖ░ņØś ļÅÖņóģĻ│Ąļ¦ēĒÄĖņ£╝ļĪ£ ļŹ«Ļ│Ā 10-0 nylonņ£╝ļĪ£ ļ┤ēĒĢ®ĒĢśņśĆļŗż. ņĀłĻ░£ļÉ£ Ļ▓░ļ¦ēņØä 10-0 nylonņ£╝ļĪ£ ļ┤ēĒĢ®ĒĢśņśĆļŗż.
ņłśņłĀ Ēøä 0.5% moxifloxacin (Vigamox┬«, Alcon, Fort Worth, TX, USA)ņÖĆ 1% prednisolone acetate (Pred Forte┬«, Allergan, Irvine, CA, USA)ļź╝ ņ▓śļ░®ĒĢśņśĆĻ│Ā, ļ¬©ļōĀ ņĢłņĢĢĒĢśĻ░ĢņĀ£ļŖö ņżæļŗ©ĒĢśņśĆļŗż. Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░ä ņżæ ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĢłņĢĢņØ┤ 18 mmHg ņØ┤ņāüņ£╝ļĪ£ ņāüņŖ╣ĒĢśĻ▒░ļéś, 18 mmHgļ│┤ļŗż ļåÆņ¦Ć ņĢŖļŹöļØ╝ļÅä ņłĀņ×ÉņØś ĒīÉļŗ©ņŚÉ ļö░ļØ╝ ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢśĻ│Ā ņ׳ļŖö Ļ▓ĮĒ¢źņä▒ņØä ļ│┤ņØ┤Ļ▒░ļéś ĒÖśņ×ÉņØś ļģ╣ļé┤ņן ļ│æĻĖ░Ļ░Ć ņ¦äĒ¢ēļÉ£ ņāüĒā£ņŚ¼ņä£ ņČöĻ░ĆņĀüņØĖ ņĢłņĢĢĒĢśĻ░ĢņØ┤ ĒĢäņÜöĒĢśļŗżĻ│Ā ĒīÉļŗ©ļÉĀ Ļ▓ĮņÜ░ ņäĀņĀ£ņĀüņ£╝ļĪ£ ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ļŗżņŗ£ ņé¼ņÜ®ĒĢśĻ▒░ļéś 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ļ░Å needlingņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀņØĆ 5 mg 5-FU 0.1 mL, dexamethasone 0.05 mL, 1% lidocaine 0.05 mLļź╝ Ēś╝ĒĢ®ĒĢ£ ļÆż ņĢäļ®öļō£ļ░ĖļĖī ņןņ╣śĒīÉ ņŻ╝ļ│ĆņØś Ļ▓░ļ¦ēĒĢś Ļ│ĄĻ░äņŚÉ ņŻ╝ņé¼ĒĢśņśĆļŗż.
Kaplan-Meier ņāØņĪ┤ļČäņäØļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļłäņĀü ņ╣śļŻī ņä▒Ļ│ĄļźĀņØä ĻĄ¼ĒĢśņśĆņ£╝ļ®░, ņłśņłĀ ņŗżĒī©ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņØĖņ×ÉļŖö ļŗ©ņł£ ļ░Å ļŗżņżæ Cox ĒÜīĻĘĆļČäņäØļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĪ░ņé¼ĒĢśņśĆļŗż. ņŗ£ļĀźņĀĆĒĢśļŖö ņłĀ Ēøä 1ļģä ļÆż ņŗ£ļĀźņØ┤ ņłĀ ņĀä ņŗ£ļĀźļ│┤ļŗż logMAR ņŗ£ļĀźņŚÉņä£ 2ņżä ņØ┤ņāü ņŗ£ļĀźņØ┤ Ļ░ÉņåīĒĢ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā, ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØņØä ĒåĄĒĢ┤ ņŗ£ļĀźņĀĆĒĢśņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×Éļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņØś ļéśņØ┤, ņä▒ļ│ä, ņĢłņĢĢ, 5-FU ņŻ╝ņ×ģņłĀ ņ£Āļ¼┤, Ļ│ĀņĢłņĢĢĻĖ░ ļ░£ņāØ ņ£Āļ¼┤, Ļ│ĀņĢłņĢĢĻĖ░ ļ░£ņāØ ņŗ£ņĀÉ ļō▒ņØś ļ╣äĻĄÉ ļČäņäØņØä ņ£äĒĢśņŚ¼ independent two sample t-test, chi-squared test, Wilcoxon rank sum testļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ĒåĄĻ│äĒĢÖņĀü ļČäņäØņØĆ R software packages (R Studio, Boston, MA, USA)ļź╝ ņØ┤ņÜ®ĒĢśņśĆĻ│Ā, pĻ░ÆņØ┤ 0.05 ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ ĒåĄĻ│äņĀü ņ£ĀĒÜ©ņä▒ņØä Ļ░Ćņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż.
ļģ╣ļé┤ņןņ£╝ļĪ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØä ļ░øņØĆ ņ┤Ø 108ņĢłņØ┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉśņŚłļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØä ņéĮņ×ģĒĢ£ ĻĄ░ņØĆ 55ņĢłņØ┤ņŚłĻ│Ā, ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØä ņéĮņ×ģĒĢśņ¦Ć ņĢŖņØĆ ļīĆņĪ░ĻĄ░ņØĆ 53ņĢłņØ┤ņŚłļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ Ļ░üĻ░ü 60.2 ┬▒ 14.5ņäĖ, 61.2 ┬▒ 14.0ņäĖļĪ£, ļæÉ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļ®░(p=0.71), ļé©ļģĆ ļ╣äņ£©ņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØś Ļ▓ĮņÜ░ ļé©ņä▒ņØ┤ 72.7%, ļīĆņĪ░ĻĄ░ņØś Ļ▓ĮņÜ░ ļé©ņä▒ņØ┤ 66.0%ļĪ£ ļæÉ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.59). ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņŚÉņä£ ņŗĀņāØĒśłĻ┤Ćļģ╣ļé┤ņןņØ┤ Ļ░üĻ░ü 26ņĢł(47.3%), 30ņĢł(56.6%)ņ£╝ļĪ£ Ļ░Ćņן ļ¦ÄņØĆ ļ╣äņ£©ņØä ņ░©ņ¦ĆĒ¢łĻ│Ā, ļŗżņØīņ£╝ļĪ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØ┤ Ļ░üĻ░ü 16ņĢł(29.1%), 15ņĢł(28.3%)ņ£╝ļĪ£ ļ¦ÄņĢśļŗż. ņØ┤ņÖĖņŚÉļÅä ĒżļÅäļ¦ēņŚ╝Ļ│╝ ņŚ░Ļ┤ĆļÉ£ ņØ┤ņ░©ļģ╣ļé┤ņן, Ļ▒░ņ¦ōļ╣äļŖśļģ╣ļé┤ņן, ņøÉļ░£ĒÅÉņćäĻ░ü ļģ╣ļé┤ņן ĒÖśņ×ÉĻ░Ć ĒżĒĢ©ļÉśņŚłņ£╝ļ®░, ļæÉ ĻĄ░ Ļ░äņØś ļģ╣ļé┤ņן ņóģļźśņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.86, Table 1). ļæÉ ĻĄ░ Ļ░ä ņłĀ ņĀä ņĢłņĢĢ, ņłĀ ņĀä ņĢłņĢĢĒĢśĻ░ĢņĀ£ Ļ░£ņłś, ņłĀ ņĀä logMAR ņŗ£ļĀź, ņłĀ Ēøä 1ļģä ļÆż logMAR ņŗ£ļĀź ņŚŁņŗ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż.
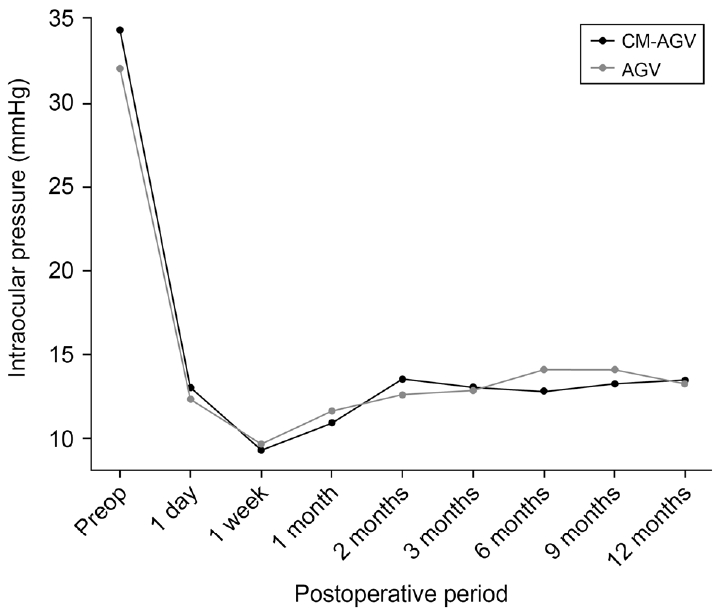
ļæÉ ĻĄ░ ļ¬©ļæÉ ņĢłņĢĢ, ņĢłņĢĢĒĢśĻ░ĢņĀ£ Ļ░£ņłśļŖö ņłśņłĀ ņĀäĒøäļĪ£ ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝ ļ│┤ņśĆļŖöļŹ░, ņĢłņĢĢņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ņłĀ ņĀä 34.4 ┬▒ 10.2 mmHgņŚÉņä£ ņłĀ Ēøä 13.5 ┬▒ 4.4 mmHgļĪ£ Ļ░ÉņåīĒĢśņśĆĻ│Ā(p<0.001), ļīĆņĪ░ĻĄ░ņŚÉņä£ļŖö ņłĀ ņĀä 32.1 ┬▒ 9.4 mmHgņŚÉņä£ ņłĀ Ēøä 13.3 ┬▒ 4.0 mmHgļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż(p<0.001, Fig. 1). ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś Ļ░£ņłśļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ņłĀ ņĀä 3.9 ┬▒ 0.4Ļ░£ņŚÉņä£ ņłĀ Ēøä 2.4 ┬▒ 1.1Ļ░£ļĪ£, ļīĆņĪ░ĻĄ░ņŚÉņä£ļŖö ņłĀ ņĀä 3.7 ┬▒ 0.8Ļ░£ņŚÉņä£ ņłĀ Ēøä 1.8 ┬▒ 1.3Ļ░£ļĪ£ ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż(p<0.001). ņłĀ Ēøä ņ¢æ ĻĄ░ Ļ░äņØś ņĢłņĢĢņØś ņØśļ»Ė ņ׳ļŖö ņ░©ņØ┤ļŖö ņŚåņŚłĻ│Ā(p=0.20), ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś Ļ░£ņłśļÅä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.09).
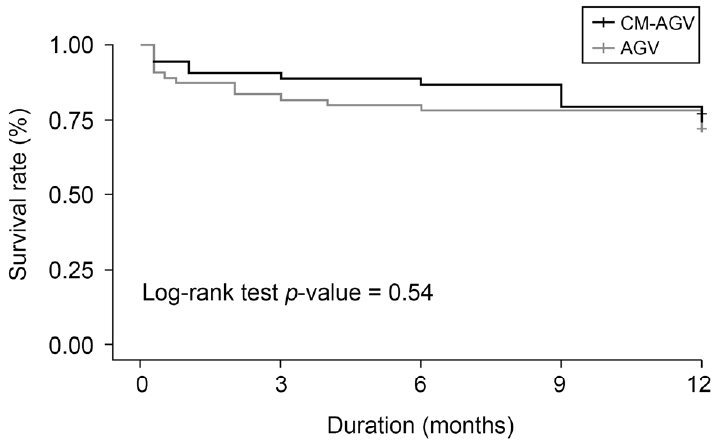
Kaplan-Meier ņāØņĪ┤ļČäņäØņØä ņØ┤ņÜ®ĒĢ£ ņłĀ Ēøä 1ļģäĻ░ä ļłäņĀü ņä▒Ļ│ĄļźĀņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 78.2%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 79.2%ļĪ£ ļæÉ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.54, Fig. 2). ņłśņłĀ ņŗżĒī© ņ£äĒŚśņÜöņØĖņØä ņ░ŠĻ│Āņ×É ņŗ£Ē¢ēĒĢ£ ļŗ©ņł£ Cox ĒÜīĻĘĆļČäņäØ Ļ▓░Ļ│╝ ņä▒ļ│ä, ļŗ╣ļć©, Ļ│ĀĒśłņĢĢ, ļģ╣ļé┤ņן ņóģļźś, ņłĀ ņĀä ļ░▒ļé┤ņןņłśņłĀ ņŚ¼ļČĆ, tube tipņØś ņ£äņ╣ś, ņłśņłĀ ņĀä ņĢłņĢĢ, ņłśņłĀ ņĀä ņŗ£ļĀź, ņłśņłĀ ņĀä ņé¼ņÜ® ņĢĮļ¼╝ Ļ░£ņłś ļō▒ņØĆ ņłśņłĀ ņä▒Ļ│Ą ņŚ¼ļČĆņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(ļ¬©ļæÉ p>0.05, Table 2). ņłśņłĀ 1ņŻ╝ņ¦Ė ņĢłņĢĢņØ┤ ļåÆĻ▒░ļéś(hazard ratio [HR]=1.14, 95% confidence interval [CI]=1.06-1.23, p<0.001), Ļ│ĀņĢłņĢĢĻĖ░ļź╝ Ļ▓¬ņØĆ Ļ▓ĮņÜ░(HR=3.81, 95% CI=1.72-8.41, p<0.001) ņłśņłĀ ņŗżĒī©ņÖĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņśĆņ£╝ļéś ļŗżņżæ Cox ĒÜīĻĘĆļČäņäØņŚÉņä£ Ļ│ĀņĢłņĢĢĻĖ░ļź╝ Ļ▓¬ņØĆ Ļ▓ĮņÜ░ļ¦ī ņłśņłĀ ņŗżĒī©ņÖĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņŚłļŗż(HR=5.16, 95% CI=1.48-17.95, p=0.009; Table 3).
ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ ņżæ 13ņĢł(23.6%), ļīĆņĪ░ĻĄ░ ņżæ 8ņĢł(15.1%)ņŚÉņä£ ņłĀ Ēøä logMAR ņŗ£ļĀźņØ┤ ņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ 2ņżä ņØ┤ņāü Ļ░ÉņåīĒĢśņśĆņ£╝ļéś ņ¢æ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.12). ļŗżļ¦ī, ņĢäļ®öļō£ļ░ĖļĖīļź╝ ņĀäļ░®ņŚÉ ņéĮņ×ģĒĢ£ Ļ▓ĮņÜ░ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņéĮņ×ģĒĢ£ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢśņŚ¼ ņŗ£ļĀźņĀĆĒĢśņÖĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņśĆĻ│Ā(p=0.011), ĻĘĖ ņÖĖņŚÉ ļéśņØ┤, ņä▒ļ│ä, ļģ╣ļé┤ņן ņóģļźś, ļģ╣ļé┤ņןņłśņłĀ ņĀä ļ░▒ļé┤ņןņłśņłĀ ņŚ¼ļČĆ, ņłśņłĀ ņĀä ņŗ£ļĀź, Ļ│ĀņĢłņĢĢĻĖ░ ņ£Āļ¼┤ ļō▒ņØĆ ņŗ£ļĀźņĀĆĒĢśņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Table 4). Ļ┤ĆņØś ņ£äņ╣śņÖĆ ņŗ£ļĀźņĀĆĒĢśņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ£ ņČöĻ░Ć ļ╣äĻĄÉ ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, Ļ┤ĆņØ┤ ņĀäļ░®ņŚÉ ņ£äņ╣śĒĢ£ Ļ▓ĮņÜ░ļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 45ņĢł(81.8%), ļīĆņĪ░ĻĄ░ņŚÉņä£ 41ņĢł(77.4%)ļĪ£ ļæÉ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.74). ļ░ĖļĖīĻ░Ć ņĀäļ░®ņŚÉ ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢśņŚ¼ ņłĀ Ēøä 1ļģä ļÆż Ļ░üļ¦ēļé┤Ēö╝ņäĖĒż Ļ░Éņåī ņĀĢļÅäĻ░Ć ļŹö Ēü¼ĻĖ┤ Ē¢łņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļŖö ņĢäļŗłņŚłņ£╝ļ®░(p=0.31), ĻĘĖ ņÖĖ ņłśņłĀ ņĀä ļ░▒ļé┤ņןņłśņłĀ ņŚ¼ļČĆ, ņŗ£ļĀźņĀĆĒĢśļź╝ ņ£Āļ░£ĒĢĀ ļ¦īĒĢ£ ļ░▒ļé┤ņן ļ░£ņāØļźĀ, 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ņ£Āļ¼┤, needling ņ£Āļ¼┤, Ļ│ĀņĢłņĢĢĻĖ░ ņ£Āļ¼┤, Ļ│╝Ļ▒░ļĀź, ļģ╣ļé┤ņן ņóģļźś, ņłĀ ņĀä ņŗ£ļĀź, ņłĀ ņĀä ņĢłņĢĢ, ņłĀ ņĀä ņĢłņĢĢĒĢśĻ░ĢņĀ£ Ļ░£ņłśņŚÉņä£ļÅä ņØśļ»Ė ņ׳ļŖö ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(Table 5).
ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ ņżæ 7ņĢł(12.7%)ņŚÉņä£ ņłĀ Ēøä ņĢłņĢĢ ņĪ░ņĀłņØä ņ£äĒĢśņŚ¼ 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ņØ┤ ņżæ 5ņĢłņŚÉņä£ļŖö needling ņ╣śļŻīļź╝ ļ│æĒ¢ēĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ░ņŚÉņä£ļŖö ņ┤Ø 16ņĢł(30.2%)ņŚÉņä£ 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ņØ┤ ņżæ 12ņĢłņŚÉņä£ļŖö needling ņ╣śļŻīļź╝ ļ│æĒ¢ēĒĢśņśĆļŗż. 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ļŗ╣ņŗ£ ņĢłņĢĢņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░(7ņĢł)ņŚÉņä£ļŖö 19.7 ┬▒ 3.5 mmHg (15-24 mmHg)ņśĆĻ│Ā, ļīĆņĪ░ĻĄ░(16ņĢł)ņŚÉņä£ļŖö 19.1 ┬▒ 4.0 mmHg (13-25 mmHg)ļĪ£ ņ¢æ ĻĄ░ Ļ░ä 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ļŗ╣ņŗ£ ņĢłņĢĢņØĆ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.719). Needling ņŗ£Ē¢ē ņŗ£ ņĢłņĢĢņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░(5ņĢł)ņŚÉņä£ļŖö 20.4 ┬▒ 3.2 mmHg (15-25 mmHg)ņśĆĻ│Ā, ļīĆņĪ░ĻĄ░(12ņĢł)ņŚÉņä£ļŖö 20.8 ┬▒ 3.5 mmHg (13-25 mmHg)ļĪ£ ņŚŁņŗ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.669). ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ņłĀ Ēøä 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ņ£ĀņØśĒĢśĻ▓ī ņĀüņŚłņ£╝ļ®░(p=0.048), needlingņØä ņŗ£Ē¢ēĒĢ£ ņĢłĻĄ¼ ņłśļŖö ļæÉ ĻĄ░ Ļ░ä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦ĆļŖö ņĢŖņĢśņ£╝ļéś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ Ļ▓ĮĻ│äņĀüņ£╝ļĪ£ ņŗ£Ē¢ē ĒܤņłśĻ░Ć ņĀüņØĆ Ļ▓ĮĒ¢źņä▒ņØä ļ│┤ņśĆļŗż(p=0.067). ļæÉ ĻĄ░ Ļ░äņØś 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ĒܤņłśļŖö ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ĻĖ┤ Ē¢łņ£╝ļéś 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ņŚ¼ļČĆĻ░Ć ņłśņłĀ ņŗżĒī©ņÖĆļŖö ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśĻ│Ā(p=0.103), needling ņŚ¼ļČĆļÅä ņłśņłĀ ņŗżĒī©ņÖĆļŖö ņØśļ»Ė ņ׳ļŖö ņŚ░Ļ┤ĆņØĆ ņŚåņŚłļŗż(p=0.126).
ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ Ļ░äņØś Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢ£ ļ╣äņ£©ņØĆ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.53). ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØś Ļ▓ĮņÜ░ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢ£ 7ņĢł(12.7%) ņżæ 3ņĢłņŚÉņä£ ņĄ£ņóģņĀüņ£╝ļĪ£ ļģ╣ļé┤ņןņłśņłĀņØ┤ ņŗżĒī©ĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ░ņŚÉņä£ļŖö 4ņĢł(7.5%)ņŚÉņä£ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢśņśĆĻ│Ā, ņØ┤ ņżæ 3ņĢłņŚÉņä£ ņĄ£ņóģņĀüņ£╝ļĪ£ ļģ╣ļé┤ņןņłśņłĀņØ┤ ņŗżĒī©ĒĢśņśĆļŗż. Ļ│ĀņĢłņĢĢĻĖ░ ļ░£ņāØ ņŗ£ĻĖ░ļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ņłĀ Ēøä ĒÅēĻĘĀ 8.0 ┬▒ 2.3ņŻ╝ ĒøäņśĆĻ│Ā, ļīĆņĪ░ĻĄ░ņŚÉņä£ļŖö 3.5 ┬▒ 3.3ņŻ╝ ĒøäļĪ£, ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ņ£ĀņØśĒĢśĻ▓ī ļŖ”Ļ▓ī ļ░£ņāØĒĢśņśĆļŗż(p=0.049).
ņłśņłĀ Ēøä ļ░£ņāØĒĢ£ ĒĢ®ļ│æņ”Øņ£╝ļĪ£ļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ņØ╝ņŗ£ņĀüņØĖ ņĀĆņĢłņĢĢņ”Ø 1ņĢł, ņĀĆņĢłņĢĢņ”ØĻ│╝ ņŚ░Ļ┤ĆļÉ£ ļ¦źļØĮļ¦ēļ░Ģļ”¼ 1ņĢł, Ļ┤Ćļ»Ėļ×Ć 1ņĢłņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā, 2ņĢłņŚÉņä£ Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżņØś Ļ░ÉņåīļĪ£ ņØĖĒĢ£ Ļ┤ĆņØś ņ£äņ╣śņĪ░ņĀĢņłĀņØä ņŗ£Ē¢ē ļ░øņĢśļŗż. ļīĆņĪ░ĻĄ░ņŚÉņä£ļŖö ņØ╝ņŗ£ņĀüņØĖ ņĀĆņĢłņĢĢņ”Ø 1ņĢł, ņĀĆņĢłņĢĢņ”ØĻ│╝ ņŚ░Ļ┤ĆļÉ£ ļ¦źļØĮļ¦ēļ░Ģļ”¼ 1ņĢłņØ┤ ļ░£ņāØĒĢśņśĆņ£╝ļ®░ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł ņĢłļé┤ņŚ╝ņØĆ ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļæÉ ĻĄ░ Ļ░äņØś ņłśņłĀ Ēøä ĒĢ®ļ│æņ”Ø ļ░£ņāØņØĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.27).
ļ│Ė ņŚ░ĻĄ¼ļŖö ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£Ē¢ēĒĢ£ MMCļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģ ņŚ¼ļČĆņŚÉ ļö░ļźĖ ņłśņłĀ ņä▒Ļ│ĄļźĀņØä ļ╣äĻĄÉĒĢ┤ļ│┤Ļ│Āņ×É ĒĢ£ ņŚ░ĻĄ¼ņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĻĖ░ņĪ┤ ļ│┤Ļ│ĀņŚÉ ļ╣äĒĢśņŚ¼ ļ¦ÄņØĆ ņłśņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēļÉśņŚłĻ│Ā, MMCļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģ ņŚ¼ļČĆņŚÉ ļö░ļźĖ ņä▒Ļ│ĄļźĀņØś ņĄ£ņ┤ł ļ│┤Ļ│ĀļØ╝ļŖö ņĀÉņŚÉņä£ ņØśņØśĻ░Ć ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ĻĖ░ņĪ┤ņØś MMCļź╝ ļ│æņÜ®ĒĢśņ¦Ć ņĢŖņØĆ ņłśņłĀņŚÉņä£ņØś Ļ▓░Ļ│╝ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģ ņŚ¼ļČĆņŚÉ ļö░ļźĖ ņłśņłĀ ņä▒Ļ│ĄļźĀņØś ņØśļ»Ė ņ׳ļŖö ņ░©ņØ┤ļŖö ņŚåņŚłĻ│Ā, Ļ│ĀņĢłņĢĢĻĖ░ņØś ļ░£ņāØļźĀ ņŚŁņŗ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż.
ĻĖ░ņĪ┤ņØś ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģ ņŚ¼ļČĆņŚÉ ļö░ļźĖ ņä▒Ļ│ĄļźĀņØä ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ļź╝ ņé┤ĒÄ┤ļ│┤ļ®┤, Kim et al [23]ņØĆ 8ņĢłņØś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ 12ņĢłņØś ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆĻ│Ā, ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņŚåņØ┤ ņĢłņĢĢņØ┤ 21 mmHg ņØ┤ĒĢśļĪ£ ņ£Āņ¦ĆļÉśļŖö Ļ▓ĮņÜ░ļź╝ ņÖäļ▓ĮĒĢ£ ņä▒Ļ│Ą, ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņé¼ņÜ® ņ£Āļ¼┤ņÖĆ ņāüĻ┤ĆņŚåņØ┤ ņĢłņĢĢņØ┤ 21 mmHg ņØ┤ĒĢśļĪ£ ņ£Āņ¦ĆļÉśļŖö Ļ▓ĮņÜ░ļź╝ ņĀ£ĒĢ£ņĀüņØĖ ņä▒Ļ│Ąņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ņØ┤ ļĢī ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ ĻĘĖļĀćņ¦Ć ņĢŖņØĆ ĻĄ░ņŚÉņä£ ņĀ£ĒĢ£ņĀüņØĖ ņä▒Ļ│ĄļźĀņØĆ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś(75% vs. 50%) ņÖäļ▓ĮĒĢ£ ņä▒Ļ│ĄļźĀņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØä ņéĮņ×ģĒĢ£ ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśĻĖ░ ļĢīļ¼ĖņŚÉ(50% vs. 8.3%) ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØ┤ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØś ņä▒Ļ│ĄļźĀ Ē¢źņāüņŚÉ ļÅäņøĆņØä ņżĆļŗżĻ│Ā ĒĢśņśĆļŗż. Ļ│ĀņĢłņĢĢĻĖ░ļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØś 12.5%, ļīĆņĪ░ĻĄ░ņØś 33.3%ņŚÉņä£ ļ░£ņāØĒ¢łņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.375). Sastre-Ib├Ī├▒ez et al [24]ņØĆ ļ░▒ņØĖ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 27ņĢłņØś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ 31ņĢłņØś ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆņ£╝ļ®░, ņłśņłĀ Ēøä 1ļģäņ¦Ė ņä▒Ļ│ĄļźĀņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 69.2%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 76.7%ļĪ£ ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż(p=0.531). Ļ│ĀņĢłņĢĢĻĖ░ļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØś 55%, ļīĆņĪ░ĻĄ░ņØś 56%ņŚÉņä£ ļ░£ņāØĒ¢łņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśĻ│Ā(p=0.947), ļæÉ ĻĄ░ Ļ░äņØś ĒĢ®ļ│æņ”Ø ļ░£ņāØļźĀļÅä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņ¢┤ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØ┤ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØś ņä▒Ļ│ĄļźĀņØ┤ļéś ņĢłņĀäņä▒ņØś Ē¢źņāüņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ļ¬╗ĒĢ£ļŗżĻ│Ā ĒĢśņśĆļŗż. Harizman et al [25]ņØ┤ ņŗ£Ē¢ēĒĢ£ ņĀäĒ¢źņĀü ļ¼┤ņ×æņ£ä ļ░░ņĀĢ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 13ņĢłņØś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░Ļ│╝ 13ņĢłņØś ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆņ£╝ļ®░, 1ļģäņ¦Ė ņä▒Ļ│ĄļźĀņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 60%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 25.5%ņśĆņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłĻ│Ā(p=0.188), Ļ│ĀņĢłņĢĢĻĖ░ļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 38.5%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 61.5% ļ░£ņāØĒ¢łņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.239). ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ņÖĆļŖö ļŗżļź┤Ļ▓ī ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ņŗ£ MMCļź╝ ļ│æĒĢ®ĒĢśņŚ¼ ņłśņłĀĒĢśņśĆņ£╝ļ®░, ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉ ļ╣äĒĢśņŚ¼ Ēø©ņö¼ ļ¦ÄņØĆ ņłśņØś ĒĢ£ĻĄŁņØĖ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. ņØ┤ņĀä ņŚ░ĻĄ¼ņÖĆ ņłśņłĀļ▓ĢņŚÉ ļŗżņåī ņ░©ņØ┤Ļ░Ć ņ׳ņ£╝ļéś ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś Ļ▓ĮņÜ░ ņłĀ Ēøä 1ļģäņ¦Ė ņä▒Ļ│ĄļźĀņØ┤ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 78.2%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 79.2%ļĪ£ ļæÉ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. Ļ│ĀņĢłņĢĢĻĖ░ļŖö ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 12.7%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 7.5%Ļ░Ć ļ░£ņāØĒĢśņŚ¼ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżĻ│╝ļŖö ļŗżļź┤Ļ▓ī ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ļ░£ņāØļźĀņØ┤ ņĢĮĻ░ä ļåÆņĢśņ£╝ļéś ļīĆņāüņĢłņØś ņłśĻ░Ć ņĀüņŚłĻ│Ā, ĒåĄĻ│äņĀüņ£╝ļĪ£ļÅä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ņłśņłĀ Ēøä ĒĢ®ļ│æņ”ØņØś ļ░£ņāØļźĀļÅä ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ļŗżļ¦ī ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņØ┤ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ņä£ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢśļŖö ņŗ£ĻĖ░Ļ░Ć ņ£ĀņØśĒĢśĻ▓ī ļŖ”ņŚłĻ│Ā, 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśļŖö ļ╣äņ£©ļÅä ņ£ĀņØśĒĢśĻ▓ī ņĀüņŚłļŗż. ļ╣äļĪØ ņĄ£ņóģ ņłśņłĀ ņä▒Ļ│ĄļźĀņØĆ ļ╣äņŖĘĒĢśņśĆņ£╝ļéś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģ ņŗ£ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļŖ”Ļ▓ī ļéśĒāĆļéśļ®┤ ņłśņłĀ Ēøä ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ļŗżņŗ£ ņé¼ņÜ®ĒĢśļŖö ņŗ£ĻĖ░Ļ░Ć ļŖ”ņ¢┤ņ¦ł ņłś ņ׳Ļ│Ā, 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀ ļ╣äņ£©ņØ┤ ņĀüņ£╝ļ®┤ ņÖĖļל ļé┤ņøÉ Ēܤņłś ļ░Å 5-FUļĪ£ ņØĖĒĢ£ ĒĢ®ļ│æņ”Ø Ļ░ĆļŖźņä▒ņØä ņżäņØ╝ ņłś ņ׳ļŗżļŖö ņĀÉņŚÉņä£ ņןņĀÉņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ĻĖ░ņĪ┤ņØś MMCļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ Ļ│ĀņĢłņĢĢĻĖ░ņØś ļ░£ņāØļźĀņØĆ Alvarado et al [17]ņØś Ļ▓ĮņÜ░ 28.4%, Lim et al [19]ņØś Ļ▓ĮņÜ░ 20.0%ļØ╝Ļ│Ā ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ 12.7%, ļīĆņĪ░ĻĄ░ņŚÉņä£ 7.5%ņŚÉņä£ ļ░£ņāØĒĢśņŚ¼ ĻĖ░ņĪ┤ ļ│┤Ļ│ĀļÉ£ ņŚ░ĻĄ¼ļōżņŚÉ ļ╣äĒĢśņŚ¼ ļé«ņØĆ ļ░£ņāØļźĀņØä ļ│┤ņśĆļŗż. ņØ┤ļŖö ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś ņäĀņĀ£ņĀüņØĖ ņé¼ņÜ® ļĢīļ¼Ėņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņŚÉņä£ ņłĀ Ēøä ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ļŗżņŗ£ ņé¼ņÜ®ĒĢ£ ņŗ£ņĀÉĻ│╝ ļŗ╣ņŗ£ ņĢłņĢĢ ņłśņ╣śņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ│┤Ļ│ĀļÉśņ¢┤ņ׳ņ¦Ć ņĢŖņĢä ņĀĢĒÖĢĒĢ£ ļ╣äĻĄÉĻ░Ć ņ¢┤ļĀżņÜ┤ ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ņ£╝ļéś, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĀäņ▓┤ ĒÖśņ×É ņżæ 57ņĢł(52.8%)ņŚÉņä£ ņĢłņĢĢņØ┤ 18 mmHgļ│┤ļŗż ļåÆņ¦Ć ņĢŖņĢśņ£╝ļéś ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņé¼ņÜ®ĒĢśĻĖ░ ņŗ£ņ×æĒĢśņśĆļŗż. ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņäĀņĀ£ņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ ĒÖśņ×ÉņØś 73.7%ļ¦ī Ļ│ĀņĢłņĢĢĻĖ░ņØś ĻĖ░ņżĆņ£╝ļĪ£ ņĀĢņØśĒĢ£ ņłśņłĀ 3Ļ░£ņøö ņØ┤ļé┤ņŚÉ ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░ņŚÉ ĒĢ┤ļŗ╣ļÉśņŚłļŗż. Ļ│ĀņĢłņĢĢĻĖ░ņØś ņ£Āļ¼┤Ļ░Ć ņłśņłĀ ņä▒Ļ│ĄļźĀņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ņä£ļŖö ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż. Ļ│ĀņĢłņĢĢĻĖ░ņØś ņ£Āļ¼┤Ļ░Ć ņłśņłĀ ņŗżĒī©ņÖĆ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņŚåļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ņ£╝ļéś[26], Won and Sung [27]Ļ│╝ Nouri-Mahdavi and Caprioli [28]ņØĆ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ņłśņłĀ ņŗżĒī©ņØś ņ£äĒŚś ņÜöņØĖņØ┤ļØ╝Ļ│Ā ĒĢśņśĆļŗż. Jung et al [29]ņŚÉ ņØśĒĢśļ®┤ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņĀäņĢłļČĆļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ĒåĄĒĢ┤ ņŚ░ņåŹņĀüņ£╝ļĪ£ ĒÖĢņØĖĒĢ£ ņŚ¼Ļ│╝ĒżņØś ĒśĢĒā£ļź╝ ļ│┤ļ®┤, Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ĻĘĖļĀćņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢśņŚ¼ ņŚ¼Ļ│╝ĒżņØś ļ░śņé¼ļÅäĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļåÆļŗżĻ│Ā ĒĢśņśĆļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ Ļ│ĀņĢłņĢĢĻĖ░ļŖö ņ┤łĻĖ░ ņ░Įņāü ņ╣śņ£Ā Ļ│╝ņĀĢņŚÉņä£ ļ░£ņāØĒĢśļŖö Ļ▓░ļ¦ēņØś ņä¼ņ£ĀĒÖöļĪ£ ņØĖĒĢ┤ ļ░®ņłśņ£ĀņČ£ ļČĆņ£äņØś ņĀĆĒĢŁņØ┤ ņ”ØĻ░ĆĒĢśļ®░ ļ░£ņāØĒĢśļŖö Ļ▓āņØä ņĢī ņłś ņ׳Ļ│Ā, ņŚ¼Ļ│╝ĒżņØś ņ”ØĻ░ĆļÉ£ ņä¼ņ£ĀĒÖöļŖö ņןĻĖ░ņĀüņ£╝ļĪ£ ņłśņłĀ ņŗżĒī©ņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. Won and Sung [27]ņŚÉ ņØśĒĢśļ®┤ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢ£ ĒÖśņ×É ņżæ 76%ņŚÉņä£ ņłśņłĀ 1ļģä ļÆż ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äļĪ£ ĒĢśĻ░ĢļÉśņŚłļŗżĻ│Ā ĒĢśļéś, ņ¦äĒ¢ēļÉ£ ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļŖö ņØ╝ņŗ£ņĀüņØĖ ņĢłņĢĢņāüņŖ╣ļ¦īņ£╝ļĪ£ļÅä ņŗ£ņŗĀĻ▓ĮņåÉņāüņØ┤ ņ¦äĒ¢ēĒĢĀ ņłś ņ׳ņ¢┤ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØ ņŗ£ ņŗ£ļĀźņśłĒøäĻ░Ć ļČłļ¤ēĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ Cox ĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØś ņŗżĒī© ņ£äĒŚśņÜöņØĖņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ļŖö ĻĘĖļĀćņ¦Ć ņĢŖņØĆ ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņłśņłĀ ņŗżĒī©ņ£©ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ ļģ╣ļé┤ņןņłśņłĀņØ┤ ņŗżĒī©ĒĢ£ 12ņĢł ņżæ 3ņĢł(25%)ņØĆ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļ░£ņāØĒĢ£ ļłłņØ┤ņŚłĻ│Ā, ņłśņłĀņØ┤ ņŗżĒī©ĒĢ£ ļīĆņĪ░ĻĄ░ 11ņĢł ņżæ 3ņĢł(27.3%)ņØĆ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ņ׳ņŚłļŗż. ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģņłĀņØ┤ Ļ│ĀņĢłņĢĢĻĖ░ ļ░£ņāØ ņŗ£ĻĖ░ļź╝ ļŖ”ņČöļŖö ļŹ░ļŖö ļÅäņøĆņØ┤ ļÉśļéś, ļ░£ņāØļźĀ ņ×Éņ▓┤ļź╝ ņżäņØ┤ņ¦ĆļŖö ļ¬╗ĒĢ£ Ļ┤ĆĻ│äļĪ£ Ļ▓░ĻĄŁ ņ¢æ ĻĄ░ņØś ņłśņłĀ ņä▒Ļ│ĄļźĀņØ┤ ļ╣äņŖĘĒĢśņśĆņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ņĢäļ®öļō£ļ░ĖļĖīņØś ņ£äņ╣śņÖĆ ņŗ£ļĀźņĀĆĒĢśņŚÉ ļīĆĒĢ£ ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ļź╝ ņé┤ĒÄ┤ļ│┤ļ®┤, Alobaida et al [30]ņØĆ ļģ╣ļé┤ņן ņŚ¼Ļ│╝ņןņ╣śĻ┤ĆņØ┤ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņ£äņ╣śĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ņĀäļ░®ņŚÉ ņ£äņ╣śĒĢ£ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢśņŚ¼ ņłĀ Ēøä ņŗ£ļĀźņŚÉ ņśüĒ¢źņØä ņżä ļ¦īĒĢ£ ņĀäļ░®ņČ£ĒśłņØ┤ ļŹ£ ļ░£ņāØĒĢśĻ│Ā ņןĻĖ░ņĀüņ£╝ļĪ£ Ļ░üļ¦ēļé┤Ēö╝ņäĖĒż Ļ░ÉņåīļÅä ņĀüļŗżĻ│Ā ĒĢśņśĆļŗż. ļ░śļ®┤ Bayer and ├¢nol [31]ņØĆ Ļ┤ĆņØä ņĀäļ░®ņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░Ļ│╝ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░ Ļ░äņØś ņŗ£ļĀźņŚö ņ░©ņØ┤Ļ░Ć ņŚåļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Ļ┤ĆņØä ņĀäļ░®ņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░ņØ┤ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņłĀ Ēøä 1ļģä ļÆż ņØśļ»Ė ņ׳ļŖö ņŗ£ļĀźņĀĆĒĢśĻ░Ć ņ׳ņŚłļŗż. Ļ┤ĆņØä ņĀäļ░®ņŚÉ ņéĮņ×ģĒĢ£ ĒÖśņ×ÉļŖö 86ņĢł, ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņéĮņ×ģĒĢ£ ĒÖśņ×É 22ņĢłņ£╝ļĪ£, ņ¢æ ĻĄ░ Ļ░äņØś ĒÖśņ×ÉņłśņŚÉ Ēü░ ņ░©ņØ┤Ļ░Ć ņ׳ņ¢┤ ņĀĢĒÖĢĒĢ£ ļ╣äĻĄÉļŖö ļŗżņåī ņ¢┤ļĀĄņ¦Ćļ¦ī, ņŗ£ļĀźņĀĆĒĢśņÖĆ Ļ┤ĆļĀ©ļÉ£ ņ£äĒŚśņØĖņ×É ļČäņäØ ņŗ£ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļŖö ņÜöņØĖņØĆ ņŚåņŚłļŗż. Ļ┤ĆņØś ņ£äņ╣śņÖĆ ņŗ£ļĀźņĀĆĒĢśņÖĆņØś ņāüĻ┤ĆĻ┤ĆĻ│äņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ│┤ļŗż ļ¦ÄņØĆ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ┤ ļ│┤ņØĖļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ĒĢ£Ļ│äņĀÉņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż. ņ▓½ ļ▓łņ¦ĖļĪ£ ņłĀ Ēøä 1ļģäĻ░äņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļ╣äĻĄÉĒĢśņŚ¼ ņŗ£Ē¢ēĒĢ£ ņŚ░ĻĄ¼ņŚ¼ņä£ ļ¼┤ņ×æņ£ä ļ░░ņĀĢņØ┤ ļÉśņ¦Ć ņĢŖņĢśĻ│Ā, 1ļģäņØ┤ļ×Ć ĻĖ░Ļ░äņØĆ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØ┤ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉ ļ»Ėņ╣śļŖö ņןĻĖ░ņĀüņØĖ ņä▒Ļ│ĄļźĀņØ┤ļéś ĒĢ®ļ│æņ”Ø ļ░£ņāØļźĀņØä ņĢīņĢäļ│┤ĻĖ░ņŚö ņ¦¦ņØĆ ĻĖ░Ļ░äņØ┤ļØ╝ļŖö ņĀÉņØ┤ļŗż. ņČöĒøä ņןĻĖ░Ļ░äņØś ņĀäĒ¢źņĀü ļ¼┤ņ×æņ£ä ļīĆņĪ░ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ┤ ļ│┤ņØĖļŗż. ļæÉ ļ▓łņ¦ĖļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĀäņĢłļČĆļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü Ļ▓Ćņé¼ņØś ļČĆņ×¼ļĪ£ ņØĖĒĢśņŚ¼ ņłĀ ņĀäĒøä ņŚ¼Ļ│╝ĒżņÖĆ Ļ▓░ļ¦ē ņāüĒā£ņŚÉ ļīĆĒĢ£ ņĀĢļ░ĆĒĢ£ ļ╣äĻĄÉ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ļČĆņĪ▒ĒĢśņśĆļŗż. ņĀäņĢłļČĆļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ļź╝ ņØ┤ņÜ®ĒĢ£ ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļżäņ¦ł Ļ▓ĮņÜ░ ņłĀ Ēøä ņ░Įņāüņ╣śņ£Ā Ļ│╝ņĀĢņŚÉņä£ņØś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØś ņŚŁĒĢĀņŚÉ ļīĆĒĢ┤ ļ│┤ļŗż ļ¦ÄņØĆ ņĀĢļ│┤ļź╝ ņ¢╗ņØä ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ņäĖ ļ▓łņ¦ĖļĪ£ Jung and Park [32]ņØĆ Ļ│ĀļÅäĻĘ╝ņŗ£ ĒÖśņ×ÉņŚÉņä£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ņŗ£ Ļ│ĀņĢłņĢĢĻĖ░ņØś ļ░£ņāØļźĀņØ┤ ļåÆļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņĢäļŗłņŚłņ£╝ļéś ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģĻĄ░ņŚÉņä£ Ļ│ĀņĢłņĢĢĻĖ░Ļ░Ć ļŹö ļ¦ÄņØ┤ ļ░£ņāØĒĢ£ Ļ▓āņØ┤ ņ¢æ ĻĄ░ Ļ░äņØś Ļ│ĀļÅäĻĘ╝ņŗ£ ĒÖśņ×ÉņØś ļ╣äņ£© ņ░©ņØ┤ ļĢīļ¼ĖņØ┤ņŚłļŖöņ¦Ć ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. Ē¢źĒøä ņČöĻ░ĆņĀüņØĖ ņĢłņČĢņן ĻĖĖņØ┤, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śņŚÉ ļīĆĒĢ£ Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ ĒÖĢņØĖņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņłśņłĀ ņĀäĒøä ļé£ņŗ£ Ļ░Æ ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ ļČäņäØņØ┤ ņØ┤ļżäņ¦Ćņ¦Ć ņĢŖņĢä Ļ┤ĆņØä ņĀäļ░®ņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░ņØ┤ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æņŚÉ ņéĮņ×ģĒĢ£ ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņłĀ Ēøä 1ļģä ļÆż ņØśļ»Ė ņ׳ļŖö ņŗ£ļĀźņĀĆĒĢśĻ░Ć ļé£ņŗ£ ļ│ĆĒÖö ļĢīļ¼ĖņØĖņ¦ĆņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ļČĆņĪ▒ĒĢśņśĆļŗż. Ē¢źĒøä ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼ņŚÉņä£ ļé£ņŗ£ ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ĒÖĢņØĖņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĘĖļ¤╝ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ│Ė ņŚ░ĻĄ¼ļŖö ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ņÖĆļŖö ļŗżļź┤Ļ▓ī MMCļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØś ņśüĒ¢źņŚÉ ļīĆĒĢ┤ Ēø©ņö¼ ļ¦ÄņØĆ ņłśņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņ¦äĒ¢ēĒĢ£ ņŚ░ĻĄ¼ļØ╝ļŖö ņĀÉņŚÉņä£ ņØśņØśĻ░Ć ņ׳ļŗżĻ│Ā ņāØĻ░üĒĢ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ MMCļź╝ ļ│æņÜ®ĒĢ£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦łņØś ņéĮņ×ģņØĆ Ļ│ĀņĢłņĢĢĻĖ░ņØś ļ░£ņāØ ņŗ£ņĀÉņØä ļŖ”ņČöĻ│Ā, 5-FU Ļ▓░ļ¦ēĒĢś ņŻ╝ņ×ģņłĀņØś Ēܤņłśļź╝ ņżäņśĆņ£╝ļéś 1ļģä ņłśņłĀ ņä▒Ļ│ĄļźĀņŚÉļŖö ņ░©ņØ┤Ļ░Ć ņŚåļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ļśÉĒĢ£ ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ņéĮņ×ģ ņŚ¼ļČĆņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ ņłśņłĀ Ēøä Ļ│ĀņĢłņĢĢĻĖ░ ļ░£ņāØņØĆ ņłśņłĀ ņŗżĒī©ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņ£ĀņØśĒĢ£ ņ£äĒŚśņØĖņ×Éņ×äņØä ĒÖĢņØĖĒĢśņśĆļŗż.
Figure┬Ā1.
Preoperative (Preop) and postoperative intraocular pressure change in collagen matrix inserted-Ahmed valve implant surgery (CM-AGV) group and conventional Ahmed valve implant surgery (AGV) group.
Figure┬Ā2.
Kaplan-Meier curve of probability of success for collagen matrix inserted Ahmed valve implant surgery (CM-AGV) group and conventional Ahmed valve implant surgery (AGV) group. Success was defined as intraocular pressure (IOP) between 6 mmHg and 18 mmHg during postoperative one-year period and no serious postoperative complications including visual acuity loss. If IOP did not decrease by more than 20% from baseline IOP or additional surgery except subconjunctival 5-fluorouracil injection or needling was needed, it was considered as failure.
Table┬Ā1.
Comparison of baseline characteristics between collagen matrix inserted-Ahmed valve implanted group and conventional Ahmed valve implanted group
| Characteristic | Collagen matrix inserted -Ahmed valve implantation (n = 55) | Conventional Ahmed valve implantation (n = 53) | p-value | |
|---|---|---|---|---|
| Age (years) | 60.2 ┬▒ 14.5 | 61.2 ┬▒ 14.0 | 0.710* | |
| Sex | 0.585ŌĆĀ | |||
| ŌĆā | Male | 40 (72.7) | 35 (66.0) | |
| Female | 15 (27.3) | 18 (34.0) | ||
| Diagnosis | 0.308ŌĆĀ | |||
| Neovascular glaucoma | 26 (47.3) | 30 (56.6) | ||
| Uveitic glaucoma | 7 (12.7) | 6 (11.3) | ||
| Open-angle glaucoma | 16 (29.1) | 15 (28.3) | ||
| Pseudoexfoliative glaucoma | 5 (9.1) | 0 | ||
| Angle closure glaucoma | 1 (1.8) | 2 (3.8) | ||
| Number of preoperative medication | 3.9 ┬▒ 0.4 | 3.7 ┬▒ 0.8 | 0.098ŌĆĪ | |
| Preoperative intraocular pressure (mmHg) | 34.4 ┬▒ 10.2 | 32.1 ┬▒ 9.4 | 0.199ŌĆĪ | |
Table┬Ā2.
Univariate Cox regression analysis of risk factors associated with surgical failure after Ahmed valve implantation
| Hazard ratio (95% confidence interval) | p-value* | |
|---|---|---|
| Age (years) | 0.98 (0.95-1.01) | 0.15 |
| Sex | ||
| ŌĆāFemale vs. male (ref.) | 1.02 (0.44-2.34) | 0.97 |
| Diabetes mellitus (n = 70) | ||
| ŌĆāYes vs. no (ref.) | 1.75 (0.62-4.92) | 0.29 |
| Hypertension (n = 48) | ||
| ŌĆāYes vs. no (ref.) | 0.71 (0.08-6.08) | 0.75 |
| Diagnosis | ||
| ŌĆāNVG vs. POAG (ref.) | 2.36 (0.69-8.06) | 0.17 |
| ŌĆāUveitic glaucoma vs. POAG (ref.) | 1.17 (0.48-2.86) | 0.74 |
| Lens | ||
| ŌĆāPseudophakic vs. phakic (ref.) | 1.07 (0.40-2.83) | 0.89 |
| Tube position | ||
| ŌĆāSulcus vs. anterior chamber (ref.) | 1.31 (0.53-3.27) | 0.56 |
| Preoperative IOP | 1.00 (0.96-1.04) | 0.96 |
| Preoperative logMAR visual acuity | 1.10 (0.75-1.62) | 0.62 |
| Number of preoperative medication | 0.93 (0.53-1.63) | 0.79 |
| IOP at one day postoperatively | 1.03 (0.99-1.06) | 0.11 |
| IOP at one week postoperatively | 1.14 (1.06-1.23) | >0.001 |
| Hypertensive phase | ||
| ŌĆāYes vs. no (ref.) | 3.81 (1.72-8.41) | >0.001 |
| Collagen matrix insertion | ||
| ŌĆāYes vs. no (ref.) | 1.26 (0.59-2.70) | 0.55 |
Table┬Ā3.
Multivariate Cox regression analysis of risk factors associated with surgical failure after Ahmed valve implantation
| Hazard ratio (95% confidence interval) | p-value* | |
|---|---|---|
| Age (years) | 0.65 (0.37-1.13) | 0.12 |
| Sex | ||
| ŌĆāFemale vs. male (ref.) | 1.02 (0.37-2.80) | 0.97 |
| IOP at one day postoperatively | 1.01 (0.61-1.67) | 0.98 |
| IOP at one week postoperatively | 1.57 (0.95-2.60) | 0.08 |
| Hypertensive phase | ||
| ŌĆāYes vs. no (ref.) | 5.16 (1.48-17.95) | 0.01 |
| Collagen matrix insertion | ||
| ŌĆāYes vs. no (ref.) | 1.37 (0.64-2.96) | 0.42 |
Table┬Ā4.
Univariate logistic regression analysis of risk factors associated with visual acuity loss at one year postoperatively
| Odds ratio (95% confidence interval) | p-value* | |
|---|---|---|
| Age (years) | 0.99 (0.96-1.02) | 0.55 |
| Sex | ||
| ŌĆāFemale vs. male (ref.) | 1.33 (0.55-3.42) | 0.53 |
| Diagnosis | ||
| ŌĆāNVG vs. POAG (ref.) | 1.76 (0.19-17.32) | 0.59 |
| ŌĆāUveitic glaucoma vs. POAG (ref.) | 2.32 (0.23-3.56) | 0.41 |
| Diabetes mellitus | ||
| ŌĆāYes vs. no (ref.) | 0.62 (0.15-2.18) | 0.48 |
| Hypertension | ||
| ŌĆāYes vs. no (ref.) | 0.36 (0.92-1.18) | 0.11 |
| Lens | ||
| ŌĆāPseudophakic vs. Phakic (ref.) | 0.45 (0.12-1.34) | 0.18 |
| Tube position | ||
| ŌĆāSulcus vs. anterior chamber (ref.) | 0.29 (0.11-0.75) | 0.01 |
| Preoperative IOP | 1.03 (0.99-1.09) | 0.12 |
| Preoperative logMAR visual acuity | 0.99 (0.65-1.51) | 0.95 |
| Number of preoperative medication | 1.01 (0.48-1.92) | 0.97 |
| IOP at one day postoperatively | 0.99 (0.94-1.04) | 0.64 |
| IOP at one week postoperatively | 0.97 (0.89-1.06) | 0.48 |
| Hypertensive phase | ||
| ŌĆāYes vs. no (ref.) | 1.47 (0.51-4.89) | 0.49 |
Table┬Ā5.
Comparison of eyes between those with anterior chamber tube placement and sulcus tube placement
REFERENCES
1) Lim KS, Allan BD, Lloyd AW, et al. Glaucoma drainage devices; past, present, and future. Br J Ophthalmol 1998;82:1083-9.



2) Taglia DP, Perkins TW, Gangnon R, et al. Comparison of the Ahmed glaucoma valve, the Krupin eye valve with disk, and the double-plate Molteno implant. J Glaucoma 2002;11:347-53.


3) Wu SC, Huang SC, Lin KK. Clinical experience with the Ahmed glaucoma valve implant in complicated glaucoma. Chang Gung Med J 2003;26:904-10.

4) Lee HJ, Choi KR. Clinical experience with the Ahmed glaucoma valve implant in refractory glaucoma. J Korean Ophthalmol Soc 2006;47:933-40.
5) Lee YW, Yim JH, Lee SB, Kim CS. The factors associated with the success of Ahmed glaucoma valve implantation. J Korean Ophthalmol Soc 2005;46:1509-17.
6) Huang MC, Netland PA, Coleman AL, et al. Intermediate-term clinical experience with the Ahmed glaucoma valve implant. Am J Ophthalmol 1999;127:27-33.


7) Lee SH, Ma KT, Hong YJ. Outcome of Ahmed valve implantation in refractory glaucoma. J Korean Ophthalmol Soc 2007;48:83-90.
8) Topouzis F, Coleman AL, Choplin N, et al. Follow-up of the original cohort with the Ahmed glaucoma valve implant. Am J Ophthalmol 1999;128:198-204.

9) Lai JS, Poon AS, Chua JK, et al. Efficacy and safety of the Ahmed glaucoma valve implant in Chinese eyes with complicated glaucoma. Br J Ophthalmol 2000;84:718-21.



10) Souza C, Tran DH, Loman J, et al. Long-term outcomes of Ahmed glaucoma valve implantation in refractory glaucomas. Am J Ophthalmol 2007;144:893-900.


11) Netland PA, Ishida K, Boyle JW. The Ahmed glaucoma valve in patients with and without neovascular glaucoma. J Glaucoma 2010;19:581-6.


12) Park UC, Park KH, Kim DM, Yu HG. Ahmed glaucoma valve implantation for neovascular glaucoma after vitrectomy for proliferative diabetic retinopathy. J Glaucoma 2011;20:433-8.


13) Shen CC, Salim S, Du H, Netland PA. Trabeculectomy versus Ahmed glaucoma Valve implantation in neovascular glaucoma. Clin Ophthalmol 2011;5:281-6.


14) Kurnaz E, Kubaloglu A, Yilmaz Y, et al. The effect of adjunctive mitomycin C in Ahmed glaucoma valve implantation. Eur J Ophthalmol 2005;15:27-31.

15) Susanna R Jr, Nicolela MT, Takahashi WY. Mitomycin C as adjunctive therapy with glaucoma implant surgery. Ophthalmic Surg 1994;25:458-62.


16) Kook MS, Yoon J, Kim J, Lee MS. Clinical results of Ahmed glaucoma valve implantation in refractory glaucoma with adjunctive mitomycin C. Ophthalmic Surg Lasers 2000;31:100-6.


17) Alvarado JA, Hollander DA, Juster RP, Lee LC. Ahmed valve implantation with adjunctive mitomycin C and 5-fluorouracil: long-term outcomes. Am J Ophthalmol 2008;146:276-84.


18) Yoon HJ, Park JJ. Ahmed valve implantation with adjunctive mitomycin C and 5-fluorouracil: outcomes at one year. J Korean Ophthalmol Soc 2010;51:227-33.

19) Lim SH, Seo WM, Park JJ, Yun SU. Ahmed valve implantation with adjunctive mitomycin C and 5-fluorouracil: outcomes at 2 years. J Korean Ophthalmol Soc 2011;52:1470-7.

20) Yun IS, Lee JD, Kim YH, Ahn JH. Ahmed valve implant surgery with adjunctive mitomycin C and selective 5-fluorouracil injection. J Korean Ophthalmol Soc 2016;57:468-76.

21) Chen HS, Ritch R, Krupin T, Hsu WC. Control of filtering bleb structure through tissue bioengineering: an animal model. Invest Ophthalmol Vis Sci 2006;47:5310-4.


22) Hsu WC, Ritch R, Krupin T, Chen HS. Tissue bioengineering for surgical bleb defects: an animal study. Graefes Arch Clin Exp Ophthalmol 2008;246:709-17.


23) Kim TJ, Kang S, Jeoung JW, et al. Comparison of 1-year outcomes after Ahmed glaucoma valve implantation with and without Ologen adjuvant. BMC Ophthalmol 2018;18:45.



24) Sastre-Ib├Ī├▒ez M, Cabarga C, Canut MI, et al. Efficacy of Ologen matrix implant in Ahmed glaucoma valve implantation. Sci Rep 2019;9:3178.



25) Harizman N, Du J, Tania Tai TY. A prospective randomized trial of Ahmed glaucoma drainage device implantation with or without Ologen collagen matrix. Ophthalmol Glaucoma 2021;4:421-6.


26) Kim JJ, Shin JP. Long-term results of Ahmed valve implantation in neovascular glaucoma and the effects of intracameral bevacizumab. J Korean Ophthalmol Soc 2013;54:757-65.

27) Won HJ, Sung KR. Hypertensive phase following silicone plate Ahmed Glaucoma valve implantation. J Glaucoma 2016;25:e313-7.


28) Nouri-Mahdavi K, Caprioli J. Evaluation of the hypertensive phase after insertion of the Ahmed Glaucoma Valve. Am J Ophthalmol 2003;136:1001-8.


29) Jung KI, Park H, Jung Y, Park CK. Serial changes in the bleb wall after glaucoma drainage implant surgery: characteristics during the hypertensive phase. Acta Ophthalmol 2015;93:e248-53.


30) Alobaida IA, Malik R, Ahmad S. Comparison of surgical outcomes between sulcus and anterior chamber implanted glaucoma drainage devices. Saudi J Ophthalmol 2020;34:1-7.







 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




