 |
 |
| J Korean Ophthalmol Soc > Volume 62(8); 2021 > Article |
|
국문초록
대상과 방법
2016년 1월부터 2018년 12월까지 본원에서 단일 술자에 의해 백내장수술을 받은 환자들을 대상으로 의무기록을 조사하였다. 술 후 1-2개월에 시행한 빛간섭단층촬영검사에서 망막전막이 있는 눈은 연구에서 제외하였다. 이후에 안저촬영사진을 이용하여 망막전막을 진단하였으며, 술 후 2-6개월, 6-12개월, 12-24개월 사이로 기간을 나누어 발생률을 조사하였다. 또한 Kaplan-Meier 분석을 통해 망막전막의 누적발생률을 구하였다. 망막전막 발생과 각 변수들과의 관련성을 로지스틱 회귀분석을 이용하여 분석하였다.
결과
161명 218안이 연구에 포함되었으며 수술 당시 평균 연령은 66.6 ± 9.7세였다. 술 후 2-6개월 사이에는 218안 중 3안(1.4%), 6-12개월 사이에는 176안 중 15안(8.3%), 12‒24개월 사이에는 150안 중 14안(10.3%)에서 망막전막이 진단되었다. 망막전막의 누적발생률은 술 후 24개월까지 11.7%였다. 다변량 로지스틱 회귀분석에서 고령(65세 이상, 교차비 8.6, 95% 신뢰구간 1.43-51.49), 반대안 망막전막의 존재(교차비 3.63, 95% 신뢰구간 1.04-12.73), 긴 안축장(26 mm 이상, 교차비 8.02, 95% 신뢰구간 1.08-59.66), 완전 후유리체박리 발생(교차비 7.48, 95% 신뢰구간 1.64-34.14)이 망막전막 발생과 유의하게 관련 있었다.
ABSTRACT
Purpose
To investigate the incidence and risk factors of epiretinal membrane (ERM) after cataract surgery.
Methods
We reviewed the medical records of patients who underwent cataract surgery between January 2016 and December 2018. Eyes with ERM, as observed by optical coherence tomography performed 1-2 months after surgery, were excluded from the study. ERM was diagnosed by fundus photography. The incidence rate was determined 2-6, 6-12, and 12-24 months after surgery. The cumulative incidence rate of ERM was calculated by Kaplan-Meier analysis. Data were analyzed using logistic regression to determine the associations between ERM development and various factors.
Results
The study included 218 eyes of 161 patients with a mean age of 66.6 ± 9.7 years at the time of surgery. ERM was observed in 3 of 218 eyes (1.4%) between 2 and 6 months, 15 of 176 eyes (8.3%) between 6 and 12 months, and 14 of 150 eyes (10.3%) between 12 and 24 months after surgery. The cumulative incidence rate of ERM was 11.7% over the 24-month period after surgery. In multivariate logistic regression analysis, older age (≥65 years; odds ratio [OR], 8.59, 95% confidence interval [CI], 1.43-51.49), fellow eye with ERM (OR, 3.63; 95% CI, 1.04-12.73), longer axial length (≥26 mm; OR, 8.02; 95% CI, 1.08-59.66), and complete posterior vitreous detachment development (OR, 7.48; 95% CI, 1.64-34.14) were significantly associated with ERM development.
망막전막은 황반의 내경계막 표면에 섬유세포막이 형성되는 질환으로서, 섬유세포막이 수축하여 망막주름이나 견인, 황반부종 등을 일으키고 시력을 손상시키는 질환이다[1,2]. 국내 연구에서 망막전막 유병률은 40세 이상의 성인에서 2.9%로 알려져 있으며, 고령, 높은 칼슘 섭취, 낮은 적혈구 수치 등이 위험인자로 보고되고 있다[3-5]. 망막전막은 유리체절제술로 제거될 수 있으며, 술 전 시력이 좋은 경우, 망막전막 발생 기간이 짧은 경우, 시세포층의 손상이 적은 경우가 술 후 시력예후가 좋다고 알려져 있어서, 조기에 진단하는 것이 중요하다고 알려져 있다[6-13]. Lee and Oh [14]는 급성 후유리체박리 이후 12개월에 망막전막의 누적발생률이 35%였다고 보고하였고, 이 중에서 망막전막제거술을 받은 5안에서 술 후 최대교정시력이 모두 20/20으로 좋았으며, 이는 심하게 진행되지 않은 상태에서 조기에 진단하였기 때문이라고 하였다.
백내장은 고령에서 시력저하를 일으키는 가장 흔한 안과 질환이며, 수술로써 치료가 된다[15]. 수명이 늘어나면서 노인인구가 많아졌고, 따라서 백내장수술 건수도 상당히 증가하고 있다[16]. 본 연구에서는 백내장수술 후 망막전막 발생률을 알아보고, 그 위험인자를 분석하고자 하였다.
본 연구는 헬싱키선언을 준수하였으며, 동국대학교 일산병원 의학연구윤리심의위원회(Institutional Review Board, IRB)의 승인을 얻은 후에 진행되었다(IRB 승인 번호: 202004039). 2016년 1월부터 2018년 12월까지 본원에서 단일 술자(J.H.O.)에 의해 백내장수술을 받은 환자들을 대상으로 의무기록을 후향적으로 조사하였다.
모든 백내장수술은 같은 방식으로 시행되었으며, 전신마취를 시행한 2명 4안을 제외하고 점안마취 후에 진행되었다. 1 mm와 2.8 mm의 투명각막절개를 시행 후 점탄물질 4% chondroitin sulfate-3% sodium hyaluronate (Viscoat, Alcon Laboratories Inc., Fort Worth, TX, USA)를 전방에 채우고, 5.5 mm 정도의 원형전낭절개술을 시행하였다. 평형염액을 사용하여 수력분리술을 시행한 후 INFINITI Vision System (Alcon Laboratroies Inc., Fort Worth, TX, USA)을 이용하여 수정체핵의 초음파유화술과 수정체피질 제거를 시행하였다. 수술 중 후낭파열 등의 합병증이 발생하지 않은 경우에는 Tecnis® (single-piece hydrophobic acrylic intraocular lens, Abbott Medical Optics, Inc. Santa Ana, CA, USA) 또는 AcrySof IQ® (single-piece hydrophobic acrylic intraocular lens, Alcon Laboratories Inc., Fort Worth, TX, USA) 인공수정체를 수정체낭 내에 삽입하였고, 점탄물질을 제거한 뒤에 각막봉합 없이 수술을 마무리하였다. 수술 후에는 moxifloxacin 0.5% 점안액을 하루 4회 1주일간 사용하였으며, prednisolone acetate 1.0% 점안액과 Bromfenac sodium hydrate 점안액을 하루 4회 한 달간 사용하였다. 수술 후 1-2개월 사이에 내원하여 안저촬영검사와 빛간섭단층촬영검사를 포함한 눈 검사를 모두 받았다. 이후 보통 3개월에서 6개월 간격으로 추적 관찰을 권유하였으며, 외래 방문하면 안저촬영검사를 모두 시행하였고, 필요한 경우에 빛간섭단층촬영검사를 함께 시행하였다. 망막전막이 관찰되는 경우에는 빛간섭단층촬영검사에서 황반중심에 변형이 생기거나, 시력저하 또는 변형시를 호소하면 망막전막제거술을 권하였고, 그렇지 않으면 추적 관찰을 하였다.
수술 후 1-2개월 사이에 빛간섭단층촬영검사를 시행하지 않았거나, 이 때 시행한 빛간섭단층촬영검사에서 망막표면에 고반사 선이 관찰되고 내망막 표면의 찌그러짐, 주름 또는 편평함 소견이 동반될 때에 망막전막이 이미 존재하는 것으로 보고 제외하였다[17]. 또한 당뇨망막병증, 망막정맥폐쇄, 중심 장액맥락망막병증, 나이관련황반변성 등이 동반되거나 망막수술 병력, 망막광응고술 병력, 포도막염 병력이 있는 경우도 연구에서 제외하였다. 또한 안저촬영사진의 화질이 분석하기에 충분하지 않다고 판단되면 제외하였다.
의무기록으로부터 환자의 성별, 수술 당시 연령, 눈의 방향, 당뇨 동반 여부, 수술 당시 키와 몸무게, 술 전 최대교정시력, 수술 전 안축장 등을 조사하였으며, 수술 중 후낭파열 같은 합병증 발생 유무, 망막질환 동반 유무 또는 치료 병력, 포도막염 병력, 반대안의 망막전막 유무, 술 후 낭포황반부종 발생 등을 확인하였다. 추적 관찰에서 망막전막이 발생한 환자의 경우는, 유리체절제술 권유 여부, 유리체절제술 시행 여부, 수술 시기, 수술 방법, 수술 전과 후의 최대교정시력 등을 추가 조사하였다.
안저촬영검사는 VX-10 (Kowa, Nagoya, Japan) 또는 Optos California (Optos PLC, Dunfermline, UK)를 이용하였다. 수술 2개월 이후 망막전막의 발생은 안저촬영사진만으로 진단하였으며, 반투명막, 혈관비틀림, 방사상 망막주름 등이 관찰될 때에 진단하였다[2,18]. 안저촬영사진의 분석은 두 명의 연구자(J.I.K, J.H.O)에 의해서 독립적으로 이루어졌다. 수술 이후 2개월에서 6개월 사이와 6개월에서 12개월 사이, 12개월에서 24개월 사이로 기간을 셋으로 나누어서 망막전막의 발생 여부를 조사하였다. 또한 Kaplan-Meier 분석을 통해 술 후 24개월 동안의 누적발생률을 구하였다.
빛간섭단층촬영기기는 Cirrus™ HD-OCT (Model 4000 or 5000, Carl Zeiss Meditec, Dublin, CA, USA)을 사용하였다. 수술 후 1-2개월에 시행한 빛간섭단층촬영검사에서 낭포황반부종 유무를 확인하였으며, 이는 황반중심 1 mm에서 측정된 중심황반두께가 300 µm 이상이고 황반중심 1 mm 이내에 50 µm 이상 크기의 망막내 낭포가 관찰되는 경우로 정의하였다[19,20].
안저촬영사진과 빛간섭단층촬영검사를 이용하여 후유리체박리의 단계를 평가하였다. 안저촬영사진에서 Weiss 고리가 관찰되거나 빛간섭단층촬영검사에서 후극부와 시신경유두 가장자리에 유리체피질의 반사가 관찰되지 않는 경우에 완전(complete) 후유리체박리로 진단하였다[14,17,21,22]. 또한 빛간섭단층촬영검사를 이용하여 Johnson의 분류에 따라 후유리체박리의 단계를 평가하였으며, 중심와주위 유리체박리가 확인되지만, 유리체중심와 유착이 남아있으면 stage 1, 유리체중심와 유착이 없으며 중심와주위 유리체박리가 확인되면 stage 2, 유리체시신경유두 유착만 남고 유리체박리가 확인되면 stage 3로 정의하였다[22]. 수술 후 1-2개월에 시행한 빛간섭단층촬영검사에서 확인된 후유리체박리의 단계를 수술 당시의 상태로 간주하여 분석하였으며, 수술 전 3개월 이내에 빛간섭단층촬영검사를 시행하였고, 신호강도가 6 이상인 일부 대상에서도 후유리체박리 단계를 확인하여 비교하였다.
망막전막 발생과 관련된 인자들을 확인하기 위해, 망막전막 발생군과 비발생군으로 나누었다. 추적 기간 중에 망막전막이 관찰된 환자를 망막전막 발생군에, 12개월에서 24개월 사이에 시행한 안저촬영사진에서 망막전막이 관찰되지 않은 환자를 망막전막 비발생군에 포함하였다. 통계적 분석은 SPSS 프로그램(version 21.0, IBM Corp., Armonk, NY, USA)을 이용하였으며, 두 그룹 간의 비교에서 연속변수는 t-test를 사용하였으며 정규성 검정을 만족하였고, 범주변수는 chi-square 검정 또는 Fisher의 정확한 검정을 사용하였다. 그리고 로지스틱 회귀분석을 통해, 망막전막 발생에 대한 각 변수들의 교차비(odds ratio)와 95% 신뢰구간(confidence interval)을 구하였다. p-value가 0.05 미만인 경우에 통계적으로 유의한 것으로 간주하였다. 24개월 동안의 누적발생률은 Kaplan-Meier 분석을 통해 구하였다.
2016년 1월부터 2018년 12월까지 총 464안이 백내장수술을 시행 받았다. 이 중에서 술 후 1-2개월에 빛간섭단층촬영검사를 시행 받지 않은 116안, 술 후 1-2개월에 시행한 빛간섭단층촬영검사에서 망막전막이 확인된 44안, 다른 망막 질환이 동반된 85안, 유리체절제술 병력이 있던 1안을 제외하였다. 수술 중 후낭파열 같은 합병증이 발생했던 눈은 없었으며, 망막광응고술 병력, 포도막염 병력이 있는 눈도 없었다. 안저촬영사진은 모두 분석이 가능하였다.
총 161명의 218안이 본 연구에 포함되었으며, 그 특성은 Table 1과 같다. 수술 당시 평균 나이는 66.6 ± 9.6세였으며, 수술 당시에 28안(12.8%)은 반대안에 망막전막이 존재하는 것이 안저촬영검사 또는 빛간섭단층촬영검사에서 확인되었다.
안저촬영사진의 분석 결과는 두 명의 연구자가 모두 일치하였다. 술 후 2-6개월 사이 외래 내원하여 안저촬영검사를 시행 받은 환자 중 3안(1.4%)에서 망막전막이 확인되었다. 6-12개월 사이에는 15안(8.3%)에서 망막전막이 확인되었다. 15안 중 3안은 2-6개월 사이의 검사에서도 망막전막이 관찰되었으며, 나머지 12안은 모두 2-6개월 사이에 안저촬영검사를 받았으나 당시에는 망막전막 소견이 보이지 않았다. 12-24개월 사이 4안(10.3%)에서 망막전막이 확인되었다. 14안 중 11안은 2-12개월 사이 망막전막이 확인되었다. 나머지 3안 중 1안은 12개월째 검사에서는 망막전막이 관찰되지 않았으나 19개월째 검사에서 망막전막이 확인되었고, 다른 1안은 15개월째 검사에서는 망막전막이 관찰되지 않았으나 17개월째 검사에서 망막전막이 확인되었고, 마지막 1안은 2개월째 망막전막이 관찰되지 않았으나 23개월째 검사에서 망막전막이 확인되었다(Fig. 1). 망막전막은 218안 중에서 18안(8.3%)에서 24개월 동안 누적하여 확인되었으며, Kaplan-Meier 분석 결과 술 후 12개월까지 망막전막의 누적발생률은 6.9%였으며, 24개월까지의 누적발생률은 11.7%였다(Fig. 2).
술 후 경과 관찰 12-24개월 사이의 검사에서 136안(88.3%)은 망막전막이 관찰되지 않았고(망막전막 비발생군), 모든 기간에서 18안(11.7%)에서 망막전막이 관찰되었다(망막전막 발생군). 두 그룹 간의 특성을 Table 2에서 비교하였다. 수술 당시 나이가 65세 이상인 환자는 망막전막발생률이 16.5%였으며, 65세 미만의 환자(3.5%)보다 유의하게 더 높았다(p=0.018). 반대안에 망막전막이 존재하는 환자는 망막전막 발생률이 27.3%였으며, 그렇지 않은 환자(9.1%)보다 유의하게 더 높았다(p=0.014).
술 후 1-2개월째 안저촬영사진과 빛간섭단층촬영검사로 완전 후유리체박리 유무를 확인하였으며, 154안 중에서 99안(64.3%)은 완전 후유리체박리가 확인되었다. 나머지 55안 중 50안은 후유리체박리 stage 1, 3안은 stage 2, 2안은 stage 3였으며, 이 중 11안(20%)은 이후 경과에서 안저촬영 사진 또는 빛간섭단층촬영검사에서 완전 후유리체박리가 확인되었으며, 이 중에서 5안(45.5%)에서 망막전막이 발생하였다. 5안 중에 3안은 완전 후유리체박리와 망막전막이 같은 시기에 확인되었으며, 5개월째 완전 후유리체박리가 확인되고 10개월째 망막전막이 확인된 1안, 6개월째 완전 후유리체박리가 확인되고 8개월째 망막전막이 확인된 1안이 있었다. 경과 중에 완전 후유리체박리가 발생하지 않았던 44안 중에 4안에서(9.1%)에서 망막전막이 확인되었으며, 이때 후유리체박리 단계는 모두 stage 3이었다. 이 4안은 술 후 1-2개월째 빛간섭단층촬영검사에서 모두 후유리체박리 stage 1이었다.
연구 대상 218안 중 74안이 수술 전 3개월 이내에 빛간섭단층촬영검사를 시행받았으며, 이 중에서 신호강도가 6 이상인 경우는 34안이었다. 후유리체박리 stage 1은 10안, stage 2는 3안, stage 3는 2안, 완전 후유리체박리는 19안이었다. 이는 술 후 1-2개월에 시행한 빛간섭단층촬영검사에서 확인된 후유리체박리의 단계와 모두 같았다.
다변량 로지스틱 회귀분석에서 고령(65세 이상, 교차비 8.6, 95% 신뢰구간 1.43-51.49), 반대안 망막전막의 존재(교차비 3.63, 95% 신뢰구간 1.04-12.73), 긴 안축장(26 mm 이상, 교차비 8.02, 95% 신뢰구간 1.08-59.66), 완전 후유리체박리 발생(교차비 7.48, 95% 신뢰구간 1.64-34.14)이 망막전막 발생과 유의하게 관련 있었다(Table 3). 성별과 체질량지수(body mass index)는 관련 없었다.
망막전막이 관찰된 18안 중에서 3안이 망막전막제거술을 권유 받았다(Fig. 3). 69세 여자 환자는 백내장수술 후 11개월에 망막전막을 처음 진단 받았고, 이때 완전 후유리체박리도 확인되었다. 그리고 술 후 15개월째 변시증을 호소하여 망막전막제거술을 시행 받았으며, 수술 후 증상 호전되고 최대교정시력 20/20으로 유지되었다. 다른 두 환자(61세 여자와 70세 남자)는 각각 백내장수술 후 18개월째와 22개월째 망막전막제거술을 권유 받았으나 수술은 거절하였다.
본 연구에서는 안저촬영사진을 후향적으로 분석하여 백내장수술 후 망막전막의 발생률을 알아보았다. 기간을 나누어 발생률을 조사하였고, 수술 후 2-6개월 사이에는 1.4%, 6-12개월 사이에는 8.3%, 12-24개월 사이에는 10.3%로 추적 관찰 기간이 길어질수록 점점 증가하는 양상이 확인되었다(Fig. 1). 2-12개월 사이에는 망막전막이 없었지만 12개월 이후 3안에서 망막전막이 새롭게 발생하는 것도 확인하였다. 이러한 결과들은 백내장수술 후 환자를 오랜 기간 동안 추적 관찰하면서 망막검진을 해야 함을 시사한다. 본 연구에서는 총 218안 중에서 68안(31.2%)은 12개월 이후 추적 관찰을 받지 않았기 때문에 망막전막 발생 여부에 대한 장기적인 결과를 확인할 수 없었다. 한편, Kaplan-Meier 분석으로 구한 망막전막의 누적발생률은 백내장수술 후 12개월에 6.9%, 24개월에 11.7%였다.
기존 연구에서 Jahn et al [23]은 백내장수술 후에 78 diopter 비접촉렌즈를 이용한 세극등현미경검사로 망막전막을 확인하였고, 술 후 2주 이내 검사에서 망막전막이 없던 283안 중 32안(11.3%)에서 술 후 6개월에 망막전막이 발생하였다고 보고하였다. Fong et al [24]은 백내장수술 후에 안저촬영사진을 이용하여 망막전막을 확인하였고, 술 후 1달째 검사에서 망막전막이 없던 1,119안에서 백내장수술 후 망막전막의 누적발생률은 12개월째 5.0% (95% 신뢰구간 3.9-6.5%), 24개월째 9.0% (95% 신뢰구간 7.5-10.9%), 36개월째 11.2% (95% 신뢰구간 9.4-13.4%)였다고 보고하였으며, 12개월 이후에도 발생률이 증가하는 것을 보여주었다[24].
Jahn et al [23]은 백내장수술로 인해 유리체망막경계면에 기계적인 견인력이 작용하여 후유리체박리가 일어나고, 이 것이 망막전막 발생과 관련될 것이라고 하였다. 본 연구의 결과는 Jahn et al [23]의 가설을 뒷받침한다. 본 연구에서는 백내장수술 후 후유리체의 상태를 확인하였고, 수술 1개월째 이후 경과에서 55안 중 11안(20%)에서 완전 후유리체박리가 새로 발생하였고, 이 중에서 5안(45.5%)에 망막전막이 발생하였다. 이는 완전 후유리체박리가 발생하지 않은 눈(44안 중 4안, 9.1%)과 수술 1개월째 이미 완전 후유리체박리가 있었던 눈(99안 중 9안, 9.1%)의 발생률보다 높았다. 술 후 완전 후유리체박리 발생과 망막전막 발생의 관련성은 다변량 회귀분석에서도 유의한 것으로 확인되었다.
백내장수술 이후 후유리체박리 발생이 증가한다는 여러 보고들이 있다. 백내장수술 후 후유리체박리가 약 6배 더 많이 발생한다는 보고가 있으며, 백내장수술 후 6개월에 73.3%에서 완전 후유리체박리가 발생하였다는 보고도 있다[25]. Degirmenci et al [26]은 백내장수술 후 1개월째 3.3%에서 완전 후유리체박리가 관찰되었으나, 술 후 6개월째 20%로 증가하였다고 보고하였으며 Park et al [27]은 백내장수술 후 평균 6.22개월에 17.6%에서 후유리체박리 단계가 진행하였다고 하였다. 한편, 완전 후유리체박리는 망막전막의 발생과 깊게 관련된 것으로 알려져 있으며[28,29], Lee and Oh [14]는 급성 후유리체박리 이후 12개월에 망막전막의 누적 발생률이 35%였다고 보고하였다.
백내장수술 후 망막전막의 발생에는 수술로 인해 발생한 염증도 관여할 것이다. 백내장수술 후 다양한 염증인자들이 증가되는 것으로 알려져 있다[30-32]. 이 중 전환성장인자(transforming growth factor)-β는 뮐러아교세포(Müller glial cell)의 간엽이행(mesenchymal transition)에도 관여하여 망막전막 발생과 연관되어 있다고 알려져 있다[33]. Vallejo-Garcia et al [30]는 백내장수술 후 염증으로 인해서 기존 망막전막이 더 진행한다고 하였다. 본 연구에서 백내장수술 1개월 때 이미 완전 후유리체박리가 있었던 눈에서도 9.1%에서 망막전막이 발생하였는데, 이는 임상적으로 확인되지 않았던 망막전막이 백내장수술로 인하여 더 악화되고 진단이 가능하게 되었을 수도 있다.
완전 유리체박리가 발생하지 않았던 4안에서도 망막전막이 확인되었으며, 이때 후유리체박리 단계는 모두 stage 3이었다. 이들 모두 술 후 1-2개월째 시행한 빛간섭단층촬영검사에서는 후유리체박리 단계는 stage 1이었다. 유리체박리 단계의 진행도 망막전막 발생과 관련되는 것을 확인할 수 있었다.
본 연구에서는 65세 이상의 고령, 26 mm 이상의 안축장, 반대안 망막전막 등도 술 후 망막전막의 발생과 유의하게 관련 있었다. 안축장 26 mm 이상의 고도근시와 고령은 기존 연구에서도 망막전막의 위험인자로 잘 알려져 있으며[4], 또한, 후유리체박리의 위험인자이기도 하다[4,27,34].
본 연구는 후향적 연구이고, 많지 않은 환자를 대상으로 하였다는 제한점이 있다. 또한 술 후 1-2개월 이후 경과에서 빛간섭단층촬영검사는 필요한 경우에만 시행하였기 때문에, 망막전막의 진단은 안저촬영사진만을 이용하였다. 이는 망막전막의 유병률이 과소평가되었을 가능성이 있다. 따라서 추후 연구에는 빛간섭단층촬영검사를 추가로 이용한다면 경미한 망막전막까지도 진단할 수 있을 것이다. 마지막으로, 본 연구에서는 백내장수술 후 1-2개월에 시행한 검사를 기준으로 술 전 망막전막의 유무, 후유리체의 상태를 정의하였다. 이는 수술 전에 시행한 검사는 백내장으로 인해 검사의 질이 낮을 수 있기 때문이다. 따라서 백내장수술 후 1-2개월 이내에 발생한 망막전막 또는 후유리체박리가 누락되었을 가능성도 생각해야 할 것이다. 본 연구에서는 일부 환자에서 수술 전 빛간섭단층촬영검사를 분석할 수 있었는데, 수술 전과 수술 후 1-2개월째 후유리체박리의 단계가 모두 같았다.
결론적으로, 본 연구는 백내장수술 후 24개월째 망막전막의 누적발생률이 11.7%로 낮지 않았으며, 12개월 이후에도 망막전막이 새롭게 발생하는 것을 보여주었다. 또한 백내장수술 후 발생한 완전 후유리체박리가 망막전막과 관련됨을 확인하였다. 백내장수술 후 장기적인 망막검진이 필요할 것이다.
NOTES
Figure 1.
Incidence of epiretinal membrane (ERM) after cataract surgery. The incidence reached to 10.3% between 12 and 24 months after cataract surgery.
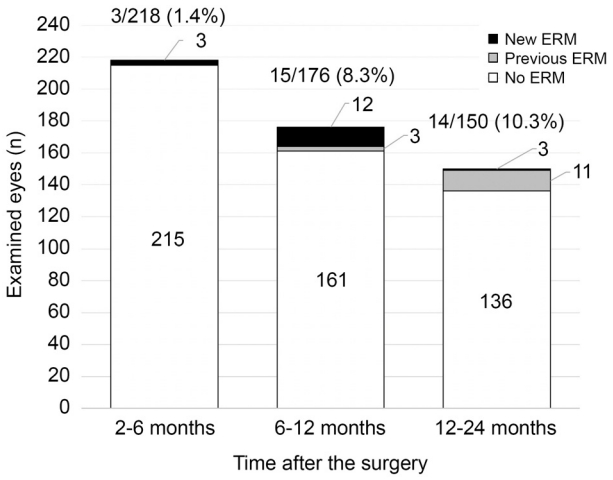
Figure 2.
Kaplan-Meier curve for 24 months cumulative incidence of epiretinal membrane (ERM) after cataract surgery. The cum ulative incidence of ERM up to 12 m onths and 24 months after the surgery was 6.9% and 11.7%, respectively.
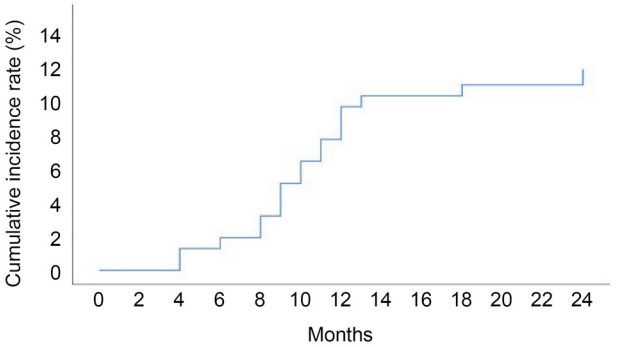
Figure 3.
Optical coherence tomography images of three cases with significant epiretinal membrane (ERM) development after cataract surgery. The left images (A, C, E) were taken between 1 and 2 months after the surgery, and the right images (B, D, F) were taken when ERM removal was recommended at 15 months, 18 months and 22 months after the surgery, respectively. The reflective line of the posterior hyaloid membrane away from the perifoveal surface is observed in A and E.
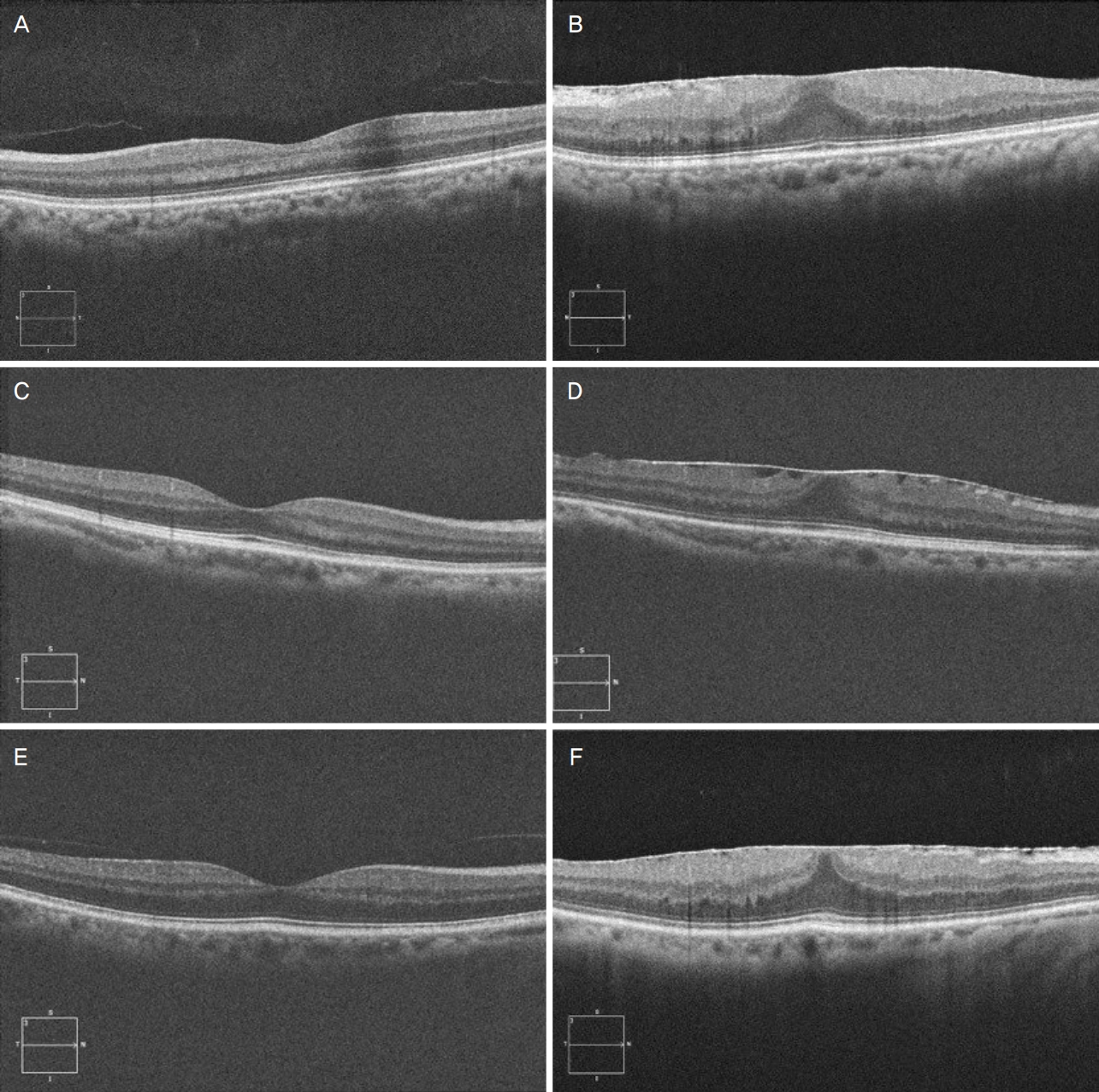
Table 1.
Baseline characteristics of the subjects
Table 2.
Characteristics of groups with or without ERM development
| Factor |
Development of ERM |
p-value | |
|---|---|---|---|
| No = 136 | Yes = 18 (11.7)* | ||
| Age (years) | 67.1 ± 9.8 | 68.4 ± 10.7 | 0.577 |
| Age groups (years) | 0.018† | ||
| <65 | 55 | 2 (3.5) | |
| ≥65 | 81 | 16 (16.5) | |
| Sex | 0.247 | ||
| Male | 80 | 8 (9.1) | |
| Female | 56 | 10 (15.1) | |
| Diabetes mellitus | 0.280† | ||
| No | 95 | 15 (13.6) | |
| Yes | 41 | 3 (6.8) | |
| Body mass index (kg/m2) | 0.134† | ||
| <25 | 46 | 15 (24.6) | |
| ≥25 | 48 | 5 (9.4) | |
| Fellow eye with ERM | 0.014 | ||
| No | 120 | 12 (9.1) | |
| Yes | 16 | 6 (27.3) | |
| Preoperative BCVA (Snellen) | 0.548† | ||
| ≤0.1 | 9 | 1 (10.0) | |
| >0.1 and ≤0.5 | 24 | 5 (17.2) | |
| >0.5 | 103 | 12 (10.4) | |
| Axial length (mm) | 0.095† | ||
| <26 | 129 | 7 (5.1) | |
| ≥26 | 15 | 3 (16.7) | |
| PVD status | 0.004† | ||
| Pre-existed complete PVD | 90 | 9 (9.1) | |
| No complete PVD | 40 | 4 (9.1) | |
| Complete PVD development after surgery | 6 | 5 (45.4) | |
| Cystoid macular edema‡ | 0.361† | ||
| No | 128 | 18 (12.3) | |
| Yes | 8 | 0 | |
Table 3.
Logistic regression results for predicting ERM development
REFERENCES
1) Mitchell P, Smith W, Chey T, et al. Prevalence and associations of epiretinal membranes. The Blue Mountains Eye Study, Australia. Ophthalmology 1997;104:1033-40.


2) Fraser-Bell S, Guzowski M, Rochtchina E, et al. Five-year cumulative incidence and progression of epiretinal membranes: the Blue Mountains Eye Study. Ophthalmology 2003;110:34-40.


3) Ng CH, Cheung N, Wang JJ, et al. Prevalence and risk factors for epiretinal membranes in a multi-ethnic United States population. Ophthalmology 2011;118:694-9.


4) Cheung N, Tan SP, Lee SY, et al. Prevalence and risk factors for epiretinal membrane: the Singapore epidemiology of eye disease study. Br J Ophthalmol 2017;101:371-6.


5) Kim JM, Lee H, Shin JP, et al. Epiretinal membrane: prevalence and risk factors from the Korea national health and nutrition examination survey, 2008 through 2012. Korean J Ophthalmol 2017;31:514-23.



6) Scheerlinck LM, van der Valk R, van Leeuwen R. Predictive factors for postoperative visual acuity in idiopathic epiretinal membrane: a systematic review. Acta Ophthalmol 2015;93:203-12.


7) Kauffmann Y, Ramel JC, Lefebvre A, et al. Preoperative prognostic factors and predictive score in patients operated on for combined cataract and idiopathic epiretinal membrane. Am J Ophthalmol 2015;160:185-92.e5.


8) Takabatake M, Higashide T, Udagawa S, Sugiyama K. Postoperative changes and prognostic factors of visual acuity, metamorphopsia, and aniseikonia after vitrectomy for epiretinal membrane. Retina 2018;38:2118-27.


9) Suh MH, Seo JM, Park KH, Yu HG. Associations between macular findings by optical coherence tomography and visual outcomes after epiretinal membrane removal. Am J Ophthalmol 2009;147:473-80.e3.


10) Cobos E, Arias L, Ruiz-Moreno J, et al. Preoperative study of the inner segment/outer segment junction of photoreceptors by spectral-domain optical coherence tomography as a prognostic factor in patients with epiretinal membranes. Clin Ophthalmol 2013;7:1467-70.



11) Shiono A, Kogo J, Klose G, et al. Photoreceptor outer segment length: a prognostic factor for idiopathic epiretinal membrane surgery. Ophthalmology 2013;120:788-94.


12) Rahman R, Stephenson J. Early surgery for epiretinal membrane preserves more vision for patients. Eye (Lond) 2014;28:410-4.



13) Nakashizuka H, Kitagawa Y, Wakatsuki Y, et al. Prospective study of vitrectomy for epiretinal membranes in patients with good best-corrected visual acuity. BMC Ophthalmol 2019;19:183.



14) Lee SJ, Oh JH. Incidence and risk factors of epiretinal membrane following acute posterior vitreous detachment. J Korean Ophthalmol Soc 2020;61:1450-7.

16) Kim C, Kwon JW, Wee WR, et al. Factors affecting the visual outcome of cataract surgery in the very elderly. J Korean Ophthalmol Soc 2007;48:905-10.
17) Govetto A, Lalane RA 3rd, Sarraf D, et al. Insights into epiretinal membranes: presence of ectopic inner foveal layers and a new optical coherence tomography staging scheme. Am J Ophthalmol 2017;175:99-113.


18) Maitra P, Kumar DA, Agarwal A. Epiretinal membrane profile on spectral domain optical coherence tomography in patients with uveitis. Indian J Ophthalmol 2019;67:376-81.



20) Kim SJ, Bressler NM. Optical coherence tomography and cataract surgery. Curr Opin Ophthalmol 2009;20:46-51.


21) Nicholson BP, Zhou M, Rostamizadeh M, et al. Epidemiology of epiretinal membrane in a large cohort of patients with uveitis. Ophthalmology 2014;121:2393-8.


22) Johnson MW. Perifoveal vitreous detachment and its macular complications. Trans Am Ophthalmol Soc 2005;103:537-67.



23) Jahn CE, Minich V, Moldaschel S, et al. Epiretinal membranes after extracapsular cataract surgery(1). J Cataract Refract Surg 2001;27:753-60.

24) Fong CS, Mitchell P, Rochtchina E, et al. Incidence and progression of epiretinal membranes in eyes after cataract surgery. Am J Ophthalmol 2013;156:312-8.e1.


25) Hilford D, Hilford M, Mathew A, Polkinghorne PJ. Posterior vitreous detachment following cataract surgery. Eye (Lond) 2009;23:1388-92.


26) Degirmenci C, Afrashi F, Mentes J, et al. Evaluation of posterior vitreous detachment after uneventful phacoemulsification surgery by optical coherence tomography and ultrasonography. Clin Exp Optom 2017;100:49-53.


27) Park JH, Yang H, Kwon H, Jeon S. Risk factors for onset or progression of posterior vitreous detachment at the vitreomacular interface after cataract surgery. Ophthalmol Retina 2021;5:270-8.


29) Johnson MW. Posterior vitreous detachment: evolution and complications of its early stages. Am J Ophthalmol 2010;149:371-82.e1.


30) Vallejo-Garcia JL, Romano M, Pagano L, et al. OCT changes of idiopathic epiretinal membrane after cataract surgery. Int J Retina Vitreous 2020;6:37.



31) Yu J, Feng L, Wu Y, et al. Vitreous proteomic analysis of idiopathic epiretinal membranes. Mol Biosyst 2014;10:2558-66.


32) Wallentin N, Wickström K, Lundberg C. Effect of cataract surgery on aqueous TGF-beta and lens epithelial cell proliferation. Invest Ophthalmol Vis Sci 1998;39:1410-8.

-
METRICS

-
- 0 Crossref
- 0 Scopus
- 2,258 View
- 83 Download
- Related articles
-
Six Cases of Fungal Exogenous Endophthalmitis after Cataract Surgery2022 September;63(9)
Clinical Benefits of Amniotic Membrane Contact Lens2022 July;63(7)
Case Series of Descemet Membrane Detachment Associated with Cataract Surgery2021 June;62(6)
Incidence and Risk Factors for the Ptosis after Trabeculectomy2020 June;61(6)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



