성인에서 발생한 HLA-A*11:01 및 A*31:01형의 비전형 스티븐스존슨증후군
Adult-onset Atypical Stevens-Johnson Syndrome with HLA-A*11:01 and HLA-A*31:01 Alleles
Article information
Abstract
목적
피부 병변 없이 구강 및 안구 점막만 침범한 성인 비전형 스티븐스존슨증후군 1예를 보고하고자 한다.
증례요약
발열을 동반한 인후염으로 비스테로이드성 소염제, 아세트아미노펜, 세파클러 항생제 등을 포함한 감기약을 5일간 복용한 뒤 피부 이상 없이 구강 점막의 까짐과 양안 결막의 심한 충혈 및 가성막이 발생한 33세 남자가 의뢰되었다. 초진 시, 양안 구결막 및 검결막의 상피 결손이 뚜렷했다. 비전형 스티븐스존슨증후군을 염두에 두고 국소 안약제를 이용한 보존적 치료를 시작하였고, 복용 약물에 대한 유전적 감수성을 확인하기 위한 HLA 유전자검사상 HLA-A*11:01와 HLA-A*31:01 대립유전자형이 확인되었다. 10개월 후 시행한 마이코플라스마 폐렴균의 항체검사상 면역글로불린G 양성, M 음성이었다. 발병 1년 후 자가혈청안약, 경구 또는 국소 스테로이드, 0.1% 사이클로스포린 안약, 항생제 안약 투여 유지하면서 각결막미란은 현저히 호전되었다.
결론
비전형 스티븐스존슨증후군은 매우 드물지만 구강 및 안구 점막만 침범할 수 있으므로 약물 복용력과 마이코플라즈마 폐렴병발 등의 적절한 병력 청취를 통해 조기에 의심하는 것이 필요하겠다.
Trans Abstract
Purpose
We report a case of adult-onset atypical Stevens-Johnson syndrome (SJS) in which only the oral and ocular mucosae were involved, without skin lesions.
Case summary
A 33-year-old man was referred to our institute with recent severe oral mucositis and bilateral conjunctival hyperemia and pseudomembrane formation, which occurred 5 days after taking cold medicine, including a non-steroidal anti-inflammatory drug, acetaminophen and cefaclor, for pharyngitis with fever. At the initial visit, the patient had an epithelial defect of the bulbar and tarsal conjunctiva in both eyes. Conservative treatment using topical eye drops was started, with suspicion of atypical SJS. In addition, HLA-A alleles were typed to assess possible genetic susceptibility to the relevant drugs, and HLA-A*11:01 and HLA-A*31:01 alleles were confirmed. Immunoglobulin (Ig) G against Mycoplasma pneumoniae was positive and IgM was negative at 10 months after the initial onset of disease. One year after the disease onset, autologous serum eye drops, oral and topical steroids, 0.1% cyclosporine eye drops, and antibiotic eye drops were maintained and the corneal and conjunctival erosions were much improved.
Conclusions
Although atypical SJS is very rare, it is important to suspect it early by taking a history of any preceding medication or possible concurrent mycoplasma pneumonia, because atypical SJS may affect the oral and ocular mucosae without skin lesions.
스티븐스존슨증후군(Stevens-Johnson syndrome, SJS)/독성표피괴사융해증(toxic epidermal necrolysis, TEN)은 매년 발생률이 백만 명 당 0.4-7명으로 매우 드문 질환으로서[1] 이상 면역 반응에 의해 발생하는 피부 및 점막의 광범위한 괴사, 표피 탈락을 특징으로 한다[2]. 침범한 체표 면적에 따라 10% 미만인 경우 SJS, 30% 이상인 경우 TEN, 그 사이를 SJS-TEN 중첩반응(SJS-TEN overlap)으로 구분한다[3].
SJS/TEN은 중증피부유해반응(severe cutaneous adverse reaction, SCAR)의 일종으로서 대개 전신 약물에 대한 특이 체질성(idiosyncratic) 반응으로 발생하며, 원인 약물로는 대표적으로 비스테로이드성 소염제(non-steroidal anti-inflammatory drug, NSAID), 아세트아미토펜, 설폰아마이드 및 베타락탐계 항생제, 테트라사이클린, 퀴놀론, 방향족(aromatic) 항경련제, 알로퓨리놀, 라모트리진 등이 있다[4]. 약물 복용 관련한 정확한 SJS의 원인 기전은 알려져 있지 않지만 병태생리에 있어 human leukocyte antigen (HLA) 대립유전자형(allele)과 감수성이 있는 약물 종류와의 특정 조합들의 관련성이 알려져 있다[5]. 반면, 비약물성 요인들 역시 SJS/TEN의 유발인자로 작용할 수 있으며 백신, 화학물질 및 흄, 헤르페스바이러스 감염, 에이즈, 허브 물질, 광선 노출 및 방사선치료 등과의 관련성이 보고된 바 있었다[2].
한편, 피부 병변 없이 점막만 침범하는 SJS는 다형 홍반 major의 변이형으로도 생각되며 푹스 증후군(Fuchs syndrome) 혹은 비전형 SJS이라고 불린다[6]. 피부 침범 없는 비전형 SJS 중 상당수는 마이코플라즈마 폐렴을 동반한다고 알려져 있는데, 마이코플라즈마 폐렴-관련 비전형 SJS는 대개 소아와 청소년에서 발생이 보고되었으나[7] 성인에서의 발생 역시 10예 이내로 매우 드물게 보고된 바 있었다[6]. 본 증례에서는 전형적인 피부 병변을 보이지 않고 구강 및 양안 안구 점막만 침범하는 비전형적 SJS 임상 양상을 보인 HLA-A*11:01 및 HLA-A*31:01 대립유전자형의 가진 성인 환자 증례 1예를 보고하고자 한다.
증례보고
33세 남자가 안구를 침범한 SJS가 의심되어 추가적인 평가 및 치료를 위해 본원으로 의뢰되었다. 과거력상 본원 초기 내원 3주 전 전신 발열을 동반한 인후염이 있었고 내과 의원에서 경구 약제를 5일간 복용한 뒤 양안의 심한 결막충혈 및 가성막이 발생하였다. 당시 복용한 경구 약제들은 NSAID인 록소프로펜(loxoprofen), 아세트아미토펜(acetaminophen), 항생제인 세파클러(cefaclor), 진해 거담목적의 스트렙토키나제(streptokinase), 스트렙토도르나아제(streptodornase), 아세틸시스테인(acetylcysteine), 소화기계약제인 모사프리드(mosapride) 및 스테로이드인 프레드니솔론(prednisolone)이었다. 초기 안구 증상 발생 당시 안과 의원에서 바이러스 결막염 의심하 국소 레보플록사신 항생제 및 플루오로메토론 스테로이드 점안의 보존적 치료하였고 이후 2주간 호전 없이 지속되었으며, 안구 증상 발생과 동시기에 위아래 입술을 포함한 심한 구강 내 점막 까짐이 동반되어 이후 이비인후과 의원에서 SJS을 추정 진단한 바 있었다. 피부 발적을 포함한 전신 피부 이상 소견은 없었다. 안과적으로는 3년 전 양안 라섹수술을 제외하고 특이 과거 력은 없었다.
본원 안과 초진 당시 세극등현미경상 양안 구결막과 상하안검결막의 미만성 충혈 및 상피결손, 각막의 미만성 점상 각막미란이 관찰되었고 가성막 및 검구 유착은 없었으며(Fig. 1), 구강 점막 벗겨짐은 호전된 이후였다. 안검결막 및 구결막의 여포 및 유두 비대는 관찰되지 않았다. 본원 피부과 협진상 피부 병변이 없었기 때문에 전형적인 SJS의 가능성은 낮다고 하였다. 그러나, 여포 및 유두 비대를 동반하지 않은 결막충혈과 결막상피결손이 양안에서 명백하고, 구강 점막을 뚜렷하게 침범했던 점, 상기도 감염 및 약물 복용력 등을 종합적으로 고려하여 안과에서는 비전형 SJS으로 추정 진단하였다. 외안부검사상 InflammaDryTM (Quidel, San Diego, CA, USA)로 측정한 눈물 내 기질 금속단백분해효소 9 (matrix metalloproteinase-9)의 발현은 양안 모두 강양성이었고 쉬르머I검사상 눈물 분비량은 우안 9 mm, 좌안 22 mm였다. 양안 모두 망막, 시신경에는 이상 소견은 없었다. 양안에서 안구 표면의 다발성 상피결손이 있었기 때문에 과거 알려진 급성기 SJS/TEN에서의 치료지침[2]에 따라 시급한 양안 일시 양막덧댐술을 강력 권고하였으나 환자분이 내과적 치료를 우선 원하여 양안 20% 자가혈청 2시간마다, 국소 목시플록사신(Vigamox; Alcon, Fort Worth, TX, USA) 하루 4회, 0.1% 사이클로스포린(Ikervis; Santen SAS, Evry, France) 하루 2회, 0.5% 로테프레드놀(Lotepro; Hanlim, Yongin, Korea) 하루 4회 점안을 시작하였다. 특정 약물에 대한 SJS/TEN의 유전적 감수성 여부를 확인하기 위해 시행한 고해상도 HLA-A 대립유전자형 검사 결과 대립유전자 1에서는 HLA-A*11:01, 대립유전자 2에서는 HLA-A*31:01이 확인되었다. 이외 혈액검사상, 간기능 및 신기능은 정상이었고 림프구증가증 및 호산구증가증은 없어 SJS/TEN와 더불어 SCAR의 일종인 호산구 증가와 전신반응을 동반한 약발진(drug reaction [or rash] with eosinophilia and systemic symptoms)의 가능성은 배제하였다. 또한 감염성 질환 동반 여부를 감별하고, SJS 환자에서 안구 표면 세균총 변화 여부를 통상 확인하는 본 기관 진료지침에 따라 결막낭 도말 검체를 채취한 후 세균, 진균 배양검사를 시행하였으며 모두 음성으로 확인되었다.
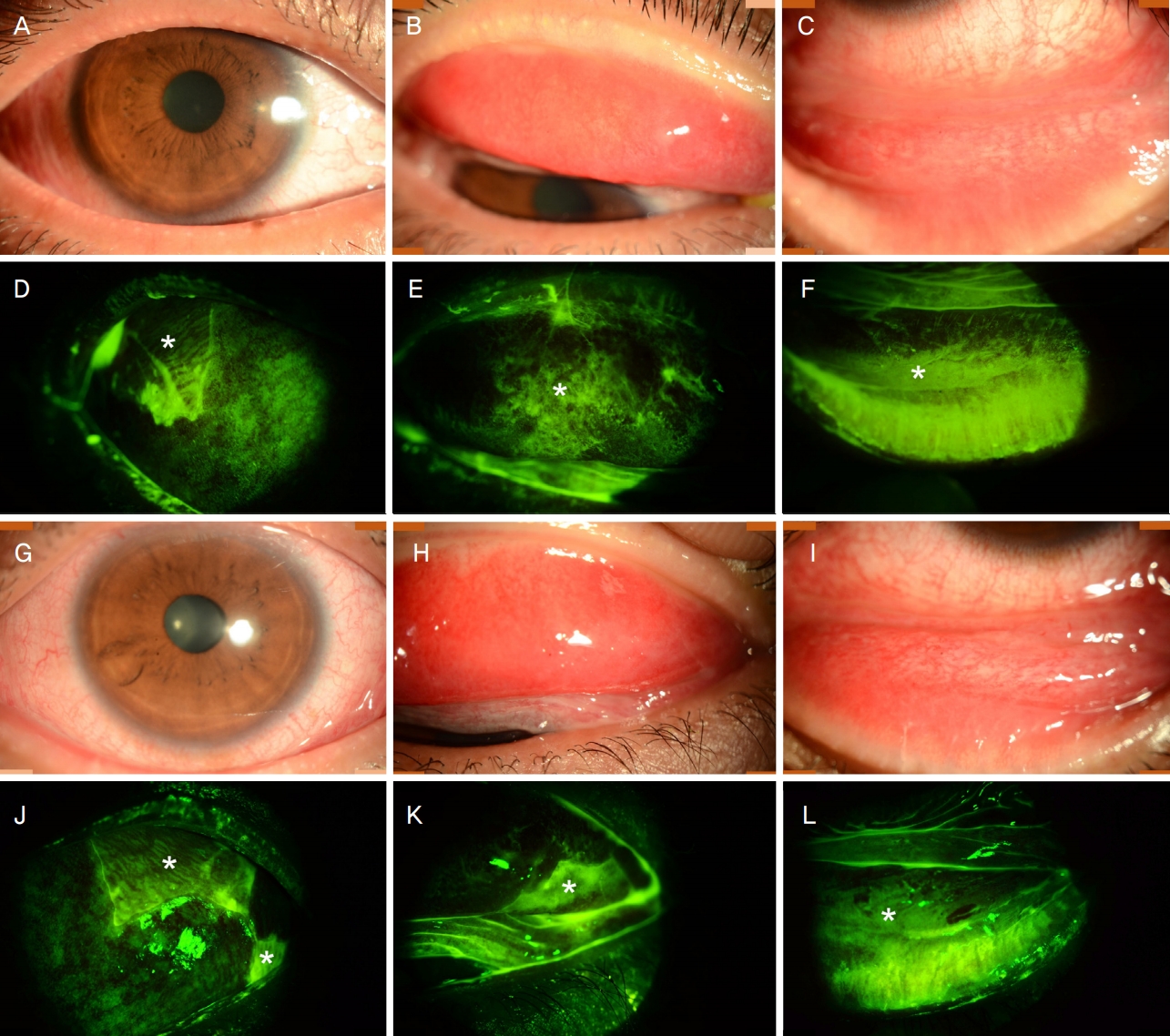
Slit-lamp photographs in the right (A-F) and left (G-L) eyes at the initial visit. The slit-lamp photographs show the diffuse bulbar conjunctival injection (A, G) with severe hyperemia at the upper and lower tarsal conjunctiva (B, C, H, I). The conjunctival epithelial defect with fluorescein staining (white asterisks) was noted in temporal area of bulbar conjunctiva (D, J) and upper (E, K) and lower tarsal conjunctiva (F, L) in both eyes.
10일 후 양안 결막의 상피결손은 소실되었고 한 달 뒤 양안 충혈 및 각결막미란은 크게 호전되었다. 이후 양안 20% 자가혈청, 목시플록사신, 0.1% 사이클로스포린 점안을 유지하였고, 기존에 사용하던 로테프레드놀 대신 대신 무보존제 0.1% 국소 플루오로메토론(Fumelon; Hanlim, Yongin, Korea) 하루 4회와 덱사메타손, 네오마이신, 폴리믹신 복합안연고(Maxitrol oint; Alcon, Fort Worth, TX, USA) 하루 1회 안구 도포로 대체하였으며 무보존제 카보머 겔(Liposic EDO ophthalmic gel; Bausch & Lomb, Laval, Canada) 점안을 시작하였다. 이후 5개월간 뚜렷한 호전 및 악화 없이 상태 유지되었으며, 각막미란은 미국국립안연구소(The National Eye Institute/Industry, NEI Scale) 기준으로 우안 12점, 좌안 10점, Sjögren’s International Collaborative Clinical Alliance (SICCA) 안구표면염색지수는 우안 9점, 좌안 8점으로 여전히 매우 높았다. 이에 점안 스테로이드를 기존 플루오로메토론에서 무보존제 1% 프레드니솔론 아세테이트(Predbell; Chong Kun Dang, Seoul, Korea) 하루 4회 점안으로 교체하였고 이외 점안제들은 유지하였으며, 경구 프레드니솔론 10 mg 하루 1회 매일 복용을 시작하여 이후 4개월간 서서히 감량하면서 복용을 중단하였다. 4개월 후 각막미란은 NEI scale 기준 우안 4점, 좌안 3점으로, SICCA 안구표면염색지수는 우안 8점, 좌안 5점으로 호전되었다. 비록 발병 후 약 10개월이 경과하였으나 비전형 SJS의 발생 원인을 감별하기 위해 시행한 혈액검사상 마이코플라즈마 폐렴균에 대한 혈청 immunoglobulin (Ig)M은 음성, IgG가 양성으로 확인되었다. 안구 증상이 만성적으로 지속되었기에 비록 가능성은 낮을 것이지만 마이코플라즈마 폐렴균에의 재노출 등을 염두에 두고 경구 클래리스로마이신 250 mg을 하루 2회씩 2주일간 복용하였으며, 점안제는 20% 자가혈청, 목시플록사신, 0.1% 사이클로스포린, 무보존제 0.1% 플루오로메토론, 무보존제 카보머 겔의 점안을 지속하였다. 발병 12개월째 각막미란은 NEI scale 기준 우안 2점, 좌안 2점으로, SICCA 안구표면염색지수는 우안 6점, 좌안 3점으로 호전되었고(Fig. 2) 환자가 호소하는 외안부 불편감 역시 완화되었다. 양안 모두 검구 유착은 발생하지 않았다.

Slit-lamp photographs in the right (A-D) and left (E-H) eyes at 1 year. The slit-lamp photographs show the attenuation of bulbar conjunctival injection (A, E) compared to the initial visit. The corneal punctate epithelial erosions were minimal (B, F). The conjunctival punctate epithelial erosions were observed in both eyes with fluorescein staining (C, D, G, H) and the conjunctival erosions were more apparent in the right eye (asterisks in C, D).
고 찰
전형적인 SJS은 대개 약물 복용에 의해 유발되며 초기 소견으로서 안과적 병변보다는 피부 병변이 특징적인 질환이다. 이에 본 증례와 같이 전형적인 피부 병변을 보이지 않는 비전형 SJS 증후군의 경우 진단이 지연될 수 있다. 비록 뒤늦게 마이코플라즈마 폐렴균에 대한 혈청 IgG 양성결과를 얻었지만 이는 과거 마이코플라즈마 폐렴균에 대한 노출 혹은 감염력만 알려줄 뿐 정확한 감염 시점을 알 수 없다. 단, 환자 병력 청취상 이전에 폐렴을 앓은 적이 없는 점으로 미루어볼 때 처음 인후염을 호소하던 당시 호흡기 증상이 마이코플라스마 폐렴균에 의한 것일 가능성이 높아 본 증례에서는 마이코플라스마 폐렴균에 의한 비전형 SJS을 어느 정도 추정할 수는 있겠다. 마이코플라즈마 폐렴균이 관련된 비전형 SJS의 문헌들을 정리한 한 연구에 따르면, 마이코플라즈마 폐렴균 관련 비전형 SJS은 대개 소아나 청소년에 발생하고 성인에서는 매우 드물며 이제껏 단 7명의 성인 증례만 전 세계적으로 보고된 바 있었다 하였으므로[6], 마이코플라즈마 폐렴균-관련 비전형 SJS은 그 자체로 매우 드문 질환이라고 할 수 있겠다. 또한 일반적으로 비전형 증례로 진단하기 위해서는 타질환을 배제하는 것이 중요한데, 본 증례에서는 여포 및 유두 비대가 없었고 결막낭 배양검사상 균이 배양되지 않았던 점 때문에 바이러스나 세균 및 진균성 질환의 가능성은 낮다고 판단하였다.
본 증례의 HLA-A의 대립유전자형은 HLA-A*11:01와 HLA-A*31:01로 확인되었는데, 이는 과거 5,802명의 한국인을 대상으로 한 HLA 대립유전자 빈도 분석 연구 결과 HLA-A*11:01는 HLA-A 중 약 10.048 %, HLA-A*31:01는 5.024 %의 빈도로 발견되어[8] 한국인에서 상대적으로 한국인에서 흔한 유전자형이라고 생각할 수 있다. HLA-A*11:01은 감기약 복용 후 발생한 SJS/TEN 환자에서 발현 연관성이 밝혀진 바 있었고[9], HLA-A*31:01 유전자형은 몇몇 인구 집단에서 항경련제 복용 후 발생한 SJS/TEN의 위험인자로 작용하는 것이 확인된 바 있었는데[10], 흥미롭게도 HLA-A*31:01는 특히 비전형 SJS에서도 그 발현이 확인된 바 있었다[11]. 본 증례의 환자는 복용 약물 중 항경련제가 포함되어 있지 않고 NSAID, 아세트아미노펜 등 감기 약물 복용력이 있으면서 HLA-A*11:01 대립유전자형은 발현하나 전형적인 피부 이상 소견은 나타나지 않았기 때문에 주로 마이코플라즈마 폐렴균이 연관되어 있었던 기존 보고들과는 달리 오히려 약물 복용력과 뚜렷하게 연관된 비전형 SJS이라는 독특한 임상 특징을 가진다고 할 수 있겠다. 반면 최근 한 연구에 따르면, 감기 약물 복용 이후 발생한 중증 안구 표면 합병증을 동반하는 한국인 SJS 환자에서는 HLA-A*02:06와 HLA-C*03:04 대립유전자형이 가장 크게 연관되어 있다고 보고되었다. 이렇듯 인종, 복용 약물의 종류 및 HLA 대립유전자형이 SJS의 임상 양상에 서로 상이한 영향을 줄 수 있으며, 특히 비전형 SJS 환자와 특정 HLA 대립유전자형의 상관 관계를 파악하기 위해서는 국내에서도 비전형 SJS 환자를 재조명하고 향후 대립유전자형의 꾸준한 분석 및 자료 수집이 요구되겠다.
본 증례가 마이코플라즈마 폐렴균-관련 비전형 SJS인지는 명확하지 않지만 이제까지 국내에서 피부 침범 없이 안구 및 구강만 침범하는 비전형 SJS 증례는 보고된 바 없었으며 본 증례가 최초 보고이다. 비전형 SJS은 피부 소견이 없기 때문에 비록 진단이 쉽지 않겠고 심지어 질환 발생이 매우 드물겠지만, 약물 복용력과 더불어 구강 및 안구 점막의 동시 침범이 있는 경우 비전형 SJS의 가능성을 한번쯤 염두에 둘 필요가 있겠다. 더불어 초기 정확한 원인 감별 진단을 위해서 마이코플라스마 폐렴균에 대한 혈청 항체검사, 약물 발진을 구분하기 위한 호산구증가증 여부 확인, 호흡기 내과 진료 의뢰, 구강 병변이 있는 경우 이에 대한 생검을 고려해볼 수 있겠다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
김민정 / Minjeong Kim
중앙대학교 의과대학 중앙대학교병원 안과학교실
Department of Ophthalmology, Chung-Ang University Hospital, Chung-Ang University College of Medicine
