폐쇄성 수면무호흡증(obstructive sleep apnea)은 수면 중 반복적으로 기도가 제한되면서 무호흡과 저호흡이 발생하는 질환으로, 수면호흡장애(sleep-disordered breathing)의 한 유형이다. 임상에서 흔하게 접할 수 있는 질환 중 하나로, 여러 가지 신체적 질환과 연관되어 있는 것으로 알려져 있다. 폐쇄성 수면무호흡증 환자들에서는 수면 중 무호흡과 저호흡으로 인하여 저산소증, 고이산화탄소증과 각성이 유발되고 야간 수면의 질 저하, 주간에 피로, 졸림, 집중력 저하, 기억력 저하 등이 발생하여 일상 생활의 불편함을 호소하는 일이 빈번하게 나타난다[
1,
2]. 더 나아가 기분장애, 전신성 고혈압, 당뇨, 관상동맥질환, 뇌졸중과 같은 심혈관계 사망률 증가에도 영향을 미치는 것으로 알려져 있다[
3-
8]. 폐쇄성 수면무호흡증의 기전으로는 상기도의 해부학적 구조 문제, 비만 등으로 인두부의 좁아짐, 연조직과 혀에 지방이 축적되어 발생하는 상기도의 해부학적 허탈(collapsibility) 등이 알려져 있다[
1]. 또한 복부비만과 같은 중심부 지방조직의 증가도 폐용적을 감소시켜 인두부의 허탈을 증가시킨다[
9]. 임상에서 폐쇄성 수면무호흡증을 의심할 수 있는 가장 흔한 증상은 수면 중 코골이이며 호흡이 반복적으로 멈췄다가 다시 시작되는 무호흡이 동침자에게서 발견되기도 한다. 이학적 검사 소견으로는 허리둘레, 목둘레 증가와 같은 중심비만이 관찰되며 비중격만곡, 비갑대의 비대가 보이기도 한다[
1]. 여러 연구들을 통해 국내 폐쇄성 수면무호흡증의 유병률은 남성에서 4.5%, 여성에서 3.2%로 알려져 있다. 최근 진단검사의 대중화와 질병에 대한 관심 증가로 폐쇄성 수면무호흡증으로 진단받는 환자의 수가 지속적으로 증가하고 있다[
10].
표준 수면다원검사는 만성적 저산소증에 따른 수면 상태 및 질평가를 객관화한 검사법으로 폐쇄성 수면무호흡증의 진단 및 환자 상태 분석에 매우 유용하다. 수면다원검사 결과 중 가장 대표적인 것으로 평균 1시간 동안 발생한 무호흡과 저호흡 횟수를 합한 무호흡-저호흡 지수(apnea-hypopnea index, AHI)가 있으며 정상은 5 미만, 경증은 5-14, 중등도는 15-29, 중증은 30 이상으로 폐쇄성 수면무호흡증을 분류한다. 무호흡은 수면 중 10초 이상 평소 호흡기류의 90% 이상의 감소를 보이는 것이며, 저호흡은 수면 중 10초 이상 평소 호흡기류의 30% 이상의 감소를 보이고 혈중 산소포화도가 3% 이상 감소를 동반하거나 각성을 동반하는 것으로 정의한다. 호흡장애지수(respiratory disturbance index, RDI)는 AHI에 호흡노력 관련 각성(repiratory effortrelated arousal, RERA)을 합한 값이다. RERA은 호흡곤란으로 10초 이상 무호흡이나 저호흡의 기준에는 도달하지 못하지만 호흡노력에 의해 각성이 발생하고 각성이 일어나면 호흡노력이 해소되는 것을 의미한다. 호흡노력은 식도 내압이 음압으로 10 cmH
2O 이상으로 유지되는 것을 뜻한다. 산소탈포화도지수(oxygen desaturation index, ODI)는 시간당 산소포화도 값이 baseline보다 3% 이상 저하되는 횟수이며 정상은 5 미만이다[
11,
12]. 검사 결과상 AHI, RDI와 ODI가 높을수록, 최저산소포화도가 낮을수록 더 악화된 폐쇄성 수면무호흡증을 의미하게 된다.
폐쇄성 수면무호흡증의 임상적 중요성이 밝혀지면서, 이 질환이 눈에 미치는 다양한 영향들에 대해 많은 연구가 진행되었다. Ekinci et al [
13]에 따르면 폐쇄성 수면무호흡증이 악화되어 AHI가 높을수록, 최저산소포화도(Min. SpO
2)가 낮을수록 중심각막두께가 얇아짐을 발표했다. Koseoglu et al [
14]는 AHI와 ODI가 높고, 최저산소포화도는 낮을수록 중심각막두께가 얇아지는 상관 관계를 보고하였다. 2019년에 Bojarun et al [
15]는 AHI, ODI가 높을수록 중심각막두께뿐만 아니라 각막내피세포밀도도 작아지며, 최저산소포화도가 낮을수록 각막내피세포밀도가 감소하는 상관 관계가 있음을 확인하였다. 위의 연구들을 통해 폐쇄성 수면무호흡증이 심할수록 중심각막두께와 각막내피세포밀도는 감소하며, 이는 낮은 산소포화도와 관련되어 있음을 확인하였다. 하지만 국내에서는 이와 같은 폐쇄성 수면무호흡증 환자들의 각막을 형태학적으로 분석한 연구는 아직 없었다. 따라서 본 연구는 폐쇄성 수면무호흡증으로 진단받은 국내 환자 22명을 대상으로 경면현미경을 이용하여 각막의 형태학적 분석을 시행하고, 수면다원검사 결과 간의 상관 관계를 알아보고자 한다.
대상과 방법
본 연구는 경희대학교병원 기관윤리심의위원회(KyungHee University Hospital Institutional Review Board, 승인 번호: KHUH 2020-06-088)의 승인 아래 진행되었으며, 헬싱키선언(Declaration of Helsinki)을 준수하였다. 2014년부터 경희대학교병원 신경과와 이비인후과에서 수면다원검사를 시행하여 폐쇄성 수면무호흡증으로 진단받은 환자들 중 안과에서 비접촉형 경면현미경(Konan Noncon Robo NSP-9900 noncontact specular microscope; Konan medical, Inc., Nishinomiya, Japan) 검사를 시행한 22명 22안에 대한 의무기록을 후향적으로 분석하였다. 폐쇄성 수면무호흡증 환자 22명에 대하여 시력, 안압, 경면현미경검사 결과인 중심각막두께, 각막내피세포밀도, 육각형세포비율, 세포면적변이계수와 수면다원검사 결과인 AHI, RDI, ODI, 최저산소포화도, 신체비만지수를 조사하였다. 비접촉형 경면현미경을 이용하여 각막중심부의 내피 영상을 촬영하였고, 캡처된 내피 영상의 내피세포 윤곽이 선명하지 않거나 초점이 빗나간 경우에는 반복 촬영하였으며, 반복을 통해 얻은 1회 측정값을 분석 대상에 포함시켰다.
대조군은 폐쇄성 수면무호흡증 진단과 치료를 받지 않았으며 이들의 동침자에게 폐쇄성 수면무호흡증의 증상인 수면 중 코골이, 무호흡증, 주간 졸림증, 주간 피로, 집중력 저하, 기억력 저하가 없음이 확인되고 나이, 성별, 당뇨병, 고혈압, 신체비만지수까지 고려하여 2014년 이후부터 본원 안과에서 안과적 검사를 시행 및 추적 관찰 중인 환자들에서 32명 32안으로 설정하였다. 환자군과 대조군 모두 어느 쪽 안이든 백내장수술과 같은 안과적 수술을 시행한 경우, 안구 내 활동성 감염 혹은 염증 소견이 있거나 과거 포도막염의 병력이 있는 경우, 시력을 저해하거나 또는 내과적, 외과적 중재가 필요할 수 있는 백내장, 당뇨망막병증, 망막혈관폐색, 망막박리, 황반원공 그리고 안압하강제 사용이 필요한 녹내장 등의 질환이 있는 경우는 제외하였다. 추가적으로 폐쇄성 수면무호흡증 환자 22명 중 빛간섭단층촬영기(Cirrus HD-OCT 5000®; Carl Zeiss Meditec, Dublin, CA, USA)를 이용하여 상측, 하측, 이측, 비측의 망막신경섬유층 두께를 측정한 12명에 대하여, 같은 방법으로 망막신경섬유층 두께를 측정한 대조군 32명과의 하위집단 분석을 시행하여 망막신경섬유층 두께와 수면다원검사 결과 인자들 사이의 통계적 연관성을 분석하였다.
폐쇄성 수면무호흡증 환자군과 대조군은 Mann-Whitney test를 시행하여 두 군 간의 통계적 연관성을 확인하였다. 또한 각막의 형태학적 인자들과 수면다원검사 인자들 사이의 연관성은 Spearman correlation test를 통하여 상관관계를 분석하였다. 통계처리는 IBM SPSS software version 23.0 (IBM Corp., Armonk, NY, USA)을 사용하여 분석하였고 p값이 0.05 미만인 경우를 통계적으로 유의하다고 판단하였다.
결 과
본 연구의 대상안은 수면다원검사를 시행하여 폐쇄성 수면무호흡증을 진단받은 22명 22안이었으며 평균 나이는 61.88 ± 11.71세(23-79세)였고, 성별은 남자 10명, 여자 12명이었다. 환자군의 수면다원검사 결과, 평균 AHI는 35.08 ± 23.81/hr (중증도 분류: AHI ≥30/hr이므로 중증으로 분류), 평균 RDI 39.62 ± 22.36/hr, 평균 ODI 22.61 ± 21.45/hr였으며 평균 최저산소포화도는 82.68 ± 9.96%로 나타났다. 폐쇄성 수면무호흡증 환자군과 대조군 사이의 두 군 간 나이(
p=0.465)와 신체비만지수(
p=0.102)는 통계적인 차이는 없었다. 하지만 두 군 간 중심각막두께(
p=0.033)와 각막내피세포밀도(
p=0.021)는 폐쇄성 수면무호흡증 환자군이 대조군보다 통계적으로 의미 있게 더 낮은 것으로 나타났다. 이외에 두 군 간 육각형세포비율, 세포면적변이계수, 시력, 안압의 유의미한 차이는 없었다(
Table 1).
각막의 형태학적 인자들과 수면다원검사 인자들 간의 상관관계 분석 결과, 중심각막두께와 AHI (r=-0.519,
p=0.013) 사이에 통계적으로 의미 있는 음의 상관 관계를 보였다(
Table 2,
Fig. 1A). 또한 AHI가 커질수록 각막내피세포밀도는 낮아지는 경향을 보였으나 통계적으로 유의한 관련성은 없었다(r=-0.327,
p=0.137). 한편 RDI는 중심각막두께(r=-0.542,
p=0.009), 각막내피세포밀도(r=-0.454,
p=0.034)와 각각 통계적으로 유의미한 음의 상관 관계를 보였다(
Table 2,
Fig. 1B,
C). 하지만 ODI가 커질수록 중심각막두께(r=-0.255,
p=0.252)와 각막내피세포밀도(r=-0.164,
p=0.466)는 작아지는 경향이 있었지만 유의미하지 않았다. 최저산소포화도 또한 각막의 형태학적 인자들과 의미 있는 상관관계가 나타나지는 않았다(
Table 2).
추가적으로 대상안 22안 중 망막섬유신경층의 상측, 하측, 비측, 이측 두께를 측정한 12안에 대해 하위집단 분석을 시행하였다. 환자군 12안의 망막신경섬유층 두께는 대조군과 통계적으로 유의미한 차이는 없었다. 다만 환자군의 비측 망막신경섬유층 두께와 최저산소포화도(r=0.703,
p=0.011) 사이에서 의미 있는 양의 상관 관계가 확인되었다(
Table 3,
Fig. 1D).
고 찰
폐쇄성 수면무호흡증 환자에서는 만성적으로 무호흡과 저호흡이 반복되면서 저산소증, 고이산화탄소증이 지속된다. 만성적 저산소증과 고이산화탄소증은 고혈압, 당뇨병, 관상동맥질환, 뇌졸중과 같은 전신 질환을 야기한다.1 또한 느슨한눈꺼풀증후군, 비동맥염성 앞허혈시신경병증, 중심장액망막병증, 망막정맥폐쇄, 녹내장 등 여러 안과 질환 및 각막내피세포의 허혈성 변화가 폐쇄성 수면무호흡증과 연관되어 있다고 알려져 있다[
15,
16]. 폐쇄성 수면무호흡증과 유사하게 전신적으로 허혈성 조건이 지속되는 만성 호흡기질환 환자에서도 각막내피세포밀도가 감소되어 있음이 보고되었다[
17].
폐쇄성 수면무호흡증에서 가장 중요한 생리적 변화는 만성적으로 반복되는 저산소증이며, 이로 인한 허혈과 재관류로 인한 손상이 각막에 영향을 미칠 수 있다. 저산소증 조건에서는 혐기성 해당 반응(anaerobic glycosis)이 발생하고 각막기질의 산증(acidosis)을 유발하여 각막두께가 얇아지게 된다[
18]. 또한 만성적 저산소증 때문에 젖산염 탈수소 효소(lactate dehydrogenase) 방출, 미토콘드리아 반응산소의 증가, 세포내 질소산화물과 칼슘 증가, 항산화 효소인 초과산화물불균등화효소(superoxide dismutase) 활성도 및 세포 adenosine triphosphate (ATP) 감소가 발생하여 세포 생존력이 감소되고 중심각막두께가 감소되는 것으로 알려져 있다[
19]. 이외에 콘택트렌즈를 장기간 사용하여 저산소증 환경이 지속된 환자들에서 각막기질세포(keratocyte)와 각막두께의 감소를 밝힌 연구는 앞선 연구에서의 저산소증 조건하 각막의 형태학적 변화를 뒷받침해 준다[
20]. 또 다른 연구에서는 저산소증이 tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6)와 같은 염증사이토카인을 자극하는데 핵심적 역할을 하는 nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB)를 포함한 다양한 전사인자(transcription factors)를 촉진시키고 이러한 사이토카인들이 과발현되어 각막이 얇아진다고 발표하였다[
21].
기존의 많은 연구들에서 폐쇄성 수면무호흡증과 여러 안과적 질환에 대한 관련성을 보고한 바는 있었으나 각막의 형태학적 변화에 대한 국내 연구는 없었기 때문에, 저자들은 폐쇄성 수면무호흡증 환자 각막의 형태학적 특징을 대조군과 비교하고 각막의 형태학적 인자와 수면다원검사 인자 간의 상관 관계를 분석하는 데 목적을 두었다. 이에 폐쇄성 수면무호흡증 환자 22명에 대해 경면현미경검사를 시행하여 각막의 형태학적 변화를 분석하였다. 그 결과 국내 환자들의 중심각막두께는 대조군보다 25.54 μm 더 얇은 것으로 나타났다. 환자군의 중심각막두께가 얇아진 원인으로는 폐쇄성 수면무호흡증으로 유발된 전신적 저산소증과 이에 따른 허혈과 재관류가 각막의 손상 및 각막 기질의 산증, 세포 생존력의 감소를 야기한 것으로 추측된다. 또한 환자군에서 각막내피세포밀도가 대조군보다 의미 있게 적은 것을 확인하였다. 이는 만성적 저산소증이 방수와 각막내피세포의 물질대사 변화를 일으키고, 각막내피세포의 열역학적, 기하학적 불안정으로 인해 생리학적으로 각막내피세포가 그 크기와 육각형 모양을 유지하기가 어렵게 되는 점에 기인한 것으로 보인다. 이와 같은 조건에서의 폐쇄성 수면무호흡증 환자에서는 각막내피세포의 세포 내 골격(intracellular cytoskeleton)의 영구적인 변화가 발생하여, 각막내피세포밀도의 감소가 발생한 것으로 생각된다[
17,
22]. 환자의 전신적 저산소증이 심하여 AHI, RDI 값이 커질수록 중심각막두께와 각막내피세포밀도가 감소하는 음의 상관관계를 보였는데, 이는 만성적 전신 저산소증으로 인한 각막의 형태학적 변화를 뒷받침해 준다. 이와 같은 본 연구의 결과들을 바탕으로 만성적으로 반복되는 악화된 저산소증의 정도와 기간, 즉 폐쇄성 수면무호흡증의 중증도와 질병 지속 기간에 따라 각막의 형태학적 변화 양상이 다양하게 나타날 수 있을 것으로 생각해 볼 수 있다. 하지만 본 연구는 폐쇄성 수면무호흡증의 중증도로 환자군을 분류하여 각막의 형태학적 인자와 수면다원검사 인자 간의 통계적 관련성을 분석하기 어려웠으며 이와 관련하여 추가적인 연구가 필요할 것으로 보인다.
다만 본 연구에서는 산소포화도와 직접적으로 연관된 ODI와 각막의 형태학적 인자들 간에 유의미한 상관 관계는 나타나지 않았다. 이는 해외 폐쇄성 수면무호흡증 환자의 수면다원검사 결과와 비교했을 때, 국내 환자들의 무호흡과 저호흡 증상 정도가 심하지 않았고, 대상 환자에서 낮은 평균 ODI 값과 높은 평균 최저산소포화도 값을 보였기 때문이다. 다시 말해 해외 환자들에서 더 악화된 만성적 저산소증이 각막의 심한 형태학적 변화를 유발하여 본 연구와는 다른 결과의 각막내피세포밀도, ODI, 최저산소포화도 등이 나타난 것으로 추측된다.
환자군 중 망막신경섬유층 두께를 측정한 12명의 하위 집단 분석 결과, 대조군과 통계적으로 유의미한 차이는 없었으나 환자군의 수면다원검사 인자 중 최저산소포화도와 비측 망막신경섬유층 두께 사이에서 의미 있는 양의 상관관계가 있는 것을 확인하였다. 이는 폐쇄성 수면무호흡증 환자들에서 만성적으로 반복되는 저산소증 및 허혈성 변화가 시신경혈류 관류와 산소포화도에도 영향을 주며, 이로 인해 망막신경섬유층이 얇아지는 변화가 나타나기 때문인 것으로 생각된다. 이전 연구들에 따르면 폐쇄성 무호흡증 환자에서 무호흡과 저호흡이 발생하는 동안 산화질소와 엔도텔린(Endothelin)의 불균형으로 인해 시신경 혈류 자동조절기전이 손상되고, 시신경 신경절세포가 손실됨이 밝혀졌다. 동시에 저산소증과 고이산화탄소증이 뇌압 상승을 발생시키고, 간접적으로 뇌혈류량과 시신경으로의 혈류량이 감소하여 전체 평균 망막신경섬유층 두께가 얇아지는 변화가 폐쇄성 수면무호흡증 환자에서 장기간 점진적으로 발생함이 보고된 바 있다[
23-
25]. 다만 본 연구에서와 같이, 단지 비측 망막신경섬유에 있어서 유의미한 두께의 감소가 나타난 점에 대해서는 추후 이와 관련된 추가적인 연구가 필요할 것으로 보인다.
이번 연구는 후향적으로 진행되었기 때문에 수면다원검사와 안과 검사를 동시에 시행한 많은 수의 환자군을 모으기 어려워, 환자군과 하위집단 분석 대상안의 수가 부족했다. 따라서 폐쇄성 수면무호흡증 환자의 각막의 형태학적 특징을 확인하기 위해 모든 대상자를 환자군에 포함시켰으며 비정규성과 이상치의 영향을 최소화하기 위해서 비모수 분석을 시행하였다. 같은 이유로 검사 결과에 영향을 줄 수 있는 당뇨병, 고혈압과 같은 전신적 질환을 갖은 환자를 제외하지 못했으며 또한 대조군에서 수면다원검사 시행을 통한 폐쇄성 수면무호흡증이 없음을 확인하지 못하였다. 연구의 한계점을 보완하는 동시에, 보다 정확한 각막의 형태학적 변화와 폐쇄성 수면무호흡증 사이의 상관관계 등의 연관성을 찾기 위해서는 대상안 수를 늘리는 보강 연구가 필요할 것으로 생각된다.
그럼에도 불구하고 본 연구는 폐쇄성 수면무호흡증 환자를 대상으로 각막의 형태학적 분석 및 망막신경섬유층 두께를 측정하고 수면다원검사 인자와의 상관 관계를 분석한 국내 첫 연구라는 점에서 의의가 있다. 저자들은 대조군에 비해 폐쇄성 수면무호흡증 환자군에서 중심각막두께와 각막내피세포밀도가 의미 있게 더 낮으며, 각막의 형태학적 인자와 수면다원검사 인자 사이에 유의미한 상관 관계가 있음을 확인하였다. 위와 같은 이유로 안과 의사로서, 임상에서 자주 접하게 되는 폐쇄성 수면무호흡증의 안과적 이상 소견에 대한 면밀한 관찰이 필요하다. 또한 최근 여러 연구들을 통해 밝혀진 바와 같이, 폐쇄성 수면무호흡증과 관련된 저산소증과 건성안, 원추각막, 시신경병증 등 다양한 안과적 임상 질환과의 가능성을 염두하여, 일련의 질환과의 연관성에 대한 추가적인 연구가 요구된다. 이를 통해 향후 국내 수면 질환 환자에서의 안과적 병리특성을 확인할 수 있는 접근이 가능해질 것이라 기대한다.
Figure 1.
Correlation plot between polysomnographic factors and corneal morphology and nasal retinal nerve fiber nerve (RNFL) thickness. (A) Central corneal thickness (CCT) and apnea-hypopnea index (AHI) are negatively correlated in correlation plot. (B) CCT and respiratory disturbance index (RDI) are negatively correlated in correlation plot. (C) Endothelial cell density (ECD) and RDI are negatively correlated in correlation plot. (D) Nasal RNFL thickness and lowest oxygen saturation (SpO2) are positively correlated in correlation plot.
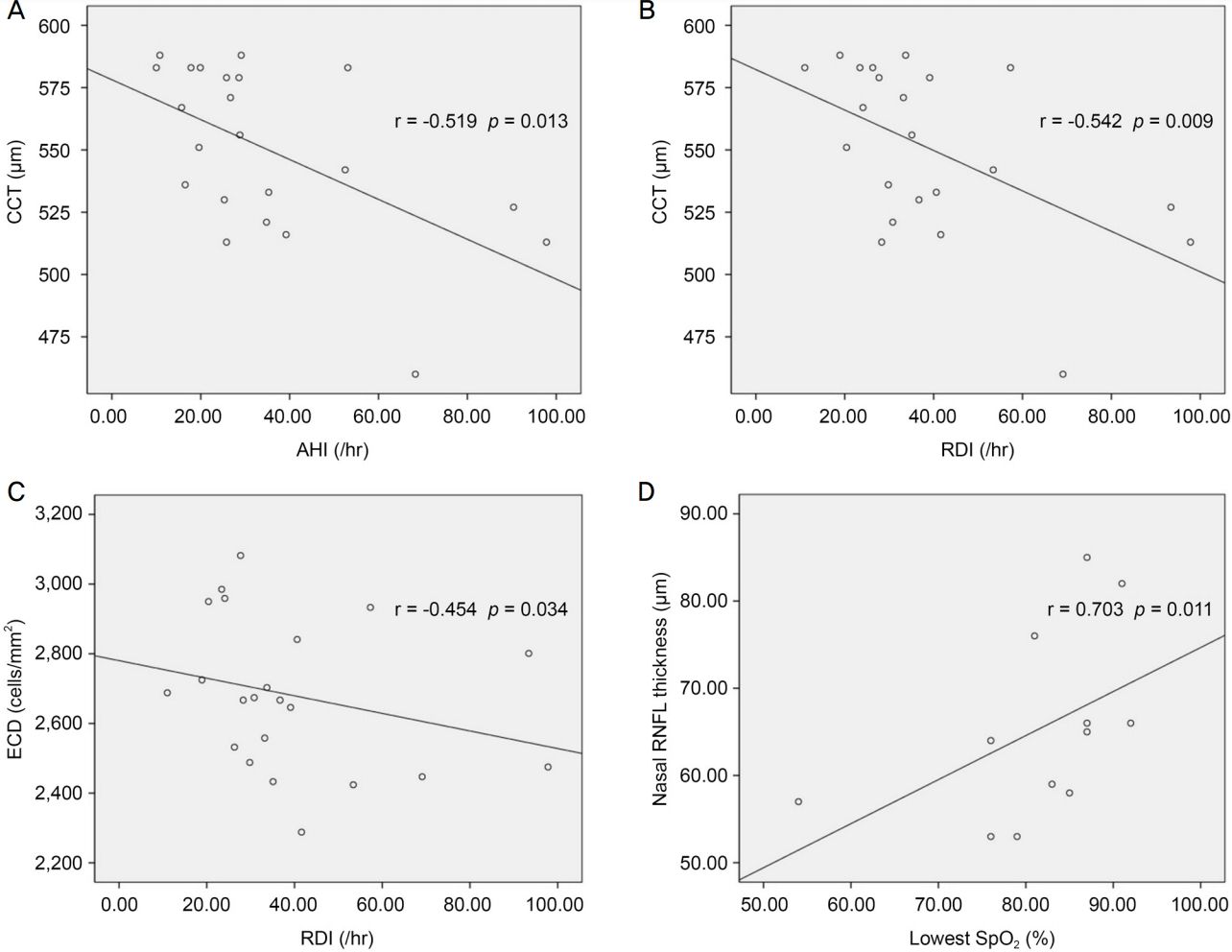
Table 1.
Demographic characteristics and results of ophthalmological/polysomnographic examination in all groups
|
Characteristic |
OSA group (n = 22) |
Control group (n = 32) |
p-value |
|
Age (years) |
61.88 ± 11.71 |
62.84 ± 11.67 |
0.465*
|
|
Sex (M:F) |
10:12 |
10:22 |
0.288†
|
|
DM |
8 (36.4) |
4 (12.5) |
0.051†
|
|
HTN |
12 (54.5) |
17 (53.1) |
0.918†
|
|
BCVA (logMAR) |
0.24 ± 0.30 |
0.38 ± 0.54 |
0.456*
|
|
IOP (mmHg) |
14.68 ± 2.80 |
15.22 ± 2.51 |
0.517*
|
|
CCT (μm) |
550.09 ± 33.81 |
575.63 ± 38.19 |
0.033*
|
|
ECD (cells/mm2) |
2,680.27 ± 214.28 |
2,866.03 ± 323.95 |
0.021*
|
|
HEX (%) |
44.45 ± 7.50 |
46.88 ± 9.84 |
0.428*
|
|
CV |
43.86 ± 10.69 |
42.06 ± 12.27 |
0.369*
|
|
BMI (kg/m2) |
26.84 ± 4.46 |
25.07 ± 4.75 |
0.102*
|
|
RNFL thickness (μm) |
|
|
|
|
Average |
88.50 ± 11.60 |
89.34 ± 13.27 |
0.785*
|
|
Superior |
107.67 ± 18.64 |
111.84 ± 26.76 |
0.594*
|
|
Inferior |
110.17 ± 18.27 |
109.88 ± 22.24 |
0.612*
|
|
Nasal |
65.33 ± 10.65 |
66.22 ± 15.46 |
0.687*
|
|
Temporal |
70.75 ± 15.05 |
69.09 ± 15.13 |
0.507*
|
Table 2.
Correlation between corneal morphological factors and polysomnographic factors in obstructive sleep apnea patients
|
CCT
|
ECD
|
HEX
|
CV
|
|
r |
p-value |
r |
p-value |
r |
p-value |
r |
p-value |
|
AHI (/hr) |
-0.519 |
0.013 |
-0.327 |
0.137 |
-0.156 |
0.487 |
0.317 |
0.151 |
|
RDI (/hr) |
-0.542 |
0.009 |
-0.454 |
0.034 |
-0.292 |
0.188 |
0.481 |
0.053 |
|
ODI (/hr) |
-0.255 |
0.252 |
-0.164 |
0.466 |
-0.165 |
0.463 |
0.175 |
0.435 |
|
Lowest SpO2 (%) |
0.000 |
0.999 |
-0.075 |
0.740 |
0.039 |
0.865 |
-0.026 |
0.907 |
|
BMI (kg/m2) |
0.110 |
0.626 |
0.167 |
0.458 |
0.083 |
0.713 |
0.027 |
0.905 |
Table 3.
Subgroup analysis (n = 12) of correlation between RNFL thickness and polysomnographic factors in obstructive sleep apnea patients
|
RNFL average
|
RNFL superior
|
RNFL inferior
|
RNFL nasal
|
RNFL temporal
|
|
r |
p-value |
r |
p-value |
r |
p-value |
r |
p-value |
r |
p-value |
|
AHI (/hr) |
0.049 |
0.879 |
-0.049 |
0.880 |
-0.130 |
0.688 |
-0.351 |
0.263 |
0.378 |
0.225 |
|
RDI (/hr) |
-0.046 |
0.887 |
-0.154 |
0.633 |
-0.295 |
0.352 |
-0.165 |
0.609 |
0.207 |
0.519 |
|
ODI (/hr) |
0.119 |
0.714 |
0.081 |
0.803 |
-0.040 |
0.901 |
-0.575 |
0.051 |
0.511 |
0.090 |
|
Lowest SpO2 (%) |
0.096 |
0.766 |
0.004 |
0.991 |
0.260 |
0.414 |
0.703 |
0.011 |
-0.511 |
0.090 |
|
BMI (kg/m2) |
0.051 |
0.874 |
-0.025 |
0.940 |
-0.012 |
0.970 |
-0.434 |
0.159 |
0.114 |
0.724 |
REFERENCES
1) Lee YJ. Updates of diagnosis and treatment of sleep-related breathing disorders-focusing on obstructive sleep apnea. J Korean Neuropsychiatr Assoc 2020;59:20-4.

2) Young T, Palta M, Dempsey J, et al. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993;328:1230-5.


7) Yaggi HK, Concato J, Kernan WN, et al. Obstructive sleep apnea as a risk factor for stroke and death. N Engl J Med 2005;353:2034-41.


8) Young T, Finn L, Peppard PE, et al. Sleep disordered breathing and mortality: eighteen-year follow-up of the Wisconsin sleep cohort. Sleep 2008;31:1071-8.


9) Carberry JC, Amatoury J, Eckert DJ. Personalized management approach for OSA. Chest 2018;153:744-55.


10) Kim J, In K, Kim J, et al. Prevalence of sleep-disordered breathing in middle-aged Korean men and women. Am J Respir Crit Care Med 2004;170:1108-13.


11) Kim HJ. Portable sleep monitoring devices in Korea. Korean J Otorhinolaryngol-Head Neck Surg 2013;56:68-73.

12) Chung YS. Diagnosis of obstructive sleep apnea syndrome. Hanyang Med Rev 2013;33:227-32.

13) Ekinci M, Huseyinoglu N, Cagatay HH, et al. Is there a relationship between sleep apnea and central corneal thickness? Curr Eye Res 2013;38:1104-9.


14) Koseoglu HI, Kanbay A, Ortak H, et al. Effect of obstructive sleep apnea syndrome on corneal thickness. Int Ophthalmol 2016;36:327-33.


15) Bojarun A, Vieversyte Z, Jaruseviciene R, et al. Effect of obstructive sleep apnea on corneal morphological characteristics. Cornea 2019;38:1576-81.


17) Ishikawa A. Risk factors for reduced corneal endothelial cell density before cataract surgery. J Cataract Refract Surg 2002;28:1982-92.


18) Ang JH, Efron N. Corneal hypoxia and hypercapnia during contact lens wear. Optom Vis Sci 1990;67:512-21.


21) Lema I, Sobrino T, Durán JA, et al. Subclinical keratoconus and inflammatory molecules from tears. Br J Ophthalmol 2009;93:820-4.


22) Soler N, Romero-Aroca P, Gris O, et al. Corneal endothelial changes in patients with chronic obstructive pulmonary disease and corneal vulnerability to cataract surgery. J Cataract Refract Surg 2015;41:313-9.


23) Lin PW, Friedman M, Lin HC, et al. Decreased retinal nerve fiber layer thickness in patients with obstructive sleep apnea/hypopnea syndrome. Graefes Arch Clin Exp Ophthalmol 2011;249:585-93.


25) Zhao XJ, Yang CC, Zhang JC, et al. Obstructive sleep apnea and retinal nerve fiber layer thickness: a meta-analysis. J Glaucoma 2016;25:e413-8.

Biography
박종범 / Jong Beom Park
경희대학교 의과대학 경희대학교병원 안과학교실
Department of Ophthalmology, Kyung Hee University Hospital, Kyung Hee University School of Medicine








 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



