유리체가 전방을 채운 난치성 녹내장 환자에서 유리체절제술 후 시행한 섬유주절제술의 임상경과
Trabeculectomy Following Vitrectomy in Refractory Glaucoma with Vitreous Filling of the Anterior Chamber: a Case Series
Article information
Abstract
목적
유리체가 전방을 채우고 있는 난치성 녹내장 환자에서 25게이지 무봉합 경결막 유리체절제술 후 시행한 섬유주절제술의 1년 임상경과를 알아보고자 하였다.
대상과 방법
전방 내 유리체가 존재하고 최대약물치료에도 안압이 조절되지 않는 위수정체와 무수정체 녹내장 환자들을 대상으로 유리체절제술을 시행하고 순차적으로 마이토마이신C를 이용한 섬유주절제술을 시행하였다. 섬유주절제술 후 최소 12개월 이상 경과 관찰한 환자들의 의무기록을 후향적으로 분석하였다. 완전 수술 성공은 안압하강제 사용 없이 안압이 18 mmHg 이하이고, 수술 전에 비해 20% 이상 하강한 경우이며, 제한적 수술 성공은 안압하강제 사용과 관계없이 안압이 18 mmHg 이하이고 수술 전에 비해 20% 이상 하강한 경우로 정의하였다.
결과
총 7명 8안(위수정체군 4명 4안, 무수정체 3명 4안)이 본 연구에 포함되었다. 섬유주절제술 후 12개월에 제한적 수술 성공률은 87.5%, 완전 수술 성공률은 62.5%였다. 섬유주절제술 전 평균 안압은 28.1 ± 3.5 mmHg에서 수술 후 마지막 방문 시 15.0 ± 3.7 mmHg로 유의하게 감소하였다(p=0.012). 섬유주절제술 전 사용한 평균 안압하강제 수는 4 ± 0개에서 수술 후 마지막 방문 시 1.5 ± 2.1개로 유의하게 감소하였다(p=0.010). 모든 증례에서 망막박리, 유리체출혈, 낭성황반부종, 유리체 감돈은 발생하지 않았다.
결론
유리체가 전방을 채우고 있는 난치성 녹내장 환자에서 경결막 무봉합 유리체절제술 후 시행한 섬유주절제술은 효과적이고 안압 감소 방법임을 알 수 있었다.
Trans Abstract
Purpose
To evaluate the 1-year clinical outcome of subsequent trabeculectomy following 25-gauge transconjunctival sutureless vitrectomy in refractory glaucoma with vitreous filling of the anterior chamber.
Methods
This study was a retrospective and consecutive case series study. We reviewed the medical records of pseudophakic and aphakic glaucoma patients with vitreous filling of the anterior chamber who underwent subsequent trabeculectomy with mitomycin C (MMC), following 25-gauge transconjunctival sutureless vitrectomy. All patients had been followed up for more than 12 months. Complete surgical success was defined as an intraocular pressure (IOP) ≤18 mmHg and IOP reduction ≥20% without glaucoma medication. Qualified surgical success was defined as IOP ≤18 mmHg and an IOP reduction ≥20% with or without glaucoma medication.
Results
Eight eyes of seven patients (four eyes of four patients with pseudophakic glaucoma and four eyes of three patients with aphakic glaucoma) were included in this study. The cumulative probability of qualified success was 87.5%, and the cumulative probability of complete success was 62.5% at 12 months after trabeculectomy. The mean IOP decreased from 28.1 ± 3.5 mmHg preoperatively to 15.0 ± 3.7 mmHg at the final visit (p = 0.012). The mean number of glaucoma medications decreased from 4 ± 0 to 1.5 ± 2.1 at the final visit (p = 0.010). Complications including retinal detachment, vitreous hemorrhage, cystoid macular edema, and vitreous incarceration into the fistula were not observed.
Conclusions
Transconjunctival sutureless vitrectomy and subsequent trabeculectomy with MMC is an effective method for controlling IOP in pseudophakic and aphakic glaucoma with vitreous filling of the anterior chamber.
최대약물치료에도 반응하지 않는 녹내장 환자에게 안압 하강을 위한 대표적인 수술적 치료법으로서 섬유주절제술이 시행되고 있다. 섬유주절제술로 여과포를 생성하여 안구 내 방수 유출을 통해 수술 후 안압하강에 도움을 주며, 이에 시신경손상을 예방하고 진행 속도를 늦추는 것을 기대할 수 있다[1]. 그러나 위수정체와 무수정체 녹내장 환자에서 시행한 섬유주절제술의 성공률은 27-67%로 수정체안에서 섬유주절제술의 성공률인 74-85%보다 낮다고 보고되었다[1-7]. 섬유주절제술 후 여과포의 실패는 섬유아세포의 증식과 결막하 섬유화에서 기인하고, 젊은 나이, 무수정체안, 신생혈관 녹내장, 염증성 녹내장, 다수의 점안 안압하강제의 장기간 사용, 이전의 실패한 녹내장 여과 수술, 결막절개를 포함한 안과적 수술, 후낭이 존재하지 않거나 손상된 경우가 실패의 위험인자로 보고되었다[1,8,9].
위수정체와 무수정체 녹내장 환자는 섬유주절제술 시행 전에 결막절개가 포함된 안과적 수술력이 있거나 후낭이 존재하지 않고 파열되어 손상된 경우가 있으므로, 이로 인하여 수정체안보다 섬유주절제술의 수술 성공률이 낮은 것으로 보고되었다[1,2,4,7-10]. 최대약물치료에도 반응하지 않아 수술적 치료를 고려하는 위수정체와 무수정체 녹내장 환자에서 섬유주절제술 시행 전에 맞닥뜨릴 수 있는 한 가지 상황은, 탈출된 유리체가 전방을 채우고 있는 경우이다[1,11]. 유리체와 경계를 이루는 장벽인 수정체나 후낭이 존재하지 않거나 후낭이 파열되어 있는 위수정체와 무수정체 녹내장 환자에서는 유리체가 전방으로 탈출할 가능성이 높아지기 때문이다[1,11]. 전방으로 탈출되어 전방각에 존재하는 유리체는 섬유주를 폐쇄하여 방수의 유출을 저해할 수 있고[12,13], 섬유주절제술 후 누공을 막아 방수유출 경로를 폐쇄함으로써 수술 실패를 야기할 수 있다[1,11]. 섬유주절제술 시행 중에 내측공막절개술 후 누공을 막는 유리체가 발견되는 경우, 방수유출 경로의 폐쇄를 방지하기 위해 유리체절제술이 필요하다[3,14]. 국내에서 Kim et al [15]은 후낭이 파열되어 있는 원발개방각녹내장 환자에서 섬유주절제술 3개월 후 홍채절개부를 통해 유리체가 전방으로 탈출되어 섬유주절제 부위가 폐쇄되고 안압이 증가함을 보고하였고, 전방으로 탈출된 유리체를 제거하고 여과포 기능 회복과 안압하강을 위해 앞유리체절제술을 시행하였다. 그러므로, 섬유주절제술 시행 과정에서 전방 내에 유리체가 있으면, 누공을 만든 후 앞유리체절제술을 시행하여 술 후 누공의 막힘을 예방하는 것이 필요하다[11]. 이를 위해 Melamed et al [11]은 유리체가 전방을 채우고 있는 위수정체와 무수정체 녹내장 환자 15안에서 앞유리체절제술과 섬유주절제술을 동시에 시행하고 안압하강제 사용에 관계없이 안압이 21 mmHg 미만을 수술 성공으로 정의하여, 80%의 수술 성공률을 보고하였다. Herschler [12]는 41명의 무수정체 녹내장 환자에서 섬유주절제술 전에 유리체절제술을 시행하거나 섬유주절제술과 동시에 유리체절제술을 시행하고 안압하강제 사용에 관계없이 안압이 21 mmHg 미만인 것을 수술 성공으로 정의하여, 수술 후 6개월에 78%의 성공률을 보고하였다.
그러나, 섬유주절제술 시 유리체절제술을 동시에 시행한 이전 연구들에서 망막박리, 낭성황반부종, 지속된 저안압과 맥락막박리, 유리체출혈 등의 심각한 수술 후 합병증이 보고되었다[11,12]. 그 이유로 이전 연구들에서 평면부 절개창이 아닌 각막윤부절개나 내측공막절개를 통한 앞유리체절제술을 시행한 것을 들 수 있다. 각막윤부절개나 내측공막절개를 통한 앞유리체절제술은 유리체절제기가 유리체를 앞으로 당겨 유리체가 계속하여 전방으로 탈출할 수 있다는 단점이 있다. 특히, 수정체소대 해리가 있는 위수정체 녹내장안에서는 수정체소대 주변으로 유리체가 나올 수 있다. 앞유리체절제술 시행 중에 발생하는 전방 내 난류에 의해 각막내피세포 손상의 가능성이 있고, 전방 내로 유리체가 당겨지면서 유리체망막견인으로 인한 망막박리의 합병증이 발생할 수 있다[16-18].
그러므로, 전방을 채우고 있는 유리체를 제거하기 위해서는 평면부로 접근하는 유리체절제술이 각막윤부절개를 통한 앞유리체절제술보다 더 효과적인 방법으로 보고되었다[16,19]. 최근 시행되고 있는 경결막 무봉합 유리체절제술은 결막을 절개하는 20게이지 유리체절제술에 비해 수술 후 염증 반응이 적고, 수술로 인한 외상성 결막반흔이 최소화되는 장점이 있어 섬유주절제술의 결과에 부정적인 영향을 미치지 않는 것으로 보고되었다[20,21].
이에 저자들은 유리체가 전방을 채우고 있는 위수정체와 무수정체 녹내장 환자에서 평면부를 통한 25게이지 경결막 무봉합 유리체절제술을 시행하여 전방내 유리체를 제거하고 순차적으로 섬유주절제술을 시행한다면 섬유주절제술 중 혹은 수술 후 유리체에 의한 내측 누공의 막힘을 예방하고 안전하고 효과적으로 안압을 감소시킬 수 있을 것으로 유추하였다.
현재까지 유리체가 전방을 채우고 있는 위수정체 그리고 무수정체 녹내장 환자에서 25게이지 경결막 무봉합 유리체절제술 후 시행한 섬유주절제술의 임상성적을 보고한 연구는 없었다. 이에 저자들은 유리체가 전방을 채우고 있는 위 수정체 그리고 무수정체 녹내장 환자에서 결막반흔과 염증을 최소화하면서 평면부로 접근하는 25게이지 경결막 무봉합 유리체절제술을 시행한 후, 마이토마이신C를 이용한 섬유주절제술을 순차적으로 시행하고 이에 대한 임상성적을 보고하고자 한다.
대상과 방법
본 연구는 평면부를 통한 25게이지 경결막 무봉합 유리체절제술을 시행하고 순차적으로 마이토마이신C를 이용한 섬유주절제술을 시행한 후 최소 12개월 이상 경과 관찰이 가능하였던 위수정체 그리고 무수정체 녹내장 환자를 대상으로 후향적으로 의무기록을 분석하였고, 부산대학교병원 임상시험위원회로부터 승인을 받았다(승인 번호: 2004-016-090).
수술을 시행한 모든 환자에서 수술 전 최대교정시력, 세극등현미경검사, 골드만압평안압계를 이용한 안압 측정, 중심각막두께 측정검사(PachmateⓇ; DGH Technology, Inc., Exton, PA, USA), 전방각경검사, 산동검사, 시신경과 망막신경섬유층 촬영(AFC-210; Nidek, Gamagori, Japan), 시야검사(Humphrey Field Analyzer, Swedish interactive threshold algorithm standard C24-2; Carl Zeiss Meditec, Inc., Dublin, CA, USA), 빛간섭단층촬영검사(Cirrus HD-OCT, Carl Zeiss Meditec Inc., Dublin, CA, USA), 그리고 여과포 상태에 대한 전안부 사진 촬영 등을 포함한 철저한 안과 검사를 시행하였다.
녹내장성 시신경손상은 시신경유두 함몰비 ≥0.7, 양안의 시신경유두 함몰비 차이 ≥0.2, 시신경유두테의 패임이나 얇아짐, 시신경유두 출혈, 시신경섬유 결손 중 한 가지 이상이 확인된 경우로 정의하였고, 녹내장성 시야 결손은 신뢰할 수 있는 두 번의 연속적인 시야 검사에서 Glaucoma hemifield test에서 “outside normal limit”이 나타날 때, 또는 pattern deviation plot에서 활 모양 영역에 있는 3개 이상 점의 역치가 정상의 5% 미만에서 나타나고 그중 한 점이 1% 미만일 때이거나, pattern standard deviation 5% 미만인 경우로 정의하였다[22]. 섬유주절제술은 최대약물요법으로 안압 조절에 실패하거나 최대약물치료에도 불구하고 시신경손상 혹은 시야 결손이 진행하는 경우에 시행하였다[23].
25게이지 경결막 무봉합 유리체절제술은 1명의 수술자에 의해서 시행되었다. 국소마취하에 평면부에 25게이지 케뉼라를 이용한 공막절개창을 상이측, 하이측, 상비측에 만들었다. 각막윤부에서 3.0-3.5 mm 떨어진 곳에 비스듬히 절개하는 것을 원칙으로 하였다. 유리체절제술 기구는 Constellation® Vision System (Alcon Laboratories, Inc., Fort Worth, TX, USA)이 사용되었다. 안저관찰은 비접촉광각관찰장치(Oculus BIOM®; Oculus surgical, Wetzlar, Germany) 및 RESIGHT 광각관찰 시스템(Resight® 700; Carl Zeiss, Jena, Germany)을 이용하였다. 유리체절제술을 시행 시 중심부 유리체절제 후, 주변부 유리체절제를 시행하였고, 공막누르개를 이용하여 앞쪽 유리체를 최대한 제거하였다. 필요 시에 트리암시놀론을 전방 내로 주입하여 전방 내 유리체를 가시화하고 전방을 채우고 있는 유리체를 제거하였다(Fig. 1A, B) [24].

Twenty five-gauge transconjunctival sutureless vitrectomy was performed in the left eye of pseudophakic glaucoma patient with vitreous filling the anterior chamber. (A) Remnant vitreous in the anterior chamber stained with triamcinolone was removed following total vitrectomy. (B) Subluxated intraocular lens located at ciliary sulcus with ruptured posterior capsule was noted. (C) The bleb photograph taken at 28 months after trabeculectomy showed medium height (H2), 4-clock hours extent (E3), and mild vascularity (V2) bleb. Intraocular pressure was 9 mmHg without glaucoma medication and best corrected visual acuity (Snellen) was 1.0 in the left eye at 28 months after trabeculectomy.
섬유주절제술은 1명의 수술자에 의해서 시행되었다. 국소 마취 하에 원개기저결막편을 만들기 위해 각막윤부 결막을 5-6 mm로 절개하여 결막과 테논낭을 결막낭 쪽으로 박리를 하고, 3 × 3 mm 크기, 2/3 공막두께, 사다리꼴 모양의 공막편을 만들었다. 0.4 mg/mL의 희석된 MMC를 적신 Weck-cell 스펀지를 테논낭과 공막 사이에 2-3분 동안 접촉시킨 다음 스펀지를 제거하고 약 20 mL의 평형염기용액으로 세척하였다. 내측공막절개술을 시행하고 주변 홍채를 절제한 후 미리 공막편의 뒤쪽 모서리에 설치해둔 9-0 나일론 봉합사(Ethicon Inc., Somerville, NJ, USA)로 두 군데 개봉 봉합을 시행하여 공막편을 원위치에 봉합하였다. 결막은 양쪽에서 10-0 나일론 봉합사(Ethicon Inc., Somerville, NJ, USA)를 이용하여 테논과 함께 공막에 고정봉합을 시행하였다. 전방 천자 부위를 통해 평형염기용액을 주입하여 전방을 형성시키고 공막편을 통한 방수의 유출 정도와 결막 봉합 부분을 통한 방수 누출이 있는지 확인하였다. 수술 후 Levofloxacin (CravitⓇ; Santen Pharmaceutical Co., Ltd., Osaka, Japan), Prednisolone acetate (PredbellⓇ; CKD Pharm, Co., Seoul, Korea) 점안액을 사용하였고, 안압과 여과포의 상태에 따라 안구지압과 개봉봉합사 제거를 시행하였다.
수술 후 매번 방문 시마다 안압과 최대교정시력을 측정하고, 사용하는 안압하강제 수와 합병증 발생 여부를 기록하였고, Indiana Bleb Appearance Grading Scale (IBAGS) [25]에 따라 여과포의 높이(bleb height, H)와 범위(horizontal extent, E), 혈관분포 정도(vascularity, V), 여과포 누출 정도(Seidel test, S)를 평가하여 여과포의 형태에 대해 분석하였다. 안압은 골드만압평안압계로 측정하였고, 시력은 스넬렌 시력표로 최대교정시력을 측정하고 통계적인 분석을 위하여 LogMAR 시력으로 변환하였다.
여과포의 높이 H0는 여과포의 상승 없이 평평한 경우, H1은 낮은 여과포 상승, H2는 중등도의 여과포 상승, H3는 높은 여과포 상승으로 분류되었다. 여과포의 범위는 여과포의 수평 너비를 나타내고 E0는 1시각 미만, E1은 1시각 이상 2시각 미만, E2는 2시각 이상 4시각 미만, E3는 4시각 이상인 경우로 분류하였다. 혈관분포 정도 V0는 미세낭포가 보이지 않는 무혈관 흰색(avascular white) 여과포, V1은 미세낭포가 보이는 무혈관 낭포성(avascular cystic) 여과포, V2는 경도 혈관분포, V3는 중등도 혈관분포, V4는 울혈된 혈관을 가진 과도한 혈관분포로 분류하였다. 여과포의 누출 정도는 Seidel 검사에서 여과포 표면에서 방수의 누출이 나타나는 정도에 따라 3가지로 분류하여 S0는 여과포 누출이 없는 경우, S1은 형광물질도포 후 5초 이내에 흘러나오는 방수의 누출 없이 여과포 표면의 여러 작은 지점에서 결막을 통한 누출이 보이는 경우(multiple pinpoint leak), S2는 형광물질 도포 후 5초 이내에 방수의 흐름이 보이는 누출(streaming aqueous leak)로 분류하였다.
섬유주절제술의 완전한 성공은 수술 후 안압하강제를 사용하지 않고 안압이 18 mmHg 이하이고 수술 전에 비하여 안압이 20% 이상 하강한 경우로 정의하였고, 섬유주절제술의 제한적 성공은 수술 후 안압하강제 사용 여부에 관계없이 안압이 18 mmHg 이하이고 수술 전에 비하여 안압이 20% 이상 하강한 경우로 정의하였다[5]. 수술 후 2번의 연속된 방문에서 성공 기준을 만족하지 못하는 경우와 2번의 연속된 방문에서 안압이 5 mmHg 이하인 경우, 광각인지를 못하는 경우, 안압 조절을 위해 녹내장수술이 필요한 경우를 수술 실패로 정의하였다[5]. 주사침을 이용한 여과포 복원술(bleb needling)은 수술 실패로 간주하지 않았다[26]. 저안압은 수술 후 6주 이상 경과 관찰 후 2번의 연속된 검사에서 안압이 5 mmHg 이하인 경우로 정의하였고, 지속되는 저안압은 수술 후 3개월 이상 경과 관찰 후 3번 이상의 연속적인 검사에서 안압이 5 mmHg 이하인 경우로 정의하였다[26].
수술 전후 변수 비교를 위해 Wilcoxon signed-rank test를 사용하였다. 수술 성공률 분석은 Kaplan-Meier 생존 분석을 사용하였다. 통계학적인 분석은 윈도우용 SPSS 25.0 (IBM Corp., Armonk, NY, USA)을 이용하였고, p-value가 0.05 미만일 경우를 통계적으로 유의한 것으로 간주하였다.
결 과
유리체가 전방을 채우고 있고 최대약물치료에도 안압이 조절되지 않는 위수정체 혹은 무수정체 녹내장 환자 7명 8안이 25게이지 경결막 무봉합 유리체절제술을 시행 받았다. 7명 8안의 환자 중 위수정체 녹내장은 4명 4안, 무수정체 녹내장은 3명 4안이었다.
평균 연령은 62.65 ± 14.82세, 유리체절제술 후 섬유주절제술 시행까지의 평균 간격은 83.5 ± 145.71일이었다. 섬유주절제술 후 평균 경과 관찰 기간은 2.11 ± 0.70년이었다. 유리체절제술 전 평균 안압은 33.75 ± 6.87 mmHg였고, 섬유주절제술 전 평균 안압은 28.13 ± 3.52 mmHg였다(Table 1).

Demographic and clinical characteristics of patients who had trabeculectomy following 25-gauge transconjunctival vitrectomy
위수정체 녹내장 4명 4안 모두 후낭은 파열되어 인공수정체는 섬모체고랑에 위치하고 있었고 유리체가 전방을 채우고 있었다(Fig. 1C). 이 중 3명 3안은 투명각막절개를 통한 초음파수정체유화술을 시행 받았고, 1명 1안은 상측결막절개가 포함된 수정체 낭외적출술을 시행받았다. 유리체가 전방을 채우고 있는 무수정체 녹내장 3명 4안 중 2명 3안은 선천성 백내장으로 수정체 낭내적출술을 시행받았고, 이전의 수술 기록지를 통하여 수술 과정에서 상측 결막절개가 시행되었음을 확인하였다. 나머지 1명 1안은 고도 근시안으로 결막절개가 포함된 수정체 낭내적출술을 시행받았음을 확인하였다.
섬유주절제술 전 평균 안압은 28.13 ± 3.52 mmHg에서 수술 후 마지막 방문 시 15.00 ± 3.70 mmHg로 유의하게 감소하였다(p=0.012). 섬유주절제술 전 사용한 평균 안압하강제 수는 4 ± 0개에서 수술 후 마지막 방문 시 1.50 ± 2.07개로 유의하게 감소하였다(p=0.010). 섬유주절제술 전 평균 최대교정시력(LogMAR)은 0.55 ± 0.51에서 수술 후 마지막 방문 시 0.48 ± 0.54였다(p=0.157). 섬유주절제술 전 시야검사의 mean deviation은 -18.07 ± 9.35 dB에서 수술 후 마지막 방문 시 -18.30 ± 10.57 dB이었다(p=0.944). 섬유주절제술 전 시야검사의 Visual Field Index는 50.00 ± 36.84%에서 수술 후 마지막 방문 시 47.25 ± 38.31%였다(p=0.612). 섬유주절제술 전 빛간섭단층촬영검사로 측정한 평균 황반부 신경절세포/내망상층 두께는 64.00 ± 17.54 µm에서 수술 후 마지막 방문 시 67.00 ± 22.67 µm였다(p=0.574). 섬유주절제술 전 빛간섭단층촬영검사로 측정한 평균 시신경주위 망막신경섬유층 두께는 72.00 ± 21.51 µm에서 수술 후 마지막 방문 시 64.00 ± 11.82 µm였다(p=0.483) (Table 2). 유리체절제술 전 측정 안압과 섬유주절제술 전 측정 안압은 통계적으로 유의한 차이가 없었으나(p=0.058), 섬유주절제술 후 1, 3, 6, 9, 12개월에 측정한 안압 모두 섬유주절제술 전 안압에 비해 유의하게 감소하였다(모두 p=0.012) (Fig. 2).

Pre- and post-trabeculectomy comparison of intraocular pressure, number of medications, visual acuity, visual field parameter, and optical coherence tomography parameters
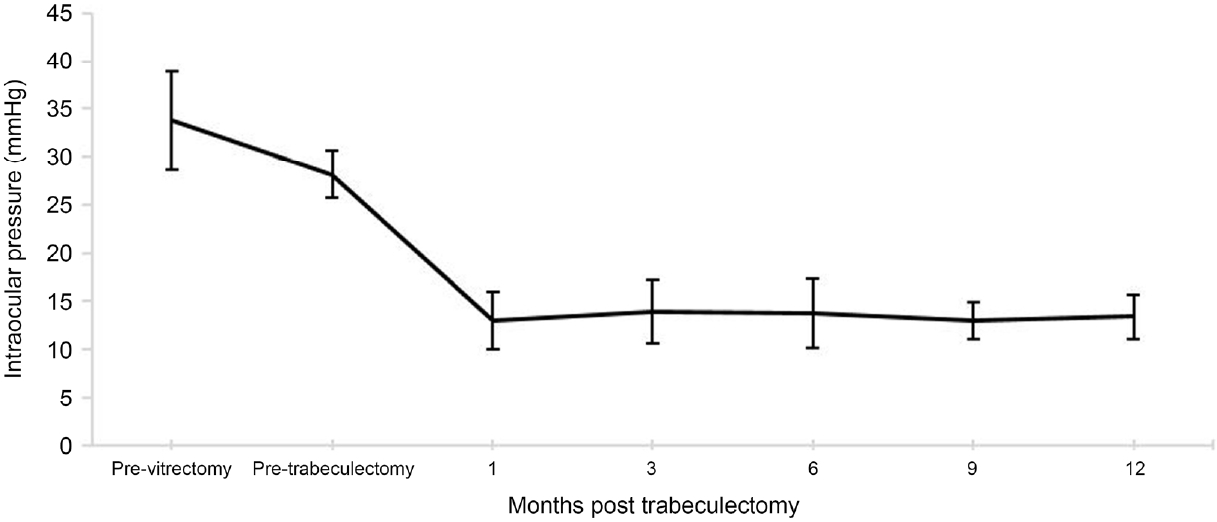
Changes in mean intraocular pressure (IOP) after trabeculectomy with Mitomycin C following 25-gauge transconjunctival sutureless vitrectomy. IOP was not significantly different between pre-vitrectomy and pre-trabeculectomy (p = 0.058; Wilcoxon Signed Rank Test). IOP decreased significantly after trabeculectomy during the entire follow-up period (all ps = 0.012, Wilcoxon Signed Rank Test). The error bars represent 95% confidence intervals (mean ± standard error × 1.96).
Kaplan-Meier 생존 분석 결과 섬유주절제술 1년 후 완전 수술 성공률은 62.5%였고(Fig. 3A), 섬유주절제술 1년 후 제한적 수술 성공률은 87.5%였다(Fig. 3B). 인공수정체 유무에 따라 완전 수술 성공률을 분석한 결과 위수정체 녹내장군은 100%였으나, 무수정체 녹내장군은 25%였다.

Cumulative probabilities of qualified surgical success (A) and complete surgical success (B) after trabeculectomy with mitomycin C. Cumulative probabilities of qualified surgical success were 87.5% and cumulative probabilities of complete surgical success were 62.5% at 12 months after trabeculectomy.
주사침을 이용한 여과포 복원술 시행 횟수는 위수정체 녹내장군 1안에서 1회, 무수정체 녹내장군 3안에서 5회로 시행하였다. 위수정체 녹내장 1안에서 섬유주절제술 6주 이후 저안압 교정 위해 경결막 공막편 봉합술을 1회 시행하였고, 무수정체 녹내장군에서 저안압 교정을 위한 경결막 공막편 봉합술을 시행한 경우는 없었다. 모든 증례에서 전체 경과 관찰 기간 동안 망막박리, 유리체출혈, 전방출혈, 맥락막상강출혈, 낭성황반부종, 여과포 관련 감염, 유리체 감돈으로 인한 누공 막힘은 발생하지 않았다(Fig. 4).
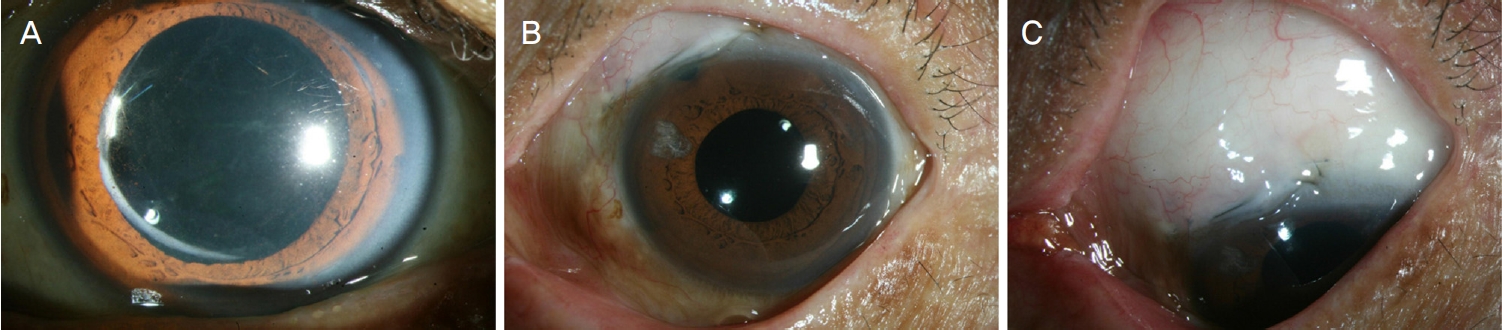
Anterior photograph before vitrectomy and bleb photograph after trabeculectomy. (A) Anterior photograph of the left eye with pseudophakic glaucoma taken before vitrectomy showed vitreous filling the anterior chamber and intraocular pressure was 35 mmHg. Trabeculectomy was performed 4 weeks after 25-gauge transconjunctival sutureless vitrectomy. The anterior photograph (B) and bleb photograph (C) were taken at 18 months after trabeculectomy. Bleb photograph showed medium height (H2), 4-clock hours extent (E3), and mild vascularity (V2) bleb in the left eye (C). Intraocular pressure was 11 mmHg without glaucoma medication and best corrected visual acuity (Snellen) was 1.0 at 18 months after trabeculectomy.
섬유주절제술 후 여과포의 형태를 IBAGS에 따라 분류하여 위수정체 녹내장군과 무수정체 녹내장군을 비교 분석하였다. 전체 증례를 대상으로 여과포의 높이는 37.5%에서 H1, 50%에서 H2, 12.5%에서 H3 소견을 보였다. 여과포의 범위는 37.5%에서 E1, 50%에서 E2, 12.5%에서 E3 소견을 보였다. 혈관분포 정도는 12.5%에서 V0, 50%에서 V2, 37.5%에서 V3 소견을 보였다. 무혈관 여과포로 분류되는 V0가 위수정체 녹내장군에서는 발생하지 않았으나, 무수정체 녹내장 1안에서 발생하였다(Table 3).
고 찰
본 연구에서 유리체가 전방을 채우고 있는 위수정체와 무수정체 녹내장안에서 유리체절제술 후 순차적으로 시행한 섬유주절제술의 임상성적을 분석하였다. 섬유주절제술 후 술 전에 비해 마지막 방문 시 안압은 유의하게 감소하였다. 수술 전, 수술 후 1, 3, 6, 9, 12개월의 모든 시점에서 안압은 유의하게 감소하였다. 섬유주절제술 12개월 후 제한적 수술 성공률은 87.5%였고, 완전 수술 성공률은 62.5%였다. 섬유주절제술 후 홍채절개부를 통한 유리체 탈출과 이로 인한 누공의 막힘, 여과포 감염, 안내염, 전방출혈, 맥락막상강출혈, 망막박리, 낭성황반부종, 유리체출혈과 같은 합병증은 모든 안에서 발생하지 않았다.
성공률 측면에서 본 연구의 결과는 위수정체와 무수정체 녹내장 환자에서 섬유주절제술의 성적을 보고한 이전 연구 결과와 유사하거나 우수하였다. Bellows와 Johnstone은 무수정체 녹내장 21안에서 섬유주절제술을 시행하고 26개월의 평균 관찰 기간 동안 안압 21 mmHg 이하를 기준으로하여 62%의 제한적 수술 성공률과 24%의 완전 수술 성공률을 보고하였다[3]. Heuer et al [4]은 무수정체 녹내장 82안에서 섬유주절제술을 시행하고 안압 21 mmHg 이하를 기준으로 하여 39%의 제한적 수술 성공률과 16%의 완전 수술 성공률을 보고하였다. Gross et al [2]은 무수정체 녹내장 10안과 위수정체 녹내장 5안에서 섬유주절제술을 시행하고 안압하강이 30% 이상이고 안압 21 mmHg 이하를 기준으로하여 26.7%의 제한적 수술 성공률과 13%의 완전 수술 성공률을 보고하였다.
무수정체 녹내장과 위수정체 녹내장 환자에서 5-fluorouracil이나 마이토마이신C를 이용한 섬유주절제술의 성적을 보고한 이전 연구와도 유사하였다. Heuer et al [4]은 무수정체 녹내장 48안에서 섬유주절제술과 결막하 5-fluorouracil 주사를 시행하고 안압하강제를 사용하면서 안압 21 mmHg 이하를 기준으로 하여, 68%의 수술 성공률을 보고하였다. Takihara et al [7]은 원발개방각녹내장 또는 거짓비늘녹내장 환자들을 대상으로 상측 결막절개를 포함한 초음파수정체유화술을 시행한 51안과 수정체안 175안에서 마이토마이신C를 이용한 섬유주절제술을 시행하고 안압이 18 mmHg 이하를 기준으로 하여, 3년 성공률을 각각 63.7%와 81.3%로 보고하여 초음파수정체유화술이 섬유주절제술 실패의 위험인자로 분석하였다.
위수정체 녹내장과 무수정체 녹내장 환자에서 시행한 섬유주절제술이 백내장적출술을 시행 받지 않은 개방각녹내장 환자들보다 성공률이 낮은 한 가지 이유는, 결막절개가 포함된 낭내적출술, 낭외적출술, 그리고 수정체유화술을 시행 받았기 때문인 것으로 생각된다[1,7-9]. Broadway et al [9]은 평균 5.9년의 경과 관찰 결과, 결막절개를 받은 적이 있는 환자들에서 시행한 섬유주절제술의 성공률은 결막절개를 받은 적이 없는 대조군에 비해 낮다고 보고하였다. 결막절개수술을 받은 적이 있는 환자들의 섬유주절제술 중에 임상적으로 뚜렷한 결막반흔이 있는 부위에서 떨어진 위치에서 채취한 결막 생검 조직에서, 대조군에 비해 섬유아세포, 대식세포, 림프구가 유의하게 더 많이 발견되었고, 섬유주절제술의 실패는 수술 중 채취한 결막 생검 조직에서 섬유아세포 수의 증가와 관련이 있음을 보고하였다. 이와는 반대로 Supawavej et al [27]은 결막절개 없이 투명각막절개를 통해 수정체유화술을 시행한 39안과 수정체안 39안에서 마이토마이신C를 이용한 섬유주절제술을 시행하고 안압하강제 사용에 관계없이 안압이 18 mmHg 이하이고 20% 이상 감소한 경우를 수술 성공으로 정의하여, 1년 성공률이 각각 90%, 83%로 두 군 사이에 유의한 차이가 없었다고 보고하였고, 그 원인으로 투명각막절개 방식은 결막, 테논낭, 공막의 절개를 포함하는 공막터널 방식이나 낭외적출술보다 조직 손상과 염증 유발이 더 적기 때문으로 유추하였다. 그러나, 수정체유화술을 받은 환자들을 대상으로 마이토마이신C를 이용한 섬유주절제술을 시행한 이전 연구들은 무수정체안이나 전방에 유리체가 있는 환자는 분석에서 제외하였고, 본 연구는 유리체가 전방을 채우고 있는 위수정체 그리고 무수정체 녹내장 환자들을 대상으로 하였으므로 본 연구의 결과와 직접적인 비교 해석은 어려움이 있다.
위수정체 그리고 무수정체 녹내장안에서 섬유주절제술의 불량한 성적에 대한 또 다른 원인은 이전의 안과적 수술 이후 혈액-방수 장벽의 급격한 변화로 인하여 방수의 성상이 변화하는 것으로 설명된다[28]. Radius et al [29]은 원숭이에서 녹내장 여과 수술 전과 후에 방수를 채취하여 조직배양한 결과 수술 전 방수에서는 결막하 섬유아세포 증식이 억제되었으나 수술 후 방수에서는 촉진되었다고 보고하였고, Addicks et al [30]은 안과적 수술 이후 혈액-방수 장벽의 변화로 인하여 혈장 단백 성분이 방수 내로 분비되어 섬유아세포의 증식을 촉진한다고 보고하였다. 특히, 후낭이 존재하지 않거나 손상되어 있는 무수정체안과 위수정체안에서 섬유주절제술의 성적은 후낭이 손상받지 않고 존재하는 안보다 불량하다고 보고되었고, 이는 방수로 섬유아세포 증식의 촉진제를 분비하는 생화학적 저장소인 유리체와 관련이 있다고 추정하였다[8,12]. 또한, 후낭이 존재하지 않거나 손상되어 있는 무수정체안과 위수정체안에서 유리체는 전방으로 이동하고 섬유주절제술 후 누공을 막음으로써 방수유출 경로를 저해할 수 있다[1,11,15].
본 연구에서는 유리체가 전방을 채운 위수정체와 무수정체 녹내장 환자에서 25게이지 경결막 무봉합 유리체절제술을 시행하고 순차적으로 마이토마이신C를 이용한 섬유주절제술을 시행하여 87.5%의 제한적 수술 성공률과 62.5%의 완전 수술 성공률을 확인하였고, 섬유주절제술 후 유리체에 의한 누공의 막힘은 관찰되지 않았다. 이와 같은 결과는 유리체가 전방을 채운 위수정체 녹내장과 무수정체 녹내장 환자에서 앞유리체절제술과 섬유주절제술을 동시에 시행한 이전 연구들과 유사하다[11,12]. Melamed et al [11]은 유리체가 전방을 채우고 있는 위수정체 녹내장 9안(전방 인공수정체 5안, 후방 인공수정체 4안)과 무수정체 녹내장 6안에서 섬유주절제술 후 유리체에 의한 누공 막힘을 예방하기 위해 앞유리체절제술과 섬유주절제술을 동시에 시행하고, 80%의 제한적 수술 성공률과 60%의 완전 수술 성공률을 보고하였다. 술 후 세극등검사에서 모든 안에서 누공을 막는 전방내 유리체는 관찰되지 않았으나, 1안에서 유리체 출혈, 2안에서 낭성황반부종, 2안에서 저안압과 동반된 맥락막박리, 1안에서 만성 포도막염이 발생하였다고 보고하였다. Herschler [12]는 41명의 무수정체 녹내장 환자에서 섬유주절제술 전에 유리체절제술을 시행하거나 섬유주절제술과 동시에 유리체절제술을 시행하고 78%의 제한적 수술 성공률을 보고하였고, 유리체절제술 없이 시행한 섬유주절제술보다 성적이 우수한 이유에 대하여 유리체절제술을 시행함으로 방수로 섬유아세포 성장 촉진제를 내보내는 유리체를 제거하였기 때문으로 유추하였다. 그러나, 2안에서 낭성황반부종, 2안에서 열공망막박리, 1안에서 시력소실을 야기한 맥락막박리가 발생하였다고 보고하였다.
본 연구에서는 이전 연구들과 다르게 망막박리, 낭성황반부종, 지속된 저안압과 맥락막박리, 유리체출혈 등의 심각한 수술 후 합병증은 발생하지 않았다. 그 이유로 이전 연구들에서 시행한 각막윤부절개나 내측공막절개를 통한 앞유리체절제술 대신 결막을 절개하지 않고 평면부로 접근하는 25게이지 경결막 무봉합 유리체절제술을 시행하였기 때문으로 생각된다[16,18,19].
각막윤부절개나 내측공막절개를 통한 앞유리체절제술은 유리체절제기가 유리체를 앞으로 당겨 유리체가 계속하여 전방으로 탈출할 수 있고, 수정체소대 해리가 있는 위수정체 녹내장안에서는 해리된 수정체소대 주변으로 유리체가 전방으로 나올 수 있으며, 전방으로 유리체가 당겨지면서 유리체망막견인으로 인한 망막박리가 발생할 수 있다[16]. 이에 반해, 본 연구에서 시행한 25게이지 경결막 무봉합 유리체절제술은 앞유리체절제술에 비해 효과적이고 안전하게 전방내 유리체를 제거하고, 수술로 인한 외상성 결막반흔이 최소화되는 장점이 있어 순차적으로 시행한 섬유주절제술의 결과에 부정적인 영향을 미치지 않는 것으로 생각된다[16,19-21].
Park et al [20]은 23게이지 경결막 무봉합 유리체절제술 후 발생한 신생혈관녹내장 12명 12안과 대조군 15명 15안에서 유리체강내 베바시주맙주입술 후 마이토마이신C를 이용한 섬유주절제술을 시행하여 경결막 무봉합 유리체절제술군과 대조군의 수술 후 12개월 성공률은 각각 82.5%, 73.3%였고, 두 군 간 성공률의 차이는 없었음을 보고하였다.
본 연구에서 위수정체 녹내장안과 무수정체 녹내장안의 완전 수술 성공률을 비교한 결과, 위수정체 녹내장안은 100%, 무수정체 녹내장안은 25%로 무수정체 녹내장안의 완전 수술 성공률이 더 낮은 경향을 보였다. 그 이유로 무수정체 녹내장안이 위수정체 녹내장안에 비해 이전에 결막절개가 포함된 수술을 받은 경우가 더 많았고(무수정체 녹내장 4안, 위수정체 녹내장 1안), 평균 연령이 더 낮았기 때문에(위수정체 녹내장안 74.5 ± 5.5세, 무수정체 녹내장안 50.8 ± 10.2세), 섬유주절제술 후 섬유아세포의 증식과 관련된 창상치유가 더 활발하였을 것으로 생각된다[1,2,4,7-10].
본 연구의 제한점으로는 섬유주절제술 후의 최소 경과 관찰 기간이 12개월로 비교적 짧고, 분석에 포함된 유리체가 전방을 채우고 있는 위수정체와 무수정체 녹내장 환자 수가 적다는 점을 들 수 있다. 또한, 위수정체와 무수정체 각 군의 증례 수가 적어 서로 간의 수술 성적 차이를 직접적으로 비교하기 어려울 것으로 생각되었다. 유리체가 전방을 채우고 있는 환자 중에서 섬유주절제술이 필요한 경우가 흔하지 않아 본 연구에 포함된 대상 환자 수가 적으므로 결과의 해석에 있어 성급한 일반화 오류의 가능성을 고려해야 할 것으로 생각된다. 향후 더 많은 환자들을 대상으로 수 년 이상 장기적인 경과 관찰을 통해 임상 성적을 평가하는 연구가 필요할 것으로 생각된다. 결론적으로 본 연구를 통해 유리체가 전방을 채우고 있는 위수정체 그리고 무수정체 녹내장 환자에서 경결막 무봉합 유리체절제술 후 시행한 섬유주절제술은 안전하고 효과적으로 안압을 감소시킬 수 있음을 알 수 있었다.
Notes
This work was supported by clinical research grant from Pusan National University Hospital in 2020.
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
정우현 / Woohyun Chung
부산대학교 의과대학 안과학교실
Department of Ophthalmology, Pusan National University College of Medicine

