급성후유리체박리 이후 망막전막의 발생률 및 위험인자
Incidence and Risk Factors of Epiretinal Membrane Following Acute Posterior Vitreous Detachment
Article information
Abstract
목적
급성후유리체박리 이후 망막전막의 발생률을 알아보고, 위험인자를 분석하고자 하였다.
대상과 방법
2013년 2월부터 2019년 2월까지 비문증 또는 광시증으로 내원하여 후유리체박리를 진단받은 환자의 의무기록을 조사하였다. 증상 발현 이후 1달 이내 진단받은 환자를 연구에 포함하였다. 망막전막은 안저사진을 이용하여 진단하였다. 증상 발현 후 1-3개월, 3-6개월, 6-12개월 사이로 기간을 나누어 발생률을 조사하였으며, 또한 Kaplan-Meier 분석을 통해 망막전막의 누적발생률을 구하였다. 망막전막 발생과 각 변수들과의 관련성을 로지스틱 회귀분석을 이용하여 분석하였다.
결과
154안이 연구에 포함되었다. 평균 연령은 56.6 ± 8.0세였다. 1-3개월 사이에는 144안 중 3안(2.1%), 3-6개월 사이에는 56안 중 11안(19.6%), 6-12개월 사이에는 63안 중 15안(23.8%)에서 망막전막이 진단되었다. 후유리체박리 증상 발현 후 12개월 동안에 망막전막의 누적발생률은 35.3%였다. 다변량 로지스틱 회귀분석에서 반대안에서 망막전막이 관찰된 경우(교차비 11.9, 95% 신뢰구간 1.4-100.1)가 망막전막 발생과 유의하게 관련되었다.
결론
후유리체박리 이후 망막전막의 발생은 비교적 흔하였다. 후유리체박리 환자는 증상 발현 이후 6개월 이상 장기적인 추적 관찰이 필요하다.
Trans Abstract
Purpose
To investigate the incidence and risk factors of epiretinal membrane (ERM) after acute posterior vitreous detachment (PVD).
Methods
We reviewed the medical records of patients diagnosed with PVD between February 2013 and February 2019. Patients with symptom onset (new floaters or photopsia) within 1 month at the time of diagnosis were included in the study. The ERM was diagnosed using fundus photographs. The incidence rate was investigated in each of the three periods: 1-3, 3-6, and 6-12 months after symptom onset. The cumulative incidence rate of ERM was calculated using Kaplan-Meier analysis. Data were analyzed using logistic regression to determine the association between ERM development and various factors.
Results
The study included 154 eyes. The mean age was 56.6 ± 8.0 years. ERM was observed in three of 144 eyes (2.1%) between 1 month and 3 months, in 11 of 56 eyes (19.6%) between 3 and 6 months, and in 15 of 63 eyes (23.8%) between 6 and 12 months from symptom onset. The cumulative incidence rate of ERM was 35.3% over the 12 months following the onset of PVD symptoms. In a multivariate logistic regression analysis, the fellow eye with ERM (odds ratio 11.9, 95% confidence interval 1.4-100.1) was significantly associated with ERM development.
Conclusions
ERM development was relatively common after PVD. Long-term follow-up of 6 months or more should be required after the onset of symptoms.
망막전막(epiretinal membrane)은 주로 황반부의 망막표면에 무혈관성의 반투명 막조직이 형성되는 질환으로 50세 이상에서 흔하고 연령 증가에 따라 빈도가 늘어나는 것으로 알려져 있다[1-4]. 망막전막의 유병률은 40세 이상에서 2.2-12.1%이며[3,5-8], 국내에서는 2.18-2.9%로 알려져 있다[9,10]. 망막전막은 막이 얇거나 막의 위치가 황반중심을 벗어나 있는 경우는 대부분 증상이 없으나, 진행하면 망막의 주름 및 견인, 황반부종 등을 일으켜 시력저하 및 변형시 등의 증상을 유발한다[1,5,7]. 망막전막은 유리체절제술을 통해 제거될 수 있는데, 술 전 시력이 좋은 경우와 망막전막 발생기간이 짧은 경우, 빛간섭단층촬영에서 시세포층의 손상이 적은 경우가 술 후 시력예후가 좋다고 알려져 있으며[11-16], 따라서 조기수술이 주장되기도 한다[17].
후유리체박리(posterior vitreous detachment)는 망막전막의 발생에 크게 관여하며, 임상적으로 유의한 망막전막의 90%에서 후유리체박리가 동반된다[17]. 후유리체박리 과정에서 발생한 망막내경계막의 결손 부위를 통해 망막표면으로 이주한 망막유래의 아교세포가 증식하거나[18-22], 후유리체박리 이후 망막표면에 남겨진 유리체피질에 존재하는 유리체세포의 증식과 섬유성 화생으로 막이 형성된다고 생각되고 있다[20,21,23]. 후유리체박리 과정에서 망막열공이 발생할 수 있는데, 망막열공을 통해 망막색소상피세포가 유리체강내로 나와 망막표면에서 막 형성에 역할을 할 수도 있다[22].
후유리체박리는 유리체변성의 결과로 발생되며, 그 유병률이 50대에서는 24%, 80대에는 87%까지 증가하는 매우 흔한 생리적인 과정이다[24,25]. 본 연구에서는 급성후유리체박리 이후 망막전막의 발생률을 알아보고, 그 위험인자를 분석하였다. 또한 후유리체박리 이후 망막전막으로 수술받은 환자들의 수술 결과를 확인하였다.
대상과 방법
본 연구는 헬싱키선언을 준수하였으며, 동국대학교 일산병원 의학연구 윤리심의위원회(Institutional Review Board, IRB)의 승인을 얻은 후에 진행되었다(IRB 승인 번호: 201911012). 2013년 2월부터 2019년 2월까지 후유리체박리를 진단받은 환자의 명단을 본원 환자 데이터베이스에서 얻고, 이 환자들의 의무기록을 후향적으로 조사하였다. 비문증 또는 광시증을 호소하여 내원한 환자는 안저사진과 안저검사, 빛간섭단층촬영검사(spectral-domain optical coherence tomography)를 시행하였다. 후유리체박리는 안저사진 또는 안저검사에서 Weiss 고리가 관찰되거나 빛간섭단층촬영검사에서 후극부와 시신경유두 가장자리에 유리체피질의 반사가 관찰되지 않는 경우에 진단하였다(Fig. 1)[26,27]. 빛간섭단층촬영기기는 Cirrus™ HD-OCT (Model 4000 or 5000; Carl Zeiss Meditec, Dublin, CA, USA)를 사용하였으며, high-definition 5-line raster scan 모드를 이용하여 후극부와 시신경 유두에서 각각 수직, 수평의 사진영상을 얻었고, 이를 이용하여 유리체피질의 상태를 확인하였다. 망막열공이 동반된 모든 경우와 일부 주변부 망막변성에는 망막광응고술을 시행하였다. 환자들은 추적 관찰을 권유받았고, 외래 방문하면 안저촬영검사를 모두 시행하였다. 망막전막이 관찰되는 경우에는 빛간섭단층촬영검사에서 황반중심에 변형이 생기거나, 시력저하 또는 변형시를 호소하면 망막전막제거술을 권하였고, 그렇지 않으면 추적 관찰을 하였다.
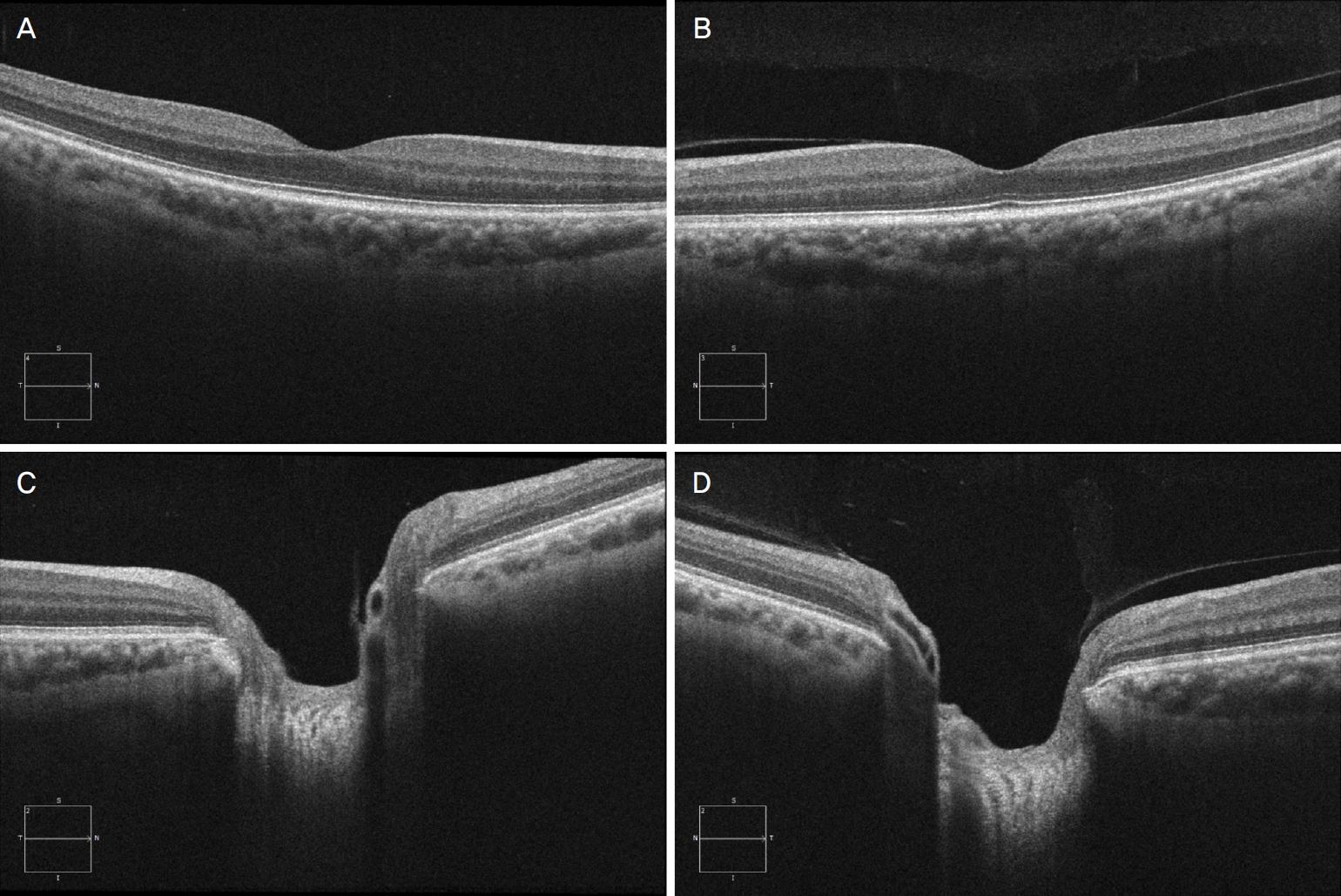
Optical coherence tomography images of a patient with acute posterior vitreous detachment of the right eye. Whereas the reflective line of the vitreous cortex is attached to the macular surface (B) and the optic disc margin (D) in the left eye, the reflective line is absent in the right eye (A, C).
비문증 또는 광시증의 증상이 발현되고 1개월 이내 후유리체박리를 진단받은 환자들을 본 연구에 포함하였으며, 진단 당시에 모두 시행한 빛간섭단층촬영검사에서 이미 망막전막이 동반되어 있거나, 경과 사이에 눈 수술 병력이 있는 경우, 당뇨망막병증, 고혈압망막병증, 망막정맥폐쇄, 중심장액맥락망막병증, 나이관련황반변성 등이 동반된 환자와 포도막염 병력이 있는 환자는 연구에서 제외하였다.
진단 당시에 망막열공 동반 유무, 유리체출혈 유무, Weiss 고리 관찰 유무, 빛간섭단층촬영검사에서 반대안의 망막전막 유무, 망막광응고술 여부 등을 확인하였고, 환자의 성별, 연령, 눈의 방향, 굴절교정술 또는 백내장수술력, 당뇨 동반여부, 구면대응치 등을 조사하였다. 망막전막이 발생한 환자의 경우는 유리체절제술 시행 여부, 수술 시기, 수술 방법, 수술 전후의 최대교정시력 등을 추가 조사하였다.
안저사진은 VX-10 (Kowa, Nagoya, Japan)와 Optos California (Optos PLC, Dunfermline, UK)를 이용하였다. 망막전막은 안저사진에서 반투명막, 혈관비틀림, 방사상 망막주름 등이 관찰될 때 진단하였다[3,28]. 안저사진의 분석은 두 명의 연구자(J. H .O, S. J. L)에 의해서 독립적으로 이루어졌다. 증상 발현 이후 1개월에서 3개월 사이와 3개월에서 6개월 사이, 6개월에서 12개월 사이로 기간을 셋으로 나누어서 망막전막의 발생 여부를 조사하였다. 또한 Kaplan-Meier 분석을 통해 12개월 동안 누적발생률을 구하였다.
망막전막 발생과 관련된 인자들을 확인하기 위해, 망막전막 발생군과 비발생군으로 나누었다. 한 번의 추적 기간이라도 망막전막이 관찰된 환자를 망막전막 발생군에, 6개월에서 12개월 사이에 시행한 안저사진에서 망막전막이 관찰되지 않은 환자를 망막전막 비발생군에 포함하였다. 통계적 분석은 SPSS 프로그램(version 21.0, IBM Corp., Armonk, NY, USA)을 이용하였으며, 두 그룹 간의 비교에서 연속변수는 t-test, 범주변수는 chi-square 검정 또는 Fisher의 정확한 검정을 사용하였다. 그리고 로지스틱 회귀분석을 통해 망막전막 발생에 대한 각 변수들의 교차비(odds ratio)와 95% 신뢰구간(confidence interval)을 구하였다. p-value가 0.05 미만인 경우에 통계적으로 유의한 것으로 간주하였다.
결 과
2013년 2월부터 2019년 2월까지 총 263안(258명)이 비문증 또는 광시증이 발생한 지 4주 이내에 내원하여 후유리체박리를 진단받았다. 당뇨망막병증(4안), 고혈압망막병증(1안), 망막분지정맥폐쇄(2안), 중심장액맥락망막병증(2안), 나이관련황반변성(1안)을 동반하거나 포도막염 병력(2안)이 있는 총 12안과 열공망막박리가 동반되어 수술을 받은 3안, 진단 당시 이미 망막전막이 확인된 7안은 연구에서 제외하였다. 87안은 진단 이후 12개월 이내에 경과 관찰을 받지 않았다. 진단 당시에 시행한 빛간섭단층촬영의 신호 강도가 6/10 미만인 경우는 없었다.
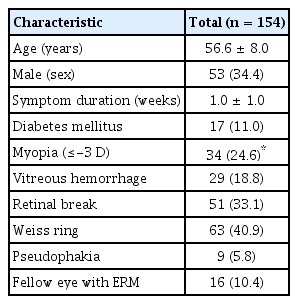
총 154안(152명)이 연구에 포함되었으며 환자들의 특성은 Table 1과 같다. 남성은 53안(34.4%), 여성은 101안(65.6%)이었으며, 진단 당시 평균 연령은 56.6 ± 8.0세(33-78)였다. 우안은 66안(42.9%)이었고, 좌안은 88안(57.1%)이었다. 환자들은 증상이 발현되고 평균 1.0 ± 1.0주 경과하였을 때 진단을 받았으며, 9안(5.8%)이 인공수정체안이었다. 16안(10.4%)에서 진단 당시 반대안에 망막전막 소견이 보였으며 29안(18.8%)에서는 유리체출혈 소견이 관찰되었다. 51안(33.1%)에서는 초진 당시에 망막열공이 동반되어 망막광응고술을 받았으며, 1안은 격자변성으로 망막광응고술을 받았다.
안저사진의 분석의 결과는 두 명의 연구자가 모두 일치하였다. 증상 발현 후 1-3개월 사이에 총 144안이 안저사진촬영을 시행하였으며, 3안(2.1%)에서 망막전막이 발생하였다. 3-6개월 사이에는 총 56안이 안저사진 촬영을 시행하였으며, 11안(19.6%)에서 망막전막이 발생하였다. 11안 중 1안은 1-3개월 사이의 검사에서도 망막전막이 관찰되었다. 나머지 10안은 모두 1-3개월 사이에 안저사진을 촬영하였으나 당시에는 망막전막 소견이 보이지 않았다. 6-12개월 사이에는 총 63안이 안저사진 촬영을 시행하였으며, 15안(23.8%)에서 망막전막이 확인되었다. 망막전막이 확인된 15안 중에서 7안은 3-6개월 사이에 시행한 검사에서도 망막전막이 관찰되었으며, 1안은 1-3개월 사이에 시행한 검사에서도 망막전막이 관찰되었다. 그리고 망막전막이 확인된 15안 중에서 8안은 1-3개월 사이와 3-6개월 사이에 시행한 검사에서 망막전막이 관찰되지 않았다(Fig. 2). 망막전막은 154안 중에서 20안(13.0%)에서 12개월 동안 누적하여 확인되었으며, Kaplan-Meier 분석 결과 증상 발현 후 12개월까지 망막전막의 누적발생률은 35.3%였다(Fig. 3). 격자변성으로 망막광응고술을 받은 1안은 6-12개월 사이의 안저사진에서 망막전막이 관찰되지 않았다.
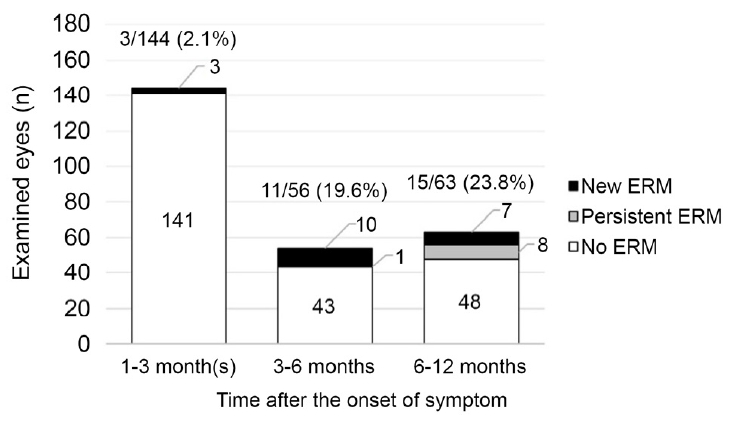
Incidence of epiretinal membrane (ERM) after acute posterior vitreous detachment. The incidence was reached to 23.8% between 6 and 12 months since the onset of symptom.
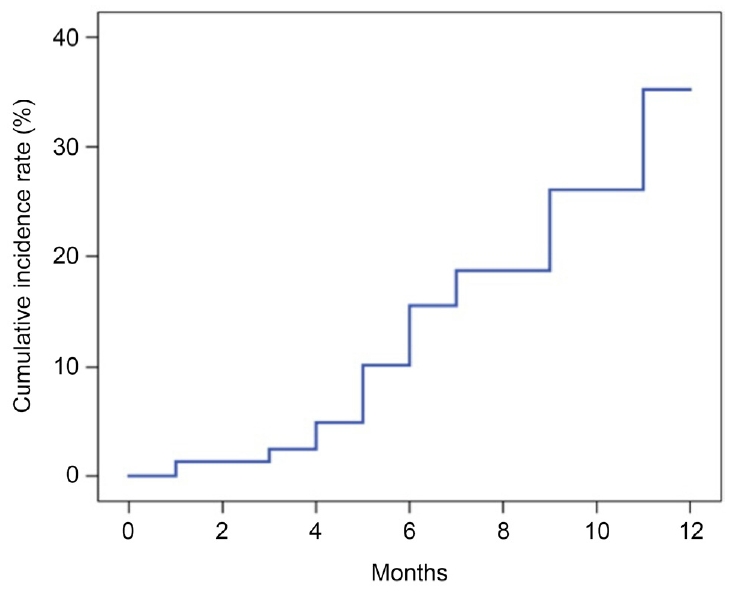
Kaplan-Meier curve for the cumulative incidence of epiretinal membrane after acute posterior vitreous detachment. The cumulative incidence of epiretinal membrane up to 12 months after the onset of symptoms was 35.3%.
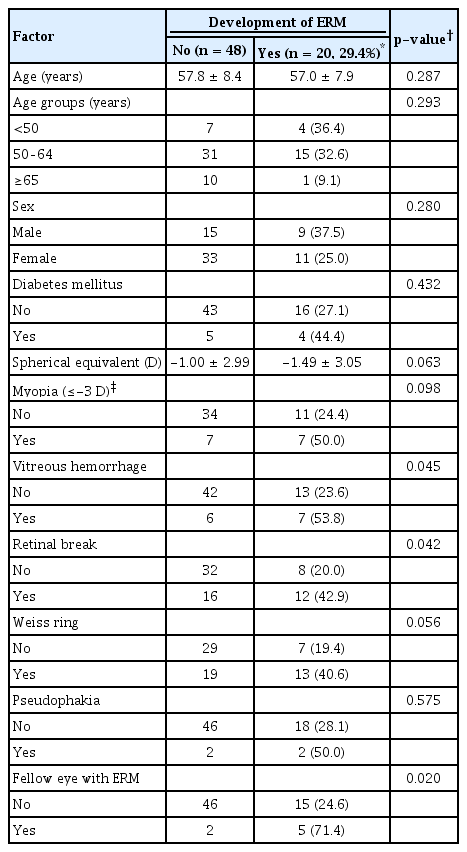
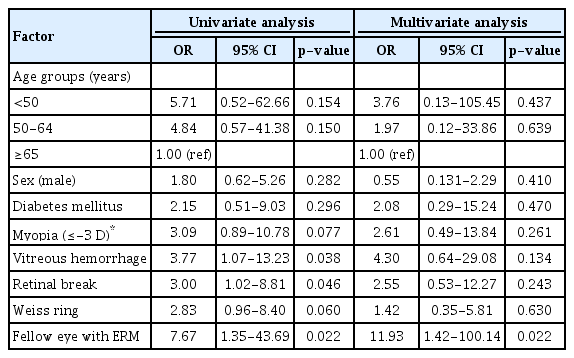
증상 발현 후 6-12개월 사이의 검사에서 48안은 망막전막이 관찰되지 않았고(망막전막 비발생군), 모든 기간에서 20안에서 망막전막이 관찰되었다(망막전막 발생군). Table 2에서는 두 그룹의 특성을 비교하였다. 후유리체박리 진단당시에 유리체출혈이 동반된 경우에 53.8%에서 망막전막이 확인되었으며, 동반되지 않은 경우(23.6%)보다 유의하게 높았다(p=0.045). 그리고 망막열공이 동반된 경우에 42.9%에서 망막전막이 확인되었으며, 동반되지 않은 경우(20.0%)보다 유의하게 높았다(p=0.042). 또한 반대안에 망막전막이 동반되어 있는 경우에 71.4%에서 망막전막이 발생하였으며, 동반되지 않은 경우(24.6%)보다 유의하게 높았다(p=0.020). 다변량 로지스틱 회귀분석에서 반대안 망막전막(교차비 11.9, 95% 신뢰구간 1.4-100.1)이 망막전막 발생과 유의하게 관련되었다(Table 3).
망막전막이 관찰된 20안 중에서 5안이 증상 발현 후 평균 16.8 ± 9.2개월에 유리체절제술 및 망막전막제거술을 받았다. 모두 망막내경계막제거술과 백내장수술을 함께 시행받았다. 술 전 빛간섭단층촬영검사에서 시세포층의 내절과 외절은 모두 정상 소견을 보였으며, 술 후 평균 3.6 ± 2.9개월에서 측정한 최대교정시력은 모두 20/20이었다.
고 찰
본 연구에서는 후유리체박리를 진단받은 환자에서 망막전막의 발생률을 알아보았다. 기간을 나누어 발생률을 조사하였고, 증상 발현 후 1-3개월 사이에는 2.1%, 3-6개월 사이에는 19.6%, 6-12개월 사이에는 23.8%로 추적 관찰 기간이 길어질수록 점점 증가하는 양상이 확인되었다(Fig. 2). 또한 6개월 이전에는 망막전막이 없던 8안에서 6개월에서 12개월 사이에 망막전막이 새롭게 발생하는 것도 확인하였다. 이러한 결과들은 후유리체박리 환자를 오랜 기간 동안 추적 관찰해야 함을 시사한다. 본 후향적 연구에서는 총 154안을 조사하였는데, 이 중에서 86안(55.8%)은 6개월과 12개월 사이에 추적 관찰을 받지 않았기 때문에 망막전막 발생 여부에 대한 장기적인 결과를 확인할 수 없었다.
기존에는 안저검사 또는 안저사진에서 Weiss 고리가 관찰되는 경우 완전한 후유리체박리를 진단하였다[29,30]. 그러나 Chung et al [29]의 연구에서 후유리체박리가 발생한 환자들의 55%에서만 Weiss 고리를 관찰할 수 있었으며, Akiba et al [31]의 연구에서는 93.8%에서만 Weiss 고리를 관찰할 수 있었다. 이렇듯 후유리체박리가 일어난 모든 환자에게서 Weiss 고리가 보이는 것은 아니므로, 본 연구에서도 안저검사 또는 안저사진에서 Weiss 고리가 보이지 않더라도 빛간섭단층촬영을 이용하여 후유리체박리를 진단하였다. 빛간섭단층촬영사진에서 후극부와 시신경유두부에 유리체피질면이 보이지 않는 경우 후유리체박리를 진단하였는데(Fig. 1), 사진의 화질이 낮거나 유리체피질의 매우 투명하다면 그 진단의 정확도가 낮아질 수가 있다. 그렇지만 본 연구에 포함된 환자들의 진단 당시 빛간섭단층촬영검사의 신호 강도는 모두 6/10 이상이었으며, 환자들의 연령이 비교적 높아서 유리체피질이 매우 투명한 경우가 매우 드물것이다. 본 연구에서는 안저사진 및 안저검사에서 Weiss 고리가 관찰된 경우가 그렇지 않은 경우 보인 경우보다 망막전막의 발생률이 높았지만, 통계적으로 유의하지는 않았다(p=0.056).
고령, 여성, 당뇨, 비만, 근시, 백내장수술, 망막열공, 반대안 망막전막 등이 망막전막 발생의 위험인자로 알려져 있다[3,5-10,32]. 기존 연구들이 대부분 단면연구(cross-sectional study)의 방법을 통해서 위험인자를 확인한 것과 달리, 본 연구에서는 급성후유리체박리 환자만을 대상으로 증상 발현 이후 12개월 동안 망막전막 발생을 확인하였고, 그 위험인자를 알아보았다. 다변량회귀분석에서 반대안에 망막전막이 동반된 경우가 유일하게 망막전막 발생과 유의하게 관련 있었다(Table 3). Fraser-Bell et al [8]은 한쪽 눈에 망막전막이 발생하면 13.5%에서 5년 이내에 반대안에 망막전막이 발생한다고 보고하였다. 망막전막은 나이와 관련된 질환이기 때문에 나이관련황반변성처럼 양안의 대칭성을 보이는 것이라고 하였다[8]. 본 연구에서는 반대안에 망막전막이 동반된 6안 중에서 4안(66.7%)에서 후유리체박리 후 망막전막이 발생하였으며, 동반되지 않은 경우(19.3%)보다 더 많이 발생하였다(p<0.05).
Saran and Brucker [33]은 망막열공으로 치료를 받은 220안 중 26안(12%)에서 망막전막이 발생하였다고 보고하였다. 본 연구에서는 망막열공이 동반되어 치료받은 28안 중 12안(42.9%)에서 망막전막이 발생하였는데, Saran and Brucker [33]의 연구보다 높은 빈도로 망막전막 소견이 보였다. 망막열공으로 치료받은 환자는 추적 관찰에 대한 순응도가 높은 것도 높은 발생률과 관련이 있을 것이다. 본 연구에서는 망막열공이 동반되어 치료받은 경우가 동반되지 않은 경우보다 망막전막 발생률이 유의하게 높았지만, 다변량회귀분석에서는 망막열공의 동반은 망막전막 발생의 유의한 위험인자는 아니었다.
본 연구에서 유리체출혈을 동반한 경우에 54%에서 망막전막이 발생하였고, 동반하지 않은 경우보다 유의하게 발생률이 높았다. 후유리체박리는 유리체출혈의 주요 원인 중 하나로, 유리체출혈 환자의 6.5-12%가 후유리체박리의 의한 것으로 보고되고 있다[34-36]. 유리체출혈은 망막열공에 동반되어 발생할 수 있고, 유리체박리 과정에서 유리체망막의 유착이 비교적 강한 부위의 망막혈관이 손상되어 출혈이 발생할 수도 있다[26,36]. 그렇지만, 다변량회귀분석에서는 유리체출혈의 동반은 망막전막 발생의 유의한 위험인자는 아니었다.
본 후향적 연구에서는 조사한 총 154안 중에서 20안(13%)이 망막전막을 누적하여 진단되었으며, 이 중 5안이 망막전막제거술을 받았다. 모두 첫 진단 후 추적 관찰하면서 수술 적응증에 해당할 때 수술을 받았으며, 3안은 증상발현 후 12개월 이전에 수술을 받았으며, 다른 2안은 12개월 이후에 수술을 받았다. 관찰 기간이 더 길다면 수술을 받는 환자가 더 증가할 수도 있을 것이다. 수술을 받은 5안 모두 술 후 최대교정시력이 20/20였는데, 이는 망막전막을 조기에 진단하고 심하게 진행되지 않은 상태에서 수술을 했기 때문일 것이다. 또한 5안 모두 수술 전 시행한 빛간섭단층촬영검사에서 시세포층의 내절과 외절이 모두 정상 소견을 보였으며, 이는 좋은 술 후 시력의 근거가 될 수 있다. 망막전막의 수술예후는 술 전 시력과 빛간섭단층촬영검사에서 관찰되는 시세포층의 상태가 가장 중요한 인자로 알려져 있으며[11,14-16], Oster et al [37]은 시세포층의 내절과 외절의 파괴가 망막전막수술의 나쁜 예후인자라고 하였다.
본 연구는 후향적 연구이고 적은 환자를 대상으로 하였다는 제한점이 있다. 또한, 망막전막의 진단을 안저사진만을 이용하였는데, 이는 경과 관찰 당시에 빛간섭단층촬영검사는 일부에서만 시행하였기 때문이다. 빛간섭단층촬영검사를 이용한다면 경미한 망막전막도 진단할 수 있을 것이다. 따라서 본 연구에서의 망막전막 발생률은 빛간섭단층촬영검사를 이용하여 진단했을 때보다는 낮을 가능성이 있다. 마지막으로, 증상 발현 이후 12월까지의 기간에 한정하여 망막전막 발생을 확인하였다. 1년 이후에도 새로운 망막전막이 확인될 수도 있지만, 이것이 후유리체박리와 관련되는 것인지를 단정할 수는 없다.
후유리체박리 이후 망막전막의 발생은 비교적 흔하였다. 또한 6개월 이후에도 망막전막이 새롭게 확인되는 것을 고려했을 때, 증상 발현 이후 6개월 이상 장기적인 추적 관찰이 필요할 것이다. 이는 후유리체박리 환자에게 망막전막발생에 대한 적극적인 설명과 교육을 통해서 이루어 낼 수 있을 것이며, 궁극적으로 망막전막을 적절한 시기에 수술하고, 환자의 좋은 시력을 유지시키는 데에 도움이 될 것이다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
이상재 / Sang Jae Lee
동국대학교 일산병원 안과
Department of Ophthalmology, Dongguk University Ilsan Hospital