 |
 |
| J Korean Ophthalmol Soc > Volume 61(11); 2020 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢ┤ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä(vessel density, VD) ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤ņĢśļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
2018ļģä 7ņøöļČĆĒä░ 2019ļģä 6ņøöĻ╣īņ¦Ć ļ░▒ļé┤ņןņłśņłĀņØä ļ░øņØĆ 24ļ¬ģ 24ņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ļČäņäØņØä ĒĢśņśĆļŗż. ĒÖ®ļ░śĒæ£ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(superficial capillary plexus, SCP)Ļ│╝ ņŗ¼ļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(deep capillary plexus, DCP), ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£äņØś VDņÖĆ ņżæņŗ¼ņśżļ¬®ļ¼┤ĒśłĻ┤Ć ļČĆņ£ä ļ®┤ņĀü ļ│ĆĒÖöļź╝ ņłĀ ņĀä, ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ņ¢╗ņØĆ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņśüņāüņØä ņØ┤ņÜ®ĒĢ┤ ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņżæņŗ¼ņśżļ¬® SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś VDļŖö Ļ░üĻ░ü ņłĀ ņĀä 15.42 ┬▒ 6.61%ņÖĆ 28.43 ┬▒ 7.62%, 47.28 ┬▒ 5.76%ņÖĆ 53.06 ┬▒ 3.89%, 45.20 ┬▒ 5.01%ņÖĆ 46.62 ┬▒ 5.89%ņŚÉņä£ ņłĀ Ēøä ņ”ØĻ░ĆĒĢśņŚ¼ 6Ļ░£ņøöņŚÉ 17.20 ┬▒ 6.21%ņÖĆ 30.52 ┬▒ 7.06%, 50.34 ┬▒ 5.00%ņÖĆ 53.90 ┬▒ 4.20%, 48.52 ┬▒ 4.32%ņÖĆ 50.96 ┬▒ 5.57%ļĪ£ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆļÉ£ ņāüĒā£ļź╝ ņ£Āņ¦ĆĒĢśņśĆļŗż(Ļ░üĻ░ü p<0.001, p=0.001, p=0.002, p=0.014, p<0.001, p=0.002). ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä VD ļ░Å ņżæņŗ¼ņśżļ¬®ļ¼┤ĒśłĻ┤Ć ļČĆņ£ä ļ®┤ņĀüņØĆ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü p=0.068, p=0.332, p=0.206).
ABSTRACT
Purpose
We used optical coherence tomography angiography (OCTA) to evaluate changes in the vessel densities of macular capillary plexuses after cataract surgery.
Methods
We performed a retrospective chart review of 24 eyes of 24 cataract patients who underwent phacoemulsification cataract surgery from July 2018 to June 2019. The changes in vessel density (VD) in the macular superficial capillary plexus (SCP), the deep capillary plexus (DCP), inside the disc, and in the peripapillary area and foveal avascular zone (FAZ), were analyzed on OCTA images obtained preoperatively and at 1 week, and 1, 3, and 6 months, postoperatively.
Results
The VDs of the foveal SCP and DCP increased significantly from 15.42 ┬▒ 6.61 and 28.43 ┬▒ 7.62% preoperatively to 17.20 ┬▒ 6.21 and 30.52 ┬▒ 7.06% at 6 months postoperatively (p <0.001, p = 0.001). The VDs of the parafoveal SCP and DCP increased significantly from 47.28 ┬▒ 5.76 and 53.06 ┬▒ 3.89% preoperatively to 50.34 ┬▒ 5.00 and 53.90 ┬▒ 4.20% at 6 months postoperatively (p = 0.002, p = 0.014). The VDs of the perifoveal SCP and DCP increased significantly from 45.20 ┬▒ 5.01 and 46.62 ┬▒ 5.89% preoperatively to 48.52 ┬▒ 4.32 and 50.96 ┬▒ 5.57% at 6 months postoperatively (p <0.001, p = 0.002). The VDs of the area inside the disc, and of the peripapillary area and FAZ, did not change significantly (p = 0.068, 0.332, and 0.206, respectively).
ļ░▒ļé┤ņןņØĆ ņŗżļ¬ģĻ│╝ ņŗ£ļĀźņåÉņāüņØś ņŻ╝ņÜö ņøÉņØĖņØ┤ļ®░, ņ┤łņØīĒīīņłśņĀĢņ▓┤ņ£ĀĒÖöņłĀņØä ĒåĄĒĢ£ ļ░▒ļé┤ņן ņĀ£Ļ▒░ļŖö ņłśņłĀ Ēøä ļīĆļŗżņłśņØś ĒÖśņ×ÉņŚÉņä£ ņŗ£ļĀźņØä Ē¢źņāüņŗ£ĒéżļŖö Ļ░Ćņן ĒØöĒĢśĻ▓ī ņŗ£Ē¢ēļÉśļŖö ņĢłĻ│╝ņĀü ņłĀĻĖ░ņØ┤ļŗż[1,2]. ļ░▒ļé┤ņןņłśņłĀņØĆ ļ¦Øļ¦ēņŚÉļÅä ņśüĒ¢źņØä ļ»Ėņ╣śļŖöļŹ░, ĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØś Ļ▓░ĒĢ©ņØä Ļ░ĆņĀĖņÖĆ ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ļéŁĒżĒÖ®ļ░śļČĆņóģņØ┤ ņāØĻĖĖ ņłś ņ׳ņ£╝ļ®░, ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü(optical coherence tomography, OCT) Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░śļæÉĻ╗śņØś ņ£ĀņØśļ»ĖĒĢ£ ņ”ØĻ░ĆĻ░Ć ļéśĒāĆļéśļŖö Ļ▓āņØ┤ ĒÖĢņØĖļÉśņŚłļŗż[3,4]. ļśÉĒĢ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄņØś ļæÉĻ╗ś ļ░Å ļ¦źļØĮļ¦ēņØś ļæÉĻ╗śĻ░Ć ņ”ØĻ░ĆĒĢ©ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[5-7]. ĒĢ£ĒÄĖ ļ░▒ļé┤ņןņłśņłĀ Ēøä ņĢłņĢĢ Ļ░Éņåīļź╝ ĒåĄĒĢ┤ ņŻ╝ļĪ£ ļ¦źļØĮļ¦ēĒśłļźśļĪ£ļČĆĒä░ ņśżļŖö ļ░ĢļÅÖņĢłĒśłļźśņÖĆ ļ░ĢļÅÖņÜ®ņĀüņØ┤ ņ”ØĻ░ĆļÉśļŖö ņØ┤ļĪ£ņÜ┤ ņśüĒ¢źņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŖöļŹ░[8,9], ļ░▒ļé┤ņןņłśņłĀņØ┤ ļ¦Øļ¦ēĒśłļźśņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ņä£ļŖö ĒÖĢņŗżĒ׳ ļ░ØĒśĆņ¦ä ļ░ö ņŚåļŗż.
ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀ(optical coherence tomography angiography)ņØĆ ļ╣Āļź┤Ļ▓ī ļ░śļ│ĄļÉśļŖö BņŖżņ║öņØä ĒåĄĒĢ┤ ĒśłĻ┤Ćļé┤ ņĀüĒśłĻĄ¼ņØś ņøĆņ¦üņ×äņØä Ļ░Éņ¦ĆĒĢśņŚ¼, ĒśĢĻ┤æņĢłņĀĆĒśłĻ┤ĆņĪ░ņśüņłĀĻ│╝ļŖö ļŗ¼ļ”¼ ņĪ░ņśüņĀ£ņØś ņé¼ņÜ® ņŚåņØ┤ ļ╣äņ╣©ņŖĄņĀüņ£╝ļĪ£ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś Ēśłļźśļź╝ ņśüņāüĒÖöĒĢ£ļŗż[10]. ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØĆ Ēæ£ņĖĄĻ│╝ ņŗ¼ļČĆļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦Ćļ®░, Ēæ£ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(superficial capillary plexus, SCP)ņØĆ ļé┤Ļ▓ĮĻ│äļ¦ē(internal limiting membrane)Ļ│╝ ļé┤ļ¦ØņāüņĖĄ(inner plexiform layer)ņØś ĒøäĻ▓ĮĻ│äļČĆ ņé¼ņØ┤ņŚÉ ņ£äņ╣śĒĢśĻ│Ā ņŗ¼ļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(deep capillary plexus, DCP)ņØĆ ļé┤ļ¦ØņāüņĖĄņØś ĒøäĻ▓ĮĻ│äļČĆņÖĆ ņÖĖļ¦ØņāüņĖĄ(outer plexiform layer)ņØś ĒøäĻ▓ĮĻ│äļČĆ ņé¼ņØ┤ņŚÉ ņ£äņ╣śĒĢ£ļŗż[10]. ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØĆ ļé┤ļČĆņØś ņśüņāüņ▓śļ”¼ ņĢīĻ│Āļ”¼ņ”śņØä ĒåĄĒĢśņŚ¼ ņżæņŗ¼ņśżļ¬®ļ¼┤ĒśłĻ┤ĆļČĆņ£ä(foveal avascular zone, FAZ)ņØś ļ®┤ņĀüņØä ĻĄ¼ĒĢśĻ│Ā, ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĻĄ¼ņĪ░ļź╝ Ēæ£ņĖĄĻ│╝ ņŗ¼ļČĆļĪ£ ļČäļ”¼ĒĢśņŚ¼ Ļ░üĻ░üņØś ĒśłĻ┤Ćļ░ĆļÅä(vessel density) ļ░Å Ļ┤Ćļźśļ░ĆļÅä(perfusion density)ļź╝ ņĀĢļ¤ēņĀüņ£╝ļĪ£ ļČäņäØĒĢĀ ņłś ņ׳ļŗż[11,12]. ņØ┤ļ¤¼ĒĢ£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░śĒśłĻ┤Ć ĻĄ¼ņĪ░ņØś ļ│ĆĒÖöļź╝ ņŚ░ĻĄ¼ĒĢ£ Ļ▓░Ļ│╝, Zhao et al [13]ņØĆ ļ░▒ļé┤ņןņłśņłĀ Ēøä ļ░£ņāØĒĢ£ ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ ļ░Å ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆĻ░Ć 3Ļ░£ņøö ļÆż ņ£Āņ¦ĆļÉśņŚłņ£╝ļ®░, FAZņØś ļ®┤ņĀüņØĆ Ļ░ÉņåīĒĢśņśĆņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. Zhou et al [14]ņØĆ ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£äņØś ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅäĻ░Ć ļ░▒ļé┤ņןņłśņłĀ 1ņŻ╝ Ēøä, 1Ļ░£ņøö ĒøäņŚÉ ņ”ØĻ░ĆĒĢśņśĆņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ, ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ļŖö ĒÖ®ļ░ś ļ»ĖņäĖĒśłļźśņØś Ļ░£ņäĀņØ┤ ņżæņŗ¼ņŗ£ļĀźņØś Ē¢źņāüņŚÉ Ēü░ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö ņżæņÜöĒĢ£ ņÜöņØĖņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[15,16]. ĒĢśņ¦Ćļ¦ī ļ░▒ļé┤ņןņłśņłĀ Ēøä ļ░£ņāØĒĢ£ ņØ┤ļ¤░ ļŗ©ĻĖ░Ļ░äņØś ļ│ĆĒÖöĻ░Ć ņןĻĖ░ņĀüņ£╝ļĪ£ ņ¦ĆņåŹĒĢśļŖö ņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢīļĀżņ¦ä ļ░ö ņŚåļŗż. ļśÉĒĢ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░śņŚÉ ļéśĒāĆļéśļŖö ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļōżņØś ĻĖ░ņĀäņŚÉ ļīĆĒĢ┤ņä£ļÅä ņĀĢĒÖĢĒ׳ ĒÖĢļ”ĮļÉ£ ļ░ö ņŚåļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļ░▒ļé┤ņןņłśņłĀ Ēøä 6Ļ░£ņøö ļÅÖņĢł ĒÖ®ļ░śņØś Ēæ£ņĖĄ ļ░Å ņŗ¼ļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä Ļ░üĻ░üņØś ĒśłĻ┤Ćļ░ĆļÅäņÖĆ FAZ ļ®┤ņĀüņØś ņŗ£Ļ░äņŚÉ ļö░ļźĖ ļ│ĆĒÖöļź╝ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀĢļ¤ēņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ļśÉĒĢ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöļ¤ēĻ│╝ Ļ┤ĆĻ│äĻ░Ć ņ׳ļŖö ņØĖņ×Éļź╝ ļČäņäØĒĢśņŚ¼ ļ░▒ļé┤ņןņłśņłĀņØ┤ ĒÖ®ļ░ś Ēśłļźś ļ│ĆĒÖöļź╝ ņØ╝ņ£╝ĒéżļŖö ĻĖ░ņĀäņØś ņØ┤ĒĢ┤ņŚÉ ļÅäņøĆņØ┤ ļÉśĻ│Āņ×É ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö 2018ļģä 7ņøöļČĆĒä░ 2019ļģä 6ņøöĻ╣īņ¦Ć ļ│ĖņøÉņŚÉņä£ ļģĖļģä ļ░▒ļé┤ņןņ£╝ļĪ£ ņ¦äļŗ©ļ░øĻ│Ā ļ░▒ļé┤ņןņłśņłĀņØä ļ░øņØĆ 24ļ¬ģ 24ņĢłņØä ļīĆņāüņ£╝ļĪ£ ņØśļ¼┤ĻĖ░ļĪØņØä ĒåĄĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņØä ņżĆņłśĒĢśņśĆĻ│Ā, ļ│ĖņøÉ ņŚ░ĻĄ¼ņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖ(ņŖ╣ņØĖ ļ▓łĒśĖ: 2019-3)ņØä ļ░øņĢä ņ¦äĒ¢ēĒĢśņśĆļŗż.
ĒÖśņ×ÉļōżņØĆ ĒĢ£ ļ¬ģņØś ļÅÖņØ╝ĒĢ£ ņłĀņ×ÉņŚÉ ņØśĒĢ┤ ļŗ©ņł£ ņłśņĀĢņ▓┤ņ┤łņØīĒīīņ£ĀĒÖöņłĀ ļ░Å Ēøäļ░®ņØĖĻ│ĄņłśņĀĢņ▓┤ ņéĮņ×ģņłĀņØä ļ░øņĢśņ£╝ļ®░, ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņłśņĀĢņ▓┤ļéŁ ļé┤ņŚÉ ņØĖĻ│ĄņłśņĀĢņ▓┤Ļ░Ć ņéĮņ×ģļÉśņŚłĻ│Ā 6Ļ░£ņøö ņØ┤ņāü Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ĒĢ£ Ļ▓ĮņÜ░ļź╝ ņŚ░ĻĄ¼ ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. ņØ┤ņĀäņØś ļłł ņÖĖņāü ļśÉļŖö ņĢłĻ│╝ņĀü ņłśņłĀņØś ĻĖ░ņÖĢļĀźņØ┤ ņ׳Ļ▒░ļéś, ļ¦Øļ¦ēņ¦łĒÖś, ļģ╣ļé┤ņן ļ░Å ĒżļÅäļ¦ēņŚ╝ ļō▒ ļŗżļźĖ ņĢłĻ│╝ņĀü ņ¦łĒÖśņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ļŖö ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņÖĖļÉśņŚłļŗż. ņĢłņĢĢņØ┤ 22 mmHg ņØ┤ņāüņØĖ Ļ▓ĮņÜ░, ņĢłņČĢņןņØ┤ 20.0 mm ļ»Ėļ¦ī ļśÉļŖö 25.0 mm ņ┤łĻ│╝ņØĖ Ļ▓ĮņÜ░ ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖļÉśņŚłļŗż. Ļ▓Ćņé¼ ĒśæņĪ░ļÅäĻ░Ć ļČłļ¤ēĒĢśĻ▒░ļéś ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀ Ļ▓Ćņé¼Ļ▓░Ļ│╝ ņŗĀĒśĖĻ░ĢļÅä(scan quality index, SQI)Ļ░Ć 4/10 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖļÉśņŚłļŗż.
ļ¬©ļōĀ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼, ņĢłņĀĆĻ▓Ćņé¼, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźĻ▓Ćņé¼, ņ×ÉļÅÖĻ░üļ¦ēĻ│ĪļźĀĻ│ä(Auto Ref-Keratometer RK-F2; Canon, Inc., Tokyo, Japan)ļź╝ ņé¼ņÜ®ĒĢ£ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś ņĖĪņĀĢ, ļ╣äņĀæņ┤ēņĢłņĢĢĻ│ä(Full auto tonometer TX-F; Canon, Inc., Tokyo, Japan)ļź╝ ņé¼ņÜ®ĒĢ£ ņĢłņĢĢ ņĖĪņĀĢ, ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀ(RTVue XR Avanti┬«; Optovue, Inc., Fremont, CA, USA)ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. Ļ░üĻ░üņØś Ļ▓Ćņé¼ļŖö ļ¬©ļæÉ ļ░▒ļé┤ņןņłśņłĀĒĢśĻĖ░ ņĀä, ņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłĀ ņĀä ļ░▒ļé┤ņןņØś ņ¦äĒ¢ē ņĀĢļÅäļŖö Lens Opacities Classification System (LOCS) IIIņŚÉ ļö░ļźĖ ļČäļźśļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņłĀ ņĀä ņĢłņČĢņןņØä IOL Master┬« (Carl Zeiss Meditec AG, Jena, Germany)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. ĒÖ®ļ░ś SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ░Å ļ¦Øļ¦ēļæÉĻ╗ś, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ļé┤ ĒśłĻ┤Ćļ░ĆļÅä, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅä, FAZ ļ®┤ņĀü ļ│ĆĒÖöļŖö ĒĢśļéśņØś ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀ ĻĖ░Ļ│äņŚÉ ņØśĒĢ┤ Ļ░ÖņØĆ ļéĀ ļÅÖņŗ£ņŚÉ ņĖĪņĀĢļÉśņŚłņ£╝ļ®░ ĒÖ®ļ░śņśüņŚŁņØĆ ņżæņŗ¼ņśżļ¬®ņØä ĻĖ░ņżĆņ£╝ļĪ£ 6.0 ├Ś 6.0 mm ņśüņŚŁņØä, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņśüņŚŁņØĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļź╝ ĻĖ░ņżĆņ£╝ļĪ£ 4.5 ├Ś 4.5 mm ņśüņŚŁņØä ņ┤¼ņśüĒĢśņśĆļŗż. ļé┤ņןļÉ£ ņåīĒöäĒŖĖņø©ņ¢┤(RTVue XR, version 2018.1.0.33; Optovue, Inc.)ļź╝ ĒåĄĒĢ┤ ņĀĢļ®┤ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü ņśüņāüņŚÉņä£ ĒÖ®ļ░ś SCPņÖĆ DCP, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£äņØś ĒśłĻ┤Ćļ░ĆļÅä(vessel density, %), ļ¦Øļ¦ēļæÉĻ╗ś(╬╝m), FAZņØś ļ®┤ņĀü(mm2), ļ¦Øļ¦ēĻ│╝ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņØś SQIļź╝ ņ×ÉļÅÖņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż[17]. ļ¦Øļ¦ēņØĆ ņ×ÉļÅÖņ£╝ļĪ£ SCPņÖĆ DCPļĪ£ ņäĖļČäĒÖöļÉśņŚłņ£╝ļ®░ SCPļŖö ļé┤Ļ▓ĮĻ│äļ¦ēņŚÉņä£ ļé┤ļ¦ØņāüņĖĄ 9 ╬╝m ņĢäļלĻ╣īņ¦Ć ĒżĒĢ©ĒĢśļÅäļĪØ ĒĢśņśĆĻ│Ā, DCPļŖö ļé┤ļ¦ØņāüņĖĄ 9 ╬╝m ņĢäļלļČĆĒä░ ņÖĖļ¦ØņāüņĖĄ 9 ╬╝m ņ£äĻ╣īņ¦Ć ĒżĒĢ©ĒĢśļÅäļĪØ ĒĢśņśĆļŗż. ņØ┤ļĢī ĒÖ®ļ░śņśüņŚŁņØĆ ņżæņŗ¼ņśżļ¬®(ņ¦üĻ▓Į 1 mm), ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝(ņ¦üĻ▓Į 3 mm), ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä(ņ¦üĻ▓Į 6 mm)ļĪ£ ļéśļłäņ¢┤ņĀĖ Ļ░üĻ░üņØś ņśüņŚŁļ│ä SCPņÖĆ DCP ĒśłĻ┤Ćļ░ĆļÅä ļ░Å ņśüņŚŁļ│ä ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śĻ░Ć ņĖĪņĀĢļÉśņŚłļŗż. ļ¦Øļ¦ēļæÉĻ╗śņØś ņĖĪņĀĢņØĆ Ļ░ü ņśüņŚŁļ│ä ĒÅēĻĘĀ ņĀäņ▓┤ ļ¦Øļ¦ēņĖĄ(total retinal layer, TRL) ļæÉĻ╗śļź╝ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, ņĀäņ▓┤ ļ¦Øļ¦ēņĖĄņØĆ ļé┤Ļ▓ĮĻ│äļ¦ēņŚÉņä£ ļ¦Øļ¦ēņāēņåīņāüĒö╝(retinal pigment epithelium)Ļ╣īņ¦Ć ĒżĒĢ©ĒĢśļÅäļĪØ ĒĢśņśĆļŗż. ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņśüņŚŁņØĆ ļé┤Ļ▓ĮĻ│äļ¦ēņŚÉņä£ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ Ēøäļ░® Ļ▓ĮĻ│ä ņé¼ņØ┤ņŚÉ ņ׳ļŖö ĒśłĻ┤Ćļ░ĆļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŖöļŹ░, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ļé┤ņÖĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ Ļ▓ĮĻ│äņŚÉņä£ ņŚ░ņןļÉśļŖö 750 ╬╝m ļäłļ╣äņØś ĒāĆņøÉĒśĢ Ļ│Āļ”¼ ņśüņŚŁņ£╝ļĪ£ ņĀĢņØśļÉ£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£äņØś ļ░®ņé¼ļ¬©ņ¢æ ņ£ĀļæÉņŻ╝ņ£ä ļ¬©ņäĖĒśłĻ┤Ć(radial peripapillary capillary, RPC) ĒśłĻ┤Ćļ░ĆļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż[18].
ļ░▒ļé┤ņןņłśņłĀņØĆ 0.5% ĒæĖļĪ£ĒīīļØ╝ņ╣┤ņØĖņŚ╝ņé░ņŚ╝(Alcaine┬«; Alcon Laboratories, Forth Worth, TX, USA)ņØä ņØ┤ņÜ®ĒĢ£ ņĀÉņĢłļ¦łņĘ© Ēøä 2.2 mm Ēü¼ĻĖ░ņØś Ēł¼ļ¬ģ Ļ░üļ¦ē ņĀłĻ░£ļź╝ Ļ░ĆĒ¢łņ£╝ļ®░ ņŚ░ņåŹĻ│ĪņäĀņłśņĀĢņ▓┤ ļéŁņøÉĒśĢņĀłĻ░£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤Ēøä ĒÅēĒśĢņŚ╝ņĢĪņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņłśļĀźļČäļ”¼ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ Infinity Vision System (Alcon Laboratories, Forth Worth, TX, USA)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņ┤łņØīĒīīņłśņĀĢņ▓┤ņ£ĀĒÖöņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤ņ¢┤ņä£ Ļ┤ĆļźśĒØĪņØĖĻĖ░ļĪ£ ļé©ņØĆ Ēö╝ņ¦łņØä ņĀ£Ļ▒░ĒĢśĻ│Ā ņĀæļŖö ņØĖĻ│ĄņłśņĀĢņ▓┤ enVista┬«MX60 (Bausch & Lomb, Rochesters, NY, USA)ļź╝ ĒøäļéŁņŚÉ ņéĮņ×ģĒĢśņśĆļŗż. ņłśņłĀ Ēøä ņ▓śņ╣śļŖö ļÅÖņØ╝ĒĢśĻ▓ī 0.5% ļĀłļ│┤ĒöīļĪØņé¼ņŗĀ(Cravit┬«; Santen Pharmaceutical Co., Ltd., Osaka, Japan)ņØä ĒĢśļŻ© 4ĒÜī, 0.1% ļĖīļĪ¼ĒÄśļéÖļéśĒŖĖļź©(Bronuck┬«; Taejoon Pharm., Seoul, Korea)ņØä ĒĢśļŻ© 2ĒÜī, ņłśņłĀ Ēøä 4ņŻ╝ ļÅÖņĢł ņĀÉņĢłĒĢśņśĆļŗż.
ĒåĄĻ│ä ļČäņäØņØĆ SPSS software ver. 18.0 (SPSS Inc., Chigaco, IL, USA)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ļ░▒ļé┤ņןņłśņłĀ Ēøä ņŗ£Ļ░äņŚÉ ļö░ļźĖ Ļ░ü ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅä, FAZ ļ®┤ņĀü, Ļ░ü ņśüņŚŁņØś ļ¦Øļ¦ēļæÉĻ╗ś, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź, ļ¦Øļ¦ēĻ│╝ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņØś SQI, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś, ņĢłņĢĢ ļ│ĆĒÖöņØś ņ£ĀņØśņä▒ Ļ▓ĆņĀĢņØä ņ£äĒĢ┤ņä£ Ēöäļ”¼ļō£ļ¦ī Ļ▓ĆņĀĢ(Friedman test)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ļśÉĒĢ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░ś SCP, DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņÖĆ SQI, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś, ņĢłņĢĢņØś ļ│ĆĒÖö, ņłĀ ņĀä ļ░▒ļé┤ņןņØś ņ¦äĒ¢ē ņĀĢļÅä, ļ¦Øļ¦ēļæÉĻ╗ś ļ│ĆĒÖö, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØś ļ│ĆĒÖö ņé¼ņØ┤ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ņŖżĒö╝ņ¢┤ļ¦ī ņł£ņ£äņāüĻ┤ĆļČäņäØ(Spearman rank correlation analysis)ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļśÉĒĢ£ SQI ļ│ĆĒÖöļ¤ē, ļ¦Øļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ļ░▒ļé┤ņן ņ¦äĒ¢ē ņĀĢļÅäĻ░Ć ĒÖ®ļ░ś SCP, DCP ĒśłĻ┤Ćļ░ĆļÅäļ│ĆĒÖöļ¤ēņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖöņ¦Ć ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ļŗżņżæĒÜīĻĘĆļČäņäØ(multiple regression analysis)ņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ļ¬©ļæÉ p-valueĻ░Ć 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
ļ░▒ļé┤ņןņłśņłĀņØä ļ░øņØĆ ņ┤Ø 24ļ¬ģ 24ņĢłņØä ņŚ░ĻĄ¼ ļīĆņāüņ£╝ļĪ£ ĒżĒĢ©ĒĢ£ Ļ░ĆņÜ┤ļŹ░, ļīĆņāü ĒÖśņ×ÉņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 66.50 ┬▒ 8.57ņäĖļĪ£, ļé©ņä▒ņØ┤ 10ļ¬ģ, ņŚ¼ņä▒ņØ┤ 14ļ¬ģņØ┤ņŚłļŗż. ņłĀ ņĀä ļ░▒ļé┤ņןņØś ņ¦äĒ¢ē ņĀĢļÅäļŖö LOCS III ļČäļźśņāü, ĒÅēĻĘĀ Ēö╝ņ¦łļ░▒ļé┤ņןņØĆ 1.96 ┬▒ 1.33, ĒĢĄļ░▒ļé┤ņןņØĆ 2.27 ┬▒ 1.32, ĒøäļéŁĒĢśļ░▒ļé┤ņןņØĆ 0.33 ┬▒ 0.76ņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ĒÅēĻĘĀ 0.35 ┬▒ 0.13 logarithm of minimal angle of resolution (logMAR)ņØ┤ņŚłļŗż. ņłĀ ņĀä ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀĻ▓Ćņé¼ņāü ļ¦Øļ¦ē SQIļŖö ĒÅēĻĘĀ 6.88 ┬▒ 1.15, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ SQIļŖö ĒÅēĻĘĀ 7.25 ┬▒ 1.26ņØ┤ņŚłļŗż. ņłĀ ņĀä ĒÅēĻĘĀ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö 0.38 ┬▒ 2.32 diopters (D)ņØ┤ņŚłņ£╝ļ®░ ņĢłņČĢņןņØĆ 23.34 ┬▒ 0.73 mmņśĆļŗż. ņłĀ ņĀä ĒÅēĻĘĀ ņĢłņĢĢņØĆ 14.46 ┬▒ 3.07 mmHgņØ┤ņŚłļŗż(Table 1).
ņżæņŗ¼ņśżļ¬® SCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ļ░▒ļé┤ņןņłśņłĀ ņĀäĻ│╝ ņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 15.42 ┬▒ 6.61%, 17.84 ┬▒ 6.80%, 18.32 ┬▒ 5.58%, 17.15 ┬▒ 5.97%, 17.20 ┬▒ 6.21%ņśĆņ£╝ļ®░, ņżæņŗ¼ņśżļ¬® DCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö 28.43 ┬▒ 7.62%, 30.95 ┬▒ 6.92%, 31.14 ┬▒ 6.18%, 29.88 ┬▒ 7.14%, 30.52 ┬▒ 7.06%ļĪ£ ļéśĒāĆļéś ņżæņŗ¼ņśżļ¬® SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņłśņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļ░▒ļé┤ņןņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ļ¬©ļæÉ ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ ļ│┤ņśĆļŗż(p<0.001, p=0.001). ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņłĀ ņĀäĻ│╝ ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 47.28 ┬▒ 5.76%, 50.83 ┬▒ 6.28%, 51.93 ┬▒ 4.60%, 50.32 ┬▒ 6.07%, 50.34 ┬▒ 5.00%ņśĆņ£╝ļ®░, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö 53.06 ┬▒ 3.89%, 53.54 ┬▒ 4.94%, 55.58 ┬▒ 3.67%, 53.05 ┬▒ 6.84%, 53.90 ┬▒ 4.20%ļĪ£ ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļśÉĒĢ£ ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļ░▒ļé┤ņןņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ļ¬©ļæÉ ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ ļ│┤ņśĆļŗż(p=0.002, p=0.014). ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņłĀ ņĀäĻ│╝ ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 45.20 ┬▒ 5.01%, 48.52 ┬▒ 5.43%, 49.47 ┬▒ 4.93%, 48.36 ┬▒ 4.94%, 48.52 ┬▒ 4.32%ņśĆņ£╝ļ®░, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä DCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö 46.62 ┬▒ 5.89%, 50.10 ┬▒ 7.08%, 53.16 ┬▒ 5.47%, 49.59 ┬▒ 8.70%, 50.96 ┬▒ 5.57%ļź╝ ļ│┤ņŚ¼ ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļśÉĒĢ£ ņłĀ ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ ļéśĒāĆļāłļŗż(p<0.001, p=0.002). ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤ ĒśłĻ┤Ćļ░ĆļÅäļŖö ļ░▒ļé┤ņןņłśņłĀ ņĀäĻ│╝ ņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 47.22 ┬▒ 4.57%, 50.08 ┬▒ 4.54%, 49.40 ┬▒ 4.63%, 48.59 ┬▒ 6.28%, 49.60 ┬▒ 4.93%ņśĆņ£╝ļ®░, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅäļŖö Ļ░üĻ░ü 51.03 ┬▒ 4.06%, 50.68 ┬▒ 3.93%, 49.75 ┬▒ 4.14%, 50.25 ┬▒ 3.51%, 50.74 ┬▒ 3.64%ļĪ£ ļéśĒāĆļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(p=0.068, p=0.332). FAZ ļ®┤ņĀüņØĆ ņłĀ ņĀä 0.37 ┬▒ 0.12 mm2ņśĆņ£╝ļ®░, ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 0.35 ┬▒ 0.11 mm2, 0.37 ┬▒ 0.10 mm2, 0.35 ┬▒ 0.10 mm2, 0.36 ┬▒ 0.11 mm2ļĪ£ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(p=0.206) (Table 2).
ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä Ļ░ü ņśüņŚŁļ│ä ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śļŖö ļ░▒ļé┤ņןņłśņłĀ ņĀä Ļ░üĻ░ü 240.13 ┬▒ 20.78 ╬╝m, 310.75 ┬▒ 13.04 ╬╝m, 272.75 ┬▒ 13.55 ╬╝mņŚÉņä£ 1ņŻ╝ Ēøä 241.67 ┬▒ 21.70 ╬╝m, 315.29 ┬▒ 14.25 ╬╝m, 275.88 ┬▒ 14.23 ╬╝m, 1Ļ░£ņøöņŚÉ 247.25 ┬▒ 22.22 ╬╝m, 320.71 ┬▒ 14.98 ╬╝m, 281.29 ┬▒ 14.83 ╬╝m, 3Ļ░£ņøöņŚÉ 251.83 ┬▒ 23.12 ╬╝m, 324.04 ┬▒ 15.22 ╬╝m, 284.42 ┬▒ 15.29 ╬╝m, 6Ļ░£ņøöņŚÉ 250.58 ┬▒ 22.63 ╬╝m, 322.96 ┬▒ 14.67 ╬╝m, 282.46 ┬▒ 14.74 ╬╝mļĪ£ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż(ļ¬©ļæÉ p<0.001). ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņłĀ ņĀä ĒÅēĻĘĀ 0.35 ┬▒ 0.13 logMARņŚÉņä£ ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 0.16 ┬▒ 0.14 logMAR, 0.12 ┬▒ 0.12 logMAR, 0.14 ┬▒ 0.13 logMAR, 0.16 ┬▒ 0.14 logMARļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż(p<0.001). ļ¦Øļ¦ē SQIņÖĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ SQIļŖö ņłĀ ņĀä ĒÅēĻĘĀ 6.88 ┬▒ 1.15, 7.25 ┬▒ 1.26ņŚÉņä£ ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ļ¦Øļ¦ē SQIļŖö 7.96 ┬▒ 0.91, 8.29 ┬▒ 0.81, 7.79 ┬▒ 1.25, 7.96 ┬▒ 1.00, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ SQIļŖö 8.25 ┬▒ 1.03, 8.58 ┬▒ 0.72, 8.21 ┬▒ 0.88, 8.33 ┬▒ 0.82ļĪ£ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż(p<0.001, p<0.001). ĒÅēĻĘĀ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö ņłĀ ņĀä 0.38 ┬▒ 2.32 DņŚÉņä£ ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü -0.04 ┬▒ 0.74 D, -0.02 ┬▒ 0.55 D, -0.04 ┬▒ 0.57 D, -0.01 ┬▒ 0.58 DļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(p=0.021). ĒÅēĻĘĀ ņĢłņĢĢņØĆ ņłĀ ņĀä 14.46 ┬▒ 3.07 mmHgņŚÉņä£ ņłśņłĀ 1ņŻ╝ Ēøä 11.02 ┬▒ 2.89 mmHgņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ņłĀ Ēøä 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉļÅä Ļ░üĻ░ü 11.57 ┬▒ 2.86 mmHg, 11.84 ┬▒ 2.69 mmHg, 11.68 ┬▒ 3.01 mmHgņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉ£ ņ▒ä ņ£Āņ¦ĆļÉśņŚłļŗż(p<0.001) (Table 3).
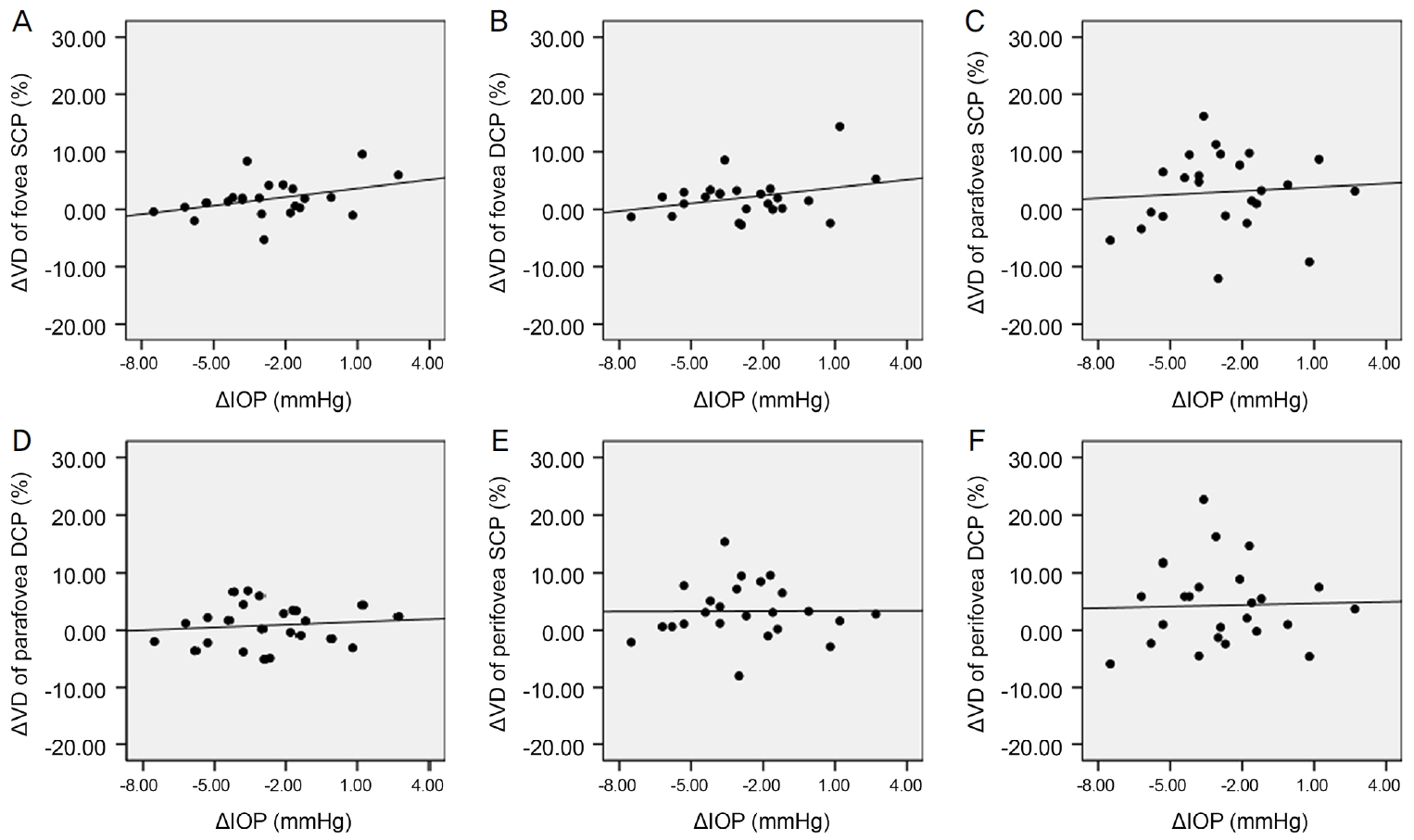
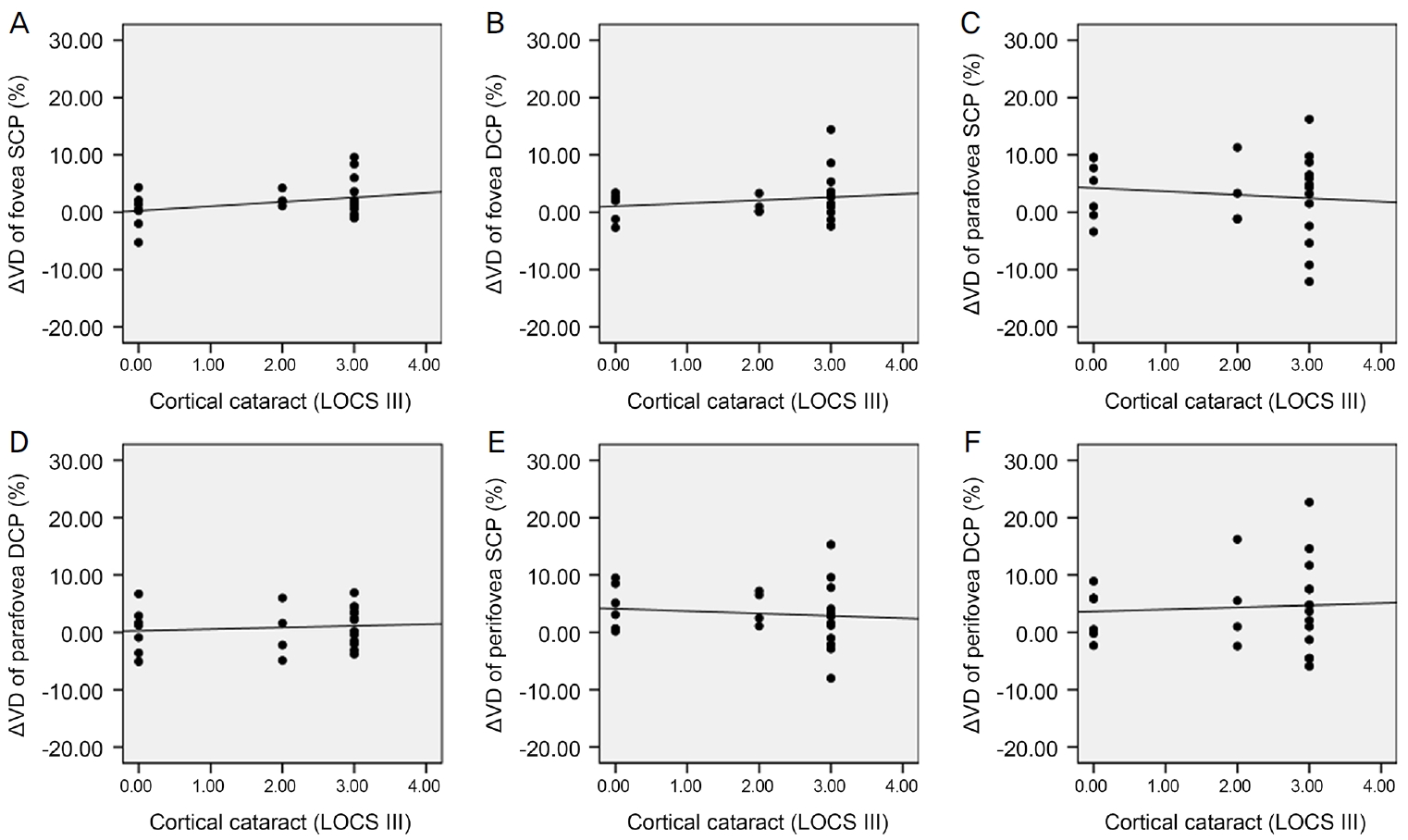
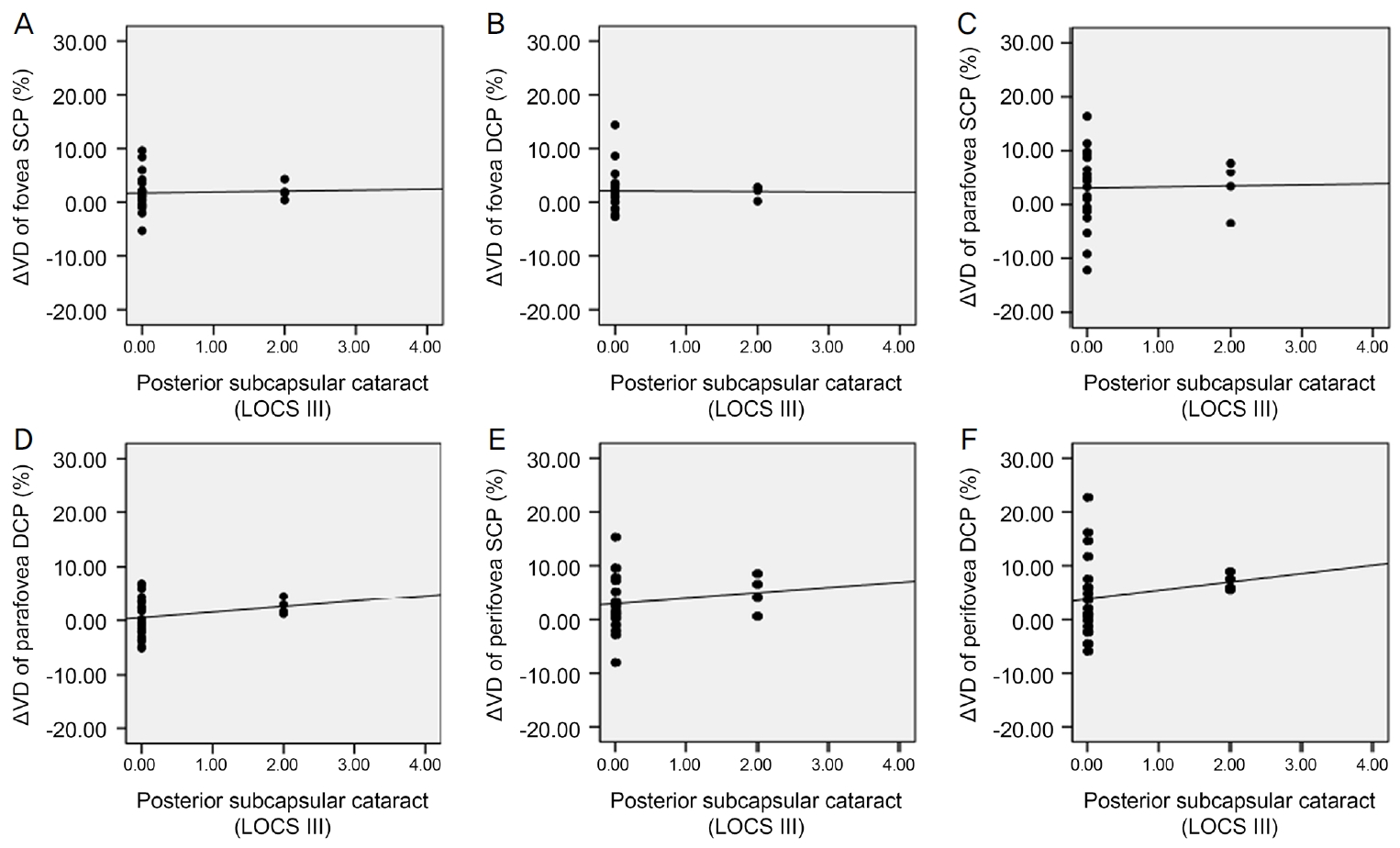
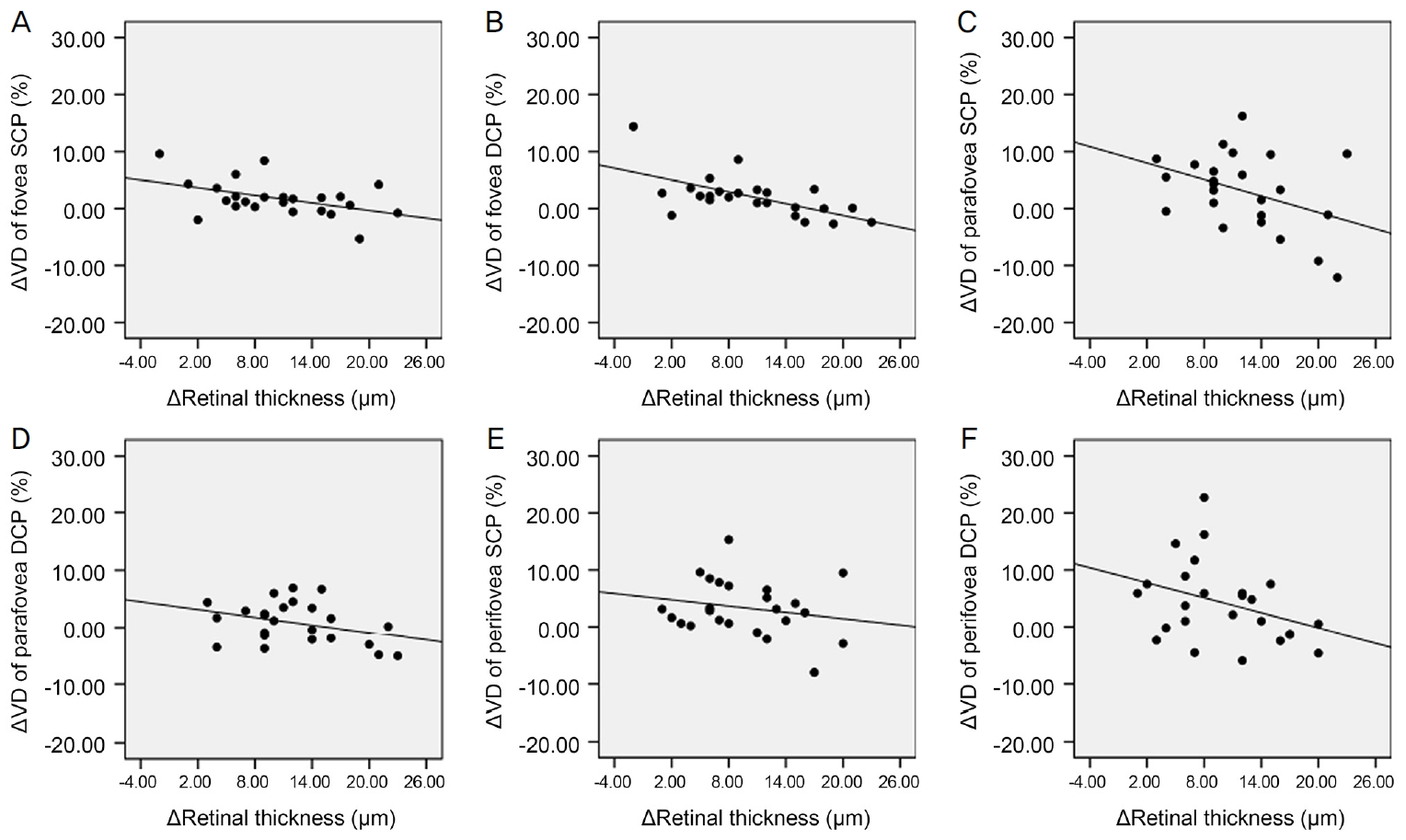
ļ░▒ļé┤ņןņłśņłĀ 6Ļ░£ņøö Ēøä SQI ļ│ĆĒÖöļŖö ņżæņŗ¼ņśżļ¬® SCPņÖĆ DCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņÖĆ DCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņÖĆ Ļ░üĻ░ü ļ¬©ļæÉņŚÉņä£ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(Ļ░üĻ░ü, Spearman correlation coefficient Žü=0.425, Žü=0.509, Žü=0.897, Žü=0.448, Žü=0.779, Žü=0.638; p<0.05 in all groups) (Fig. 1). ĒĢ£ĒÄĖ ļ░▒ļé┤ņןņłśņłĀ 6Ļ░£ņøö Ēøä ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śņØś ļ│ĆĒÖöņÖĆ ņżæņŗ¼ņśżļ¬® SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ņŚÉļŖö Ļ░üĻ░ü ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü, Spearman correlation coefficient Žü=-0.370, -0.105, 0.317, 0.250, 0.422, 0.321; p>0.05 in all groups) (Fig. 2). ļ░▒ļé┤ņןņłśņłĀ 6Ļ░£ņøö Ēøä ņĢłņĢĢļ│ĆĒÖöņÖĆ ņżæņŗ¼ņśżļ¬® SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ ļśÉĒĢ£ Ļ░üĻ░ü ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü, Spearman correlation coefficient Žü=0.311, Žü=0.088, Žü=0.072, Žü=0.093, Žü=0.061, Žü=0.004; p>0.05 in all groups) (Fig. 3). ņłĀ ņĀä ļ░▒ļé┤ņןņØś ņ¦äĒ¢ē ņĀĢļÅäļŖö ĒøäļéŁĒĢśļ░▒ļé┤ņןĻ│╝ ņłśņłĀ 1ņŻ╝ Ēøä ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ DCP, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö, Ēö╝ņ¦łļ░▒ļé┤ņןĻ│╝ 3Ļ░£ņøö Ēøä ņżæņŗ¼ņśżļ¬® SCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś(Ļ░üĻ░ü, Spearman correlation coefficient Žü=0.420, Žü=0.436, Žü=0.433; p<0.05 in all groups), ĻĘĖ ņÖĖ ļéśļ©Ėņ¦Ć ņśüņŚŁņŚÉņä£ļŖö 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņÖĆ ļ¬©ļæÉ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü, Spearman correlation coefficient, p>0.05 in all groups)(Fig. 4-6). ļ░▒ļé┤ņןņłśņłĀ Ēøä Ļ░ü ņśüņŚŁļ│ä ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļŖö ņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøöņŚÉ ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä ļ¬©ļōĀ ņśüņŚŁņŚÉņä£ ĒÖ®ļ░ś SCPņÖĆ DCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü, Spearman correlation coefficient; p>0.05 in all groups). 6Ļ░£ņøö Ēøä ņżæņŗ¼ņśżļ¬® ļ¦Øļ¦ēļæÉĻ╗ś ļ│ĆĒÖöņÖĆ ņżæņŗ¼ņśżļ¬® DCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņØīņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś(Spearman correlation coefficient Žü=-0.572, p=0.003), ņżæņŗ¼ņśżļ¬® SCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņÖĆļŖö ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłņ£╝ļ®░ ņżæņŗ¼ņśżļ¬® ļČĆĻĘ╝ SCPņÖĆ DCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöļŖö ļ¬©ļæÉ Ļ░ü ņśüņŚŁņØś ļ¦Øļ¦ēļæÉĻ╗ś ļ│ĆĒÖöņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü, Spearman correlation coefficient Žü=-0.393, Žü=-0.310, Žü=-0.257, Žü=-0.140, Žü=-0.335; p>0.05 in all groups) (Fig. 7). ļ░▒ļé┤ņןņłśņłĀ 6Ļ░£ņøö Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ļ│ĆĒÖöņÖĆ ņżæņŗ¼ņśżļ¬® SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ ļśÉĒĢ£ Ļ░üĻ░ü ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü, Spearman correlation coefficient Žü=-0.092, Žü=-0.239, Žü=-0.353, Žü=-0.064, Žü=-0.203, Žü=-0.165; p>0.05 in all groups) (Fig. 8).
ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśņś© SQI ļ│ĆĒÖöļ¤ē, ļ¦Øļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ļ░▒ļé┤ņן ņ¦äĒ¢ē ņĀĢļÅäĻ░Ć ĒÖ®ļ░ś SCP, DCP ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöļ¤ēņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖöņ¦Ć ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ļŗżņżæĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝, SQI ļ│ĆĒÖöļ¤ēļ¦īņØ┤ ņżæņŗ¼ņśżļ¬® SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ SCPņÖĆ DCP, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäļ│ĆĒÖöņŚÉ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä Ļ░Ćņ¦ĆļŖö ņÜöņØĖņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(Ļ░üĻ░ü, Multiple regression analysis coefficient B=0.899, B=1.089, B=3.918, B=2.063, B=2.669, B=4.354; p<0.001 in all groups)(Table 4).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņÖĆ FAZ ļ®┤ņĀüņØś 6Ļ░£ņøöĻ░äņØś ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ļ░▒ļé┤ņןņłśņłĀņØä ņŗ£Ē¢ēĒĢ£ 24ņĢłņŚÉņä£ ĒÖ®ļ░ś SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ¬©ļæÉ ņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬® ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä ņäĖ ņśüņŚŁ ņĀäņ▓┤ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░ ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöĻ░Ć ņłśņłĀ Ēøä 6Ļ░£ņøöņŚÉļÅä ņ£Āņ¦ĆļÉśņ¢┤ ņØ┤ņĀäņØś Zhao et al [13], Zhou et al [14]ņØś ņŚ░ĻĄ¼ņÖĆ ļ╣äĻĄÉĒ¢łņØä ļĢī ļŹö ņśżļל ņ£Āņ¦ĆļÉśļŖö ļ¬©ņŖĄņØä ļéśĒāĆļāłļŗż. ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤ ļ░Å ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅäļŖö ņ£ĀņØśļ»ĖĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░, ļ░▒ļé┤ņןņłśņłĀ Ēøä ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢ£ Zhou et al [14]ņØś ņŚ░ĻĄ¼ņÖĆļŖö ļŗżļźĖ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļāłļŗż. FAZ ļ®┤ņĀüņØĆ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢä ļ░▒ļé┤ņןņłśņłĀ Ēøä FAZ ļ®┤ņĀüņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢ£ Zhao et al [13]ņØś ņŚ░ĻĄ¼ņÖĆļŖö ļŗżļźĖ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļāłļŗż.
ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░śņŚÉ ņØ╝ņ¢┤ļéśļŖö ļ│ĆĒÖöļōżņØ┤ ņ¢┤ļ¢ĀĒĢ£ ĻĖ░ņĀäņ£╝ļĪ£ ļéśĒāĆļéśļŖö ņ¦ĆļŖö ņĢäņ¦ü ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖņ¦Ćļ¦ī ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć Ļ░ĆņäżļōżņØ┤ ņĀ£ĻĖ░ļÉśĻ│Ā ņ׳ļŗż. Yu et al [19]ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ļ░▒ļé┤ņןņłśņłĀņØä ĒåĄĒĢ£ ņłśņĀĢņ▓┤Ēś╝ĒāüņØś ņĀ£Ļ▒░ļŖö ņĢłĻĄ¼ ņøĆņ¦üņ×äņŚÉ ņØśĒĢ£ ņĖĪņĀĢ ņśżļźś(motion artifact)ļź╝ Ļ░Éņåīņŗ£ĒéżĻ│Ā, ĒÖ®ļ░śņØś ļ»ĖņäĖĒśłĻ┤ĆļōżņØ┤ ļŹö ņל ņŗ£Ļ░üĒÖöļÉ©ņ£╝ļĪ£ņŹ© SQIļź╝ ņ”ØĻ░Ćņŗ£ņ╝£ SCPņÖĆ DCPņØś Ļ┤Ćļźś ļ░Å ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆņŚÉ ņ£ĀņØśĒĢ£ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś SQIņØś ņ”ØĻ░ĆņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā FAZ ļ®┤ņĀüņØĆ ļ│ĆĒÖöĻ░Ć ņŚåņŚłļŗż. ņĢłĻĄ¼ ņøĆņ¦üņ×äņŚÉ ņØśĒĢ£ ņĖĪņĀĢ ņśżļźśļŖö ļČłļ¤ēĒĢ£ ņŗ£ļĀźĻ│╝ ļČłņĢłņĀĢĒĢ£ ņŻ╝ņŗ£ņŚÉ ņśüĒ¢źņØä ļ░øņ£╝ļ®░, ņłśņĀĢņ▓┤Ēś╝Ēāüņ£╝ļĪ£ ņØĖĒĢ┤ Ļ░ÉņåīļÉ£ ņŗ£ļĀźļÅä SQIņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŗż[20,21]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤Ć ņĪ░ņśüņłĀĻ▓Ćņé¼ņØś SQIļŖö ļ░▒ļé┤ņןņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, ņłĀ Ēøä 6Ļ░£ņøöņØś SQI ņ”ØĻ░ĆļŖö ĒÖ®ļ░ś SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆņÖĆ ņ£ĀņØśĒĢ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłĻ│Ā, FAZ ļ®┤ņĀüņØĆ SQIņØś ņ”ØĻ░ĆņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć ņŚåņŚłļŗż. ļśÉĒĢ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä SQI ļ│ĆĒÖöļ¤ē, ļ¦Øļ¦ēļæÉĻ╗ś ļ│ĆĒÖöļ¤ē, ļ░▒ļé┤ņן ņ¦äĒ¢ē ņĀĢļÅäņÖĆ ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöļ¤ēņØś ļŗżņżæĒÜīĻĘĆļČäņäØ Ļ▓░Ļ│╝ SQI ļ│ĆĒÖöļ¦īņØ┤ ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņÜöņØĖņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ņłśņĀĢņ▓┤Ēś╝ĒāüņØś ņĀ£Ļ▒░ļź╝ ĒåĄĒĢ£ SQIņØś ņ”ØĻ░ĆĻ░Ć ņłĀ Ēøä ņĖĪņĀĢļÉ£ ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäņØś ņ”ØĻ░ĆņŚÉ ņ£ĀņØśĒĢ£ ņśüĒ¢źņØä ļ»Ėņ│żļŗżļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī SQIņØś ņ”ØĻ░ĆĻ░Ć FAZ Ļ▓ĮĻ│äņĖĪņĀĢņŚÉļŖö ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśņØä Ļ▓āņØ┤ļŗż.
ĒĢ£ĒÄĖ, ļ░▒ļé┤ņןņłśņłĀ Ēøä ļ░£ņāØĒĢśļŖö ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś ļ│ĆĒÖöņŚÉ ņØśĒĢ£ ņśüĒ¢źņØä Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. Li et al [22]ņØĆ ĒÅēĻĘĀ -6 D ĻĄ┤ņĀłņØ┤ņāüņØś Ļ│ĀļÅäĻĘ╝ņŗ£ņĢłĻ│╝ ņĀĢņāüņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒśłĻ┤Ćļ░ĆļÅäļź╝ ļ╣äĻĄÉ ļČäņäØĒĢ┤ ļ│Ė Ļ▓░Ļ│╝, ņĀĢņāüņĢłņŚÉ ļ╣äĒĢ┤ Ļ│ĀļÅäĻĘ╝ņŗ£ņĢłņØĆ SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć ļ¬©ļæÉ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļ│┤ļŗżļŖö Ļ│ĀļÅäĻĘ╝ņŗ£ļĪ£ ņØĖĒĢ┤ ņĢłņČĢņןņØ┤ ĻĖĖņ¢┤ņ¦ĆĻ│Ā ļ¦Øļ¦ēņØ┤ ļŖśņ¢┤ļéśļ®░ ņāØĻĖ┤ ļ│æņĀü ļ│ĆĒÖöņŚÉ ņØśĒĢ£ ņśüĒ¢źņ£╝ļĪ£ ļ│┤ņĢśļŗż. ļŗ©, ņĀĢņāüņĢłņŚÉņä£ļŖö SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć ņĢłņČĢņןņØ┤ ņĢäļŗī ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śņÖĆ ņ£ĀņØśĒĢ£ Ļ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż. Chen et al [23]ņØĆ Ļ│ĀļÅäĻĘ╝ņŗ£ņĢłņØä ļīĆņāüņ£╝ļĪ£ small incision lenticule extractionņØä ņŗ£Ē¢ēĒĢ£ Ēøä 1ņØ╝, 1ņŻ╝, 1Ļ░£ņøö ĒøäņØś ļ¦Øļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöļź╝ ņŚ░ĻĄ¼ĒĢ┤ļ│Ė Ļ▓░Ļ│╝ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö 1ņØ╝, 1ņŻ╝, 1Ļ░£ņøö Ēøä ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ¦Ćļ¦ī, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝Ļ│╝ ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņłśņłĀ Ēøä 1ņØ╝ņŚÉ Ļ░ÉņåīĒĢśņśĆļŗżĻ░Ć 2ņŻ╝ ĒøäļČĆĒä░ļŖö ņłĀ ņĀäĻ│╝ Ļ░ÖņØĆ ņāüĒā£ļĪ£ ļÅīņĢäņÖöņ£╝ļ®░ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śņÖĆ ļ¦Øļ¦ēĒśłĻ┤Ćļ░ĆļÅäļŖö ņ£ĀņØśĒĢ£ Ļ┤ĆĻ│äĻ░Ć ņŚåņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś ņłĀ ņĀä ĒÅēĻĘĀ ņĢłņČĢņןņØĆ 23.34 ┬▒ 0.73 mm, ĒÅēĻĘĀ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö 0.38 ┬▒ 2.32 DļĪ£ Ļ│ĀļÅäĻĘ╝ņŗ£ņØś ļ│æņĀüļ│ĆĒÖöĻ░Ć ļ¦Øļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅäņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ļ░░ņĀ£ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö ļ░▒ļé┤ņןņłśņłĀ Ēøä 6Ļ░£ņøöņŚÉ -0.01 ┬▒ 0.58 DļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆņ£╝ļéś(p=0.021), ļ░▒ļé┤ņןņłśņłĀ 6Ļ░£ņøö ĒøäņØś ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śņØś ļ│ĆĒÖöņÖĆ SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż.
Alaghband et al [24]ņŚÉ ļö░ļź┤ļ®┤ ļ░▒ļé┤ņןņłśņłĀņØĆ ļ░®ņłśņØś ņä¼ņ£ĀņŻ╝ņ£ĀņČ£ļźĀņØä ņ”ØĻ░Ćņŗ£ņ╝£ ņĢłņĢĢņØś Ļ░Éņåīļź╝ ņØ╝ņ£╝Ēé©ļŗżĻ│Ā ĒĢ£ļŗż. Weigert et al [25]ņØĆ ņĢłņĀĆņØś ļ¦źļ░Ģ ņ¦äĒÅŁņØ┤ ņĢłņĢĢ ņ”ØĻ░ĆļĪ£ ņØĖĒĢ┤ Ļ░ÉņåīĒĢ©ņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░, Zhao et al [13]ņØĆ ļ░▒ļé┤ņןņłśņłĀ Ēøä ļ░£ņāØĒĢ£ ņĢłņĢĢĻ░ÉņåīĻ░Ć ĒÖ®ļ░śņØś Ēśłļźś ļ│ĆĒÖöņŚÉ ņśüĒ¢źņØä ļü╝ņ│żņØä Ļ░ĆļŖźņä▒ņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. Zhou et al [14]ņØĆ ļ░▒ļé┤ņןņłśņłĀ Ēøä ņ£ĀņØśĒĢ£ ņĢłņĢĢ Ļ░Éņåīļź╝ ĒÖĢņØĖĒĢśņśĆņ£╝ļéś ĒÖ®ļ░śņØś Ēśłļźś ļ│ĆĒÖöņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äļŖö ņŚåņŚłņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÅēĻĘĀ ņĢłņĢĢņØĆ ņłĀ ņĀä 14.46 ┬▒ 3.07 mmHgņŚÉņä£ 1ņŻ╝ Ēøä 11.02 ┬▒ 2.89 mmHgņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆĻ│Ā 6Ļ░£ņøö ĒøäņŚÉļÅä 11.68 ┬▒ 3.01 mmHgņ£╝ļĪ£ Ļ░ÉņåīļÉ£ ņ▒ä ņ£Āņ¦ĆļÉśņŚłņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż. ĒĢśņ¦Ćļ¦ī ļ░▒ļé┤ņןņłśņłĀ 6Ļ░£ņøö Ēøä ņĢłņĢĢņØś ļ│ĆĒÖöņÖĆ SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż.
ĻĘĖ ņÖĖņŚÉļÅä, ļ░▒ļé┤ņןņłśņłĀ Ēøä ņŚ╝ņ”Ø ļ░śņØæņŚÉ ņØśĒĢ£ ņśüĒ¢źņØä ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. ņØ┤ņĀäņØś ņłśņĀĢņ▓┤ ņĀüņČ£ņłĀņØä ņŗ£Ē¢ēĒĢ£ ņźÉ ņŚ░ĻĄ¼ņŚÉņä£ ņłĀ Ēøä interleukin-1├¤, chemokine ligand 2ņÖĆ Ļ░ÖņØĆ ņĀäņŚ╝ņ”Øņä▒ ņ£ĀņĀäņ×ÉņØś ļ░£ĒśäņØ┤ ņ”ØĻ░ĆĒĢ©ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[26]. ļ░▒ļé┤ņןņłśņłĀ Ēøä ņŚ╝ņ”Ø ļ░śņØæņ£╝ļĪ£ ĒöäļĪ£ņŖżĒāĆĻĖĆļ×ĆļöśņØś ļ░®ņČ£ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ļ░®ņłśņŚÉ ĒöäļĪ£ņŖżĒāĆĻĖĆļ×ĆļöśņØ┤ ļČäļ╣äļÉśļŖöļŹ░, ņØ┤ļĪ£ ņØĖĒĢ┤ ĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØ┤ ĒīīĻ┤┤ļÉśļ®┤ ņ£Āļ”¼ņ▓┤Ļ│ĄĻ░ä ļé┤ļĪ£ ņŚ╝ņ”Øļ¼╝ņ¦łņØ┤ ĒŹ╝ņ¦Ćļ®┤ņä£ ļ¦Øļ¦ēņŚÉ ņ×Āņ×¼ņĀüņØĖ ļ│ĆĒÖöļź╝ ņØ╝ņ£╝Ēé¼ ņłś ņ׳Ļ▓ī ļÉ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[27,28]. ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░śļæÉĻ╗śĻ░Ć ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░, ņłĀ Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ļéŁĒżĒÖ®ļ░śļČĆņóģņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[3,4]. Perente et al [3]ņØĆ ļ░▒ļé┤ņןņłśņłĀ Ēøä 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ņØś ļ¦Øļ¦ēļæÉĻ╗śĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņØīņØä ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, Zhao et al [13]ņØĆ ļ░▒ļé┤ņןņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøöņŚÉ ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä ļ¦Øļ¦ēļæÉĻ╗śĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░ ĒŖ╣Ē׳ ļé┤Ļ▓ĮĻ│äļ¦ēĻ│╝ ļé┤ļ¦ØņāüņĖĄ ņé¼ņØ┤ ļæÉĻ╗śĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä Ļ░ü ņśüņŚŁļ│ä ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śļŖö ļ░▒ļé┤ņן ņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒ¢łļŗż. ĻĘĖļ¤¼ļéś ņØ┤ļ¤¼ĒĢ£ ņ”ØĻ░ĆļŖö ņłśņłĀ Ēøä 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøöņŚÉ ĒÖ®ļ░ś SCP, DCP ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆņÖĆ Ļ░üĻ░ü ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłĻ│Ā, 6Ļ░£ņøö Ēøä ņżæņŗ¼ņśżļ¬® DCP ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ņØīņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłņ£╝ļéś, ļŗżņżæĒÜīĻĘĆļČäņäØņŚÉņä£ļŖö ņŚ░Ļ┤Ćņä▒ņØ┤ ņŚåņŚłļŗż. Yu et al [19]ņØĆ ļ░▒ļé┤ņןņłśņłĀ Ēøä ņ”ØĻ░ĆĒĢ£ ņé░ņåīņåīļ╣äļ¤ēņØä ļ│┤ņāüĒĢśĻĖ░ ņ£äĒĢ┤ ļ¦Øļ¦ēĒśłĻ┤ĆņØś ĻĄ¼Ļ▓ĮņØĆ ļ│ĆĒÖöĒĢśņ¦Ć ņĢŖĻ│Ā ņé░ņåīĒżĒÖöļÅäņÖĆ Ēśłļźś ņåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņĢśņ£╝ļ®░, ļĀłņØ┤ņĀĆ ĒöīļĀłņ¢┤ ņĖĪĻ┤æĻ▓Ćņé¼(laser flare photometry) Ļ▓░Ļ│╝ ņłĀ Ēøä ņŚ╝ņ”Øņ£╝ļĪ£ ņØĖĒĢ£ ļ░®ņłśĒØÉļ”╝(flare)ņØĆ ņśżĒ׳ļĀż SQIļź╝ Ļ░Éņåīņŗ£ņ╝£ ĒÖ®ļ░ś ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ņØīņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļéśĒāĆļé┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£ ņØ┤ļ¤¼ĒĢ£ ņĀäļ░®ņØś ļ░®ņłśĒØÉļ”╝(flare)ņØĆ ĒĢ£ ļŗ¼ ņØ┤ĒøäņŚÉļŖö ļŗżņŗ£ ņłĀ ņĀäĻ│╝ Ļ░ÖņØĆ ņāüĒā£ļĪ£ ļÅīņĢäņśżļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[29]. ļö░ļØ╝ņä£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ņŚ╝ņ”Ø ļ░śņØæņØĆ ņłśņłĀ Ēøä ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆņÖĆ Ļ┤ĆļĀ©ņØ┤ ņŚåņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ļ¦Øļ¦ēņŚÉ ļ»Ėņ╣śļŖö ļ╣ø ļÅģņä▒ņØś ņ”ØĻ░ĆļĪ£ ņØĖĒĢ£ ņןĻĖ░ņĀüņØĖ ņśüĒ¢źņØä Ļ│ĀļĀżĒĢ┤ļ│╝ ņłś ņ׳ļŖöļŹ░, ļ░▒ļé┤ņןņØĆ ļ¦Øļ¦ēņ£╝ļĪ£ Ļ░ĆļŖö ļ╣øņØś 18-40%ļź╝ ņ░©ļŗ©ĒĢśļ®░ ļ░▒ļé┤ņןņłśņłĀņØä ĒĢśļ®┤ ļ¦Øļ¦ēņŚÉ ļÅäļŗ¼ĒĢśļŖö ļ╣øņØ┤ ņ”ØĻ░ĆĒĢ£ļŗż[30]. ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ļ╣ø ļÅģņä▒ņØĆ ļ¦Øļ¦ēņØś ļīĆņé¼ļź╝ ĒÖ£ņä▒ĒÖöņŗ£ĒéżĻ│Ā ĒśłĻ┤ĆņŗĀņāØņØä ņ┤ēņ¦äĒĢśļ®░, ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ņØś ļ░£ņāØļźĀ ņ”ØĻ░ĆņÖĆļÅä Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[31,32]. ļ░▒ļé┤ņןņłśņłĀ Ēøä ņ”ØĻ░ĆļÉ£ ļ╣ø ļÅģņä▒ņØĆ ļ¦Øļ¦ēņØś ĒśłļźśņŚÉ ņןĻĖ░ņĀüņ£╝ļĪ£ ņśüĒ¢źņØä ļü╝ņ╣Ā Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļéś ņØ┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ĒĢśņ¦Ć ļ¬╗ĒĢśņśĆņ£╝ļ®░ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤ ļ░Å ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅäļŖö ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ļŗ¼ļ”¼ ņ£ĀņØśļ»ĖĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŖöļŹ░ ņØ┤ļŖö RPCņÖĆ ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒĢ┤ļČĆĒĢÖņĀü ņ░©ņØ┤ņÖĆ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņŚÉ ņØśĒĢ£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņśüņŚŁ ĒśłĻ┤Ćļ░ĆļÅä ņĖĪņĀĢņØś ļé«ņØĆ ņ×¼Ēśäņä▒ņŚÉ ĻĖ░ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż. RPCļŖö ĒśłĻ┤Ć ļ¬©ņ¢æņØ┤ Ļ│¦Ļ│Ā ĻĖĖļ®░ ļ¼ĖĒĢ®ņØ┤ ļō£ļ¼╝Ļ│Ā ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄņŚÉ ņ£äņ╣śĒĢ£ļŗż[33]. ņØ┤ļ¤░ ĒĢ┤ļČĆĒĢÖņĀü ĒŖ╣ņ¦Ģņ£╝ļĪ£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀļĪ£ ņĖĪņĀĢļÉ£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ļ░▒ļé┤ņןņłśņłĀ Ēøä SQI ļ│ĆĒÖöņŚÉ ņśüĒ¢źņØä ļŹ£ ļ░øņĢśņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. Lim et al [34]ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝, ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņŚÉ ņØśĒĢ£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņśüņŚŁ ĒśłĻ┤Ćļ░ĆļÅä ņĖĪņĀĢņØĆ ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä ņĖĪņĀĢņŚÉ ļ╣äĒĢ┤ ņ×¼Ēśäņä▒ņØ┤ ļé«ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŖöļŹ░, ņØ┤ļĪ£ ņØĖĒĢ┤ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ļ│Ė ņŚ░ĻĄ¼ļŖö ņĀüņØĆ ņłśņØś ĒÖśņ×ÉĻĄ░ņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀüņ£╝ļĪ£ ņŗżņŗ£ĒĢśņśĆļŗżļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ņ¢┤ ļ░▒ļé┤ņןņłśņłĀ Ēøä ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤ ļ░Å ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöļŖö Ē¢źĒøä ļŹö ļ¦ÄņØĆ ņłśņØś ĒÖśņ×ÉĻĄ░ņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ļ░▒ļé┤ņןņłśņłĀ Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņłĀ ņĀä ĒÅēĻĘĀ 0.35 ┬▒ 0.13 logMARņŚÉņä£ ņłĀ Ēøä 6Ļ░£ņøöņŚÉ 0.16 ┬▒ 0.14 logMARļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ļ│ĆĒÖöņÖĆ ĒÖ®ļ░ś SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆļŖö ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņŚłļŗż. ļö░ļØ╝ņä£ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆĻ░Ć ņłśņłĀ Ēøä ņŗ£ļĀź ĒśĖņĀäņŚÉļŖö ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖņĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░ś SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£äņŚÉņä£ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļŖö 6Ļ░£ņøö ĒøäņŚÉļÅä ņ£Āņ¦ĆļÉśņŚłļŗż. ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤ ļ░Å ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅäņÖĆ FAZ ļ®┤ņĀüņØĆ ļ░▒ļé┤ņןņłśņłĀ Ēøä ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļ░▒ļé┤ņןņłśņłĀ Ēøä ņłśņĀĢņ▓┤Ēś╝ĒāüņØś ņĀ£Ļ▒░ņŚÉ ļö░ļźĖ SQI ņ”ØĻ░ĆļŖö ņłĀ Ēøä ņĖĪņĀĢļÉ£ ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäņØś ņ”ØĻ░ĆņŚÉ ņ£ĀņØśĒĢ£ ņśüĒ¢źņØä ļ»Ėņ│żņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļ®░, ļ░▒ļé┤ņןņłśņłĀ ņĀäĒøä ļ╣øĻ░äņäŁĒśłĻ┤ĆņĪ░ņśüņłĀ ņ┤¼ņśü ņŗ£ ņØ┤ļź╝ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ĒĢ£Ļ│äņĀÉņ£╝ļĪ£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀ Ļ▓Ćņé¼ ņŗ£ņŚÉ Ēł¼ņé¼ ĒÜ©Ļ│╝(projection artifact)ņŚÉ ņØśĒĢ┤ SCPņØś ĒśłĻ┤ĆņØ┤ DCPņŚÉ ļ╣äņ│ÉņĀĖ FAZņØś ņĀĢĒÖĢĒĢ£ ļ®┤ņĀüņØä ĻĄ¼ĒĢśĻ│Ā ĒÖ®ļ░śņØś ļ»ĖņäĖĒśłĻ┤Ć ļ│ĆĒÖöļź╝ Ļ░Éņ¦ĆĒĢśļŖö ļŹ░ņŚÉ ņśüĒ¢źņØä ļü╝ņ│żņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļ®░, Ē¢źĒøä Ēł¼ņé¼ ĒÜ©Ļ│╝ļź╝ ļ░░ņĀ£ĒĢĀ ņłś ņ׳ļŖö ĻĖ░ņłĀņĀü ļ░£ņĀäņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż[35]. ļśÉĒĢ£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢ£ ĒśłĻ┤Ćļ░ĆļÅä ņĖĪņĀĢņØś ņ×¼Ēśäņä▒ņØä ņŚ░ĻĄ¼ĒĢ£ Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤, ņØ╝ņżæ ļ│ĆļÅÖņ£╝ļĪ£ ņĖĪņĀĢ ņŗ£Ļ░äņŚÉ ļö░ļØ╝ SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ¬©ļæÉ Ļ░üĻ░ü ņĄ£ļīĆ 8%, 10%ņØś ņ░©ņØ┤ļź╝ ļ│┤ņØ╝ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŖöļŹ░ ņØ┤ ņĀÉņŚÉ ļīĆĒĢ┤ņä£ Ļ│ĀļĀżĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż[36]. ļśÉĒĢ£ ņ¦äĒ¢ēļÉ£ ļ░▒ļé┤ņןņØ╝ņłśļĪØ ņłĀ ĒøäņŚ╝ņ”Ø ļ░śņØæņØ┤ ņŗ¼ĒĢśĻ│Ā ņłśņłĀ ņĀäĒøä SQI ļ│ĆĒÖöĻ░Ć ņ╗żņä£ ĒśłĻ┤Ćļ░ĆļÅäļ│ĆĒÖöĻ░Ć Ēü┤ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢśņśĆņ£╝ļéś, ļ░▒ļé┤ņן ņ¦äĒ¢ē ņĀĢļÅäļŖö ĒøäļéŁĒĢśļ░▒ļé┤ņןĻ│╝ ņłśņłĀ 1ņŻ╝ Ēøä ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝ DCP, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä DCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö, Ēö╝ņ¦łļ░▒ļé┤ņןĻ│╝ 3Ļ░£ņøö Ēøä ņżæņŗ¼ņśżļ¬® SCPņØś ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖö ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłļŹś Ļ▓ā ņÖĖņŚÉ ļéśļ©Ėņ¦Ć ņśüņŚŁņŚÉņä£ļŖö 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ ĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöļ¤ēĻ│╝ ļ¬©ļæÉ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņ¢┤ Yu et al [19]ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆļŖö ļŗżļź┤Ļ▓ī ļéśĒāĆļé¼ļŗż. ņØ┤ļŖö LOCS III ļČäļźśņāü ĒÅēĻĘĀ Ēö╝ņ¦łļ░▒ļé┤ņן 3, ĒĢĄļ░▒ļé┤ņן 4, ĒøäļéŁĒĢśļ░▒ļé┤ņן 4ņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Yu et al [19]Ļ│╝ļŖö ļŗ¼ļ”¼ ļ│ĖņøÉņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö SQIĻ░Ć 4 ļ»Ėļ¦īņØĖ ĒÖśņ×ÉļŖö ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢ©ņŚÉ ļö░ļØ╝ LOCS III ļČäļźśņāü ĒÅēĻĘĀ Ēö╝ņ¦łļ░▒ļé┤ņן 1.96 ┬▒ 1.33, ĒĢĄļ░▒ļé┤ņן 2.27 ┬▒ 1.32, ĒøäļéŁĒĢśļ░▒ļé┤ņן 0.33 ┬▒ 0.76ņ£╝ļĪ£ ņāüļīĆņĀüņ£╝ļĪ£ Ļ▓ĮĒĢ£ ĒÖśņ×ÉĻĄ░ņØä ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ĒĢ©ņŚÉ ļö░ļØ╝ Ēæ£ļ│ĖņäĀņĀĢĒÄĖĒīīņØś ņśüĒ¢źņØ┤ ņ׳ņŚłņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ĻĘĖļ”¼Ļ│Ā Ēøäļ░£ ļ░▒ļé┤ņןņØĆ SQIņŚÉ ņśüĒ¢źņØä ļ»Ėņ│É ĒÖ®ļ░ś ĒśłĻ┤Ćļ░ĆļÅä ņĖĪņĀĢņŚÉ ņśüĒ¢źņØä ņżä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļéś ļ│Ė ņŚ░ĻĄ¼ļŖö ņØśļ¼┤ĻĖ░ļĪØņØä ĒåĄĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ Ēøäļ░£ļ░▒ļé┤ņן ņĀĢļÅäņŚÉ ļīĆĒĢ£ ĻĖ░ņłĀņØ┤ ņŚåļŖö ĒÖśņ×ÉĻ░Ć ļīĆļČĆļČäņØ┤ņ¢┤ņä£ ņØ┤ņŚÉ ļīĆĒĢ£ ļČäņäØņØĆ ņŗ£Ē¢ēĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. ļ░▒ļé┤ņןņłśņłĀ Ēøä 6Ļ░£ņøöņØś ĻĖ░Ļ░ä ļÅÖņĢł Ēøäļ░£ļ░▒ļé┤ņןņ£╝ļĪ£ ņĢ╝ĻĘĖļĀłņØ┤ņĀĆĒøäļéŁņĀłĻ░£ņłĀņØä ņŗ£Ē¢ēĒĢ£ ņé¼ļĪĆļŖö ņŚåņŚłļŖöļŹ░, Ē¢źĒøä ņĢ╝ĻĘĖļĀłņØ┤ņĀĆĒøäļéŁņĀłĻ░£ņłĀ ņĀäĒøä ĒÖ®ļ░ś ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ć ļ░ĆļÅä ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ļŖö ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļ░▒ļé┤ņןņłśņłĀ Ēøä ĒÖ®ļ░śņØś SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅä, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤ņÖĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅä, FAZ ļ®┤ņĀüņØś ļ│ĆĒÖöļź╝ Ļ░üĻ░ü ņĀĢļ¤ēņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļé┤, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ņ£ä ĒśłĻ┤Ćļ░ĆļÅäņÖĆ FAZ ļ®┤ņĀüņØĆ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć ļéśĒāĆļéśņ¦Ć ņĢŖņĢśņ£╝ļ®░ ĒÖ®ļ░ś SCPņÖĆ DCPņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņżæņŗ¼ņśżļ¬®, ņżæņŗ¼ņśżļ¬®ļČĆĻĘ╝, ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä ņäĖ ņśüņŚŁņŚÉņä£ ļ░▒ļé┤ņןņłśņłĀ 1ņŻ╝ Ēøä, 1Ļ░£ņøö Ēøä, 3Ļ░£ņøö Ēøä, 6Ļ░£ņøö ĒøäņŚÉ ļ¬©ļæÉ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆļÉśņŚłņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.
Figure┬Ā1.
Scatter plots for correlation between change in scan quality index (╬öSQI) and change in vessel density (╬öVD) 6 months after cataract surgery. There was significant correlation between ╬öSQI and ╬öVD. (A) Correlation between ╬öSQI and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = 0.425, p = 0.038). (B) Correlation between ╬öSQI and ╬öVD of fovea deep capillary plexus (DCP) (Žü = 0.509, p = 0.011). (C) Correlation between ╬öSQI and ╬öVD of parafovea SCP (Žü = 0.897, p <0.001). (D) Correlation between ╬öSQI and ╬öVD of parafovea DCP (Žü = 0.448, p = 0.028). (E) Correlation between ╬öSQI and ╬öVD of perifovea SCP (Žü = 0.779, p <0.001). (F) Correlation between ╬öSQI and ╬öVD of perifovea DCP (Žü = 0.638, p = 0.001). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.

Figure┬Ā2.
Scatter plots for correlation between change in spherical equivalent (╬öSE) and change in vessel density (╬öVD) 6 months after cataract surgery. There was no significant correlation between ╬öSE and ╬öVD. (A) Correlation between ╬öSE and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = -0.370, p = 0.099). (B) Correlation between ╬öSE and ╬öVD of fovea deep capillary plexus (DCP) (Žü = -0.105, p = 0.651). (C) Correlation between ╬öSE and ╬öVD of parafovea SCP (Žü = 0.317, p = 0.161). (D) Correlation between ╬öSE and ╬öVD of parafovea DCP (Žü = 0.250, p = 0.275). (E) Correlation between ╬öSE and ╬öVD of perifovea SCP (Žü = 0.422, p = 0.056). (F) Correlation between ╬öSE and ╬öVD of perifovea DCP (Žü = 0.321, p = 0.156). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.

Figure┬Ā3.
Scatter plots for correlation between change in intraocular pressure (╬öIOP) and change in vessel density (╬öVD) 6 months after cataract surgery. There was no significant correlation between ╬öIOP and ╬öVD. (A) Correlation between ╬öIOP and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = 0.311, p = 0.139). (B) Correlation between ╬öIOP and ╬öVD of fovea deep capillary plexus (DCP) (Žü = 0.088, p = 0.684). (C) Correlation between ╬öIOP and ╬öVD of parafovea SCP (Žü = 0.072, p = 0.739). (D) Correlation between ╬öIOP and ╬öVD of parafovea DCP (Žü = 0.093, p = 0.667). (E) Correlation between ╬öIOP and ╬öVD of perifovea SCP (Žü = 0.061, p = 0.777). (F) Correlation between ╬öIOP and ╬öVD of perifovea DCP (Žü = 0.004, p = 0.984). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.
Figure┬Ā4.
Scatter plots for correlation between cortical cataract and change in vessel density (╬öVD) 6 months after cataract surgery. There was no significant correlation between cortical cataract and ╬öVD. (A) Correlation between cortical cataract and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = 0.179, p = 0.403). (B) Correlation between cortical cataract and ╬öVD of fovea deep capillary plexus (DCP) (Žü = 0.148, p = 0.490). (C) Correlation between cortical cataract and ╬öVD of parafovea SCP (Žü = -0.085, p = 0.693). (D) Correlation between cortical cataract and ╬öVD of parafovea DCP (Žü = 0.159, p = 0.459). (E) Correlation between cortical cataract and ╬öVD of perifovea SCP (Žü = -0.103, p = 0.631). (F) Correlation between cortical cataract and ╬öVD of perifovea DCP (Žü = -0.011, p = 0.960). Spearman rank correlation analysis was used to evaluate the relationship between variables. LOCS = Lens Opacities Classification System; Žü = coefficient of correlation.
Figure┬Ā5.
Scatter plots for correlation between nuclear cataract and change in vessel density (╬öVD) 6 months after cataract surgery. There was no significant correlation between nuclear cataract and ╬öVD. (A) Correlation between nuclear cataract and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = 0.021, p = 0.924). (B) Correlation between nuclear cataract and ╬öVD of fovea deep capillary plexus (DCP) (Žü = 0.042, p = 0.846). (C) Correlation between nuclear cataract and ╬öVD of parafovea SCP (Žü = 0.117, p = 0.585). (D) Correlation between nuclear cataract and ╬öVD of parafovea DCP (Žü = 0.042, p = 0.846). (E) Correlation between nuclear cataract and ╬öVD of perifovea SCP (Žü = 0.024, p = 0.912). (F) Correlation between nuclear cataract and ╬öVD of perifovea DCP (Žü = 0.020, p = 0.925). Spearman rank correlation analysis was used to evaluate the relationship between variables. LOCS = Lens Opacities Classification System; Žü = coefficient of correlation.

Figure┬Ā6.
Scatter plots for correlation between posterior subcapsular cataract and change in vessel density (╬öVD) 6 months after cataract surgery. There was no significant correlation between posterior subcapsular cataract and ╬öVD. (A) Correlation between posterior subcapsular cataract and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = 0.097, p = 0.652). (B) Correlation between posterior subcapsular cataract and ╬öVD of fovea deep capillary plexus (DCP) (Žü = 0.065, p = 0.764). (C) Correlation between posterior subcapsular cataract and ╬öVD of parafovea SCP (Žü = 0.000, p = 1.000). (D) Correlation between posterior subcapsular cataract and ╬öVD of parafovea DCP (Žü = 0.210, p = 0.325). (E) Correlation between posterior subcapsular cataract and ╬öVD of perifovea SCP (Žü = 0.186, p = 0.385). (F) Correlation between posterior subcapsular cataract and ╬öVD of perifovea DCP (Žü = 0.299, p = 0.156). Spearman rank correlation analysis was used to evaluate the relationship between variables. LOCS = Lens Opacities Classification System; Žü = coefficient of correlation.
Figure┬Ā7.
Scatter plots for correlation between change in retinal thickness (╬öretinal thickness) and change in vessel density (╬öVD) 6 months after cataract surgery. There was no significant correlation between ╬öretinal thickness and ╬öVD except in fovea deep capillary plexus (DCP). (A) Correlation between ╬öretinal thickness and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = -0.393, p = 0.058). (B) Correlation between ╬öretinal thickness and ╬öVD of fovea DCP (Žü = -0.572, p = 0.003). There was significant correlation between ╬öretinal thickness and ╬öVD of fovea DCP. (C) Correlation between ╬öretinal thickness and ╬öVD of parafovea SCP
(Žü = -0.310, p = 0.140). (D) Correlation between ╬öretinal thickness and ╬öVD of parafovea DCP (Žü = -0.257, p = 0.226). (E) Correlation between ╬öretinal thickness and ╬öVD of perifovea SCP (Žü = -0.140, p = 0.514). (F) Correlation between ╬öretinal thickness and ╬öVD of perifovea DCP (Žü = -0.335, p = 0.109). Spearman rank correlation analysis was used to evaluate the relationship between variables. Žü = coefficient of correlation.
Figure┬Ā8.
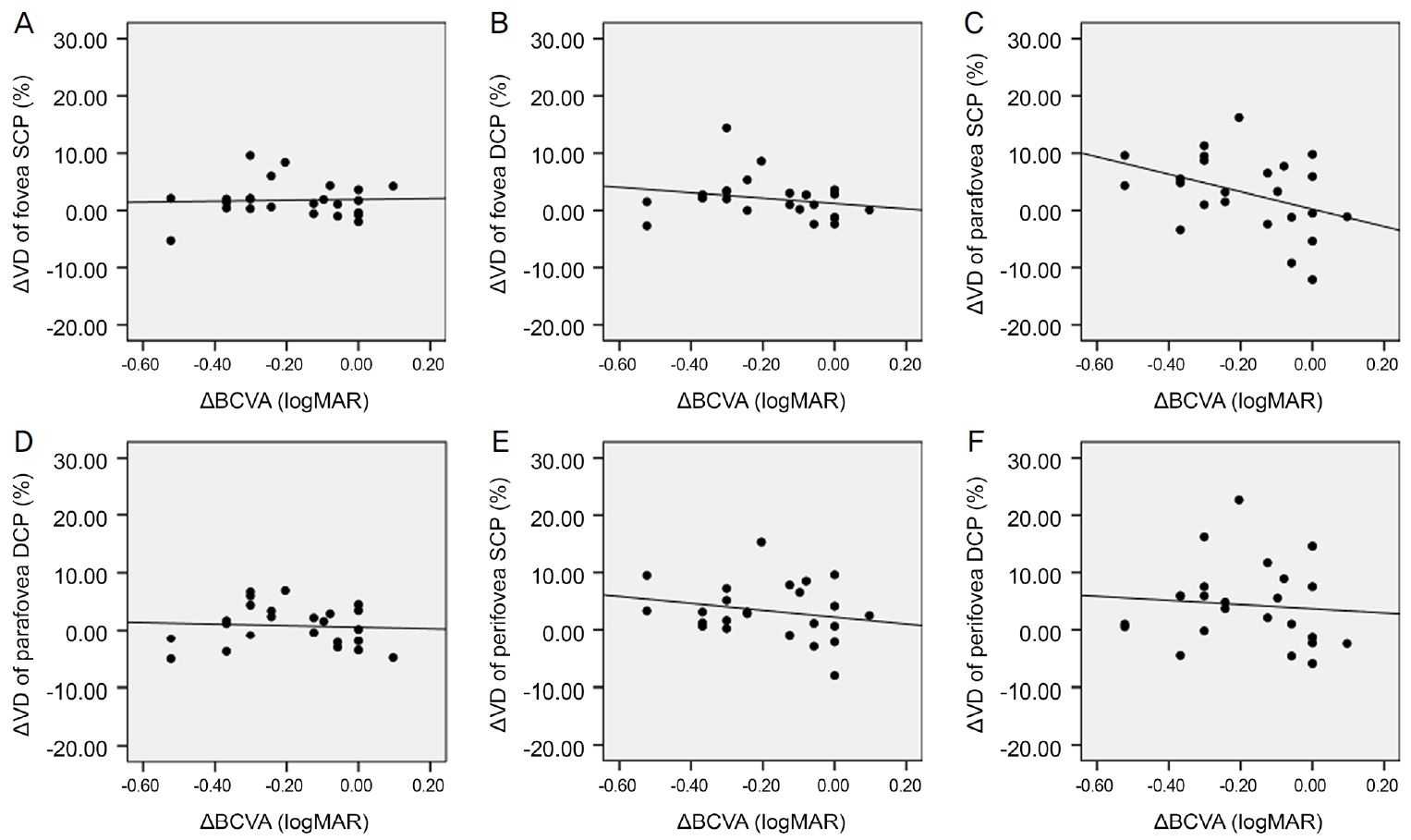
Scatter plots for correlation between change in best corrected visual acuity (╬öBCVA) and change in vessel density (╬öVD) 6 months after cataract surgery. There was no significant correlation between ╬öBCVA and ╬öVD. (A) Correlation between ╬öBCVA and ╬öVD of fovea superficial capillary plexus (SCP) (Žü = -0.092, p = 0.668). (B) Correlation between ╬öBCVA and ╬öVD of fovea deep capillary plexus (DCP) (Žü = -0.239, p = 0.260). (C) Correlation between ╬öBCVA and ╬öVD of parafovea SCP (Žü = -0.353, p = 0.090). (D) Correlation between ╬öBCVA and ╬öVD of parafovea DCP (Žü = -0.064, p = 0.765). (E) Correlation between ╬ö BCVA and ╬öVD of perifovea SCP (Žü = -0.203, p = 0.341). (F) Correlation between ╬öBCVA and ╬öVD of perifovea DCP (Žü = -0.165, p = 0.441). Spearman rank correlation analysis was used to evaluate the relationship between variables. logMAR = logarithm of minimal angle of resolution; Žü = coefficient of correlation.
Table┬Ā1.
Demographic characteristics and clinical features of the patients
Values are presented as mean ┬▒ standard deviation or number unless otherwise indicated.
OD:OS = ocular dexter:ocular sinister; LOCS III = lens opacities classification system III; BCVA = best corrected visual acuity; logMAR = logarithm of minimal angle of resolution; SQI = scan quality index; D = diopters; IOP = intraocular pressure.
Table┬Ā2.
Vessel density of macular capillary plexuses and foveal avascular zone at baseline and after cataract surgery
| Variable | Preop | Postop 1 week | Postop 1 month | Postop 3 months | Postop 6 months | p-value* |
|---|---|---|---|---|---|---|
| VD (%) | ||||||
| ŌĆāFovea S | 15.42 ┬▒ 6.61 | 17.84 ┬▒ 6.80 | 18.32 ┬▒ 5.58 | 17.15 ┬▒ 5.97 | 17.20 ┬▒ 6.21 | <0.001 |
| ŌĆāFovea D | 28.43 ┬▒ 7.62 | 30.95 ┬▒ 6.92 | 31.14 ┬▒ 6.18 | 29.88 ┬▒ 7.14 | 30.52 ┬▒ 7.06 | 0.001 |
| ŌĆāParafovea S | 47.28 ┬▒ 5.76 | 50.83 ┬▒ 6.28 | 51.93 ┬▒ 4.60 | 50.32 ┬▒ 6.07 | 50.34 ┬▒ 5.00 | 0.002 |
| ŌĆāParafovea D | 53.06 ┬▒ 3.89 | 53.54 ┬▒ 4.94 | 55.58 ┬▒ 3.67 | 53.05 ┬▒ 6.84 | 53.90 ┬▒ 4.20 | 0.014 |
| ŌĆāPerifovea S | 45.20 ┬▒ 5.01 | 48.52 ┬▒ 5.43 | 49.47 ┬▒ 4.93 | 48.36 ┬▒ 4.94 | 48.52 ┬▒ 4.32 | <0.001 |
| ŌĆāPerifovea D | 46.62 ┬▒ 5.89 | 50.10 ┬▒ 7.08 | 53.16 ┬▒ 5.47 | 49.59 ┬▒ 8.70 | 50.96 ┬▒ 5.57 | 0.002 |
| ŌĆāInside disc | 47.22 ┬▒ 4.57 | 50.08 ┬▒ 4.54 | 49.40 ┬▒ 4.63 | 48.59 ┬▒ 6.28 | 49.60 ┬▒ 4.93 | 0.068 |
| ŌĆāPeripapillary | 51.03 ┬▒ 4.06 | 50.68 ┬▒ 3.93 | 49.75 ┬▒ 4.14 | 50.25 ┬▒ 3.51 | 50.74 ┬▒ 3.64 | 0.332 |
| FAZ (mm2) | 0.37 ┬▒ 0.12 | 0.35 ┬▒ 0.11 | 0.37 ┬▒ 0.10 | 0.35 ┬▒ 0.10 | 0.36 ┬▒ 0.11 | 0.206 |
Table┬Ā3.
Values of parameters at baseline and after cataract surgery
| Variable | Preop | Postop 1 week | Postop 1 month | Postop 3 months | Postop 6 months | p-value* |
|---|---|---|---|---|---|---|
| Retinal thickness (╬╝m) | ||||||
| ŌĆāFovea | 240.13 ┬▒ 20.78 | 241.67 ┬▒ 21.70 | 247.25 ┬▒ 22.22 | 251.83 ┬▒ 23.12 | 250.58 ┬▒ 22.63 | <0.001 |
| ŌĆāParafovea | 310.75 ┬▒ 13.04 | 315.29 ┬▒ 14.25 | 320.71 ┬▒ 14.98 | 324.04 ┬▒ 15.22 | 322.96 ┬▒ 14.67 | <0.001 |
| ŌĆāPerifovea | 272.75 ┬▒ 13.55 | 275.88 ┬▒ 14.23 | 281.29 ┬▒ 14.83 | 284.42 ┬▒ 15.29 | 282.46 ┬▒ 14.74 | <0.001 |
| BCVA (logMAR) | 0.35 ┬▒ 0.13 | 0.16 ┬▒ 0.14 | 0.12 ┬▒ 0.12 | 0.14 ┬▒ 0.13 | 0.16 ┬▒ 0.14 | <0.001 |
| Retina SQI | 6.88 ┬▒ 1.15 | 7.96 ┬▒ 0.91 | 8.29 ┬▒ 0.81 | 7.79 ┬▒ 1.25 | 7.96 ┬▒ 1.00 | <0.001 |
| Disc SQI | 7.25 ┬▒ 1.26 | 8.25 ┬▒ 1.03 | 8.58 ┬▒ 0.72 | 8.21 ┬▒ 0.88 | 8.33 ┬▒ 0.82 | <0.001 |
| SE (D) | 0.38 ┬▒ 2.32 | -0.04 ┬▒ 0.74 | -0.02 ┬▒ 0.55 | -0.04 ┬▒ 0.57 | -0.01 ┬▒ 0.58 | 0.021 |
| IOP (mmHg) | 14.46 ┬▒ 3.07 | 11.02 ┬▒ 2.89 | 11.57 ┬▒ 2.86 | 11.84 ┬▒ 2.69 | 11.68 ┬▒ 3.01 | <0.001 |
Table┬Ā4.
The relationship between parameters and changes of mean vessel density after cataract surgery
| Variable |
Fovea SCP ΔVD |
Fovea DCP ΔVD |
Parafovea SCP ΔVD |
Parafovea DCP ΔVD |
Perifovea SCP ΔVD |
Perifovea DCP ΔVD |
||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| B | p-value* | B | p-value* | B | p-value* | B | p-value* | B | p-value* | B | p-value* | |
| ΔSQI | 0.899 | <0.001 | 1.089 | <0.001 | 3.918 | <0.001 | 2.063 | <0.001 | 2.669 | <0.001 | 4.354 | <0.001 |
| C | 0.574 | 0.037 | 0.605 | 0.075 | 0.011 | 0.976 | 0.629 | 0.140 | -0.209 | 0.467 | 0.759 | 0.178 |
| N | -0.170 | 0.534 | -0.212 | 0.531 | -0.424 | 0.225 | -0.204 | 0.633 | -0.885 | 0.003 | -1.184 | 0.037 |
| P | -0.230 | 0.547 | -0.603 | 0.205 | -0.859 | 0.077 | 0.469 | 0.428 | 0.512 | 0.210 | 1.521 | 0.058 |
| ΔRetinal thickness (μm) | -0.066 | 0.124 | -0.130 | 0.016 | -0.015 | 0.796 | 0.070 | 0.309 | 0.028 | 0.573 | 0.080 | 0.414 |
| Regression equation (R2)* | 0.262 | 0.290 | 0.725 | 0.325 | 0.649 | 0.562 | ||||||
| p-value* | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | ||||||
Values are presented as coefficient and p-value of each parameter.
SCP = superficial capillary plexus; ΔVD = change of mean vessel density; DCP = deep capillary plexus; B = coefficient of multiple regression analysis; ΔSQI = change of mean scan quality index; C = cortical cataract; N = nuclear cataract; P = posterior subcapsular cataract.
REFERENCES
2) Porela-Tiihonen S, Kaarniranta K, Kokki M, Kokki H. Recovery and patient satisfaction after cataract surgery. A one-year prospective follow-up study. Acta Ophthalmol 2015;93:e172-3.


3) Perente I, Utine CA, Ozturker C, et al. Evaluation of macular changes after uncomplicated phacoemulsification surgery by optical coherence tomography. Curr Eye Res 2007;32:241-7.


4) Lobo CL, Faria PM, Soares MA, et al. Macular alterations after small-incision cataract surgery. J Cataract Refract Surg 2004;30:752-60.


5) El-Ashry M, Appaswamy S, Deokule S, Pagliarini S. The effect of phacoemulsification cataract surgery on the measurement of retinal nerve fiber layer thickness using optical coherence tomography. Curr Eye Res 2006;31:409-13.


6) Ohsugi H, Ikuno Y, Ohara Z, et al. Changes in choroidal thickness after cataract surgery. J Cataract Refract Surg 2014;40:184-91.


7) Shahzad R, Siddiqui MAR, Zafar S, et al. Choroidal thickness changes following cataract surgery using swept source optical coherence tomography. Can J Ophthalmol 2018;53:60-4.


8) Mansberger SL, Gordon MO, Jampel H, et al. Reduction in intraocular pressure after cataract extraction: the Ocular Hypertension Treatment Study. Ophthalmology 2012;119:1826-31.



9) Hilton EJ, Hosking SL, Gherghel D, et al. Beneficial effects of small-incision cataract surgery in patients demonstrating reduced ocular blood flow characteristics. Eye (Lond) 2005;19:670-5.


10) Spaide RF, Klancnik JM Jr, Cooney MJ. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomography angiography. JAMA Ophthalmol 2015;133:45-50.


11) Kashani AH, Chen CL, Gahm JK, et al. Optical coherence tomography angiography: a comprehensive review of current methods and clinical applications. Prog Retin Eye Res 2017;60:66-100.



12) Kim AY, Chu Z, Shahidzadeh A, et al. Quantifying microvascular density and morphology in diabetic retinopathy using spectral-domain optical coherence tomography angiography. Invest Ophthalmol Vis Sci 2016;57:OCT362-70.



13) Zhao Z, Wen W, Jiang C, Lu Y. Changes in macular vasculature after uncomplicated phacoemulsification surgery: optical coherence tomography angiography study. J Cataract Refract Surg 2018;44:453-8.


14) Zhou Y, Zhou M, Wang Y, et al. Short-term changes in retinal vasculature and layer thickness after phacoemulsification surgery. Curr Eye Res 2020;45:31-7.


15) Hsiao CC, Yang CM, Yang CH, et al. Correlations between visual acuity and macular microvasculature quantified with optical coherence tomography angiography in diabetic macular oedema. Eye (Lond) 2020;34:544-52.


16) Winegarner A, Wakabayashi T, Fukushima Y, et al. Changes in retinal microvasculature and visual acuity after antivascular endothelial growth factor therapy in retinal vein occlusion. Invest Ophthalmol Vis Sci 2018;59:2708-16.


17) Tan CS, Lim LW, Chow VS, et al. Optical coherence tomography angiography evaluation of the parafoveal vasculature and its relationship with ocular factors. Invest Ophthalmol Vis Sci 2016;57:OCT224-34.


18) Yarmohammadi A, Zangwill LM, Diniz-Filho A, et al. Optical coherence tomography angiography vessel density in healthy, glaucoma suspect, and glaucoma eyes. Invest Ophthalmol Vis Sci 2016;57:OCT451-9.



19) Yu S, Frueh BE, Steinmair D, et al. Cataract significantly influences quantitative measurements on swept-source optical coherence tomography angiography imaging. PLoS One 2018;13:e0204501.



20) Lauermann JL, Woetzel AK, Treder M, et al. Prevalences of segmentation errors and motion artifacts in OCT-angiography differ among retinal diseases. Graefes Arch Clin Exp Ophthalmol 2018;256:1807-16.


21) Ali N, Sampson DM, Au Yong A, et al. Clinical validation of the RTVue optical coherence tomography angiography image quality indicators. Clin Exp Ophthalmol 2020;48:192-203.


22) Li M, Yang Y, Jiang H, et al. Retinal microvascular network and microcirculation assessments in high myopia. Am J Ophthalmol 2017;174:56-67.


23) Chen M, Dai J, Gong L. Changes in retinal vasculature and thickness after small incision lenticule extraction with optical coherence tomography angiography. J Ophthalmol 2019;2019:3693140.



24) Alaghband P, Beltran-Agull├│ L, Galvis EA, et al. Effect of phacoemulsification on facility of outflow. Br J Ophthalmol 2018;102:1520-6.



25) Weigert G, Findl O, Luksch A, et al. Effects of moderate changes in intraocular pressure on ocular hemodynamics in patients with primary open-angle glaucoma and healthy controls. Ophthalmology 2005;112:1337-42.


26) Xu H, Chen M, Forrester JV, Lois N. Cataract surgery induces retinal pro-inflammatory gene expression and protein secretion. Invest Ophthalmol Vis Sci 2011;52:249-55.


27) Miyake K, Ibaraki N. Prostaglandins and cystoid macular edema. Surv Ophthalmol 2002;47 Suppl 1:S203-18.


28) Schultz T, Joachim SC, Stellbogen M, Dick HB. Prostaglandin release during femtosecond laser-assisted cataract surgery: main inducer. J Refract Surg 2015;31:78-81.


29) Chee SP, Ti SE, Sivakumar M, Tan DT. Postoperative inflammation: extracapsular cataract extraction versus phacoemulsification. J Cataract Refract Surg 1999;25:1280-5.


30) Artigas JM, Felipe A, Navea A, et al. Spectral transmission of the human crystalline lens in adult and elderly persons: color and total transmission of visible light. Invest Ophthalmol Vis Sci 2012;53:4076-84.


31) Libre PE. Intraoperative light toxicity: a possible explanation for the association between cataract surgery and age-related macular degeneration. Am J Ophthalmol 2003;136:961.

32) Cugati S, Mitchell P, Rochtchina E, et al. Cataract surgery and the 10-year incidence of age-related maculopathy: the Blue Mountains Eye Study. Ophthalmology 2006;113:2020-5.


33) Vujosevic S, Muraca A, Gatti V, et al. Peripapillary microvascular and neural changes in diabetes mellitus: an OCT-Angiography Study. Invest Ophthalmol Vis Sci 2018;59:5074-81.


34) Lim CW, Cheng J, Tay ELT, et al. Optical coherence tomography angiography of the macula and optic nerve head: microvascular density and test-retest repeatability in normal subjects. BMC Ophthalmol 2018;18:315.



-
METRICS

-
- 1 Crossref
- 0 Scopus
- 2,863 View
- 106 Download
- Related articles




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



