유리체절제술 후 소수성 표면을 가진 친수성 아크릴 단초점 인공수정체의 지연성 혼탁
Late Opacification of a Hydrophilic Acrylic Monofocal Intraocular Lens with Hydrophobic Surface after Vitrectomy
Article information
Abstract
목적
증식당뇨망막병증 환자에서 2회 유리체절제술 후 소수성 표면을 가진 친수성 아크릴 단초점인공수정체 CT SPHERIS® 204에 지연성으로 혼탁이 발생한 증례를 보고하고자 한다.
증례요약
50세 남자 환자가 우안 시력저하를 주소로 내원하였다. 환자의 기저 질환은 당뇨였다. 내원하기 약 43개월 전 우안 유리체 출혈로 유리체절제술, 수정체초음파유화술 및 인공수정체(CT SPHERIS® 204)삽입술, 광응고술, 유리체강내 베바시주맙(Avastin®)주입술을 받았다. 수술 4개월 후 우안에 전방각 신생혈관과 유리체강내 재출혈이 있어 부분 유리체절제술, 전방 및 유리체강내 베바시주맙주입술을 시행하였다. 우안 시력저하로 내원했을 때 우안 최대교정시력은 0.1이었고, 세극등현미경검사상 인공수정체 광학부 표면에 과립성 백색 혼탁이 광범위하게 관찰되었다. 수정체낭과 함께 인공수정체를 제거하였고, 주사전자현미경과 에너지 분산 방사선 분광법을 시행하였다.
결론
본 증례는 소수성 표면을 가진 친수성 아크릴 단초점인공수정체 CT SPHERIS® 204에 지연성으로 혼탁이 발생한 최초의 보고이며, 당뇨망막병증 환자에서 이러한 유형의 인공수정체 사용에 주의할 필요가 있다.
Trans Abstract
Purpose
To report a case of late opacification of a hydrophilic acrylic monofocal intraocular lens (IOL) with a hydrophobic surface (CT SPHERIS® 204) after a second vitrectomy in a patient with proliferative diabetic retinopathy.
Case summary
A 50-year-old male with diabetes presented with decreased visual acuity in the right eye. He had undergone phacoemulsification and IOL (CT SPHERIS® 204) implantation, vitrectomy, endolaser photocoagulation, and intravitreal bevacizumab (Avastin®) injection due to vitreous hemorrhage in the right eye about 43 months prior. Four months after the surgery, presenting with recurrent vitreous hemorrhage and neovascularization of the angle, he underwent partial vitrectomy and intravitreal and intracameral bevacizumab (Avastin®) injection. The best-corrected visual acuity was 0.1 in the right eye when he presented with decreased visual acuity. Slit lamp examination of the right eye showed diffuse whitish granular opacity on the surface of the IOL. The IOL was explanted, together with the capsular bag, and examined using scanning electron microscopy and energy-dispersive X-ray spectroscopy.
Conclusions
This case is the first to report late opacification of a hydrophilic, acrylic monofocal IOL with a hydrophobic surface, the CT SPHERIS® 204. It is necessary to be cautious in using this type of lens in patients with diabetic retinopathy.
백내장수술 기법이 발전하면서 백내장적출술 후 인공수정체를 삽입하게 되었으며, 1949년 영국의 Harold Ridley가 지지부가 없는 원형 형태의 polymethyl methacrylate (PMMA) 재질 인공수정체를 최초로 제작하여 수정체낭 내에 삽입하였다[1]. 이후 PMMA 이외에도 실리콘, 아크릴, 하이드로겔 재질이 사용되면서 다양한 인공수정체가 개발되었다[2].
친수성 아크릴 인공수정체의 혼탁에 대한 다양한 보고가 있었으며, 제조사들은 친수성 아크릴 인공수정체 혼탁의 위험성에 대한 인식을 하게 되어 친수성 아크릴에 소수성 표면 성질을 갖는 인공수정체를 개발하였다[3]. 하지만 소수성 표면을 가진 친수성 아크릴 인공수정체에서도 다양한 혼탁의 증례가 보고되었다. 보고된 증례에서 인공수정체 혼탁과 기저 질환의 연관성을 제시하기도 하였고, 제조 공정이나 재료 자체의 문제, 수술 후 전방 내 대사 변화, 급격한 온도 변화와 기체 응축 등을 혼탁의 원인으로 추정하였다[4-8].
CT SPHERIS® 204 (Carl Zeiss Meditec AG, Jena, Germany)는 소수성 표면을 가진 친수성 아크릴 재질의 구면 단초점인공수정체로 광학부 직경은 6.0 mm, 전체 직경은 11.0 mm이며, 접을 수 있는 일체형의 구조로 되어 있다. 지금까지 CT SPHERIS® 204 (Carl Zeiss Meditec AG)에서 침착물로 인해 혼탁이 발생한 증례는 없다. 따라서 저자들은 2회의 유리체절제술 후 지연성으로 소수성 표면을 가진 친수성 아크릴 재질의 인공수정체 CT SPHERIS® 204 (Carl Zeiss Meditec AG)에 칼슘, 인, 마그네슘, 아연, 불소로 구성된 침착물로 인해 혼탁이 발생한 1예를 보고하고자 한다.
증례보고
50세 남자 환자가 우안 시력저하를 주소로 내원하였다. 환자는 당뇨 이외에 전신 질환의 병력이 없었다. 내원하기 약 43개월 전 우안 증식당뇨망막병증에 의한 유리체출혈로 유리체절제술, 수정체초음파유화술 및 인공수정체삽입술, 광응고술, 유리체강내 베바시주맙(Avastin®; Genentech Inc., San Francisco, CA, USA) 주입술을 시행하였다. 당시 CT SPHERIS® 204 (Carl Zeiss Meditec AG)가 수정체낭 내에 삽입되었다. 수술 4개월 후 우안에 전방각 신생혈관과 유리체강내 재출혈이 있어 부분 유리체절제술, 전방 및 유리체강내 베바시주맙주입술을 시행하였다. 약 3개월 후 우안 최대교정시력은 0.7로 측정되었고, 경과 관찰을 하던 중 우안 당뇨망막부종으로 유리체강내 베바시주맙주입술 2회와 덱사메타손삽입물(Ozurdex®, Allergan, Irvine, CA, USA) 주입술 1회를 시행하였다.
우안 시력저하로 내원하였을 당시 우안 최대교정시력은 0.1이었고, 세극등현미경검사상 인공수정체 광학부 표면에 과립성 백색 혼탁이 광범위하게 관찰되었다(Fig. 1). 인공수정체를 교환하기로 결정하고 수술을 시행하였다. 인공수정체 제거 시 섬모체소대의 손상이 관찰되어 수정체낭과 함께 인공수정제를 제거하고 부분 유리체절제술을 시행하였다. 이후 새로운 인공수정체 AcrySof® MN60AC (Alcon Inc., Fort Worth, TX, USA)를 이용하여 공막내고정술을 시행하였다. 제거한 인공수정체는 광학부 전반에 걸쳐 과립성 백색 혼탁이 있었으나 광학부 가장자리와 지지부에는 혼탁이 없었다(Fig. 2). 인공수정체 혼탁을 일으킨 침착물을 분석하기 위해 주사전자현미경(Scanning electron microscopy)과 에너지 분산 방사선 분광법(Energy-dispersive X-ray spectroscopy)을 시행하였다. 제거한 인공수정체의 표면을 백금으로 코팅한 후 주사전자현미경으로 관찰하였을 때 다양한 크기의 과립성 침착물이 인공수정체 표면에서 관찰되었다(Fig. 3). 에너지 분산 방사선 분광법으로 제거한 인공수정체에서 침착물이 없는 부위와 침착물이 있는 부위를 분석하였다. 침착물이 없는 부위에서는 탄소와 산소가 확인되었고, 침착물이 있는 부위에서는 칼슘, 인, 마그네슘, 아연, 불소가 추가적으로 확인되었다(Fig. 4).
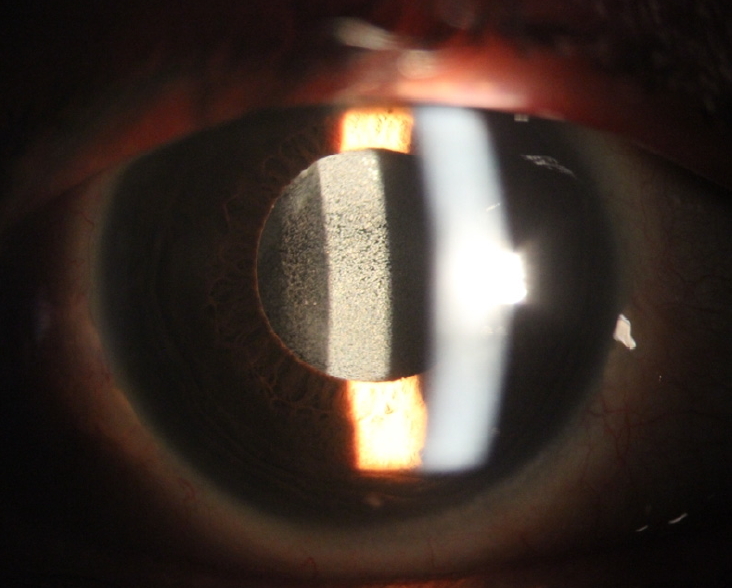
Slit lamp photograph of the opacified intraocular lens (IOL) before surgery. It shows fine whitish granular deposits on the anterior surface of the IOL.

Slit lamp photograph of the explanted intraocular lens (IOL). Fine whitish granular deposits are present on nearly the entire optic of the IOL.

Scanning electron microscopy of the explanted intraocular lens (original magnification, ×100). Image of the anterior surface of the intraocular lens showing different sizes of granular deposits. EHT = electron high tension; WD = working distance.
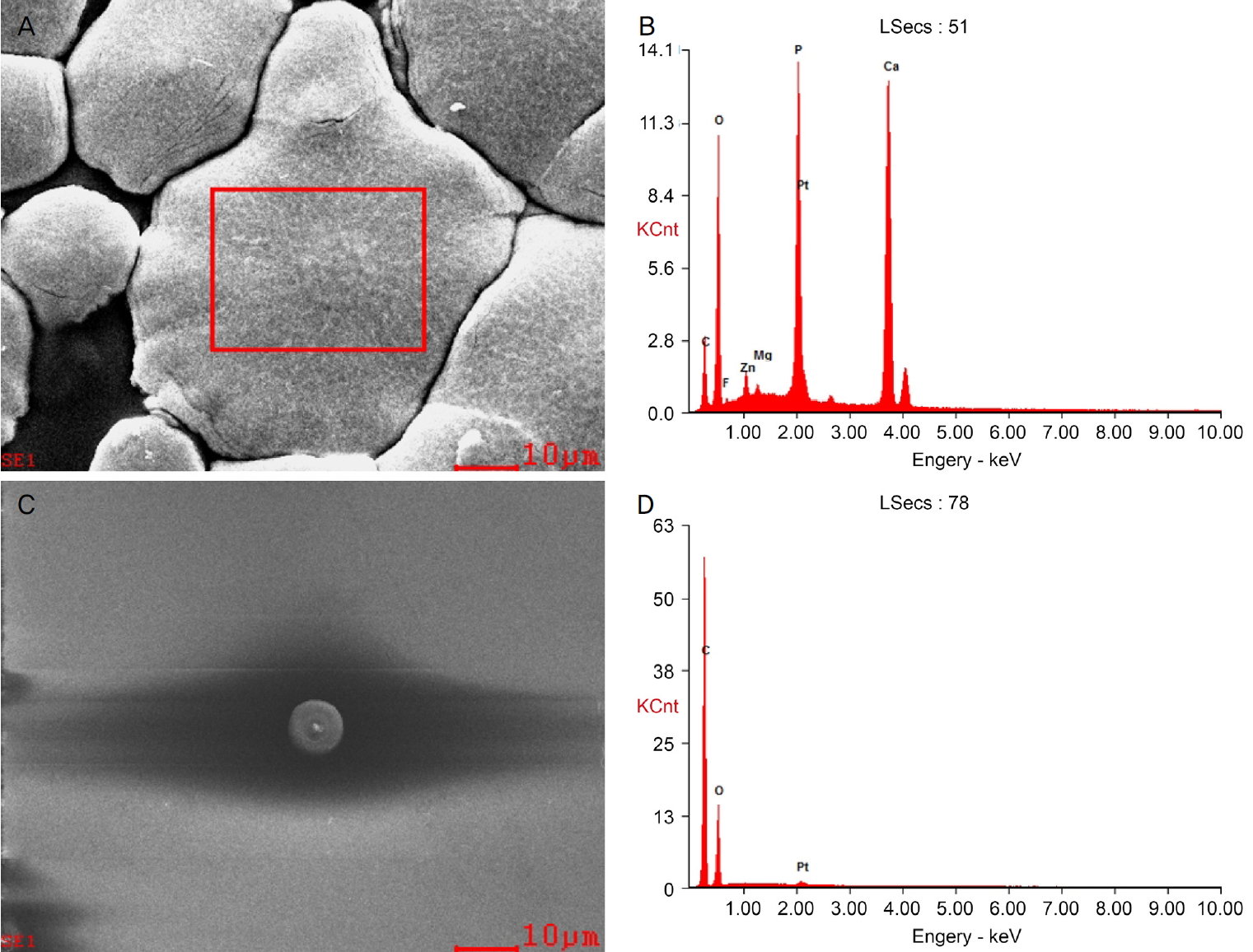
Scanning electron microscopy (SEM) and Energy-dispersive X-ray spectroscopy (EDS) of the explanted intraocular lens. SEM showing granular deposits area (A) and control area (C) of the explanted intraocular lens (original magnification, ×1,000). EDS from granular deposits area (B) and control area (D) of the intraocular lens. The deposits consist of calcium (Ca), phosphate (P), magnesium (Mg), zinc (Zn), and fluorine (F). Platinum (Pt) was used for coating the surface of the intraocular lens.
고 찰
인공수정체에 발생하는 혼탁은 백내장수술 후 발생하는 매우 드문 합병증이며, 인공수정체교환술을 시행하게 되는 원인이다. 친수성 아크릴 인공수정체는 소수성 인공수정체보다 유연하고 접기가 쉬워 작은 절개창을 통해 인공수정체를 삽입할 수 있게 되었다[2]. 하지만 다양한 친수성 인공 수정체에서 수술 후 혼탁이 발생한 증례들이 보고되었다[9-12].
Neuhann et al [13]은 혼탁으로 인해 제거한 400개 이상의 인공수정체를 분석하여 3가지 유형으로 분류하였으며, 분석된 대부분의 인공수정체는 친수성 아크릴 인공수정체였다. 이 연구에서 인공수정체 자체와 관련된 일차 석회화, 질환이나 환경적인 원인에 의한 이차 석회화, 위양성 석회화로 분류하였고, 특히 이차 석회화의 원인으로 과거나 현재 질환, 세포와 단백질이 이동하게 되는 혈액방수장벽의 파괴를 제시하였다. Bompastor-Ramos et al [4]은 소수성 표면의 친수성 인공수정체 Lentis® LS-502-1 (Oculentis GmbH, Berlin, Germany)를 삽입하고 평균 29.15개월 후 지연성으로 발생한 20안의 인공수정체 혼탁을 보고하였으며, 이러한 혼탁은 고혈압, 당뇨, 녹내장과 높은 연관성을 보였다. Bang et al [5]은 소수성 표면의 친수성 다초점인공수정체 Lentis® Mplus LS-313 MF30 (Oculentis GmbH, Berlin, Germany)에서 혼탁이 발생한 7명의 환자, 10안의 증례를 보고하였다. 이 증례에서 2명의 환자가 당뇨망막병증의 병력을 가진 것 외에는 관련된 동반 질환이나 과거 수술력을 찾을 수 없었으며, 석회화가 인공수정체 전반에 걸쳐 나타난 양상으로 보아 제조공정이나 재료 자체의 문제로 인해 발생했을 것으로 추정하였다[5]. 데스메막박리자동내피각막이식술 후 친수성 인공수정체에서 석회화가 발생하는 것은 수술 중 전방으로 주입된 공기나 가스가 인공수정체와 반응하면서 생긴 인공수정체의 구조변화나 수술 후 안압상승, 염증 반응, 대사인자가 원인이 될 수 있다고 보았다[11,12]. Mojzis et al [6]은 소수성 표면의 친수성 인공수정체에서 데스메막박리자동내피각막이식술 후 석회화가 발생한 증례를 보고하였으며, 이 증례에서 환자의 푹스각막내피이상증으로 인한 전방내 대사 변화 때문에 석회화가 발생한 것으로 추정하였다. Cao et al14은 유리체출혈로 유리체절제술을 시행하고 10개월 후 친수성 아크릴 인공수정체 Akreos® Adapt AO (Bausch & Lomb, Rochester, NY, USA)에 혼탁이 발생한 증례를 보고하였으며, 당뇨망막병증의 병력, 유리체절제술 이후 염증 반응, 혈액방수장벽의 파괴가 혼탁의 원인이라고 추정하였다. 이러한 혈액방수장벽 파괴가 전방내 칼슘 농도 상승을 일으켜 인공수정체의 석회화를 일으키는 데 역할을 하였을 것이다[15]. Khurana and Werner [9]은 유리체절제술과 눈 속 공기충전 시행 8개월 후 친수성 아크릴 인공수정체 NaturaLens® SC25-Fold (EyeKon Medical, Clearwater, FL, USA)에서 혼탁이 발생한 증례를 보고하였다. 이 증례에서 공기에 노출된 인공수정체 표면이 전하를 띄게 되면서 칼슘과 인이 축적된다고 설명하였다[9]. Balendiran et al [10]은 30안에서 발생한 다양한 친수성 아크릴 인공수정체 혼탁을 보고하였다. 이 연구에서 유리체강내 항혈관내 피성장인자를 주입한 환자, 망막수술과 유리체강내 가스 또는 실리콘 기름을 주입한 환자, 녹내장수술을 받은 환자의 인공수정체에 석회화가 관찰되었고, 저자들은 수술이나 시술 이후 악화된 만성 염증 반응과 전방 내 물질대사 변화로 인해 석회화가 발생하였을 것으로 보았다[10]. 석회화로 인한 인공수정체의 혼탁 외에도 다른 원인에 의한 증례 또한 보고되었다. Gutierrez et al [7]은 본 증례와 같은 인공수정체인 CT SPHERIS® 204 (Carl Zeiss Meditec AG)에서 백내장수술 중 혼탁이 발생하고 24시간 뒤 저절로 호전된 증례를 보고하였다. Zhang et al [8] 또한 소수성 표면을 가진 친수성 아크릴 재질의 구면 삼중초점 인공수정체인 AT LISA tri 839MP (Carl Zeiss Meditec AG)에서 백내장수술 중 혼탁이 발생하고 3시간 뒤 저절로 호전된 증례를 보고하였다.이 두 증례 모두 저온에서 보관하였던 인공수정체의 급격한 온도 변화와 기체 응축을 혼탁이 발생한 원인으로 추정하였다[7,8].
본 증례에서는 증식당뇨망막병증에 의한 유리체출혈로 유리체절제술을 시행하였고, 소수성 표면을 가진 친수성 아크릴 재질의 구면 단초점인공수정체인 CT SPHERIS® 204 (Carl Zeiss Meditec AG)를 삽입하였다. 이후 전방각 신생혈관과 유리체강내 재출혈이 있어 부분 유리체절제술, 전방 및 유리체강내 베바시주맙주입술을 시행하였고 지연성으로 인공수정체에 석회화가 발생하였다. 이는 증식당뇨망막병증, 전방각 신생혈관, 유리체절제술로 인한 염증 반응, 혈액방수장벽 파괴, 전방 내 칼슘농도 상승과 물질대사 변화가 일어나 인공수정체 표면에 칼슘과 인을 포함한 전하를 띤 무기 이온이 염을 형성하여 발생된 것으로 생각된다. 이외에 제조공정이나 인공수정체 자체의 문제로 인해 인공수정체 표면이 칼슘이 부착되기 쉬운 구조로 변화하여 석회화가 발생하였을 가능성도 있다.
결론적으로 본 증례는 소수성 표면을 가진 친수성 아크릴 재질의 구면 단초점인공수정체인 CT SPHERIS® 204 (Carl Zeiss Meditec AG)에서 2회의 유리체절제술 후 발생한 지연성 혼탁에 대한 최초의 보고이다. 인공수정체 혼탁은 백내장수술의 매우 드문 합병증이지만 환자의 기저 질환과 과거력에 따라 발생할 가능성이 높아질 수 있다. 따라서 백내장수술이나 유리체절제술 전 환자에게 수술을 하고 난 후 지연성으로도 인공수정체 혼탁이 발생할 수 있으며, 그에 대한 치료로 인공수정체교환술을 할 수 있다는 것을 설명할 필요가 있다. 또한 당뇨망막병증 환자에서 백내장수술 시 소수성 표면을 가진 친수성 아크릴 인공수정체의 사용에 대해 신중하게 고려할 필요가 있다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
조영채 / Yeong Chae Jo
메리놀병원 안과
Department of Ophthalmology, Maryknoll Medical Center
