 |
 |
| J Korean Ophthalmol Soc > Volume 61(9); 2020 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
Ļ▓░Ļ│╝
ABSTRACT
Purpose
Methods
Results
Conclusions
Figure┬Ā1.
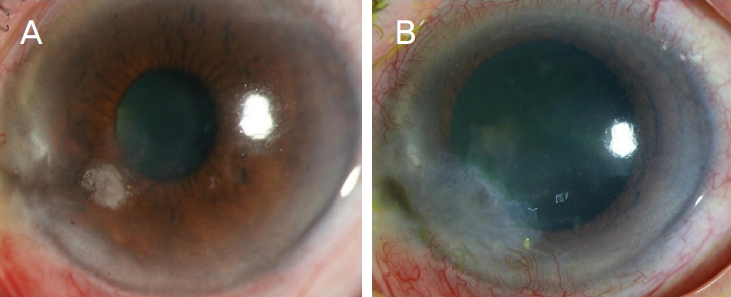
Figure┬Ā2.

Table┬Ā1.
| No. | Age/Sex | Isolates | Gram stain | KOH smear | Predisposing factor & Previous OSD & ocular surgery | Prior use of steroids | Systemic disease | Symptom duration (days) | Location & depth & size (mm2) | Hypopyon | Complete epithelialization time (days) | Surgical treatment | Initial BCVA | Final BCVA |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 71/F | CS, EC, SA | G+ cocci | - | Unknown, Excision of pterygium | - | DM | 6 | P, S, 4.9 | + | N/A* | None | HM | N/A* |
| 2 | 65/F | CA | - | - | Unknown, NK, BK | + | None | 3 | C, S, 6.0 | + | 39 | Conjunctival flap | HM | HM |
| 3 | 69/M | CS | Yeast+ | + | Soil, Cataract surgery | - | None | 20 | P, S, 6.2 | + | 21 | None | 0.02 | 0.08 |
| 4 | 70/F | CA | Yeast+ | + | Vegetable, CRVO, Hypertensive retinopathy | - | HTN | 15 | C, D, 25.0 | - | N/A | Evisceration | NLP | AE |
| 5 | 19/M | CA, SM, KP, PA | - | - | Contact lens | - | None | 3 | C, S, 4.0 | - | 10 | None | 0.01 | 1.0 |
| 6 | 78/M | CA | Yeast+++ | + | Soil | - | None | 60 | C, S, 4.6 | - | N/A | Enucleation | 0.08 | AE |
| 7 | 51/F | CA | - | + | Unknown, DES, Cataract surgery | - | TB | 7 | C, D, 3.3 | - | 8 | None | 0.5 | N/AŌĆĀ |
| 8 | 64/F | CS, Fusarium spp. | Yeast+ | + | Soil, Vegetable | - | None | 8 | C, S, 2.3 | + | N/A | Conjunctival flap, Evisceration | 0.5 | AE |
| 9ŌĆĪ | 71/M | CA | Yeast+ | + | Vegetable | + | HTN, TIA, Angina | 60 | P, D, 4.8 | + | N/A | Evisceration | 0.1 | AE |
| 10 | 88/M | CA | - | - | Soil | - | HTN | 60 | P, D, 4.0 | + | 74 | AMT, Conjunctival flap | LP | LP |
| 11 | 74/F | Candida tropicalis, SP | G+ cocci | - | Vegetable | - | None | 7 | C, D, 5.3 | + | 17 | None | 0.01 | 0.4 |
| 12 | 71/F | CS | Yeast+ | + | Unknown, Exposure keratopathy | - | HTN | 14 | P, S, 3.0 | - | 14 | None | 0.1 | 0.04 |
| 13 | 60/F | CA | Yeast+ | + | Unknown, HSV keratouveitis, Removal of retrobulbar mass | + | DM, HTN, HBV | 60 | C, D, 4.0 | + | N/A | AMT, Scleral lamellar graft, Conjunctival flap, Evisceration | HM | AE |
| 14┬¦ | 75/M | CA | Yeast+ | + | Soil DES, SPK, Blepharitis, Excision of pterygium | + | HTN, CVA | 13 | P, S, 9.0 | - | 28 | AMT #2 | 0.2 | 0.2 |
| 15 | 54/M | CS, Candida tropicalis, PS | - | - | Unknown, HSV keratitis, AMT for corneal perforation | + | HTN | 4 | C, D, 25.0 | - | 18 | AMT | HM | HM |
| 16 | 87/F | Candida famata | Yeast+ | + | Unknown, NK, HSV keratitis, Cataract surgery | + | HTN | 60 | C, D, 36.0 | - | 34 | AMT | HM | HM |
| 17 | 70/M | CS, Candida famata | - | - | Unknown, Pseudophakic BK, ACL implantation | + | None | 1 | C, S, 6.0 | - | 14 | AMT | 0.02 | HM |
| 18 | 78/M | CS, SE | - | - | Vegetable, HSV keratitis | - | Liver cirrhosis | 30 | C, S, 2.3 | - | 5 | None | HM | 0.2 |
KOH = potassium hydroxide; OSD = ocular surface disease; BCVA = best corrected visual acuity; CS = Candida species; EC = Enterobacter cloacae; SA = Staphylococcus aureus; G = Gram; DM = diabetes mellitus; P = peripheral; S = superficial; N/A = not applicable; HM = hand motion; CA = Candida albicans; NK = neurotrophic keratopathy; BK = bullous keratopathy; C = central; CRVO = central retinal vein occlusion; HTN = hypertension; D = deep; NLP = no LP; LP = light perception; AE = artificial eye; SM = Serratia marcescens; KP = Klebsiella pneumoniae; PA = Pseudomonas aeruginosa; DES = dry eye syndrome; TB = tuberculosis; TIA = transient ischemic attack; AMT = amniotic membrane transplantation; SP=Streptococcus pneumoniae; HSV = herpes simplex virus; HBV = hepatitis B virus; SPK = superficial punctate keratopathy; CVA = cardiovascular disease; PS = Pseudomonas species; ACL = anterior chamber lens; SE = Staphylococcus epidermidis.
ŌĆĪ photographs of case 9 were showed in Figure 2.
┬¦ photographs of case 14 were showed in Figure 1.
Table┬Ā2.
| Characteristic | Total (n = 18) | CA (n = 9) | NCA (n = 9) | p-value* |
|---|---|---|---|---|
| Sex (male) | 9 (50) | 5 (56) | 4 (44) | 1.00 |
| Age (years) | 67.5 ┬▒ 15.4 | 64.1 ┬▒ 20.0 | 70.9 ┬▒ 9.1 | 0.63ŌĆĀ |
| Age subgroup (years) | 1.00 | |||
| ŌĆā0-19 | 1 (6) | 1 (11) | 0 | - |
| ŌĆā20-39 | 0 | 0 | 0 | - |
| ŌĆā40-59 | 2 (11) | 1 (11) | 1 (11) | - |
| ŌĆā60-79 | 13 (72) | 6 (67) | 7 (78) | - |
| ŌĆāŌēź80 | 2 (11) | 1 (11) | 1 (11) | - |
| Symptom duration (days)ŌĆĪ | 23.9 ┬▒ 24.0 | 31.2 ┬▒ 27.6 | 16.7 ┬▒ 18.6 | 0.21ŌĆĀ |
| ŌĆāMedian (IQR) | 13.5 (5.5-60.0) | 15 (5.0-60.0) | 8 (5.0-25.0) | 0.49 |
| ŌĆāŌēź14 days | 9 (50) | 5 (56) | 4 (44) | 1.00 |
| Urban residency | 9 (50) | 5 (56) | 4 (44) | 1.00 |
| Seasonal distribution | 0.64 | |||
| ŌĆāSpring (Mar-May) | 4 (22) | 1 (11) | 3 (33) | - |
| ŌĆāSummer (Jun-Aug) | 7 (39) | 4 (44) | 3 (33) | - |
| ŌĆāAutumn (Sep-Nov) | 4 (22) | 3 (33) | 1 (11) | - |
| ŌĆāWinter (Dec-Feb) | 3 (17) | 1 (11) | 2 (22) | - |
| Gram stain result | ||||
| ŌĆāPositive result | 11 (61) | 5 (56) | 6 (67) | 1.00 |
| ŌĆāŌĆāYeast | 9 (50) | 5 (56) | 4 (44) | 1.00 |
| ŌĆāŌĆāRod or cocci | 2 (11) | 0 | 2 (22) | 0.47 |
| KOH smear positive | 10 (56) | 6 (67) | 4 (44) | 0.64 |
| Polymicrobial infection | 7 (39) | 1 (11) | 6 (67) | 0.05 |
Table┬Ā3.
| Predisposing factor | Total (n = 18) | CA (n = 9) | NCA (n = 9) | p-value* |
|---|---|---|---|---|
| Corneal trauma | 8 (44) | 4 (44) | 4 (44) | 1.00 |
| Contact-lens wear | 2 (11) | 1 (11) | 1 (11) | 1.00 |
| Previous OSDŌĆĀ | 8 (44) | 3 (33) | 5 (56) | 0.64 |
| Previous ocular surgeryŌĆĪ | 7 (39) | 2 (22) | 5 (56) | 0.34 |
| Previous topical antibiotics use | 11 (61) | 5 (56) | 6 (67) | 1.00 |
| Previous topical steroid use | 7 (39) | 4 (44) | 3 (33) | 1.00 |
| Systemic disease | 11 (61) | 6 (67) | 5 (56) | 1.00 |
| ŌĆāHypertension | 8 (44) | 5 (56) | 3 (33) | 0.64 |
| ŌĆāDiabetes mellitus | 2 (11) | 1 (11) | 1 (11) | 1.00 |
| No apparent cause | 8 (44) | 3 (33) | 5 (56) | 0.64 |
Values are presented as number (%).
CA = Candida albicans; NCA = non-CA; OSD = ocular surface disease.
ŌĆĀ CA group included neurotrophic keratopathy with bullous keratopathy (1 case), herpetic keratouveitis (1 case), and punctate epithelial keratitis (1 case); NCA group included herpetic keratitis (2 cases), herpetic keratitis with neurotrophic keratopathy (1 case), exposure keratopathy (1 case), and pseudophakic bullous keratopathy (1 case);
Table┬Ā4.
| Characteristic | Total (n = 18) | CA (n = 9) | NCA (n = 9) | p-value* |
|---|---|---|---|---|
| Central lesionŌĆĀ | 12 (67) | 6 (67) | 6 (67) | 1.00 |
| Infiltrate characteristic | ||||
| ŌĆāRound infiltration | 13 (72) | 6 (67) | 7 (78) | 1.00 |
| ŌĆāIrregular border | 4 (22) | 2 (22) | 2 (22) | 1.00 |
| ŌĆāSatellite lesion | 1 (6) | 1 (11) | 0 | 1.00 |
| ŌĆāFeathery like projection | 1 (6) | 0 | 1 (11) | 1.00 |
| ŌĆāDeep infiltrationŌĆĪ | 8 (44) | 5 (56) | 3 (33) | 0.64 |
| Epithelial defect size (mm2) | 8.6 ┬▒ 9.6 | 7.2 ┬▒ 6.9 | 10.1 ┬▒ 12.0 | 0.54┬¦ |
| ŌĆāŌēź5 mm2 | 8 (44) | 3 (33) | 5 (56) | 0.64 |
| Hypopyon | 8 (44) | 4 (44) | 4 (44) | 1.00 |
| Endothelial plaque | 3 (17) | 2 (22) | 1 (11) | 1.00 |
| Epithelial healing time (days)╬Ā | 23.5 ┬▒ 18.9 | 31.8 ┬▒ 26.9 | 17.5 ┬▒ 8.8 | 0.53┬¦ |
| ŌĆāŌēź14 days | 10 (83) | 4 (80) | 6 (86) | 1.00 |
| Complications | 11 (61) | 6 (67) | 5 (56) | 1.00 |
| ŌĆāCorneal perforation | 8 (44) | 4 (44) | 4 (44) | 1.00 |
| ŌĆāCorneal melting | 5 (28) | 3 (33) | 2 (22) | 1.00 |
| Surgical treatment | 11 (61) | 7 (78) | 4 (44) | 0.34 |
| ŌĆāAMT | 6 (33) | 3 (33) | 3 (33) | 1.00 |
| ŌĆāConjunctival flap | 4 (22) | 3 (33) | 1 (11) | 0.58 |
| ŌĆāEvisceration | 5 (28) | 4 (44) | 1 (11) | 0.29 |
| Presenting BCVA (logMAR) | 1.85 ┬▒ 0.91 | 1.90 ┬▒ 0.82 | 1.81 ┬▒ 1.05 | 0.93┬¦ |
| ŌĆā<0.1 (Snellen) | 13 (72) | 6 (67) | 7 (78) | 1.00 |
| Final BCVA (logMAR)# | 2.07 ┬▒ 1.14 | 2.32 ┬▒ 1.25 | 1.81 ┬▒ 1.03 | 0.23┬¦ |
| ŌĆā<0.1 (Snellen) | 12 (75) | 6 (75) | 6 (75) | 1.00 |
| Decreased BCVA# | 6 (38) | 3 (38) | 3 (38) | 1.00 |
| Treatment outcome┬Č | ||||
| ŌĆāSuccess | 6 (35) | 2 (22) | 4 (50) | 0.34 |
| ŌĆāFailure | 11 (65) | 7 (78) | 4 (50) | - |
Values are presented as mean ┬▒ standard deviation or number (%).
CA = Candida albicans; NCA = non-CA; AMT = amniotic membrane transplantation; BCVA = best corrected visual acuity; logMAR = logarithm of the minimum angle of resolution.
ŌĆĪ depth of infiltration was assessed in 2 categories: superficial (more than 0% to 50%), deep (more than 50% to 100%);
Table┬Ā5.
| Factor | Treatment success* (n = 6)ŌĆĀ | Treatment failure (n = 11)ŌĆĀ | p-valueŌĆĪ |
|---|---|---|---|
| Age (years) | 60.3 ┬▒ 22.3 | 71.1 ┬▒ 10.5 | 0.19┬¦ |
| Sex (male/female) | 3/3 | 6/5 | 1.00 |
| CA | 2 (33) | 7 (64) | 0.34 |
| NCA | 4 (67) | 4 (36) | 0.34 |
| Symptom duration (days) | 13.5 ┬▒ 10.1 | 31.3 ┬▒ 27.8 | 0.08┬¦ |
| Previous OSD | 2 (33) | 6 (55) | 0.62 |
| Previous topical steroid use | 0 | 7 (64) | 0.04 |
| Central location | 4 (67) | 7 (64) | 1.00 |
| Epithelial defect size (mm2) | 7.2 ┬▒ 6.9 | 9.5 ┬▒ 12.3 | 0.64┬¦ |
| Hypopyon | 2 (33) | 5 (46) | 1.00 |
| Polymicrobial infection | 3 (50) | 3 (27) | 0.60 |
| KOH smear positive | 3 (50) | 7 (64) | 0.64 |
| Gram stain: yeast positive | 2 (33) | 7 (64) | 0.34 |
| Presenting BCVA (logMAR) | 1.60 ┬▒ 0.82 | 1.93 ┬▒ 0.99 | 0.50┬¦ |
| Final BCVA (logMAR) | 0.72 ┬▒ 0.55 | 2.68 ┬▒ 0.70 | <0.001┬¦ |
Values are presented as mean ┬▒ standard deviation or number (%) unless otherwise indicated.
CA = Candida albicans; NCA = non-CA; OSD = ocular surface disease; KOH = potassium hydroxide; BCVA = best corrected visual acuity; logMAR = logarithm of the minimum angle of resolution.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




