섬유주세포에서 황화수소가 산화스트레스와 세포노화에 미치는 영향
Effect of Hydrogen Sulfide on the Oxidative Stress and Senescence in Trabecular Meshwork Cells
Article information
Abstract
목적
섬유주세포에서 황화수소(hydrogen sulfide, H2S)가 산화스트레스와 세포노화에 미치는 영향을 알아보고자 하였다.
대상과 방법
섬유주세포를 200 μM 과산화수소로 산화스트레스를 유발한 다음 황화수소(sodium hydrogen sulfide, NaHS) 0, 50, 100 μM에 24시간 노출시킨 후 MTT assay로 세포의 생존율을 측정하였고, 세포노화의 정도를 SA-β-galactosidase 염색을 시행하여 측정하였다. 반응성산소종과 superoxide의 생성 정도를 dichlorofluorescein assay와 modified cytochrome c assay로 각각 측정하였다. Griess assay와 RT-PCR로 일산화질소의 생성과 endothelial nitric oxide synthase (eNOS) mRNA의 발현을 각각 측정하였다.
결과
200 μM 과산화수소는 세포의 생존에 유의한 영향을 미치지 않았다. 50, 100 μM NaHS는 과산화질소에 노출된 대조군에 비하여 세포의 노화를 유의하게 감소시켰다. 과산화수소에 노출된 대조군에 비하여 50, 100 μM NaHS는 반응성산소종의 생성을 감소시켰고 100 μM NaHS는 superoxide의 생성을 저하시켰다. 100 μM NaHS는 일산화질소의 생성과 eNOS mRNA의 발현을 각각 유의하게 증가시켰다.
결론
과산화수소로 유발된 산화스트레스에 대해 NaHS는 자유유리기의 생성을 감소시키면서 세포의 노화를 억제하였다. 따라서 황화질소는 산화스트레스를 감소시켜 섬유주세포의 노화를 감소시키는 작용을 나타낼 것으로 생각된다.
Trans Abstract
Purpose
To investigate the effects of hydrogen sulfide (H2S) on the senescence and oxidative stress of cultured human trabecular meshwork cells (HTMCs).
Methods
After inducing oxidative stress with 200 μM hydrogen peroxide (H2O2), primary cultured HTMCs were exposed to 0, 50, and 100 μM sodium hydrogen sulfide (NaHS) for 24 hours. Cell survival and senescence were measured using an MTT assay and SA-β-galactosidase staining, respectively. Generation of reactive oxygen species (ROS) and superoxide were measured using the dichlorofluorescein assay and modified cytochrome c assay. Production of nitric oxide (NO) and expression of eNOS mRNA were assessed using the Griess assay and reverse polymerase chain reaction.
Results
Cell survival was not affected by 200 μM H2O2. Exposure to 50 and 100 μM NaHS significantly decreased cellular senescence, compared with the H2O2-exposed control. Exposure to 50 and 100 μM NaHS decreased the generation of ROS, and exposure to 100 μM NaHS decreased the generation of superoxide. Treatment with 100 μM NaHS increased the production of NO and expression of eNOS mRNA, respectively.
Conclusions
NaHS decreased the cellular senescence associated with the decreased generation of free radicals. Thus, H2S could inhibit the senescence of HTMCs by reducing oxidative stress.
황화수소(hydrogen sulfide, H2S)는 3가지 효소에 의해 내인적으로 생성되며 생리적으로 다양한 역할을 하는데[1-5] 혈관의 이완에도 관여할 뿐만 아니라 심혈관계와 중추신경계에서 세포보호작용을 나타내며, 산화스트레스와 세포고사를 감소시키고 노화를 지연시키는 작용도 나타낸다[6-8].
안구 내 다양한 조직에서 H2S는 기질인 L-cysteine에 의해 내인성으로 생성되는데[9] 동물 실험에서 안압을 낮추는 효과가 있으며, 전안부 관류 실험에서 방수유출을 증가시키는 것으로 알려져 있다[10,11]. 또한 H2S는 안구 내에서 산화스트레스에 대해 신경보호작용을 나타내며[12], 녹내장 모델을 이용한 연구에서도 망막신경절세포 보호 효과가 있는 것으로 알려져 있다[13-15].
섬유주에서 산화스트레스의 증가는 섬유주의 손상을 유발하여 개방각녹내장을 유발하는 요인으로 알려져 있으며[16-18] 이러한 산화스트레스는 세포의 조기 노화를 유발하여 기능을 저하시키는 원인이 된다[19,20]. 사람의 섬유주세포는 연령이 증가할수록 숫자가 감소하는데 정상인에 비해 개방각녹내장의 경우에서 섬유주세포의 노화가 더 많이 나타나므로 섬유주세포의 노화가 녹내장의 발병기전의 하나로 알려져 있다[21-23].
H2S는 혈관내피세포 또는 망막신경절세포에서 산화스트레스에 대해 세포보호 효과를 나타내므로 방수유출로에서도 산화스트레스에 대하여 섬유주세포 보호작용과 섬유주세포의 노화를 지연시키는 작용을 나타낼 가능성도 있으나 섬유주세포에서 이와 관련된 연구는 아직 자세히 행해지지 않았다. 이에 따라 본 연구에서는 사람의 섬유주세포를 일차배양하여 산화스트레스를 유도한 다음 H2S가 섬유주세포의 노화를 억제하는 효과가 있는지 알아보고, 산화스트레스와의 관련성을 알아보고자 하였다.
대상과 방법
세포배양과 약물처리
본 연구는 대구가톨릭대학교병원 의학윤리심의위원회(IRB)의 승인을 받았고(승인 번호: CR-19-010-L), 헬싱키선언을 따라 시행되었다. 각막이식에 동의한 42세 환자로부터 사후 6시간 이내에 적출한 안구를 안구은행에서 얻어 전방각에서 섬유주를 벗겨내어 배양접시에 옮긴 후 항생제(Gibco, Invitrogen, Carlsbad, CA, USA)와 10% 우태아혈청(Hyclone, Thermoscientific, Carlsbad, CA, USA)이 포함된 Dulbecco’s modified Eagle’s medium 배지(DMEM, Gibco, Invitrogen)를 사용하여 5% CO2 배양기에서 초대배양하였다. 배양된 인체의 섬유주세포에 0, 50, 100 μM 황화수소 나트륨(sodium hydrogen sulfide, NaHS, Sigma, St. Louis, MO, USA)에 24시간 노출시켰다. 이때 산화스트레스를 유발하기 위하여 200 μM 과산화수소(hydrogen peroxide, [H2O2], Sigma)를 30분간 먼저 노출시켰다.
MTT assay
세포의 증식에 대한 효과는 MTT (3-[4,5–dimethylthiazol2-yl]-2,5-diphenyltetrazolium bromide, Sigma) assay를 이용하였다[24,25]. 약물처리한 세포의 배지에 MTT를 각 well당 100 μL씩 투여한 후 4시간 동안 정치배양한 다음 염류용액으로 씻어낸 후 dimethylsulfoxide (Sigma)를 각 well당 0.5 mL씩 넣어 96-well plate에 옮겨 spectrophotometer (Fluostar Optima, BMG labtech, Offenberg, Germany)로 570 nm에서 흡광도를 측정하였다. 이때 세포의 생존 정도는 실험군의 값을 약물처리를 하지 않은 대조군의 비로 나누어 백분율로 나타내었다.
SA-β-galactosidase assay
노화된 세포에서 특징적으로 발현되는 β-galactosidase의 활 성을 측정하기 위해 상용의 senescence-associated β-galactosidase kit (SA-β-gal, Sigma)을 이용하였다[26,27]. 배지를 흡입 제거한 후 염류용액으로 세척한 다음 염색액을 넣어 2시간 동안 배양하였다. 이때 노화된 세포는 β–galactosidase를 발현하여 푸른색을 나타내므로 광학현미경으로 100 배율로 무작위로 세포 구역을 정하여 β-galactosidase 양성인 푸르게 염색된 노화된 세포 수와 전체 세포 수를 수동으로 세어서 노화된 세포의 정도를 표시하였다.
반응성산소종(reactive oxygen species, ROS)와 superoxide의 측정
ROS의 생성 정도는 dichlorofluorescein assay로 측정하였다[28]. 96-well 배양접시를 이용하여 약물처리한 세포배양에서 배지를 제거한 다음 Phosphated Buffered Saline로 세척한 후 5 μM dichlorofluorescein diacetate (Sigma)를 투여한 다음 암실에서 30분간 배양하였다. 산화된 dichlorofluorescein의 형광 변화를 excitation 파장 488 nm, emission 파장 527 nm에서 형광분석계(FLUOstar OPTIMA, BMG Labtech)를 이용하여 측정하였다. Superoxide의 생성 정도는 modified cytochrome c assay로 측정하였다[29,30]. 160 μM cytochrome c (Sigma)와100 U/mL superoxide dismutase (Sigma)를 혼합한 반응용액 100 μL에 약물 처리한 세포를 20분간 노출시켰다. 540 nm에서 환원된 cytochrome c를 측정하였다. 106개의 세포에 대해 시간당 환원된 cytochrome c의 양(nmoL)을 2.1×104/M/cm의 net extinction coefficient로 생성된 superoxide의 양을 nmoL/106cell/h로 나타내었다.
일산화질소(nitric oxide, NO)와 endothelial NO synthase (eNOS) mRNA의 측정
섬유주세포에서 NO의 생성은 Griess assay를 이용하여 측정하였다[31]. 약물에 노출시킨 배지에 동량의 Griess reagent (Sigma)를 섞은 후 96-well plate에 옮겨 분광광도계(FLUOstar Optima, BMG Labtech)로 540 nm에서 흡광도를 측정하였다. eNOS mRNA 발현은 reverse transcription polymerase chain reaction (RT-PCR)으로 측정하였다. 섬유주세포에서 Trizol (Invitrogen)을 이용하여 RNA를 분리한 후 분리한 RNA와 Oligo dT primer, Nuclease-free water를 혼합하여 만든 RNA denaturation mix를 Prime RT premix (Genet bio, Seoul, Korea)와 혼합하여 cDNA를 합성하였다. 합성한 cDNA에 2XGoTaq Green Master Mix (Promega, Fitchburg, WI, USA)와 10 pmoL의 forward primer (ctg gct ttc cct tcc agt tc, 225 bp), reverse primer (cct tcc aga tta agg cgg ac, 225 bp)를 각각 혼합하여 DNA Engine cycler (Bio-Rad, Hercules, CA, USA)를 사용하여 반응시켰다. 증폭된 PCR product를 1% agarose gel에 전기 영동하여 DNA band를 multi Gauge v2.02 (Fujifilm, Tokyo, Japan)을 이용하여 분석하였다. 이때 β-actin을 internal standard로 사용하였다.
통계적 처리
모든 실험은 3계대에서 5계대 사이의 세포를 이용하였다. Unpaired t-test를 사용하여 유의성을 비교하였으며 유의수준은 5%로 정하였다.
결 과
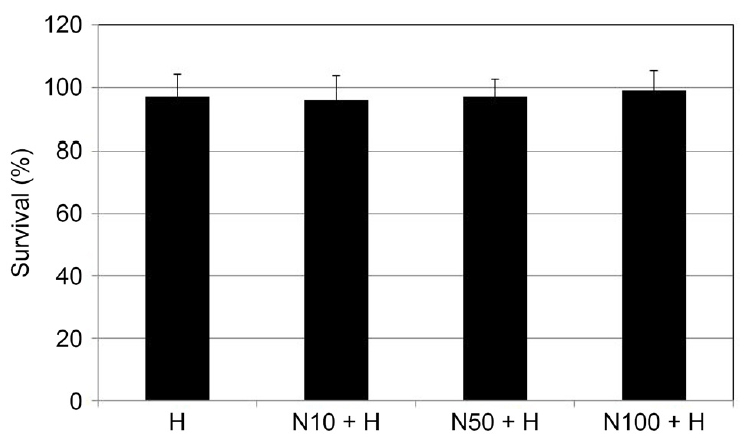
NaHS와 H2O2가 섬유주세포의 생존에 미치는 영향
배양된 섬유주세포에 200 μM H2O2에 단독으로 노출시 킨 경우와 10, 50, 100 μM NaHS와 200 μM H2O2를 함께 노출시킨 경우 모두 약물에 노출시키지 않은 대조군에 비하여 섬유주세포의 생존에 유의한 영향을 미치지 않았다(모두 p>0.05) (Fig. 1). 이는 500 μM 이하의 H2O2가 농도로 처리한 경우 섬유주세포의 생존에는 유의한 영향을 미치지 않는다는 기존의 연구와[32] 일치하는 결과이며, 본 실험에 사용된 각 약물의 농도에서 측정된 아래 실험의 결과들은 세포의 생존 변화에 의한 것이 아님을 알 수 있다.
산화스트레스에 대해 NaHS가 세포노화의 정도에 영향
배양된 섬유주세포에 200 μM H2O2에 단독으로 노출시킨 경우 약물에 노출시키지 않은 대조군에 비하여 유의하게 노화된 세포 숫자가 증가하였다(p=0.010). 200 μM H2O2에 단독으로 노출시킨 경우에 비하여 NaHS를 함께 노출시킨 경우 50, 100 μM NaHS는 노화된 세포 숫자를 유의하게 감소시켰다(p=0.035, p=0.016) (Fig. 2).
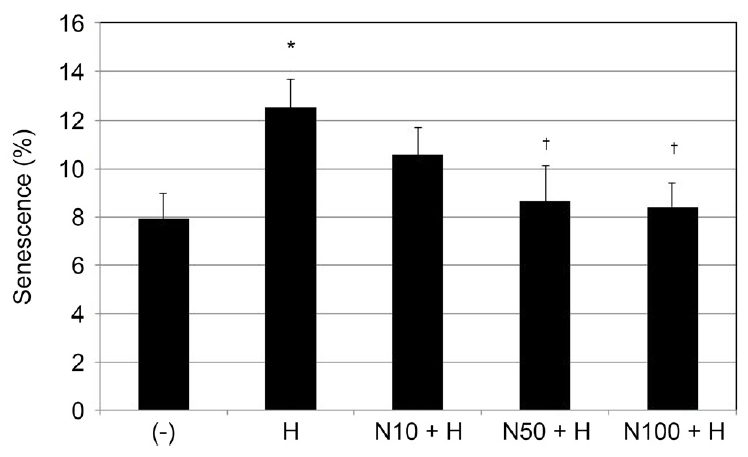
Effect of H2O2 (H) and NaHS (N) on the senescence of cultured human trabecular meshwork cells. Exposing to 200 μM H2O2 increased cellular senescence compared to non-exposed controls (*p = 0.010). Compared to exposing to 200 μM H2O2 alone, co-exposing to 200 μM H2O2 and 50 or 200 μM H2O2 and 100 μM NaHS decreased cellular senescence significantly (†p = 0.035, p = 0.016).
산화스트레스에 대해 NaHS가 ROS의 생성에 미치는 영향
배양된 섬유주세포에 200 μM H2O2에 단독으로 노출시킨 경우 약물에 노출시키지 않은 대조군에 비하여 유의하게 ROS가 증가하였다(p=0.012). 이에 비하여 10, 50, 100 μM NaHS와 200 μM H2O2를 함께 노출시킨 경우 H2O2에 단독으로 노출시킨 경우에 비하여 50, 100 μM NaHS는 ROS의 생성을 유의하게 감소시켰다(p=0.047, p=0.036) (Fig. 3).

Effect of H2O2 (H) and NaHS (N) on the generation of reactive oxygen species (ROS) in cultured human trabecular meshwork cells. Exposing to 200 μM H2O2 increased generation of ROS compared to non-exposed controls (*p = 0.012). Compared to exposing to 200 μM H2O2 alone, co-exposing to 200 μM H2O2 and 50, 100 μM NaHS decreased generation of ROS significantly †p = 0.047, p = 0.036).
배양된 섬유주세포에 200 μM H2O2에 단독으로 노출시킨 경우 약물에 노출시키지 않은 대조군에 비하여 유의하게 superoxide의 생성이 증가되었다(p=0.034). 이와 대조적으로 10, 50, 100 μM NaHS와 200 μM H2O2를 함께 노출시킨 경우 H2O2에 단독으로 노출시킨 경우에 비하여 100 μM NaHS는 superoxide의 생성을 유의하게 감소시켰다(p=0.020) (Fig. 4).
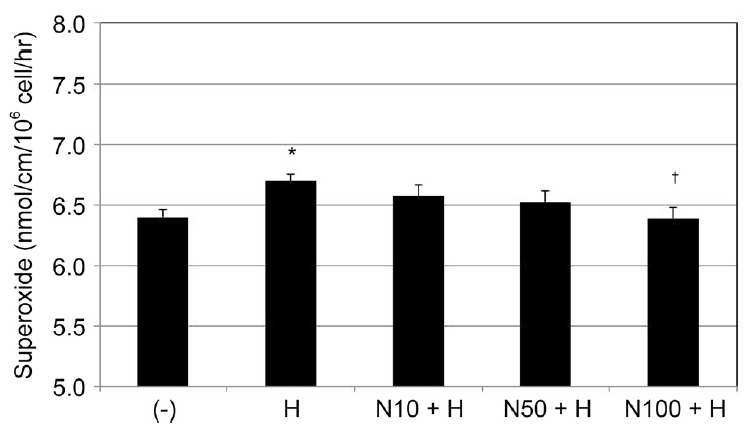
Effect of H2O2 (H) and NaHS (N) on the generation of superoxide in cultured human trabecular meshwork cells. Exposing to 200 μM H2O2 increased generation of superoxide compared to non-exposed controls (*p = 0.034). Compared to exposing to 200 μM H2O2 alone, co-exposing to 200 μM H2O2 and 100 μM NaHS decreased generation of superoxide significantly (†p = 0.020).
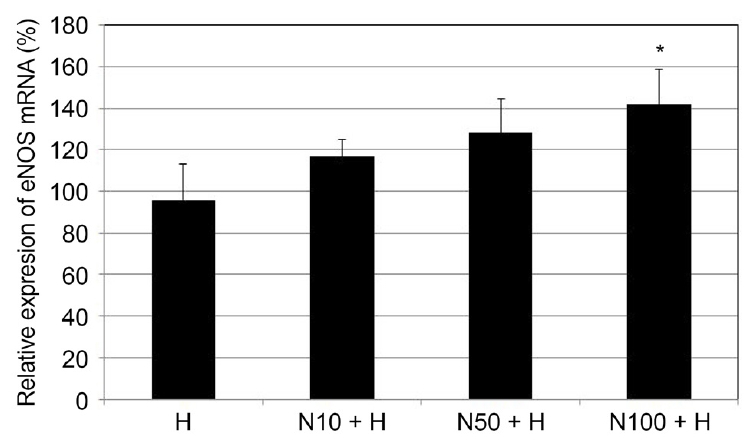
산화스트레스에 대해 NaHS가 NO생성과 eNOS mRNA의 발현에 미치는 영향
배양된 섬유주세포에 200 μM H2O2에 단독으로 노출시킨 경우 약물에 노출시키지 않은 대조군에 비하여 배지에서의 nitrite 생성 정도는 유의한 차이를 나타내지 않았으나(p=0.364) (Fig. 5), H2O2에 단독으로 노출시킨 경우에 비하여 100 μM NaHS를 함께 노출시킨 경우에는 NO의 생성이 유의하게 증가하였다(p=0.018). 200 μM H2O2에 단독으로 노출시킨 경우 약물에 노출시키지 않은 대조군에 비하여 eNOS mRNA의 발현에는 유의한 차이를 나타내지 않았으나(p=0.742) (Fig. 6), H2O2에 단독으로 노출시킨 경우에 비하여 100 μM NaHS를 함께 노출시킨 경우에는 eNOS mRNA의 발현이 유의하게 증가하였다(p=0.031).

Effect of H2O2 (H) and NaHS (N) on the production of nitric oxide (NO) in cultured human trabecular meshwork cells. Compared to exposing to 200 μM H2O2 alone, co-exposing to 200 μM H2O2 and 100 μM NaHS increased production of NO significantly (*p = 0.018).
고 찰
H2S는 인체 내에서 신호전달분자로 작용하여 평활근 이완이나 염증 반응, 신경전달과 세포의 생존 등에 대한 다양한 작용을 나타낸다[33]. H2S는 안구 내에서 내인성 경로로 생성되며 홍채, 수정체, 포도막, 망막과 방수 같은 안구 내 여러 조직에서 H2S합성에 관여하는 효소들이 존재한다[9,34].
H2S는 안구 내 망막신경절세포와 성상세포에 대하여 세포보호작용을 나타내며[12-15], 그 기전으로 H2S의 항산화작용이 관여한다[7,34,35]. 섬유주는 방수 내의 산화스트레스에 항상 노출되어 있는데[17] 산화스트레스가 증가하게 되면 섬유주세포는 구조적, 기능적인 손상을 받게 될 뿐만 아니라[36,37] 세포의 노화도 유발되는데[19,20] 이는 개방각녹내장의 발병기전의 하나가 된다[23]. 따라서 H2S는 섬유주세포에서도 항산화작용에 의해 세포보호 효과와[32] 섬유주세포의 노화를 억제하는 작용을 나타낼 가능성이 있다.
본 연구에서는 SA-β-galactosidase 염색을 이용하여 노화된 세포의 수를 측정하였는데 이는 특정 세포의 종류에 따라 활성을 나타낼 수도 있으나 혈관내피세포 또는 평활근세포를 포함한 대부분의 인체 세포에서 세포노화의 정도를 나타내는 좋은 지표로 알려져 있다[26,27]. 이에 따라 시행한 본 연구에서 H2O2 단독으로 처치한 대조군에 비해 NaHS를 함께 투여한 경우 NaHS 농도의 증가에 따라 섬유주세포의 노화를 유의하게 감소시켰다. 한편 이전의 연구와 같이[32] 본 연구에서 산화스트레스를 유도하기 위해 사용한 H2O2의 농도는 세포의 생존에는 유의한 영향을 미치지 않았으므로 이러한 결과는 세포의 생존 감소와는 무관하였다.
NaHS에 의한 세포노화의 억제 기전을 알아보기 위하여 ROS의 생성 정도를 조사하였는데 H2O2 단독으로 처치한 대조군에 비해 NaHS를 함께 투여한 경우 산화스트레스를 유발하는 자유유리기인 ROS와 superoxide의 생성이 유의하게 억제되었다. 따라서 섬유주세포에서도 NaHS에 의한 노화억제의 기전으로 H2O2의 항산화작용이 관여할 가능성이 있다. 그러나 H2O2의 항산화작용은 ROS 이외에 glutathione을 비롯한 다른 기전에 의해 매개되어 나타날 수 있으므로[38,39] 이에 관해서는 향후 보다 자세한 연구를 요한다.
세포 내에서 ROS는 주로 미토콘드리아에서 생성되는데 그중 세포호흡에 의해 미토콘드리아에서 생성되는 superoxide가 중요한 산화물질로 작용한다[40]. 혈관내피세포에서 H2O2는 NO의 생성을 저하시켜 superoxide와의 반응을 유발함으로써 peroxynitrite 같은 해로운 산화물질을 생성하여 세포 내 분자와 반응함으로써 정상적인 세포 대사를 저해하게 되는데[41-44] 이에 대해 H2S는 NO의 생성을 증가시켜 세포 내 대사를 조절하는 NO의 기능을 유지하는 역할을 한다[45]. 섬유주세포에서 이러한 작용을 나타내는지 규명하기 위해 시행한 본 연구의 결과에서 H2O2에 단독으로 노출된 경우와 비교해 고농도의 NaHS는 NO과 eNOS mRNA의 발현을 증가시켰다. H2S는 산화물질의 생성을 감소시키면서 NO의 기능을 유지시키는 작용을 나타낼 수 있으며, 이러한 NO의 생성 증가는 세포의 노화를 억제하는 작용을 나타내므로[46,47] 섬유주세포에서 H2S는 산화스트레스의 억제와 NO의 기능 유지에 의해 세포노화를 억제하는 작용을 나타낼 수 있을 것으로 생각된다. 결론적으로 H2S는 산화스트레스에 대해 섬유주세포의 노화를 억제하는 작용을 나타내었으며 이는 반응성산소종의 발생을 감소키는 H2S의 항산화작용에 의한 것으로 생각된다.
Acknowledgements
This work was supported by the grant of Research Institute of Medical Science, Catholic University of Daegu (2019).
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
박현진 / Hyeon Jin Park
대구가톨릭대학교 의과대학 안과학교실
Department of Ophthalmology, Daegu Catholic University School of Medicine