 |
 |
| J Korean Ophthalmol Soc > Volume 61(12); 2020 > Article |
|
국문초록
목적
시험 착용 미니공막렌즈의 위생 관리 목적으로 ethylene oxide (EO) 멸균의 적용 가능성을 확인하기 위해 반복적인 EO 멸균에 의한 렌즈 기본 척도들의 변화 여부를 분석하고자 하였다.
대상과 방법
미니공막렌즈(Onefit A; Biumtec, Seoul, Korea)의 기본형과 oblate형 총 67개를 대상으로 EO 멸균 전, 2주 간격의 3차례의 EO 멸균 후의 각 시점에서 기본만곡반경, 렌즈 도수, 중심렌즈 두께, 전체 렌즈 직경의 4가지 척도들을 측정하였다. 총 15시간 동안의 EO 멸균 과정 중 핵심 단계인 노출 멸균 단계에서는 압력 1.5 bar, 온도 56°C에서 총 180분 간 EO 혼합 가스에 렌즈들이 노출되었다.
ABSTRACT
Purpose
We analyzed changes in mini-scleral lens parameters after repetitive ethylene oxide (EO) sterilization.
Methods
We measured the base curve radius (BCR), the optical power, the central lens thickness (CLT), and the overall lens diameter (OLD) of 67 basic, oblate-type mini-scleral lenses (Onefit A; BIUMTEC, Seoul, Korea) before and after three repeats of EO sterilization at 2-week intervals. The sterilization process (15 hours in duration) included a core step featuring exposure to gaseous EO for 180 minutes at 1.5 bar and 56°C.
Results
The BCR changes in the basic type of mini-scleral lens after EO sterilization were -0.011 ± 0.004 mm, -0.024 ± 0.005 mm, and -0.021 ± 0.005 mm for the first, second, and third sterilizations, respectively; all changes were significant. None of optical power, CLT, or OLD were affected by EO sterilization. We found no significant correlation between any baseline value and the change thereof after sterilization.
흔히 알려진 직경 12.5 mm 이하의 각막산소투과성 하드콘택트렌즈(rigid gas permeable [RGP] contact lens)는 각막표면에 국한해서 위치한다. 반면, 더 큰 직경의 RGP 콘택트렌즈는 각막의 경계를 넘어서 공막 위에 놓이게 되는데 이와 같은 큰 직경의 RGP 콘택트렌즈는 크게 공막렌즈라는 이름의 카테고리 내에서, 그 직경과 안구 접촉 위치에 따라 직경 12.5-15.0 mm의 각막윤부렌즈(corneo-scleral lens, semi-scleral 혹은 limbal contact lens), 직경 15.0-18.0 mm의 미니공막렌즈(mini-scleral lens), 직경 18.0-25.0 mm의 공막렌즈(full scleral lens)로 구분된다[1,2]. 공막렌즈는 각막이 아닌 공막과 접촉하기 때문에 착용감이 우수하고, 원추각막, 각막확장증, 각막이식 후 심한 난시 등으로 인해 각막 RGP 콘택트렌즈나 안경을 착용할 수 없었던 환자들에게 성공적인 결과를 가져왔다[3-5]. 뿐만 아니라, 안반흔유천포창, 스티븐스-존슨증후군, 이식편대숙주병 등의 질환에서 안구 표면을 안정화시키는 장점도 있다[6-8]. 그중 특히, 미니공막렌즈는 직경이 공막렌즈(full scleral lens)보다 작아서 백인보다 결막낭의 깊이가 얕은 아시아 인종과 안구 표면 반흔성 질환으로 결막낭 단축이 온 환자들에게 적합하고 렌즈 처방이 비교적 수월하며 시력개선 효과가 우수하여 최근 널리 이용되고 있다[7,9].
각막 RGP 콘택트렌즈와 공막렌즈 모두 환자에게 처방하기 전 외래에서 재사용 가능한 시험 착용 콘택트렌즈(reusable trial contact lens)를 이용하여 피팅한다. 재사용 렌즈의 오염 및 감염 전파의 위험 때문에 과거 미국 질병통제예방센터(Centers for Disease Control and Prevention)에서 RGP 콘택트렌즈, 소프트 콘택트렌즈를 대상으로 3% 과산화수소(hydrogen peroxide)를 이용한 소독(disinfection) 방법을 권고한 바 있다[10,11]. 하지만 소독은 해로운 미생물을 제거하거나 줄이는 데에 그치고, 이에 반해 멸균(sterilization)은 모든 유기체를 사멸시키기 때문에 실험실이나 수술실 등에서는 autoclave 고압증기 멸균이나 ethylene oxide (EO) 멸균, 플라스마 멸균을 이용한다[12,13]. 멸균 대비 소독은 그람양성 세균 중 일부 바실러스(Bacillus) 및 클로스트리듐(Clostridium) 세균이 생성하는 내생 포자(endospore)를 죽일 수 없고[13], 과거 몇몇 연구에서는 콘택트렌즈의 과산화수소 소독이나 화학 소독이 일부 세균 및 진균들에 효과적이지 않다고 알려진 바 있다[11,14-18]. 또한, 공막렌즈의 착용 대상이 되는 환자들은 만성 안구 표면 질환자이거나 감염후 상태인 경우가 많기 때문에 단순 굴절이상 환자에 비해서 시험 착용 콘택트렌즈를 통한 감염 전파의 위험성이 상대적으로 높다. 하지만, autoclave 멸균 방식은 고온으로 인하여 RGP 콘택트렌즈와 소프트 콘택트렌즈 모두에서 심각한 열 변형을 초래할 수 있기 때문에 시험 착용 콘택트렌즈의 멸균에 적용할 수 없다[19]. 플라스마 멸균 방식은 주로 과산화수소를 고주파 방전으로 플라스마화하여 발생하는 분자를 이용하여 미생물을 죽이는 방법인데, 독성이 없고 단 시간의 멸균이 가능하지만 침투력이 약해 멸균 가능한 기구의 범위가 좁고 비용이 높은 단점이 있다[20].
공막렌즈는 기존 각막 RGP 콘택트렌즈보다 직경이 더 크기 때문에 렌즈 척도의 작은 변화도 피팅에는 더 큰 변화를 일으킬 수 있다. 이에 본 연구에서는 시험 착용 미니공막렌즈의 관리에 있어서 소독보다 훨씬 강력한 살균 효과를 가질 수 있는 EO 멸균의 적용 가능성을 염두에 두고, 반복적인 EO 멸균이 미니공막렌즈의 기본만곡반경, 렌즈 도수, 중심렌즈 두께, 전체 렌즈 직경의 4가지 기본 척도들의 변화에 미치는 영향을 분석하여 그 결과를 보고하고자 하였다.
본 연구는 인간 대상 연구가 아니기 때문에 본원 연구윤리심의위원회의 심의 없이 수행하였다. 연구에 사용한 시험 착용 용도의 미니공막렌즈는 연구 기간에 한정하여 회사(Onefit A; Biumtec, Seoul, Korea) 측으로부터 순수 연구 목적만으로 공여 받아 사용하였으며, 이해관계 상충으로 인해 연구 결과에 영향을 수 있는 일체의 재정적 지원, 연구 인력 고용 지원 및 특허 등은 철저하게 연구에서 배제되었다.
본 연구에 사용한 미니공막렌즈(Onefit A)는 비구면렌즈로서 중심 광학부 영역(optical zone), 각공막 경계의 장착 상태를 조절하는 이행부 영역(transitional zone), 공막 위 결막에 안착하는 공막부 영역(landing zone)으로 구성되며(Fig. 1), 기본형인 Onefit A 렌즈는 전체 직경 14-16 mm, 광학부 직경 7.00-9.00 mm, 기본만곡반경 5.50-9.00 mm, 렌즈 도수 +20.00 to -20.00 D, 중심렌즈 두께 0.17-0.76 mm, 공막부 영역의 폭 0.95 mm, 주변부 들림 정도 표준(standard), 1-2단계 가파름(1S, 2S), 1-2단계 편평함(1F, 2F)의 범위 및 디자인을 가지고 있다. Oblate형인 Onefit A Oblate 렌즈는 Onefit A 렌즈와 동일한 범위를 가지고 있으나 중심 광학부 영역의 시상 깊이를 70 μm, 110 μm, 150 μm씩 줄인 CCR70, CCR110, CCR150으로 3종이 있다. 렌즈는 hexafocon A (Acuity 100; Acuity Polymers Inc., Rochester, NY, USA) 재질로 제작되었고, 산소투과율(Dk)은 100 × 10-11cm3 O2 (cm)/(sec, cm2, mmHg)이다. 가시광선 투과율(380-780 nm)은 90 ± 5%, 자외선 A (380-316 nm) 투과율은 16% 이하, 자외선 B (315-280 nm) 투과율은 2% 이하이다.
기본형(Onefit A) 미니공막렌즈 59개와 oblate형 미니공막렌즈(Onefit A Oblate) 8개의 총 67개의 미니공막렌즈를 대상으로 EO 멸균을 시행하였다. 본원 중앙공급실에 있는 EO 멸균기(HS-700EO; Hanshin Medical Co., Incheon, Korea)를 이용하였으며, EO 멸균의 일련의 과정은 원내 의료 기구들에 일괄 적용하는 동일 프로토콜대로 시행하였다. EO 가스 20%와 이산화탄소(CO2) 80%의 혼합가스를 사용하였고 총 15시간 동안의 EO 멸균 과정은 1) 전처리(preconditioning), 2) 노출 멸균(exposure), 3) 통기(aeration)의 3단계로 구성된다. 전체 과정은 15시간 동안 진행되며 이 중 핵심이 되는 노출 멸균 단계는 EO 멸균 전체 과정 중 최고 온도 및 최고 압력에 노출되는 단계로서 압력 1.5 bar, 온도 56°C에서 총 180분간 EO 혼합 가스에 노출되었다. 모든 미니공막렌즈는 낱개로 개별 포장하여 동시에 EO 멸균을 시행하였고 2주 간격으로 총 3회 시행하였다.
기본만곡반경은 곡률반경 측정계(radiuscope, RG-400; Shin-Nippon, Sakai, Japan)를 이용하여, 렌즈 도수는 렌즈미터(lensmeter, LM-8; Topcon, Tokyo, Japan)를 이용하여, 중심렌즈 두께와 렌즈 전체 직경은 다이얼 측정기(dial indicator, 2046S, Mitutoyo, Kawasaki, Japan)를 이용하여 수동으로 측정하였다. 본 연구에 포함한 총 67개 미니공막렌즈의 EO 멸균 전 4가지 렌즈 척도의 범위는 Table 1과 같다.
미니공막렌즈 척도들의 반복적인 EO 멸균 회차에 따른 추세적 변화를 분석하기 위해 일원배치 반복측정분산분석(one-way repeated measures analysis of variance, RM-ANOVA)을 시행하였으며, 이러한 변화 추이가 기본형과 oblate형 미니공막렌즈 간 차이가 있는지 확인하기 위해서는 이원배치 반복측정분산분석(two-way RM-ANOVA)을 시행하였다. 미니공막렌즈의 EO 멸균 전후 각 시점 간 척도들의 렌즈별 짝 지은 변화의 유의성을 분석하기 위해서, 정규성 분포를 만족할 시에는 모수적 방법인 paired t-test를, 정규성 분포를 만족하지 않을 시에는 비모수적 방법인 Wilcoxon signed rank test를 사용하였다. EO 멸균 전 렌즈 척도값과 EO 멸균 후 해당 척도값의 변화량 간의 상관 관계 분석은 Spearman’s rank 상관 분석을 이용하였다. 통계 처리는 SPSS for Window (SPSS Version 19.0 Inc., Chicago, IL, USA) 통계 프로그램을 이용하였다. 유의확률(p-value)이 0.05 미만인 경우를 통계적으로 유의한 것으로 간주하였다.
미니공막렌즈 전체의 EO 멸균 전 기본만곡반경의 평균값인 7.857 ± 0.070 (평균 ± 표준오차) mm 대비 변화값은 1차 멸균 후 -0.011 ± 0.004 mm, 2차 멸균 후 -0.024 ± 0.005 mm, 3차 멸균 후 -0.021 ± 0.005 mm로서, 1-3차 멸균 후 각각에서 최초 멸균 전에 비해서 렌즈의 곡률이 가파르게 변화하였다. 이와 같은 멸균 회차에 따른 기본만곡반경의 추세적 변화는 통계적으로 유의하였다(p=0.003, Table 2). 최초 멸균 전과 1-3차 EO 멸균 후를 각각 비교하였을 시, 1차 및 2차 멸균 후에는 기본만곡반경이 유의하게 감소하였으나, 3차 멸균 이후에는 2차 멸균 후 대비 추가적으로 의미 있는 변화를 보이지 않았다(Table 2).
기본형(Onefit A)과 oblate형(Onefit A Oblate) 미니공막렌즈에서의 변화를 구분해서 파악하기 위해 하위집단 분석(subgroup analysis)을 시행하였다. 두 그룹을 구분하여 통계 분석하였을 시, 기본형 렌즈와 oblate형 렌즈 모두 EO멸균 후 렌즈들의 각 그룹 당 평균 기본만곡이 가파르게 변화하였으나 oblate형에서는 그 변화가 유의하지 않았다(Table 3). 기본형 미니공막렌즈의 3차 멸균 이후에는 전체 그룹을 대상으로 한 분석(Table 2)에서와 마찬가지로 2차 멸균 이후 대비 기본만곡반경의 추가적인 유의한 변화는 없었다(Table 3). EO 멸균 회차에 따른 기본만곡반경의 변화 추이는 기본형과 oblate형 미니공막렌즈의 두 그룹 간 통계적으로 유의한 차이가 없었다(p=0.361, Table 3).
미니공막렌즈 전체의 EO 멸균 전 렌즈 도수의 평균값인 -4.705 ± 0.433 (D) 대비 변화값은 1차 멸균 후 0.000 ± 0.016 D, 2차 멸균 후 0.030 ± 0.018 D, 3차 멸균 후 0.016 ± 0.024 D로서 평균 도수값의 절대값이 점차 감소하는 경향을 보였으나, EO 멸균 전후 모든 회차 간 짝 지은 비교분석상 유의한 변화는 보이지 않았다(Table 4).
미니공막렌즈 전체의 EO 멸균 전 중심렌즈 두께의 평균값인 0.262 ± 0.005 mm 대비 중심렌즈 두께의 변화값은 1차 멸균 후 0.000 ± 0.000 mm, 2차 멸균 후 -0.000 ± 0.000 mm, 3차 멸균 후 -0.001 ± 0.000 mm였다. 최초 멸균전과 1차 멸균 후 각각과 비교하였을 시 3차 EO 멸균 후 중심렌즈 두께의 유의한 변화를 보였지만, 그 변화폭은 미미하였다(Table 4).
미니공막렌즈의 EO 멸균 전 전체 렌즈 직경의 평균값인 14.754 ± 0.034 mm 대비 변화값은 1차 멸균 후 -0.004 ± 0.004 mm, 2차 멸균 후 0.003 ± 0.006 mm, 3차 멸균 후 -0.006 ± 0.007 mm였으며, EO 멸균 전후 모든 회차 간 짝지은 비교 분석상 유의한 변화는 보이지 않았다(Table 4).
미니공막렌즈의 4가지 렌즈 척도의 EO 멸균 전 수치가 EO 멸균 후 변화량에 영향을 미치는지 분석하고자 하였다. 기본만곡반경, 렌즈 도수, 중심렌즈 두께, 전체 렌즈 직경 모두 EO 멸균 전 수치는 3차례의 EO 멸균 후 각 척도값의 최초 EO 멸균 전 대비 변화량과 무관하였다(Fig. 2).
각막 RGP 콘택트렌즈와 산소 투과성 재질의 공막렌즈는 단순 시력 교정을 넘어서 불규칙 난시 교정을 통한 시력개선, 반흔성 난치성 안구 표면 질환에서 안구 표면의 안정화를 가져올 수 있는데, 환자에게도 안과 의사에게도 또 하나의 유용한 치료적 대안이 될 수 있기에 널리 이용되고 있다. 하드 콘택트렌즈의 처방은 주로 외래에서 시험 착용 렌즈의 피팅을 통해 이루어지기 때문에 콘택트렌즈 착용 관련 감염 방지를 위해서는 최우선적으로 검사자의 손 위생 및 환자의 눈꺼풀, 얼굴 위생에 신경 써야 하며, 뿐만 아니라 시험 착용 렌즈의 주기적인 소독 또는 멸균을 통해서 감염 전파를 방지해야 한다. 이에 본 연구를 통해서 반복적인 EO 멸균이 미니공막렌즈의 척도들에 영향을 미치는지 분석하여 시험 착용 미니공막렌즈의 EO 멸균의 실제 임상 적용 가능성을 타진하였고, 렌즈 도수, 중심렌즈 두께, 전체렌즈 직경은 반복적인 EO 멸균에도 유의한 변화가 없었으며, 기본만곡반경은 단회 EO 멸균에 의해서도 유의한 감소를 보일 수 있다는 결과를 얻었다.
녹농균(Pseudomonas aeruginosa)과 포도알균(Staphylococcus aureus) 등의 세균은 콘택트렌즈 표면에 직접 부착될 수 있고[21,22], 가시아메바(Acanthamoeba)의 영양형(tropozoite)은 RGP 콘택트렌즈에 강하게 부착될 수 있다고 보고된 바 있다[23]. 안구 감염의 흔한 원인 진균인 칸디다 알비칸스(Candida albicans) 역시 보존액에 담긴 폴리에틸린 렌즈케이스의 벽에 부착하여 살아남을 수 있다[24]. 1형 단순포진바이러스, 사람면역결핍바이러스(human immunodeficiency virus)는 눈물, 각막, 콘택트렌즈에서 검출될 수 있고[25-27], B형 간염 바이러스는 안구 표면에 노출된 후 전파될 수 있다고 알려졌다[28]. 이 때문에 통상적으로 시험 착용 콘택트렌즈의 소독은 세균, 바이러스, 진균, 가시아메바 모두에 효과적이어야 하며 현재 관련하여 열 소독, 화학 소독, 과산화수소를 이용한 산화(oxidation)의 3가지 렌즈 소독 시스템이 이용되고 있다[11]. 열 소독은 78-90°C의 고온에서 20-60분간 노출시켜야 가시아메바의 포낭형까지 죽일 수 있지만 RGP 콘택트렌즈에 열변형을 초래할 수 있기 때문에 반복적인 사용이 어려워[19] 미국 질병통제예방센터와 미국안과학회의 권고 하에 과산화수소를 이용한 산화 소독과 클로르헥시딘을 이용한 화학 소독이 선호되고 있다[10,29].
미국 질병통제예방센터에서 과산화수소를 이용한 산화소독을 권고한 것은 사람면역결핍바이러스를 파괴할 수 있는 능력에 특정하여 근거한 것이다. 하지만, 소독이 세균이 생성하는 내생 포자를 죽일 수 없는 반면, 멸균은 모든 유기체를 사멸시키는 훨씬 강력한 살균법이라는 점에서 소독과 멸균 간 감염 차단의 효과는 근본적으로 상이하다[13]. 미니공막렌즈의 적응증 중 하나인 스티븐스-존슨증후군 환자는 결막의 세균총 및 항균제 감수성의 변화가 초래되기에 착용하는 콘택트렌즈의 미생물 감염의 위험 역시 올라갈 수 있다[30-32]. 하지만 Bilgin et al [14]은 소프트 콘택트렌즈를 대상으로 과산화수소 시스템을 이용한 소독 후 기존 녹농균양성 이었던 렌즈 중 55%만 소독된 결과를 보고했고, 세라티아(Serratia)와 녹농균 중 일부가 클로르헥시딘과 벤잘코니움을 함유한 화학 소독 용액 속에서 적응하여 생존했다는 보고들도 있다[15,16]. 또한, 클로르헥시딘, polyaminopropyl biguanide, 벤잘코니움, polyquaternium-1들은 아스페르길루스(Aspergillus) 속의 진균들에 효과적이지 않다고 알려졌다[11,17,18]. 이렇듯 보고된 연구들에 따라서, 소독 방법 및 세부 프로토콜에 따라서 시험 착용 렌즈의 감염 전파를 충분하게 방지한다는 점에는 논란의 여지가 있을 수 있다.
본 연구 결과, EO 멸균 후 렌즈 도수, 중심렌즈 두께, 렌즈 전체 직경은 3회 EO 멸균을 반복하였을 때까지 유의한 변화를 보이지 않았다. 반면 기본만곡반경은 반복적인 EO멸균을 거치면서 유의한 감소를 보였다. 비록 56°C에서 시행하는 EO 멸균 과정이 100°C 이상에서 시행하는 고압증기 멸균과 78-90°C에서 시행하는 열소독에 비해 상대적으로 저온에서 이루어지나 56°C는 열 변성을 가능성을 배제할 만큼 낮은 온도는 아니며, EO 멸균 중 렌즈들이 노출 멸균 단계에서 렌즈들이 대기압의 1.5배에 해당하는 1.5 bar의 압력에 3시간 동안 노출되기 때문에 열과 압력에 의한 복합 영향의 가능성을 추측해볼 수 있다. EO 멸균 후 기본만곡반경의 감소폭은 2차 EO 멸균 후가 가장 컸는데, 이는 1차 멸균 시 렌즈가 열과 압력에 어느 정도 견뎌 변형폭이 상대적으로 작았지만 2차 멸균 이후 열과 압력 자극이 누적되면서 변화 폭이 커졌으며, 이후 3차 멸균 후에는 이미 충분히 변형된 후라 추가적인 변형의 정도가 심하지 않았던 것이라고 추측된다. EO 멸균의 기전은 단백질, DNA, RNA에 대한 알킬화(alkylation)로서[33] 세포나 미생물에 직접 작용하기 때문에 EO 가스가 렌즈의 변형에 화학적으로 영향을 미칠 수 있는 가능성은 크지 않을 것으로 예상된다.
EO 멸균 전후 기본만곡반경의 최대 변화량은 -0.024 ± 0.005 mm로, Onefit A 미니공막렌즈가 대개 0.10 mm 간격으로 시험 착용 렌즈를 구성하고 있다는 점으로 봤을 때 평균값 자체의 변화는 그리 크지 않다. 하지만, EO 소독 후 기본만곡반경이 0.10 mm 이상 변화한 개별 렌즈들이 일부 존재하였고 이는 렌즈 피팅의 정확도에 상당한 영향을 미칠 수 있는 정도이기 때문에 미니공막렌즈를 대상으로 EO 멸균을 실제 임상 환경에서 적용하기에는 쉽지 않을 수 있겠다.
EO 멸균은 장비를 갖춰야 사용할 수 있기에 1차 의료기관에서는 시행하기 어려울 수 있는 단점을 가지고 있으나, 공막렌즈 적응 질환의 비율이 각막 RGP 콘택트렌즈에 비해서는 EO 멸균 장비를 갖춘 병원급에 상대적으로 높으며 EO 멸균의 프로토콜은 대개 정해져 있고 병원에서 매우 쉽게 시행할 수 있는 장점을 가지고 있다. 하지만, 반복적인 EO 멸균은 기본만곡반경에 있어 유의한 가파름을 유발하기 때문에 통상적인 렌즈 관리 방법으로 사용하기에는 어려울 것이다. 뿐만 아니라, EO 멸균 전 렌즈 척도값들이 3차례의 EO 멸균 후 해당 척도들의 변화값들과 대체적으로 유의한 상관관계를 보이지 않았기 때문에 예측성을 가지고 선별적으로 렌즈를 선택하여 EO 멸균을 시도해보기도 무리가 있다. 다만, 일부 렌즈에서는 EO 멸균 후 기본만곡반경의 변화가 없거나 미미하였던 점을 근거로, 과산화수소수를 이용한 산화 소독이나 화학 소독에도 소독 효과가 제한적일 수 있는 안구 표면 중증 감염 과거력의 환자를 대상으로 피팅한 시험 착용 미니공막렌즈는 조심스럽게 단회의 EO 멸균을 시도해볼 수도 있겠다.
하위 그룹 분석상 oblate형의 미니공막렌즈는 EO 멸균전후 기본만곡반경을 포함하여 모든 척도에 변화가 없었다. 이는 oblate형 특성상 기본형에 비해 중심부 틈새(central clearance)를 감소시켜 더 편평하기 때문에 열 자극으로 인한 중심부 가파름 변화가 상대적으로 덜 반영되었기 때문일 가능성도 있겠으나, oblate형 렌즈가 8개로 기본형에 비해 훨씬 적었던 점이 원인으로 크게 작용했을 것이라고 판단되며 기본형과 oblate형 렌즈 간 EO 멸균 전후 기본만곡반경의 변화값이 유사했던 점은 이를 뒷받침한다.
미니공막렌즈와 안구 표면 간의 피팅 적합성 결정에 있어서 기본만곡반경 이외에도 미니공막렌즈의 시상 높이(sagittal depth)와 공막부 영역(landing zone)의 곡률반경 역시 매우 중요한 역할을 하는데, 이들 2가지 지표가 분석에 빠진 것은 본 연구의 주요 제한점들 중 하나이다. 또한 EO 멸균 전후의 산소투과성의 변화, 습윤성(wettability)의 변화 등의 기능적인 척도와 비구면도의 변화를 조사하지 못한 점, 그리고 순수 연구 목적으로 무상 공여 받은 미니공막렌즈 샘플을 대상으로 연구를 시행했기 때문에 EO 멸균을 대상으로 한 렌즈의 기본만곡반경, 렌즈 도수, 중심렌즈 두께, 전체 직경이 균일한 간격으로 모든 범위에 걸쳐 분포하지 않았다는 점 역시 한계점이다. 이들 한계점들은 향후 보다 대규모의 렌즈를 대상으로 다양한 미니공막렌즈 척도들을 분석하고 여러 멸균 방법에서의 척도 변화를 살펴보는 후속 연구들을 통해 개선되어야 하겠다.
본 연구는 최근 각광받고 있는 미니공막렌즈를 대상으로 소독보다 훨씬 강력한 살균 효과를 보이는 EO 멸균이 공막렌즈의 일차적인 구조의 변화에 미치는 영향을 최초로 분석한 연구로서, 반복적인 EO 멸균이 렌즈 도수, 중심렌즈두께, 전체 직경에 영향을 주지 않은 반면 기본만곡반경의 유의한 감소를 초래할 수 있기 때문에 EO 멸균법을 미니공막렌즈의 통상적인 관리 목적으로 사용하기에는 무리가 있겠다는 점을 제시한 데 의의가 있겠다.
Figure 2.
Correlation analyses between the baseline values of parameters including the base curve radius (BCR), the optical power, the central lens thickness (CLT), and the overall lens diameter (OD) and their post-ethylene oxide (EO) sterilization delta values from baseline. (A-D) At post-3rd EO sterilization, the baseline values of BCR (A), power (B), CLT (C) and OD (D) did not correlate with their delta changes from the baseline, respectively.
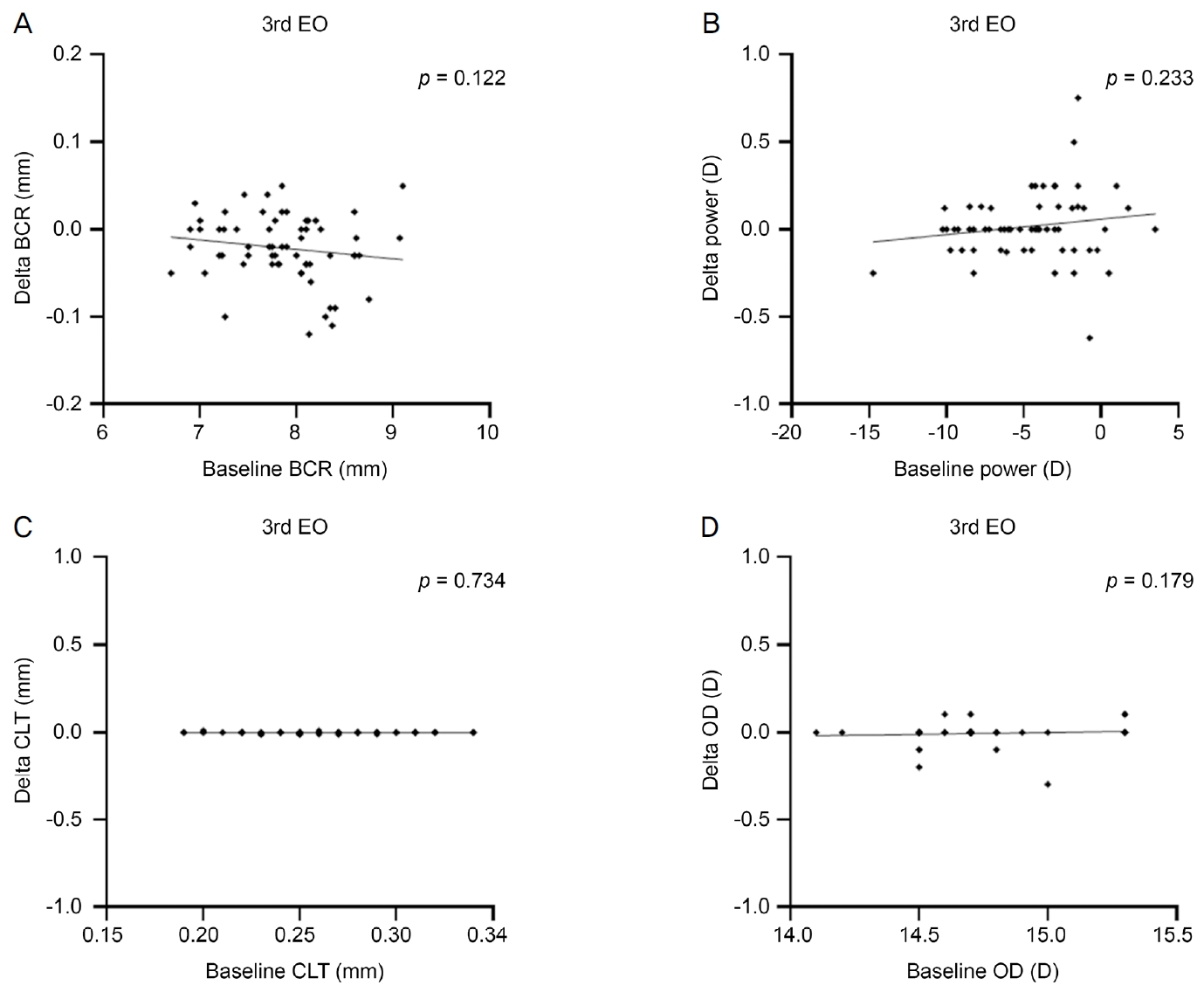
Table 1.
The range of the mini-scleral lenses according to the BCR, the optical power, the CLT and the OD before the EO sterilization
Table 2.
Analysis of the change of the BCR of mini-scleral lens before and after 3 times of the EO sterilization
| Time | BCR (mm) | Delta BCR (mm) | p-value* | |
|---|---|---|---|---|
| Baseline | 7.857 ± 0.070 | - | - | |
| 1st EO | 7.845 ± 0.069 | -0.011 ± 0.004 | vs. baseline | 0.004† |
| 2nd EO | 7.833 ± 0.069 | -0.024 ± 0.005 | vs. baseline | < 0.0001‡ |
| -0.012 ± 0.004 | vs. 1st EO | 0.006† | ||
| 3rd EO | 7.835 ± 0.069 | -0.021 ± 0.005 | vs. baseline | < 0.0001‡ |
| -0.010 ± 0.005 | vs. 1st EO | < 0.0001‡ | ||
| 0.002 ± 0.004 | vs. 2nd EO | 0.582 | ||
| Source |
BCR |
|||
| df | F | p-value§ | ||
| Time | 3 | 4.794 | 0.003† | |
Table 3.
Subgroup-analysis of the change of the BCR of mini-scleral lens before and after 3 times of the EO sterilization
|
Subgroup |
Standard type mini-scleral lens (Onefit A, n = 59) |
Oblate type mini-scleral lens (Onefit A Oblate, n = 8) |
||||||
|---|---|---|---|---|---|---|---|---|
| Time | BCR (mm) | Delta BCR (mm) | p-value* | BCR (mm) | Delta BCR (mm) | p-value† | ||
| Baseline | 7.791 ± 0.070 | - | - | 8.475 ± 0.172 | - | - | ||
| 1st EO | 7.781 ± 0.069 | -0.009 ± 0.004 | vs. baseline | 0.022† | 8.442 ± 0.176 | -0.033 ± 0.016 | vs. baseline | 0.250 |
| 2nd EO | 7.767 ± 0.068 | -0.023 ± 0.005 | vs. baseline | <0.0001§ | 8.448 ± 0.181 | -0.027 ± 0.014 | vs. baseline | 0.188 |
| -0.014 ± 0.004 | vs. 1st EO | 0.002Π | 0.007 ± 0.014 | vs. 1st EO | 0.875 | |||
| 3rd EO | 7.770 ± 0.069 | -0.021 ± 0.005 | vs. baseline | 0.0001# | 8.450 ± 0.179 | -0.025 ± 0.015 | vs. baseline | 0.313 |
| -0.012 ± 0.005 | vs. 1st EO | 0.012† | 0.008 ± 0.019 | vs. 1st EO | 0.750 | |||
| 0.002 ± 0.004 | vs. 2nd EO | 0.577 | 0.002 ± 0.019 | vs. 2nd EO | 0.875 | |||
| Source |
BCR |
|||||||
| df | F | p-value¶ | ||||||
| Time × subgroup | 3 | 1.075 | 0.361 | |||||
Table 4.
Analysis of the change of the optical power, the CLT, and the OD of mini-scleral lens before and after 3 times of EO sterilization
| Time | Optical power (D) | Delta optical power (D) | p-value* | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Baseline | -4.705 ± 0.433 | - | - | ||||||
| 1st EO | -4.704 ± 0.435 | 0.000 ± 0.016 | vs. baseline | 0.992 | |||||
| 2nd EO | -4.674 ± 0.434 | 0.030 ± 0.018 | vs. baseline | 0.107 | |||||
| 0.030 ± 0.015 | vs. 1st EO | 0.056 | |||||||
| 3rd EO | -4.688 ± 0.437 | 0.016 ± 0.024 | vs. baseline | 0.490 | |||||
| 0.017 ± 0.022 | vs. 1st EO | 0.466 | |||||||
| -0.014 ± 0.022 | vs. 2nd EO | 0.523 | |||||||
| Time | CLT (mm) | Delta CLT (mm) | p-value* | ||||||
| Baseline | 0.262 ± 0.005 | - | - | ||||||
| 1st EO | 0.262 ± 0.005 | 0.000 ± 0.000 | vs. baseline | Incalculable | |||||
| 2nd EO | 0.261 ± 0.005 | 0.000 ± 0.000 | vs. baseline | 0.321 | |||||
| 3rd EO | 0.261 ± 0.005 | 0.000 ± 0.000 | vs. 1st EO | 0.321 | |||||
| -0.001 ± 0.000 | vs. baseline | 0.020† | |||||||
| -0.001 ± 0.000 | vs. 1st EO | 0.020† | |||||||
| -0.001 ± 0.000 | vs. 2nd EO | 0.133 | |||||||
| Time | OD (mm) | Delta OD (mm) | p value‡ | ||||||
| Baseline | 14.754 ± 0.034 | - | - | ||||||
| 1st EO | 14.749 ± 0.034 | -0.004 ± 0.004 | vs. baseline | 0.999 | |||||
| 2nd EO | 14.757 ± 0.037 | 0.003 ± 0.006 | vs. baseline | 0.809 | |||||
| 0.007 ± 0.005 | vs. 1st EO | 0.273 | |||||||
| 3rd EO | 14.748 ± 0.036 | -0.006 ± 0.007 | vs. baseline | 0.531 | |||||
| -0.001 ± 0.005 | vs. 1st EO | 0.999 | |||||||
| -0.009 ± 0.006 | vs. 2nd EO | 0.213 | |||||||
| Source |
Optical power |
CLT |
OD |
||||||
| df | F | p-value‡ | df | F | p-value‡ | df | F | p-value‡ | |
| Time | 2.524 | 1.078 | 0.354 | 1.006 | 0.735 | 0.395 | 2.586 | 1.072 | 0.357 |
REFERENCES
1) Montalt JC, Porcar E, España-Gregori E, Peris-Martínez C. Visual quality with corneo-scleral contact lenses for keratoconus management. Cont Lens Anterior Eye 2018;41:351-6.


2) Yan P, Kapasi M, Conlon R, et al. Patient comfort and visual outcomes of mini-scleral contact lenses. Can J Ophthalmol 2017;52:69-73.


3) Pecego M, Barnett M, Mannis MJ, Durbin-Johnson B. Jupiter scleral lenses: the UC Davis Eye Center experience. Eye Contact Lens 2012;38:179-82.


4) Tan DT, Pullum KW, Buckley RJ. Medical applications of scleral contact lenses: 1. A retrospective analysis of 343 cases. Cornea 1995;14:121-9.


5) Pullum KW, Buckley RJ. A study of 530 patients referred for rigid gas permeable scleral contact lens assessment. Cornea 1997;16:612-22.


6) Romero-Rangel T, Stavrou P, Cotter J, et al. Gas-permeable scleral contact lens therapy in ocular surface disease. Am J Ophthalmol 2000;130:25-32.


7) Sotozono C, Yamauchi N, Maeda S, Kinoshita S. Tear exchangeable limbal rigid contact lens for ocular sequelae resulting from Stevens-Johnson syndrome or toxic epidermal necrolysis. Am J Ophthalmol 2014;158:983-93.


8) Lee SM, Kim YJ, Choi SH, et al. Long-term effect of corneoscleral contact lenses on refractory ocular surface diseases. Cont Lens Anterior Eye 2019;42:399-405.


9) Suh SY, Lee JH, Lee SU, et al. Fitting the miniscleral contact lens in patients with corneal abnormalities. J Korean Ophthalmol Soc 2016;57:1699-705.

10) Centers for Disease C. Recommendations for preventing possible transmission of human T-lymphotropic virus type III/lymphadenopathy-associated virus from tears. MMWR Morb Mortal Wkly Rep 1985;34:533-4.

11) Smith CA, Pepose JS. Disinfection of tonometers and contact lenses in the office setting: are current techniques adequate? Am J Ophthalmol 1999;127:77-84.

12) Holland MR. A review of sterilization and disinfection in dentistry. Oral Surg Oral Med Oral Pathol 1955;8:788-95.


13) Yoo JH. Review of disinfection and sterilization-back to the basics. Infect Chemother 2018;50:101-9.



14) Bilgin LK, Manav G, Tutkun IT, et al. Efficacy of a one-step hydrogen peroxide system for disinfection of soft contact lenses. CLAO J 1993;19:50-2.


15) Gandhi PA, Sawant AD, Wilson LA, Ahearn DG. Adaptation and growth of Serratia marcescens in contact lens disinfectant solutions containing chlorhexidine gluconate. Appl Environ Microbiol 1993;59:183-8.



16) Keeven J, Wrobel S, Portoles M, DeCicco BT. Evaluating the preservative effectiveness of RGP lens care solutions. CLAO J 1995;21:238-41.

17) McLaughlin WR, Hallberg KB, Tuovinen OH. Chemical inactivation of microorganisms on rigid gas permeable contact lenses. Optom Vis Sci 1991;68:721-7.


18) Rosenthal RA, Stein JM, McAnally CL, Schlech BA. A comparative study of the microbiologic effectiveness of chemical disinfectants and peroxide-neutralizer systems. CLAO J 1995;21:99-110.

20) Lerouge S, Wertheimer MR, Yahia LH. Plasma sterilization: a review of parameters, mechanisms, and limitations. Plasma Process Polym 2001;6:175-88.
21) Ajayi BO, Kio FE, Otajevwo FD. Adhesive capabilities of Staphylococcus aureus and Pseudomonas aeruginosa isolated from tears of HIV/AIDS patients to soft contact lenses. Glob J Health Sci 2012;4:140-8.

22) Willcox MD. Pseudomonas aeruginosa infection and inflammation during contact lens wear: a review. Optom Vis Sci 2007;84:273-8.


23) Sharma S, Ramachandran L, Rao GN. Adherence of cysts and trophozoites of Acanthamoeba to unworn rigid gas permeable and soft contact lenses. CLAO J 1995;21:247-51.

24) May LL, Gabriel MM, Simmons RB, et al. Resistance of adhered bacteria to rigid gas permeable contact lens solutions. CLAO J 1995;21:242-6.

25) Ramchandani M, Kong M, Tronstein E, et al. Herpes simplex virus type 1 shedding in tears and nasal and oral mucosa of healthy adults. Sex Transm Dis 2016;43:756-60.



26) Ablashi DV, Sturzenegger S, Hunter EA, et al. Presence of HTLV-III in tears and cells from the eyes of AIDS patients. J Exp Pathol 1987;3:693-703.

27) Fujikawa LS, Salahuddin SZ, Ablashi D, et al. HTLV-III in the tears of AIDS patients. Ophthalmology 1986;93:1479-81.


28) Bond WW, Peterson NJ, Favero MS, et al. Transmission of type B viral hepatitis via eye inoculation of a chimpanzee. J Clin Microbiol 1982;15:533-4.



29) Lichter PR. Controlling risks of the possible transmission of human immunodeficiency virus. Notice of American Academy of Ophthalmology Clinical Alert 2/4. Ophthalmology 1989;96:1.

30) Frizon L, Araújo MC, Andrade L, et al. Evaluation of conjunctival bacterial flora in patients with Stevens-Johnson Syndrome. Clinics (Sao Paulo) 2014;69:168-72.



31) Yin VT, Weisbrod DJ, Eng KT, et al. Antibiotic resistance of ocular surface flora with repeated use of a topical antibiotic after intravitreal injection. JAMA Ophthalmol 2013;131:456-61.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 2,891 View
- 97 Download
- Related articles
-
Changes in Ocular Surface after Hematopoietic Stem Cell Transplantation.2016 November;57(11)





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



