 |
 |
| J Korean Ophthalmol Soc > Volume 64(6); 2023 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņØś ņĀäļ░®ņłś ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ļČäņäØĒĢśņŚ¼ Ļ░ü ņ¦łĒÖśņØś ļ│æņØĖņŚÉ ņŻ╝ņÜö ĻĖ░ņŚ¼ļź╝ ĒĢśļŖö ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
ņ┤Ø 57ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ Ļ░ü ĻĘĖļŻ╣ļŗ╣ 19ļ¬ģņö® ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ, ņĀĢņāü ļīĆņĪ░ĻĄ░ ņäĖ ĻĄ░ņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņśĆļŗż. Ļ░ü ĻĘĖļŻ╣ļŗ╣ ņĀäļ░® ļé┤ epidermal growth factor (EGF), vascular endothelial growth factor-C (VEGF-C), monocyte chemoattractant protein-1 (MCP-1), hepatocyte growth factor (HGF), interleukin (IL)-3, IL-8, IL-6, IL-12p40, intercellular adhesion molecule 1 (ICAM-1) ļåŹļÅäļź╝ ņĖĪņĀĢĒĢ£ Ēøä ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅä ļ╣äĻĄÉļź╝ ņ£äĒĢ┤ Kruskal-Wallis test, Mann-Whitney U testļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ ļ╣äĻĄÉņŚÉņä£ļŖö EGF, VEGF-C, MCP-1, HGF, IL-3, IL-8ņØ┤ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆĻ▓ī ļéśĒāĆļé¼ņ£╝ļ®░(p=<0.0001, <0.0001, 0.004, 0.015, <0.0001, 0.014), ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ ļ╣äĻĄÉņŚÉņä£ļŖö EGF, VEGF-C, IL-3, IL-8ņØ┤ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆĻ▓ī ļéśĒāĆļé¼ļŗż(p=<0.0001, <0.0001, <0.0001, 0.005). ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ ļ╣äĻĄÉņŚÉņä£ļŖö EGFĻ░Ć ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆĻ▓ī ļéśĒāĆļé¼ļŗż(p=0.001).
ABSTRACT
Purpose
To investigate the cytokine concentrations of aqueous humor in patients with exudative age-related macular degeneration (AMD) and diabetic macular edema (DME).
Methods
Fifty-seven subjects were included in the exudative AMD, DME and control groups, each group has 19 patients. Aqueous levels of cytokines epidermal growth factor (EGF), vascular endothelial growth factor-C (VEGF-C), monocyte chemoattractant protein-1 (MCP-1), hepatocyte growth factor (HGF), interleukin (IL)-3, IL-8, IL-6, IL-12p40, intercellular adhesion molecule 1 (ICAM-1) were investigated in each groups. Kruskal-Wallis test and Mann-Whitney U test were performed to compare cytokine concentrations.
Results
Aqueous levels of EGF, VEGF-C, MCP-1, HGF, IL-3, IL-8 were significantly higher in exudative AMD group than control group (p = < 0.0001, < 0.0001, 0.004, 0.015, < 0.0001, 0.014) and EGF, VEGF-C, IL-3, IL-8 were significantly higher in DME group than control group (p = < 0.0001, < 0.0001, < 0.0001, 0.005). In the comparison between the exudative AMD and DME groups, EGF was significantly higher in the exudative AMD group (p = 0.001).
ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØĆ ļģĖņØĖ ņØĖĻĄ¼ņŚÉņä£ ļ╣äĻ░ĆņŚŁņĀüņØĖ ņżæņ”Ø ņŗ£ļĀźņןņĢĀņØś ņŻ╝ņÜö ņøÉņØĖņ£╝ļĪ£ ļæÉ ņ¦łĒÖśņØś ļ░£ņāØĻ│╝ ņ¦äĒ¢ēņŚÉļŖö ĒśłĻ┤ĆņŗĀņāØĻ│╝ ņŚ╝ņ”ØņØ┤ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ£ļŗż. ĻĘĖļÅÖņĢł ļæÉ ņ¦łĒÖśņØś ļ│æļ”¼ĻĖ░ņĀäņŚÉ Ļ┤ĆĒĢ£ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ļŗżņ¢æĒĢ£ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ ņĀäļ░®ņłś ļé┤ņŚÉņä£ ļ░£Ļ▓¼ļÉśņŚłņ£╝ļ®░, ĒŖ╣ņĀĢ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓░Ļ│╝ļōżņØ┤ ņ׳ļŗż.1-3 ĒŖ╣Ē׳, ļæÉ ņ¦łĒÖśņØś ņ¦äĒ¢ēņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ņżæņÜöĒĢ£ ņä▒ņןņØĖņ×ÉļĪ£ ņŗĀņāØĒśłĻ┤Ć ļ░Å ĒśłĻ┤Ć Ēł¼Ļ│╝ņä▒ņØä ņĪ░ņĀłĒĢśļŖö ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É(vascular endothelial growth factor, VEGF)Ļ░Ć Ļ░Ćņן ļ¦ÄņØ┤ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░, ņØ┤ļŖö ļŗ©ĒĢĄĻĄ¼ ļ░Å ĒśłņåīĒīÉņØä ĒżĒĢ©ĒĢ£ ļ¬©ļōĀ ņŚ╝ņ”ØņäĖĒżļź╝ ĒÖ£ņä▒ĒÖöņŗ£ņ╝£ ĻĄŁņåī ņŚ╝ņ”ØņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż.4,5 ļśÉĒĢ£, ĻĘĖļÅÖņĢł ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ VEGF ņÖĖņŚÉļÅä ļŗżļźĖ ļ¦ÄņØĆ ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖļōżņØ┤ ļæÉ ņ¦łĒÖśņØ┤ ņ׳ļŖö ļłłņŚÉņä£ ļåÆņØĆ ļåŹļÅäļĪ£ ļ░£Ļ▓¼ ļÉśņŚłļŖöļŹ░, ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØĆ ņĢłņĪ░ņ¦üņØś ļ░▒ĒśłĻĄ¼ ņ╣©ņ£żņŚÉ ņØśĒĢ£ ļ¦Øļ¦ēņĪ░ņ¦üņåÉņāüņØä ņ£Āļ░£ĒĢśļ®░, ņŗĀņāØĒśłĻ┤Ć ļ░£ņāØņŚÉļÅä ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ļŗż.6,7 VEGF Ļ│╝ļ░£ĒśäņŚÉ ļö░ļźĖ ĒśłĻ┤ĆņŗĀņāØņØ┤ ņŚ╝ņ”ØņØś ņøÉņØĖņØĖņ¦Ć Ēś╣ņØĆ Ļ▓░Ļ│╝ņØĖņ¦ĆļŖö ņĢäņ¦ü ļ¬ģĒÖĢĒ׳ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśņ£╝ļéś, ĒśłĻ┤ĆņŗĀņāØĻ│╝ ņŚ╝ņ”ØņØ┤ ņāüĒśĖ ņØśņĪ┤ņĀüņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦ĆĻ│Ā ņ׳ļŗż.8,9
ĻĘĖļÅÖņĢł ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉļōżņØś ņĀäļ░®ņłś ļ░Å ņ£Āļ”¼ņ▓┤ ļČäņäØņØä ĒåĄĒĢ┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś ņŚŁĒĢĀņØä ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ¦ÄņØ┤ ņ¦äĒ¢ēļÉśņŚłņ¦Ćļ¦ī ņä£ļĪ£ ņāüņØ┤ĒĢ£ Ļ▓░Ļ│╝ļź╝ Ļ░¢ļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśņ£╝ļ®░, ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ļŖö Ļ░ü ņ¦łĒÖśņØä ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēļÉ£ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż.1-3 ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░ü 3ĻĄ░ņŚÉņä£ ņĀäļ░®ņłś ļé┤ ņŚ¼ļ¤¼ ņóģļźśņØś ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ņĖĪņĀĢĒĢśņŚ¼ ĻĘĖ ņ░©ņØ┤ļź╝ ļ╣äĻĄÉ ļČäņäØĒĢ┤ ļ│┤Ļ│Āņ×É ĒĢśņśĆņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢ┤ Ļ░ü ņ¦łĒÖśņØś ļ│æņØĖņŚÉ ņŻ╝ņÜö ĻĖ░ņŚ¼ļź╝ ĒĢśļŖö ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØä Ļ░Éļ│äĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ļ│Ė ļģ╝ļ¼ĖņØĆ ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ ņŚ░ĻĄ¼Ļ│╝ņĀĢņØĆ ļ¬ģņ¦Ćļ│æņøÉ ĻĖ░Ļ┤Ćņ£żļ”¼ņŗ¼ņØś ņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖņØä ļ░øņĢä ņ¦äĒ¢ēĒĢśņśĆĻ│Ā(IRB ņŖ╣ņØĖļ▓łĒśĖ: MJH 2018-01-039), ĒŚ¼ņŗ▒ĒéżņäĀņ¢Ė(Declaration of Helsinki)ņØä ņżĆņłśĒĢśņśĆļŗż. 2018ļģä 3ņøöļČĆĒä░ 2020ļģä 11ņøöĻ╣īņ¦Ć ļ│ĖņøÉ ņĢłĻ│╝ ņÖĖļלņŚÉ ļé┤ņøÉĒĢ£ ĒÖśņ×É 57ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆņ£╝ļ®░, ņŚ░ĻĄ¼ņŚÉ ņ░ĖņŚ¼ĒĢśĻĖ░ ņĀäņŚÉ ļ¬©ļōĀ ĒÖśņ×ÉļĪ£ļČĆĒä░ ņé¼ņĀä ļÅÖņØśļź╝ ņ¢╗ņŚłļŗż.
ņŚ░ĻĄ¼ ļīĆņāü ĒÖśņ×É ņżæ ņĢłĻĄ¼ ļé┤ ņŻ╝ņé¼ ņ╣śļŻī Ļ│╝Ļ▒░ļĀź, ņĢłĻĄ¼ ļé┤ ņłśņłĀļĀź, Ļ┤æņØæĻ│Āļ¦Øļ¦ēļĀłņØ┤ņĀĆņłĀņØä ļ░øņØĆ Ļ│╝Ļ▒░ļĀź, ļŗżļźĖ ņĢłĻ│╝ ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļīĆņāü ĒÖśņ×ÉņØś ļéśņØ┤, ņä▒ļ│äņØä ņĪ░ņé¼ĒĢśņŚ¼ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×É 19ļ¬ģ 19ņĢł, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×É 19ļ¬ģ 19ņĢłņØä ņŚ░ĻĄ¼ĻĄ░ņ£╝ļĪ£ ņäĀņĀĢĒĢśņśĆņ£╝ļ®░, Ļ│ĀĒśłņĢĢ, ļŗ╣ļć© ļō▒ņØś ĻĖ░ņĀĆ ņ¦łĒÖśņØ┤ ņŚåļŖö ļ░▒ļé┤ņןņłśņłĀ ņśłņĀĢņ×É 19ļ¬ģ 19ņĢłņØä ļīĆņĪ░ĻĄ░ņ£╝ļĪ£ ņäĀņĀĢĒĢśņśĆļŗż.
ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×É 19ļ¬ģ ņżæ ņ¢æņĢł ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×ÉļŖö ņ┤Ø 5ļ¬ģņØ┤ņŚłņ£╝ļ®░, ņØ┤ļōżņØĆ ļ¬©ļæÉ ņŗżĒŚśņĢłņØĆ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒, ļ░śļīĆņĢłņØĆ Ļ▒┤ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ņŚÉ ņØ┤ĒÖśļÉ£ ĒÖśņ×ÉļĪ£ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ņ£╝ļĪ£ ņĢłĻĄ¼ ļé┤ ņŻ╝ņé¼ ņ╣śļŻī ĻĖ░ņżĆņŚÉ ļČĆĒĢ®ĒĢ£ ĒĢ┤ļŗ╣ ņĢłņØä ņŗżĒŚśņĢłņ£╝ļĪ£ ņäĀņĀĢĒĢśņŚ¼ ļ░®ņłś ņ▒äņĘ©ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×É 19ļ¬ģ ņżæ ņ¢æņĢł ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉļŖö ņ┤Ø 6ļ¬ģņØ┤ņŚłņ£╝ļ®░, ņ¢æņĢł ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ĒÖ®ļ░śļČĆ ļæÉĻ╗śļź╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒÖ®ļ░śļČĆņóģņØ┤ ļŹöņÜ▒ ņŗ¼ĒĢ£ ļłłņØä ņŗżĒŚśņĢłņ£╝ļĪ£ ņäĀņĀĢĒĢśņŚ¼ ļ░®ņłś ņ▒äņĘ©ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņØś 52.6% (10ļ¬ģ)ļŖö ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø, 47.4% (9ļ¬ģ)ļŖö ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØ┤ņŚłļŗż.
ņĀäļ░®ņłś Ļ▓Ćņ▓┤ļŖö ņłśņłĀņŗżņŚÉņä£ ļ¼┤ĻĘĀņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņ▒äņĘ©ĒĢśņśĆņ£╝ļ®░, ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ņĢłĻĄ¼ ļé┤ ņŻ╝ņé¼ ņ╣śļŻī ņØ┤ņĀäņŚÉ, ļīĆņĪ░ĻĄ░ņØś Ļ▓ĮņÜ░ ļ░▒ļé┤ņןņłśņłĀ ņ¦üņĀäņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņÜ░ņäĀ ĒöäļĪ£ĒīīļØ╝ņ╝ĆņØĖ(proparacaine; Alcaine┬«, Alcon, Puurs, Belgium)ņ£╝ļĪ£ ņĀÉņĢłļ¦łņĘ© Ēøä 5% Ēżļ╣äļÅł ņÜöņśżļŗżņØĖ(povidone iodine)ņ£╝ļĪ£ ļłł Ēæ£ļ®┤ņØä ņåīļÅģĒĢ£ ļÆż ļłłĻ║╝ĒÆĆ ņŻ╝ņ£äņÖĆ ļłłņŹ╣ņØä ļ¼Ėņ¦łļ¤¼ ņåīļÅģĒĢśņśĆļŗż. ņØ┤Ēøä ņåīļÅģļÉ£ Ļ░£Ļ▓ĆĻĖ░ļź╝ ļłłĻ║╝ĒÆĆ ņé¼ņØ┤ņŚÉ ļü╝ņÜ░Ļ│Ā 30 gauge ļ░öļŖśņØ┤ ļŗ¼ļ”░ 1 mL ņŻ╝ņé¼ĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĀäļ░®ņ▓£ņ×Éļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņĀäļ░®ņłś ņ¢æņØĆ 0.1-0.15 mLļź╝ ņ▒äņĘ©ĒĢśņśĆļŗż. ņĀäļ░®ņłś Ļ▓Ćņ▓┤ļŖö ņ”ēņŗ£ ļ¼┤ĻĘĀ ĒŖ£ļĖīņŚÉ ņś«ĻĖ┤ Ēøä -76ŌäāņŚÉ ĻĖēņåŹ ļāēĻ░üĒĢśņŚ¼ ļ│┤Ļ┤ĆĒĢśņśĆņ£╝ļ®░, Human Magnetic Luminex performance Assay (R&D Systems, Inc., Minneapolis, MN, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż.
ļČäņäØ ļ░®ļ▓ĢņØĆ ņĀ£ņĪ░ĒÜīņé¼ņØś Ļ▓Ćņé¼ļ░®ņ╣©ņØä ņżĆņłśĒĢśņŚ¼ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ epidermal growth factor (EGF), vascular endothelial growth factor-C (VEGF-C), monocyte chemoattractant protein-1 (MCP-1), hepatocyte growth factor (HGF), interleukin (IL)-3, IL-8, IL-6, IL-12p40, intercellular adhesion molecule 1 (ICAM-1) ņ┤Ø 9Ļ░Ćņ¦Ć ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ņØĖņ×ÉļōżņØä ļČäņäØĒĢśņśĆļŗż.
Ļ░ü ņØĖņ×ÉļōżņØś Ļ▓░Ļ│╝Ļ░ÆņØĆ SPSS 26.0 for Windows (IBM Corp., Armonk, NY, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż. Demographic factor ļČäņäØņØä ņ£äĒĢ┤ one-way analysis of variance, chi-square testļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░, ļīĆņĪ░ĻĄ░ ņäĖ ĻĄ░ Ļ░ä ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅä ņ░©ņØ┤ļź╝ ļ╣äĻĄÉ ļČäņäØĒĢśĻĖ░ ņ£äĒĢ┤ Kruskal-Wallis testļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņØ┤Ēøä ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░, ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ ļæÉ ĻĄ░ņö® ņīŹņØä ņ¦Ćņ¢┤ ņé¼ĒøäļČäņäØņ£╝ļĪ£ Mann-Whitney U testļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ĻĘĖļ”¼Ļ│Ā ņĀ£1ņóģ ņśżļźśļź╝ ļ│┤ņĀĢĒĢśĻ│Āņ×É Bonferroni correctionņØä ĒåĄĒĢ┤ p-valueĻ░Ć 0.0167 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
ļīĆņāü ĒÖśņ×ÉņØś ĒÅēĻĘĀ ļéśņØ┤ļŖö ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ 75.1 ┬▒ 2.7ņäĖ, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ 73.6 ┬▒ 2.3ņäĖ, ļīĆņĪ░ĻĄ░ 74.2 ┬▒ 2.8ņäĖņśĆņ£╝ļ®░, ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ 19ļ¬ģ ņżæ 11ļ¬ģ, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ 19ļ¬ģ ņżæ 8ļ¬ģ, ļīĆņĪ░ĻĄ░ 19ļ¬ģ ņżæ 10ļ¬ģņØ┤ ļé©ņ×ÉļĪ£ ņäĖ ĻĄ░ Ļ░äņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Table 1).
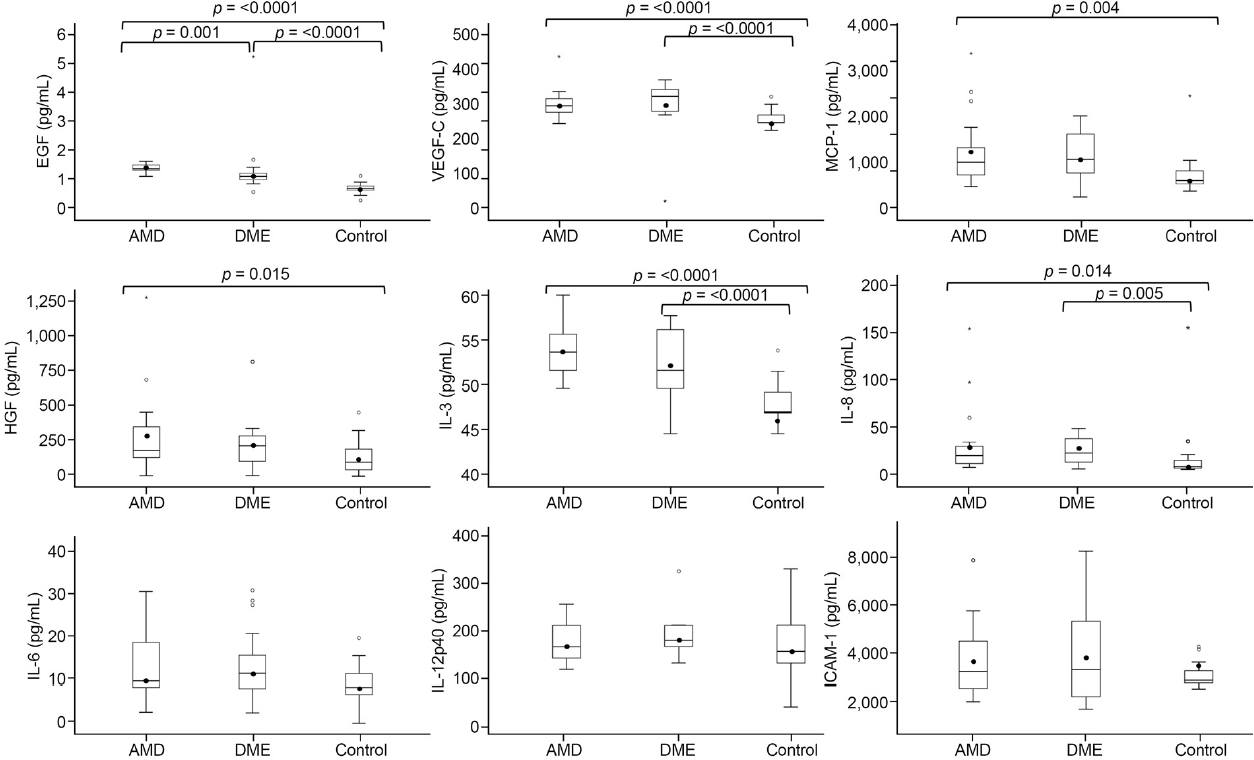
Ļ░ü ĻĘĖļŻ╣ļŗ╣ ņĀäļ░®ņłś ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļČäņäØ Ļ▓░Ļ│╝ ņé╝ņČ£ņä▒ ļéśņØ┤ Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņØś ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö EGF 1.40 ┬▒ 0.14 pg/mL, VEGF-C 300.77 ┬▒ 39.77 pg/mL, MCP-1 1,248.27 ┬▒ 760.70 pg/mL, HGF 319.62 ┬▒ 313.76 pg/mL, IL-3 53.96 ┬▒ 3.09 pg/mL, IL-8 30.08 ┬▒ 37.32 pg/mL, IL-6 10.55 ┬▒ 17.45 pg/mL, IL-12p40 171.99 ┬▒ 40.72 pg/mL, ICAM-1 3,809.89 ┬▒ 1,748.70 pg/mL, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņØś ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö EGF 1.18 ┬▒ 0.96 pg/mL, VEGF-C 296.33 ┬▒ 96.85 pg/mL, MCP-1 1,041.85 ┬▒ 532.20 pg/mL, HGF 274.91 ┬▒ 190.22 pg/mL, IL-3 52.60 ┬▒ 3.92 pg/mL, IL-8 26.57 ┬▒ 14.18 pg/mL, IL-6 12.63 ┬▒ 44.20 pg/mL, IL-12p40 180.31 ┬▒ 28.91 pg/mL, ICAM-1 3,820.01 ┬▒ 2,040.89 pg/mL, ļīĆņĪ░ĻĄ░ņØś ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö EGF 0.73 ┬▒ 0.18 pg/mL, VEGF-C 257.43 ┬▒ 24.33 pg/mL, MCP-1 781.27 ┬▒ 443.92 pg/mL, HGF 151.86 ┬▒ 126.04 pg/mL, IL-3 46.22 ┬▒ 2.34 pg/mL, IL-8 17.58 ┬▒ 34.64 pg/mL, IL-6 8.97 ┬▒ 3.39 pg/mL, IL-12p40 161.00 ┬▒ 56.45 pg/mL, ICAM-1 3,543.90 ┬▒ 499.23 pg/mLļĪ£ ņĖĪņĀĢļÉśņŚłļŗż(Table 2).
ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ Ļ░ä ļ╣äĻĄÉņŚÉņä£ļŖö EGF, VEGF-C, MCP-1, HGF, IL-3, IL-8 ņ┤Ø 6Ļ░Ćņ¦Ć ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ļåÆĻ▓ī ļéśĒāĆļé¼ņ£╝ļ®░(p=<0.0001, <0.0001, 0.004, 0.015, <0.0001, 0.014), ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ ļ╣äĻĄÉņŚÉņä£ļŖö EGF, VEGF-C, IL-3, IL-8 ņ┤Ø 4Ļ░Ćņ¦Ć ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ļåÆĻ▓ī ļéśĒāĆļé¼ļŗż(p=<0.0001, <0.0001, <0.0001, 0.005). ĻĘĖļ”¼Ļ│Ā ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ļæÉ ĻĄ░ Ļ░ä ļ╣äĻĄÉņŚÉņä£ļŖö ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉ ļ╣äĒĢ┤ EGFĻ░Ć ļåÆņØĆ ļåŹļÅäļĪ£ ņĖĪņĀĢļÉśņŚłļŗż(p=0.001) (Fig. 1).
ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņØä ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░ ļ░Å ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░ņ£╝ļĪ£ ņäĖļČäĒĢśņŚ¼ ņĀäļ░®ņłś ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļČäņäØ Ļ▓░Ļ│╝ ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░ņØś ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö EGF 1.06 ┬▒ 0.12 pg/mL, VEGF-C 285.45 ┬▒ 96.96 pg/mL, MCP-1 1,003.57 ┬▒ 556.16 pg/mL, HGF 249.78 ┬▒ 131.59 pg/mL, IL-3 52.96 ┬▒ 3.61 pg/mL, IL-8 25.15 ┬▒ 14.28 pg/mL, IL-6 12.34 ┬▒ 11.43 pg/mL, IL-12p40 176.50 ┬▒ 30.91 pg/mL, ICAM-1 3,673.50 ┬▒ 2,113.54 pg/mL, ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░ņØś ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö EGF 1.30 ┬▒ 1.28 pg/mL, VEGF-C 307.21 ┬▒ 100.89 pg/mL, MCP-1 1,080.13 ┬▒ 537.34 pg/mL, HGF 300.04 ┬▒ 223.26 pg/mL, IL-3 52.24 ┬▒ 4.34 pg/mL, IL-8 27.99 ┬▒ 14.72 pg/mL, IL-6 12.92 ┬▒ 59.27 pg/mL, IL-12p40 184.12 ┬▒ 28.18 pg/mL, ICAM-1 3,966.52 ┬▒ 2,078.20 pg/mLļĪ£ ņĖĪņĀĢļÉśņŚłņ£╝ļ®░, ļæÉ ĻĄ░ Ļ░ä ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Table 3).
ĻĘĖļÅÖņĢł ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉļōżņØś ņĀäļ░®ņłś ļ░Å ņ£Āļ”¼ņ▓┤ ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅä ļČäņäØ ņŚ░ĻĄ¼Ļ░Ć ļ¦ÄņØ┤ ņ¦äĒ¢ēļÉśņŚłņ¦Ćļ¦ī, ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ļŖö Ļ░ü ņ¦łĒÖśņØä ļīĆņāüņ£╝ļĪ£ ņ¦łĒÖśņØś ņżæņ”ØļÅäņŚÉ ļö░ļØ╝ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ¦Äļŗż.1,2 ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ņØś ņĀäļ░®ņłś ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ņĖĪņĀĢĒĢśņŚ¼ ņäĖ ĻĄ░ Ļ░ä ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦Ć ņé┤ĒÄ┤ļ│┤ņĢśļŗż.
ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ ņé┤ĒÄ┤ļ│Ė 9Ļ░Ćņ¦Ć ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ņżæ EGF, VEGF-C, IL-3, IL-8ņØ┤ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ ļ¬©ļæÉņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņØĆ ļåŹļÅäļĪ£ Ļ▓ĆņČ£ļÉśņŚłņ£╝ļ®░, MCP-1Ļ│╝ HGFĻ░Ć ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņØĆ ļåŹļÅäļĪ£ Ļ▓ĆņČ£ļÉśņŚłļŗż. ļśÉĒĢ£, ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉ ļ╣äĒĢ┤ EGFĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļåÆņØĆ ļåŹļÅäļĪ£ Ļ▓ĆņČ£ļÉśņŚłļŗż. ņČöĻ░ĆļĪ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņØä ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░Ļ│╝ ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░ņ£╝ļĪ£ ņäĖļČäĒĢśņŚ¼ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ ļæÉ ĻĄ░ Ļ░ä ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
EGFļŖö ļ¦Øļ¦ēņāēņåīņāüĒö╝ņäĖĒżņØś ņ”ØņŗØ ņ£Āļ░£ņØĖņ×ÉļĪ£, Bikbov et al10ņŚÉ ļö░ļź┤ļ®┤ geographic atrophyļź╝ Ļ░Ćņ¦ä AMD ĒÖśņ×ÉņØś ņ╣śļŻīņŚÉ EGF ņĢłļé┤ ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ cystoid macular edemaĻ░Ć ĒśĖņĀäļÉśņŚłļŗżĻ│Ā ĒĢśņśĆļŗż. ļśÉĒĢ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×ÉņŚÉņä£ EGFĻ░Ć ļåÆņØĆ ļåŹļÅäļĪ£ ņĪ┤ņ×¼ĒĢśļŖö Ļ▓āņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ EGFļŖö ļ¦Øļ¦ēĒÖ®ļ░ś ļæÉĻ╗śņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ļŗż.3 ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ ļ¬©ļæÉņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ļåŹļÅäļĪ£ Ļ▓ĆņČ£ļÉśņŚłļŗż. ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ļæÉ ĻĄ░ Ļ░ä ļ╣äĻĄÉņŚÉņä£ļŖö ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉ ļ╣äĒĢ┤ EGFĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļåÆņØĆ ļåŹļÅäļĪ£ Ļ▓ĆņČ£ļÉśņŚłļŖöļŹ░, ņØ┤ļŖö ļæÉ ņ¦łĒÖśņØś ļ░£ņāØĻĖ░ņĀäņØ┤ ļŗżļź┤ĻĖ░ ļĢīļ¼ĖņØ╝ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļ¦Øļ¦ē ņāēņåīņāüĒö╝ļŖö ļłłņŚÉņä£ ņÖĖņĖĪĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØä ĻĄ¼ņä▒ĒĢśļ®░, ņé░ĒÖö ņŖżĒŖĖļĀłņŖżļĪ£ļČĆĒä░ ļ¦Øļ¦ēņØś ļ│┤ĒśĖ, ņśüņ¢æņåī ņĀäļŗ¼ ļ░Å ļģĖĒÅÉļ¼╝ ņ▓śļ”¼, ņä▒ņןņØĖņ×É ĒĢ®ņä▒ ļ░Å ļ░®ņČ£ ļō▒ ļŗżņ¢æĒĢ£ ņŚŁĒĢĀņØä ņłśĒ¢ēĒĢ£ļŗż.11 ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ņØś ļ│æņØĖņØĆ ļ¦Øļ¦ēņāēņåīņāüĒö╝ņäĖĒżņĖĄņØś ĻĖ░ļŖźņןņĢĀļĪ£ ļ¦źļØĮļ¦ēņŗĀņāØĒśłĻ┤ĆņØ┤ ļ░£ņāØĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£, ņŗĀņāØĒśłĻ┤ĆļČäņ¦ĆņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ļé┤Ēö╝ņäĖĒżļŖö ņןļ▓ĮĻĖ░ļŖźņØ┤ ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ Ļ░ÉĻ░üņŗĀĻ▓Įļ¦Øļ¦ē, ļ¦Øļ¦ēņāēņåīņāüĒö╝ņĖĄņŚÉņä£ ļŗ©ļ░▒ņ¦ł ļ░Å ņ¦Ćļ░®ņé╝ņČ£ļ¼╝ ļō▒ņØś ļłäņČ£ņØ┤ ļ░£ņāØĒĢśĻ▓ī ļÉ£ļŗż. ĒŖ╣Ē׳, ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄņŚÉņä£ ņ×ÉļØ╝ĻĖ░ ņŗ£ņ×æĒĢ£ ĒśłĻ┤ĆņØĆ ĒīīņŚ┤ļÉ£ ļĖīļŻ©Ēü¼ļ¦ēņØä ĒåĄĒĢ┤ ĒÖ®ļ░śļČĆĻ╣īņ¦Ć ņ╣©ļ▓öņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ¢┤12 ļ¦Øļ¦ēņāēņåīņāüĒö╝ņäĖĒżņØś ņåÉņāüņØ┤ ļŹöņÜ▒ Ēü┤ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ņØ┤ņŚÉ ļ░śĒĢ┤ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØĆ ļ¦īņä▒ Ļ│ĀĒśłļŗ╣ņŚÉ ļö░ļźĖ ļ»ĖņäĖĒśłĻ┤Ć ņØ┤ņāü ļ░Å ĒÅÉņćäĻ░Ć ņŻ╝ņÜöĒĢ£ ļ│æņØĖņ£╝ļĪ£, ņØ┤ļĪ£ ņØĖĒĢ£ ļ¦Øļ¦ēņØś ĒŚłĒśłņä▒ ņåÉņāüņØĆ ņØ┤ņ░©ņĀüņ£╝ļĪ£ ļŗżņ¢æĒĢ£ ņä▒ņןņØĖņ×É ļČäļ╣äļź╝ ņØ╝ņ£╝ņ╝£, ļé┤ņĖĪĒśłņĢĪļ¦Øļ¦ēņןļ▓ĮņØś ņåÉņāüņØä ņ┤łļלĒĢśĻ│Ā ņäĖĒżņÖĖĻ░äņ¦łņĢĪņØś ņČĢņĀüņØä ņĢ╝ĻĖ░ĒĢ£ļŗż. ļśÉĒĢ£ ļŗżņ¢æĒĢ£ ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØä ļ¦żĻ░£ļĪ£ ĒĢ£ ņŚ╝ņ”Ø ļ░śņØæļÅä ļČĆņóģņØś ļ░£ņāØĻ│╝ ņāüĻ┤ĆņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ņ£╝ļ®░, ĻĘĖ ņÖĖņŚÉļÅä ļŗ╣ļć© ĒÖśņ×ÉņŚÉņä£ļŖö ņĀĢņāüņØĖĻ│╝ ļŗ¼ļ”¼ ļČłņÖäņĀä Ēøäņ£Āļ”¼ņ▓┤ļ░Ģļ”¼Ļ░Ć ļ¦ÄĻ│Ā, ņ£Āļ”¼ņ▓┤ņä¼ņ£ĀļŖö ņłśņČĢļÉśņ¢┤ ņ׳ņ£╝ļ®░, ļ¦Øļ¦ēņĢ×ļ¦ēņØś ļ░£ņāØ ļ╣łļÅäļÅä ļåÆĻĖ░ ļĢīļ¼ĖņŚÉ ņ£Āļ”¼ņ▓┤ĒÖ®ļ░śĻ▓¼ņØĖ ļśÉĒĢ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ņøÉņØĖ ĻĖ░ņĀäņØ┤ ļÉĀ ņłś ņ׳ļŗż.13,14 ļ¼╝ļĪĀ ļ¦Øļ¦ēņāēņåīņāüĒö╝ņäĖĒżņØś ņØ┤ņāüļÅä ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģņØś ļ░£ņāØņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļéś15 ņØ┤ļŖö ļ░£ļ│æņØś ņŻ╝ņÜö ļ®öņ╗żļŗłņ”śņØ┤ ņĢäļŗłļŗż. ļö░ļØ╝ņä£ ļæÉ ņ¦łĒÖśņØś ļ░£ļ│æĻĖ░ņĀäņØä Ļ│ĀļĀżĒĢśņśĆņØä ļĢī, ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņØ┤ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉ ļ╣äĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ ļ¦Øļ¦ēņāēņåīņāüĒö╝ņäĖĒżņĖĄņØś ņåÉņāüņØ┤ ļŹöņÜ▒ ļ¦Äņ£╝ļ»ĆļĪ£ ļ¦Øļ¦ēņāēņåīņāüĒö╝ņäĖĒżņØś ņ”ØņŗØņØä ļŗ┤ļŗ╣ĒĢśļŖö EGFņØś ļåŹļÅäĻ░Ć ļŹöņÜ▒ ļåÆĻ▓ī ņĖĪņĀĢļÉ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
VEGFļŖö ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ļ░£ņāØņØś ņŻ╝ņÜö ĻĖ░ņŚ¼ņØĖņ×ÉļĪ£, VEGF Ēī©ļ░Ćļ”¼ ņżæ VEGF-CļŖö ņŻ╝ļĪ£ ļ”╝ĒöäĻ┤Ć ņŗĀņāØ ļ░Å ĒśłĻ┤ĆņŗĀņāØņØä ļŗ┤ļŗ╣ĒĢśļ®░ VEGF-AņÖĆ ņŗ£ļäłņ¦Ćļź╝ ņØ╝ņ£╝ņ╝£ ņŗĀņāØĒśłĻ┤ĆņØä ļ¦īļōżĻ│Ā, ĒśłĻ┤Ć Ēł¼Ļ│╝ņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝£ ļ¦Øļ¦ēņāēņåīņāüĒö╝ņĖĄņØä ņåÉņāüņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. Cabral et al16ņØś ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņĢłĻĄ¼ ļé┤ ņŻ╝ņé¼ Ēøä ļ░®ņłś ļé┤ VEGF-AņØś ļåŹļÅäļŖö Ļ░ÉņåīĒĢ£ ļ░śļ®┤, VEGF-CņØś ļåŹļÅäļŖö ņ”ØĻ░ĆĒĢśņśĆļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, ņØ┤ļź╝ ņŗĀņāØĒśłĻ┤Ć ĒśĢņä▒ņØä ņ£äĒĢ£ ņāłļĪ£ņÜ┤ Ļ▓ĮļĪ£ņ×äņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ ļ¬©ļæÉņŚÉņä£ VEGF-C ļåŹļÅäĻ░Ć ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż. ņØ┤ļŖö ņØ┤ļ¤¼ĒĢ£ ņ¦łĒÖśņŚÉņä£ ĒśłĻ┤ĆņŗĀņāØņŚÉ VEGF-A ņÖĖņŚÉļÅä VEGF-CņØś ļ░£ĒśäņØ┤ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņØä ņØśļ»ĖĒĢśļ®░, ņĢ×ņ£╝ļĪ£ OPT-302 (VEGF-CņÖĆ VEGF-D ņ¢ĄņĀ£)ņÖĆ Ļ░ÖņØĆ combined anti-VEGF ņĀ£ņĀ£Ļ░Ć anti-VEGF A ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåļŖö ĒÖśņ×ÉļōżņŚÉĻ▓ī ņŻ╝ņÜö ņ╣śļŻī targetņØ┤ ļÉĀ ņłś ņ׳ņØīņØä ļÆĘļ░øņ╣©ĒĢ£ļŗż.17
IL-3ņØś ņŻ╝ņÜö ĻĖ░ļŖźņØĆ ļŗżņ¢æĒĢ£ ĒśłņĢĪņäĖĒżņØś ļåŹļÅäļź╝ ņĪ░ņĀłĒĢśļŖö Ļ▓āņ£╝ļĪ£, ņäĖĒżņé¼ļź╝ ņśłļ░®ĒĢśĻ│Ā ļīĆņŗØņäĖĒż, ļ╣äļ¦īņäĖĒż, Ļ▒░ĒĢĄĻĄ¼ņØś ņāØņĪ┤ņØä ņ┤ēņ¦äĒĢśņŚ¼ ņŚ╝ņ”Ø Ļ│╝ņĀĢņØä ņĪ░ņĀłĒĢ£ļŗż. IL-8ņØĆ ĒŚłĒśłņä▒ ļ¦Øļ¦ēņØś ļé┤Ēö╝ņäĖĒżņÖĆ ņŗĀĻ▓ĮĻĄÉņäĖĒżņŚÉņä£ ņāØņä▒ļÉśņ¢┤ ņŚ╝ņ”Ø ļ░Å ĒśłĻ┤Ć ņŗĀņāØņØä ņ£Āļ░£ĒĢ£ļŗż. ĒŖ╣Ē׳ IL-8ņØś Ļ▓ĮņÜ░ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ļ¦Øļ¦ēĒĢśņĢĪņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ļ¦Øļ¦ēĒĢśņĢĪņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢ┤ ļåŹļÅäĻ░Ć ļŹöņÜ▒ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļéś, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ņ¦äĒ¢ēņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĪīņ£╝ļ®░,18 Brelen et al19ņŚÉ ļö░ļź┤ļ®┤ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ IL-8 ļåŹļÅä ņ”ØĻ░ĆļŖö ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņĢģĒÖöņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ IL-3ņÖĆ IL-8 ļ¬©ļæÉ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉņä£ ņ”ØĻ░ĆļÉ£ ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż.1,3
MCP-1ņØĆ ļŗ©ĒĢĄĻĄ¼ ļ░Å ļīĆņŗØņäĖĒżņØś ņØ┤ļÅÖ ļ░Å ņ╣©ņ£żņØä ņĪ░ņĀłĒĢśļŖö ņØĖņ×ÉļĪ£, ļŗ©ĒĢĄĻĄ¼ ļ¬©ņ¦æņØĆ ņŚ╝ņ”Ø ļ░Å ĒśłĻ┤ĆņŗĀņāØ Ļ│╝ņĀĢņØä Ļ░£ņŗ£ĒĢśļŖö ņ┤łĻĖ░ ļŗ©Ļ│äļź╝ ļŗ┤ļŗ╣ĒĢ£ļŗż. ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ņŚÉņä£ MCP-1ņØś ņĢłļé┤ ļåŹļÅäĻ░Ć ĒÖ®ļ░śļČĆņóģņØś ņĀĢļÅä ļ░Å ņżæņŗ¼ņśżļ¬®ĒĢś ļ¦źļØĮļ¦ēņŗĀņāØĒśłĻ┤Ćļ¦ēņØś ņ×äņāü ņ£ĀĒśĢĻ│╝ ņ£ĀņØśĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ, ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ļ░£ļ│æņŚÉ ņŻ╝ņÜö ĻĖ░ņŚ¼ļź╝ ĒĢśĻ│Ā ņ׳ņØīņØ┤ ņĢīļĀżņĀĖ ņ׳ļŗż.20 ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņŚŁņŗ£ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņ¢┤ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ļÆĘļ░øņ╣©ĒĢĀ ņłś ņ׳ņŚłļŗż.
HGFļŖö ņ£ĀļĪ£ĒéżļéśņĀ£ ļ░£ĒśäņØä ĒåĄĒĢ┤ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒż ņØ┤ļÅÖ ĒÖ£ņä▒ņØä ņ×ÉĻĘ╣ĒĢ©ņ£╝ļĪ£ņŹ© ļ¦Øļ¦ēĒśłĻ┤ĆņŗĀņāØ Ļ░£ņŗ£ ļ░Å ļ░£ļŗ¼ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×ÉņŚÉņä£ ļåÆņØĆ ļåŹļÅäļĪ£ Ļ▓ĆņČ£ļÉśļ®░, ĒÖ®ļ░śļČĆ ļæÉĻ╗śņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ļŗż.3 ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä HGFĻ░Ć ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ļåŹļÅäļĪ£ ņĖĪņĀĢļÉśņŚłļŗż.
ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ Ļ░ä MCP-1 ļ░Å HGFņØś ļåŹļÅäļŖö ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŖöļŹ░, ņØ┤ļŖö ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņÖĆ ņāüņØ┤ĒĢ£ Ļ▓░Ļ│╝ņØ┤ļŗż. Matsumoto et al21ņŚÉ ļö░ļź┤ļ®┤ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ MCP-1ņØ┤ ļåÆņØĆ ļåŹļÅäļĪ£ ņĪ┤ņ×¼ĒĢśļ®░, MCP-1 ļåŹļÅäņÖĆ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØś ņ¦äĒ¢ē ņĀĢļÅäņÖĆ ņ¦üņĀæņĀüņØĖ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŗżĻ│Ā ĒĢśņśĆņ£╝ļ®░, HGF ņŚŁņŗ£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ļåÆņØĆ ļåŹļÅäļĪ£ Ļ▓ĆņČ£ļÉ©ņØ┤ ļ░ØĒśĆņĀĖ ņ׳ņ£╝ļ®░,22 Brelen et al19ņŚÉ ļö░ļź┤ļ®┤ HGF ļåŹļÅä ņ”ØĻ░ĆņÖĆ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņĢģĒÖö Ļ░ä ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ņØ┤ļź╝ ĒåĀļīĆļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņāüļīĆņĀüņ£╝ļĪ£ Ļ▓Įņ”ØņØś ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉļōżņØ┤ ĒżĒĢ©ļÉśņ¢┤ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņāüņØ┤ĒĢ£ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņŚłņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż.
IL-6, IL-12p40, ICAM-1ņØĆ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĻĘĖļ”¼Ļ│Ā ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×É ļ¬©ļæÉņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ļŖö Ļ▓āņŚÉ ļ░śĒĢ┤,3,23-25 ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦ä ņĢŖņĢśļŗż. ĻĘĖļ¤¼ļéś ĒÅēĻĘĀ ļåŹļÅäļź╝ ļ╣äĻĄÉĒĢ┤ļ│┤ļ®┤ IL-6, IL-12p40, ICAM-1 ļ¬©ļæÉ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ĻĄ░ ļ░Å ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ņłśņ╣śļź╝ ļ│┤ņśĆļŗż.
IL-6ļŖö ļ░▒ĒśłĻĄ¼, ļé┤Ēö╝ņäĖĒż ļ░Å ņä¼ņ£ĀņĢäņäĖĒżļź╝ ĒżĒĢ©ĒĢ£ ļŗżņ¢æĒĢ£ ņäĖĒż ņ£ĀĒśĢņŚÉ ņ×æņÜ®ĒĢśņŚ¼ ņŚ╝ņ”Ø ļ░Å ļ®┤ņŚŁļ░śņØæņØä ņĪ░ņĀłĒĢśļŖö ļŗżĻĖ░ļŖź ņé¼ņØ┤ĒåĀņ╣┤ņØĖņ£╝ļĪ£ ņ¦üĻ░äņĀæņĀüņ£╝ļĪ£ VEGFņØś ļ░£ĒśäņØä ņ£ĀļÅäĒĢśņŚ¼ ĒśłĻ┤Ć Ēł¼Ļ│╝ņä▒ ņ”ØĻ░Ć ļ░Å ĒśłĻ┤ĆņŗĀņāØ ņ┤ēņ¦äņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ņ£╝ļ®░,24 IL-12p40ņØĆ ļ¦Øļ¦ēĒśłĻ┤ĆņŗĀņāØņØä ņ¢ĄņĀ£ĒĢśļŖö ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ļŗż.26 ĻĘĖļ”¼Ļ│Ā ICAM-1ņØĆ ļ░▒ĒśłĻĄ¼ ļČĆņ░®, ĒśłĻ┤ĆņŗĀņāØ Ļ│╝ņĀĢņŚÉ Ļ┤ĆņŚ¼ĒĢśļ®░ ĒśłĻ┤Ć ļłäņČ£, ļé┤Ēö╝ņäĖĒż ņåÉņāü ļō▒ ĒśłĻ┤Ć ĒĢ®ļ│æņ”Ø ļ░£ļ│æņŚÉ ņŻ╝ņÜö ņŚŁĒĢĀņØä ĒĢśļŖö ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ļŗż.27
ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ IL-6ņÖĆ ICAM-1ņØś ļåŹļÅäļŖö ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ņ¦łĒÖśņØś ņżæņ”ØļÅäņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ļŗż.2,24,28 ļśÉĒĢ£ ICAM-1ņØĆ ĒÖ£ņä▒ĒśĢ ņ”ØņŗØļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ļ╣äĒÖ£ņä▒ĒśĢ ņ”ØņŗØļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ļåŹļÅäļĪ£ ņĪ┤ņ×¼ĒĢśļ®░,28 ICAM-1ņØś ļåŹļÅäņÖĆ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņāü ĒÖ®ļ░śļČĆņóģņØś ņżæņ”ØļÅäņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ļŗż.2 ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ Jonas et al3ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö IL-12p40 ļåŹļÅäĻ░Ć ĒÖ®ļ░śļČĆ ļæÉĻ╗śņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżĻ│Ā ĒĢśņśĆņ£╝ļ®░, IL-6 ļåŹļÅäļŖö ļ¦Øļ¦ēņāēņåīņāüĒö╝ļ░Ģļ”¼ņØś ļåÆņØ┤ņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŚ░ĻĄ¼ ļīĆņāüņ×ÉļōżņØä ņ¦łĒÖśņØś ņżæņ”ØļÅäņŚÉ ļö░ļØ╝ ļČäļźśĒĢśņ¦Ć ņĢŖņĢä ņāüļīĆņĀüņ£╝ļĪ£ Ļ▓Įņ”ØņØś ĒÖśņ×ÉļōżņØ┤ ļ¦ÄņØ┤ ĒżĒĢ©ļÉśņ¢┤ ņ׳ņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļ®░ ļŹöļČłņ¢┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś ļŗżņ¢æņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░Ļ│╝ ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░ ļæÉ ĻĄ░ Ļ░ä ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØś ņżæņ”ØļÅäņŚÉ ļö░ļØ╝ ņĀäļ░®ņłś ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ļ╣äĻĄÉĒĢ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņÖĆļŖö ņāüņØ┤ĒĢ£ Ļ▓░Ļ│╝ļĪ£, ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ IL-6, IL-8, VEGF, ICAM-1, MCP-1ņØä ĒżĒĢ©ĒĢ£ ņØ╝ļČĆ ņé¼ņØ┤ĒåĀņ╣┤ņØĖļōżņØ┤ ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉ ļ╣äĒĢ┤ ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņ£╝ļ®░, ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×É ņżæņŚÉņä£ļÅä ņŗĀņāØĒśłĻ┤Ć ļģ╣ļé┤ņן ļÅÖļ░ś ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ ļŹöņÜ▒ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż.29 ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģĻĄ░ņØä ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░Ļ│╝ ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻĄ░ņ£╝ļĪ£ ņäĖļČäĒĢśņśĆņØä ļĢī Ļ░ü ĻĄ░ņØś ņŚ░ĻĄ¼ ļīĆņāüņ×É ņłśĻ░Ć ĒśäņĀĆĒ׳ ņżäņ¢┤ļōżņ¢┤ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņ¦Ć ļ¬╗ĒĢśņśĆņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļ®░, ļŹöļČłņ¢┤ ņāüļīĆņĀüņ£╝ļĪ£ ņżæņ”ØņØś ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ļ░Å Ļ▓Įņ”ØņØś ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ĒÖśņ×ÉĻ░Ć ļ¦ÄņØ┤ ĒżĒĢ©ļÉśņ¢┤ ņ׳ņ¢┤ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņÖĆļŖö ņāüņØ┤ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ņØ┤ ņĀÉņŚÉ ļīĆĒĢ┤ņä£ļŖö ņČöĒøä ļīĆĻĘ£ļ¬© ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£, ļ╣äņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØĻ│╝ ņ”ØņŗØņä▒ ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņØś ņ¦łĒÖś ņżæņ”ØļÅäļź╝ ņäĖļČäĒĢśņŚ¼ ņČöĻ░Ć ļČäņäØņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļŗżņØīĻ│╝ Ļ░ÖņØĆ ĒĢ£Ļ│äņĀÉņØ┤ ņ׳ļŗż. ņ▓½ņ¦Ė, ņ£Āļ”¼ņ▓┤ļź╝ ļīĆņŗĀĒĢśņŚ¼ ņĀäļ░®ņłś ņāśĒöīņØä ņ▒äņĘ©ĒĢ┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ļČäņäØĒĢ£ ņŚ░ĻĄ¼ļĪ£ ņĢł ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ņÖäņĀäĒ׳ ļ░śņśüĒĢśĻĖ░ņŚÉļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ņØä ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņĀäļ░®ņłśņÖĆ ņ£Āļ”¼ņ▓┤ļź╝ ļ¬©ļæÉ ņØ┤ņÜ®ĒĢśņŚ¼ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ņĖĪņĀĢĒĢ£ ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņĀäļ░®ņłś ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļŖö ņ£Āļ”¼ņ▓┤ ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäņÖĆ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņØĖļŗżĻ│Ā ĒĢśņśĆļŗż.30 ļæśņ¦Ė, ņ¦łĒÖśņØś ņżæņ”ØļÅäļź╝ ĻĄ¼ļČäĒĢśņ¦Ć ņĢŖĻ│Ā ļ¬©ņ¦æļŗ© Ļ░ä ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅä ļ╣äĻĄÉĻ░Ć ņØ┤ļŻ©ņ¢┤ņĪīļŗż. ļĢīļ¼ĖņŚÉ Ļ▓Įņ”Ø Ēś╣ņØĆ ņżæņ”ØņØś ĒÖśņ×ÉļōżņØ┤ ĒĢ£ ņ¦æļŗ©ņ£╝ļĪ£ ņ╣śņÜ░ņ│ÉņĀĖ ņ׳ņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļ»ĆļĪ£, ņČöĒøä ņ¦łĒÖśņØś ņżæņ”ØļÅäļź╝ ĻĄ¼ļČäĒĢśņŚ¼ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅäļź╝ ļ╣äĻĄÉĒĢśļŖö ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ņģŗņ¦Ė, ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉ£ ĒÖśņ×É ņłśĻ░Ć ņĀüļŗż. ņØ┤ ņĀÉņØĆ ņČöĒøä ļīĆĻĘ£ļ¬© ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
Ēśäņ×¼ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņØś ņ╣śļŻīņŚÉ Ļ│ĄĒåĄņĀüņ£╝ļĪ£ anti-VEGF ņĢłĻĄ¼ ļé┤ ņŻ╝ņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā ņ׳ļŖö Ļ░ĆņÜ┤ļŹ░, ņĢ×ņ£╝ļĪ£ļŖö ļæÉ ņ¦łĒÖśņØś ņ╣śļŻīņŚÉ ņ░©ļ│äĒÖöļÉ£ ņĀæĻĘ╝ņØ┤ ĒĢäņÜöĒĢ£ ņāüĒÖ®ņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņØś ņĀäļ░®ņłś ļé┤ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļåŹļÅä ņ░©ņØ┤ļź╝ ņ¦üņĀæņĀüņ£╝ļĪ£ ļ╣äĻĄÉĒĢ£ ļŹ░ņŚÉ ņØśņØśĻ░Ć ņ׳ņ£╝ļ®░, ļŗżņ¢æĒĢ£ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒Ļ│╝ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉņä£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłņ¦Ćļ¦ī ĒŖ╣Ē׳ EGFņØś Ļ▓ĮņÜ░ ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×ÉņŚÉņä£ ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ ĒÖśņ×ÉņŚÉ ļ╣äĒĢ┤ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ņČöĒøä ņé╝ņČ£ņä▒ ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ĒÖśņ×ÉņŚÉĻ▓ī ĒŖ╣ĒÖöļÉ£ Ēæ£ņĀü ņ╣śļŻīļĪ£ EGFļź╝ ĒÖ£ņÜ®ĒĢĀ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż.
Figure┬Ā1.
The aqueous levels (pg/mL) of cytokines in AMD, DME, and control groups. The mean values are indicated by the dots. The statistical analyses were performed with the Mann-Whitney U test (p<0.0167 by Bonferroni correction). AMD = age-related macular degeneration; DME = diabetic macular edema; EGF = epidermal growth factor; VEGF-C = vascular endothelial growth factor-C; MCP-1 = monocyte chemoattractant protein-1; HGF = hepatocyte growth factor; IL = interleukin; ICAM-1 = intercellular adhesion molecule 1.
Table┬Ā1.
Subject and subgroup demographics
Table┬Ā2.
Levels of 9 cytokines in the aqueous humor among 3 groups
|
Mean ┬▒ SD (pg/mL) |
p-value |
|||||
|---|---|---|---|---|---|---|
| AMD | DME | Control | AMD vs. Control* | DME vs. Control* | AMD vs. DME* | |
| EGF | 1.40 ┬▒ 0.14 | 1.18 ┬▒ 0.96 | 0.73 ┬▒ 0.18 | <0.0001ŌĆĀ | <0.0001ŌĆĀ | 0.001ŌĆĀ |
| VEGF-C | 300.77 ┬▒ 39.77 | 296.33 ┬▒ 96.85 | 257.43 ┬▒ 24.33 | <0.0001ŌĆĀ | <0.0001ŌĆĀ | 0.385 |
| MCP-1 | 1,248.27 ┬▒ 760.70 | 1,041.85 ┬▒ 532.20 | 781.27 ┬▒ 443.92 | 0.004ŌĆĀ | 0.02 | 0.954 |
| HGF | 319.62 ┬▒ 313.76 | 274.91 ┬▒ 190.22 | 151.86 ┬▒ 126.04 | 0.015ŌĆĀ | 0.04 | 0.863 |
| IL-3 | 53.96 ┬▒ 3.09 | 52.60 ┬▒ 3.92 | 46.22 ┬▒ 2.34 | <0.0001ŌĆĀ | <0.0001ŌĆĀ | 0.339 |
| IL-8 | 30.08 ┬▒ 37.32 | 26.57 ┬▒ 14.18 | 17.58 ┬▒ 34.64 | 0.014ŌĆĀ | 0.005ŌĆĀ | 0.665 |
| IL-6 | 10.55 ┬▒ 17.45 | 12.63 ┬▒ 44.20 | 8.97 ┬▒ 3.39 | 0.863 | 0.053 | 0.181 |
| IL-12p40 | 171.99 ┬▒ 40.72 | 180.31 ┬▒ 28.91 | 161.00 ┬▒ 56.45 | 0.488 | 0.146 | 0.435 |
| ICAM-1 | 3,809.89 ┬▒ 1,748.70 | 3,820.01 ┬▒ 2,040.89 | 3,543.90 ┬▒ 499.23 | 0.385 | 0.931 | 0.665 |
SD = standard deviation; AMD = age-related macular degeneration; DME = diabetic macular edema; EGF = epidermal growth factor; VEGF-C = vascular endothelial growth factor-C; MCP-1 = monocyte chemoattractant protein-1; HGF = hepatocyte growth factor; IL = interleukin; ICAM-1 = intercellular adhesion molecule 1.
Table┬Ā3.
Levels of 9 cytokines in the aqueous humor between NPDR and PDR group
|
Mean ┬▒ SD (pg/mL) |
p-value |
||
|---|---|---|---|
| NPDR | PDR | NPDR vs. PDR* | |
| EGF | 1.06 ┬▒ 0.12 | 1.30 ┬▒ 1.28 | 0.095 |
| VEGF-C | 285.45 ┬▒ 96.96 | 307.21 ┬▒ 100.89 | 0.278 |
| MCP-1 | 1,003.57 ┬▒ 556.16 | 1,080.13┬▒537.34 | 0.905 |
| HGF | 249.78 ┬▒ 131.59 | 300.04 ┬▒ 223.26 | 0.276 |
| IL-3 | 52.96 ┬▒ 3.61 | 52.24 ┬▒ 4.34 | 0.661 |
| IL-8 | 25.15 ┬▒ 14.28 | 27.99 ┬▒ 14.72 | 0.604 |
| IL-6 | 12.34 ┬▒ 11.43 | 12.92 ┬▒ 59.27 | 0.549 |
| IL-12p40 | 176.50 ┬▒ 30.91 | 184.12 ┬▒ 28.18 | 0.565 |
| ICAM-1 | 3,673.50 ┬▒ 2,113.54 | 3,966.52┬▒2,078.20 | 0.543 |
NPDR = non-proliferative diabetic retinopathy; PDR = proliferative diabetic retinopathy; SD = standard deviation; EGF = epidermal growth factor; VEGF-C = vascular endothelial growth factor-C; MCP-1 = monocyte chemoattractant protein-1; HGF = hepatocyte growth factor; IL = interleukin; ICAM-1 = intercellular adhesion molecule 1.
REFERENCES
1) Jonas JB, Jonas RA, Neumaier M, Findeisen P. Cytokine concentration in aqueous humor of eyes with diabetic macular edema. Retina 2012;32:2150-7.


2) Hillier RJ, Ojaimi E, Wong DT, et al. Aqueous humor cytokine levels as biomarkers of disease severity in diabetic macular edema. Retina 2017;37:761-9.


3) Jonas JB, Tao Y, Neumaier M, Findeisen P. Cytokine concentration in aqueous humour of eyes with exudative age-related macular degeneration. Acta Ophthalmol 2012;90:e381-8.


4) Gaudry M, Br├®gerie O, Andrieu V, et al. Intracellular pool of vascular endothelial growth factor in human neutrophils. Blood 1997;90:4153-61.



5) Wartiovaara U, Salven P, Mikkola H, et al. Peripheral blood platelets express VEGF-C and VEGF which are released during platelet activation. Thromb Haemost 1998;80:171-5.


6) Meleth AD, Agr├│n E, Chan CC, et al. Serum inflammatory markers in diabetic retinopathy. Invest Ophthalmol Vis Sci 2005;46:4295-301.


7) Tan W, Zou J, Yoshida S, et al. The role of inflammation in age-related macular degeneration. Int J Biol Sci 2020;16:2989-3001.



8) Romero-Aroca P, Baget-Bernaldiz M, Pareja-Rios A, et al. Diabetic macular edema pathophysiology: vasogenic versus inflammatory. J Diabetes Res 2016;2016:2156273.




9) Kauppinen A, Paterno JJ, Blasiak J, et al. Inflammation and its role in age-related macular degeneration. Cell Mol Life Sci 2016;73:1765-86.




10) Bikbov MM, Khalimov TA, Panda-Jonas S, Jonas JB. Intravitreal application of epidermal growth factor in non-exudative age-related macular degeneration. Br J Ophthalmol 2022;106:1762-6.


11) Ao J, Wood JP, Chidlow G, et al. Retinal pigment epithelium in the pathogenesis of age-related macular degeneration and photobiomodulation as a potential therapy? Clin Exp Ophthalmol 2018;46:670-86.



12) Al Gwairi O, Thach L, Zheng W, et al. Cellular and molecular pathology of age-related macular degeneration: potential role for proteoglycans. J Ophthalmol 2016;2016:2913612.


13) Klaassen I, Van Noorden CJ, Schlingemann RO. Molecular basis of the inner blood-retinal barrier and its breakdown in diabetic macular edema and other pathological conditions. Prog Retin Eye Res 2013;34:19-48.


14) Gandorfer A, Rohleder M, Grosselfinger S, et al. Epiretinal pathology of diffuse diabetic macular edema associated with vitreomacular traction. Am J Ophthalmol 2005;139:638-52.


15) Xia T, Rizzolo LJ. Effects of diabetic retinopathy on the barrier functions of the retinal pigment epithelium. Vision Res 2017;139:72-81.


16) Cabral T, Lima LH, Polido J, et al. Angiogenesis agents levels after bevacizumab intravitreal injection in patients with neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci 2016;57:3341.
17) Dugel PU, Boyer DS, Antoszyk AN, et al. Phase 1 study of OPT-302 inhibition of vascular endothelial growth factors C and D for neovascular age-related macular degeneration. Ophthalmol Retina 2020;4:250-63.


18) Yenihayat F, Ûzkan B, Kasap M, et al. Vitreous IL-8 and VEGF levels in diabetic macular edema with or without subretinal fluid. Int Ophthalmol 2019;39:821-8.



19) Brelen ME, Mohamed S, Chan C, et al. Correlation of aqueous cytokines with OCT appearance in patients with diabetic macular oedema. Invest Ophthalmol Vis Sci 2015;56:4679.
20) Jonas JB, Tao Y, Neumaier M, Findeisen P. Monocyte chemoattractant protein 1, intercellular adhesion molecule 1, and vascular cell adhesion molecule 1 in exudative age-related macular degeneration. Arch Ophthalmol 2010;128:1281-6.


21) Matsumoto Y, Takahashi M, Ogata M. Relationship between glycoxidation and cytokines in the vitreous of eyes with diabetic retinopathy. Jpn J Ophthalmol 2002;46:406-12.


22) Torres-Costa S, Alves Valente MC, Falc├Żo-Reis F, Falc├Żo M. Cytokines and growth factors as predictors of response to medical treatment in diabetic macular edema. J Pharmacol Exp Ther 2020;373:445-52.


23) Zhu D, Zhu H, Wang C, Yang D. Intraocular soluble intracellular adhesion molecule-1 correlates with subretinal fluid height of diabetic macular edema. Indian J Ophthalmol 2014;62:295-8.



24) Funatsu H, Yamashita H, Ikeda T, et al. Vitreous levels of interleukin-6 and vascular endothelial growth factor are related to diabetic macular edema. Ophthalmology 2003;110:1690-6.


25) Mastropasqua R, D'Aloisio R, Di Nicola M, et al. Relationship between aqueous humor cytokine level changes and retinal vascular changes after intravitreal aflibercept for diabetic macular edema. Sci Rep 2018;8:16548.




26) Zhou Y, Yoshida S, Kubo Y, et al. Interleukin-12 inhibits pathological neovascularization in mouse model of oxygen-induced retinopathy. Sci Rep 2016;6:28140.




27) Sim├│-Servat O, Hern├Īndez C, Sim├│ R. Usefulness of the vitreous fluid analysis in the translational research of diabetic retinopathy. Mediators Inflamm 2012;2012:872978.


28) El-Asrar AM, Nawaz MI, Kangave D, et al. High-mobility group box-1 and biomarkers of inflammation in the vitreous from patients with proliferative diabetic retinopathy. Mol Vis 2011;17:1829-38.


-
METRICS

-
- 1 Crossref
- 0 Scopus
- 943 View
- 45 Download
- Related articles




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



