 |
 |
| J Korean Ophthalmol Soc > Volume 62(9); 2021 > Article |
|
국문초록
목적
한국인에서 아이스텐트(iStent®) 또는 아이스텐트 인젝트(iStent inject®) 삽입술 시행 후 치료 효과, 예후 인자, 수술 후 발생한 합병증에 대해 분석하고자 한다.
대상과 방법
한국인에서 녹내장으로 아이스텐트 또는 아이스텐트 인젝트 삽입술을 단독 혹은 백내장수술과 병합하여 수술 후 6개월 이상 추적 관찰이 가능했던 42안을 대상으로 의무기록을 통하여 후향적으로 분석하였다. 수술 성공 여부는 수술 후 안압이 21 mmHg 미만이며, 수술 전 안압에 비하여 20% 이상 감소하였을 경우로 정의하였다.
결과
수술 후 6개월 누적 성공률은 아이스텐트 인젝트 단독 삽입술(A군)이 45.3 ± 8.1%, 아이스텐트 단독 삽입술(B군)이 28.6 ± 13.1%, 아이스텐트 인젝트와 백내장수술 병합(A-1군) 81.2 ± 6.8%, 아이스텐트와 백내장수술 병합(B-1군) 27.3 ± 21.8%로 A-1군이 B-1군에 비해 유의하게 높은 성공률(p=0.007)을 보였으며, A군과 B군의 성공률 차이는 유의하지 않았다(p=0.579). 성공 예후 인자를 콕스 회귀분석으로 분석하였을 때, 수술 전 안압이 높을수록 수술 성공률이 높은 것으로 나타났다(hazard ratio 0.80, p=0.02).
ABSTRACT
Purpose
To analyze the therapeutic effects, prognostic factors, and complications that occurred after iStent® or iStent inject® implantation in South Korean glaucoma patients.
Methods
We retrospectively analyzed 42 eyes of South Korean glaucoma patients, who were followed-up for more than 6 months after iStent® or iStent inject® implantation alone or combined with cataract surgery. Surgical success was defined as an intraocular pressure (IOP) ≤21 mmHg and an IOP reduction ≥20% from preoperative IOP levels.
Results
The cumulative success rate at 6 months after surgery was 45.3 ± 8.1% for iStent inject® alone (group A), 28.6 ± 13.1% for iStent® alone (group B), 81.2 ± 6.8% for iStent inject® combined with cataract surgery (group A-1), and 27.3 ± 21.8% for iStent® combined with cataract surgery (group B-1). Group A-1 showed a higher success rate than group B-1 (p = 0.007); the difference in success rates between groups A and B was not statistically significant (p = 0.579). When the success prognostic factors were analyzed by Cox regression analysis, the results showed that a higher preoperative IOP was associated with a higher surgical success rate (hazard ratio 0.80, p = 0.02).
전 세계적으로 녹내장은 비가역적 실명의 원인 중 큰 비중을 차지하며, 따라서 진단과 치료가 매우 중요하다[1]. 녹내장의 치료 목표는 녹내장성 시신경손상의 진행을 억제하는 것이며, 그 종류는 안약 점안, 레이저 시술, 수술적 치료가 있다. 녹내장 안약 점안은 대부분의 환자에서 녹내장 치료의 시작으로 고려되며, 안압을 낮추는 효과가 있지만 환자의 순응도, 비용, 안구 표면의 불편감을 야기하는 등의 단점이 있다[2]. 레이저 치료는 녹내장 초기의 치료로 효과적이나 시간이 지날수록 효과가 떨어져 결국 안압이 다시 상승하는 경우가 많다[3]. 안약으로 안압이 충분히 조절되지 않거나 안약에 부작용을 보이는 등의 경우에서 수술적 치료를 고려할 수 있다[4]. 기존의 침습적 녹내장수술은 안압하강의 효과가 크지만, 침습적인 만큼 저안압성 망막병증, 맥락막박리, 맥락막부종, 수술 부위의 감염 등 시력에 치명적인 영향을 주는 합병증이 보고되고 있어 보다 비침습적인 수술법에 대한 연구가 진행되어 왔다[5-7].
최근 연구 및 적용되고 있는 미세침습 녹내장수술(minimally-invasive glaucoma surgeries, MIGS)은 안압하강 효과와 더불어 기존의 침습적 녹내장수술에 비하여 수술 후 합병증 발생률을 낮추며, 회복에 필요한 시간이 비교적 짧아진다는 연구들이 보고되고 있다[8]. 미세침습 녹내장수술은 섬유주, 맥락막 위, 결막하 등으로 방수를 배출하게 되며, 단독 혹은 백내장수술과 함께 시행되고 이외에도 레이저를 이용한 공막경유 모양체광응고술, 엑시머레이저를 이용한 섬유주 절개술 등을 포함한다[9]. 섬유주 미세우회 스텐트인 아이스텐트(iStent®, Glaukos, Laguna Hills, CA, USA)와 2세대격인 아이스텐트 인젝트(iStent inject®, Glaukos, Laguna Hills, CA, USA)는 최근 녹내장 환자에게 활발하게 적용되고 있다. 또한 아이스텐트 삽입술은 백내장수술과 함께 수술할 경우 추가 절개 없이 수술이 가능하여 백내장수술 시 간편하게 수술할 수 있다[10]. 국외에서는 이에 대한 효과 및 비교된 연구가 많으나 국내에서는 이에 대한 비교와 합병증에 대한 연구가 없다. 따라서, 본 연구는 국내에서 아이스텐트 혹은 아이스텐트 인젝트 삽입술을 시행한 후 6개월 간의 치료 성적의 비교, 예후 인자와 합병증에 대해 분석하고자 한다.
본 연구는 2019년 3월부터 2021년 1월까지 인천성모병원에서 원발개방각녹내장을 진단 받고, 아이스텐트 혹은 아이스텐트 인젝트 단독 삽입술, 혹은 백내장수술과 병합하여 시행한 42안을 대상으로 의무기록을 후향적으로 분석하였다. 2019년 3월부터 수술 후 6개월 이상 추적 관찰이 가능한 환자를 대상으로 하였으며, 모든 수술은 1명의 수술자(Y.C.K)에 의해 시행되었다. 18살 이상의 성인에서, 1개 이상의 녹내장 안약을 사용하거나 안압이 21 mmHg 이상인 경우, 전방각경검사에서 섬유주가 3사분면 이상 관찰이 가능한 경우를 포함하였으며, 백내장수술이 필요한 경우에는 백내장수술을 병합하여 시행하였다. 6개월 이상 추적 관찰이 불가능한 경우, 6개월 이내에 다른 안과적 수술을 받거나 안질환을 앓은 경우, 시야 이상을 유발할 만한 다른 신경학적 질환이 있는 경우는 연구 대상에서 제외하였다. 본 연구는 헬싱키선언에 입각한 인천성모병원의 의학연구윤리 심의위원회(Institutional Review Board, IRB)로부터 승인 번호 OC21RASI0011로 심의 승인을 받아 연구를 시행하였다.
수술에 사용된 아이스텐트는 높이 0.33 mm, 길이 1.00 mm로 L 모양 티타늄 스텐트이며, 전방으로 열린 내강의 지름은 0.12 mm이다. 이는 일회용 삽입기에 삽입된 상태이다(Fig. 1A). 아이스텐트 인젝트는 높이 0.36 mm, 지름 0.36 mm의 화살표 모양의 티타늄 스텐트이며, 쉴렘관을 향해 들어가는 머리 윗부분에는 지름 0.08 mm의 중심 배출구와 옆부분엔 지름 0.05 mm의 4개의 배출구가 있으며, 일회용 삽입기에 2개의 스텐트가 삽입된 상태이다(Fig. 1B).
아이스텐트 삽입술과 백내장수술을 병합하여 시행할 경우, 백내장수술을 먼저 진행하였다. 수술은 0.5% proparacaine hydrochloride (Alcaine, Alcon, Fort Worth, TX, USA)를 이용하여 점안마취하에 진행되었으며, 5% potadine 용액으로 결막을 소독한 후에 시행되었다. 다이아몬드 칼로이측에 3 mm에 각막윤부 절개선을 긋고, 각막을 절개한 후 전방에 점탄물질(Hyalu inj. 1.5%, Hanmi Pharm. Co., Ltd., Seoul, Korea)을 주입한 후 낭절개술용 겸자를 이용하여 수정체낭원형절개술을 시행하였다. 평형생리식염수(balanced salt solution [BSS]®, Alcon Laboratories, Inc., Fort Worth, TX, USA)를 투입하여 수력분리술을 시행 후 수정체초음파유화술로 핵과 피질의 일부를 제거하고 관류 및 흡입장치로 잔류 피질을 제거한 후 낭내에 점탄물질을 채워 팽창시켜 인공수정체를 삽입하였다. 전방각경으로 섬유주와 쉴렘관의 상태를 확인하고, 각막절개 부위로 삽입기를 넣은 후 전방각경으로 스텐트의 위치를 확인하며, 쉴렘관에 수직으로 스텐트를 2개 삽입하였다(Fig. 2). 전방각경으로 스텐트의 위치를 확인 후 점탄물질을 제거하였고, 각막절개는 기질수화(stromal hydration)를 시행하여 마무리하였다. 수술 후 안약은 0.5% levofloxacin (Cravit®, Santen Pharmaceutical Co., Ltd., Osaka, Japan)과 1% Predbell (Predbell®, Chong Kun Dang Pharm, Seoul, Korea)을 각각 하루 4회 점안하였다.
수술 후 1, 2, 3, 6개월째에 안압 및 수술 상태를 확인하였다. 안압은 골드만압평안압계(Goldmann applanation tonometer)로 측정된 안압을 사용하였으며, 골드만압평안압계는 모두 한 사람(Y.C.K)에 의해 측정되었다. 수술 성공의 기준은 안약 사용 유무와 상관없이 수술 후 안압이 21 mmHg 미만이며, 수술 전의 안압에 비해 20% 이상 감소한 경우로 정의하였다.
통계는 SPSS 통계프로그램(version 18.0; IBM Corp., Armonk, NY, USA)을 사용하였으며, 수술 전 각 그룹의 연속형 변수 비교는 Mann-Whitney U test를 사용하였으며, 범주형 자료 Chi-square test with Fisher’s exact test를 사용하였다. 수술 전과 후의 비교는 Wilcoxon signed rank test를 사용하였다. 수술 성공률(cumulative probabilities of success)은 Kaplan-Meier 생존 분석을 사용하였으며, Log-rank test를 통해 각 군 간의 수술 성공률을 비교하였다. 수술 후 6개월의 수술 성공 결과에 영향을 주는 예후인자 콕스 회귀분석을 사용하여, 각 변수들의 위험비(hazard ratio)와 95% 신뢰구간(confidence interval)을 구하였다. 모든 통계 분석은 p-value가 0.05 미만일 경우를 통계적으로 유의한 것으로 간주하였다.
아이스텐트 인젝트 단독 삽입술을 시행한 경우는 17안(A군), 아이스텐트 인젝트와 백내장수술 병합은 17안(A-1군), 아이스텐트 단독 삽입술을 시행한 경우는 6안(B군), 아이스텐트와 백내장수술 병합은 2안(B-1군)이었다. A군과 B군, A-1군과 B-1군에서 나이, 성별, 당뇨 유무, 고혈압 유무, 수술 전 안압, 수술 전 사용한 안약의 개수, 안축장의 길이, 전방깊이, 각막내피세포수, 중심 각막두께는 각각 유의한 차이가 없었다(Table 1, 2).
A군에서는 수술 전 안압 23.65 ± 10.34 mmHg에 비하여, 수술 후 1달째 16.35 ± 3.81 mmHg (p=0.001), 수술 후 2달째 15.65 ± 3.22 mmHg (p=0.001), 수술 후 3달째 15.00 ± 2.00 mmHg (p<0.001), 수술 후 6달째 14.12 ± 2.78 mmHg (p=0.001) 모두 안압이 유의하게 감소하였다.
B군에서는 수술 전 안압 29.67 ± 8.09 mmHg에 비하여, 수술 후 1달째 18.67 ± 5.15 mmHg (p=0.028), 수술 후 2달째 19.33 ± 5.01 mmHg (p=0.027), 수술 후 3달째 18.33 ± 3.56 mmHg (p=0.028), 수술 후 6달째 18.67 ± 4.27 mmHg (p=0.027) 모두 안압이 유의하게 감소하였다(Table 3, Fig. 3A).
A-1군에서는 수술 전 안압 24.30 ± 7.25 mmHg에 비하여, 수술 후 1달째 13.52 ± 2.32 mmHg (p<0.001), 수술 후 2달째 14.71 ± 2.47 mmHg (p<0.001), 수술 후 3달째 14.35 ± 2.57 mmHg (p<0.001), 수술 후 6달째 13.47 ± 2.07 mmHg (p<0.001) 모두 안압이 유의하게 감소하였다. B-1군에서는 수술 전 안압 24.00 ± 12.73 mmHg에 비하여, 수술 후 1달째 16.00 ± 2.83 mmHg (p=0.458), 수술 후 2달째 16.50 ± 3.54 mmHg (p=0.455), 수술 후 3달째 12.00 ± 2.82 mmHg (p=0.472), 수술 후 6달째 14.50 ± 1.71 mmHg (p=0.465) 모두 유의하지는 않으나 안압이 감소하는 양상을 보였다(Table 4, Fig. 3B).
A군에서 사용한 안압약의 개수는 수술 전 2.53 ± 0.63개에 비하여, 수술 후 1달째 2.47 ± 0.63개(p=0.151), 수술 후 2달째 2.41 ± 0.62개(p=0.150), 수술 후 3달째 2.24 ± 0.56개(p=0.136), 수술 후 6달째 2.12 ± 0.60개(p=0.146)로 유의미한 차이를 보이지 않았다. B군에서 사용한 안압약의 개수는 수술 전 3.00 ± 0.00개에 비하여, 수술 후 1달째 2.33 ± 0.82개(p=0.028), 수술 후 2달째 2.67 ± 0.52개(p=0.028), 수술 후 3달째 2.67 ± 0.52개(p=0.028), 수술 후 6달째 2.83 ± 0.41개(p=0.027)로 유의하게 감소하였다(Table 5, Fig. 3C).
A-1군에서 사용한 안압약의 개수는 수술 전 1.93 ± 1.07개에 비하여, 수술 후 1달째 1.24 ± 1.03개(p<0.001), 수술 후 2달째 1.18 ± 0.95개(p<0.001), 수술 후 3달째 1.06 ± 0.83개(p<0.001), 수술 후 6달째 1.00 ± 0.79개(p=0.001)로 유의하게 감소하였다. B-1군에서 사용한 안압약의 개수는 수술 전 3.00 ± 0.00개에 비하여, 수술 후 1달째 2.50 ± 0.71개(p=0.500), 수술 후 2달째 2.00 ± 0.00개(p<0.001), 수술 후 3달째 1.50 ± 0.71개(p=0.500), 수술 후 6달째 1.00 ± 0.00개(p<0.001)로 감소하는 경향을 보였다(Table 6, Fig. 3D).
수술 성공률은 수술 후 안압을 기준으로 하였으며, Kaplan-Meier 생존 분석 결과에 따른 누적 성공률은 A군은 수술 1개월 후 89.7 ± 3.7%, 2개월 후 77.4 ± 5.4%, 3개월 후 59.2 ± 7.0%, 6개월 후 45.3 ± 8.1%였고, B군은 수술 1개월 후 91.7 ± 5.6%, 2개월 후 76.7 ± 9.3%, 3개월 후 57.3 ± 11.8%, 6개월 후 28.6 ± 13.1%였으며, A군과 B군의 수술성공률의 차이는 통계적으로 유의하지는 않았다(p=0.579) (Fig. 4A). A-1군은 수술 1개월 후 97.1 ± 2.0%, 2개월 후 91.6 ± 3.6%, 3개월 후 86.3 ± 5.0%, 6개월 후 81.2 ± 6.8%였고, B-1군은 수술 1개월 후 87.8 ± 11.7%, 2개월 후 72.9 ± 16.5%, 3개월 후 54.7 ± 20.1%, 6개월 후 27.3 ± 21.8%였으며, A-1군과 B-1군의 수술 성공률의 차이는 통계적으로 유의하였다(p=0.007) (Fig. 4B).
수술 전 확인한 나이, 성별, 당뇨 유무, 고혈압 유무, 수술 전 안압, 수술 전 사용한 안압약의 개수, 안축장의 길이, 전방의 깊이, 각막내피세포수, 중심 각막두께를 대상으로 수술 성공 여부와의 관계에 대해 분석하고자 하였다. 이에 대해 콕스 회귀분석을 시행하였으며, 수술 전 안압이 수술 성공 여부에 유의하게 영향을 주는 인자로 나타났다. 단변량 콕스 회귀분석에서 수술 전 안압이 유의하게 영향을 주며(위험비 0.83, 95% 신뢰구간 0.70-0.98; p=0.03), 나이, 수술 전 안압 등을 공변량으로 한 다변량 콕스 회귀분석에서도 수술 전 안압이 1 mmHg 높을수록 수술 실패율이 20% 낮아진다는 결론이 나왔다(위험비 0.80, 95% 신뢰구간 0.66-0.96, p=0.02) (Table 7).
수술 1일째 육안으로 관찰 가능한 전방출혈(gross hyphema)이 발생한 경우는 5건이었으며, 수술 후 6개월째 5건 모두 전방출혈은 회복되었으며, 수술 후 1일째 중등도 각막부종이 발생한 경우는 1건이었으며, 6개월째 각막부종이 회복되었다. 수술 후 1일째 수술안 안압이 30 mmHg 이상인 경우는 4건 있었으며, 3건은 수술 후 6개월째 21 mmHg 미만으로 호전되었으나, 1건에서는 안압이 조절되지 않아 수술 후 40일째 아메드밸브삽입술을 시행하였다(Table 8).
본 연구에서는 한국인에서 아이스텐트와 2세대 아이스텐트 격인 아이스텐트 인젝트의 수술 결과를 비교하였다. 수술 후 6개월 누적 성공률은 아이스텐트 인젝트 단독 삽입술(A군)이 45.3 ± 8.1%, 아이스텐트 단독 삽입술(B군)이 28.6 ± 13.1%, 아이스텐트 인젝트와 백내장수술 병합(A-1군)이 81.2 ± 6.8%, 아이스텐트와 백내장수술 병합(B-1군)이 27.3 ± 21.8%로 A-1군이 B-1군에 비해 유의하게 높은 성공률(p=0.007)을 보였으며, A군과 B군의 성공률 차이는 유의하지 않았다(p=0.579). 본 연구에서 수술 후 6개월째까지 경과 관찰 동안 발생한 5건의 육안으로 관찰 가능한 전방출혈, 1건의 중등도 각막부종은 수술 후 6개월째까지 모두 호전되어 수술 결과에 영향을 미치지 않는 것으로 나타났다. 수술 후 1일째 안압이 30 mmHg 이상으로 상승한 경우 4건에서 3건은 수술 후 6개월째 안압이 21 mmHg 미만이었으나 1건은 재수술을 하였으며, 수술 성공 여부 관련 인자에 대한 콕스 회귀분석에서도 수술 전 안압만이 유의한 상관관계를 갖는 것으로 나타났다. 이를 통해 수술 전후의 안압 상태가 6개월째의 수술 성공 여부에 영향을 미치는 것으로 생각해 볼 수 있다.
2007년 Spiegel et al [11]에 의해 아이스텐트에 대한 논문이 처음 발간된 이후로 아이스텐트에 대한 연구는 활발하게 진행되어 왔다. 2011년 Samuelson et al [12]에 의해 보고된 바에 따르면 대조군인 백내장수술만 시행한 123건과 실험군인 백내장수술과 1개의 아이스텐트를 삽입한 117건에서 12개월 동안 추적 관찰을 하였을 때, 대조군에서는 5.4%의 안압하강, 실험군에서는 8.2%의 안압하강이 나타났다. 2010년 Fernández-Barrientos et al [13]이 보고한 바에 따르면 대조군인 백내장수술만 시행한 16건과 실험군인 백내장수술과 2개의 아이스텐트를 삽입한 17건을 대상으로 12개월 동안 추적 관찰을 하였을 때, 대조군에서는 16.5%의 안압하강, 실험군에서는 27.3%의 안압하강이 보고되었다. 2014년 Fea et al [14]이 대조군인 약물만 사용한 98건과 실험군인 2개의 아이스텐트를 삽입한 94건에 대해 12개월 동안 추적 관찰하였을 때, 대조군에서는 36.2%의 안압하강이 있었고, 실험군에서는 38.4%의 안압하강이 있었다. 이를 통해 아이스텐트 삽입술이 안약보다 안압하강 효과가 있으며, 백내장수술과 병합하였을 때 그 효과가 더 좋을 것이라 생각할 수 있다.
Popovic et al [15]이 개방각 녹내장에서 아이스텐트와 아이스텐트 인젝트를 사용하여 삽입된 스텐트 수에 따른 안압하강 효과를 비교하였다. 1개의 스텐트를 삽입한 경우 안압하강 정도는 4.67 ± 23.18 mmHg, 2개의 스텐트를 삽입한 경우 안압하강 정도는 6.03 ± 4.66 mmHg, 3개의 스텐트를 삽입한 경우 안압하강 정도는 9.33 ± 6.23 mmHg로 삽입된 아이스텐트의 개수가 많을수록 안압하강 정도는 더 컸다. 또한 백내장수술 단독 시 안압하강 정도는 4.62 ± 3.47 mmHg였으며, 백내장수술과 아이스텐트 삽입술을 병합한 경우 안압하강 정도는 6.30 ± 3.10 mmHg로 병합술에서 더 좋은 결과를 나타냈음을 보고하였다. 또한 아이스텐트 인젝트삽입술 단독 시 안압하강 정도는 8.52 ± 1.14 mmHg, 아이스텐트 삽입술과 백내장수술 병합 시 안압하강 정도는 9.99 ± 2.14 mmHg로 아이스텐트 인젝트에서도 단독술 보다 병합술에서 안압하강 정도가 더 크게 보고되었다. 본 연구에서는 매 수술마다 아이스텐트를 2개 삽입하였다. 기존의 녹내장수술에서 합병증으로 흔히 나타나는 것 중 하나인 저안압증이 추적 관찰 기간 동안 1건도 보고되지 않았다. 녹내장수술은 적절한 안압하강이 중요하므로, 본 연구의 결과를 보았을 때, 2개의 아이스텐트 삽입이 적당하였던 것으로 사료된다. 또한 앞서 기존에 보고된 결과와 같이 한국인에서도 아이스텐트 삽입술 단독보다 백내장수술과 병합하였을 때 안압하강 정도가 더 크게 나타났다.
본 연구에서 수술 전 안압이 1 mmHg 높을수록 수술 실패율이 20% 낮아진다는 결론이 나왔으며(hazard ratio 0.80, p=0.02), 이는 Ferguson et al [16]가 발표한 논문에서 수술 전 안압이 높을수록 수술 후 안압하강의 정도가 크다는 연구결과와 같은 맥락을 보인다.
본 연구에서 보고된 10건의 수술 후 합병증에서 가장 흔하게 나타난 합병증은 5건 보고된 육안으로 관찰되는 전방출혈이었고, 이외 각막부종이 발생한 1건에서도 모두 6개월 경과 관찰 후 호전되었다. 수술 후 1일째, 30 mmHg 이상의 고안압이 발생한 4건에서 1건의 재수술을 시행하였다. 앞서 수술 성공률에 영향을 주는 인자를 로지스틱 회귀분석을 시행하였을 때, 수술 전 안압만이 유의하게 수술 성공률에 영향을 주었다. 두 가지 결과를 종합하였을 때 수술 전후의 안압이 수술 성공률에 유의미하게 영향을 미칠 것으로 생각해 볼 수 있다. 따라서 수술 전 안압이 높을수록, 수술 후 1일째 30 mmHg 이상의 고안압이 측정되는 환자는 더욱 경과 관찰을 유심히 해야 할 필요가 있을 것으로 사료된다.
본 연구는 대상이 42건으로 수가 작고, 특히 B군과 B-1군이 6건, 2건으로 그 수가 작아 제한점이 있다. 모든 수술이 1명의 술자에 의해 시행되어 수술자 요소의 영향을 주지 않았으나 아이스텐트를 이용한 수술 모두 아이스텐트인젝트 수술보다 수술일이 빨라 수술자의 숙련도에 따른 영향을 배제할 수 없었다. 아이스텐트와 백내장수술을 병합하여 시행한 환자에서는 수술 전에 녹내장 안약 개수가 아이스텐트 단독술을 받은 환자보다 적은데, 이는 백내장이 있는 환자에서는 안압약을 늘리기 전에 술자가 백내장병합술을 선호하여 차이가 발생하였다. 또한 본 연구에서 수술 전 안압의 차이가 A군과 B군(p=0.087), A-1군과 B-1군(p=0.825)에서 유의미한 차이가 나지 않았으나 평균의 차이가 있고, 특히 A군과 B군에서는 p-value도 낮아 유의미하지는 않으나 영향을 주었을 수 있는 요인이 되어 본 연구에서 한계점을 가진다.
결론적으로 한국인에서 아이스텐트와 백내장수술 병합시 아이스텐트 인젝트가 아이스텐트보다 더 좋은 효과가 있음을 확인할 수 있었다. 미세침습 녹내장수술은 현재도 활발히 연구가 진행되며 국외에서는 이에 대해 임상적 적용 및 연구가 활발히 진행되고 있다. 이를 국내에 적용하여 한국인에서의 임상적 적용과 연구를 더 적극적으로 하여 최신 수술법을 국내에 더 빠르게 적용한다면 국내 녹내장치료에 더 다양한 가능성이 열려 성공적인 치료와 유지가 가능할 것으로 기대해 본다.
Figure 1.
(A) First-generation iStent® (Glaukos, Laguna Hills, CA, USA). The lumen is directed toward the anterior chamber and a self-trephining tip is inserted into Schlemm's canal. (B) Second-generation iStent inject® (Glaukos, Laguna Hills, CA, USA). iStent inject® possesses four side holes opening toward Schlemm's canal. The central lumen is directed toward the anterior chamber. Image by Courtesy of Glaukos and approved for use.
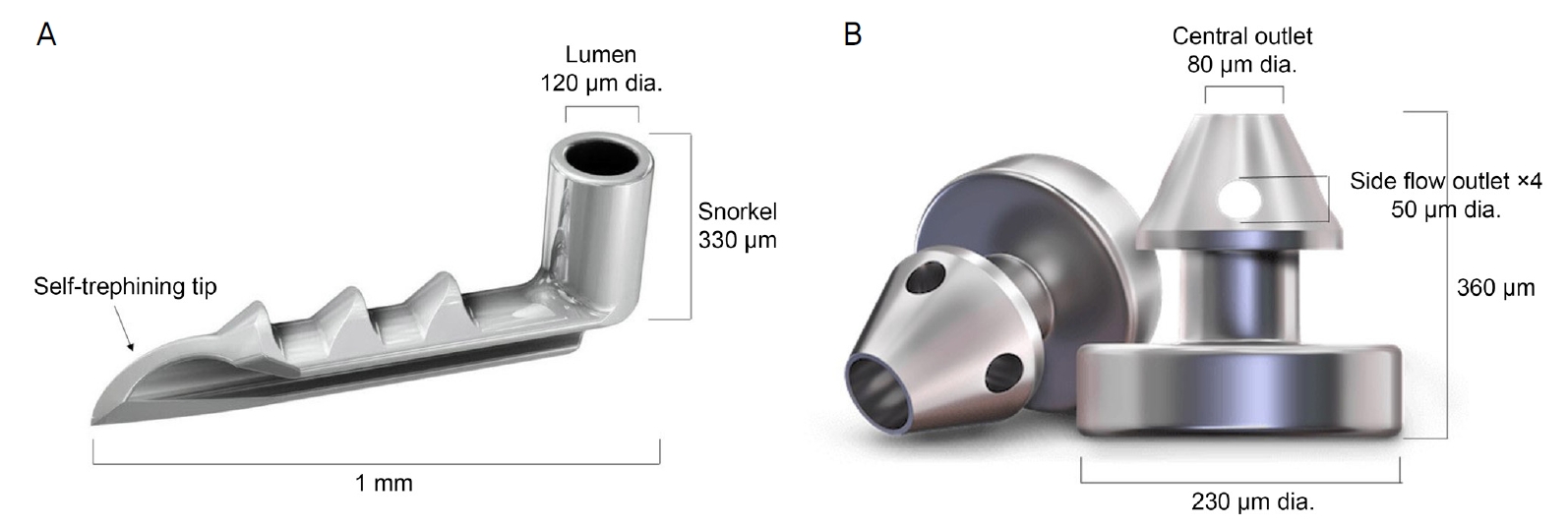
Figure 2.
iStent inject® (Glaukos, Laguna Hills, CA, USA) in the trabecular meshwork. Two iStent injects are placed in trabecular meshwork and these can be observed through gonioscopy.

Figure 3.
The change of intraocular pressure and glaucoma eyedrops during 6 months follow up. (A) Intraocular pressure (IOP) decreased in both iStent inject® (Glaukos, Laguna Hills, CA, USA) group (group A) and iStent® (Glaukos, Laguna Hills, CA, USA) group (group B). (B) IOP decreased in both iStent inject® + Phaco group (group A-1) and iStent® + Phaco group (group B-1). (C) The number of glaucoma eyedrops was similar after surgery in both iStent inject® group (group A) and iStent® group (group B). (D) The number of glaucoma eyedrops was decreased in both iStent inject® + Phaco gourp (group A-1) and iStent® + Phaco group (group B-1).
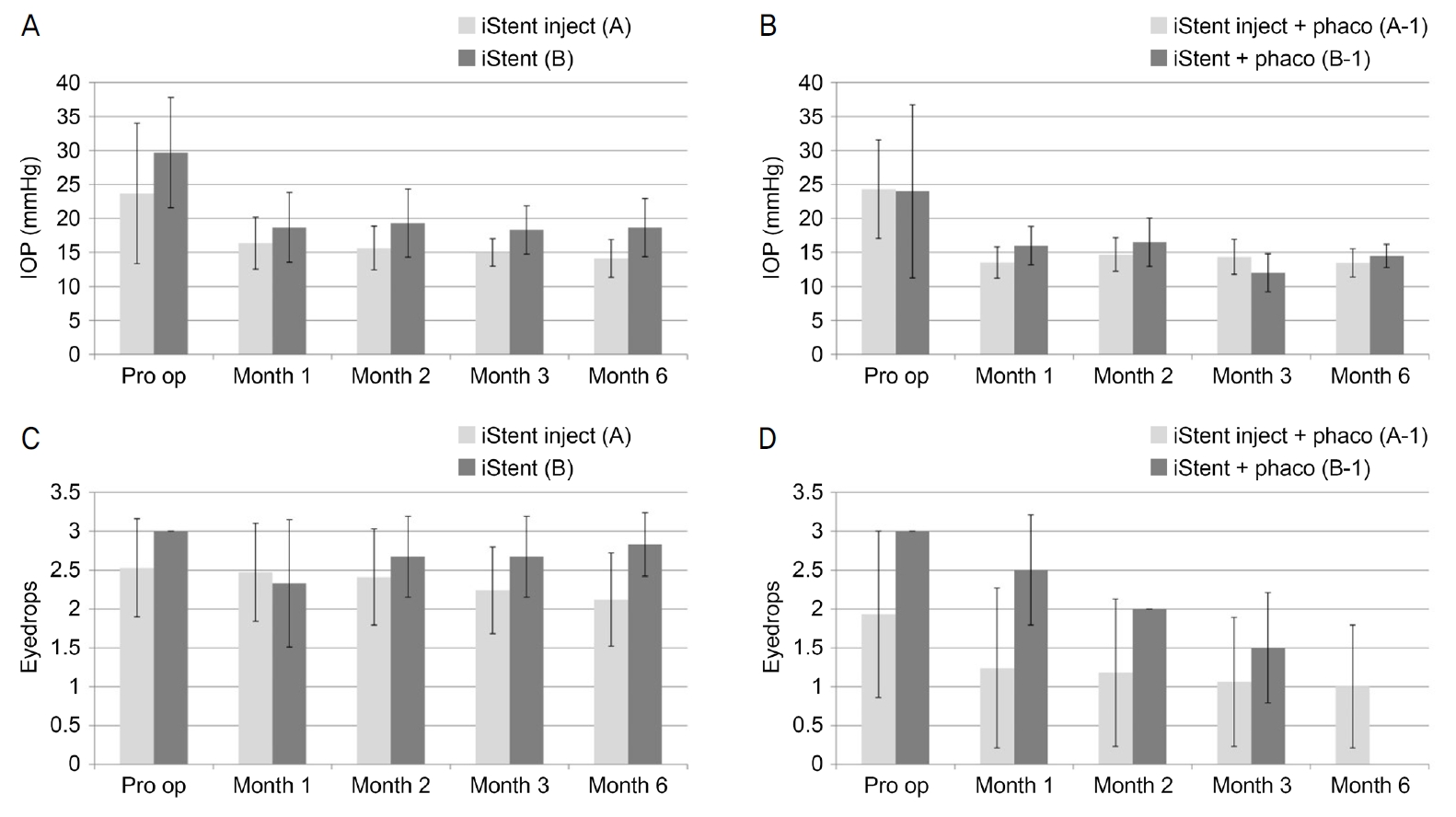
Figure 4.
Kaplan-Meier curves for successful intraocular pressure using the definition of success. (A) Success rate at 6 months was 45.3% in group A (iStent inject®, Glaukos, Laguna Hills, CA, USA) and 28.6% in group B (iStent®, Glaukos, Laguna Hills, CA, USA) (p = 0.579). (B) Success rate at 6 months was 81.2% in group A-1 (iStent inject® + Phaco) and 21.8% in group B-1 (iStent® + Phaco) (p = 0.007).
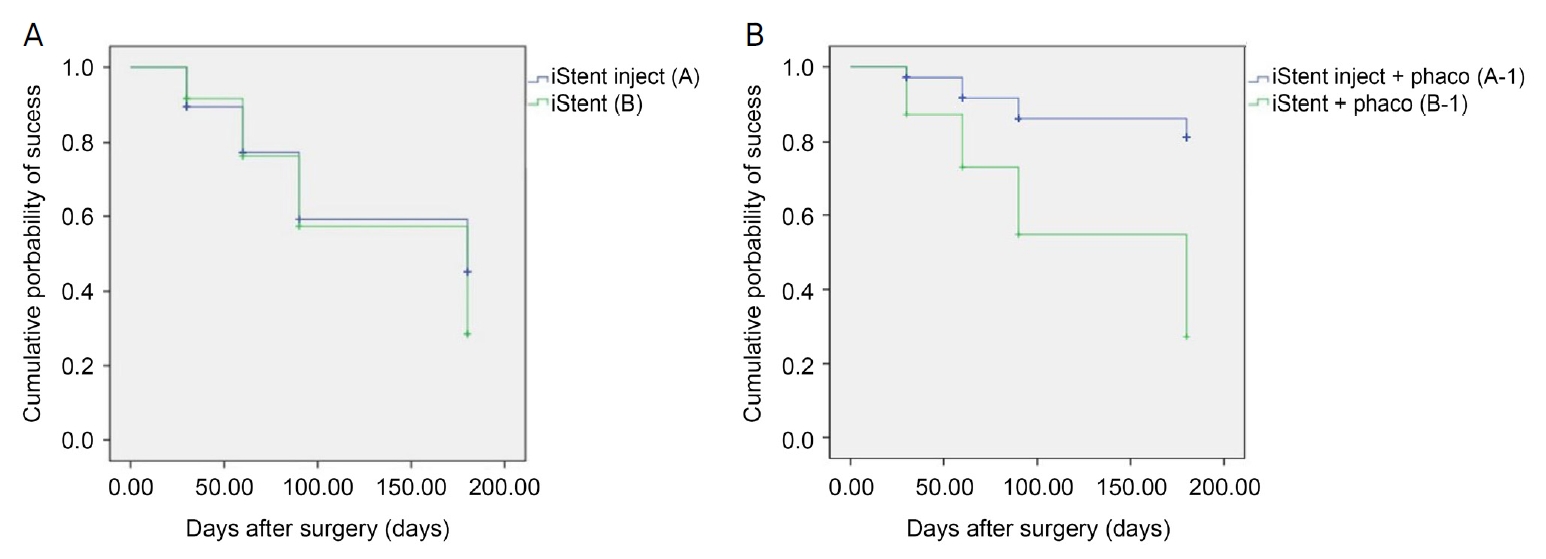
Table 1.
Patient demographics and clinical characteristics of group A & B
| Variable |
Disease group |
p-value | |
|---|---|---|---|
| iStent inject® (A) | iStent® (B) | ||
| Number of cases | 17 | 6 | |
| Age (years) | 63.65 ± 10.61 | 68.33 ± 9.50 | 0.431* |
| Sex (female:male) | 12:10 | 2:4 | 0.561† |
| DM | 9 | 5 | 0.957† |
| HTN | 8 | 4 | 0.408† |
| Preoperative IOP (mmHg) | 23.65 ± 10.33 | 29.67 ± 8.09 | 0.087* |
| Preoperative VA | 0.72 ± 0.23 | 0.55 ± 0.24 | 0.177* |
| Number of preoperative IOP-lowering medications | 2.53 ± 0.62 | 3.00 ± 0.00 | 0.155* |
| CCT | 553.12 ± 52.02 | 584.17 ± 47.01 | 0.256* |
| AxL | 24.79 ± 1.67 | 24.93 ± 2.10 | 0.708* |
| ACD | 3.92 ± 0.70 | 3.66 ± 0.76 | 0.473* |
| ECC | 2,468.76 ± 421.52 | 2,624.67 ± 344.14 | 0.609* |
Table 2.
Patient demographics and clinical characteristics of group A-1 & B-1
| Variable |
Disease group |
p-value | |
|---|---|---|---|
| iStent inject®+Phaco (A-1) | iStent®+Phaco (B-1) | ||
| Number of cases | 17 | 2 | |
| Age (years) | 74.94 ± 9.67 | 68.00 ± 14.14 | 0.596* |
| Sex (female:male) | 13:4 | 2:0 | 0.147† |
| DM | 3 | 1 | 0.272† |
| HTN | 7 | 1 | 0.813† |
| Preoperative IOP (mmHg) | 24.30 ± 7.25 | 24.00 ± 12.73 | 0.825* |
| Number of preoperative IOP-lowering medications | 1.93 ± 1.07 | 3.00 ± 0.00 | 0.869* |
| CCT | 565.52 ± 49.31 | 582.50 ± 30.44 | 0.708* |
| AxL | 23.03 ± 0.76 | 23.41 ± 0.66 | 0.954* |
| ACD | 2.97 ± 0.35 | 2.52 ± 0.27 | 0.614* |
| ECC | 2,618.65 ± 433.02 | 2,608.00 ± 33.94 | 0.262* |
Table 3.
Comparison of preoperative and postoperative intraocular pressure (mmHg) in group A & group B
Table 4.
Comparison of preoperative and postoperative intraocular pressure (mmHg) in group A-1 & group B-1
Table 5.
Comparison of preoperative and postoperative number of IOP-lowering medications in group A & group B
Table 6.
Comparison of preoperative and postoperative number of IOP-lowering medications in group A-1 & group B-1
Table 7.
Risk factors for failure of istent surgery in the study
| Variable |
Univariate analysis |
Multivariate analysis |
||||
|---|---|---|---|---|---|---|
| HR | 95% CI | p-value* | HR | 95% CI | p-value* | |
| Age (years) | 0.96 | 0.93-1.04 | 0.61 | 1.03 | 0.96-1.10 | 0.45 |
| Sex (female:male) | 1.49 | 0.42-5.27 | 0.54 | |||
| DM | 1.82 | 0.47-7.04 | 0.39 | |||
| HTN | 1.82 | 0.51-6.43 | 0.36 | |||
| Preoperative IOP (mmHg) | 0.83 | 0.70-0.98 | 0.03 | 0.80 | 0.66-0.96 | 0.02 |
| Number of preoperative IOP-lowering medications | 1.16 | 0.59-2.27 | 0.67 | 1.36 | 0.60-3.31 | 0.50 |
| CCT | 1.00 | 0.99-1.02 | 0.74 | |||
| AxL | 1.09 | 0.77-1.55 | 0.64 | |||
| ACD | 1.48 | 0.67-3.25 | 0.33 | 1.42 | 0.61-3.31 | 0.42 |
| ECC | 1.00 | 0.99-1.00 | 0.35 | |||
Table 8.
Postoperative complications
REFERENCES
1) Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311:1901-11.



2) Nordstrom BL, Friedman DS, Mozaffari E, et al. Persistence and adherence with topical glaucoma therapy. Am J Ophthalmol 2005;140:598.e1-11.

3) Glaucoma Laser Trial Research Group. The Glaucoma Laser Trial (GLT) and glaucoma laser trial follow-up study: 7. results. Am J Ophthalmol 1995;120:718-31.


4) Musch DC, Gillespie BW, Niziol LM, et al. Factors associated with intraocular pressure before and during 9 years of treatment in the Collaborative Initial Glaucoma Treatment Study. Ophthalmology 2008;115:927-33.


5) Rulli E, Biagioli E, Riva I, et al. Efficacy and safety of trabeculectomy vs nonpenetrating surgical procedures: a systematic review and meta-analysis. JAMA Ophthalmol 2013;131:1573-82.


6) Jampel HD, Musch DC, Gillespie BW, et al. Perioperative complications of trabeculectomy in the Collaborative Initial Glaucoma Treatment Study (CIGTS). Am J Ophthalmol 2005;140:16-22.


7) Conlon R, Saheb H, Ahmed II. Glaucoma treatment trends: a review. Can J Ophthalmol 2017;52:114-24.


8) Fingeret M, Dickerson JE Jr. The role of minimally invasive glaucoma surgery devices in the management of glaucoma. Optom Vis Sci 2018;95:155-62.



9) Lavia C, Dallorto L, Maule M, et al. Minimally-invasive glaucoma surgeries (MIGS) for open angle glaucoma: a systematic review and meta-analysis. PLoS One 2017;12:e0183142.



10) Salimi A, Lapointe J, Harasymowycz P. One-year outcomes of second-generation trabecular micro-bypass stents (iStent Inject) implantation with cataract surgery in different glaucoma subtypes and severities. Ophthalmol Ther 2019;8:563-75.



11) Spiegel D, Wetzel W, Haffner DS, Hill RA. Initial clinical experience with the trabecular micro-bypass stent in patients with glaucoma. Adv Ther 2007;24:161-70.


12) Samuelson TW, Katz LJ, Wells JM, et al. Randomized evaluation of the trabecular micro-bypass stent with phacoemulsification in patients with glaucoma and cataract. Ophthalmology 2011;118:459-67.


13) Fernández-Barrientos Y, García-Feijoó J, Martínez-de-la-Casa JM, et al. Fluorophotometric study of the effect of the glaukos trabecular microbypass stent on aqueous humor dynamics. Invest Ophthalmol Vis Sci 2010;51:3327-32.


14) Fea AM, Belda JI, Rękas M, et al. Prospective unmasked randomized evaluation of the iStent inject (R) versus two ocular hypotensive agents in patients with primary open-angle glaucoma. Clin Ophthalmol 2014;8:875-82.


-
METRICS

- Related articles
-
Long-term Clinical Course and Prognostic Factor of Branch Retinal Artery Occlusion2023 April;64(4)
Short-term Outcomes and Prognostic Factors of iStent in the Republic of Korea2020 April;61(4)
Surgical Outcomes and Prognostic Factors of Consecutive Exotropia.2015 December;56(12)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



