 |
 |
| J Korean Ophthalmol Soc > Volume 61(9); 2020 > Article |
|
ęľëŹ¸ě´ëĄ
몊ě
본 ě°ęľŹě 몊íë ěšëŁ ě¤ë¨ í 1ë
ě´ě ěŹë° ě´ë Ľě´ ěěźëŠ° ě˘ě ěë Ľě ě ě§íë 결ě 맼ë˝ë§íę´ëłěŚ íěě ěěě íšě§ě 쥰ěŹíë ë°ě ěë¤.
ëěęłź ë°Šë˛
결ě 맼ë˝ë§íę´ëłěŚě ěëĄę˛ ě§ë¨ë°ęł ííę´ë´íźěąěĽě¸ě 1ëŹ ę°ę˛Š 3í ěŁźěŹ ěšëŁ ëë ę´ěíěë˛ęłź ííę´ë´íźěąěĽě¸ěě ëłľíŠ ěšëŁëĽź ě´ę¸° ěšëŁëĄ ěí ë°ě íěë¤ě ííĽě ěźëĄ ëśěíěë¤. ě´ę¸° ěšëŁ í 1ë
ě´ě ěŹë°íě§ ěęł ěśę°ě ě¸ ěšëŁ ěě´ ě°ěí ěë Ľě ě ě§í ě´ë¤(ëšěŹë°ęľ°, 47ě)ęłź ëłëłě ěŹë°ëĄ ë°ëłľě ě¸ ěšëŁëĽź ë°ě íěë¤(ěŹë°ęľ°, 54ě)ëĄ ëëěěźëŠ°, ë ęľ° ę°ě ëšę°ěë¨ě¸ľě´Źě ë° ě¸ëěŹě´ěë꡸댰íę´ěĄ°ěě ě겏ě íšě§ě ëšęľ ëśěíěë¤.
결곟
ëšěŹë°ęľ°ě ěŹë°ęľ°ě ëší´ ěľëëłëłě§ę˛˝ě íŹę¸°ę° ěěěźëŠ°(p<0.001), 결ě ě ěę° ě ęł (p<0.001), ěěěíźë°ëŚŹě ěĄ´ěŹ ëšě¨ě´ ëŽěë¤(p=0.003). ě´ëŹí 결곟ë ííę´ë´íźěąěĽě¸ě ë¨ë
ěë˛ęłź ę´ěíěë˛ ëłľíŠ ěë˛ě ěšëŁ ë°Šë˛ě ěę´ěě´ ëěźí ě¸ěë¤ě´ ě ěíę˛ ëíëŹë¤. ëĄě§ě¤íą íęˇëśě 결곟 ěě íŹę¸°ě ěľëëłëłě§ę˛˝(p=0.002), ě ě ěě 결ě (p=0.013), ěěěíźë°ëŚŹě ëśěŹ(p=0.025)ę° ě˘ě ěíě ę´ë ¨ě´ ěë¤ë ěŹě¤ ëí íě¸ëěë¤.
결ëĄ
ěě íŹę¸°ě ëłëł, ě ě ěě 결ě , ěěěíźë°ëŚŹę° ěë 결ě 맼ë˝ë§íę´ëłěŚ íěë¤ěě ě´ę¸° ěšëŁ ě´í 1ë
ě´ě ěŹë° ěě´ ě˘ě ěë Ľě´ ě ě§ëěë¤. 기ě ěě ě´ě ę°ě íšě§ě ëł´ě¸ íěë¤ě ěšëŁ í ěśě ę´ě°°ěě ěí¸í 경곟뼟 ëł´ěź ę˛ěźëĄ ěěëë¤.
ABSTRACT
Purpose
We here describe the clinical features of eyes with polypoidal choroidal vasculopathy (PCV) that exhibited good visual acuity (VA) over one year without additional treatment.
Methods
Patients newly diagnosed with PCV who received anti-vascular endothelial growth factor injections three times per month, with or without photodynamic therapy, were retrospectively reviewed. We divided the patients into those who maintained good VA for over one year (nonrecurrent group, 47 eyes) and those who required further treatment because of recurrence (recurrent group, 54 eyes). We compare the baseline characteristics including optical coherence tomographic and indocyanine green angiographic data of the two groups.
Results
The nonrecurrent group (initially treated via single or combination therapy) exhibited a smaller greatest linear dimension (GLD) (p < 0.001), fewer polyps (p < 0.001), and no pigment epithelial detachment (PED) at baseline (p = 0.003) compared to the recurrent group. Logistic regression revealed that a lower GLD (p = 0.002), fewer polyps (p = 0.013), and absence of PED (p = 0.025) were associated with a favorable prognosis.
결ě 맼ë˝ë§íę´ëłěŚ(polypoidal choroidal vasculopathy, PCV)ě ěľěą ëě´ę´ë ¨íŠë°ëłěą(age-related macular degeneration, AMD)ě ěíěźëĄ, Yannuzzi et al [1]ě´ 1990ë
ě ěľě´ëĄ ě¸ę¸íěë¤. PCVë ě¸ëěŹě´ěë꡸댰íę´ěĄ°ěě (indocyanine green angiography, ICGA)ěě 결ě -ě ěŹ ëë§ĽëĽ íěĽęłź í¨ęť 맼ë˝ë§ íę´ě ëśě§ëĽź íšě§ěźëĄ íë¤[2-4].
Uyama et al [5]ě PCVě ěě° ę˛˝ęłźě ę´ë ¨íěŹ, 50%ě íěë ěí¸í 경곟뼟 ëł´ě´ë ë°ëŠ´ ëë¨¸ě§ ě ë°ě ěśíęłź ëěś ëąě´ ë°ëłľëě´ íŠë°ëśě ëłěą ë° ěë Ľ ěě¤ëĄ ě´ě´ěĄë¤ęł ëł´ęł íěë¤. PCVěě ěę° ěĽě 뼟 ěźěźí¤ë ě ëë ë¤ěíë, ěźë°ě ěźëĄ wet AMDëł´ë¤ ěë Ľěíę° ë ě˘ě ę˛ěźëĄ ěë ¤ě ¸ ěë¤[5,6].
PCV뼟 ěšëŁí기 ěí í¨ęłźě ě¸ ë°Šë˛ěźëĄ verteporfině ě´ěŠí ę´ěíěë˛(photodynamic therapy, PDT), ííę´ë´íźěąěĽě¸ě(anti-vascular endothelial growth factor, anti-VEGF)ě ě 댏체ę°ë´ 죟ě
, íšě ë ěšëŁě ëłľíŠ ěë˛ ëąě´ ěë¤[7-10]. ę´ěíěë˛ě 결ě ěą ëłëłęłź ěźěśěą ëłíě í´í뼟 ě ëíë ë°ě í¨ęłźě ě¸ ę˛ěźëĄ ëíëŹë¤[11,12]. EVEREST II ě°ęľŹěěë PDTě ranibizumabě ěŹěŠí ëłľíŠ ěë˛ě´ ranibizumabě ë¨ë
ěë˛ëł´ë¤ PCV뼟 ěëĄę˛ ě§ë¨ ë°ě íěë¤ěě ěë Ľě , í´ëśíě ěźëĄ ë ě°ěí í¨ęłźëĽź ěšëŁ ěě 12ę°ě ěě ě ëł´ěë¤ęł ëł´ęł íë¤[9]. ěľęˇźěë AMD ěšëŁëĽź ěí´ ę°ë°ë anti-VEGF ěë˛ě´ PCVě ěźě°¨ ěšëŁëĄ ë§ě´ ěŹěŠëęł ěë¤. ëíě ě¸ anti-VEGF ěšëŁ ë°Šë˛ěźëĄ as-needed regimenęłź treat and extend regimen, fixed dosing regimen ëąě´ ěë¤[13-15]. ěľęˇź PLANET ě°ęľŹěě aflibercept뼟 ě´ěŠí ë¨ë
ěë˛ěźëĄ ě ěí ěë Ľ íĽěě ëł´ěŹěŁźěęł , ěěě íěë§ě´ ěśę°ě PDT ěšëŁę° íěíë¤ęł ëł´ęł íěë¤[10].
ě¤ě ěěěě PCV íěë¤ě ěšëŁ ě´í ë¤ěí 경곟뼟 ëł´ě¸ë¤. ěźëś íěë¤ě ěľěíě ěšëŁë§ěźëĄ ěí¸í 경곟뼟 ëł´ě´ë ë°ëŠ´, ě§ěě ě¸ ěšëŁěë ëśęľŹíęł ěíę° ě ě°¨ ě
íëë íěë¤ë ěë¤. ëłëłě ë°ëłľëë ěŹë°ě ëě ěë Ľěíě ę´ë ¨ ěě ě ěë¤. ë§ě˝ PCV íěě ěšëŁëĽź ěěí기 ě ě 기ě íšěąěźëĄëśí° ěšëŁ 결곟ě ěí뼟 ě츥í ě ěë¤ëŠ´, íěě ěśě ę´ëŚŹ ë° ěšëŁ ë°ŠíĽ ě¤ě ě ëěě´ ë ę˛ě´ë¤. 본 ě°ęľŹě 몊íë ěľěíě ě´ę¸° ěšëŁ í 1ë
ě´ě ěŹë°íě§ ěęł ě°ěí ěë Ľě ě ě§í PCV íěě ěěě íšě§ě 쥰ěŹíë ë° ěë¤.
본 ě°ęľŹë ě˛ěěźëĄ PCV ě§ë¨ě ë°ęł 본ěěě ěšëŁëĽź ěěí ě´í ěľě 1ë
ě´ě ěśě ę´ě°°í íěě ě돴 기ëĄě ë°íěźëĄ ě§íí ííĽě ë§¤ę° ě°ęľŹě´ë¤. 모ë íěë PCVě ëí´ ě˛ě ěšëŁëĽź ë°ę¸° ěěí ě´ë¤ëĄ, ę°í¨ëŚëíęľ ěě¸ěąëިëłěěě ę˛ě§, ěšëŁ ë°ě íěë¤ě ëěěźëĄ ě§íëěë¤. 본 ě°ęľŹë ëłěě ě¤ëŚŹ ěěíě ěšě¸ě ë°ěęł Helsinki ě ě¸ě ěęą°íěŹ ě§íëěěźëŠ° 본ě ěěě°ęľŹěŹěŹěěí(Institutional Review Board, IRB)ě ěšě¸íě ě§íëěë¤(ěšě¸ ë˛í¸: KC19RASI0898).
PCVě ě§ë¨ě ICGAę˛ěŹëĽź ě´ěŠíěŹ ëśě§íę´ë§ ě 돴ě íšě§ě ě¸ ę˛°ě ěą íę´ ëłëłě 쥴ěŹě ěí´ ě´ëŁ¨ě´ěĄë¤. ë¤ěě ě ě¸ ę¸°ě¤ě´ ě ěŠëěë¤: 1) ěľě´ ę˛ěŹěě ě¤ěŹě 욨ë˛íë ě§ëí ěěś ëë ěíě íí°ę° ěë 경ě°, 2) ěë Ľě ěíĽě ě¤ ě ěë ë¤ëĽ¸ ěęłźě ě§í(ěŚěëšë¨ë§ë§ëł ëë ë§ë§ě¤ěŹě 맼íě ëą), 3) ěśě ę´ě°° ę¸°ę° ě¤ í늴ëśě 댏체ě ě ě ě ë°ě íě, 4) 기í 맼ë˝ë§ë§ě§íěźëĄ ě 댏체ë§ë§ěě ë° ěęľŹë´ ěŁźěŹěšëŁ, ę´ěęł ëë ę´ěíěë˛ě ë°ěë íě. ë§ë§í ěśíě ę°ě§ íěě 경ě°ěë íŠë°í ěśíě íŹę¸°ę° 2 ě ëě§ę˛˝ 늴ě ě´ěěźëĄ ě 댏체ę°ë´ ę°ě¤ěŁźě
ě ęłź ę°ě ě˛ěšëĽź ěí ë°ě ě´ë¤ ěě ě ě¸ëěë¤.
모ë íěë íŹę´ě ěęłź ę˛ěŹëĽź ë°ěěźëŠ°, ě´ěë ě¤ëŹë ěë Ľí뼟 ě´ěŠí ěľëęľě ěë Ľ(best-corrected visual acuity, BCVA)ę˛ěŹ, ě¸ęˇšëąí미경ę˛ěŹ, ě°ë í ěě ę˛ěŹ, ěě ě´Źě, ęłľě´ě 죟ěŹë ě´ě ę˛ě경ę˛ěŹëĽź ě´ěŠí íę´ěě íę´ěĄ°ěě ęłź ICGA (Heidelberg Retina Angiograph [HRA]; Heidelberg Engineering Co., Heidelberg, Germany) ëąě´ 기본 ę˛ěŹëĄ íŹí¨ëěë¤. ëšę°ěë¨ě¸ľě´Źě(optical coherence tomography, OCT) ěěě ě¤íí¸ëź ěě OCTëĄ ě´Źěëěë¤(Spectralis OCT+HRA; Heidelberg Engineering, Heidelberg, Germany).
ěľëëłëłě§ę˛˝(greatest linear dimension, GLD)ě Heidelberg Eye Explorer ěíí¸ě¨ě´(v.6.0.9.0; Heidelberg Engineering)뼟 ěŹěŠíěŹ ICGA ěěěě ěę¸°ëĄ ě¸Ąě íěęł , 결ě ě ě ëí ICGA ěěěě íě
íěë¤. ICGAě ě§ě°ę¸°ěě ë¤ě´ě ęłźíę´ ěěě íě
í¨ěźëĄě¨ 맼ë˝ë§íę´ ęłźíŹęłź(choroidal vascular hyperpermeability)뼟 íě¸íěë¤. íŠë°ëśëĽź 욨ë˛íë ë§ë§ë´ěĄ(intraretinal fluid), ë§ë§íěĄ(subretinal fluid), ë§ë§ěěěíźë°ëŚŹ(pigmented epithelial detachment, PED)ë OCT ěěě íľí´ íě¸íěë¤. ě¤ěŹěí 맼ë˝ë§ëęť(subfoveal choroidal thickness)ë ë§ë§ěěěíź ě¸ě¸Ąěěëśí° ë´ě¸Ą ęłľë§ ę˛˝ęłě ęšě§ě ěě§ ęą°ëŚŹëĽź ě¤ěŹěěě 츥ě íěë¤.
íěë¤ě ë´ëš ěěŹě íë¨ě ë°ëź, anti-VEGF ë¨ë
ěë˛ ëë PDTě anti-VEGFě ëłľíŠ ěë˛ ě¤ í ę°ě§ ěšëŁ ë°Šë˛ě ě´ę¸° ěšëŁëĄ ěí ë°ěë¤. ëëśëśě íěë¤ě anti-VEGF ë¨ë
ěë˛ě ěźě°¨ ěšëŁëĄ ěí ë°ěęł , 결ě ęłź ëśě§ íę´ë§ěě ëěśě´ ěë 경ě°ě´ęą°ë PEDě ę´ë ¨ë ę´ë˛ěí ë§ë§íěĄ ëë ěźěśě ëł´ě´ë ę˛˝ě° ëąěë ëłľíŠ ěë˛ě ěźě°¨ ěšëŁëĄ ęł ë ¤íěë¤. Anti-VEGF ěë˛ě ě´ę¸° ěšëŁëĄ ë°ě íěë¤ěę˛ë ranibizumab (Lucentis; Genentech Inc., South San Francisco, CA, USA) ëë aflibercept (Eylea; Bayer HealthCare, Berlin, Germany) ě 댏체ę°ë´ 죟ě
ě ě í ëŹ ę°ę˛ŠěźëĄ 3í 죟ěŹíěë¤. PDTě anti-VEGF ëłľíŠ ěë˛ě 경ě°ë 첍 ë˛ě§¸ ě 댏체ę°ë´ anti-VEGF 죟ěŹëĽź ěííęł 3-4ěź ě´íě PDT ěšëŁëĽź ěííěěźëŠ° ěŁźěŹ ě˝ëŹźě bevacizumab (Avastin; Genentech Inc.)ě ěŹěŠíěë¤. PDTë Treatment of Age-Related Macular Degeneration with Photodynamic Therapy Studyě ëŞ
ěë ë°Šë˛ěźëĄ ěííěë¤[16].
ě´ę¸° ěšëŁ í íěë¤ě 매 1-2ę°ěë§ë¤ 경곟 ę´ě°°í늴ě íě ě anti-VEGF뼟 ěśę°ëĄ 죟ěŹíěëë°, OCTěě ě¤ěŹě뼟 욨ë˛íęą°ë ěííë ë§ë§íěĄ/ë§ë§ë´ěĄě´ ë°ěí ę˛˝ě° íšě ěě ę˛ěŹěě ěëĄě´ ë§ë§/ë§ë§í ěśíě´ ë°ěí 경ě°ëĽź ě§íě íëěąě´ ěŹë°í ę˛ěźëĄ íë¨íęł ěśę° 죟ěŹëĽź ěííěë¤. ěŹë°íě§ ěě íěě 경ě°ěë ěśę° ěšëŁ ěě´ ë´ëš ěěŹě íë¨ě ë°ëź 경곟 ę´ě°° ę°ę˛Šě ě°ěĽíěë¤.
경곟 ę´ě°° ę¸°ę° ě¤ 1) ě´ę¸° ěšëŁ ě´íě ë§ë§íěĄ/ë§ë§ë´ěĄě´ ěě í ěě¤ë ěíëĄ 1ë
ě´ ëë ę¸°ę° ëě ě§í íëěąě ěŹë° ě겏ě ëł´ě´ě§ ěęł , 2) ěśę°ě ě¸ ěŁźěŹ ěšëŁëĽź ë°ě§ ěěěźëŠ°, 3) ë§ě§ë§ 경곟 ę´ě°° ěě ě¤ëŹë ěë Ľ 20/30 ě´ěě ě°ěí ěë Ľě ëł´ě¸ íěë¤ě âëšěŹë°ęľ°âěźëĄ ëśëĽíěęł , ěě ě¸ ę°ě§ ěŹí ě¤ í ę°ě§ëźë í´ëšëě§ ěë íěë¤ě âëšěŹë°ęľ°âě íŹí¨ěí¤ě§ ěěë¤. ë°ëŠ´, ě´ę¸° ěšëŁ ě´í ěě ę´í´ ěŹëśě ěę´ěě´ ę˛˝ęłź ę´ě°° ě¤ ě§í íëěąě ěŹë°ëĄ ěśę°ě ě¸ ěšëŁëĽź ë°ě íěë¤ě âěŹë°ęľ°âěźëĄ ëśëĽíěë¤.
ëšěŹë°ęľ°ęłź ěŹë°ęľ°, ë ꡸룚 ę°ě 기ě íšěą ë° OCT, ICGAě ꡟ깰í í´ëśí ě겏ě ě°¨ě´ëĽź ëšęľíěë¤. ëí ěšëŁ ë°Šë˛ě ë°ëź anti-VEGF ë¨ë
ěŁźěŹ ěšëŁë§ ěí ë°ě íěë¤ ë´ěěě ëšěŹë°ęľ°ęłź ěŹë°ęľ°, ęˇ¸ëŚŹęł ëłľíŠ ěë˛ě ěí ë°ě íěë¤ ë´ěěě ëšěŹë°ęľ°ęłź ěŹë°ęľ° ę°ě ě°¨ě´ ěě ę°ę° ëśěě ěííěë¤. íľęł ëśěě ěí´ BCVA ę°ě logarithm of the minimal angle of resolution (logMAR)ěźëĄ ëłííěë¤. ěëě°ěŠ SPSS ë˛ě 19.0뼟 ěŹěŠíěŹ íľęł ëśěě ěííë¤(SPSS Inc., Chicago, IL, USA). ě°ě ëłě ëšęľëĽź ěí´ studentâs t-test뼟 ěŹěŠíěęł , chi-square ę˛ě ě ěŹěŠíěŹ ë˛ěŁźí ëłě뼟 ëšęľíěěźëŠ°, ë¨ëłë ëśěěě ě ěí ě¸ěë¤ě ëěěźëĄ ëĄě§ě¤íą íęˇëśěě ěśę°ëĄ ěííěë¤. p-valueę° 0.05 미ë§ě¸ ę˛˝ě° íľęłě ěźëĄ ě ěíë¤ęł í´ěíěë¤.
본 ě°ęľŹë 101ëŞ
íěě ë 101ěě ëśěíěë¤. Table 1ě anti-VEGF ë¨ë
ěë˛ ëë PDTě anti-VEGF ëłľíŠ ěë˛ ěšëŁëĽź ë°ě 모ë PCV íěë¤ě 기ě íšě§ě ëł´ěŹěŁźęł ěë¤. íęˇ ě°ë šě 63.83 Âą 8.79ě¸ěęł ě¤ěŹěí 맼ë˝ë§ëęťë 286.11 Âą 104.45 Âľm, íŠë°ëśëĽź 욨ë˛íë ë§ë§íěĄ, ë§ë§ë´ěĄ, ěěěíźë°ëŚŹě ěĄ´ěŹ ëšě¨ě ę°ę° 94.1%, 12.9%, 32.7%ěë¤. ěľëëłëłě§ę˛˝ě íŹę¸°ë 3,041.22 Âą 1,178.73 Âľm ěęł ę˛°ě ě ěë 1.47 Âą 0.85ę°ěë¤. 59ěě anti-VEGF ë¨ë
ěë˛ě ěí ë°ěęł 42ěě ëłľíŠ ěë˛ě ěí ë°ěë¤. 모ë ëěěě íęˇ ěśě ę´ě°° 기ę°ě 59.32 Âą 32.75ę°ěě´ěë¤.
47ěě´ ě´ę¸° ěšëŁ í 경곟 ę´ě°° ě¤ě 1ë
ě´ě ěŹë° ěě´ ě˘ě ěë Ľě ě ě§íë ěí¸í 경곟뼟 ëł´ěęł (ëšěŹë°ęľ°), 54ěě ě§ěě ě¸ ëłëłě ěŹíěąíëĄ anti-VEGF ěŁźěŹ ëë PDT뼟 ěśę° ěšëŁëĄ ěí ë°ěë¤(ěŹë°ęľ°). ěŹë°ęľ°ě ę˛˝ě° 65.57 Âą 35.29ę°ěě ěśě ę´ě°° ę¸°ę° ëě ěśę° ěšëŁëĄ 모ë ěěě ěľě 5í ě´ěě anti-VEGF ěŁźěŹ ěšëŁę° ěíëěěźëŠ° íęˇ ěŁźěŹ íěë 21.22 Âą 12.73íěë¤. 5ěěěë PDT 1í, 2ěěěë PDT 2íę° ěśę°ëĄ ěíëěë¤.
ëšěŹë°ęľ°ęłź ěŹë°ęľ°, ë ꡸룚 ę°ě ě°¨ě´ě ě Table 2ě ě ěëě´ ěë¤. ëšěŹë°ęľ°ě íŹí¨ë íěë¤ ě¤ 29ěě anti-VEGF ë¨ë
ěë˛ě, 18ěě ëłľíŠ ěë˛ě ě´ę¸° ěšëŁëĄ ěíë°ěęł , ěŹë°ęľ°ě íŹí¨ë íěë¤ ě¤ 30ěě anti-VEGF ë¨ë
ěë˛ě, 24ěě ëłľíŠ ěë˛ě ěí ë°ěěźëŠ°, ë ꡸룚 ę° ě´ę¸° ěšëŁ ë°Šë˛ě íľęłě ěźëĄ ě ěí ě°¨ě´ëĽź ëł´ě´ě§ ěěë¤(p=0.551). ë ꡸룚 ę° ëě´, ěąëł, ę¸°ě¤ ěë Ľ ěě ě ěí ě°¨ě´ë ěěęł , ěľě˘
ěë Ľ(logMAR)ě ëšěŹë°ęľ°ěě ë ě˘ěë¤(0.07 Âą 0.06 vs 0.44 Âą 0.31, p<0.001). OCT 결곟ěě ěŹë°ęľ°ě´ ëšěŹë°ęľ°ëł´ë¤ ěěěíźë°ëŚŹě ěĄ´ěŹ ëšě¨ě´ ëę˛ ëíëŹęł (p=0.003), ICGA 결곟ěě ëšěŹë°ęľ°ě ěľëëłëłě§ę˛˝ íŹę¸°ę° ë ěěěźëŠ°(p<0.001) 결ě ě ěë ěŹë°ęľ°ëł´ë¤ ě ę˛ ëíëŹë¤(p<0.001). ë§ë§íěĄ, ë§ë§ë´ěĄ, ě¤ěŹěí 맼ë˝ë§ëęť, 맼ë˝ë§íę´ ęłźíŹęłźë ë ꡸룚 ę° ě ěí ě°¨ě´ëĽź ëł´ě´ě§ ěěë¤. íęˇëśě 결곟ěě ěě ěľëëłëłě§ę˛˝(p=0.002), ě ě ěě 결ě (p=0.013), ęˇ¸ëŚŹęł ěěěíźë°ëŚŹě ëśěŹ(p=0.025)ę° ě˘ě ěíě ę´ë ¨ ěěě´ íě¸ëěë¤.
Anti-VEGF ë¨ë
ěë˛ë§ ë°ě íěěěě ëšěŹë°ęľ° ë° ěŹë°ęľ°ě 기ě íšěąě ëśěíěŹ Table 3ě ě ěíěë¤. ëšěŹë°ęľ°ě ěŹë°ęľ°ě ëší´ ěěěíźë°ëŚŹě ěĄ´ěŹ ëšě¨ě´ íľęłě ěźëĄ ě ěíę˛ ëŽěęł (p=0.049) ěľëëłëłě§ę˛˝ íŹę¸°ę° ěěęł (p=0.002) 결ě ě ěę° ě ěë¤(p=0.005). íęˇëśě 결곟ěě ěě ěľëëłëłě§ę˛˝(p=0.030), ě ě ěě 결ě (p=0.017), ęˇ¸ëŚŹęł ěěěíźë°ëŚŹě ëśěŹ (p=0.044)ę° ě˘ě ěíě ę´ë ¨ ěěě´ íě¸ëěë¤. ëí ěŹëĄę° Fig. 1ě ě ěëě´ ěë¤.
ëłľíŠ ěë˛ě ěí ë°ě íěěěě ëšěŹë°ęľ° ë° ěŹë°ęľ°ě 기ě íšěąě ëśěíěŹ Table 4ě ě ěíěë¤. OCT 결곟 ě¤, ěěěíźë°ëŚŹě ěĄ´ěŹ ěŹëśë§ě´ ë ꡸룚 ę° íľęłě ěźëĄ ě ěí ě°¨ě´ëĽź ëł´ěë¤(p=0.014). ICGA ě겏 ě¤ěě ěľëëłëłě§ę˛˝ íŹę¸°(p<0.001)ě 결ě ě ě(p=0.012)ę° ë ꡸룚 ę° ě ěí ě°¨ě´ëĽź ëł´ěë¤. íęˇëśě 결곟, ěľëëłëłě§ę˛˝ íŹę¸°(p=0.006)ë§ě´ ěšëŁ í ě˘ě ěíěě ę´ë ¨ěąě ëł´ěë¤. ëí ěŹëĄę° Fig. 2ě ě ěëě´ ěë¤.
ě´ě ě ę°íë PCVě ěšëŁ 결곟 ë° ěíě ëí ěŹëŹ ë
źëŹ¸ë¤ě íľí´ ěľëëłëłě§ę˛˝[17-20], 결ě ě ęľ°ě§í[17,20,21], 맼ë˝ë§íę´íŹęłźěą[22,23], 맼ë˝ë§ëęť[24,25], ë§ë§íěĄě ě 돴[22] ë° ěěěíźë°ëŚŹě ě 돴[18,26-28ę°] ěíě ę´ë ¨ë ě¤ěí ěě¸ě´ëź ěë ¤ě ¸ ěë¤. ě¤ě ěěěě ë§ě PCV íěë¤ě ëłëłě ěŹíěąí ëë ě
íëĄ ě§ěě ě¸ ěšëŁëĽź íěëĄ íë¤. ꡸ëŹë PCV íěë¤ ě¤ ěźëśěěë ě´ę¸° ěšëŁě ě ë°ěí ě´í ěŹë°ě´ë ěśę° ěšëŁ ěě´ ě°ěí ěë Ľě ě ě§í늰 ě¤ë ę¸°ę° ëě ě˘ě í´ëśíě ěí뼟 ě ě§íë 경ě°ë ěë¤. PCV íěë¤ě ë¤ěí 기ě íšěąë¤ ě¤ěě ěšëŁ í ěí¸í 결곟뼟 ě츥í ě ěë íšě í ě¸ěę° ěë¤ëŠ´ ěšëŁ ë°ŠíĽ ě¤ě ë° ěí ě츥ě ëěě´ ë ę˛ě´ëŠ°, ě´ ě¸ěë¤ě íě
íë ę˛ě´ 본 ě°ęľŹě 몊ě ě´ěë¤.
2010ë
ě Okubo et al [29]ě ě¤ë ę¸°ę° ěšëŁ ěě´ ěě ě ě¸ ěí뼟 ëł´ě´ëŠ° ě˛ě˛í ě§ííë PCV ěŹëĄë¤ě ěěą ę˛˝ęłźëĄ ëł´ęł íë¤. ě°ëŚŹ ě°ęľŹěěë ěľěíě ě´ę¸° ěšëŁ í ěľě 1ë
ě´ě ěŹë°ě´ ěęł ěśę° ěšëŁëĽź ë°ě§ ěěźëŠ°, ě°ěí ěë Ľě ě ě§íë 경ě°ëĽź ěěą ę˛˝ęłźëĄ ě ěíěë¤. ěľěíě ě´ę¸° ěšëŁëź í¨ě anti-VEGF ë¨ë
ěë˛ěěë ě´ę¸° 1ëŹ ę°ę˛Š 3ě°¨ëĄě 죟ěŹ, ęˇ¸ëŚŹęł ëłľíŠ ěë˛ě 경ě°ěë anti-VEGF ěŁźěŹ ěšëŁ 1íě PDT 1íëĄ ě ěíěěźëŠ°, ě°ěí ěë Ľě´ë 20/30 ě´ěě ě¤ëŹë ěë ĽěźëĄ ě ěíěë¤.
본 ě°ęľŹ 결곟ě ë°ëĽ´ëŠ´, 기ě íšěąěě ěľëëłëłě§ę˛˝ě íŹę¸°ę° ěęł ę˛°ě ě ěę° ě ěźëŠ° ěěěíźë°ëŚŹę° ěě ë ěí¸í 경곟뼟 ëł´ěěźëŠ°, ě´ëŹí 결곟ë anti-VEGF ë¨ë
ěë˛ ëë PDT ëłľíŠ ěë˛ ëąě ěšëŁ ë°Šë˛ęłź ěę´ěě´ ëěźíę˛ ëíëŹë¤. ë¤ëĽ¸ ěŹëŹ ë
źëŹ¸ěě ěľëëłëłě§ę˛˝ íŹę¸°ě ěë Ľ ë° ěšëŁ ěíě ěę´ěąě ëí´ ëł´ęł í ë° ěë¤. 2011ë
ě Tsujikawa et al [30]ě PCV íěěě ëłëł íŹę¸°ę° ěě ëëśëśě ę˛˝ě° ě´ę¸° ěë Ľě´ ě˘ěěźëŠ° 경곟 ę´ě°° ę¸°ę° ëě ě°ěí ěë Ľě ě ě§íë¤ęł ëł´ęł íë¤. ěľęˇź Kim et al [17]ě ranibizumab ěŁźěŹ ěšëŁëĽź ë°ě íěë¤ě ëśěí 결곟, í° ěľë ëłëłě§ę˛˝ě´ ěšëŁ í 1ë
ě´ë´ě ëłëłě´ ěŹë°íë ěí ěě¸ ě¤ íëěě ë°íëë¤.
본 ě°ęľŹě ëśě 결곟ěěë ěě ěľëëłëłě§ę˛˝ě´ ěě PCV íěë¤ě ě´ę¸° ěšëŁ í 1ë
ě´ ëë ěśě ę¸°ę° ëě ěŹë° ěě´ ěě ě ěźëĄ ě ě§ëë ěí¸í 경곟뼟 ëł´ěë¤. ë°ëźě ě´ě ě ěë ¤ě§ ë°ě ę°ě´ PCVěě ěľëëłëłě§ę˛˝ě ěë Ľ ěí ë° ěšëŁ 결곟ě ěę´ěąě´ ëě ěě¸ě´ëźë ę˛ě´ íě¸ëěë¤.
íŹëěĄě´ě˛ëź 결ě ě´ ęľ°ě§ě íěąíë ę˛˝ě° ěíę° ě˘ě§ ěë¤ë ěŹě¤ ěě ěľí ěë ¤ě ¸ ěęł , ě´ëŹí ëłëłë¤ě ëě íěąě ë늰 ěśí, ëěśě´ ě ěźě´ëęł ěŹę°í ěë Ľ ěěě ě ë°íë¤[5,31]. 2013ë
ě Hikichi et al [20]ě ranibizumaběźëĄ ěšëŁ ë°ě PCV íěë¤ě ëśěíěŹ, íŹëěĄě´ě ę°ě ęľ°ě§ě ě´ëŁ¨ë 결ě ëłëłě´ ěë 경ě°ě ěľě´ ranibizumab ěŁźěŹ 1ë
íě ěë Ľě´ ě°ěíë¤ë ěŹě¤ě ë°ííěë¤. Lee et al [32]ě 2012ë
ě íŹëěĄě´ íěźëĄ ęľ°ě§ě ě´ëŁ¨ë 결ě ě PCVë PDT ěšëŁ í ěźěśě´ ě§ěëęą°ë ěŹë°íë ëą ěě ë°ěě´ ě˘ě§ ěë¤ë 결곟뼟 ë°ííěęł , 2016ë
ěë íŹëěĄě´í 결ě ě PCV ëłëłě´ ę°ě§ęł ěë ě ě íę´ ě ë°ě íšě§ěźëĄ ě¸í´ ěźë°ě ě¸ PCVëł´ë¤ ë ě죟 죟ěŹëĽź ë§ěěź íë¤ęł ëł´ęł íë¤[21].
íŹëěĄě´í 결ě ęľ°ě§ě 경곟 ę´ě°° ę¸°ę° ě¤ ěŹíěąí ěíě´ ëęł ěšëŁ ę˛°ęłźę° ě˘ě§ ěěźëŠ° 곾겊ě ě¸ ěšëŁëĽź ěíë¤. ë°ëźě PCV ě¤ěě 결ě ě ěę° ě ě ę˛˝ě° ě´ę¸° ěšëŁě ë°ěě´ ë ě˘ěźëŠ° ěĽę¸°ę° ěŹë°ě´ ěë ě°ěí ěí뼟 ëł´ě¸ë¤ęł í ě ěë¤.
ěěěíźë°ëŚŹë PCVě ěěě íšě§ ě¤ íëě´ëŠ°, ě´ ě겏ě anti-VEGF ěë˛ě ě ë°ěíě§ ěë 경íĽě´ ěë¤[33]. ě´ě ě ě°ęľŹë¤ě íľí´ PCV íěěě ěěěíźë°ëŚŹě 쥴ěŹě ěë Ľ ěíě ěę´ěąě ëí´ěë ěźę´ë ę˛°ëĄ ě´ ëěśëě§ ěěë¤.
2008ë
ě Saito et al [28]ě ěěěíźë°ëŚŹę° 쥴ěŹíë PCV íěě 쥴ěŹíě§ ěë íě ę°ě PDT ěšëŁ ě´í ěë Ľě ëšęľíěęł ě ěí ě°¨ě´ę° ěë¤ęł ëł´ęł íë¤. ë°ëŠ´, ěľęˇź ěźëś ě°ęľŹěěë PCV íěěě ěěěíźë°ëŚŹę° ěě ě ěë Ľ ěíę° ë ě˘ë¤ë ę˛°ęłźę° ëł´ęł ëěë¤. Kang and Koh [18]ë 기ě ě ěěěíźë°ëŚŹę° ěë ę˛˝ě° ranibizumab ěŁźěŹ í ěĽę¸° ěë Ľě´ ě°ěíę˛ ě ě§ëë ę˛ęłź ëě ěę´ěąě ëł´ě¸ë¤ęł ëł´ęł íěë¤. ěľęˇź Mori et al [26]ě ranibizumab ěšëŁ 결곟뼟 ëśěíěëë°, 기ě ěěě ěěěíźë°ëŚŹě ě ëŹ´ę° ę˛˝ęłź ę´ě°° ę¸°ę° ě¤ ěŹěšëŁě íě ěŹëśëĽź ě츥íë ěě¸ě´ ëë¤ęł ëł´ęł íë¤.
본 ě°ęľŹěěë 기ě ě ěěěíźë°ëŚŹę° ěë ę˛˝ě° ě´ę¸° ěšëŁ í ě˘ě í´ëśíě 결곟뼟 ëł´ěěźëŠ°, ě´ë anti-VEGF ěŁźěŹ ë¨ěź ěë˛ ěšëŁëĽź ë°ě íěě PDT ëłľíŠ ěšëŁëĽź ë°ě íě ę°ę°ěě ëěźí ę˛°ęłźę° ëíëŹë¤. ëšëĄ ęłźęą°ě ë
źëŹ¸ë¤ě´ ěëĄ ě윊ëë 결곟뼟 ě ěí기ë íěźë, ěěěíźë°ëŚŹě ěĄ´ěŹ ěŹëśë ěšëŁ ěíě 결ě ěě¸ ě¤ íëëĄ ěę°ëë¤. ë°ëźě 기ě ěě ěěěíźë°ëŚŹę° ěë ę˛˝ě° ě´ę¸° ěšëŁ í ěĽę¸°ę° ěśę° ěšëŁę° íě ěë ě°ěí ěí뼟 기ëí ě ěë¤.
본 ě°ęľŹë ëŞ ę°ě§ ě íě ě´ ěë¤. 첍째, 돴ěě ě ě ě íě§ ěęł ěěě íě뼟 ě ě í ííĽě ě°ęľŹëĄ ě§ííě기 ë돸ě ě í í¸íĽě´ ë°ěí ě ěë¤. ë째, 본 ě°ęľŹ 결곟ë ëšěŹë°ęľ°ęłź ěŹë°ęľ° ę°ě íšě§ě ěëě ěźëĄ ëšęľí ę˛ěźëĄ, ě ëě íě¤ ę¸°ě¤ě ě ěíě§ ěěë¤. ě
째, ěľëëłëłě§ę˛˝, 결ě ě ě, ěěěíźë°ëŚŹ ě 돴 ëą ě´ě ě ěë ¤ě§ ě¸ě ě´ě¸ě ěëĄě´ ěě¸ě´ ë°ę˛Źëě§ë ěěë¤. ꡸ëŹë 본 ě°ęľŹě ëěě´ ë íěë¤ě ěśě ę´ě°° ę¸°ę° ě¤ ë´ëš ěěŹě ëłę˛˝ ěě´ ëěźí ě 돸ěěę˛ ě´ę¸° ě§ë¨ëśí° ěšëŁęšě§ ěí ë°ě기 ë돸ě, ę° íěë§ë¤ ěśě ę¸°ę° ě¤ ěšëŁ ë°Šë˛ ę˛°ě ě 기ě¤ě´ ëěźíę˛ ě ěŠëěë¤ęł ëłź ě ěë¤. ëí, anti-VEGF ěŁźěŹ ë¨ěź ěë˛ íšě PDT ëłľíŠ ěë˛ě ěšëŁ ë°Šë˛ě ę´ęłěě´ ěí¸í 결곟ě ę´ë ¨ë ě¸ěë¤ě´ ëěźíë¤ęł ë°íěĄë¤ë ë°ě 본 ě°ęľŹě ë ë¤ëĽ¸ ěěę° ěë¤ęł ěę°ëë¤. 본 ě°ęľŹěě PCVě ěí¸í 경곟ë ě˘ě í´ëśíě ěí(dry macula)ě 기ëĽě ěźëĄ ě°ěí ěë Ľ(ě¤ëŹë ěë Ľ 20/30 ě´ě) ě ě§ ëŞ¨ë뼟 ęł ë ¤íěŹ ě ěíěěźëŠ°, ë°ëźě ë¤ëĽ¸ ě°ęľŹě ëšęľí´ ëšěŹë°ęľ° ě ě 기ě¤ě´ ë ě겊íë¤ë ě ëí 본 ě°ęľŹę° ę°ě§ë ę°ě ě´ëźęł ëłź ě ěë¤.
ę˛°ëĄ ě ěźëĄ, PCV ěšëŁě ěě´ě anti-VEGF ěŁźěŹ ë¨ěź ěë˛ě´ë PDT ëłľíŠ ěë˛ ëąě ěšëŁ ë°Šë˛ě ë§ëĄ íęł , ěě ěľëëłëłě§ę˛˝, ě ě ěě 결ě , ěěěíźë°ëŚŹě ëśěŹě ę°ě 기ě íšěąě´ ě´ę¸° ěšëŁ í ě¤ë ę¸°ę° ěŹë°ě´ ěěźëŠ° ě°ěí ěë Ľě´ ě ě§ëë ěí¸í 경곟ě ě°ę´ë ě¸ěëźë ę˛ě´ íě¸ëěë¤. ě¤ě ěěěě ěšëŁ ěě ě ě 기ě ěě ě´ě ę°ě íšěąě íě
íë ę˛ě´ íěě ěšëŁ 결곟 ě츥 ë° ěśě ę´ě°° ę¸°ę° ëě ěšëŁ ë°ŠíĽ ě¤ě ě ëěě´ ë ę˛ěźëĄ ěę°ëë¤.
Figure 1.
Baseline indocyanine green angiography and optical coherence tomography images of patients who received anti-vascular endothelial growth factor monotherapy. (A) Images of a patient in nonrecurrent group shows smaller greatest linear dimension (GLD), single polyp and absence of pigmented epithelial detachment (PED). (B) Images of a patient in recurrent group shows larger GLD, multiple polyps and presence of PED. Double arrow demonstrates GLD of a vascularized lesion.
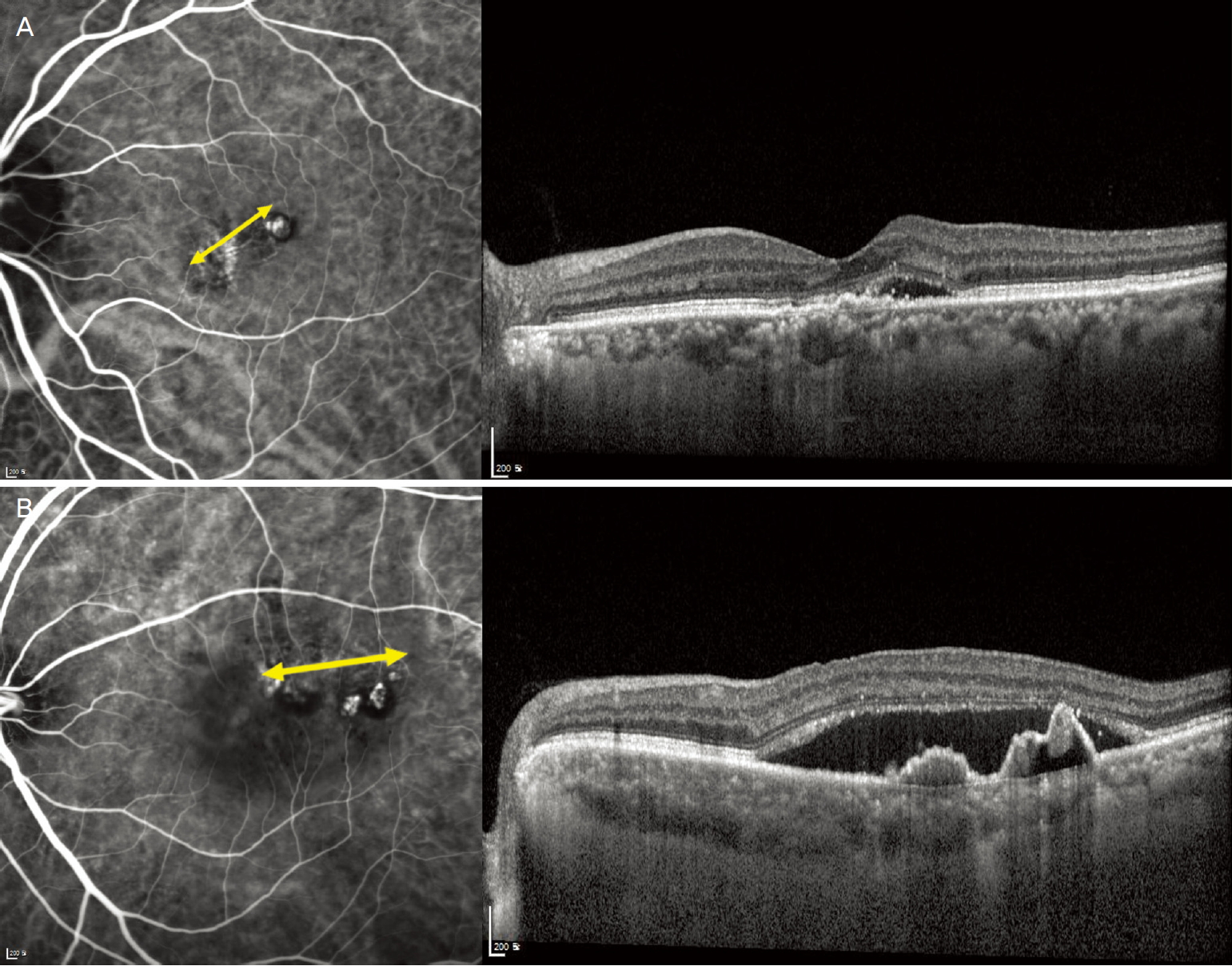
Figure 2.
Baseline indocyanine green angiography and optical coherence tomography images of patients who received combination therapy. (A) Images of a patient in nonrecurrent group shows smaller greatest linear dimension (GLD), single polyp and absence of pigmented epithelial detachment (PED). (B) Images of a patient in recurrent group shows larger GLD, multiple polyps and presence of PED. Double arrow demonstrates GLD of a vascularized lesion.
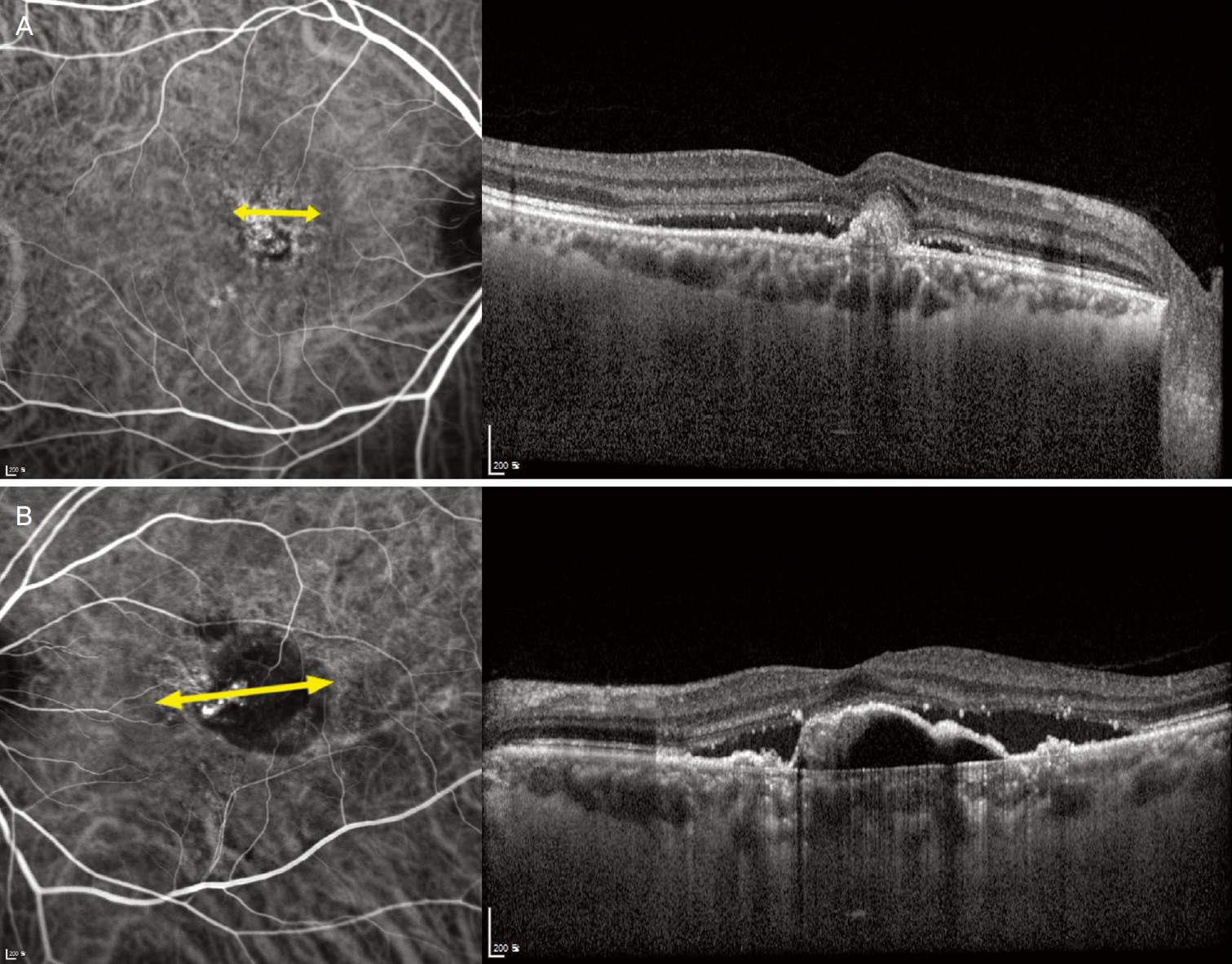
Table 1.
Baseline characteristics of total enrolled patients
Table 2.
Comparison of characteristics between nonrecurrent and recurrent group
| Characteristic | Nonrecurrent (n = 47) | Recurrent (n = 54) | p-value |
|---|---|---|---|
| Age (years) | 62.98 Âą 9.58 | 64.57 Âą 8.05 | 0.365* |
| Sex (male/female) | 32/15 | 44/10 | 0.166â |
| Baseline BCVA (logMAR) | 0.30 Âą 0.22 | 0.39 Âą 0.27 | 0.108* |
| Final BCVA (logMAR) | 0.07 Âą 0.09 | 0.44 Âą 0.31 | <0.001* |
| Subfoveal choroidal thickness (Îźm) | 274.47 Âą 106.58 | 296.24 Âą 102.47 | 0.298* |
| Presence of subretinal fluid | 43 (91.5) | 52 (96.3) | 0.413â |
| Presence of intraretinal fluid | 8 (17.0) | 5 (9.3) | 0.372â |
| Presence of pigment epithelial detachment | 8 (17.0) | 25 (46.3) | 0.003â |
| Number of polyps | 1.13 Âą 0.34 | 1.76 Âą 1.05 | <0.001* |
| Greatest linear dimension (Îźm) | 2,461.77 Âą 836.10 | 3,545.56 Âą 1,207.42 | <0.001* |
| Choroidal vascular hyperpermeability | 20 (42.6) | 24 (44.4) | 0.999â |
| Treatment option (anti-VEGF/combination) | 29/18 | 30/24 | 0.551â |
Table 3.
Comparison of characteristics between nonrecurrent and recurrent group among patients treated with anti-VEGF monotherapy
| Characteristic | Nonrecurrent (n = 29) | Recurrent (n = 30) | p-value |
|---|---|---|---|
| Age (years) | 62.45 Âą 9.47 | 65.20 Âą 8.85 | 0.254* |
| Sex (male/female) | 18/11 | 22/8 | 0.259â |
| Baseline BCVA (logMAR) | 0.27 Âą 0.19 | 0.33 Âą 0.22 | 0.249* |
| Final BCVA (logMAR) | 0.06 Âą 0.07 | 0.38 Âą 0.34 | <0.001* |
| Subfoveal choroidal thickness (Îźm) | 290.69 Âą 111.66 | 315.87 Âą 90.64 | 0.345* |
| Presence of subretinal fluid | 26 (89.7) | 29 (96.7) | 0.293â |
| Presence of intraretinal fluid | 5 (17.2) | 3 (10.0) | 0.334â |
| Presence of pigment epithelial detachment | 5 (17.2) | 12 (40.0) | 0.049â |
| Number of polyps | 1.14 Âą 0.35 | 1.67 Âą 0.92 | 0.005* |
| Greatest linear dimension (Îźm) | 2,539.03 Âą 870.21 | 3,489.23 Âą 1,281.12 | 0.002* |
| Choroidal vascular hyperpermeability | 14 (48.3) | 15 (50.0) | 0.551â |
Table 4.
Comparison of characteristics between nonrecurrent and recurrent group among patients treated with combination therapy
| Characteristic | Nonrecurrent (n = 18) | Recurrent (n = 24) | p-value |
|---|---|---|---|
| Age (years) | 63.83 Âą 9.95 | 63.79 Âą 7.03 | 0.987* |
| Sex (male/female) | 14/4 | 22/2 | 0.204â |
| Baseline BCVA (logMAR) | 0.37 Âą 0.26 | 0.46 Âą 0.32 | 0.330* |
| Final BCVA (logMAR) | 0.12 Âą 0.12 | 0.51 Âą 0.26 | <0.001* |
| Subfoveal choroidal thickness (Îźm) | 248.33 Âą 95.04 | 271.71 Âą 112.73 | 0.471* |
| Presence of subretinal fluid | 17 (94.4) | 23 (95.8) | 0.679â |
| Presence of intraretinal fluid | 3 (16.7) | 2 (8.3) | 0.361â |
| Presence of pigment epithelial detachment | 3 (16.7) | 13 (54.2) | 0.014â |
| Number of polyps | 1.11 Âą 0.32 | 1.88 Âą 1.12 | 0.012* |
| Greatest linear dimension (Îźm) | 2,337.28 Âą 785.95 | 3,615.96 Âą 1,131.66 | <0.001* |
| Choroidal vascular hyperpermeability | 6 (33.3) | 9 (37.5) | 0.520â |
REFERENCES
1) Yannuzzi LA, Sorenson J, Spaide RF, Lipson B. Idiopathic polypoidal choroidal vasculopathy (IPCV). Retina 1990;10:1-8.


2) Spaide RF, Yannuzzi LA, Slakter JS, et al. Indocyanine green videoangiography of idiopathic polypoidal choroidal vasculopathy. Retina 1995;15:100-10.


3) Yannuzzi LA, Ciardella A, Spaide RF, et al. The expanding clinical spectrum of idiopathic polypoidal choroidal vasculopathy. Arch Ophthalmol 1997;115:478-85.


4) Yannuzzi LA, Wong DW, Sforzolini BS, et al. Polypoidal choroidal vasculopathy and neovascularized age-related macular degeneration. Arch Ophthalmol 1999;117:1503-10.


5) Uyama M, Wada M, Nagai Y, et al. Polypoidal choroidal vasculopathy: natural history. Am J Ophthalmol 2002;133:639-48.


6) Ciardella AP, Donsoff IM, Huang SJ, et al. Polypoidal choroidal vasculopathy. Surv Ophthalmol 2004;49:25-37.


7) Chan WM, Lam DS, Lai TY, et al. Photodynamic therapy with verteporfin for symptomatic polypoidal choroidal vasculopathy: one-year results of a prospective case series. Ophthalmology 2004;111:1576-84.


8) Kokame GT, Yeung L, Lai JC. Continuous anti-VEGF treatment with ranibizumab for polypoidal choroidal vasculopathy: 6-month results. Br J Ophthalmol 2010;94:297-301.


9) Koh A, Lee WK, Chen LJ, et al. EVEREST study: efficacy and safety of verteporfin photodynamic therapy in combination with ranibizumab or alone versus ranibizumab monotherapy in patients with symptomatic macular polypoidal choroidal vasculopathy. Retina 2012;32:1453-64.


10) Lee WK, Iida T, Ogura Y, et al. Efficacy and Safety of Intravitreal Aflibercept for Polypoidal Choroidal Vasculopathy in the PLANET Study: a randomized clinical trial. JAMA Ophthalmol 2018;136:786-93.



11) Gomi F, Ohji M, Sayanagi K, et al. One-year outcomes of photodynamic therapy in age-related macular degeneration and polypoidal choroidal vasculopathy in Japanese patients. Ophthalmology 2008;115:141-6.


12) Yamashita A, Shiraga F, Shiragami C, et al. Two-year results of reduced-fluence photodynamic therapy for polypoidal choroidal vasculopathy. Am J Ophthalmol 2013 155:96-102. e1.


13) Fung AE, Lalwani GA, Rosenfeld PJ, et al. An optical coherence tomography-guided, variable dosing regimen with intravitreal ranibizumab (Lucentis) for neovascular age-related macular degeneration. Am J Ophthalmol 2007;143:566-83.


14) Engelbert M, Zweifel SA, Freund KB. "Treat and extend" dosing of intravitreal antivascular endothelial growth factor therapy for type 3 neovascularization/retinal angiomatous proliferation. Retina 2009;29:1424-31.


15) Kim JH. Intravitreal anti-vascular endothelial growth factor therapy for retinal angiomatous proliferation: a review of the literature and therapeutic considerations. J Retin 2016;1:11-22.

16) Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: one-year results of 2 randomized clinical trialsâTAP report 1. Treatment of age-related macular degeneration with photodynamic therapy (TAP) Study Group. Arch Ophthalmol 1999;117:1329-45.


17) Kim JH, Chang YS, Kim JW, et al. Submacular hemorrhage and grape-like polyp clusters: factors associated with reactivation of the lesion in polypoidal choroidal vasculopathy. Eye (Lond) 2017;31:1678-84.




18) Kang HM, Koh HJ. Long-term visual outcome and prognostic factors after intravitreal ranibizumab injections for polypoidal choroidal vasculopathy. Am J Ophthalmol 2013;156:652-60.


19) Koizumi H, Yamagishi T, Yamazaki T, Kinoshita S. Predictive factors of resolved retinal fluid after intravitreal ranibizumab for polypoidal choroidal vasculopathy. Br J Ophthalmol 2011;95:1555-9.


20) Hikichi T, Higuchi M, Matsushita T, et al. Factors predictive of outcomes 1 year after 3 monthly ranibizumab injections and as-needed reinjections for polypoidal choroidal vasculopathy in Japanese patients. Retina 2013;33:1949-58.


21) Lee JH, Lee WK. Anti-vascular endothelial growth factor monotherapy for polypoidal choroidal vasculopathy with polyps resembling grape clusters. Graefes Arch Clin Exp Ophthalmol 2016;254:645-51.



22) Ogasawara M, Koizumi H, Yamamoto A, et al. Prognostic factors after aflibercept therapy for typical age-related macular degeneration and polypoidal choroidal vasculopathy. Jpn J Ophthalmol 2018;62:584-91.



23) Koizumi H, Yamagishi T, Yamazaki T, Kinoshita S. Relationship between clinical characteristics of polypoidal choroidal vasculopathy and choroidal vascular hyperpermeability. Am J Ophthalmol 2013 155:305-13. e1.


24) Kong M, Kim SM, Ham DI. Comparison of clinical features and 3-month treatment response among three different choroidal thickness groups in polypoidal choroidal vasculopathy. PLoS One 2017;12:e0184058.



25) Sakurada Y, Sugiyama A, Tanabe N, et al. Choroidal thickness as a prognostic factor of photodynamic therapy with aflibercept or ranibizumab for polypoidal choroidal vasculopathy. Retina 2017;37:1866-72.


26) Mori R, Tanaka K, Yuzawa M. Factors predicting 2-year treatment results of ranibizumab therapy for polypoidal choroidal vasculopathy in eyes with good baseline visual acuity. Medicine (Baltimore) 2018;97:e11188.



27) Cho HJ, Kim HS, Jang YS, et al. Effects of choroidal vascular hyperpermeability on anti-vascular endothelial growth factor treatment for polypoidal choroidal vasculopathy. Am J Ophthalmol 2013 156:1192-200. e1.


28) Saito M, Iida T, Nagayama D. Photodynamic therapy with verteporfin for age-related macular degeneration or polypoidal choroidal vasculopathy: comparison of the presence of serous retinal pigment epithelial detachment. Br J Ophthalmol 2008;92:1642-7.


29) Okubo A, Arimura N, Abematsu N, Sakamoto T. Predictable signs of benign course of polypoidal choroidal vasculopathy: based upon the long-term observation of non-treated eyes. Acta Ophthalmol 2010;88:e107-14.


30) Tsujikawa A, Ojima Y, Yamashiro K, et al. Association of lesion size and visual prognosis to polypoidal choroidal vasculopathy. Am J Ophthalmol 2011 151:961-72. e1.


31) Bessho H, Honda S, Imai H, Negi A. Natural course and funduscopic findings of polypoidal choroidal vasculopathy in a Japanese population over 1 year of follow-up. Retina 2011;31:1598-602.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




