 |
 |
| J Korean Ophthalmol Soc > Volume 63(6); 2022 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉļōżņŚÉņä£ ņĢģņä▒ļģ╣ļé┤ņןņØä Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ņØ┤ļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņ”ØļĪĆņÜöņĢĮ
(ņ”ØļĪĆ 1) ņÜ░ņĢł ĒÅÉņćäĻ░üļģ╣ļé┤ņןņØ┤ ņ׳ļŖö 76ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉņŚÉņä£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. Ļ░üļ¦ēļČĆņĀäņØä ņÜ░ļĀżĒĢśņŚ¼ ņĢäļ®öļō£ļ░ĖļĖī ĒŖ£ļĖīļź╝ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æ ļé┤ņŚÉ ņ£äņ╣śņŗ£ņ╝░ļŗż. ņłĀ Ēøä 8ņØ╝ņ¦Ė, ņ¢ĢņØĆ ņĀäļ░®Ļ│╝ ņĢłņĢĢņāüņŖ╣ņ£╝ļĪ£ ņłśņłĀņĀü ĒÖŹņ▒äņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłĀ Ēøä 3ņŻ╝ņ¦Ė ņĢłņĢĢņāüņŖ╣ ļ░Å ņĀäļ░®ņåīņŗżļĪ£ ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ļ░śļ│ĄņĀü ņĢłņĢĢņāüņŖ╣ņØ┤ ņ׳ņ¢┤ ņĢäļ®öļō£ļ░ĖļĖī ĒŖ£ļĖīļź╝ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ļĪ£ ņ×¼ņ£äņ╣ś ņŗ£Ēé© Ēøä ņĢłņĢĢņØ┤ ņĪ░ņĀłļÉśņŚłļŗż. (ņ”ØļĪĆ 2) Ļ▒░ņ¦ōļ╣äļŖśļģ╣ļé┤ņןņØ┤ ņ׳ļŖö 93ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉņŚÉĻ▓ī ņóīņĢł ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ņŗ£Ē¢ē Ēøä 5ņØ╝ņ¦Ė ņĢłņĢĢņāüņŖ╣ ļ░Å ņĀäļ░®ņåīņŗż, ņĀäļ░® ļé┤ ņłśņĀĢņ▓┤ Ēö╝ņ¦łĻ│╝ ĒāłņČ£ļÉ£ ņ£Āļ”¼ņ▓┤Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż. ņĀäļ░®ņäĖņ▓ÖĻ│╝ ņłśņłĀņĀü ĒÖŹņ▒äņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒ¢łņ£╝ļéś ņłĀ Ēøä 1Ļ░£ņøö ņĢłņĢĢ ņ×¼ņāüņŖ╣ ļ░Å ņĀäļ░®ņåīņŗżļĪ£ ņĢ×ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż.
Ļ▓░ļĪĀ
ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ņāØĻĖ░ļŖö Ļ▓ĮņÜ░ļŖö ļ¦żņÜ░ ļō£ļ¼╝ļŗż. ņ¦¦ņØĆ ņĢłņČĢņן, ņĢĮĒĢ£ ņä¼ļ¬©ņ▓┤ņåīļīĆ, Ļ│ĀļĀ╣, ņŚ¼ņä▒ ļō▒ņØś ņ£äĒŚśņÜöņåīĻ░Ć Ļ│ĄņĪ┤ĒĢśļŖö Ļ▓ĮņÜ░, ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņĢģņä▒ļģ╣ļé┤ņןņØś ļ░£ņāØ Ļ░ĆļŖźņä▒ņØ┤ ļåÆņĢäņ¦ł ņłś ņ׳ņ¢┤ ņŻ╝ņØśĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ABSTRACT
Case summary
(Case 1) A 76-year-old female with angle closure glaucoma in the right eye underwent Ahmed valve implantation. To reduce the risk of corneal endothelial failure, the tube tip was located in the sulcus. Eight days after surgery, surgical iridectomy was performed due to intraocular pressure elevation and a shallow anterior chamber. Three weeks later, vitrectomy was performed due to intraocular pressure elevation with a shallow anterior chamber. Recurrent intraocular pressure elevation was resolved after tip reposition into the vitreous cavity. (Case 2) A 93-year-old female with pseudoexfoliation glaucoma underwent Ahmed valve implantation in the left eye. Five days after surgery, the intraocular pressure increased with a shallow anterior chamber; the remnant cortex and prolapsed vitreous body were present in the anterior chamber. She underwent anterior chamber washing and surgical iridectomy; however, the increase in intraocular pressure with a shallow anterior chamber worsened after 1 month; thus, anterior vitrectomy was performed.
Conclusions
Malignant glaucoma after Ahmed valve implantation is considered very rare. However, if risk factors such as short axial length, zonular weakness, old age, or female gender are present, as in these cases, there may be an increased risk of malignant glaucoma developing after Ahmed valve implantation.
ņĢģņä▒ļģ╣ļé┤ņןņØ┤ļØ╝ļŖö ņÜ®ņ¢┤ļŖö ĻĖ░ņĪ┤ņØś ļģ╣ļé┤ņן ņ╣śļŻīņŚÉ ņל ļ░śņØæĒĢśņ¦Ć ņĢŖĻ│Ā, ļ╣Āļź┤Ļ▓ī ņ¦äĒ¢ēĒĢśņŚ¼ ņŗżļ¬ģĻ╣īņ¦Ć ņØ┤ļź╝ ņłś ņ׳Ļ▓ī ĒĢśļŖö Ļ│ĄĻ▓®ņĀüņØĖ ļģ╣ļé┤ņןņØä ļ¼śņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ 1869ļģä von Graefe [1]Ļ░Ć ņĀ£ņŗ£Ē¢łļŗż. ņĢģņä▒ļģ╣ļé┤ņןņØĆ ņĀäĒśĢņĀüņ£╝ļĪ£ ņØ╝ņ░©ĒÅÉņćäĻ░üļģ╣ļé┤ņןņØä Ļ░Ćņ¦ä ĒÖśņ×ÉņŚÉņä£ ņłśņłĀņĀü ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒ¢łņØä ļĢī ļō£ļ¼╝Ļ▓ī ļéśĒāĆļéśļŖö ļģ╣ļé┤ņןņØś ĒĢ£ ĒśĢĒā£ņØ┤ļ®░, ļ¦źļØĮļ¦ēņāüĻ░ĢņČ£Ēśł ļśÉļŖö ļ¦źļØĮļ¦ēņé╝ņČ£ ļō▒ ļ¦Øļ¦ēņØś ļ│æļ│ĆņØĆ ņŚåņ£╝ļ®░ ĒÖŹņ▒ä ņĀłĻ░£ņ░ĮņØ┤ ņĀüņĀłĒĢśĻ▓ī Ļ░£ļ░®ļÉśņ¢┤ ņ׳ņ¦Ćļ¦ī ļ¦żņÜ░ ņ¢ĢĻ▒░ļéś ņåīņŗżļÉ£ ņĀäļ░®Ļ│╝ ļŹöļČłņ¢┤ ņĢłņĢĢņØ┤ ņś¼ļØ╝Ļ░ĆļŖö ĒŖ╣ņ¦ĢņØä ņ¦Ćļŗīļŗż[2]. ĒŖ╣Ē׳ ļ░▒ļé┤ņןņłśņłĀņØ┤ ņłśņłĀ Ļ│╝ņĀĢņŚÉ ĒżĒĢ©ļÉ£ Ļ▓ĮņÜ░ ļ░£ļ│æļźĀņØ┤ ļåÆņ£╝ļ®░, ļģ╣ļé┤ņןņłśņłĀ ņżæņŚÉņä£ļŖö ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņØä ļĢīĻ░Ć Seton valve, ExPress shunt ļō▒[3]ņØś ļ░®ņłśņ£ĀņČ£ņןņ╣śļź╝ ņéĮņ×ģĒĢśņśĆņØä ļĢīļ│┤ļŗż ņĢģņä▒ļģ╣ļé┤ņן ļ░£ļ│æļźĀņØ┤ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż. ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ļ░£ņāØĒĢ£ ņé¼ļĪĆļŖö ļ¦żņÜ░ ļō£ļ¼╝ļ®░, ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ņ×¼ņłśņłĀ ņØ┤Ēøä ļ░£ņāØĒĢ£ ĻĄŁņÖĖļ│┤Ļ│Ā 1ņśłņÖĆ Ļ│ĀļĀ╣ņØś Ļ▒░ņ¦ōļ╣äļŖśņ”ØĒøäĻĄ░ņŚÉņä£ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ņØ┤ĒøäņŚÉ ļ░£ņāØĒĢ£ ĻĄŁļé┤ ĒÖśņ×Éļ│┤Ļ│Ā 1ņśłĻ░Ć ņ׳ļŗż[4,5]. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ļŗ©ļÅģ ņŗ£Ē¢ē Ēøä ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ļ░£ņāØĒĢ£ 2ņśłļź╝ Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ņØ┤ļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
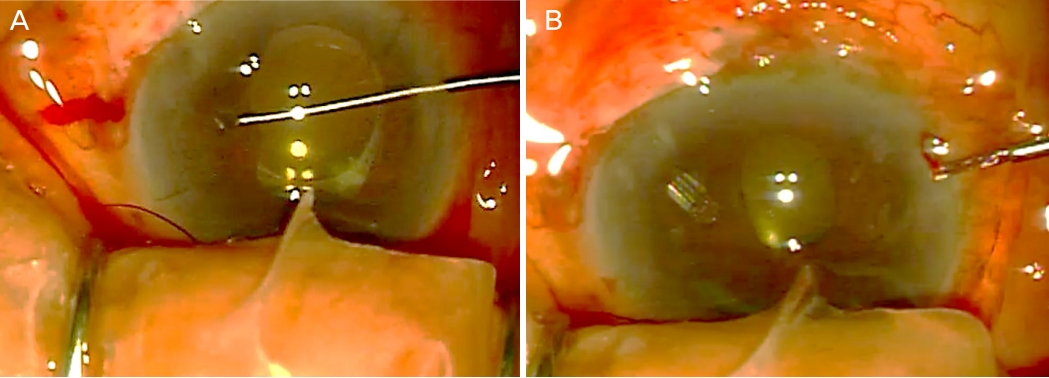
76ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉņŚÉĻ▓ī ĒÅÉņćäĻ░üļģ╣ļé┤ņןņ£╝ļĪ£ ņÜ░ņĢł ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. 5ļģä ņĀä ņ¢æņĢł ļ░▒ļé┤ņןņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ ņØĖĻ│ĄņłśņĀĢņ▓┤ļŖö ĒøäļéŁņŚÉ ņ£äņ╣śĒĢśĻ│Ā ņ׳ņŚłņ£╝ļ®░ ņä¼ļ¬©ņ▓┤ņåīļīĆņØś ņĢĮĒÖöļŖö ļÜ£ļĀĘĒĢśņ¦Ć ņĢŖņĢśļŗż. ņłĀ ņĀä ņÜ░ņĢł ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 0.5ņØ┤Ļ│Ā Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļĪ£ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņØĆ 18 mmHgņśĆļŗż. ņÜ░ņĢł ņĢłņČĢņןņØĆ 20.83 mm, ņłĀ ņĀä ņĖĪņĀĢĒĢ£ Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżļ░ĆļÅäļŖö 1,244 cells/mm2ņśĆļŗż. ņłśņłĀņØĆ ņĢäļ®öļō£ļ░ĖļĖīņØś Ļ░£ļ░®ņä▒ņØä ĒÖĢņØĖ Ēøä ņłĀ Ēøä ņĀĆņĢłņĢĢņØä ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤ 1Ļ░ĆļŗźņØś 4-0 NylonņØä ĒŖ£ļĖī ņĢłņ£╝ļĪ£ ļäŻņØĆ ņāüĒā£ņŚÉņä£ ĒŖ£ļĖīļź╝ 8-0 VicrylļĪ£ Ļ▓░ņ░░ĒĢśĻ│Ā ņØ┤Ēøä nylonņØä ņĀ£Ļ▒░ĒĢśņśĆļŗż. ņĀäļ░®ņŚÉ 1.6% hyaluronic acid/4.0% chondroitin sulfate (Discovisc┬«; Alcon Laboratories, Inc., Fort Worth, TX, USA)ļź╝ ņ▒äņÜ┤ ļÆż ĒŖ£ļĖīļź╝ ņéĮņ×ģĒĢśņśĆĻ│Ā Ļ▓░ļ¦ē ļ┤ēĒĢ® ņĀä ņĀĆņĢłņĢĢ ļ░Å ņ¢ĢņØĆ ņĀäļ░®ņØä ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤ ņĀäļ░® ļé┤ņŚÉ ņĀÉĒāäļ¼╝ņ¦ł(Discovisc┬«, Alcon Laboratories, Inc.)ņØä ņ▒äņøī ļäŻņŚłļŗż. Ļ░üļ¦ēļČĆņĀä ņ£äĒŚśņØä ņĄ£ņåīĒÖöĒĢśĻĖ░ ņ£äĒĢ┤ ņĢäļ®öļō£ļ░ĖļĖī ĒŖ£ļĖīļź╝ ņä¼ļ¬©ņ▓┤Ļ│Āļ×æ ļé┤ņŚÉ ņ£äņ╣śņŗ£ņ╝░ļŗż. ņłĀ Ēøä 1ņØ╝ņ¦Ė ņÜ░ņĢł ņĢłņĢĢņØĆ 15 mmHgļĪ£ ņĖĪņĀĢļÉśņŚłņ£╝ļ®░ ņĀäļ░®ņØĆ Ļ╣ŖĻ▓ī ņ£Āņ¦ĆļÉśņŚłļŗż. ņłĀ Ēøä 8ņØ╝ņ¦Ė ņÜ░ņĢł ņŗ£ļĀź ņĢłņĀäņłśņ¦Ć 30 cm, ņĢłņĢĢ 36 mmHg, ņ¢ĢņØĆ ņĀäļ░®ņØ┤ Ļ┤Ćņ░░ļÉśļ®░ ĒÖŹņ▒äĻ░Ć ĒŖ£ļĖī ļüØņØä ļ¦ēĻ│Ā ņ׳ļŖö Ļ▓āņØ┤ ņØśņŗ¼ļÉśņŚłļŗż. ļÅÖĻ│Ą ņ░©ļŗ© ļģ╣ļé┤ņןņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ ļäōņØĆ ņłśņłĀņĀü ĒÖŹņ▒äņĀłņĀ£ņłĀņØä ņŗ£Ē¢ē Ēøä ņĀłņĀ£ļÉ£ ĒÖŹņ▒ä ļé┤ļĪ£ ĒŖ£ļĖīļź╝ ĒåĄĻ│╝ņŗ£ņ╝£ ņĀäļ░®ņŚÉ ņ£äņ╣śņŗ£ņ╝░ļŗż(Fig. 1). ļŗżņØīļéĀ ņÜ░ņĢł ņĢłņĢĢ 12 mmHgļĪ£ ņĖĪņĀĢļÉśņŚłņ£╝ļ®░ ņĀäļ░® ņåīņŗżļÉśņ¢┤ ņĀäļ░® ļé┤ ņĀÉĒāäļ¼╝ņ¦ł(Discovisc┬«; Alcon Laboratories, Inc.)ņØä ņŻ╝ņ×ģĒĢśņśĆļŗż. ņłśņłĀņĀü ĒÖŹņ▒äņĀłņĀ£ņłĀ ņŗ£Ē¢ē 1ņŻ╝ Ēøä ņÜ░ņĢł ĒåĄņ”Ø, Ļ░üļ¦ēļČĆņóģĻ│╝ ĒĢ©Ļ╗ś ņĢłņĢĢņØ┤ 31 mmHgļĪ£ ņāüņŖ╣ĒĢśņśĆņ£╝ļ®░ ņ¢ĢņØĆ ņĀäļ░®ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņ┤łņØīĒīīĻ▓Ćņé¼ņāü ļ¦źļØĮļ¦ēņāüĻ░ĢņČ£ĒśłņØ┤ļéś ļ¦źļØĮļ¦ēņé╝ņČ£ ļō▒ņØś ĒŖ╣ņØ┤ ņåīĻ▓¼ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Fig. 2). 1% atropine sulfate (Isopto┬« Atropine; Alcon Laboratories, Inc.) ĒĢśļŻ© 2ĒÜī, 1% predisolone acetate (PredForte┬«; Allergan Inc., Irvine, CA, USA) ĒĢśļŻ© 4ĒÜī ņĀÉņĢłĻ│╝ ļŹöļČłņ¢┤ dorzolamide hydrochloride/timolol maleate (Cosopt┬«; Merck & Co, Inc., Kenilworth, NJ, USA) ĒĢśļŻ© 2ĒÜī ņĀÉņĢł, brimonidine tartrate (Alphagan┬«-P; Allergan Inc.) ĒĢśļŻ© 3ĒÜī ņĀÉņĢł ļ░Å Travoprost (Travatan┬«, Alcon Inc., Camberley, UK) ĒĢśļŻ© 1ĒÜī ņĀÉņĢłĒĢśņśĆņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĢłņĢĢņØ┤ 37 mmHgļĪ£ ņĖĪņĀĢļÉśņ¢┤ ņĢģņä▒ļģ╣ļé┤ņן ņ¦äļŗ©ĒĢśņŚÉ ņÜ░ņĢł ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłĀ Ēøä 1ņØ╝ņ¦Ė ņĢłņĢĢņØĆ 13 mmHg ņåīĻ▓¼ņØä ļ│┤ņśĆĻ│Ā ņĀäļ░®ņØĆ ņל ņ£Āņ¦ĆļÉśņŚłļŗż. ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ 1ļģä Ēøä, ņÜ░ņĢł ņŗ£ļĀźņØĆ ņĢłņĀäņłśļÅÖ, ņĢłņĢĢņØĆ 25 mmHg, Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżļ░ĆļÅä 790 cells/mm2ļĪ£ ņĖĪņĀĢļÉśņŚłņ£╝ļ®░ ņĢäļ®öļō£ļ░ĖļĖī ĒŖ£ļĖī ļüØņØ┤ ĒÖŹņ▒äņŚÉ ļ¦ēĒśĆņ׳ņŚłļŗż. ņØ┤ņŚÉ ņĢäļ®öļō£ļ░ĖļĖī ĒŖ£ļĖīļź╝ ņä¼ļ¬©ņ▓┤ ĒÅēļ®┤ļČĆļź╝ ĒåĄĒĢ┤ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ņŚÉ ņ×¼ņ£äņ╣ś ņŗ£ņ╝░ņ£╝ļ®░ ņĢäļ®öļō£ļ░ĖļĖī ĒŖ£ļĖī ņ×¼ņ£äņ╣śņłĀ Ēøä 5Ļ░£ņøöņ¦Ė ņÜ░ņĢł ĻĄÉņĀĢņŗ£ļĀź 0.2, ņĢłņĢĢ 12 mmHg, Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżļ░ĆļÅä 875 cells/mm2ļĪ£ ņĖĪņĀĢļÉśņŚłņ£╝ļ®░ ņĀäļ░®ņØĆ Ļ╣ŖĻ▓ī ņ£Āņ¦ĆļÉśņŚłļŗż(Fig. 3).
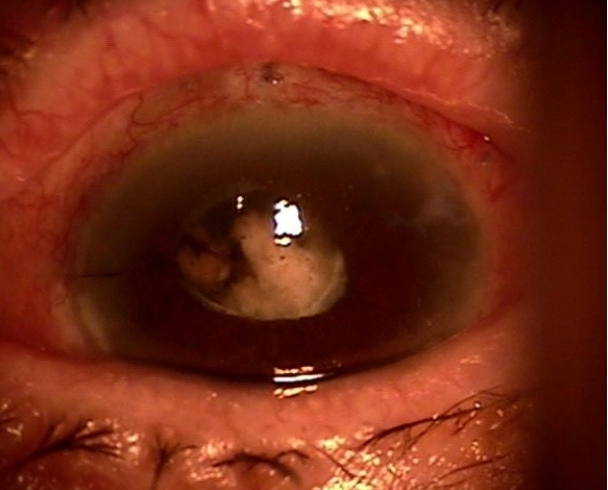
93ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉĻ░Ć Ļ▒░ņ¦ōļ╣äļŖśļģ╣ļé┤ņןņ£╝ļĪ£ ņóīņĢł ņĢäļ®öļō£ļ░ĖļĖī ņéĮņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłĀņ×É ļ░Å ņłśņłĀ ļ░®ļ▓ĢņØĆ ņ”ØļĪĆ 1Ļ│╝ ļÅÖņØ╝ĒĢśļ®░ ņĢäļ®öļō£ļ░ĖļĖīņØś ĒŖ£ļĖīļŖö ņĀäļ░® ļé┤ļĪ£ ņ£äņ╣śņŗ£ņ╝░ļŗż. 9ļģä ņĀä ņÜ░ņĢł ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ļ░Å ņ¢æņĢł ļ░▒ļé┤ņןņłśņłĀņØä ņŗ£Ē¢ēĒĢ£ ĻĖ░ņÖĢļĀźņØ┤ ņ׳ņ£╝ļ®░, ņóīņĢł ņØĖĻ│ĄņłśņĀĢņ▓┤ļŖö ĒøäļéŁņŚÉ ņéĮņ×ģļÉśņ¢┤ ņ׳ņŚłĻ│Ā ĒøäļéŁ ĒīīņŚ┤ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņØĖĻ│ĄņłśņĀĢņ▓┤ļ¢©ļ”╝ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņłĀ ņĀä ņóīņĢł ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 0.1, Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļĪ£ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņØĆ 30 mmHg, ņĢłņČĢņןņØĆ 22.0 mmļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ņłĀ Ēøä 1ņØ╝ņ¦Ė ņóīņĢł ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņĢłņĀäņłśļÅÖ, ņĢłņĢĢ 5 mmHgļĪ£ ņĖĪņĀĢļÉśņŚłĻ│Ā ņ¢ĢņØĆ ņĀäļ░®ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņłĀ Ēøä 5ņØ╝ņ¦Ė ņĀäļ░®ņØĆ ņŚ¼ņĀäĒ׳ ņ¢ĢņŚłĻ│Ā ņĢłņĢĢņØĆ 22 mmHgļĪ£ ņāüņŖ╣ĒĢ£ ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļ®░, ņłĀ ņĀä ļ░Å ņłĀ ņżæ ļ│┤ņØ┤ņ¦Ć ņĢŖļŹś ņØĖĻ│ĄņłśņĀĢņ▓┤ ņĢäļלņ¬Įņ£╝ļĪ£ ļé©ņĢäņ׳ļŹś Ēö╝ņ¦łĻ│╝ ņ£Āļ”¼ņ▓┤ ņØ╝ļČĆņØś ĒāłņČ£ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 4). 1% atropine sulfate (Alcon Laboratories, Inc.)ņØä ĒĢśļŻ© 2ĒÜī ņĀÉņĢł ļ░Å ņĀäļ░® ļé┤ ņĀÉĒāäļ¼╝ņ¦ł(Discovisc┬«; Alcon Laboratories, Inc.)ņØä ņŻ╝ņ×ģ ņŗ£Ē¢ēĒĢśļ®░ Ļ▓ĮĻ│╝Ļ┤Ćņ░░ ņżæ ņłĀ Ēøä 7ņØ╝ņ¦Ė ņĢłņĢĢņØ┤ 41 mmHgļĪ£ ņĖĪņĀĢļÉśņŚłĻ│Ā ņĀäļ░®ņØĆ ņåīņŗżļÉśņŚłļŗż. ņ┤łņØīĒīīĻ▓Ćņé¼ ņāü ĒŖ╣ņØ┤ ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░ ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ņØśņŗ¼ļÉśņŚłņ£╝ļéś ĒŖ£ļĖī ļüØņØś Ļ░£ĒåĄņØ┤ ĒÖĢņØĖļÉśņ¦Ć ņĢŖĻ│Ā ļÅÖĻ│Ąņ░©ļŗ©ļģ╣ļé┤ņןņØś Ļ░ĆļŖźņä▒ņØä ļ░░ņĀ£ ĒĢśĻĖ░ ņ£äĒĢ┤ ņÜ░ņäĀņĀüņ£╝ļĪ£ ņóīņĢł ņĀäļ░®ņäĖņ▓ÖĻ│╝ ņłśņłĀņĀü ĒÖŹņ▒äņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņŗ£ ņĢłņĢĢņØĆ Cosopt┬« (Merck & Co, Inc., Kenilworth, NJ, USA), Alphagan┬« (Allergan Inc., Irvine, CA, USA), Travatan┬« (Alcon Inc., Camberley, UK)ņ£╝ļĪ£ ņĄ£ļīĆ ņĢĮļ¼╝ ņ╣śļŻīļź╝ ĒĢśļ®┤ņä£ 20 mmHg ņĀäĒøäļĪ£ ņ£Āņ¦ĆĻ░Ć ļÉśņŚłņ£╝ļ®░ ņĀäļ░®ņØĆ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗ś 1.5ļ░░ ņĀĢļÅäļĪ£ ņ¢ĢĻ▓ī ņ£Āņ¦ĆļÉśņŚłļŗż. ĒÖŹņ▒äņĀłņĀ£ņłĀ ņŗ£Ē¢ē ĒĢ£ ļŗ¼ Ēøä ņĢłņĢĢņØ┤ ļŗżņŗ£ 31 mmHgļĪ£ ņāüņŖ╣ĒĢśļ®░ ņżæņŗ¼ļČĆ ļ░Å ņŻ╝ļ│ĆļČĆ ņĀäļ░® ļ¬©ļæÉ ņåīņŗżļÉśņ¢┤ ņĢ×ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņĀäļ░® ļé┤ļĪ£ ĒāłņČ£ĒĢ£ Ēö╝ņ¦łĻ│╝ ņ£Āļ”¼ņ▓┤ļź╝ ņĀ£Ļ▒░ĒĢśņśĆļŗż. ļŗżņØīļéĀ ņĢłņĢĢņØĆ 12 mmHgļĪ£ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░ ņĀäļ░® Ļ╣ŖņØ┤ ļśÉĒĢ£ ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗ś 3ļ░░ļĪ£ ĒśĖņĀäļÉśņŚłļŗż. 1ļģä Ēøä, ņóīņĢł ņĄ£ņóģņŗ£ļĀźņØĆ Ļ┤æĻ░üņ£╝ļĪ£ ņĢłņĢĢņāüņŖ╣ņØĆ ņŚåņŚłĻ│Ā ņĀäļ░®ļÅä Ļ╣ŖĻ▓ī ņ£Āņ¦ĆļÉśņŚłļŗż.
ņĢģņä▒ļģ╣ļé┤ņןņØĆ ĻĖ░ņĪ┤ņŚÉ ņĀäļ░®Ļ░üĒÅÉņćäĻ░Ć ņ׳ļŖö ļłłņŚÉņä£ ļģ╣ļé┤ņן ņłśņłĀņØä ļ░øņØĆ Ēøä ņŻ╝ļĪ£ ļéśĒāĆļéśļ®░ 2-4%ņØś ļ╣łļÅäļź╝ ļ│┤ņØĖļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[6]. ĻĘĖļ¤¼ļéś ļĀłņØ┤ņĀĆņłśņłĀņØ┤ļéś ļŗżļźĖ ņĢłĻ│╝ņĀü ņłśņłĀņØä ļ░øņØĆ Ļ▓ĮņÜ░ņŚÉļÅä ļéśĒāĆļéĀ ņłś ņ׳ņ£╝ļ®░ ņØ┤ņĀäņŚÉ ņłśņłĀļ░øņ¦Ć ņĢŖņØĆ ļłłņŚÉņä£ļÅä ņÖĖņāü, ņŚ╝ņ”Ø, ņČĢļÅÖņĀ£ņØś ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ ņ£Āļ░£ļÉśĻ▒░ļéś ĒŖ╣ļ│äĒĢ£ ņøÉņØĖ ņŚåņØ┤ļÅä ļéśĒāĆļé£ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[7]. ņłśņłĀ Ēøä ļ░£ņāØĒĢśļŖö ņŗ£ĻĖ░ļŖö ņłśņŗ£Ļ░ä ļé┤ņŚÉņä£ ņłśļģä ļé┤ļĪ£ ļŗżņ¢æĒĢśļŗż[2]. ņĢģņä▒ļģ╣ļé┤ņןņØĆ ļ░£ņāØ ĻĖ░ņĀäņŚÉ ļö░ļØ╝ ņä¼ļ¬©ņ▓┤ņ░©ļŗ©ļģ╣ļé┤ņן(ciliary block glaucoma), ļ░®ņłśĒØÉļ”äņØ┤ņāüņ”ØĒøäĻĄ░(aqueous misdirection), ņä¼ļ¬©ņ▓┤ņłśņĀĢņ▓┤ ļģ╣ļé┤ņן(ciliolenticular glaucoma), ņä¼ļ¬©ņ£Āļ”¼ņ▓┤ņ░©ļŗ© ļģ╣ļé┤ņן(ciliovitreal block glaucoma) ļō▒ņØś ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņÜ®ņ¢┤ļĪ£ļÅä ļČłļ”¼ņÜ┤ļŗż[8]. ļ¼┤ņłśņĀĢņ▓┤ņĢł, ņØĖĻ│ĄņłśņĀĢņ▓┤ņĢł, ņłśņĀĢņ▓┤ņĢłņŚÉņä£ ļ¬©ļæÉ ļéśĒāĆļéĀ ņłś ņ׳ņ£╝ļ®░ ĻĖ░ņĀäņØĆ Ļ│ĄĒåĄņĀüņ£╝ļĪ£ ļ░®ņłśĻ░Ć ņĀĢņāüņĀüņØĖ ņ£ĀņČ£ Ļ▓ĮļĪ£ļź╝ ļö░ļØ╝Ļ░Ćņ¦Ć ņĢŖĻ│Ā ņ£Āļ”¼ņ▓┤ ņ¬Įņ£╝ļĪ£ ņŚŁļźśĒĢśļ®┤ņä£, Ēøäļ░® ņĢĢļĀźņØ┤ ņś¼ļØ╝Ļ░ĆĻ│Ā ņĢ×ņ£Āļ”¼ņ▓┤ļ®┤ņØ┤ ņĢ×ņ¬Įņ£╝ļĪ£ ņØ┤ļÅÖĒĢśņŚ¼ ņłśņĀĢņ▓┤ļéś ĒÖŹņ▒äļź╝ ņĀäļ░®ņ£╝ļĪ£ ļ░Ćņ¢┤ ņØ┤ņ░©ņĀüņØĖ ņĀäļ░®Ļ░üĒÅÉņćäļź╝ ņØ╝ņ£╝ĒéżļŖö Ļ▓āņØ┤ļŗż. ņØ┤ņŚÉ ļö░ļØ╝ ļ░®ņłśļŖö ņĀäļ░®ņ£╝ļĪ£ Ļ│äņåŹ ļ╣ĀņĀĖļéśĻ░Ćņ¦Ć ļ¬╗ĒĢśļŖö ņĢģņł£ĒÖśņØ┤ ļ░£ņāØĒĢśĻ▓ī ļÉśļ®░ ņĢłņĢĢņØ┤ ņāüņŖ╣ĒĢśĻ▓ī ļÉśļŖö Ļ▓āņØ┤ ņĢģņä▒ļģ╣ļé┤ņןņØś ĻĖ░ņĀäņ£╝ļĪ£ ņāØĻ░üļÉśĻ│Ā ņ׳ļŗż[9].
ņĢģņä▒ļģ╣ļé┤ņןņØś ņØ╝ņ░©ņĀü ņĢĮļ¼╝ņĀü ņ╣śļŻīļŖö ļ░®ņłśņāØņä▒ ņ¢ĄņĀ£ļź╝ ņ£äĒĢ£ ņĢłņĢĢĒĢśĻ░ĢņĀ£ņĀ£ņÖĆ ņ£Āļ”¼ņ▓┤ņÜ®ņĀüņØä ņżäņØ┤ļŖö Ļ│Āņé╝Ēł¼ņĢĢņĀ£ļź╝ ņé¼ņÜ®ĒĢśļ®░, ņä¼ļ¬©ņ▓┤ ņåīļīĆļź╝ ĻĖ┤ņןņŗ£ņ╝£ ļĀīņ”ł-ĒÖŹņ▒ä ĒÅēļ®┤ņØä Ēøäļ░®ņ£╝ļĪ£ ņØ┤ļÅÖņŗ£ņ╝£ ņä¼ļ¬©ņ▓┤-ļĀīņ”ł, ņä¼ļ¬©ņ▓┤-ņ£Āļ”¼ņ▓┤ ņ░©ļŗ©ņØä ĒĢ┤ņåīĒĢĀ ļ¬®ņĀüņ£╝ļĪ£ ņĪ░ņĀłļ¦łļ╣äņĀ£ļź╝ ņé¼ņÜ®ĒĢ£ļŗż. ļé┤Ļ│╝ņĀü ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ ņłśņłĀņĀü ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢśĻ▓ī ļÉśļ®░ ļ╣äņĀĢņāü ļ░®ņłśņØś ĒØÉļ”äņØś ņ░©ļŗ©ņØä ĒÆĆņ¢┤ņŻ╝ļŖö Ļ▓āņØä ļ¬®ņĀüņ£╝ļĪ£ ĒĢ£ļŗż. ļĀłņØ┤ņĀĆĒÖŹņ▒äņĀłĻ░£ņłĀņØĆ ļÅÖĻ│Ąņ░©ļŗ© ĻĖ░ņĀäņØś Ļ░Éļ│ä ļ░Å ĒĢ┤ņåīļź╝ ņ£äĒĢ┤ ņØ╝ņ░©ņĀüņ£╝ļĪ£ ņŗ£Ē¢ēļÉĀ ņłś ņ׳ņ£╝ļ®░ ņØ┤ņĀä ĒÖŹņ▒äņĀłĻ░£ ļČĆņ£äņØś Ļ░£ĒåĄņä▒ņØ┤ ņØśņŗ¼ļÉ£ļŗżļ®┤ ņŻ╝ļ│ĆļČĆ ĒÖŹņ▒äņĀłņĀ£ņłĀņØä ņŗżņŗ£ĒĢśņŚ¼ Ēøäļ░®ņŚÉņä£ ņĀäļ░®ņ£╝ļĪ£ņØś ĒåĄļĪ£ļź╝ ļ¦īļōżņ¢┤ņżä ņłś ņ׳ļŗż. ņ£Āļ”¼ņ▓┤ ļé┤ Ļ░ćĒ×ī ļ░®ņłśņØś ļ░░ņČ£ņØä ņ£äĒĢ┤ Ēøäļ░® Ļ│Ąļ¦ēņĀłĻ░£ņłĀ ļ░Å vitreous tapping, Nd:Yag ļĀłņØ┤ņĀĆ ĒøäļéŁņĀłĻ░£ņłĀ, ĒÅēļ®┤ļČĆ ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņĄ£ĻĘ╝ņŚÉļŖö ĒÅēļ®┤ļČĆ ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØ┤ ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņØĖĻ│ĄņłśņĀĢņ▓┤ ņĢłņŚÉņä£ļŖö ņĢ×ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀĻ│╝ ļÅÖļ░śĒĢ£ ĒÖŹņ▒äņĀłņĀ£ņłĀ-ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ-ņåīļīĆņĀłņĀ£ņłĀ(iridectomy-hyaloidotomy-zonulectomy) ļśÉĒĢ£ ļåÆņØĆ ņä▒Ļ│ĄļźĀņØä ļ│┤ņØĖļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[2,10].
ņĢģņä▒ļģ╣ļé┤ņןņØś ņ£äĒŚśņØĖņ×ÉļĪ£ļŖö ņøÉņŗ£, ņåīņĢłĻĄ¼, ņĀäļ░®Ļ░üĒÅÉņćäņØś ļ│æļĀź, Ļ│ĀņøÉĒÖŹņ▒ä, ņłĀ ņżæ ĻĖ░ņ╣©ņØ┤ļéś ņŖżĒŖĖļĀłņŖżļĪ£ ņØĖĒĢ┤ ĒśæņĪ░Ļ░Ć ņל ņĢłļÉśļŖö Ļ▓ĮņÜ░, ņŗ¼ĒĢ£ ļ░▒ļé┤ņן, Ļ▒░ņ¦ōļ╣äļŖśņ”ØĒøäĻĄ░, ņä¼ļ¬©ņ▓┤ņåīļīĆ ņĢĮĒÖö, ņłĀ Ēøä ņóüņØĆ ņĀäļ░®Ļ░ü ļō▒ņØ┤ ņ׳ļŗż[3,8]. ņĢäņŗ£ņĢäņØĖņŚÉņä£ ļŹö ĒØöĒĢśĻ▓ī ļ░£ņāØĒĢśļŖöļŹ░ ĻĘĖ ņØ┤ņ£ĀļĪ£ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ņ¦¦ņØĆ ņĢłņČĢņןĻ│╝ ĻĘĖļĪ£ ņØĖĒĢ┤ ņóüņØĆ ņĀäļ░®Ļ░üņØä Ļ░Ćņ¦ł ņåīņØĖņØ┤ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ņ£ĀņČöļÉśĻ│Ā ņ׳ļŗż[11]. ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ļ░£ļ│æĒĢśļŖö ĒÅēĻĘĀ ļéśņØ┤ļŖö 70ļīĆņØ┤ļ®░ ņŚ¼ņä▒ņØś ļ╣äņ£©ņØ┤ ļŹö ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[3,12]. ļģ╣ļé┤ņןņłśņłĀ ņżæņŚÉņä£ļŖö ņŗ¼ļČĆĻ│Ąļ¦ēņĀłņĀ£ņłĀ(deep sclerectomy), i-stent ļō▒ņØś ļ╣äĻ┤ĆĒåĄņłśņłĀ(nonpenetrating surgery)ņŚÉ ļ╣äĒĢ┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ, Ex-press shunt ņéĮņ×ģ Ļ░ÖņØĆ Ļ┤ĆĒåĄņłśņłĀ(penetrating surgery)ņØä ņŗ£Ē¢ēĒĢśņśĆņØä ļĢī 2.3%ņØś ĒÖśņ×ÉņŚÉņä£ ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ļéśĒāĆļéś ņ£äĒŚśņØĖņ×ÉļĪ£ ļ│╝ ņłś ņ׳ņ£╝ļ®░ ĒÖŹņ▒äĻ░üļ¦ēĻ░üņØ┤ ņóüņØäņłśļĪØ ņĢģņä▒ļģ╣ļé┤ņן ļ░£ņāØ ņ£äĒŚśņØ┤ 3ļ░░ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[3].
ņØ┤ņŚÉ ļ╣äĒĢ┤ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØĆ Ļ┤ĆĒåĄņłśņłĀņ×äņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ņłĀ Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö Ļ▓ĮņÜ░ļŖö ļō£ļ¼Ė Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░ ņ”ØļĪĆļ│┤Ļ│ĀļÅä ļō£ļ¼╝ļŗż. ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØä ņŗ£Ē¢ē ņŗ£ ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ļ░£ņāØĒĢ£ ņ”ØļĪĆļŖö ņØĖĻ│ĄņłśņĀĢņ▓┤ņĢłņŚÉņä£ 2ņśł, ļ░▒ļé┤ņןņłśņłĀĻ│╝ ļÅÖņŗ£ņŚÉ ņŗ£Ē¢ēĒĢ£ ņĢłņŚÉņä£ 1ņśł ļ│┤Ļ│ĀļÉśņŚłļŗż[4,5,13]. ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņןĻĖ░ Ļ▓░Ļ│╝ļź╝ ņČöņĀüĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĢģņä▒ļģ╣ļé┤ņןņØ┤ļéś ļ░®ņłśņØ┤ņāüĒØÉļ”äņ”ØĒøäĻĄ░ņØ┤ ĒżĒĢ©ļÉ£ Ļ▓ĮņÜ░ļŖö ļō£ļ¼╝ņ¢┤ ļīĆļץņĀüņØĖ ļ╣łļÅäļź╝ ņĢīĻĖ░ ņ¢┤ļĀżņÜ░ļéś, Wishart et al [14]ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ╝ņŗ£ņĀü ĒŖ£ļĖī Ļ▓░ņ░░Ļ│╝ Ļ░ĆņŖżļź╝ ņ▒äņÜ┤ ĻĘĖļŻ╣ņØĆ 51ņĢł ņżæ 4ņĢłņŚÉņä£ ļ░®ņłśņØ┤ņāüĒØÉļ”äņ”ØĒøäĻĄ░ņØ┤ ļéśĒāĆļé¼Ļ│Ā, ĒŖ£ļĖī Ļ▓░ņ░░Ļ│╝ Ļ░ĆņŖż ņé¼ņÜ®ņØ┤ ņŚåņŚłļŹś ĻĘĖļŻ╣ņŚÉņä£ļŖö 36ņłśņĀĢņ▓┤ņĢł ņżæ 1ņĢłņŚÉņä£ ļ░®ņłśņØ┤ņāüĒØÉļ”äņ”ØĒøäĻĄ░ņØ┤ ļéśĒāĆļé¼ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņĢ×ņäĀ ņ”ØļĪĆļōżņŚÉņä£ ņĢģņä▒ļģ╣ļé┤ņןņØś ņ╣śļŻīļŖö ņŻ╝ļ│ĆļČĆĒÖŹņ▒äņĀłņĀ£ņłĀĻ│╝ ĒĢ©Ļ╗ś ĒÅēļ®┤ļČĆ ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ ļśÉļŖö ņĢ×ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀĻ│╝ ņ£Āļ”¼ņ▓┤-ņåīļīĆņĀłņĀ£ņłĀ (hyaloido-zonulectomy)ņØä ĒåĄĒĢ┤ ņØ┤ļŻ©ņ¢┤ņĪīļŗż. ĻĘĖļ¤¼ļéś Baerveldt ļ░®ņłś ņ£ĀņČ£ ņןņ╣śņØś Ļ▓ĮņÜ░ņŚÉļŖö ļŗ©ļÅģņ£╝ļĪ£ ņéĮņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņØä ļĢī ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀĻ│╝ Ļ▓░Ļ│╝ļź╝ ļ╣äĻĄÉĒĢ£ the tube versus trabeculectomy (TVT) studyņŚÉņä£ ņ┤łĻĖ░ ņłĀ Ēøä ĒĢ®ļ│æņ”ØņŚÉņä£ ņĢģņä▒ļģ╣ļé┤ņןņØś ļ╣łļÅäĻ░Ć Ļ░üĻ░ü 3%, 1%ļĪ£ ļŹö ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[15]. Ļ░ÖņØĆ ļ░®ņłś ņ£ĀņČ£ ņןņ╣śņØ┤ļéś ņĢäļ®öļō£ņןņ╣śļŖö ļ░ĖļĖīļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ņāüļīĆņĀüņ£╝ļĪ£ ļ░ĖļĖīĻ░Ć ņŚåļŖö Baerveldtļéś ļŗżļźĖ ļģ╣ļé┤ņן ņłśņłĀņŚÉ ļ╣äĒĢ┤ ņłĀ Ēøä ĻĖēĻ▓®ĒĢ£ ņĀĆņĢłņĢĢ, ņóüņØĆ ņĀäļ░®Ļ░üņØ┤ ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░Ļ░Ć ļŹö ņĀüļŗżĻ│Ā ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░[16], ņØ┤ļ¤¼ĒĢ£ ļČĆļČäņŚÉ ņØśĒĢ┤ ņłĀ Ēøä ļ¬©ņ¢æņ▓┤ņÖĆ ņłśņĀĢņ▓┤ņØś ņĀæņ┤ēņØś Ļ░ĆļŖźņä▒ņØ┤ ļé«ņĢä ņĢģņä▒ļģ╣ļé┤ņןņØś ņ£äĒŚśņØĖņ×Éļź╝ Ļ░Éņåīņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż.
ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ ļŗ©ļÅģņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņłĀ Ēøä ļ░£ņāØĒĢ£ ņĢģņä▒ļģ╣ļé┤ņן 2ņśłļź╝ Ļ▓ĮĒŚśĒĢśņśĆļŗż. ļæÉ ņ”ØļĪĆ ļ¬©ļæÉ Ļ│ĀļĀ╣ņØś ņŚ¼ņä▒ņØ┤ņŚłĻ│Ā, ņĢłņČĢņןņØ┤ ņ¦¦ņĢśņ£╝ļ®░ ĒĢ£ ņ”ØļĪĆļŖö Ļ▒░ņ¦ōļ╣äļŖśņ”ØĒøäĻĄ░ļĪ£ ņØĖĒĢ£ ņä¼ļ¬©ņ▓┤ņåīļīĆĒĢ┤ļ”¼ņÖĆ ņ£Āļ”¼ņ▓┤ĒāłņČ£ņØś ņ£äĒŚśņØĖņ×Éļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłļŗż. Ļ│ĀļĀ╣Ļ│╝ Ļ▒░ņ¦ōļ╣äļŖśļģ╣ļé┤ņןņØĆ Ļ│ĄĒåĄņĀüņ£╝ļĪ£ ņä¼ļ¬©ņ▓┤ņåīļīĆņØś ņĢĮĒÖöļź╝ Ļ░ĆņĀĖņś¼ ņłś ņ׳Ļ│Ā ņ¦¦ņØĆ ņĢłņČĢņןņ£╝ļĪ£ ņłĀ Ēøä ļ¬©ņ¢æņ▓┤ņ£Āļ”¼ņ▓┤ ņ░©ļŗ©ņØ┤ ļ│┤ļŗż ņēĮĻ▓ī ņØ╝ņ¢┤ļéś ņĢģņä▒ļģ╣ļé┤ņןņ£╝ļĪ£ ņ¦äĒ¢ēĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ļ│Ė ņ”ØļĪĆĻ░ÖņØ┤ ņĢģņä▒ļģ╣ ļé┤ņןņØś ņŚ¼ļ¤¼ ņ£äĒŚśņØĖņ×ÉĻ░Ć Ļ│ĄņĪ┤ĒĢśļŖö Ļ▓ĮņÜ░ņŚÉļŖö ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņŚÉņä£ ļō£ļ¼╝Ļ▓ī ļ░£ņāØĒĢśļŖö ĒĢ®ļ│æņ”ØņØĖ ņĢģņä▒ļģ╣ļé┤ņןņØś Ļ░ĆļŖźņä▒ņØä ņŚ╝ļæÉņŚÉ ļæÉņ¢┤ ņłśņłĀ Ēøä ĻĖēĻ▓®ĒĢ£ ņĢłņĢĢĒĢśĻ░ĢņØ┤ ņØ╝ņ¢┤ļéśņ¦Ć ņĢŖĻ▓ī ĒŖ£ļĖīņØś ļ¦żļōŁ ļō▒ņØä ņĪ░ņĀłĒĢ┤ņĢ╝ ĒĢśļ®░ ņłĀ Ēøä ņĀäļ░®ņØś ļ│ĆĒÖöļź╝ ņŻ╝ņØś Ļ╣ŖĻ▓ī ņé┤ĒÄ┤ņĢ╝ ĒĢ£ļŗż. ĻĘĖļ”¼Ļ│Ā ņĢłņĢĢĒĢśĻ░ĢņĀ£ņÖĆ ņĪ░ņĀłļ¦łļ╣äņĀ£ļĪ£ ņ”ēņŗ£ ņĢĮļ¼╝ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢśļ®░ ĒÜ©Ļ│╝Ļ░Ć ņŚåņØä ņŗ£, ņĪ░ĻĖ░ņŚÉ ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ ļō▒ņØś ņłśņłĀņĀü ņ╣śļŻīļ▓ĢņØä Ļ│ĀļĀżĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż. ņĢģņä▒ļģ╣ļé┤ņןņ£╝ļĪ£ ņĀäļ░®ņØ┤ ņåīņŗżļÉśļŖö Ļ│╝ņĀĢĻ│╝ ņØ┤ņ░©ņĀüņØĖ ņłśņłĀņØä Ļ▒░ņ╣śļ®┤ņä£ ņČöĒøä Ļ░üļ¦ēļČĆņĀäņØś ņ£äĒŚśņä▒ņØ┤ ņ╗żņ¦ĆļŖöļŹ░, ņ”ØļĪĆ 1ņŚÉņä£ņ▓śļ¤╝ ņä¼ļ¬©ņ▓┤ĒÅēļ®┤ļČĆļź╝ ĒåĄĒĢ┤ ĒŖ£ļĖīņ×¼ņ£äņ╣śņłĀņØä ņŗ£Ē¢ēĒĢśļŖö Ļ▓āļÅä ņןĻĖ░ņĀüņ£╝ļĪ£ Ļ░üļ¦ēļé┤Ēö╝ņäĖĒżļ░ĆļÅä Ļ░Éņåīļź╝ ņĄ£ņåīĒÖöĒĢĀ ņłś ņ׳ļŖö ļ░®ļ▓ĢņØ┤ ļÉĀ ņłś ņ׳ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņĢģņä▒ļģ╣ļé┤ņןņØ┤ ņāØĻĖ░ļŖö Ļ▓ĮņÜ░ļŖö ļ╣äĻĄÉņĀü ļō£ļ¼╝ļŗż. ĒĢśņ¦Ćļ¦ī ņĢłņČĢņןņØ┤ ņ¦¦Ļ▒░ļéś, ņä¼ļ¬©ņ▓┤ņåīļīĆĻ░Ć ņĢĮĒĢśĻ▒░ļéś, Ļ│ĀļĀ╣ Ēś╣ņØĆ ņŚ¼ņä▒ ļō▒ ņ£äĒŚśņÜöņåīļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö Ļ▓ĮņÜ░ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀ Ēøä ņĢģņä▒ļģ╣ļé┤ņן ļ░£ņāØ Ļ░ĆļŖźņä▒ņØ┤ ļåÆņĢäņ¦ł ņłś ņ׳ņ¢┤ ņŻ╝ņØśļź╝ ņÜöĒĢ£ļŗż.
Figure┬Ā1.
Intraoperative images of surgical iridectomy. (A) Iris blocking the tube tip was removed by large surgical iridectomy and (B) the tube tip was repositioned into the anterior chamber through iridectomy site.
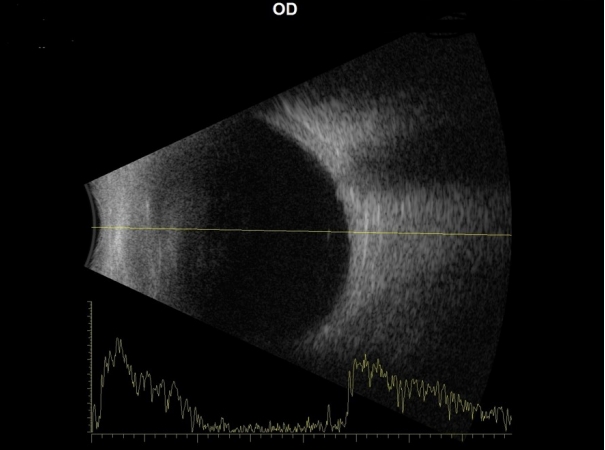
Figure┬Ā2.
Ocular ultrasonography. There were no signs of suprachoroidal hemorrhage or choroidal effusion present in posterior part of eye. OD = oculus dexter.
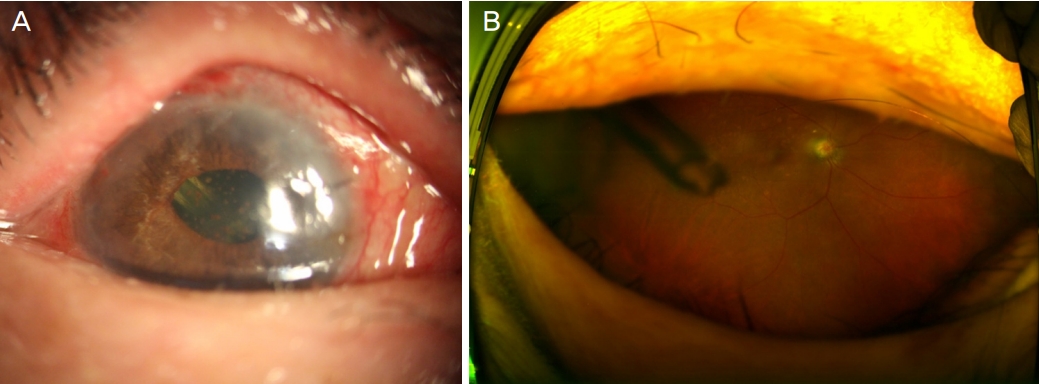
Figure┬Ā3.
Right eye 5 months after tube reposition into the vitreous cavity through pars plana. Tube tip was repositioned to avoid corneal decompensation. Slit lamp examination (A) showed clear cornea with deep anterior chamber, and ultra-widefield fundus photograph (B) showed tube position and patency.
REFERENCES
1) von Graefe A. Beltrage zur patholoogie and therapie des glaucomas. Albrecht von Graefe. Arch Ophthalmol 1869;15:article 108.
2) Foreman-Larkin J, Netland PA, Salim S. Clinical management of malignant glaucoma. J Ophthalmol 2015;2015:283707.




3) Krix-Jachym K, ┼╗arnowski T, R─Ökas M. Risk factors of malignant glaucoma occurrence after glaucoma surgery. J Ophthalmol 2017;2017:9616738.




4) Lee SY, Bae HW, Kim CY. Evaluating anterior segment structure using anterior segment optical coherence tomography in malignant glaucoma after Ahmed valve implantation. Med case rep study protoc 2020;1:e0006.

5) Mart├Łnez-de-la-Casa JM, Garc├Ła-Feijo├│ J, Castillo A, et al. Malignant glaucoma following combined Ahmed valve implant and phacoemulsification surgery for chronic angle-closure glaucoma. Arch Soc Esp Oftalmol 2005;80:667-70.

6) Byrnes GA, Leen MM, Wong TP, Benson WE. Vitrectomy for ciliary block (malignant) glaucoma. Ophthalmology 1995;102:1308-11.


7) Schwartz AL, Anderson DR. Malignant glaucoma" in an eye with no antecedent operation or miotics. Arch Ophthalmol 1975;93:379-81.


8) Grzybowski A, Kanclerz P. Acute and chronic fluid misdirection syndrome: pathophysiology and treatment. Graefes Arch Clin Exp Ophthalmol 2018;256:135-54.




9) Balekudaru S, Choudhari NS, Rewri P, et al. Surgical management of malignant glaucoma: a retrospective analysis of fifty eight eyes. Eye (Lond) 2017;31:947-55.




11) Varma DK, Belovay GW, Tam DY, Ahmed II. Malignant glaucoma after cataract surgery. J Cataract Refract Surg 2014;40:1843-9.


12) Dave P, Senthil S, Rao HL, Garudadri CS. Treatment outcomes in malignant glaucoma. Ophthalmology 2013;120:984-90.


13) Bitrian E, Caprioli J. Pars plana anterior vitrectomy, hyaloido-zonulectomy, and iridectomy for aqueous humor misdirection. Am J Ophthalmol 2010 150:82-7. e1.


14) Wishart PK, Choudhary A, Wong D. Ahmed glaucoma valves in refractory glaucoma: a 7-year audit. Br J Ophthalmol 2010;94:1174-9.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,663 View
- 77 Download
- Related articles
-
Two Cases of Cataract after COVID-19 mRNA Vaccine Injection2022 December;63(12)
Surgical Treatment for Tube Erosion after Ahmed Valve Implantation.2016 March;57(3)
A Case of Malignant Glaucoma in a Vitrectomized Eye.2015 April;56(4)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



