 |
 |
| J Korean Ophthalmol Soc > Volume 63(5); 2022 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņżæļō▒ļÅäņÖĆ ņé¼ņāüĒīÉ Ļ╣ŖņØ┤ņÖĆņØś ņāüĻ┤Ćņä▒ņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
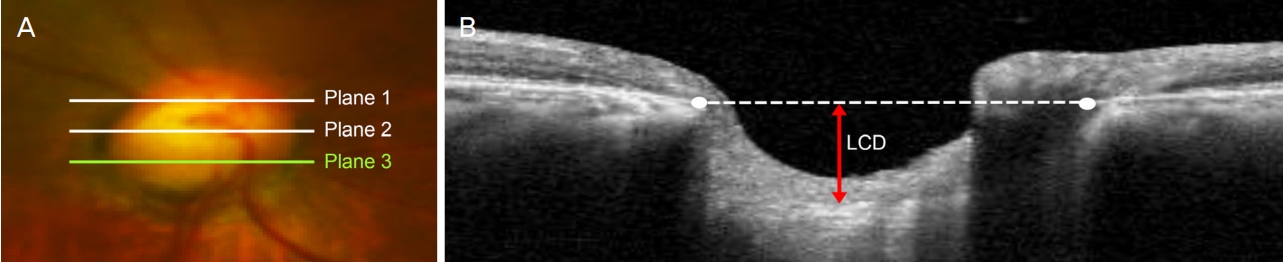
ņåÉņāü ņĀĢļÅäĻ░Ć ļŗżļźĖ ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņ¢æņĢłņØś optic nerve head (ONH) horizontal B-scan ņśüņāüņØä ņ¢╗ņŚłļŗż. ONHņØś ņłśņ¦ü Ļ▒░ļ”¼Ļ░Ć ļÅÖņØ╝ĒĢ£ 3Ļ░£ņØś ņ£äņ╣śņŚÉņä£ ņé¼ņāüĒīÉ Ļ╣ŖņØ┤ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņŗ£ņĢ╝Ļ▓░ņåÉ ņżæļō▒ļÅäņŚÉ ļö░ļØ╝ Ļ▓░ņåÉņØ┤ ņŗ¼ĒĢ£ ļłł ĻĄ░Ļ│╝ Ļ▓░ņåÉņØ┤ Ļ▓ĮĒĢ£ ļłł ĻĄ░ņ£╝ļĪ£ ļéśļłäņ¢┤ ļæÉ ĻĄ░ņØś LCDļź╝ ļ╣äĻĄÉ ļČäņäØĒĢśņśĆļŗż. ņĪ░Ļ▒┤ļČĆ ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļģ╣ļé┤ņן ņśłĒøäņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×Éļź╝ ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ĒÖśņ×É 52ļ¬ģ, ņ┤Ø 104ņĢłņØ┤ ĒżĒĢ©ļÉśņŚłļŗż. ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 66.0 ┬▒ 15.0ņäĖņśĆĻ│Ā, ļé©ņ×É 31ļ¬ģ, ņŚ¼ņ×É 21ļ¬ģņØ┤ņŚłļŗż. ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņŗ¼ĒĢ£ ļłłņØĆ ļ░śļīĆ ļłłļ│┤ļŗż, ĻĖ░ņĀĆņĢłņĢĢņØ┤ ļåÆĻ│Ā(p’╝£0.001), ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śĻ░Ć ņ¢ćĻ│Ā(p’╝£0.001), ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś mean deviation Ļ░ÆņØ┤ ļé«Ļ│Ā(p’╝£0.001), pattern standard deviationņØ┤ ņ╗Ėļŗż(p’╝£0.001). ņ¢æņĢłņØś ĻĄ¼ļ®┤ļīĆņØæņłśņ╣ś ļ░Å ņĢłņČĢņן ĻĖĖņØ┤ņØś ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļéś, ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņŗ¼ĒĢ£ ļłłņØś ņé¼ņāüĒīÉ Ļ╣ŖņØ┤Ļ░Ć ļ░śļīĆ ļłłļ│┤ļŗż ņ╗Ėļŗż(529.4 ┬▒ 116.7 vs. 482.9 ┬▒ 107.5 ╬╝m, p’╝£0.001). ņĪ░Ļ▒┤ļČĆ ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØņŚÉņä£ ĻĖ░ņĀĆņĢłņĢĢņØ┤ ļåÆņØäņłśļĪØ (p=0.006), LCDĻ░Ć Ēü┤ņłśļĪØ(p=0.003) ļģ╣ļé┤ņןņØ┤ ņŗ¼ĒĢĀ ņ£äĒŚśņØ┤ ļåÆņĢśļŗż.
ABSTRACT
Purpose
To evaluate the association between lamina cribrosa depth (LCD) and the severity of glaucomatous damage in patients with normal-tension glaucoma (NTG).
Methods
The optic nerve heads (ONHs) of patients with bilateral NTG showing asymmetrical damage were scanned using spectral-domain optical coherence tomography. LCDs were measured on ONH horizontal B-scan images at three locations equidistant across the vertical optic disc diameter and compared between the more damaged and contralateral eyes. Conditional logistic regression analysis was performed to identify ocular risk factors associated with more severe damage between the eyes.
Results
One hundred and four eyes of 52 patients with bilateral NTG were included. The mean age was 66.0 ┬▒ 15.0 years; there were 31 males and 21 females. The more damaged eyes exhibited a higher baseline intraocular pressure (IOP) (p < 0.001), a thinner global retinal nerve fiber layer thickness (p < 0.001), and worse visual field mean deviation (p < 0.001) and a pattern standard deviation (p < 0.001), than the contralateral eyes. In contrast, we found no significant inter-eye difference in either the spherical equivalent or the axial length. The average LCD was significantly larger in the more damaged eyes (529.4 ┬▒ 116.7 vs. 482.9 ┬▒ 107.5 ╬╝m, p < 0.001). On conditional logistic regression analysis, the higher the baseline IOP (p = 0.006) and the larger the LCD (p = 0.003), the higher the risk of having more severe damage compared to the contralateral eye under similar systemic conditions.
ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØĆ ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņØ┤ļ®┤ņä£ ļģ╣ļé┤ņןņØś ĒŖ╣ņ¦ĢņĀüņØĖ ņ¦äĒ¢ēņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ ĻĘĖņŚÉ ļö░ļźĖ ņŗ£ņĢ╝ Ļ▓░ņåÉņØä ļ│┤ņØ┤ļŖö ņ¦łĒÖśņØ┤ļŗż[1,2]. Ļ│ĀņĢłņĢĢļģ╣ļé┤ņןĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ļŖö ņĢłņĢĢĻ│╝ Ļ┤ĆļĀ©ļÉ£ ĻĖ░Ļ│äņĀüņØĖ ņåÉņāüļ│┤ļŗżļŖö ĒśłņĢĢ, ņ×ÉĻ░Ćļ®┤ņŚŁ, ņāØņ▓┤ņŚŁĒĢÖņÜöņØĖ(biomechanical factor) ļō▒ņØś ņĀäņŗĀ ņØĖņ×ÉļōżņØ┤ ņŗ£ņŗĀĻ▓Į ņåÉņāüņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņĀ£ĻĖ░ļÉśņ¢┤ ņÖöļŗż[3,4]. ĒĢśņ¦Ćļ¦ī ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä ņĢłņĢĢņØ┤ ļåÆņØäņłśļĪØ ļģ╣ļé┤ņןņØś ļ░£ļ│æ ņ£äĒŚśņØ┤ ļåÆĻ│Ā[5], ņĢłņĢĢĒĢśĻ░Ģ ņ╣śļŻīĻ░Ć ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņ¦äĒ¢ē ņ£äĒŚśņØä ļé«ņČöĻĖ░ ļĢīļ¼ĖņŚÉ[6], ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ļÅä ņĢłņĢĢĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņé¼ņāüĒīÉņØś ĻĖ░Ļ│äņĀüņØĖ ņåÉņāü ļ░Å ļ│ĆĒśĢņØ┤ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ļ│æĒā£ņāØļ”¼ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[4,5].
ņé¼ņāüĒīÉņØĆ Ēæ£ņĖĄņŗĀĻ▓Įņä¼ņ£ĀņĖĄ, ņé¼ņāüĒīÉņĀäņĖĄĻ│╝ ĒĢ©Ļ╗ś ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļź╝ ņØ┤ļŻ©ļŖö ĻĘĖļ¼╝ļ¬©ņ¢æņØś ĻĄÉņøÉņ¦ł ĒīÉņ£╝ļĪ£, ļ¦Øļ¦ē ņŗĀĻ▓ĮņĀł ņäĖĒż(retinal ganglion cell, RGC)ņØś ņČĢņéŁ(axon)ņØ┤ ĒåĄĻ│╝ĒĢśļŖö ĻĄ¼ņĪ░ļ¼╝ņØ┤ļŗż. ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØĆ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[7-9]. ņé¼ņāüĒīÉĻ▓Įņ£ĀņĢĢļĀźņ░©(trans-lamina cribrosa pressure difference = intraocular pressure - intracranial pressure) ļ░Å ņé¼ņāüĒīÉņØś Ēāäņä▒ ĒŖ╣ņä▒(elastoplastic property of lamina cribrosa)ņŚÉ ņØśĒĢ┤ Ļ▓░ņĀĢļÉśļŖö ņé¼ņāüĒīÉņØś ĒśĢĒā£ļŖö[10] ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņĀĢņāüņØĖĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ Ļ╣Ŗņ¢┤ņ¦äļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[11]. ņØ┤ļ¤¼ĒĢ£ ņé¼ņāüĒīÉņØś Ļ╣Ŗņ¢┤ņ¦ÉņØĆ ņé¼ņāüĒīÉņØä ņ¦ĆļéśļŖö RGC axonņØś axonal transportļź╝ ņĀĆĒĢ┤ņŗ£ĒéżĻ│Ā, ņä▒ņāüĻĄÉņäĖĒżņŚÉ ņØśĒĢ£ Ļ▓░ĒĢ®ņĪ░ņ¦üņØś ļ│ĆĒśĢ ļō▒ņØś Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ RGCņØś ņåÉņāüņØä ņ┤ēņ¦äņŗ£Ēé┤[12]Ļ│╝ ļÅÖņŗ£ņŚÉ ņé¼ņāüĒīÉ ļé┤ņØś ļ¬©ņäĖĒśłĻ┤ĆņŚÉņä£ ņØĖņĀæĒĢ£ RGC axonņ£╝ļĪ£ņØś ņśüņ¢æļČä ĒÖĢņé░ņØä ļ░®ĒĢ┤ĒĢ©ņ£╝ļĪ£ņŹ©, ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØä ņ£Āļ░£ĒĢśĻ│Ā ņ¦äĒ¢ēņØä ņ┤ēņ¦äņŗ£Ēé¼ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[7].
Enhanced depth imaging (EDI) ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ņŖżĒÄÖĒŖĖļ¤╝ ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü(spectral domain optical coherence tomography, SD-OCT)ņØś ļ░£ļŗ¼ļĪ£ ņé¼ņāüĒīÉ ņĪ░ņ¦üņØś ņäĖļ░ĆĒĢ£ ņśüņāüņØä ņ¢╗ņØä ņłś ņ׳Ļ▓ī ļÉśņ¢┤ ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņé¼ņāüĒīÉņØś ļ»ĖņäĖ ĻĄ¼ņĪ░ņÖĆ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ņØś Ļ┤ĆļĀ©ņä▒ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć Ļ░ĆļŖźĒĢ┤ņĪīļŗż. Ļ│ĀņĢłņĢĢļģ╣ļé┤ņן ļ┐Éļ¦ī ņĢäļŗłļØ╝, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä ņĀĢņāüņØĖĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņé¼ņāüĒīÉņØ┤ Ļ╣ŖĻ│Ā[11], ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ ļģ╣ļé┤ņןņØś ļ░£ņāØĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ¢┤, ņ╣śļŻī ņĀä ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņØĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä ņé¼ņāüĒīÉņØś ĒśĢĒā£ĒĢÖņĀü ļ│ĆĒśĢņØ┤ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ļ│æĒā£ņāØļ”¼ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ×äņØ┤ ņĀ£ĻĖ░ļÉśņŚłļŗż[5]. ĒĢśņ¦Ćļ¦ī Ēśäņ×¼Ļ╣īņ¦Ć ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņé¼ņāüĒīÉņØś ĒśĢĒā£ņÖĆ ļģ╣ļé┤ņן ņżæļō▒ļÅäņÖĆņØś ņāüĻ┤Ćņä▒ņØä ĒÖĢņØĖĒĢ£ ņŚ░ĻĄ¼ļŖö ņŚåņŚłļŗż.
Ļ│ĀņĢłņĢĢļģ╣ļé┤ņןĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņŗ£ņŗĀĻ▓Į ņåÉņāüņŚÉļŖö ņĀäņŗĀ ĒśłņĢĢ(ĒŖ╣Ē׳, ņĢ╝Ļ░ä ņĀĆĒśłņĢĢ) ļō▒ņØś ņĀäņŗĀ ņ£äĒŚśņØĖņ×ÉĻ░Ć ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[13,14]. ļśÉĒĢ£ ļ╣äņŖĘĒĢ£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØä Ļ░Ćņ¦ä ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä ņé¼ņāüĒīÉņØś ļ│ĆĒśĢ ņĀĢļÅä ļ░Å ņĀäņŗĀ ņØĖņ×ÉņØś ĒŖ╣ņä▒ņØ┤ ļŗżļź┤ļŗż[15]. ņØ┤ļ¤¼ĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ Ļ│ĀļĀżĒĢĀ ļĢī, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņĢłņØĖņ×É ļČäņäØņŚÉņä£ļŖö ĒÖśņ×É Ļ░£ļ│äņØś ĒŖ╣ņä▒ ļ░Å ņĀäņŗĀ ņ£äĒŚśņØĖņ×ÉņØś ļ│┤ņĀĢņØ┤ ņżæņÜöĒĢśņ¦Ćļ¦ī, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØś Ļ░£ņØĖĻ░ä ļ╣äĻĄÉ ņŚ░ĻĄ¼ņŚÉņä£ ņØ┤ļ¤¼ĒĢ£ ņĀäņŗĀ ņØĖņ×É ļ│┤ņĀĢņØĆ ĒśäņŗżņĀüņ£╝ļĪ£ ņĀ£ĒĢ£ņĀüņØ╝ ņłśļ░¢ņŚÉ ņŚåļŗż. ņØ┤ļ¤¼ĒĢ£ ņĖĪļ®┤ņŚÉņä£ ņ¢æņĢłņØś ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņĀĢļÅäĻ░Ć ļŗżļźĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ Ļ░£ņØĖ ļé┤ ņ¢æņĢł ļ╣äĻĄÉļź╝ ĒåĄĒĢ┤ ļģ╣ļé┤ņןņØś ņżæļō▒ļÅäņÖĆ Ļ┤ĆļĀ©ļÉ£ ņĢłņØĖņ×Éļź╝ ļ╣äĻĄÉ ļČäņäØ ĒĢśļŖö Ļ▓āņØĆ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ│æņØĖĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņĀäņŗĀ ņØĖņ×ÉĻ░Ć ļ│┤ņĀĢļÉśļŖö ņĖĪļ®┤ņŚÉņä£ ņןņĀÉņØ┤ ņ׳ļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ļŖö ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņĀĢļÅäĻ░Ć ļŗżļźĖ ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņ¢æņĢłņØś ņé¼ņāüĒīÉ Ļ╣ŖņØ┤(lamina cribrosa depth, LCD)ļź╝ ļ╣äĻĄÉĒĢśĻ│Ā, ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņĀĢļÅäņÖĆ LCDņÖĆņØś ņŚ░Ļ┤Ćņä▒ņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
2021ļģä 9ņøöļČĆĒä░ 2022ļģä 2ņøöĻ╣īņ¦Ć ļ│ĖņøÉ ņĢłĻ│╝ņŚÉ ļé┤ņøÉĒĢ£ ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×É ņżæņŚÉ, ņ¢æņĢłņØś ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņżæļō▒ļÅäĻ░Ć ļŗżļźĖ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ SD-OCTļź╝ ņØ┤ņÜ®ĒĢ£ horizontal optic nerve head (ONH) B-scan ļ░Å ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö Ļ░ĢņøÉļīĆĒĢÖĻĄÉ ņŚ░ĻĄ¼ņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board, IRB)ļĪ£ļČĆĒä░ ņŖ╣ņØĖ ļ▓łĒśĖ 2021-11-005ļĪ£ ņŗ¼ņØś ņŖ╣ņØĖņØä ļ░øņĢśņ£╝ļ®░, ĒŚ¼ņŗ▒ĒéżņäĀņ¢Ė(Declaration of Helsinki)ņŚÉ ņØśĻ▒░ĒĢśņŚ¼ ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØĆ ņĢłņĢĢņØ┤ 21 mmHg ņØ┤ĒĢśņØ┤ļ®┤ņä£ ņĀäļ░®Ļ░üņØĆ ņŚ┤ļĀż ņ׳Ļ│Ā, ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ ņØ┤ņŚÉ ļö░ļźĖ ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ļģ╣ļé┤ņןņØś ņżæņ”ØļÅäļŖö ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś mean deviation (MD)Ļ░ÆņØä ĻĖ░ņżĆņ£╝ļĪ£, 1) ņ┤łĻĖ░(MD > -6 dB), 2) ņżæĻĖ░(-6 dB Ōēź MD Ōēź -12 dB), 3) ļ¦ÉĻĖ░(MD < -12 dB)ņØś ņäĖ ļŗ©Ļ│äļĪ£ ņĀĢņØśĒĢśņśĆļŗż[16-18]. ņ¢æņĢłņØś ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×É ņżæ ņ¢æņĢł ņŗ£ņĢ╝Ļ▓░ņåÉņØś ņżæļō▒ļÅäĻ░Ć ņä£ļĪ£ ļŗżļź┤ļ®┤ņä£ ņ¢æņĢłņØś MD ņ░©ņØ┤Ļ░Ć 3 ņØ┤ņāüņØĖ ĒÖśņ×ÉļōżņØä ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ņŗ£ņ╝░ļŗż[19].
ņŗ£ņĢ╝Ļ▓Ćņé¼ļŖö ĒŚśĒöäļ”¼ ņ×ÉļÅÖņŗ£ņĢ╝Ļ│ä(Humphrey┬« visual field analyzer 740i, Carl Zeiss Meditec Inc., Dublin, CA, USA)ņØś Central 24-2 SITA-standard strategyļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļæÉ ļ▓ł ņØ┤ņāü ņŗ£Ē¢ēĒĢśņśĆļŗż. Ļ░Ćņ¢æņä▒ 15%, Ļ░ĆņØīņä▒ 15%, ņŻ╝ņŗ£ ņāüņŗż 20%ļź╝ ņ┤łĻ│╝ĒĢśļŖö Ļ▓ĮņÜ░ ĒĢ┤ļŗ╣ ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś Ļ▓░Ļ│╝ļŖö ļČäņäØņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļģ╣ļé┤ņןņä▒ ņŗ£ņĢ╝ Ļ▓░ņåÉņØĆ 1) pattern deviation plotņŚÉņä£ ĻČüņāü ņśüņŚŁņŚÉ ņ׳ļŖö 3Ļ░£ ņØ┤ņāüņØś ņĀÉņØś ņŚŁņ╣ś(mean sensitivity)Ļ░Ć ņĀĢņāüņØś 5% ļ»Ėļ¦īņ£╝ļĪ£ ļéśĒāĆļéśĻ│Ā ĻĘĖņżæ ĒĢ£ ņĀÉņØ┤ 1% ļ»Ėļ¦īņØ╝ ļĢī, ļśÉļŖö 2) glaucoma hemifield testņŚÉņä£ outside normal limitsĻ░Ć ļæÉ ļ▓ł ņŚ░ņåŹņ£╝ļĪ£ ļéśĒāĆļéĀ ļĢī, ļśÉļŖö 3) corrected pattern standard deviation (PSD)ņØ┤ ņĀĢņāüņØś 5% ļ»Ėļ¦īņ£╝ļĪ£ ļéśĒāĆļéĀ ļĢīļĪ£ ņĀĢņØśĒĢśņśĆļŗż[20-22]. ņĢłņĢĢņØ┤ 21 mmHgļ│┤ļŗż ļåÆĻ▒░ļéś, ĒÅÉņćäĻ░üļģ╣ļé┤ņן ļ░Å ņØ┤ņ░©ļģ╣ļé┤ņן, ņŗ£ņŗĀĻ▓ĮņŚ╝ņØ┤ļéś ĻĖ░ĒāĆ ļ╣äļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Įļ│æņ”Ø, ņŗ£ņĢ╝ ņØ┤ņāüņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ļŖö ļŗżļźĖ ļ│æļ│ĆņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ņĢłņĢĢ ņĖĪņĀĢņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö Ļ░üļ¦ēņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż.
ĻĖ░ņĀĆņĢłņĢĢņØĆ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśĻĖ░ ņĀäņØś ņĢłņĢĢņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ņ┤łņ¦ä ņŗ£ ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŖö ĒÖśņ×ÉņØś Ļ▓ĮņÜ░, ņåīĻ▓¼ņä£ ņāü ņĢĮļ¼╝ņ╣śļŻī ņĀä ņĢłņĢĢņØ┤ ļ¬ģņŗ£ļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ļ¦īņØä ļČäņäØņŚÉ ĒżĒĢ©ĒĢśņśĆļŗż[23]. OCT Ļ▓Ćņé¼ ņŗ£ ņĢłņĢĢņØĆ SD-OCTļź╝ ņØ┤ņÜ®ĒĢ£ horizontal ONH B-scanņØä ņŗ£Ē¢ēĒĢśļŖö ļéĀĻ│╝ ļÅÖņØ╝ĒĢ£ ļéĀņŚÉ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
LCDļŖö ļæÉ ļ¬ģņØś ņłÖļĀ©ļÉ£ ņŚ░ĻĄ¼ņ×ÉĻ░Ć ĒÖśņ×ÉļōżņØś ņ×äņāü ņĀĢļ│┤ļź╝ ļ¬©ļź┤ļŖö ņāüĒā£ņŚÉņä£, Heidelberg Eye Explorer ņåīĒöäĒŖĖņø©ņ¢┤ (version 1.5.12.0)ņŚÉ ļé┤ņןļÉ£ caliper tool (draw region)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. ONH horizontal B-scan ņśüņāüņØĆ ņłÖļĀ©ļÉ£ Ļ▓Ćņé¼ņ×ÉļōżņØ┤ ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü(Heidelberg Engineering, Heidelberg, Germany)ņØś EDI ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ¢╗ņŚłļŗż[24]. ONHņØś ņłśņ¦ü Ļ▒░ļ”¼Ļ░Ć ļÅÖņØ╝ĒĢ£ 3Ļ░£ņØś ņ£äņ╣ś(plane 1ļČĆĒä░ 3Ļ╣īņ¦Ć)ņŚÉņä£ ņ¢╗ņØĆ 3Ļ░£ņØś horizontal B-scan ņśüņāüņŚÉņä£ LCDļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. LCDļŖö BruchŌĆÖs membrane opening (BMO)ņØś Ļ░Ćņןņ×Éļ”¼ļź╝ ņŚ░Ļ▓░ĒĢśļŖö ĻĖ░ņżĆņäĀņŚÉņä£ ņé¼ņāüĒīÉņØś ņĢ×ņ¬Į Ēæ£ļ®┤Ļ╣īņ¦ĆņØś ņĄ£ļīĆ ņłśņ¦ü Ļ▒░ļ”¼ļĪ£ ņĀĢņØśĒĢśņśĆļŗż(Fig. 1) [5,25]. ņé¼ņāüĒīÉņØś ņĢ×ņ¬Į Ēæ£ļ®┤ņØ┤ ļ¬ģĒÖĢĒĢśĻ▓ī ļ│┤ņØ┤ņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ņŚÉļŖö 30-35 ╬╝m ņĀĢļÅä ņ░©ņØ┤ ļéśļŖö ĻĘĖ ļŗżņØī ļŗ©ļ®┤ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. OCT ņØ┤ļ»Ėņ¦ĆņØś quality scoreĻ░Ć 15ļź╝ ļäśļŖö Ļ▓ĮņÜ░ļ¦ī ĒżĒĢ©ĒĢśņśĆĻ│Ā, BMOļéś ņé¼ņāüĒīÉņØś ņĢ×ņ¬Į Ēæ£ļ®┤ņØ┤ ļ¬ģĒÖĢĒĢśĻ▓ī ĻĄ¼ļČäļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ļŖö ļČäņäØņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ĒÅēĻĘĀ LCDļŖö plane 1-3ņŚÉņä£ ņĖĪņĀĢĒĢ£ Ļ░ÆņØś ĒÅēĻĘĀĻ░Æņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā, ļæÉ ļ¬ģņØś ņŚ░ĻĄ¼ņ×ÉĻ░Ć ņĖĪņĀĢĒĢ£ Ļ░ÆņØś ĒÅēĻĘĀĻ░ÆņØä ļČäņäØņŚÉ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļæÉ ņŚ░ĻĄ¼ņ×É Ļ░äņØś ņĖĪņĀĢ ņØ╝ņ╣śļÅäļź╝ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ 95% Bland-Altman limits of agreementļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż[5,25].
ļ¬©ļōĀ ņ×ÉļŻīļōżņØĆ ĒÅēĻĘĀĻ░Æ ┬▒ Ēæ£ņżĆĒÄĖņ░©ļĪ£ Ēæ£ĻĖ░ĒĢśņśĆļŗż. ņ¢æņĢłņØś ņĢłņØĖņ×É(ocular factor) ļ╣äĻĄÉ ļČäņäØņØĆ paired t-testļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ņĪ░Ļ▒┤ļČĆ ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØ(conditional logistic regression)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļģ╣ļé┤ņן ņżæļō▒ļÅäņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×Éļź╝ ļČäņäØĒĢśņśĆļŗż. ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłł ĻĘĖļŻ╣Ļ│╝ ļ░śļīĆ ļłł ĻĘĖļŻ╣ņŚÉņä£ LCDņÖĆ Ļ┤ĆļĀ© ņØĖņ×Éļź╝ ļČäņäØĒĢśĻĖ░ ņ£äĒĢ┤ ņäĀĒśĢĒÜīĻĘĆļČäņäØ(linear regression analysis)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ļŗżņżæļ╣äĻĄÉņŚÉ ņØśĒĢ£ ņ£äļ░£Ļ▓¼ņ£©(false discovery rate)ņØś ļ│┤ņĀĢņØĆ Benjamini-Hochberg ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░, ļÅģļ”Įļ│Ćņłśļōż Ļ░äņØś ļŗżņżæĻ│ĄņäĀņä▒ ĒÖĢņØĖņØä ņ£äĒĢ┤ ļČäņé░ĒīĮņ░ĮĻ│äņłś(variance inflation factor)ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļŗ©ļ│Ćļ¤ē ļČäņäØņŚÉņä£ ļ│Ćņłś ņżæ pĻ░ÆņØ┤ 0.1 ņØ┤ĒĢśņØĖ ļ│ĆņłśļōżļĪ£ ļŗżļ│Ćļ¤ē ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ĒåĄĻ│äņĀü ļČäņäØņØĆ SPSS IBM┬« version 22.0 (IBM Corp., Armonk, NY, USA)ļź╝ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ĒåĄĻ│äĒĢÖņĀü ņ£ĀņØś ņłśņżĆņØĆ 0.05 ļ»Ėļ¦īņ£╝ļĪ£ ĒĢśņśĆļŗż.
ņ┤Ø 52ļ¬ģņØś ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉĻ░Ć ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉśņŚłļŗż(Table 1). ĒÖśņ×ÉļōżņØś ĒÅēĻĘĀ ļéśņØ┤ļŖö 66.0 ┬▒ 15.0ņäĖ(30-86ņäĖ)ņśĆĻ│Ā, ļé©ņ×ÉļŖö 31ļ¬ģ(59.6%)ņØ┤ņŚłļŗż. ĻĖ░ņĀĆņĢłņĢĢņØĆ ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņŗ¼ĒĢ£ ļłłĻ│╝ ļ░śļīĆ ļłł Ļ░üĻ░ü 15.3 ┬▒ 3.5 mmHg (9-21 mmHg), 13.8 ┬▒ 3.2 mmHg (8-20 mmHg)ņ£╝ļĪ£ ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņŗ¼ĒĢ£ ļłłņØ┤ ļŹö ļåÆņĢśļŗż(p<0.001). ĒĢśņ¦Ćļ¦ī, OCT Ļ▓Ćņé¼ ņŗ£ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņØĆ ņŗ£ņĢ╝ Ļ▓░ņåÉņØ┤ ņŗ¼ĒĢ£ ļłłĻ│╝ ļ░śļīĆ ļłł Ļ░üĻ░ü 13.1 ┬▒ 3.3 mmHg (8-19 mmHg), 13.0 ┬▒ 2.8 mmHg (7-20 mmHg)ņ£╝ļĪ£ ļæÉ ļłłņØś ņ░©ņØ┤ļŖö ņŚåņŚłļŗż (p=0.769). ļæÉ ĻĄ░ņØś ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗ś, ĻĄ¼ļ®┤ļīĆņØæņłśņ╣ś ļ░Å ņĢłņČĢņן ĻĖĖņØ┤ņØś ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p>0.10). ļæÉ ĻĄ░ņØś ņŗ£ņĢ╝Ļ▓Ćņé¼ MD ņ░©ņØ┤ļŖö 14.41 ┬▒ 5.16 dBļĪ£, ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłłņØ┤ ļ░śļīĆ ļłłĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś MD Ļ░ÆņØ┤ ļé«Ļ│Ā(-10.68 ┬▒ 6.55 vs. -3.67 ┬▒ 4.05 dB, p<0.001), PSD Ļ░ÆņØĆ ņ╗ĖĻ│Ā(8.26 ┬▒ 3.75 vs. 3.76 ┬▒ 3.04 dB, p<0.001), ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śļÅä ņ¢ćņĢśļŗż(65.4 ┬▒ 15.2 vs. 82.5 ┬▒ 15.7 ╬╝m, p<0.001).
LCD ņĖĪņĀĢņŚÉņä£ ļæÉ ņĖĪņĀĢņ×É Ļ░äņØś Bland-Altman 95% ņØ╝ņ╣śļÅä ļ▓öņ£äļŖö -14.7 to 21.1 ╬╝mņśĆļŗż. ĒÅēĻĘĀ LCDļŖö ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłłņØ┤ ļ░śļīĆ ļłłļ│┤ļŗż ņ╗Ėļŗż(529.4 ┬▒ 116.7 vs. 482.9 ┬▒ 107.5 ╬╝m, p<0.001, Fig. 2A). ņśüņŚŁļ│ä ļ╣äĻĄÉņŚÉņä£ļÅä 3Ļ░£ņØś ņĖĪņĀĢ ņ£äņ╣ś ļ¬©ļæÉņŚÉņä£ ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłłņØś LCDĻ░Ć ļ░śļīĆ ļłłļ│┤ļŗż ņ╗Ėļŗż(Fig. 2B, Table 2, p<0.002). LCDĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×É ļČäņäØņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłł ĻĘĖļŻ╣Ļ│╝ ļ░śļīĆ ļłł ĻĘĖļŻ╣ ļ¬©ļæÉņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņĢłņØĖņ×ÉļŖö ņŚåņŚłļŗż(Table 3).
ļŗ©ļ│Ćļ¤ē ņĪ░Ļ▒┤ļČĆ ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØņŚÉņä£ LCDĻ░Ć Ēü┤ņłśļĪØ (odds ratio [OR] 1.023, 95% confidence interval [CI] 1.009-1.03, p=0.001), ĻĖ░ņĀĆņĢłņĢĢņØ┤ ļåÆņØäņłśļĪØ(OR 1.752, 95% CI 1.230-2.496, p=0.002) ļģ╣ļé┤ņןņØ┤ ņŗ¼ĒĢĀ ņ£äĒŚśņØ┤ ļåÆņĢśļŗż. ļŗżļ│Ćļ¤ē ņĪ░Ļ▒┤ļČĆ ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØņŚÉņä£ļÅä ĻĖ░ņĀĆņĢłņĢĢņØ┤ ļåÆņØäņłśļĪØ(OR 1.758, 95% CI 1.178-2.624, p=0.006), LCDĻ░Ć Ēü┤ņłśļĪØ(OR 1.028, 95% CI 1.009-1.047, p=0.003) ļģ╣ļé┤ņןņØ┤ ņŗ¼ĒĢĀ ņ£äĒŚśņØ┤ ļåÆņĢśļŗż(Table 4). Fig. 3ņØĆ ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłłņØ┤ ļ░śļīĆ ļłłĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ LCDĻ░Ć ļŹö Ēü░ Ļ▓āņØä ļ│┤ņŚ¼ņŻ╝ļŖö ļīĆĒæ£ņĀüņØĖ ņ”ØļĪĆņØ┤ļŗż.
ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņĀĢļÅäĻ░Ć ļŗżļźĖ ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļŹö ņŗ¼ĒĢ£ ļłłņØ┤ ļ░śļīĆ ļłłĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ LCDĻ░Ć ņ╗Ėļŗż. ļśÉĒĢ£, ļÅÖņØ╝ĒĢ£ ņĀäņŗĀ ņØĖņ×Éļź╝ Ļ░Ćņ¦ä Ļ░£ņØĖ ļé┤ņŚÉņä£ ĻĖ░ņĀĆņĢłņĢĢņØ┤ ļåÆņØäņłśļĪØ, LCDĻ░Ć Ēü┤ņłśļĪØ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļŹö ņŗ¼ĒĢĀ ņ£äĒŚśņØ┤ ļåÆņĢśļŗż. ņØ┤ļŖö ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņØĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ļÅä ņĢłņĢĢ ļ░Å ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳Ļ│Ā, ļ╣äņŖĘĒĢ£ ņĀäņŗĀ ņĪ░Ļ▒┤ņŚÉņä£ ņĢłņĢĢņØ┤ ļåÆņØäņłśļĪØ, LCDĻ░Ć Ēü┤ņłśļĪØ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļŹö ņŗ¼ĒĢĀ ņ£äĒŚśņØ┤ ļåÆņØä Ļ▓āņ×äņØä ņŗ£ņé¼ĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ņ¢æņĢłņØś ņżæļō▒ļÅäĻ░Ć ļŗżļźĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņØś Ļ░£ņØĖ ļé┤ ņ¢æņĢł ļ╣äĻĄÉļź╝ ĒåĄĒĢ┤ ļģ╣ļé┤ņן ņżæļō▒ļÅäņÖĆ Ļ┤ĆļĀ©ļÉ£ ņĢłņØĖņ×Éļź╝ ļČäņäØĒĢśņśĆĻ│Ā ņØ┤ļŖö ļ╣äĻĄÉ ĻĄ░ Ļ░äņØś ņĀäņŗĀ ņØĖņ×Éļź╝ ļ│┤ņĀĢĒĢśņśĆļŗżļŖö ņĖĪļ®┤ņŚÉņä£ Ļ░ĢņĀÉņØ┤ ņ׳ļŗż. Ļ│ĀņĢłņĢĢ ļģ╣ļé┤ņןĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņŚÉņä£ļÅä ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļ░£ņāØĒĢśļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØĆ ņĀäņŗĀ ĒśłņĢĢ ļ░Å ņŗ£ņŗĀĻ▓ĮņØś ĻĄŁņåī Ļ┤Ćļźś ļČĆņĀä ļō▒ņØś ņŗ£ņŗĀĻ▓ĮņØś ĒŚłĒśłņä▒ ņåÉņāüņØ┤ ļ│æļ”¼ ĻĖ░ņĀäņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[5]. ļŗ©ņĢłņØś ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ļģ╣ļé┤ņן ņĢłņØś ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ņ£ä ļ»ĖņäĖ Ļ┤Ćļźś ļČĆņĀäņØś ļ╣łļÅäĻ░Ć ļåÆĻ│Ā, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ņ£ä ņ£äņČĢ(beta zone parapapillary atrophy)ņØ┤ ļŹö ļäōņ£╝ļ®░, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śļÅä ņ¢ćņĢśļŗż[26]. Lee et al. [15]ņØĆ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņĀĢļÅäĻ░Ć ļ╣äņŖĘĒĢ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä Ļ░£ļ│äņØś ņé¼ņāüĒīÉ ļ│ĆĒśĢ ļ░Å ņĀäņŗĀ ņ£äĒŚśņØĖņ×ÉĻ░Ć ļŗżņ¢æĒĢ£ ĒŖ╣ņä▒ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ ļÜ£ļĀĘĒĢśņ¦Ć ņĢŖņØĆ ļģ╣ļé┤ņן ĒÖśņ×ÉļŖö ļ│ĆĒśĢņØ┤ ņŗ¼ĒĢ£ ĒÖśņ×ÉņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ņ╣śļŻī ņĀä ņĢłņĢĢĻ│╝ ņĀäņŗĀ ĒśłņĢĢņØ┤ ļé«Ļ│Ā, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ņ£ä ņ£äņČĢ ļ░Å ļ»ĖņäĖ Ļ┤Ćļźś ļČĆņĀäņØä ļ│┤ņØ┤Ļ│Ā, ņŗ£ņŗĀĻ▓Į ņ£ĀļæÉ ņŻ╝ņ£ä ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ¢ćņØĆ ĒŖ╣ņä▒ņØä ļ│┤ņśĆļŗż. ņØ┤ļŖö ļ╣äņŖĘĒĢ£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØä ļ│┤ņØ┤ļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļ░£ņāØĒĢśļŖö ĻĖ░ņĀäņØ┤ ļŗżļź┤Ļ│Ā, ņé¼ņāüĒīÉņØś ļ│ĆĒśĢ ņĀĢļÅä ņŚŁņŗ£ ļŗżņ¢æĒĢ©ņØä ņŗ£ņé¼ĒĢśĻ│Ā, ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ ļŗ©ņł£Ē׳ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś Ļ▓░Ļ│╝ļŖö ņĢäļŗÉ Ļ▓āņ×äņØä ņŗ£ņé¼ĒĢ£ļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ┤ĆņĀÉņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņ£äĒŚś ņØĖņ×Éļź╝ ļČäņäØĒĢśĻĖ░ ņ£äĒĢ£ Ļ░£ņØĖ Ļ░ä ļ╣äĻĄÉļź╝ ĒåĄĒĢ£ ņŚ░ĻĄ¼ļŖö ĒśłņĢĢ ļō▒ņØś ņĀäņŗĀ ņ£äĒŚśņØĖņ×Éļź╝ ļ│┤ņĀĢĒĢ┤ņĢ╝ ĒĢśņ¦Ćļ¦ī, Ļ░£ļ│ä ĒÖśņ×ÉņØś ļ╣äĻĄÉļŖö ĒśäņŗżņĀüņ£╝ļĪ£ ņĀäņŗĀ ņ£äĒŚśņØĖņ×É ļ│┤ņĀĢņŚÉ ĒĢ£Ļ│äĻ░Ć ņ׳ņØä ņłśļ░¢ņŚÉ ņŚåļŗż.
LCDļŖö ņĢłņĢĢņŚÉ ņØĖĒĢ£ ņé¼ņāüĒīÉņØś ĻĖ░Ļ│äņĀüņØĖ ņåÉņāü ļ░Å ņØ┤ļĪ£ ņØĖĒĢ£ ļ│ĆĒśĢņØä ļ░śņśüĒĢśļŖö ņ¦ĆĒæ£ļĪ£, ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņŚÉņä£ LCDņÖĆ ļģ╣ļé┤ņןĻ│╝ņØś ņāüĻ┤Ćņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż. Park et al. [17]ņØĆ Ļ│ĀņĢłņĢĢļģ╣ļé┤ņןņØä ĒżĒĢ©ĒĢ£ Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ļČäņäØĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņä▒ļ│äĻ│╝ ņŚ░ļĀ╣ņØ┤ ļÅÖņØ╝ĒĢ£ ļČäĒżļź╝ Ļ░Ćņ¦ä Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×É ĻĘĖļŻ╣ņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļŹö ņŗ¼ĒĢ£ ĒÖśņ×ÉņØś LCDĻ░Ć ļŹö Ēü¼ļŗżĻ│Ā ĒĢśņśĆļŗż. Kim et al. [27]ņØĆ ļŗ©ņĢłņØś Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņ׳ļŖö ļłł ļ┐Éļ¦ī ņĢäļŗłļØ╝ ļ░śļīĆņĢłņŚÉņä£ļÅä LCDĻ░Ć ņĀĢņāüņØĖĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ Ēü¼ļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ņ╣śļŻī ņĀä ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņØĖ ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņżæļō▒ļÅäņŚÉ ļö░ļØ╝ ļæÉ ĻĄ░ņ£╝ļĪ£ ļéśļłäņ¢┤ Ļ░£ņØĖ ļé┤ ņ¢æņĢłņØś LCDļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉ£ ĒÖśņ×ÉļōżņØś LCDļŖö ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļŹö ņŗ¼ĒĢ£ ļłł(529.4 ┬▒ 116.7 ╬╝m)Ļ│╝ ļ░śļīĆ ļłł(482.9 ┬▒ 107.5 ╬╝m) ļ¬©ļæÉ Ļ▒┤Ļ░ĢĒĢ£ ĒĢ£ĻĄŁ ņä▒ņØĖņØś LCD (402.06 ┬▒ 101.46 ╬╝m) [25]ļ│┤ļŗż Ēü░ Ļ▓ĮĒ¢źņØä ļ│┤ņśĆĻ│Ā, ļģ╣ļé┤ņןņØ┤ ņŗ¼ĒĢ£ ļłłņØś LCDĻ░Ć ļ░śļīĆ ļłłĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļŹö ņ╗Ėļŗż. ņØ┤ļŖö ļŗ©ņĢłņØś ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ļģ╣ļé┤ņןņĢłņØś LCDĻ░Ć ņĀĢņāüņĢłņØś LCDļ│┤ļŗż ļŹö ņ╗ĖļŹś ĻĖ░ņĪ┤ ņŚ░ĻĄ¼[5]ņØś Ļ▓░Ļ│╝ņÖĆļÅä ņāüņØæĒĢśļ®░, Ļ│ĀņĢłņĢĢ ļģ╣ļé┤ņן ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņØĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņØä Ļ▓āņ×äņØä ņŗ£ņé¼ĒĢ£ļŗż.
Ļ│ĀņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×Éļź╝ ĒżĒĢ©ĒĢ£ Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×É(ņĢłņĢĢ ļ▓öņ£ä 12-55 mmHg)ņŚÉņä£ ņĢłņĢĢĻ│╝ LCDļŖö ņ¢æņØś ņāüĻ┤Ćņä▒ņØä ļ│┤ņśĆĻ│Ā[28], ņłśņłĀņĀü ņ╣śļŻīļź╝ ĒåĄĒĢ┤ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņĢłņĢĢņØ┤ ĒĢśĻ░ĢļÉ£ ĒÖśņ×É(ņłśņłĀ ņĀä ņĢłņĢĢ 27.4 ┬▒ 9.0 mmHg, ņłśņłĀ 6Ļ░£ņøö Ēøä ņĢłņĢĢ 9.7 ┬▒ 3.1 mmHg)ņŚÉņä£ ņłśņłĀ Ēøä LCDņØś Ļ░Éņåīļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, LCD Ļ░ÉņåīļŖö ņĢłņĢĢĒĢśĻ░Ģ ņĀĢļÅäņÖĆ ņ¢æņØś ņāüĻ┤Ćņä▒ņØä ļ│┤ņśĆļŗż[29]. ĻĘĖļ¤¼ļéś ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļŖö ņĢłņĢĢĒĢśĻ░Ģ ņĀĢļÅäņÖĆ ņé¼ņāüĒīÉņØś ļ│ĆĒśĢ ņĀĢļÅäļŖö ņ£ĀņØśĒĢ£ ņāüĻ┤Ćņä▒ņØ┤ ņŚåņŚłļŗż[30]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä Ļ│ĀņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņÖĆ ļŗ¼ļ”¼, ņĢłņĢĢĻ│╝ LCD Ļ░äņØś ņāüĻ┤Ćņä▒ņØĆ ĒÖĢņØĖļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ļ│Ė ņŚ░ĻĄ¼Ļ░Ć ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×Éļ¦īņØä ļīĆņāüņ£╝ļĪ£ ļČäņäØĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ, ĒżĒĢ©ļÉ£ ĒÖśņ×ÉļōżņØś ņĢłņĢĢ ļ▓öņ£äĻ░Ć ņóüņĢäņä£ ņĢłņĢĢĻ│╝ LCD ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆņØ┤ ĒÖĢņØĖļÉśņ¦Ć ņĢŖņØĆ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļæÉ ļłł ņżæņŚÉ LCDĻ░Ć Ēü¼Ļ│Ā, ĻĖ░ņĀĆņĢłņĢĢņØ┤ ļåÆņØĆ ļłłņŚÉņä£ ļģ╣ļé┤ņןņØ┤ ņŗ¼ĒĢĀ ņ£äĒŚśņØ┤ ļåÆņĢśļŗż. ņØ┤ļŖö ļŗ©ņĢł ņĀĢņāüņĢłņĢĢ ļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņé¼ņāüĒīÉ ļ│ĆĒśĢņØ┤ Ēü░ ļłłņŚÉņä£ ļģ╣ļé┤ņן ļ░£ļ│æņØś ņ£äĒŚśņØ┤ ļåÆņĢśļŹś ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņÖĆ ņāüņØæĒĢśļŖö Ļ▓░Ļ│╝ļĪ£[5], ņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņØĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ļÅä ņé¼ņāüĒīÉņØś Ēøäļ░® ļ│ĆĒśĢņØ┤ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļŗ©ļ®┤ ņŚ░ĻĄ¼ļĪ£, ņé¼ņāüĒīÉņØś ĒśĢĒā£ņÖĆ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ļ¬ģĒÖĢĒĢ£ ņØĖĻ│╝Ļ┤ĆĻ│ä ĻĘ£ļ¬ģņŚÉļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ņ¦Ćļ¦ī, ļŗżņØīĻ│╝ Ļ░ÖņØ┤ ņé¼ņāüĒīÉņØś ĒśĢĒā£ņÖĆ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņāüĻ┤Ćņä▒ņØä ņČöņĀĢĒĢ┤ ļ│╝ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ņ▓½ ļ▓łņ¦Ė, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ LCDĻ░Ć Ēü┤ņłśļĪØ ņśłĒøäĻ░Ć ļéśņüĀ Ļ▓āņØ┤ļØ╝ļŖö Ļ░ĆņäżņØ┤ļŗż. ļæÉ ļ▓łņ¦ĖļŖö ņé¼ņāüĒīÉņØś Ēøäļ░® ļ│ĆĒśĢņØ┤ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņŚÉ ļö░ļźĖ ņØ┤ņ░©ņĀüņØĖ ļ│ĆĒÖöļØ╝ļŖö Ļ▓āņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ LCDļŖö ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłłņŚÉņä£ ļŹö ņ╗Ėņ¦Ćļ¦ī, ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłł ĻĘĖļŻ╣Ļ│╝ ļ░śļīĆ ļłł ĻĘĖļŻ╣ ļé┤ņŚÉņä£ LCDņÖĆ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØś ņĀĢļÅä(retinal nerve fiber layer [RNFL] thickness and visual field indices) Ļ░äņØś ņāüĻ┤Ćņä▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ļŗ©ņł£Ē׳ RNFL ņåÉņŗżņØ┤ ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØä ņ£Āļ░£Ē¢łņØä Ļ░ĆļŖźņä▒ņØĆ ļé«ļŗżļŖö Ļ▓āņØä ņäżļ¬ģĒĢśļŖö Ļ▓░Ļ│╝ņØ┤ļŗż. ĻĖ░ņĪ┤ņØś ļģ╣ļé┤ņן ļÅÖļ¼╝ ņŗżĒŚś ļ¬©ļŹĖņŚÉņä£ ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ RNFL ņåÉņŗżļ│┤ļŗż ļ©╝ņĀĆ ļ░£ņāØĒĢśĻ│Ā[31], ļ╣äļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Įļ│æņ”Ø ĒÖśņ×ÉņØś ņé¼ņāüĒīÉņØ┤ ņĀĢņāüņØĖĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒśĢĒā£ĒĢÖņĀü ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŹś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝[32-34] ņŚŁņŗ£ ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ ņŗ£ņŗĀĻ▓Į ņåÉņāüņŚÉ ļö░ļźĖ ņØ┤ņ░©ņĀüņØĖ Ļ▓░Ļ│╝ļØ╝ļŖö Ļ▓āņŚÉļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī ļ│Ė ņŚ░ĻĄ¼ļŖö ļŗ©ļ®┤ ņŚ░ĻĄ¼ņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ ņé¼ņāüĒīÉ ļ│ĆĒśĢņØś ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņןĻĖ░ņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļŗżņØīĻ│╝ Ļ░ÖņØĆ ĒĢ£Ļ│äņĀÉņØ┤ ņ׳ļŗż. ņ▓½ ļ▓łņ¦ĖļĪ£ ĒÖśņ×ÉļōżņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢ£ ļŗ©ļ®┤ ņŚ░ĻĄ¼ļĪ£ LCDĻ░Ć Ēü░ ļłłņØ┤ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņŚÉ ļŹö ņĘ©ņĢĮĒĢ£ Ļ▓āņØĖņ¦Ć, ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļŹö Ēü░ ļłłņŚÉņä£ ņØ┤ņ░©ņĀüņ£╝ļĪ£ LCDĻ░Ć ņ╗żņ¦ä Ļ▓āņØĖņ¦Ć ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ļ¬ģĒÖĢĒ׳ ĻĘ£ļ¬ģĒĢśĻĖ░ ņ¢┤ļĀĄļŗż. ņØ┤ļ¤¼ĒĢ£ ĒĢ£Ļ│äņĀÉņØä ĻĘ╣ļ│ĄĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņČöĒøä ņןĻĖ░ņĀüņØĖ ņČöņĀü Ļ┤Ćņ░░ņØä ĒåĄĒĢ£ ņØĖĻ│╝Ļ┤ĆĻ│äņØś ĒÖĢņØĖņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļæÉ ļ▓łņ¦ĖļĪ£ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņłĀ ĻĖ░Ļ│äņŚÉļŖö ņĢäņ¦ü LCDļź╝ ņ×ÉļÅÖņ£╝ļĪ£ ņĖĪņĀĢĒĢśļŖö ņåīĒöäĒŖĖņø©ņ¢┤Ļ░Ć Ēāæņ×¼ļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņĢä ņłśļÅÖņ£╝ļĪ£ ņĖĪņĀĢĒĢ┤ņĢ╝ ĒĢśļ»ĆļĪ£, ņĖĪņĀĢņ×ÉņŚÉ ļö░ļźĖ ņśżņ░©Ļ░Ć ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ņØś ņĖĪņĀĢņ×É Ļ░ä Bland-Altman ņØ╝ņ╣śļÅä ļČäņäØ Ļ▓░Ļ│╝ņŚÉņä£ 95% ņØ╝ņ╣śļÅä ļ▓öņ£äļŖö -14.7 to 21.1 ╬╝mļĪ£ ļåÆņØĆ ņØ╝ņ╣śņ£©ņØä ļ│┤ņśĆĻ│Ā, ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłłĻ│╝ ļ░śļīĆ ļłłņØś LCDņØś ņ░©ņØ┤(46.0 ┬▒ 63.0 ╬╝m)ļŖö ņĖĪņĀĢ ņśżņ░©ļź╝ ļäśĻĖ░ ļĢīļ¼ĖņŚÉ, ņĖĪņĀĢ ņśżņ░©Ļ░Ć ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£, ļ│Ė ņŚ░ĻĄ¼ļŖö ņĢłņĢĢĒĢśĻ░Ģ ņ╣śļŻī ņżæņØĖ ĒÖśņ×ÉĻ░Ć ĒżĒĢ©ļÉśņŚłĻĖ░ ļĢīļ¼ĖņŚÉ, LCDĻ░Ć ņĢłņĢĢĒĢśĻ░Ģ ņ╣śļŻīļĪ£ Ļ░ÉņåīļÉśņŚłņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż[30,35]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļłłņØ┤ ļ░śļīĆ ļłłļ│┤ļŗż, LCDĻ░Ć ļŹö Ēü¼Ļ│Ā, ņĢłņĢĢĒĢśĻ░Ģ ņĀĢļÅäļÅä ļŹö ņ╗Ėļŗż. ņØ┤ļŖö ņ╣śļŻī ņĀä LCD ņŚŁņŗ£, ļģ╣ļé┤ņןņØ┤ ņŗ¼ĒĢ£ ļłłņØ┤ ļ░śļīĆ ļłłĻ│╝ ļ╣äĻĄÉĒĢ┤ņä£ ļŹö ņ╗ĖņØä Ļ▓āņ£╝ļĪ£ ņČöņĀĢĒĢĀ ņłś ņ׳ĻĖ░ņŚÉ, ņĢłņĢĢĒĢśĻ░Ģ ņ╣śļŻīĻ░Ć ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ│żņØä Ļ░ĆļŖźņä▒ņØĆ ņĀüņØä Ļ▓āņØ┤ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¢æņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ļŹö ņŗ¼ĒĢ£ ļłłņØ┤ ļ░śļīĆ ļłłĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ LCDĻ░Ć ļŹö ņ╗ĖĻ│Ā, LCDĻ░Ć Ēü░ ļłłņØ┤ ļ░śļīĆ ļłłĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņŗ£ņŗĀĻ▓Į ņåÉņāüņØ┤ ņŗ¼ĒĢĀ ņ£äĒŚśņØ┤ ļåÆņĢśļŗż. ņØ┤ļŖö ĻĖ░ņĀĆņĢłņĢĢņØ┤ ņĀĢņāü ļ▓öņ£äņØĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ļÅä ņé¼ņāüĒīÉņØś ļ│ĆĒśĢņØ┤ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż.
Acknowledgments
This research was supported by grants of the Patient-Centered Clinical Research Coordinating Center funded by the Ministry of Health & Welfare, Republic of Korea (grant numbers: HI19C0481, HC19C0276).
Figure┬Ā1.
Measurement of the lamina cribrosa (LC) depth (LCD). (A) Fundus image showing an eye with three lines indicating the levels of the horizontal B-scan images spaced equidistantly across the vertical optic disc diameter. (B) The LCD (red double-headed arrow) was measured in the direction perpendicular to the reference line connecting the two Bruch's membrane opening points at the maximally depressed point of the anterior LC surface.
Figure┬Ā2.
Inter-eye comparison of lamina cribrosa depth (LCD) in three horizontal optic nerve head B-scan images between the eyes with asymmetrical severity in bilateral normal tension glaucoma patients. (A) Scatter plots show that more damaged eyes had a deeper LCD than did contralateral eyes. The red lines indicate equivalence between more damaged eyes and less damaged eyes. (B) LCDs were deeper at all three planes in eyes with more damage than contralateral eyes (all p < 0.05). In figure (B), scale bar and ŌĆś*ŌĆÖ indicates standard error of mean and p-value less than 0.05, respectively.

Figure┬Ā3.
A case of an 88-year-old female with bilateral asymmetric normal-tension glaucoma based on the mean deviation (MD) on the Humphrey visual fields test (-1.55 dB in the right eye [D] and -7.28 dB in the left eye [H], respectively). Her baseline intraocular pressure was 16 mmHg in the right eye and 14 mmHg in the left eye, respectively. Disc photos (A, E), peripapillary retinal nerve fiber layer (RNFL) thickness profiles (C, G), and visual field pattern deviation plots (D, H) confirmed that her left eye had more damaged optic nerve head than the contralateral right eye. Note that lamina cribrosa depth (red double-headed arrows in the B, F) was significantly deeper in the eye with more damage (F, 455 ╬╝m) than the contralateral eye (B, 369 ╬╝m). TEMP = temporal; SUP = superior; NAS = nasal; INF = inferior; GHT = glaucoma hemifield test; PSD = pattern standard deviation.

Table┬Ā1.
Demographic characteristics of the study subjects (n = 52)
| Variable | More damaged eye | Less damaged eye | p-value* |
|---|---|---|---|
| Age (years) | 66.0 ┬▒ 15.0 | - | |
| Sex (female) | 21 (40.4) | - | |
| Difference in MD between eyes (dB) | 14.41 ┬▒ 5.16 | - | |
| Diabetes mellitus | 15 (28.8) | - | |
| Hypertension | 19 (36.5) | - | |
| Family history of glaucoma | 7 (13.4) | - | |
| Cold extremities | 21 (40.3) | - | |
| Migraine | 7 (13.4) | ||
| SBP (mmHg) | 126.4 ┬▒ 15.7 | ||
| DBP (mmHg) | 78.4 ┬▒ 13.4 | - | |
| - | |||
| - | |||
| Baseline IOP (mmHg) | 15.3 ┬▒ 3.5 | 13.8 ┬▒ 3.2 | <0.001 |
| IOP at OCT imaging (mmHg) | 13.1 ┬▒ 3.3 | 13.0 ┬▒ 2.9 | 0.769 |
| Difference in IOP between baseline and imaging (mmHg) | 2.3 ┬▒ 3.9 | 0.7 ┬▒ 4.5 | 0.002 |
| Spherical equivalent D (D) | -0.88 ┬▒ 2.90 | -0.67 ┬▒ 2.55 | 0.392 |
| Central corneal thickness (╬╝m) | 551.4 ┬▒ 55.7 | 541.2 ┬▒ 44.4 | 0.137 |
| Axial length (mm) | 24.18 ┬▒ 1.78 | 24.17 ┬▒ 1.77 | 0.831 |
| Global RNFL thickness (╬╝m) | 65.4 ┬▒ 15.2 | 82.5 ┬▒ 15.7 | <0.001 |
| Automated perimetry (dB) | |||
| ŌĆāMD | -10.68 ┬▒ 6.55 | -3.67 ┬▒ 4.05 | <0.001 |
| ŌĆāPSD | 8.26 ┬▒ 3.75 | 3.76 ┬▒ 3.04 | <0.001 |
Table┬Ā2.
Inter-eye comparison of the lamina cribrosa depth between eyes with asymmetrical severity in bilateral normal-tension glaucoma patients (n = 52)
|
LCD (╬╝m) |
p-valueŌĆĀ | |||
|---|---|---|---|---|
| More damaged eye | Less damaged eye | Absolute difference* | ||
| Plane Location | ||||
| ŌĆāSuperior | 578.9 ┬▒ 125.8 | 528.5 ┬▒ 116.9 | 50.0 ┬▒ 65.0 | <0.001 |
| ŌĆāCentral | 509.69 ┬▒ 130.3 | 458.8 ┬▒ 113.2 | 51.0 ┬▒ 82.0 | <0.001 |
| ŌĆāInferior | 499.9 ┬▒ 114.6 | 461.3 ┬▒ 106.7 | 39.0 ┬▒ 79.0 | 0.002 |
| ŌĆāAverage | 529.4 ┬▒ 116.7 | 482.9 ┬▒ 107.5 | 46.0 ┬▒ 63.0 | <0.001 |
Table┬Ā3.
Factors associated with the lamina cribrosa depth in bilateral normal-tension glaucoma patients showing more damage in one eye (n = 52)
Table┬Ā4.
Ocular risk factors associated with the more damaged eye between eyes in bilateral normal-tension glaucoma patients (n = 52)
| Variable |
Univariate analysis |
Multivariate analysis* |
||||
|---|---|---|---|---|---|---|
| OR | 95% CI | p-valueŌĆĀ | OR | 95% CI | p-valueŌĆĀ | |
| Baseline IOP (per 1 mmHg higher) | 1.752 | 1.230-2.496 | 0.002 | 1.758 | 1.178-2.624 | 0.006 |
| IOP at imaging (per 1 mmHg higher) | 0.965 | 0.763-1.220 | 0.766 | |||
| Spherical error (per 1 D larger) | 0.882 | 0.639-1.215 | 0.442 | |||
| CCT (per 1 ╬╝m thicker) | 1.012 | 0.996-1.028 | 0.134 | |||
| Axial length (per 1 mm longer) | 1.288 | 0.079-21.090 | 0.859 | |||
| Average LCD (per 1 ╬╝m deeper) | 1.023 | 1.009-1.037 | 0.001 | 1.028 | 1.009-1.047 | 0.003 |
REFERENCES
1) Shields MB. Normal-tension glaucoma: is it different from primary open-angle glaucoma? Curr Opin Ophthalmol 2008;19:85-8.


2) Mallick J, Devi L, Malik PK, Mallick J. Update on normal tension glaucoma. J Ophthalmic Vis Res 2016;11:204-8.



3) Hayreh SS. Blood supply of the optic nerve head and its role in optic atrophy, glaucoma, and oedema of the optic disc. Br J Ophthalmol 1969;53:721-48.



4) Flammer J, Org├╝l S. Optic nerve blood-flow abnormalities in glaucoma. Prog Retin Eye Res 1998;17:267-89.


5) Kim JA, Kim TW, Lee EJ, et al. Intereye comparison of lamina cribrosa curvature in normal tension glaucoma patients with unilateral damage. Invest Ophthalmol Vis Sci 2019;60:2423-30.


7) Morrison JC, Jerdan JA, Dorman ME, Quigley HA. Structural proteins of the neonatal and adult lamina cribrosa. Arch Ophthalmol 1989;107:1220-4.


8) Morrison JC, L'Hernault NL, Jerdan JA, Quigley HA. Ultrastructural location of extracellular matrix components in the optic nerve head. Arch Ophthalmol 1989;107:123-9.


9) Burgoyne CF. A biomechanical paradigm for axonal insult within the optic nerve head in aging and glaucoma. Exp Eye Res 2011;93:120-32.



10) Burgoyne CF, Downs JC. Premise and prediction-how optic nerve head biomechanics underlies the susceptibility and clinical behav ior of the aged optic nerve head. J Glaucoma 2008;17:318-28.



11) Li L, Bian A, Cheng G, Zhou Q. Posterior displacement of the lamina cribrosa in normal-tension and high-tension glaucoma. Acta Ophthalmol 2016;94:e492-500.


12) Anderson DR, Hendrickson AE. Failure of increased intracranial pressure to affect rapid axonal transport at the optic nerve head. Invest Ophthalmol Vis Sci 1977;16:423-6.

13) Leske MC, Heijl A, Hyman L, et al. Predictors of long-term progression in the early manifest glaucoma trial. Ophthalmology 2007;114:1965-72.


14) Kwon J, Jo YH, Jeong D, et al. Baseline systolic versus diastolic blood pressure dip and subsequent visual field progression in normal-tension glaucoma. Ophthalmology 2019;126:967-79.


15) Lee SH, Kim TW, Lee EJ, et al. Ocular and clinical characteristics associated with the extent of posterior lamina cribrosa curve in normal tension glaucoma. Sci Rep 2018;8:961.




16) Ono T, Yuki K, Asaoka R, et al. Glaucomatous visual field defect severity and the prevalence of motor vehicle collisions in Japanese: a hospital/clinic-based cross-sectional study. J Ophthalmol 2015;2015:497067.




17) Park SC, Brumm J, Furlanetto RL, et al. Lamina cribrosa depth in different stages of glaucoma. Invest Ophthalmol Vis Sci 2015;56:2059-64.


18) Rao HL, Begum VU, Khadka D, et al. Comparing glaucoma progression on 24-2 and 10-2 visual field examinations. PLoS One 2015;10:e0127233.



19) Scoralick ALB, Gracitelli CPB, Dias DT, et al. Lack of association between provocative test-based intraocular pressure parameters and functional loss in treated glaucoma patients. Arq Bras Oftalmol 2019;82:176-82.


20) Kwun Y, Han JC, Kee C. Comparison of lamina cribrosa thickness in normal tension glaucoma patients with unilateral visual field defect. Am J Ophthalmol 2015 159:512-8. e1.


21) Heijl A, Leske MC, Bengtsson B, et al. Measuring visual field progression in the early manifest glaucoma trial. Acta Ophthalmol Scand 2003;81:286-93.



22) Kim JA, Kim TW, Lee EJ, et al. Lamina cribrosa morphology in glaucomatous eyes with hemifield defect in a Korean population. Ophthalmology 2019;126:692-701.


23) Park DH, Park SW, Sung MS. Choroidal thickness in advanced glaucoma patients. J Korean Ophthalmol Soc 2021;62:1626-36.


24) Park HY, Hwang YS, Park CK. Ocular characteristics associated with the location of focal lamina cribrosa defects in open-angle glaucoma patients. Eye (Lond) 2017;31:578-87.




25) Seo JH, Kim TW, Weinreb RN. Lamina cribrosa depth in healthy eyes. Invest Ophthalmol Vis Sci 2014;55:1241-51.


26) Kim JA, Son DH, Lee EJ, et al. Intereye comparison of the characteristics of the peripapillary choroid in patients with unilateral normal-tension glaucoma. Ophthalmol Glaucoma 2021;4:512-21.


27) Kim DW, Jeoung JW, Kim YW, et al. Prelamina and lamina cribrosa in glaucoma patients with unilateral visual field loss. Invest Ophthalmol Vis Sci 2016;57:1662-70.


28) Wu J, Du Y, Li J, et al. The influence of different intraocular pressure on lamina cribrosa parameters in glaucoma and the relation clinical implication. Sci Rep 2021;11:9755.




29) Lee EJ, Kim TW, Weinreb RN. Variation of lamina cribrosa depth following trabeculectomy. Invest Ophthalmol Vis Sci 2013;54:5392-9.


30) Kim JA, Lee SH, Son DH, et al. Morphologic changes in the lamina cribrosa upon intraocular pressure lowering in patients with normal tension glaucoma. Invest Ophthalmol Vis Sci 2022;63:23.

31) Bellezza AJ, Rintalan CJ, Thompson HW, et al. Deformation of the lamina cribrosa and anterior scleral canal wall in early experimental glaucoma. Invest Ophthalmol Vis Sci 2003;44:623-37.


32) Lee EJ, Choi YJ, Kim TW, Hwang JM. Comparison of the deep optic nerve head structure between normal-tension glaucoma and nonarteritic anterior ischemic optic neuropathy. PLoS One 2016;11:e0150242.



33) Kim JA, Lee EJ, Kim TW, et al. Differentiation of nonarteritic anterior ischemic optic neuropathy from normal tension glaucoma by comparison of the lamina cribrosa. Invest Ophthalmol Vis Sci 2020;61:21.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




