 |
 |
| J Korean Ophthalmol Soc > Volume 62(2); 2021 > Article |
|
국문초록
대상과 방법
2016년 11월부터 2018년 2월까지 비손상 망막 레이저 치료를 받은 만성 중심장액맥락망막병증 환자들을 대상으로 후향적 연구를 실시하였다. 2회 이상 유리체강내 항혈관내피세포 성장인자 주입술을 시행 받았으나 시력호전이 되지 않고 망막하액이 감소되지 않았던 환자들에게 비손상 레이저 치료를 시행, 최소 6개월 이상 추적 관찰 가능하였던 경우를 대상으로 하였고, 치료 전후로 최대교정시력 및 빛간섭단층촬영을 이용한 황반의 두께 변화로 망막하액의 양을 측정하였다.
결과
총 18명(남자 11명, 여자 7명)의 만성 중심장액맥락망막병증 환자들이 분석에 포함되었으며, 환자들의 나이는 평균 54.6 ± 13.19세, 비손상 망막 레이저 치료 이후 추적 관찰 기간은 평균 9.75 ± 3.20개월이었다. 레이저 전후의 중심망막두께(nm)는 평균 375에서 246으로 감소하였고(p<0.001), 최대교정시력은 평균 0.48에서 0.40으로 호전되었다(p=0.028). 레이저 이후 망막하액이 완전 소실된 환자는 10명(남자 5명, 여자 5명)으로 완전 소실률은 55.56%였다. 레이저 치료 후 황반부에 특별한 이상 소견은 관찰되지 않았다.
ABSTRACT
Purpose
This study analyzed the effects of non-damaging retinal laser therapy (NRT) in patients with chronic central serous chorioretinopathy.
Methods
A retrospective study was conducted on patients with chronic central serous chorioretinopathy who were undergoing follow-up with NRT from November 2016 to February 2018. NRT was performed in patients who underwent intravitreal anti-vascular endothelial growth factor (anti-VEGF) injection at least two times with no improvement in visual acuity and a reduced amount of subretinal fluid. Before and after treatment, logMAR best-corrected visual acuity (BCVA) evaluation and subretinal fluid (SRF) according to thickness measurements of the macula determined from optical coherence tomography imagery were performed over a period of at least 6 months.
Results
Eighteen eyes of 18 patients (11 male and 7 female) with chronic central serous retinopathy were treated with NRT. The mean age of patients was 54.6 ± 13.19 years old and the mean duration of follow-up was 9.75 ± 3.20 months. The central macular thickness decreased from 375 to 246 nm (p < 0.001) and BCVA improved from 0.48 to 0.40 (p = 0.028). SRF completely resolved in 55.56% of the patients after NRT.
중심장액맥락망막병증은 망막색소상피층의 병적 변화와 이에 동반된 장액망막박리를 특징으로 하는 질병으로[1], 대부분의 경우 3개월 이내 자연 호전되고 좋은 시력예후를 보이지만, 약 5%의 환자는 만성으로 진행한다고 알려져 있고[2], 이 경우 황반부 망막박리가 지속되거나 잦은 재발을 보이면서 망막색소상피위축, 시세포 외절의 변화, 망막하삼출, 망막하섬유증, 낭포황반변성 및 맥락막신생혈관 등의 합병증으로 시력저하, 영구적 중심암점을 가져올 수 있다[2,3]. 6개월 이상 감각신경망막박리가 지속 또는 재발하여 증상의 호전이 없을 경우 추가적 합병증을 예방하기 위해 보다 적극적인 치료가 권장된다[4,5]. 중심장액맥락망막병증의 병리기전은 명확하게 밝혀지지 않았지만, 맥락막혈관의 투과성 증가와 망막색소상피(retinal pigment epithelium, RPE)의 펌프 기능과 방어벽 기능 저하로 인해 장액망막박리 및 망막색소상피박리가 유발되는 것으로 알려졌다[5,6]. 이러한 병리 기전에 착안하여, 만성 중심장액맥락망막병증의 치료로 광역학 치료(photodynamic therapy)와 유리체강내 항혈관내피성장인자(vascular endothelial growth factor, VEGF) 주입술이 널리 사용되고 있다[7,8]. 각각의 치료 방법을 적절하게 병행하였음에도 불구하고 감각신경망막박리가 지속되는 경우에는 비손상 망막 레이저 치료를 고려해 볼 수 있다. 기존의 망막 레이저광응고술은 망막의 색소상피층에 영구적인 손상을 주기 때문에 황반 질환에서는 사용할 수 없었으나[1,8,9] 비손상 망막 레이저 치료는 망막 손상을 최소화하기 위해 레이저 세기를 감소시키고 짧은 펄스를 이용하여 주변 신경망막조직에 손상을 주지 않아 황반 질환을 치료하는 데 시도해 볼 수 있다[10,11].
아직까지 고식적인 치료에도 반응하지 않는 만성 중심장액맥락망막병증 환자에서 비손상 망막 레이저 치료 효과에 대한 연구는 알려진 바가 없다. 따라서 저자들은 만성 중심장액맥락망막병증에 대한 유리체강내 항혈관내피성장인자주입술 이후에도 호전되지 않은 환자를 대상으로 비손상 망막 레이저를 시행하여 치료 효과를 알아보고자 하였다.
2016년 11월부터 2018년 2월까지 본원에서 만성 중심장액맥락망막병증으로 진단받은 18명 18안을 후향적으로 분석하였다. 본 연구는 헬싱키선언을 준수하였고, 본원 연구윤리심의위원회(Institutional Review Board, IRB)의 승인(승인 번호: 2020-423)을 받아 진행하였다. 중심장액맥락망막병증의 진단은 안저검사에서 황반부의 장액성 융기를 보이고, 형광안저조영 소견에서 병변부에 연관된 형광누출을 보이면서 빛간섭단층촬영소견상 감각신경망막박리가 확인되는 경우로 정의하였다[12].
중심장액맥락망막병증으로 진단받은 환자 중 증상이 최소 6개월 이상 지속되고, 2회 이상 유리체강내 베바시주맙(Bevacizumab, Avastin®; Genentech Inc., South SanFrancisco, CA, USA, 1.25 mg/0.05 mL) 주입술을 시행받았으나 호전되지 않은 경우만 연구에 포함시켰다. 모든 환자에서 시술 전 성별, 나이, 최대교정시력(logarithm of the minimum angle of resolution, logMAR)을 측정하였고 세극등현미경검사, 안저촬영, Cirrus HD-OCT (Carl Zeiss Meditec, Inc., Dublin, CA, USA)를 이용한 빛간섭단층촬영을 시행하였다. 치료는 한 명의 숙련된 안과 전문의(D.Y.L)에 의해 시행되었으며 치료 효과 판정을 위해 시술 후 1개월, 3개월, 6개월에 최대교정시력, 안저검사, 빛간섭단층촬영을 시행하여 장액망막박리와 망막색소상피박리의 호전 여부 및 합병증 발생 여부를 조사하였다. 시술 후 6개월에 시행한 빛간섭단층촬영에서 중심망막두께가 가장 높은 부위의 높이를 비교하여 그 높이가 20% 이상 감소한 경우에 부분 호전이라 하였고, 완전히 사라졌을 경우에는 완전 소실이라 정의하였다. 재발은 장액성 망막하액이 완전 소실된 후 다시 발생한 경우로 정의하였다.
치료는 파장 577 nm PASCAL 레이저(Topcon Medical Laser Systems, Livermore, CA, USA)의 엔드포인트 매니지먼트(Endpoint Management)를 사용하였다. 시술방법은 먼저 barely visible burn (레이저 후 2초 이내 회백색의 응고반이 희미하게 보이는 것으로 정의)의 titration을 상이측 혈관궁(superotemporal vascular arcade) 또는 하이측 혈관궁(superotemporal vascular arcade)의 혈관 바깥에 시행하였다. 처음 150 mW, 15 ms로 200 μm 크기의 하나의 응고반으로 테스트하여 진한 회백색이 바로 보이거나 에너지가 강하다고 판단되면 세기를 10 mw씩 줄이고 응고반에 색깔 변화가 없으면 세기를 올리는 식으로 최대 200 mw까지 증가시켜 레이저의 세기를 정하였다. barely visible burn (100% 레이저 에너지)의 세기를 정한 후에는 Endpoint management를 이용하여 30%의 에너지를 황반부에 조사하였다. 황반부 레이저는 우선 중심와 위에서 3 × 3 패턴, Spot diameter 200 μm, Spacing 0.25 diameter로 설정하여 최대한 중첩되지 않게 주의하면서 중심에서 주변으로 사각형 모양으로 진행하면서 혈관궁 이내로 최대한 촘촘하게 조사하였다. 마지막에는 중심 오목에 2 × 2 패턴으로 1회 또는 2회 레이저를 조사하였다(Fig. 1). 치료 후에도 망막하액이 남은 경우 재치료를 시행하였는데 망막손상의 가능성을 최소화하기 위해 2개월 이상의 간격을 두고 시행하였고 치료 방법은 동일하였다. 2회의 레이저 치료에도 치료 반응이 전혀 없는 경우 더 이상 치료하지 않았다.
통계분석은 SPSS (Version 18.0; IBM Corp., Armonk, NY, USA) 프로그램을 사용하였다. 치료 전후의 시력, 중심망막두께 비교는 Wilcoxon Signed-Rank, 레이저 치료 후 장액망막박리가 완전 소실되는데 영향을 미치는 인자는 Mann-Whitney test와 Fisher’s exact test를 이용하여 분석하였으며, p<0.05인 경우 통계학적으로 유의한 것으로 정의하였다.
남성 11안, 여성 7안으로 총 18안이 연구에 포함되었다. 환자들은 비손상 망막 레이저 치료 전까지 유리체강내 항혈관내피세포 성장인자 주입술을 평균 치료를 3.1회 받았고, 레이저 치료는 평균 2.83 ± 0.83회, 레이저 세기는 140.32 ± 12.56 mW, Spot 수는 458 ± 72.34였다. 치료 후 경과 관찰 기간은 평균 9.75 ± 3.20개월이었다(Table 1). 비손상 망막 레이저 치료 6개월 후 최대교정시력(logMAR)은 평균 0.40 ± 0.31로 치료 전 평균 0.48 ± 0.29에 비해 통계적으로 유의하게 호전되었고(p=0.028), 중심망막두께 역시 치료 전 평균 375.21 ± 36.42 nm에 비해 치료 6개월 후 평균 246.44 ± 41.88 nm로 통계학적으로 유의하게 감소하였다(p<0.001) (Table 2).
레이저 치료 후 16안에서 장액망막박리의 완전 소실 또는 부분 호전을 관찰할 수 있었으나 2안에서는 치료에 반응하지 않고 호전되지 않았다. 16안 중 완전 소실은 8명으로, 비손상 망막 레이저 치료 6개월 후 완전 소실률은 55.56%로 보였다(Fig. 2). 레이저 치료 후 장액망막박리가 완전히 소실된 환자에서 황반부에 응고반이 발생하거나 황반부에 출혈 또는 삼출물 등의 부작용이 생긴 환자는 없었다(Fig. 3).
비손상 망막 레이저 치료 후 장액망막박리가 완전 소실되는데 영향을 미치는 인자를 분석하기 위해 완전 소실된 환자군과 그렇지 않은 환자군을 분석하였을 때, 완전 소실군에서의 환자 연령이 통계적으로 유의하게 낮았다(p=0.043). 또한 레이저 치료 이전에 시행한 유리체강내 항혈관내피세포 성장인자 주입술 이후 반응이 있었다가 재발하였던 환자들에서 반응이 전혀 없었던 환자들보다 레이저 치료 효과가 더 뛰어난 것으로 나왔다(p=0.38). 또한 레이저 치료 전 빛간섭단층촬영으로 측정한 망막하액의 높이가 낮을수록 완전 소실에 유리했다(p=0.030). 그 외 망막색소상피박리 유무 등 다른 요인들은 통계적으로 유의한 차이를 보이지 않았다(Table 3).
중심장액맥락망막병증은 감각신경망막층 밑에 장액이 축적되는 것을 특징으로 하는 질환으로 맥락막혈관의 과투과성이 병인으로 알려져 왔다[13]. 알려진 치료법 중 국소 레이저광응고술은 누출 부위에 광응고된 RPE가 섬유화되어 국소 누출을 막으며 주변부 RPE가 망막하액을 맥락막모세혈관층으로 배출하는 작용에 도움을 준다고 알려져 있다[13]. 하지만 맥락막에 국한된 선택적인 치료가 불가능하며 누출점이 중심소와에 있는 경우에는 직접 레이저광응고술을 시행할 수 없고 레이저 치료시 맥락막신생혈관 발생 및 중심 암점 등 비가역적인 손상을 유발할 수 있는 단점이 있다[14]. 광역학 치료는 광과민제인 verteporfin을 이용하여 시행하는 광응고술로서 맥락막모세혈관의 수축을 유발하여 혈관의 투과성을 낮추고, 손상된 RPE를 탈락시키는 대신 정상 RPE를 자라게 함으로써 맥락막삼출을 줄이고 망막하액 감소를 유도하여 효과적인 치료법으로 알려졌다[15]. 그러나 광역학 치료 역시 RPE의 위축, 맥락막모세혈관의 허혈 변화, 이차성 맥락막신생혈관 형성 등의 합병증이 보고되면서[16,17] 새로운 치료법이 연구되었고, 현재는 유리체강내 항혈관내피세포 성장인자 주입술이 맥락막혈관의 과투과성을 억제하는 효과가 있으면서 레이저광응고술이나 광역학 치료에 비해 부작용의 위험이 없어 비교적 안전하게 시술할 수 있는 것으로 보고되면서 현재 중심장액맥락망막병증의 주된 치료로 이용되고 있다[5,18].
그러나 만성적인 중심장액맥락망막병증 환자에서 유리체강내 항혈관내피세포 성장인자 시술 후에도 재발이 빈번하거나 병변이 지속될 경우 환자의 불편감과 정식적인 고통, 경제적 부담을 줄 수 있어 이런 경우 시도해 볼 수 있는 치료 방법 중 하나가 황반부 산란 광응고술(macular scatter photocoagulation)을 이용한 비손상 망막 레이저 치료다. 황반부 산란 광응고술의 작용기전은 명확히 밝혀지지 않았으나 열충격 단백질(heat shock protein, HSP)과 밀접한 연관이 있을 것이라 생각된다[10,19]. 열충격 단백질은 세포가 고온의 열에 노출되었을 때 발현되는 단백질로, 열충격(heat shock) 뿐만이 아니라 거의 모든 종류의 스트레스가 HSP의 발현을 유도함으로, HSP의 발현은 스트레스에 노출된 세포에서 보이는 일반적인 현상이라고 할 수 있다[20]. 여러 종류의 스트레스는 세포 내 환경의 변화를 일으켜 단백질과 DNA에 손상을 일으킬 수 있는데, 손상된 세포는 역설적으로 서로 다른 두 가지 반응을 보일 수 있다. 첫 번째는 세포자멸사(apoptosis)이다. 이는 세포 사멸의 한 방식으로서, 손상된 세포를 제거하여 염증을 방지한다. 두 번째는 스트레스 반응(stress response)이다. 이를 통해 세포는 자신의 손상을 방지하고 회복을 촉진시켜 생존을 돕는다[21]. 많은 HSP는 세포 내에서 molecular chaperones으로 활동하여 단백질의 응집(aggregation)을 방지하고, 손상된 단백질의 수리에 관여한다. 이것은 세포 내에 존재하는 다양한 단백질의 집단으로, 다른 단백질들이 응집되는 것을 방지하고, 응집괴(aggregate)를 용해시키며, 단백질 구조 형성을 돕거나(folding), 변형된 단백질의 구조를 바로잡고(refolding), 손상된 단백질을 분해(degradation)하거나, 심각한 손상의 경우, 손상된 단백질을 보다 큰 응집괴로 격리(sequestration) 시키는 역할을 담당한다. 결국 세포는 molecular chaperones의 활동을 통하여 단백질의 합성, 변형, 이동 그리고 분해 등 전 과정을 조절한다[22]. 이 가설을 통해, 망막의 레이저 요법은 HSP 발현의 역치값 이상, RPE에 열손상을 주는 에너지 미만에서 조절되어야 한다고 생각된다. 알려진 알고리즘에 따라 평균 세기 150 mW, 시간 15 ms로 Titration 후 치료시에는 30%의 에너지로 설정하였다[10,23]. 또한 치료 효과를 높이기 위해 최대한 넓은 범위의 병변에 레이저를 조사할 필요가 있다고 판단하여 3 × 3 패턴, Spot diameter 200 μm, Spacing 0.25 diameter로 설정하여 황반부에 레이저를 시행하였다[10]. 이런 고밀도 패턴은 레이저 조사 영역의 50% 면적에 해당한다. 또한 optical coherence tomography에 의해 확인된 망막하액 부위 뿐만 아니라 fluorescence angiography 검사상 과형광으로 만성 RPE 손상이 의심되는 부위도 치료 범위에 포함시켰다.
본 연구에서 레이저 치료 6개월 후 완전 소실률은 55.56%로 만성 중심장액맥락망막병증 환자를 대상으로 했던 Lavinsky and Palanker [10]의 이전 연구에서의 75%보다는 다소 낮았으나, 본 연구는 유리체강내 항혈관내피세포 성장인자 주입술을 시행받았으나 호전이 없었던 환자들을 대상으로 하였음을 감안하면 비손상 망막 레이저가 좋은 효과를 보였음을 알 수 있다. 망막하액 완전 소실에 영향을 미쳤던 인자들 중 고령이 될수록 RPE 세포의 노화가 관계있다고 생각할 수 있다. 노화와 관계되어 일어나는 세포 내의 주요 변화 중 하나는 열충격 반응과 ubiquitin-proteosome degradation system (UPS)의 급격한 감소 현상이다. 비정상적인 폴리펩티드를 증가시키는 여러 요인들은 세포의 노화 프로그램을 촉진시키고, 노화는 다시 UPS와 chaperone system을 억제시켜, 세포가 비정상적인 단백질을 처리할 수 없도록 만든다[24]. 즉 RPE 세포의 노화로 인해 열충격 반응이 감소하면서 레이저 효과 역시 감소한 것이라고 생각할 수 있다. 망막하액의 높이가 높을수록 배출해야 하는 장액량이 많고, 레이저가 RPE에 닿기도 어려워져 완전 소실이 어렵다고 생각할 수 있다. 이전에 항혈관내피세포 성장인자 주입술을 시행받았을 때 반응이 있었다는 것은, 그에 반응할 정상 RPE 세포가 남아있는 상태라고 생각할 수 있고 따라서 레이저 치료에서도 더 효과가 클 수 있다고 생각할 수 있다.
본 연구는 후향적 연구로서 몇 가지 제한점이 있다. 첫째로, 환자 수가 적고 경과 관찰 기간이 짧아 치료의 안전성을 판단하기에는 부족하고 장기적인 예후 비교가 불가능하다는 점이다. 추후 연구에서는 환자 수와 경과 관찰 기간을 늘려 비교 분석하는 것이 필요할 것으로 생각된다. 둘째, 각 환자들의 발병 시점과 치료 시점 또한 서로 달라 질병의 이환 기간이 치료 효과에 미치는 영향도 알 수 없었다. 셋째, 본 연구는 대조군 없이 치료군만 포함하고 있어 레이저 치료 효과를 판별하는 데 제한점이 있다. 비록 급성 중심장액맥락망막병증에 비해 만성 중심장액맥락망막병증에서는 망막하액의 자연 관해 비율이 낮다고 알려져 있지만[25], 망막하액의 소실이 비손상망막레이저 치료의 효과 외에 자연 관해에 의한 것일 가능성도 완전히 배제할 수 없다.
그러나 본 연구의 의미는 중심장액맥락망막병증 환자에서 현재 가장 고식적인 치료로 알려진 항혈관내피세포 성장인자 주입술에도 재발하거나 호전이 없는 경우 비손상 망막 레이저 치료로 중심망막두께와 시력을 호전시키고, 망막하액을 감소시킬 수 있다는 것이다. 비손상 망막 레이저 치료에 대한 안전성은 이미 Wood et al [26]의 연구에서 효과와 안전성을 입증하였고, 본 연구에서도 망막의 이차적인 손상이나 다른 레이저 관련 합병증은 관찰되지 않았다. 결론적으로 비손상망막레이저 치료는 이전에 항혈관내피세포 성장인자 주입술 후에도 호전 없는 만성 중심장액맥락망막병증 환자에게 추가적인 치료 방법으로 고려해 볼 수 있다.
NOTES
Figure 1.
Schematic image of Non-damaging retinal laser therapy procedure. (A) Titration is performed at inferotemporal vascular arcade outside (black arrow). (B) Treatment is performed going around from parafovea using Endpoint management (30% energy), 3 × 3 patterns and 0.25 diameter spacing between the laser spots. (C) Treatment is extended to periphery until it covors total treatment area (about 3-4 cycles). (D) Finally fovea is treated using 2 × 2 patterned laser with 30% endpoint management.
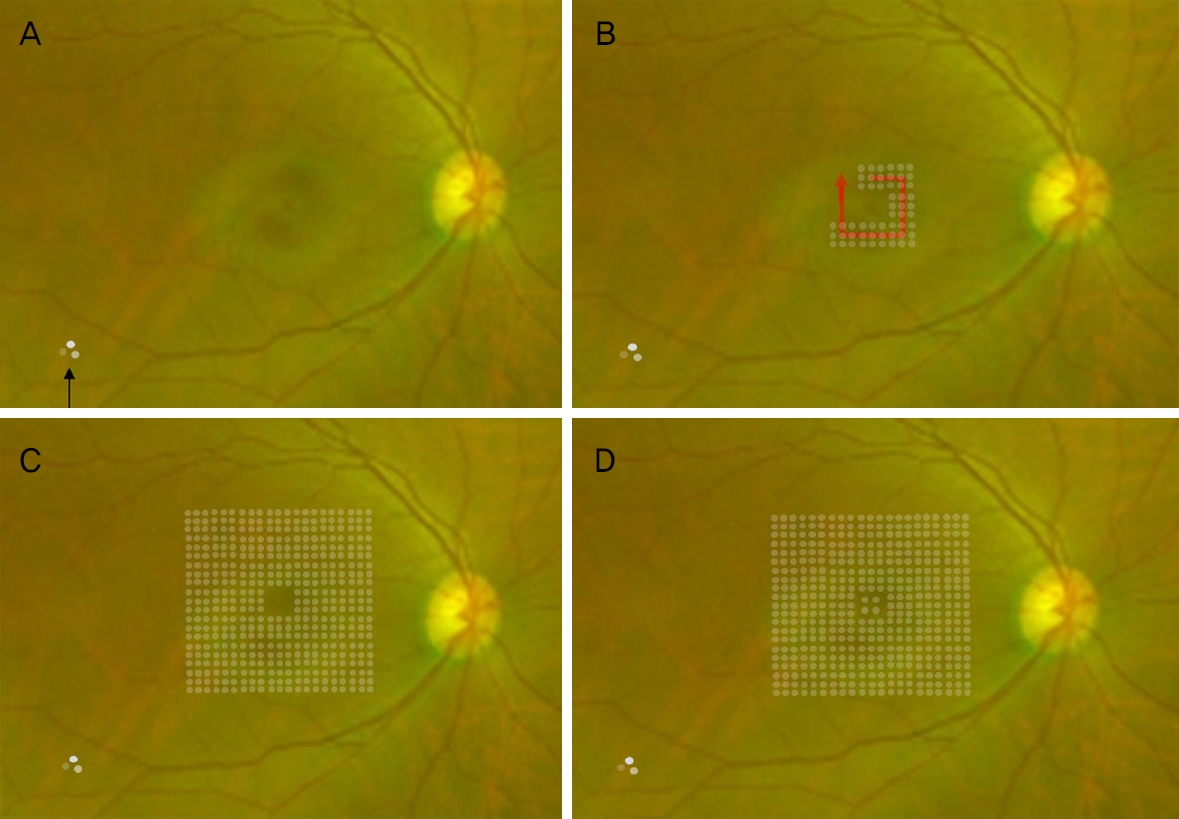
Figure 2.
Optical coherence tomography images of chronic central serous chorioretinopathy patients taken before non-damaging retinal laser therapy (NRT) (left) and after 6 month of NRT (right). (A) Central macular thickness decreased, subretinal fluid completely resolved. (B) Central macular thickness decreased, subretinal fluid partially resolved. (C) Central macular thickness and subretinal fluid didn’t decrease.
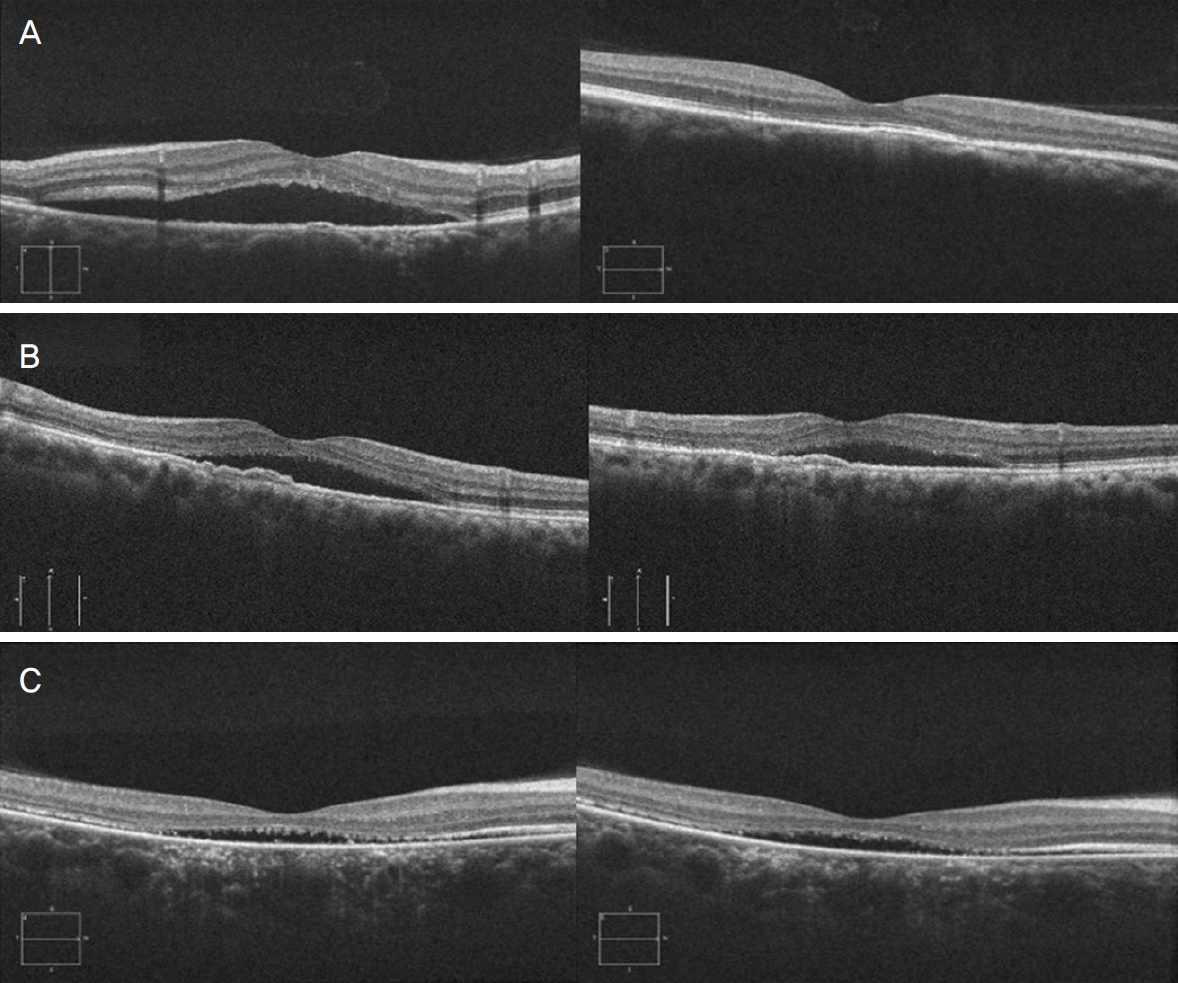
Figure 3.
Fundus photos (A, B) and optical coherence tomography images (C, D) of chronic central serous chorioretinopathy patient taken before non-damaging retinal laser therapy (NRT) (left) and after 6 month of NRT (right). Subretinal fluid completely resolved and there is no specific lesions or scar changes after NRT (left).
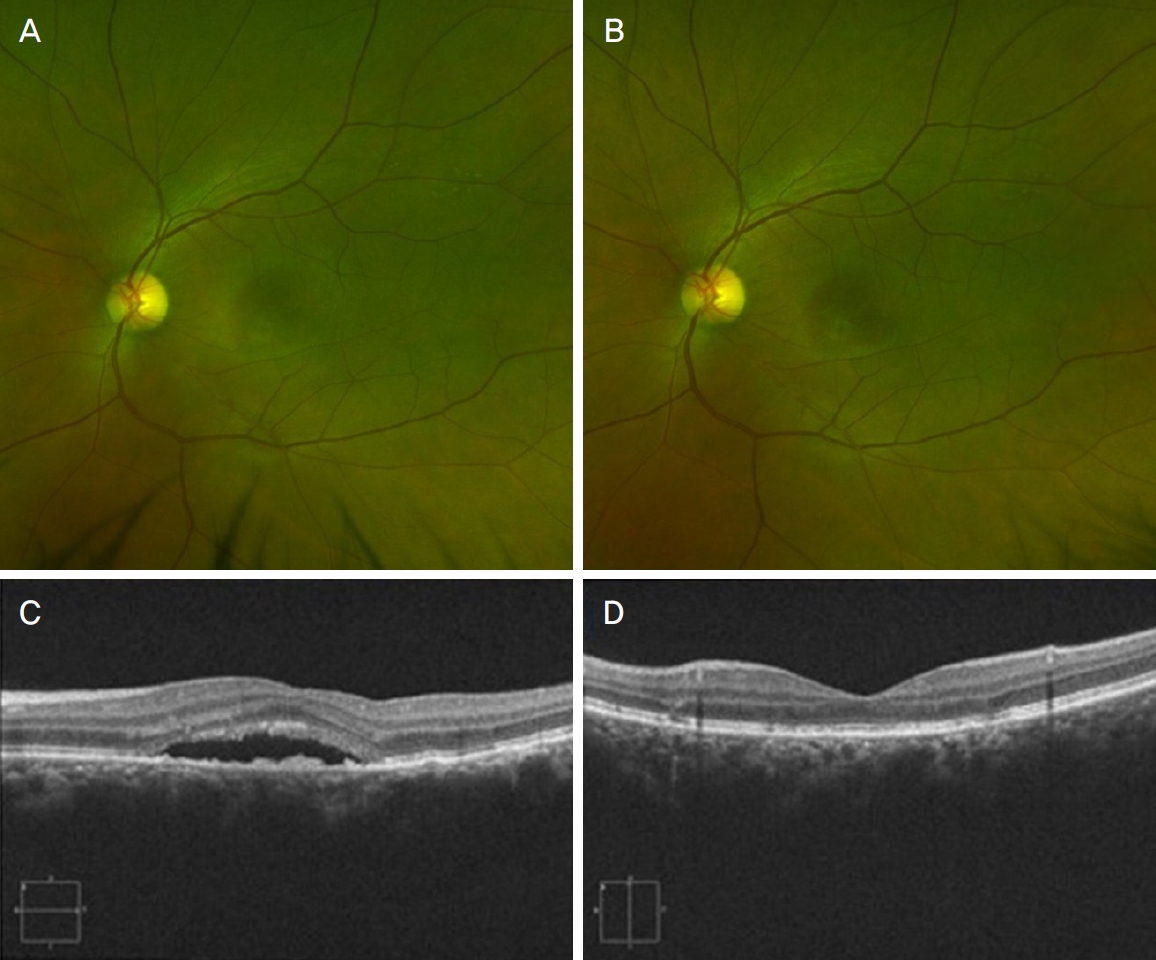
Table 1.
Clinical characteristics of patients
Table 2.
Main outcomes
| Variable | Pre NRT | Post NRT | p-value* |
|---|---|---|---|
| CRT (nm) | 375.21 ± 36.42 | 246.44 ± 41.88 | <0.001 |
| BCVA (logMAR) | 0.48 ± 0.29 | 0.40 ± 0.31 | 0.028 |
| SRF (+) | 18 | 8 | - |
| Complete resolution (%) | - | 55.56 | - |
Table 3.
Factors associated with SRF resolution
| Variable | Post NRT SRF (+) (n = 8) | Post NRT SRF (-) (n = 10) | p-value |
|---|---|---|---|
| Age (years) | 61.55 ± 11.64 | 49.76 ± 13.32 | 0.043* |
| Sex (M/F) | 5/3 | 6/4 | 0.702† |
| Number of pre IVBe injections | 3.18 ± 1.39 | 3.01 ± 2.25 | 0.764* |
| Number of NRT | 2.96 ± 0.85 | 2.80 ± 0.93 | 0.610* |
| Previous PED (+/-) | 3/5 | 3/7 | 0.436† |
| Response to prev IVBe (relapsed/refractory) | 2/6 (25/75) | 6/4 (60/40) | 0.038† |
| Height of SRF (nm) | 191.61 ± 13.44 | 145.33 ± 18.37 | 0.030* |
REFERENCES
1) Yeo YD, Kim JH, Kim YC, Kim KS. Photodynamic therapy and focal laser photocoagulation in chronic central serous chorioretinopathy. J Korean Ophthalmol Soc 2016;57:56-62.

2) Ross A, Ross AH, Mohamed Q. Review and update of central serous chorioretinopathy. Curr Opin Ophthalmol 2011;22:166-73.


3) Oh IS, Jang JH. Outer retinal layers alterations in chronic central serous chorioretinopathy: spectral domain-OCT and fundus autofluorescence findings. J Korean Ophthalmol Soc 2016;57:763-71.

4) Iida T, Yannuzzi LA, Spaide RF, et al. Cystoid macular degeneration in chronic central serous chorioretinopathy. Retina 2003;23:1-7.


5) Koh KM, Kim JY, Kim JW, Choi MJ. The efficacy of intravitreal bevacizumab injection in patients with acute central serous chorioretinopathy. J Korean Ophthalmol Soc 2012;53:781-5.

6) Manayath GJ, Ranjan R, Shah VS, et al. Central serous chorioretinopathy: current update on pathophysiology and multimodal imaging. Oman J Ophthalmol 2018;11:103-12.


7) Kim JA, Shin JY, Bae SH, et al. Comparison of choroidal hyperpermeability change after photodynamic therapy and ranibizumab for chronic central serous chorioretinopathy. J Korean Ophthalmol Soc 2015;56:205-12.

8) Kweon EY. Factors influencing the effect of the intravitreal bevacizumab injection in patients with central serous chorioretinopathy. J Korean Ophthalmol Soc 2014;55:391-5.

9) Verma L, Sinha R, Venkatesh P, Tewari HK. Comparative evaluation of diode laser versus argon laser photocoagulation in patients with central serous retinopathy: a pilot, randomized controlled trial [ISRCTN84128484]. BMC Ophthalmol 2004;4:15.



10) Lavinsky D, Palanker D. Nondamaging photothermal therapy for the retina: initial clinical experience with chronic central serous retinopathy. Retina 2015;35:213-22.

11) Sramek C, Mackanos M, Spitler R, et al. Non-damaging retinal phototherapy: dynamic range of heat shock protein expression. Invest Ophthalmol Vis Sci 2011;52:1780-7.


12) Semeraro F, Morescalchi F, Russo A, et al. Central serous chorioretinopathy: pathogenesis and management. Clin Ophthalmol 2019;13:2341-52.


13) Ficker L, Vafidis G, While A, Leaver P. Long-term follow-up of a prospective trial of argon laser photocoagulation in the treatment of central serous retinopathy. Br J Ophthalmol 1988;72:829-34.



14) Burumcek E, Mudun A, Karacorlu S, Arslan MO. Laser photocoagulation for persistent central serous retinopathy: results of long-term follow-up. Ophthalmology 1997;104:616-22.


15) Yannuzzi LA, Slakter JS, Gross NE, et al. Indocyanine green angiography-guided photodynamic therapy for treatment of chronic central serous chorioretinopathy: a pilot study. 2003. Retina 2012;32 Suppl 1:288-98.
16) Tzekov R, Lin T, Zhang KM, et al. Ocular changes after photodynamic therapy. Invest Ophthalmol Vis Sci 2006;47:377-85.


17) Colucciello M. Choroidal neovascularization complicating photodynamic therapy for central serous retinopathy. Retina 2006;26:239-42.


18) Schaal KB, Hoeh AE, Scheuerle A, et al. Intravitreal bevacizumab for treatment of chronic central serous chorioretinopathy. Eur J Ophthalmol 2009;19:613-7.


19) Caballero S, Kent DL, Sengupta N, et al. Bone Marrow-Derived cell recruitment to the neurosensory retina and retinal pigment epithelial cell layer following subthreshold retinal phototherapy. Invest Ophthalmol Vis Sci 2017;58:5164-76.



20) Zininga T, Ramatsui L, Shonhai A. Heat shock proteins as immunomodulants. Molecules 2018;23:2846.



21) Beere HM. "The stress of dying": the role of heat shock proteins in the regulation of apoptosis. J Cell sci 2004;117(Pt 13):2641-51.


22) Voellmy R, Boellmann F. Chaperone regulation of the heat shock protein response. Adv Exp Med Biol 2007;594:89-99.


23) Lavinsky D, Sramek C, Wang J, et al. Subvisible retinal laser therapy: titration algorithm and tissue response. Retina 2014;34:87-97.

24) Meriin AB, Sherman MY. Role of molecular chaperones in neurodegenerative disorders. Int J Hyperthermia 2005;21:403-19.


-
METRICS

-
- 1 Crossref
- 0 Scopus
- 2,846 View
- 100 Download
- Related articles




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



